La insuficiencia mitral isquémica (IMI) es debida a isquemia del miocardio, por lo que es una insuficiencia primariamente originada en el ventrículo izquierdo (VI). Ocurre en un 17–40% de los pacientes que han sufrido un IAM, con una repercusión clínica variable y cuyo pronóstico desfavorable depende de la gravedad de la insuficiencia. Se pueden distinguir tres entidades clínicas diferentes de IMI que implican importantes diferencias en la toma de decisiones clínicas: la IMI intermitente asociada a episodios isquémicos transitorios, la IMI aguda (IMIA) como complicación precoz de un IAM, y la IMI crónica (IMIC) como complicación tardía de la isquemia. Actualmente, la ecocardiografía es el instrumento más práctico como utillaje diagnóstico preoperatorio, para el control de la cirugía reparadora durante la intervención quirúrgica y para el seguimiento. El objetivo del presente trabajo es revisar el estado actual del tratamiento quirúrgico de la IMI (revascularización miocárdica, sustitución valvular, anuloplastia restrictiva, resincronización cardíaca) y sus fundamentos, así como comentar las nuevas técnicas dirigidas a actuar sobre el aparato subvalvular y sobre el VI, con el objetivo de obtener una reparación más estable y duradera. La validación de estos últimos procedimientos precisa de más investigación con mayor número de pacientes tratados y más larga duración del seguimiento.
Ischemic mitral regurgitation (IMR) is due to ischemic injury to the myocardium. Thus, is primarily caused by a disease of the left ventricle. It occurs in 17–40% of patients suffering myocardial infarction. Its clinical repercussion is variable, with unfavorable prognosis depending on the regurgitation severity. Three different clinical entities of IMR, which involve important variation on the clinical decision making, are distinguishable: intermittent IMR secondary to a transient ischemic phenomenon, acute IMR early complicating an acute myocardial infarction, and chronic IMR as late complication of myocardial ischemia. Currently, echocardiography is the more practical tool for preoperative diagnosis, intraoperative testing and follow-up. The aim of the present article is to review current surgical treatment of IMR (myocardial revascularization, valve replacement, restrictive annuloplasty, cardiac resynchronization) and it basis, as well as to comment the new techniques addressed to the subvalvular apparatus and left ventricle, that are bound to obtain a more stable and durable repair. Validation of these latter procedures needs more research, including larger patient cohorts and long-term follow-up.
La IMI es causada y precedida por una isquemia del miocardio. La prevalencia de la enfermedad arterial coronaria hace que la asociación de infarto de miocardio e insuficiencia mitral no isquémica sea muy frecuente, por lo que es necesario distinguir su distinta etiología.
La importancia clínica de la IMI se pone de manifiesto al haberse constatado que un 17–40% de los pacientes que han sufrido un IAM1–3 presentan precozmente evidencia clínica o ecocardiográfica de IMI que en un pequeño tanto por ciento es grave, aunque en otros, los soplos precoces después del IAM son transitorios y han desaparecido en el momento del alta1,4.
Se pueden distinguir tres entidades clínicas de IMI que implican importantes diferencias en la toma de decisiones clínicas: la IMI intermitente asociada a episodios isquémicos transitorios, la IMIA como complicación precoz de un IAM, y la IMIC como complicación tardía de la isquemia. La prevalencia de las dos primeras variantes es baja, mientras que la tercera es la más frecuente.
Insuficiencia Mitral IntermitenteEs una insuficiencia mitral ocasionada y acompañante a una isquemia miocárdica transitoria. Es poco frecuente y se considera un equivalente anginoso. Está asociada a la presencia de una estenosis significativa de la arteria coronaria derecha o de la arteria coronaria circunfleja. El tratamiento primario es evitar los episodios de isquemia miocárdica, mediante un procedimiento de revascularización.
Insuficiencia Mitral AgudaLa IMI puede aparecer agudamente en pacientes que sufren un IAM que afecta a un músculo papilar provocando su rotura, frecuentemente la de una cabeza del músculo papilar posteromedial. Es una complicación mecánica que suele ocasionar el prolapso de ambos velos y conduce a una IMIA grave e inestabilidad hemodinámica. Ocasiona una alta mortalidad en ausencia de tratamiento quirúrgico precoz. Ocurre en el 1–5% de los pacientes que mueren después de un IAM5. Por ello, exige la intervención quirúrgica sin dilación, previa estabilización del estado hemodinámico con balón de contrapulsación intraaórtico y vasodilatadores6.
También puede haber una insuficiencia mitral significativa asociada a infartos pequeños o grandes, sin rotura de músculo papilar. Los estudios en el modelo ovino7,8 indican que esta IMIA resulta de una compleja interacción de pequeños cambios temporales, geométricos y dinámicos de los músculos papilares (asincronía) y del anillo, difíciles de evaluar con los estudios de imagen actuales. Esta insuficiencia puede ser altamente letal, requiriendo cirugía. Pero también la revascularización precoz percutánea puede prevenir o revertir esta IMIA9. Generalmente, el tratamiento quirúrgico consiste en la sustitución o la reparación valvular, con o sin revascularización miocárdica. La opción más segura es la sustitución valvular conservando la continuidad de las valvas con el aparato subvalvular, que preserva la función ventricular izquierda, como observó David10, entre otros.
Algunos autores prefieren la implantación de una bioprótesis, ya que implica menos morbilidad en unos pacientes con mal pronóstico a largo plazo11,12. La mortalidad hospitalaria comunicada oscila entre el 10–61%13,14, siendo del 50%15 a 5 años. La cirugía reparadora mediante anuloplastia reductora puede tener su papel cuando el chorro regurgitante es central, hay un mínimo aumento de la tracción sobre los velos y ausencia de patología de los músculos papilares.
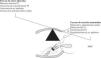
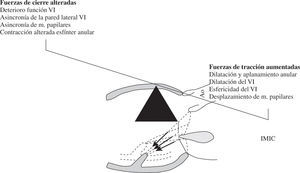
Insuficiencia Mitral CrónicaLa IMIC, también denominada funcional o secundaria, es una insuficiencia producida primariamente por la enfermedad isquémica del VI en ausencia de daño estructural de la válvula mitral, aunque ocasionalmente se han descrito casos de prolapso valvular. Siguiendo la conocida propuesta de Borger16, se debe definir como la insuficiencia mitral que aparece más de 1 semana después de un infarto de miocardio, en la que hay un movimiento anómalo de uno o más segmentos de la pared del VI, enfermedad coronaria significativa en los vasos que perfunden los segmentos de pared disfuncionantes, más una válvula mitral cuyos velos y cuerdas son estructuralmente normales. La isquemia miocárdica induce el remodelado del VI y del anillo mitral. Estos procesos ocasionan cambios en la geometría del aparato valvular mitral con valvas normales. Todo ello resulta en una insuficiencia mitral provocada por un desequilibrio entre las fuerzas de tracción (tethering) sistólica de las valvas y las fuerzas de cierre17 (Fig. 1). La tracción sistólica de las cuerdas tendinosas (principalmente de las secundarias) desde los músculos papilares provoca el desplazamiento apical del punto de aposición de las valvas (tenting) que determina un cierre incompleto de los velos mitrales por restricción de su movimiento. Si esta tracción es simétrica, por desplazamiento apical de ambos músculos papilares, generalmente provoca un chorro de insuficiencia central. Pero también puede ser asimétrica como resultado de un remodelado ventricular regional que provoca un desplazamiento del músculo papilar posteromedial y, consecuentemente, una restricción del velo posterior, que suele ocasionar un chorro excéntrico dirigido a la pared posterior de la aurícula izquierda. En el 95% de los casos, la IMIC es debida a dicha restricción de los velos durante la sístole (insuficiencia mitral tipo IIIb de Carpentier), pero es importante tener en cuenta que en el 5% restante, una elongación isquémica de un músculo papilar puede causar un área de prolapso (insuficiencia mitral tipo II de Carpentier).
La IMIC es una entidad dinámica que depende de las condiciones hemodinámicas existentes en cada momento, por lo que su gravedad puede variar a lo largo de la evolución clínica y durante el ejercicio18. También los agentes anestésicos y la medicación inotrópica cambian las condiciones de carga del ventrículo19, pudiendo reducir engañosamente la regurgitación mitral durante su evaluación intraoperatoria, lo que es importante tener en cuenta en la toma de decisiones quirúrgicas intraoperatorias.
PronósticoLa IMIC empeora el pronóstico de los pacientes con enfermedad coronaria. Grigioni, et al.20 demostraron que pacientes con insuficiencia mitral detectada en la fase crónica (>16 días) después de un infarto, tienen menor supervivencia a 5 años que pacientes sin insuficiencia mitral (38±5% vs 61±6%; p<0,001). También encontraron que la mortalidad a 5 años se relaciona con el área del orificio regurgitante efectivo (ORE), siendo menor la supervivencia cuando aquél es igual o superior a 20mm2, independientemente de la función del VI. Además, este mismo grupo demostró que la IMIC aumenta independientemente 3,6 veces el riesgo de insuficiencia cardíaca crónica, en pacientes sin o con mínimos síntomas21.
DiagnósticoLa IMIC y su gravedad son a menudo infravaloradas, siendo la auscultación una herramienta poco fiable, ya que sólo se oye un soplo en un reducido tanto por ciento de pacientes.
EcocardiografíaLa ecocardiografía transtorácica (ETT) y la transesofágica (ETE) permiten la evaluación fiable de la función valvular. Los criterios habituales para definir la insuficiencia mitral grave, se rebajan para la IMIC por su evolución clínica desfavorable (Tabla I). Las alteraciones de contractilidad producidas durante el ejercicio pueden dar lugar a un aumento de la insuficiencia mitral, habiéndose observado que un incremento del ORE igual o superior a 13 mm2 durante el ejercicio identifica a un grupo de pacientes con riesgo de mortalidad e ingresos hospitalarios por insuficiencia cardíaca congestiva18,23. Por ello, la ecocardiografía de esfuerzo puede ayudar en la toma de decisiones quirúrgicas en pacientes con disfunción ventricular izquierda que presentan disnea de esfuerzo desproporcionada a la insuficiencia mitral en reposo; en pacientes que presentan edema de pulmón sin una causa obvia; y antes de la revascularización quirúrgica, en pacientes con insuficiencia mitral moderada. Por otra parte, una disminución en el ORE durante el ejercicio, por mejoría de la contracción de los segmentos basales del VI, se asocia a mejor pronóstico a largo plazo23.
La ecocardiografía bidimensional permite determinar las características de la tracción sistólica de la válvula mitral. Así, se puede calcular el área de tracción (área entre los velos traccionados y el plano anular en sístole), la altura de la tracción (distancia entre el punto de coaptación de los velos y el plano del anillo mitral en sístole), los ángulos de tracción de los velos anterior y posterior, así como la distancia entre los músculos papilares. Estos parámetros han demostrado valor pronóstico sobre la persistencia o recurrencia de insuficiencia mitral igual o superior a II+ después de la anuloplastia restrictiva24 (Tabla II). La ecocardiografía tridimensional proporciona nuevas imágenes y datos que mejoran la valoración de la IMIC25.
Vaticinadores ecocardiográficos preoperatorios de fallo de la anuloplastia mitral restrictiva
| Parámetros | Valores |
| Ecografía transtorácica | |
| Separación de la coaptación | ≥ 1cm |
| Área de tracción sistólica | > 2,5–3cm2 |
| Ángulo posterolateral | ≥ 45° |
| Movimiento anómalo de la pared libre VI | Cicatriz |
| Chorro regurgitante central | |
| Chorros regurgitantes complejos | Múltiples |
| Diámetro telediastólico VI | ≥ 65mm |
| Diámetro telesistólico VI | ≥ 51mm |
| Altura de tracción | > 10mm |
| Distancia intermúsculos papilares | > 20mm |
| Volumen telediastólico VI | ≥ 145ml |
| Ecografía transesofágica | |
| Diámetro anular mitral sistólico | ≥ 37mm |
| Área de tracción sistólica | ≥ 1,6cm2 |
| Grado de insuficiencia mitral | > 3,5 |
Recientes estudios de resonancia magnética evidencian su utilidad en el refinamiento del estudio de la IMIC dirigido a su tratamiento quirúrgico26.
Tratamiento QuirúrgicoIndicaciónLas indicaciones de cirugía en la IMIC no están claramente definidas. Generalmente se acepta que los pacientes que van a ser sometidos a revascularización miocárdica y tienen una insuficiencia mitral grado III+ o IV+, deberían recibir intervención mitral concomitante11 (Tabla III). Sin embargo su impacto en la supervivencia es poco conocido y la mortalidad a 5 años sigue siendo alta. Persiste la controversia sobre si se debe tratar la insuficiencia grado I+ o II+ en pacientes que tienen indicación de revascularización miocárdica, pues en muchos de estos pacientes la insuficiencia mitral progresa después de la revascularización miocárdica aislada27.
Indicaciones de cirugía en la insuficiencia mitral isquémica según la ESC (Guías Clínicas 2007)
| Situación clínica | Cirugía valvular mitral |
| Pacientes con IMI grave (ORE ≥ 20 mm2) | |
| Rotura de músculo papilar debida a IAM | Inmediata |
| FEVI ≥ 30%, sometidos a cirugía de injertos coronarios | Recomendada (IC) |
| FEVI < 30%, con opción a cirugía de injertos coronarios | Razonable si sintomático (IIaC) |
| FEVI ≥ 30%, sin opción a cirugía de injertos coronarios | A considerar si sintomáticos y bajo riesgo (IIbC) |
| Pacientes con IMI moderada (ORE < 20mm2) | |
| Sometidos a cirugía de injertos coronario | Razonable si la reparación es factible (IIaC) |
| Sin opción a cirugía de injertos coronarios o sometidos a ICP | Incierta (no a priori) |
| Pacientes con IMI mínima | No recomendada |
ESC: European Society of Cardiology; ICP: intervencionismo coronario percutáneo.
El valor de la cirugía mitral asociada comparado con la cirugía de revascularización aislada precisa de más estudios. Máxime, teniendo en cuenta que la mortalidad para el procedimiento combinado está en 6–15%, frente al 3–5% para la revascularización aislada28.
Revascularización miocárdicaLa revascularización miocárdica aislada es insuficiente para hacer desaparecer la insuficiencia mitral en una alta proporción de pacientes. Por otra parte, cuando se asoció una anuloplastia restrictiva, después de 10 años de seguimiento, no parece haber un beneficio de supervivencia, al ser ésta del 50% en ambos casos29. Sin embargo, estudios retrospectivos recientes utilizando cohortes de pacientes comparables mediante puntuación de propensión (propensity score) muestran que la cirugía de revascularización miocárdica, cuando se asocia a la anuloplastia mitral restrictiva en pacientes con IMIC grado III+ o IV+, consigue mejores resultados en cuanto a reducción de la insuficiencia mitral y mejoría de la sintomatología, en el postoperatorio inicial29,30.
Sustitución valvular mitralLa sustitución valvular mitral por una prótesis mecánica o biológica ha sido el tratamiento de elección hasta la popularización de la anuloplastia. Como se comentó anteriormente, para no contribuir al deterioro de la función ventricular, se debe preservar la continuidad anillo mitral - pared ventricular izquierda, conservando las valvas y el aparato subvalvular.
En los pacientes más gravemente enfermos, la supervivencia a largo plazo es similar a la observada cuando se ha empleado la reparación mitral11. Por ello, la sustitución valvular sigue siendo una buena alternativa quirúrgica: en pacientes con tracción importante de los velos y datos ecocardiográficos predictores de insuficiencia mitral; en intervención de emergencia; en intervenciones complejas concomitantes, y en anomalías graves de la motilidad de la pared del VI.
La mortalidad precoz comunicada es del 3–33%, siendo del 30–40% la mortalidad a 5 años31. Magne, et al.32 observaron que aunque la mortalidad precoz era mayor en la sustitución valvular que en la reparación (9,7 vs 14,4%; p=0,03), la supervivencia a 6 años era similar (73±4% vs 67±4%; p=0,17). Algunos autores recomiendan la implantación de bioprótesis en pacientes con ritmo sinusal, teniendo en cuenta el mal pronóstico a largo plazo11,12.
Anuloplastia mitralLa anuloplastia restrictiva remodeladora utilizando un anillo de tamaño inferior (una o dos tallas) al ánulo mitral fue introducida en 1995 por Bolling, et al.33. La reducción del anillo mitral empuja al anillo y velo posteriores hacia la valva anterior, produciendo la restauración de la coaptación de los velos, pero no corrige la tracción (tethering) sobre los velos. La elección del tamaño del anillo debe ser cuidadosa porque la excesiva reducción anular puede provocar cierto grado de estenosis mitral funcional34. El descubrimiento de que el anillo anterior también se dilata ha llevado a la recomendación de utilizar anillos completos y no bandas35. Hay preferencia a utilizar anillos rígidos o semirrígidos porque producen una reparación que parece más duradera que la obtenida con anillos flexibles36,37, al conseguir un soporte más estable del anillo posterior, frente a los cambios progresivos que tiende a sufrir la pared del VI en su evolución. Existen múltiples propuestas de anillos protésicos (Carpentier-McCarthy-Adams, GeoForm, Rigid Saddle, Profile 3D…) dirigidas a remodelar y compensar las modificaciones que sufre el anillo como consecuencia de los cambios isquémicos de la pared del VI, sin embargo no se ha demostrado la superioridad de un determinado modelo.
Los conocimientos actuales nos permiten establecer los siguientes principios para práctica de la anuloplastia reductora:
- –
Utilización de anillos rígidos o semirrígidos dirigidos a compensar los cambios observados en el anillo nativo en cada caso.
- –
Reducción en una o dos tallas, teniendo en cuenta también el crecimiento de la distancia intertrigonal.
- –
Disposición de los puntos de sutura del anillo, muy próximos y profundos en el ánulo mitral36.
- –
Conseguir una superficie de coaptación de los velos igual o superior a 8mm36.
- –
No permitir IM residual (ETE) superior a 1/438.
Aproximadamente, en un tercio de los pacientes intervenidos persiste o recurre la IMIC, siendo esta probabilidad mayor en los primeros 6 meses del periodo postoperatorio17,33–39. Esto se explicaría porque la anuloplastia, al reducir el diámetro anteroposterior del anillo, además de restaurar la superficie de coaptación, aumenta, por razones geométricas, la tracción sobre el velo posterior, pero también del velo anterior, en una válvula que muchas veces pasa a funcionar como monocúspide. Así, el velo anterior, al cerrar contra el cuerpo de un velo posterior muy traccionado, puede provocar una regurgitación leve posreparación, lo cual puede ser más pronunciado en pacientes a los que se les implanta un anillo simétrico, pero que presentaban preoperatoriamente un orificio mitral asimétrico por mayor restricción de los segmentos P2 y P3. Si la cirugía no consigue detener el proceso de remodelado ventricular, la tracción sobre ambos velos continuará aumentando, provocando la recurrencia de la insuficiencia mitral17. Se han descrito varios parámetros ecocardiográficos que pueden ayudar a identificar a los pacientes con riesgo de fallo de la anuloplastia (Tabla II). Cuando el diámetro telediastólico preoperatorio del VI es igual o inferior a 65mm y utilizando un anillo inferior en dos tallas (anillos de 24–26mm), Braun, et al.36 han comunicado un índice de recurrencia de IM III+, tan bajo como el 1,6%.
La preferencia de la reparación mitral frente al recambio es todavía asunto de discusión, pues algún trabajo reciente sugiere resultados similares después de la sustitución valvular o de la reparación32. Sin embargo, otros muestran mejor supervivencia con la plastia mitral, por lo que abogan por su utilización preferente12,15,40.
Resincronización cardíacaLa terapia de resincronización cardíaca (TRC) puede ser recomendable, como técnica complementaria o alternativa a la cirugía, en aquellos pacientes que presentan asincronía de los músculos papilares. La Sociedad Europea de Cardiología41 recomienda (clase I con nivel de evidencia A) la TRC con marcapaso biventricular en pacientes con insuficiencia cardíaca en clase II–IV de la New York Heart Association (NYHA) que continúan sintomáticos a pesar del tratamiento farmacológico correcto y presentan una fracción de eyección del ventrículo izquierdo (FEVI) igual o inferior a 35%, dilatación del VI, ritmo sinusal normal y complejo QRS igual o superior a 120ms. La resincronización reduce la IMIC por la mejoría de la función ventricular izquierda, la reducción del tiempo de retraso en la sincronía de los músculos papilares y la contracción más efectiva –mejoría del efecto esfinteriano– del anillo mitral42. Además, disminuye el área de tracción (tenting), al desplazar el cuerpo de los velos valvulares hacia el interior de la cavidad ventricular izquierda durante la sístole. Se puede esperar una mejoría aguda de la insuficiencia mitral de hasta un 35% y una mejoría adicional tardía del 10–20%, paralela a la disminución de los volúmenes ventriculares y de la dP/dT del VI. El efecto beneficioso de la TRC exige su mantenimiento permanente, ya que su supresión conduce a la reaparición de la insuficiencia43. Pero a menudo la TCR no consigue corregir completamente la insuficiencia, debido al grado previo de deformación de la válvula mitral44 y de remodelado ventricular. Así, la insuficiencia con un ORE igual o superior a 20mm2 y un VI dilatado determinan la falta de respuesta al tratamiento durante el seguimiento.
Nuevas propuestas quirúrgicasLos resultados poco satisfactorios de la anuloplastia restrictiva han llevado a la aplicación de nuevas propuestas quirúrgicas tendentes a reducir la tracción sobre las valvas o restaurar la geometría ventricular. Estas técnicas necesitan ser validadas por estudios más extensos.
Aumento de la superficie de las valvasPara disminuir la tracción sobre los velos, Kincaid, et al.45 describieron en 25 pacientes el aumento del velo anterior mediante un parche de pericardio asociado a una anuloplastia con banda y revascularización miocárdica, comunicando una libertad actuarial de insuficiencia III+, a los 2 años, del 81%. La extensión del velo posterior ha sido descrita en pocos pacientes por Dobre46 y por Rendón47. Esta técnica ha sido recientemente reestudiada en el modelo ovino48, observándose que, asociada a una anuloplastia menos restrictiva, aumenta la curvatura del velo y disminuye la tracción, lo que pudiera mejorar la durabilidad de la reparación.
La reparación borde-borde de AflieriLa creación de un doble orificio mitral mediante un punto que une los bordes de las valvas en la región central, aún asociada a una anuloplastia, presenta un alto índice de recurrencia de la insuficiencia49, por lo que no parece una técnica recomendable.
Sección de cuerdas tendinosas de segundo ordenMessas50,51 ha propuesto reducir la tracción sobre el velo anterior observada en la IMIC, mediante la sección de cuerdas tendinosas de segundo orden en el velo anterior. Messas52 y Borger53 demostraron que esta actuación mejora la coaptación, sin afectar adversamente a la función del VI. La técnica ha sido utilizada con éxito, asociada a anuloplastia mitral.
Recolocación del músculo papilar posteromedialPara los casos de restricción grave del segmento P3, Kron, et al.54, además de implantar un anillo, describieron el uso de una sutura de tracción desde el músculo papilar posteromedial hasta el anillo mitral adyacente al trígono fibroso derecho, con el objetivo de reposicionarlo y conseguir la disminución de la tracción sobre las valvas, mejorando así la superficie de coaptación. Basado en el mismo principio, Langer y Schäfers55 asociaron a la anuloplastia la que describieron como técnica de la sutura transventricular, que permite el reposicionamiento del músculo papilar posteromedial bajo control ecocardiográfico, con el corazón latiendo y cargado.
Reaproximación de los músculos papilaresSe trata de recolocar los músculos papilares que se han alejado del eje ventricular por el remodelado ventricular. Hvass, et al.56 describieron la técnica de la eslinga de los músculos papilares o del doble anillo, en la que, además del uso de una anuloplastia moderadamente restrictiva, se rodea la base de ambos músculos papilares con una banda que los aproxima. Rama, et al.57, además de la anuloplastia asociada a la revascularización coronaria, reposicionan ambos músculos papilares mediante un punto en U, reforzado con dos parches de pericardio autólogo que une las cabezas de ambos.
Ramadan58 publicó la plicatura de la pared posterolateral infartada en tres pacientes para desplazar el músculo papilar hacia el velo anterior y así reducir la tracción, consiguiendo la ausencia de regurgitación en un seguimiento medio de 7 meses. Con el mismo objetivo, Hung, et al.59 han probado en ovejas un parche que contiene un balón hinchable. El parche se sutura al epicardio de la zona de inserción del músculo papilar posterior, y para obtener la disminución de la tracción y de la insuficiencia, el volumen del balón se ajusta mediante control ecocardiográfico con el corazón latiendo.
La restauración ventricular o técnica de Dor60, asociada a revascularización miocárdica con o sin anuloplastia mitral concomitante, ha sido utilizada con relativo éxito para excluir las zonas discinéticas o acinéticas del VI gravemente dilatado por la isquemia.
El dispositivo CoapsysEl sistema Coapsys (Myocor Inc, Maple Grove, MN, EE.UU.), diseñado para ser implantado en el corazón latiente, busca tratar el desplazamiento de los músculos papilares y el aumento del diámetro anteroposterior mitral observados en la IMIC61. Asociado a la revascularización miocárdica sin circulación extracorpórea, se ha observado mejoría en la supervivencia y disminución significativa de los eventos adversos, al compararlo con la revascularización + anuloplastia estándar62. También se ha desarrollado una variante (I Coapsys) para implantación percutánea que necesita validación clínica63. La compra de la propiedad intelectual de Myocor por Edwards Lifesciences parece haber detenido el desarrollo clínico de estos dispositivos.
ComentarioLa IMI es una insuficiencia primariamente originada en el VI isquémico. Se puede presentar como IMI intermitente, IMIA o IMIC. La ecocardiografía es la técnica diagnóstica que, de manera más práctica, permite obtener parámetros fiables para el diagnóstico preoperatorio, la predicción de resultados quirúrgicos, la estrategia y la evaluación durante la cirugía, y el seguimiento.
La IMI se asocia a un pronóstico adverso cuya gravedad depende de la importancia de la insuficiencia. La revascularización miocárdica generalmente forma parte del tratamiento, aunque en muchos casos no es suficiente para reducir la insuficiencia mitral. La sustitución valvular mitral con conservación de la continuidad entre el anillo mitral nativo y los músculos papilares está generalmente indicada cuando existe rotura de músculo papilar, en presencia de parámetros ecocardiográficos pronósticos de fallo de la reparación o en situaciones complejas. La anuloplastia restrictiva remodeladora, asociada a la revascularización miocárdica, consigue buenos resultados en pacientes seleccionados. Pero la persistencia o recurrencia de la insuficiencia sigue siendo alta, y no parece haber un beneficio de supervivencia a los 10 años de la cirugía (supervivencia aproximada del 50%), cuando se compara con la revascularización miocárdica aislada. La utilización de anillos rígidos o semirrígidos parece ventajosa para conseguir una reparación más estable. Aunque no está categóricamente demostrado, varios trabajos abogan por la superioridad de la reparación frente al recambio valvular.
La TRC permanente puede ser una técnica complementaria pero raramente alternativa a la cirugía.
Las nuevas técnicas quirúrgicas dirigidas a hacer desaparecer la tracción sobre las valvas necesitan todavía su validación mediante estudios con mayor número de pacientes y seguimiento a largo plazo.