El objetivo del presente estudio es revisar sistemáticamente la tasa de éxito del cierre percutáneo de la orejuela izquierda, su eficacia y seguridad, y la incidencia de fugas peridispositivo.
MétodosSe realizó una búsqueda bibliográfica utilizando las bases de datos de Google Scholar, MEDLINE, EMBASE y Cochrane restringiendo dicha búsqueda en inglés y recogiendo publicaciones editadas hasta el 2016. Nuestro análisis se limitó a aquellos estudios que reunieran los siguientes criterios de inclusión: 1) estudios con un diseño prospectivo unicéntrico, prospectivo multicéntrico y estudios retrospectivos multicéntrico, y 2) estudios que tuvieran un tamaño muestral ≥ 80 pacientes.
ResultadosLos datos de los 2 ensayos clínicos (PROTECT-AF y PREVAIL) sugieren que la exclusión percutánea de la orejuela izquierda proporciona una tasa similar a largo plazo de accidentes embólicos cerebrovasculares y mortalidad, comparándolo con el tratamiento con warfarina. En el estudio PROTECT AF se documenta una incidencia de fuga peridispositivo del 39%. Los estudios restantes, que analizan a pacientes con contraindicación para la anticoagulación y que no tienen un grupo control, reportan una tasa significativa de complicaciones severas relacionadas con el procedimiento (hasta el 13,7%), siendo la causa más frecuente el derrame pericárdico y/o taponamiento cardíaco.
ConclusionesEl cierre percutáneo de la orejuela izquierda se asocia con un porcentaje significativo de complicaciones graves periprocedimiento y de fuga peridispositivo.
The aim of the present study is to systematically review the success rate of percutaneous left atrial appendage closure, its efficacy and safety, and the incidence of peri-device leakage.
MethodsA bibliographic search was performed using the Google Scholar, MEDLINE, EMBASE and Cochrane databases, restricting this search in English and collecting articles published until 2016. Our analysis was limited to those studies that met the following inclusion criteria: 1) studies with a prospective unicenter, prospective multicenter and retrospective multicentre design. 2) Studies that had a sample size ≥ 80 patients.
ResultsData from the two clinical trials (PROTECT-AF and PREVAIL) suggest that percutaneous exclusion of the left atrial appendage provides a similar long-term rate of cerebrovascular embolic events and mortality compared to warfarin therapy. In the PROTECT AF study, an incidence of peri-device leak of 39% is documented. The remaining studies, which analyze patients with contraindications to anticoagulation and without a control group, report a significant rate of severe complications related to the procedure (up to 13,7%), the most frequent cause being pericardial effusion and/or cardiac tamponade.
ConclusionsPercutaneous closure of the left atrial appendage is associated with a significant incidence of severe periprocedural complications and peri-device leak.
En pacientes con fibrilación auricular no valvular el 90% de los trombos se generan en la orejuela izquierda (OI)1. Esta evidencia ha motivado el desarrollo de diferentes estrategias basadas en el cierre de la OI, para prevenir accidentes cerebrovasculares en pacientes con fibrilación auricular. La OI puede ser abordada quirúrgica o percutáneamente. Hasta el momento, los resultados en términos de prevención de accidentes cerebrovasculares, en pacientes sometidos a ligadura o resección quirúrgica de la OI, no han sido prometedores2. Actualmente, el cierre de la OI en pacientes quirúrgicos con fibrilación auricular no es un procedimiento estándar. De hecho, la guía clínica de la sociedad europea de cirugía cardíaca sobre el manejo de la fibrilación auricular subraya la ausencia de estudios aleatorizados que comparen la incidencia de eventos neurológicos en pacientes con y sin cierre quirúrgico de la OI3. El objetivo de esta revisión es analizar los resultados del cierre percutáneo de la OI en términos de seguridad, eficacia, tasa de éxito de implantación y de incidencia de fugas peridispositivo.
Estrategia de búsquedaSe realizó una búsqueda bibliográfica mediante las bases de datos de Google Scholar, MEDLINE, EMBASE y Cochrane restringiendo dicha búsqueda a estudios realizados en humanos y publicados en inglés hasta el 2016. Los términos utilizados para la investigación fueron «left appendage occlusion» OR «left appendage closure» AND «device» AND «percutaneous». Filtros: «Humans», «English», «to 2016/12/31».
Nuestro análisis se limitó a aquellos estudios que reunieran los siguientes criterios de inclusión: 1) estudios con un diseño prospectivo unicéntrico, prospectivo multicéntrico y estudios retrospectivos multicéntrico, y 2) estudios que tuvieran un tamaño muestral ≥ 80 pacientes. Publicaciones de casos clínicos, revisiones y editoriales fueron excluidas de nuestro estudio. En el caso de múltiples publicaciones de un mismo estudio, se decidió extraer los datos de la publicación más actualizada. Los resultados analizados fueron: 1) tasa de implantación exitosa (implantación del dispositivo con fuga peridispositivo ≤ 5mm de ancho); 2) resultados de eficacia: incidencia de accidente cerebrovascular isquémico o hemorrágico, embolia sistémica, o muerte cardiovascular o no explicada; 3) resultados de seguridad: incidencia de hemorragia intracraneal o gastrointestinal o derrame pericárdico severo, embolización del dispositivo o ictus relacionado con el procedimiento, y 4) incidencia de fugas peridispositivo. De cada estudio, 2 revisores (JH y SU) extrajeron de forma independiente los datos sobre el diseño del estudio, el tamaño muestral, las características clínicas de la población muestral, el seguimiento clínico y los resultados. Los desacuerdos fueron resueltos por consenso.
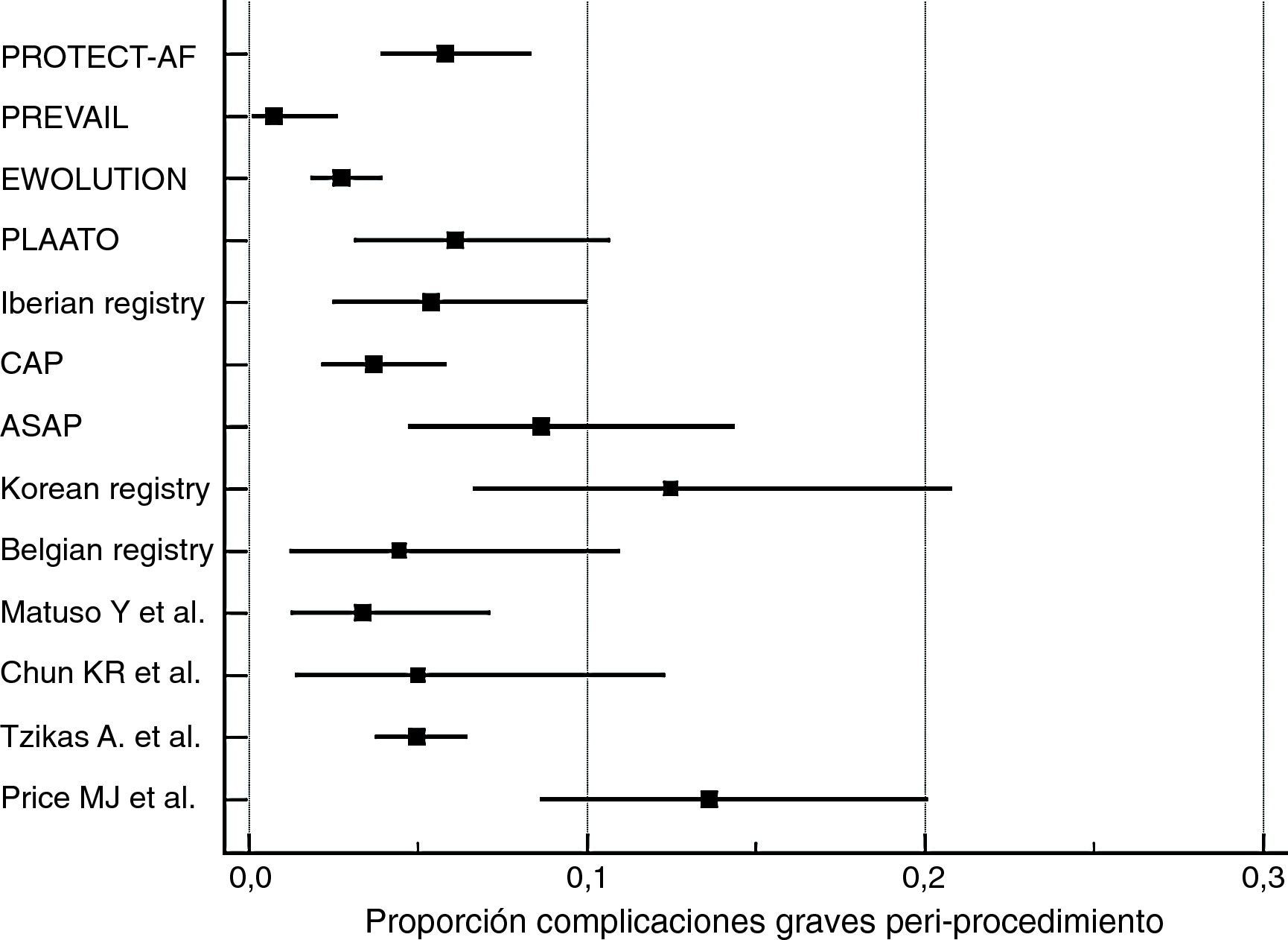
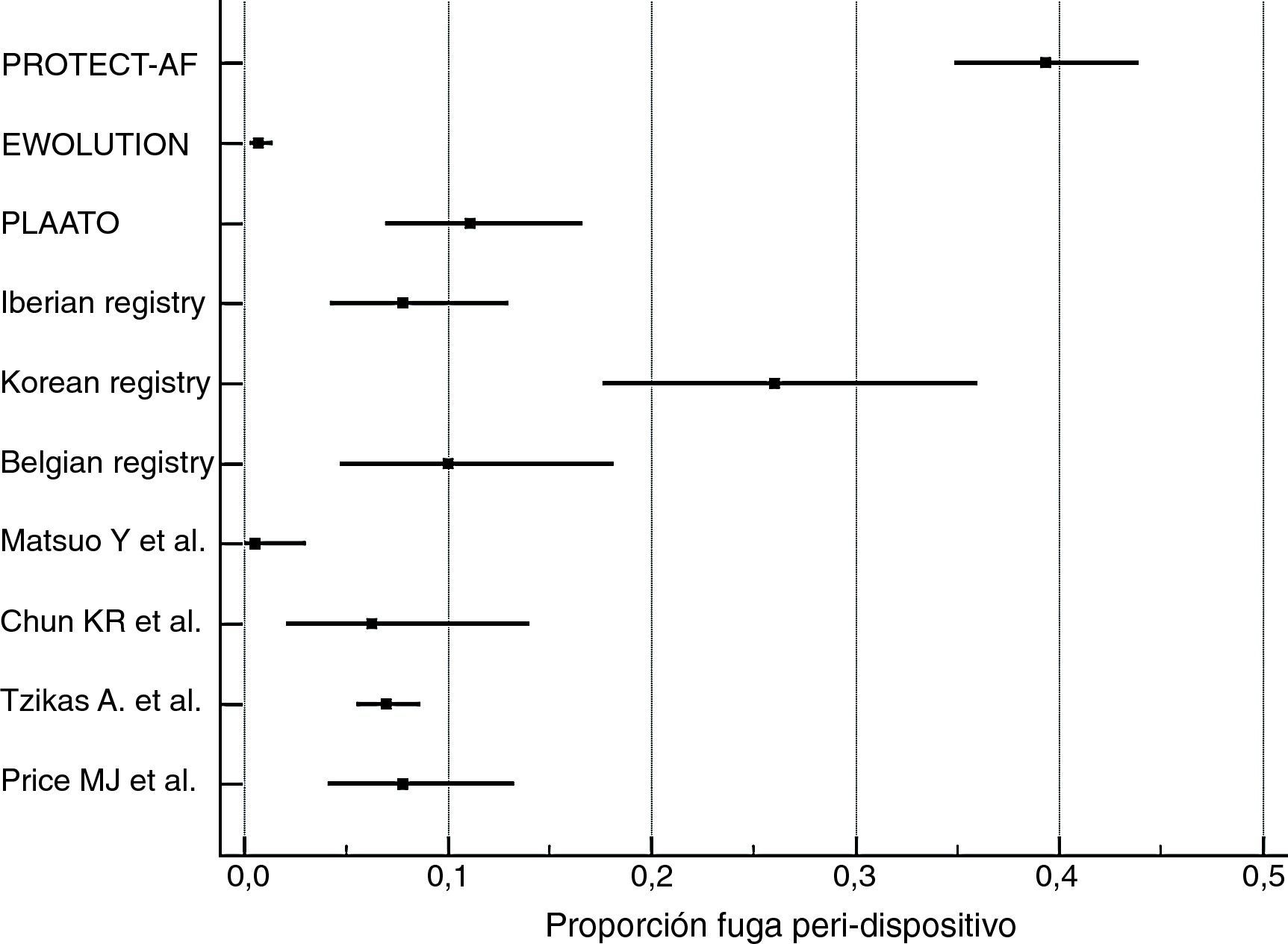
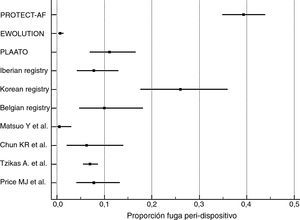
Cálculo de proporciones de eventosLa incidencia de los eventos de complicaciones graves periprocedimiento y de fugas peridispositivo fue calculada con MedCalc Statistical Software versión 17.5.5 (MedCalc Software bvba, Ostend, Bélgica; http://www.medcalc.org; 2017). Por ambos tipos de eventos se ha calculado su proporción (de 0 a 1) que se ha representado gráficamente junto con el intervalo de confianza del 95% (figs. 1 y 2). En cada uno de los gráficos el peso de los estudios está calculado por un modelo de efectos aleatorios.
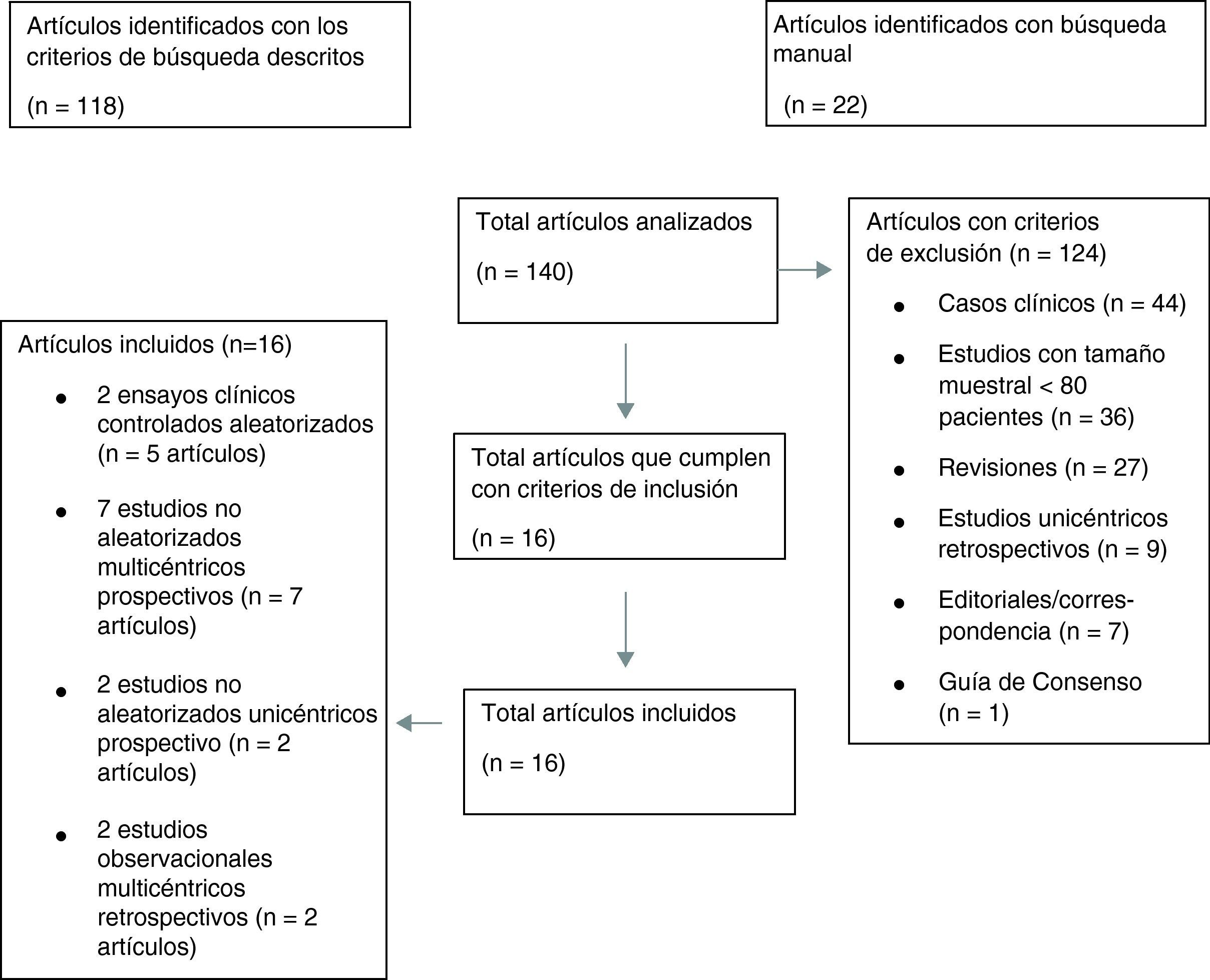
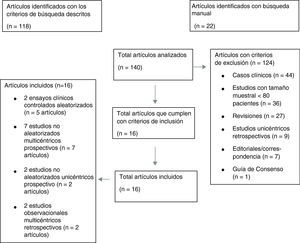
Los resultados de nuestra búsqueda bibliográfica, los estudios excluidos de nuestro análisis y los incluidos están descritos en la figura 3. Nuestra revisión incluía 16 publicaciones procedentes de 2 ensayos clínicos controlados aleatorizados (ECA) (4 publicaciones del estudio PROTECT-AF y una publicación del estudio PREVAIL), 7 estudios no aleatorizados multicéntricos prospectivos, 2 estudios no aleatorizados unicéntrico prospectivo y 2 estudios observacionales multicéntricos retrospectivos (una publicación por cada estudio). Los resultados de dichos estudios en términos de diseño y tamaño de la población muestral, nivel de evidencia según clasificación de la Oxford Centre for Evidence-Based Medicine (http://www.cebm.net/index.aspx?o=5653), duración de seguimiento clínico, resultados de seguridad y eficacia, tasa de implantación exitosa e incidencia de fugas peridispositivo se enumeran en la tabla 1. En las figuras 1 y 2 se ilustran, respectivamente, con forest plot la proporción de complicaciones graves periprocedimiento y de la fuga peridispositivo documentadas en cada estudio.
Descripción de los estudios
| Estudio | Grupo de pacientes | Resultados |
|---|---|---|
| Estudio PROTECT-AF4 Prospectivo, multicéntrico, aleatorizado, de no inferioridad Nivel de evidencia 2 | n = 707 pacientes con FA paroxística, persistente o permanente (CHADS2 medio de 2,2) Grupos: intervención: dispositivo: Watchman (n = 463), control (n = 244) Seguimiento: tiempo medio = 18 meses | Tasa de éxito de implantación: 88% (408/463) |
| Fuga peridispositivo: publicado en un estudio separado | ||
| Resultados de eficacia: incidencia de ictus isquémico o hemorrágico, muerte cardiovascular o no explicada o embolismos sistémicos. Intervención: 3% pacientes-año. Control: 4,9% pacientes-año Razón de tasas: 0,62 (IC del 95%: 0,35-1,25) | ||
| Resultados de seguridad: incidencia de sangrado intracraneal o gastrointestinal o derrame pericárdico severo, embolización sistémica, ictus relacionado con el procedimiento. Intervención: 7,4% pacientes-año. Control: 4,4% pacientes-año. Razón de tasas: 1,69 (IC del 95%: 1,01-3,19) | ||
| Eventos adversos en grupo intervención: derrame pericárdico severo: 4,8%; sangrado severo: 3,5%; ictus isquémico relacionado con el procedimiento: 1,1%; embolización del dispositivo: 0,6%; ictus hemorrágico: 0,2% | ||
| Estudio PROTECT-AF5 Prospectivo multicéntrico, aleatorizado, de no inferioridad Nivel de evidencia 2 | Estudio PROTECT-AF: protocolo descrito previamente Seguimiento: tiempo medio = 3,8 años | Tasa de éxito de implantación: 89,5% (485/542) |
| Resultados de eficacia: incidencia de ictus isquémico o hemorrágico, muerte cardiovascular o no explicada o embolismos sistémicos. Intervención: 2,3% pacientes-año. Control: 3,8% pacientes-año. Razón de tasas: 0,60 (IC del 95%: 0,41-1,05) | ||
| Resultados de seguridad: incidencia de sangrado intracraneal o gastrointestinal o derrame pericárdico severo, embolización sistémica, ictus relacionado con el procedimiento. Intervención: 6% pacientes-año. Control: 3,1% pacientes-año. Razón de tasas: 1,17 (IC del 95%: 0,78-1,95) | ||
| Mortalidad cardiovascular: intervención: 1,0% pacientes-año; control: 2,4% pacientes-año. Razón de tasas: 0,40 (IC del 95%: 0,21-0,75) | ||
| Mortalidad por otra causa: intervención: 3,2% pacientes-año; control: 4,8% pacientes-año. Razón de tasas: 0,66 (IC del 95%: 0,45-0,98) | ||
| Eventos adversos en grupo intervención: derrame pericárdico severo: 4,8%; sangrado severo: 4,8%; ictus isquémico relacionado con el procedimiento: 1,3%; embolización del dispositivo: 0,6%; ictus hemorrágico: 0,2% | ||
| Subestudio del PROTECT-AF6 Retrospectivo, multicéntrico Nivel de evidencia 3 | Evaluación de 93 ETE con sospecha de trombo relacionado con el dispositivo (TRD). | Criterio diagnóstico ecocardiográfico consensuado para TDR, consenso inicial: 67% |
| Incidencia de presencia de trombos relacionados con el dispositivo: 5,7% del total de pacientes del grupo intervención del estudio PROTECT AF | ||
| Tasa de eventos clínicos en pacientes con trombos relacionados con el dispositivo: incidencia de ictus isquémico o hemorrágico, muerte cardiovascular o inexplicable o embolismo sistémico: 3,4% pacientes-año | ||
| Subestudio del PROTECT-AF7 Retrospectivo, multicéntrico Nivel de evidencia 3 | 542 pacientes del estudio PROTECT-AF más 460 pacientes del estudio CAP, pacientes con FA no valvular paroxística, persistente, CHADS2 ≥ 1 Dispositivo: Watchman. Seguimiento: tiempo medio PROTECT-AF =2,5 años; tiempo medio CAP = 0,4 años | Resultados de seguridad: incidencia de sangrado y eventos relacionados con el procedimiento, derrame pericárdico, ictus, embolización del dispositivo en la primera semana: PROTECT-AF: 7,7%; CAP: 3,7% |
| Resultados de eficacia: incidencia de ictus, embolizaciones sistémicas y muerte cardiovascular/no explicable. Ictus: PROTECT-AF: 0,9%; CAP: ninguno. Embolización de dispositivo: PROTECT-AF: 0,6%; CAP: ninguno. Trombo asociado al dispositivo: PROTECT-AF: 4,2%; CAP: ninguno | ||
| Subestudio del PROTECT-AF8 Retrospectivo, multicéntrico Nivel de evidencia 3 | Grupo de intervención del estudio PROTECT-AF | Fuga peridispositivo (pequeña < 1 mm, moderada 1-3 mm, grande >3 mm) a los 45 días: 39% (pequeña: 7,7%; moderada: 59,9%; grande: 32,4%); a 12 meses: 32% (pequeña: 0,8%; moderada: 62,4%; grande: 36,8%). |
| Resultados de eficacia según flujo peri-dispositivo y el uso de warfarina: ausencia de flujo peridispositivo con warfarina vs. interrupción de la warfarina: cociente de riesgo: 0,89; IC del 95%, 0,12-6,73 | ||
| Estudio PREVAIL9 Prospectivo, multicéntrico, aleatorizado, de no inferioridad Nivel de evidencia 2 | n =407 pacientes con fibrilación auricular paroxística, persistencia o permanente (CHADS2 medio de 2,6) Grupos intervención: n =269, dispositivo: Watchman; control: n = 138 Seguimiento: tiempo medio =18 meses | Tasa de éxito de implantación: 95,1% |
| Resultados de eficacia: incidencia de ictus, embolismos sistémicos, y muerte cardiovascular o no explicable. Intervención: 0,064 pacientes-año vs. control: 0,063 pacientes-año. Razón de tasas: 1,07 (IC del 95%: 0,57 a 1,89) | ||
| Resultados tardíos de eficacia: incidencia de ictus o embolismos sistémicos a partir del 7.° día postaleatorización. Intervención: 0,0253 vs. control: 0,0200. Diferencia de riesgo: 0,0053 (IC del 95%: –0,0190 a 0,0273) | ||
| Resultados precoces de seguridad: grupo de la intervención: 2,2% (6/269). Embolización del dispositivo: 0,7%. Fistula arteriovenosa: 0,4%. Perforación cardiaca: 0,4%. Taponamiento cardiaco: 0,4%. Sangrado severo requiriendo trasfusión: 0,4% | ||
| EWOLUTION Registry10 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n = 1021 pacientes con FA no valvular paroxística o permanente. CHADS2 medio: 2,8 Dispositivo: Watchman Seguimiento: 30 días postprocedimiento | Tasa de éxito de implantación: 98,5% |
| Fuga peridispositivo ≥ 5mm: 0,7% | ||
| Complicaciones graves relacionadas con el procedimiento: 3,3%. Mortalidad: 0,7%. Taponamiento cardiaco: 0,2%. Embolización del dispositivo: 0,2%. Sangrado severo: 0,8%. Ictus: 0,1%. Reintervención debido a sello incompleto: 0,2%. Complicación vascular: 0,5% | ||
| PLAATO11 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n =180 pacientes con FA no valvular paroxística o permanente, con contraindicación para la anticoagulación. (CHADS2 medio de 3,1) Dispositivo: PLAATO Seguimiento: tiempo medio = 9,6 meses | Tasa de éxito de implantación: 90% |
| Fuga peridispositivo (mayor del grado ligero): a los 2 meses: 11,1% | ||
| Complicaciones graves relacionadas con el procedimiento: mortalidad: 1,1%; taponamiento cardiaco: 3,3%; embolización dispositivo: 1,2% | ||
| Eventos adversos por años (incidencia de muertes totales, ictus, complicaciones vasculares mayores, derrame pericárdico, embolización del dispositivo): 22,4% | ||
| Iberian Registry12 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n =167 FA no valvular paroxística o permanente, con contraindicación para la anticoagulación (CHADS2 medio: 3) Dispositivo: Amplatzer Cardiac Plug Seguimiento: tiempo medio = 22 meses | Tasa de éxito de implantación: 94,6%% |
| Fuga peridispositivo (fuga > 3mm): 8,2% | ||
| Complicaciones serias relacionadas con el procedimiento: mortalidad: 0%; taponamiento cardíaco: 1,2%; AIT: 1,2%. embolización dispositivo: 0,6% | ||
| Datos a los 2 años de seguimiento: muertes totales: 10,8%. Sangrado: 10,1%. Ictus: 4,4% | ||
| ASAP13 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n = 150 pacientes con FA no valvular paroxística o permanente (CHADS2 medio de 2,8) Dispositivo: Watchman Seguimiento: tiempo medio = 14,4 meses | Tasa de éxito de implantación: 94,7% |
| Fuga peridispositivo: no publicado | ||
| Complicaciones severas relacionadas con el procedimiento: 8,7%; derrame pericárdico: 3,3%; embolización dispositivo: 1,3%; trombo en el dispositivo asociado a ictus: 0,7%; complicación vascular: 2%; otras 1,4% | ||
| Datos de seguimiento: ictus de cualquier causa: 2,3% por año (4 eventos); muerte de cualquier causa: 5% por año (8 eventos en total, 3 muertes cardiovasculares) | ||
| Korean Registry14 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n = 96 pacientes con FA no valvular con contraindicación para la anticoagulación (CHADS2 medio de 2,5) Dispositivo: Watchman (n = 46), Amplatzer Cardiac Plug (n = 50) Seguimiento: tiempo medio = 21,9 meses | Tasa de éxito de implantación: 96,9% |
| Fuga peridispositivo: a 6 meses: 25,8% (n = 25): 2 ligeras (< 1 mm), 18 moderadas (1-3 mm) y 4 mayores (> 3mm), 1 severa (> 5mm) La incidencia general de fuga peridispositivo fue significativamente más alta con el dispositivo Watchman | ||
| Complicaciones severas relacionadas con el procedimiento: mortalidad: 1,0% (1/96); taponamiento cardíaco: 2,1%; embolización dispositivo: 1,3%; complicación vascular: 1,3%; posible trombo del dispositivo: 2,1% | ||
| Datos de seguimiento Mortalidad: 5,2%; tasa anual de ictus o AIT: 2,3%; trombo del dispositivo: 3 (Amplatzer Cardiac Plug, n = 1; Watchman, n = 2) | ||
| Belgian Registry15 Prospectivo, multicéntrico, no aleatorizado Nivel de evidencia 3 | n = 90 pacientes con FA no valvular paroxística o permanente. (CHA2DS2VASC medio de 4,4 ± 1,8) Dispositivo: Amplatzer Cardiac Plug Seguimiento: datos al año disponibles para 75 pacientes | Tasa éxito de implantación: 99% |
| Fuga peridispositivo: fuga pequeña (< 3mm): 15,7% (8); fuga grande (> 3mm): 1,9% (1); ninguna: 82,4% (42) | ||
| Complicaciones severas relacionadas con el procedimiento: mortalidad: 1,2%; taponamiento cardíaco: 3,4%; embolización aérea con elevación de ST transitoria: 2,2%; complicación vascular: 1,2% | ||
| Datos de seguimiento: mortalidad no relacionada con el dispositivo: 5,3%; tasa de ictus observada: 2,14% por año | ||
| Estudio de Matsuo et al.16 Prospectivo, unicéntrico, no aleatorizado Nivel de evidencia 3 | n = 179 pacientes con FA no valvular paroxística o permanente (CHADS2 medio de 2,8) Dispositivo: Watchman (n = 169), Amplatzer Cardiac Plug (n = 8) Seguimiento: datos a los 6 meses disponibles para 145 pacientes | Tasa éxito implantación: 98.9% |
| Fuga peridispositivo: a los 45 días 1 paciente (0,6%) con fuga de 5 mm | ||
| Complicaciones severas relacionadas con el procedimiento: taponamiento cardíaco 1,1%; AIT: 0,6%; embolización del dispositivo: 1,7%; embolización aérea con elevación de ST transitoria: 1,7%; trombo intracardíaco formado durante el procedimiento: 17%; complicación vascular que precisa cirugía: 1,7% | ||
| Datos de seguimiento: a los 45 días: 4,2% trombos relacionados con el dispositiv; a los 6 meses: mortalidad: 0,7% (n = 1) (muerte por insuficiencia cardíaca); AIT: 0,7% (n = 1); sangrado severo: 2,1% (n = 3: sangrado gastrointestinal superior en 2 casos y hematoma subdural traumático en un caso) | ||
| Estudio de Chun et al.17 Prospectivo, unicéntrico, noaleatorizado Nivel de evidencia 3 | n = 80 pacientes con FA no valvular (CHA2DS2- VASC medio de 4,1) Dispositivos: Watchman (n = 40) y Amplatzer Cardiac Plug (n = 40) Seguimiento: tiempo medio =12 meses | Tasa éxito de implantación: 95% en grupo Watchman,100% en grupo Amplatzer |
| Fuga peridispositivo 6,4% (5/78 flujo < 5mm) (observado solo en dispositivo Whatchman). Ninguna fuga con flujo > 5 mm fue observada | ||
| Complicaciones severas relacionadas con el procedimiento: taponamiento cardíaco: 2,6%; embolización aérea con cambios en ECG: 2,6%; complicación vascular: 6,2% | ||
| Datos de seguimiento: mortalidad: 4,1%; causas de muerte: insuficiencia cardíaca congestiva (n = 2), sangrado gastrointestinal (n = 1) Trombo relacionado con el dispositivo: 5% | ||
| Estudio de Tzikas et al.18 Retrospectivo, observacional multicéntrico, no aleatorizado Nivel de evidencia 4 | n = 1.047 pacientes con FA no valvular (CHADS2 medio de 2,8). Dispositivo: Amplatzer Cardiac Plug Seguimiento: tiempo medio = 13 meses | Tasa de éxito de implantación: 98,2% |
| Fuga peridispositivo: 11,6%: 4,3% trivial (< 1 mm); 5,4% ligera (1-3 mm); 1,9% significativa (> 3 mm) | ||
| Complicaciones serias relacionadas con el procedimiento: mortalidad: 0,8%; taponamiento cardíaco: 1,2%; embolización del dispositivo: 0,8%; sangrado mayor: 1,2%; ictus/AIT: 1,2%; infarto miocardio: 0,1%; trombo en dispositivo: 0,3%; embolismo aéreo: 0,5%; complicación vascular: 0,4% | ||
| Datos de seguimiento: muerte por cualquier causa: 1,9%; muerte cardiovascular: 1,3%; ictus: 1,3%; derrame pericárdico: 1,9%; trombo en dispositivo: 6,3% | ||
| Estudio de Price et al.19 Retrospectivo, observacional multicéntrico no aleatorizado Nivel de evidencia 4 | n=154 pacientes con FA (CHADS2 medio de 3) Dispositivo: Lariat Seguimiento: a 112 días datos disponibles de 134 pacientes | Tasa éxito de implantación: 94,6% |
| Fuga peridispositivo Fuga residual <5 mm: 7%; fuga ≥5 mm: 0,7% | ||
| Complicaciones serias relacionadas con el procedimiento: sangrado/taponamiento cardíaco: 13,7% |
AIT: accidente isquémico transitorio; ASAP: ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology study; CAP: Continued Access Protocol study; CHADS2 score: Cardiac failure, Hypertension, Age, Diabetes, Stroke (Doubled); CHA2DS2-VASc score: Congestive Heart failure, hypertension, Age >75 (doubled), Diabetes, Stroke (doubled), Vascular disease, Age 65-74, and Sex (female); ETE: ecocardiografía trans-esofágica; FA: fibrilación auricular; IC: intervalo de confianza; LAA: Closure Device In Patients With Atrial Fibrillation Versus Long Term Warfarin Therapy trial; PREVAIL: Prospective Randomized Evaluation of the Watchman; PROTECT AF: WATCHMAN Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation study; TDR: trombo relacionado con el dispositivo.
Los 2 ECA, PROTECT-AF4-8 y PREVAIL9, comparaban el dispositivo de cierre de la OI Watchman (Atritech, Plymouth, MN, EE. UU.) con la terapia anticoagulante con warfarina en pacientes con fibrilación auricular no valvular.
El ensayo PROTECT-AF4,5 incluía 463 intervenciones y 244 pacientes control (que tomaban solo warfarina). No se detectó ninguna diferencia en términos de resultados de eficacia (accidente cerebrovascular isquémico/hemorrágico, muerte cardiovascular o no explicada y embolia sistémica) a los 3,8 años de seguimiento, con 2,3 eventos por 100 pacientes-año en el grupo de cierre de OI con dispositivo Watchman vs. 3,8 eventos por 100 pacientes-año en el grupo de warfarina (odds ratio, 0,60; IC del 95%: 0,41-1,05). Los resultados en cuanto a eficacia mostraron «no inferioridad» del dispositivo Watchman (más anticoagulante durante al menos 45 días, seguido de doble terapia antiplaquetaria durante 6 meses y posteriormente aspirina de por vida) en comparación con el tratamiento con warfarina solo.
En el mismo estudio PROTECT-AF se documentó que los beneficios en cuanto a los resultados de eficacia del grupo intervenido con dispositivo fueron casi por completo neutralizados por la presencia de trombos relacionados con el dispositivo (tasa de eventos relacionados con eficacia: 3,4 por 100 pacientes-años6). Entre los pacientes tratados con dispositivo Watchman, el 10,6% presentó eventos relacionados con la seguridad (hemorragia intracraneal o gastrointestinal o derrame pericárdico severo, embolización del dispositivo o ictus relacionados con el procedimiento5). A los 45 días, se detectó fuga peridispositivo en el 39% de los pacientes. Esta fue>3mm de ancho en el 32,4% de los casos8.
El ensayo PREVAIL9 incluía a 407 sujetos (269 asignados al grupo de exclusión de la OI y 138 asignados a la terapia con warfarina). La oclusión de la OI con el dispositivo Watchman no alcanzó la «no inferioridad» estadística en comparación con el grupo de la warfarina en términos de eficacia. Solo el 2,2% de los pacientes presentaron eventos de seguridad.
El resto de los estudios prospectivos (7 multicéntricos y 2 unicéntricos) se llevaron a cabo en una población muestral con contraindicación absoluta o relativa para la anticoagulación. De esta manera, se utilizó doble terapia antiagregante, en lugar de warfarina, en pacientes a quienes se les implantó el dispositivo de oclusión de OI. En estos estudios no fue reclutado un grupo control.
Los estudios prospectivos multicéntricos son los siguientes: Ewolution10 (n=1019, dispositivo: Watchman), CAP registry7 (n=460, dispositivo: Watchman), PLAATO11 (n=180, dispositivo: Plaato, ev3 Inc., Plymouth, MN, EE. UU.), Iberian registry12 (n=167, dispositivo: Amplatzer Cardiac Plug, St. Jude Medical, St. Paul, MN, EE. UU.), ASAP study13 (n=150, dispositivo: Watchman) Korean registry14 (n=99, dispositivos: Watchman y Amplatzer Cardiac Plug) y Belgian Registry15 (n=90, dispositivo Amplatzer Cardiac Plug).
En estos 7 estudios prospectivos multicéntricos la tasa de implantación exitosa del dispositivo osciló entre el 90% (PLAATO11) y el 99% (Belgian Registry15). La presencia de fuga peridispositivo osciló entre el 0,7% (EWOLUTION10, que consideraba solo fuga > 5mm) y el 27% (Korean registry14, teniendo en cuenta cualquier rango de fuga). Las complicaciones graves derivadas del procedimiento (muerte, taponamiento cardíaco, derrame pericárdico, hemorragia severa, embolización del dispositivo, accidente cerebrovascular y embolización aérea con elevación transitoria del ST) oscilaron entre el 1,6% (EWOLUTION10) y el 12,5% (Korean registry14).
El registro CAP7 siguió cronológicamente el estudio PROTECT AF y compartió con él los investigadores. Los eventos en términos de seguridad en el registro CAP fueron casi la mitad de los del estudio PROTECT AF; por esta razón, los autores indicaron que había una curva de aprendizaje en el proceso de implantación del dispositivo que producía una mejoría de resultados, en cuanto a incidencia de eventos de seguridad, conforme iba aumentando la experiencia de los operadores.
Los 2 ensayos unicéntricos prospectivos son el estudio de Matsuo et al.16 (n =179, dispositivos: Watchman y Amplatzer Cardiac Plug) y el estudio de Chun et al.17 (n=80, dispositivos: Watchman y Amplatzer Cardiac Plug), que documentaron una tasa de complicaciones mayores relacionadas con el procedimiento del 3,3 y el 5,2%, respectivamente.
Los 2 estudios observacionales multicéntricos retrospectivos son los realizados por Tzikas et al.18 (n=1047, dispositivo: Amplatzer Cardiac Plug) y por Price et al.19 (n=154, dispositivo: Lariat, SentreHeart, Redwood City, California, EE. UU.), que objetivaron una tasa de complicaciones mayores relacionadas con el procedimiento del 5 y el 13,7%, respectivamente.
DiscusiónNuestra revisión indica que existen 2 grupos de pacientes con fibrilación auricular no valvular que podrían teóricamente beneficiarse del cierre de la OI: pacientes que pueden tomar anticoagulantes orales y los pacientes en los que la anticoagulación está contraindicada. Los datos de los 2 ensayos clínicos aleatorizados que estudian al primer grupo de pacientes (PROTECT-AF4–8 y PREVAIL9) indican que la exclusión percutánea de la OI proporciona una tasa similar de accidentes cerebrovasculares y mortalidad a largo plazo en comparación con la terapia con warfarina. En el caso de aparición de trombos relacionados con el dispositivo (hasta un 5,7%)5 o una fuga peridispositivo (hasta un 39%)7, estos pacientes pueden ser tratados con warfarina hasta la disolución del trombo en el primer caso o hasta el cierre completo de la OI en el segundo. Ambas complicaciones requieren un estricto seguimiento ecocardiográfico. En cualquier caso, la warfarina debe tomarse al menos durante los primeros 45 días para completar el proceso de endotelización del dispositivo. Los 11 estudios restantes están representados por 9 ensayos prospectivos no aleatorizados7,10-17 y 2 estudios retrospectivos multicéntricos18-19 que investigan el cierre de la OI en pacientes con contraindicación a la warfarina. En este caso, después del cierre de la OI, se administra doble tratamiento antiplaquetario. Estos últimos estudios publican una tasa significativa de complicaciones graves relacionadas con el procedimiento (hasta del 13,7%)19, siendo el derrame pericárdico/taponamiento cardiaco el más frecuente. La tasa de mortalidad periprocedimiento alcanza el 1,2%15. En el seguimiento al año, los eventos de sangrado severo, en los que el doble tratamiento antiplaquetario puede tener un impacto, tienen una incidencia de hasta un 2,1%16. Hay además que subrayar que, en estos pacientes, el manejo farmacológico de la fuga peridispositivo o trombo en el dispositivo es un problema de difícil solución, debido a la imposibilidad de administrar anticoagulantes, que en esta población están contraindicados.
LimitacionesLa presente revisión no puede beneficiarse de un metaanálisis, ya que entre los estudios incluidos hay solo 2 ensayos aleatorizados donde es posible comparar la incidencia de eventos neurológicos en pacientes tratados con dispositivo y en los tratados con anticoagulantes. La mayoría de los estudios incluidos, por lo tanto, está enfocada en el análisis de pacientes con contraindicación a la anticoagulación. Evaluar la incidencia de eventos neurológicos en estos pacientes es especialmente complejo, ya que no existe un grupo control. Hay además que subrayar que existe una extrema heterogeneidad entre los criterios de inclusión de los distintos estudios.
ConclusiónEl cierre percutáneo de la orejuela izquierda se asocia a un porcentaje significativo de complicaciones graves periprocedimiento y de fuga peridispositivo.
Conflicto de interesesLos autores del presente estudio no tienen conflicto de intereses.