La cirugía cardiaca con circulación extracorpórea (CEC) se asocia con un aumento de sangrado postoperatorio, consumo de productos hemáticos y número de reexploraciones quirúrgicas. Actualmente, del 50% de los pacientes de cirugía cardiaca transfundidos, el 20% tiene un sangrado significativo y el 5% requiere reoperación por sangrado postoperatorio. Este aumento de hemoderivados aumenta la morbimortalidad, la estancia hospitalaria y los costes sanitarios. Las causas de la coagulopatía después de la CEC son multifactoriales: la hemodilución, la exposición de la sangre a los circuitos de la CEC, la destrucción de las plaquetas y la activación de la trombina. Las directrices de las sociedades científicas americanas y europeas recomiendan el uso de ácido tranexámico (AT) para reducir la hemorragia perioperatoria en la cirugía cardiaca. El AT ahorra un promedio de 300ml de sangre con una reducción relativa del 32% al recibir una transfusión. Las intervenciones con CEC sin el uso de fármacos antifibrinolíticos se caracteriza por un aumento de la pérdida de sangre, reoperaciones y la transfusión de productos sanguíneos en comparación con otras intervenciones en donde se han utilizado antifibrinolíticos. El principal problema con el uso de AT se encuentra en los muchos patrones y diferentes dosis de administración, que varían de un artículo a otro. El objetivo de este artículo es alertar sobre el uso de altas dosis de AT y sus consecuencias, según las últimas recomendaciones de la literatura al respecto.
Cardiac surgery with cardiopulmonary bypass (CPB) is associated with increased postoperative bleeding, blood product consumption, and the number of surgical re-explorations. Currently, of the 50% of transfused patients from cardiac surgery, 20% have significant bleeding, and 5% required reoperation for postoperative bleeding. This increased consumption of blood increases morbidity, mortality, hospital stay, and healthcare costs. The causes of coagulopathy after CPB are multifactorial: hemodilution, blood exposure to CPB circuits, destruction of platelets, and thrombin activation. The guidelines of the American and European scientific societies recommend the use of tranexamic acid (TA) to reduce perioperative bleeding in cardiac surgery. TA saves an average of 300ml of blood, with a relative reduction of 32% receiving transfusion. CS interventions with CPB carried out without using any antifibrinolytic drug is characterized by increased blood loss, increased reoperations for bleeding, and increased transfusion and blood products, when compared to other interventions where antifibrinolytic were used. The main problem with the use of TA lies in the many administration patterns and different doses,, which vary from one article to another. The aim of this article is to alert on the use of high doses of TA and its consequences according to the latest recommendations in the literature.
La cirugía cardiaca (CC) con circulación extracorpórea (CEC) se asocia a un aumento del sangrado postoperatorio, del consumo de hemoderivados y del número de reexploraciones quirúrgicas. Esto es así desde la primera intervención de CC con CEC atribuida al Doctor J. Gibbon en 1953 y en la que se utilizaron de 25 a 30 unidades de sangre1. Hoy día, cerca del 50% de todos los pacientes de CC se transfunden, el 20% tiene un sangrado significativo y el 5% requiere reintervención por hemorragia postoperatoria2,3. Este mayor consumo de hemoderivados aumenta la morbimortalidad, la estancia hospitalaria y los costes sanitarios. Incluso una sola unidad de concentrado de hematíes se asocia a una mayor mortalidad4,5. Las reintervenciones por hemorragia postoperatoria tienen tasas 4 veces más altas de mortalidad e infección esternal6.
Las causas de la coagulopatía después de CEC son multifactoriales. La hemodilución de la sangre y la exposición de la misma a los circuitos de CEC diluye los factores de coagulación, origina una activación y destrucción plaquetaria y una producción de trombina. Se produce un incremento de la actividad fibrinolítica que puede ser iniciada por la generación de trombina, un aumento de la activación del activador tisular del plasminógeno (t-PA) y una disminución de los inhibidores de la plasmina como el inhibidor del activador del plasminógeno7. La hipotermia y la administración de heparina y protamina también pueden influir en el sangrado.
Al ser la fibrinólisis una importante causa de sangrado después de CC con CEC, los fármacos antifibrinolíticos se han mostrado eficaces en la reducción del sangrado en la CC. Se han utilizado 3 agentes antifibrinolíticos en CC para disminuir la hemorragia postoperatoria: la aprotinina, un inhibidor de proteasas de amplio espectro que se encuentra en los mastocitos de los mamíferos, y 2 análogos de la lisina, el ácido tranexámico (AT) y el ácido épsilon aminocaproico (AEAC). Tras la publicación de Mangano et al. 8 y el estudio Blood Conservation Using Antifibrinolytics in a Randomized Trial (BART) en el que se comparaba aprotinina, AT y AEAC, se observó que los pacientes del grupo aprotinina tenían una mayor mortalidad en los 30 primeros días del postoperatorio9. Como consecuencia de lo anterior y de las recomendaciones de la FDA10, la aprotinina ha dejado prácticamente de emplearse a pesar de que muchos autores insisten en que este fármaco es claramente superior a otros antifibrinolíticos. El AEAC tiene un mecanismo de acción similar al AT, es seguro y eficaz pero es 10 veces menos potente que el AT y se utiliza poco en nuestro medio11.
Las guías clínicas de las sociedades científicas americanas y europeas recomiendan la utilización de AT para reducir el sangrado perioperatorio en CC3,12–14. El AT ahorra un promedio de 300ml de sangre en pacientes de CC con una reducción relativa del 32% de recibir una transfusión15. Las intervenciones de CC con CEC que se realizan sin utilizar ningún fármaco antifibrinolítico se caracterizan por presentar un incremento de las pérdidas sanguíneas, un aumento de las reintervenciones por sangrado y un aumento de las transfusiones y de hemoderivados cuando se comparan con intervenciones en las que sí se han utilizado antifibrinolíticos16. El principal problema de la utilización del AT reside en las numerosas pautas y en las diferentes dosis de administración, que varían de un artículo a otro17. El objetivo de este artículo es alertar de la utilización de dosis altas de AT y sus consecuencias, y mostrar las últimas recomendaciones de la literatura en este sentido.
Ácido tranexámico y cirugía cardiacaEn la actualidad el AT es el antifibrinolítico que más se utiliza en todo el mundo. Su acción beneficiosa para disminuir la hemorragia postoperatoria se basa en la inhibición de la fibrinólisis con disminución de la formación de productos de degradación del fibrinógeno que tienen una acción deletérea sobre la función plaquetaria y los factores de coagulación v y viii; además, disminuye la conversión de plasminógeno a plasmina que tiene una actividad proteolítica sobre los receptores plaquetarios.
El AT fue descubierto por Okamoto en 1964 (quien también descubrió el AEAC) y la dosificación recomendada es de 10mg/kg de peso cada 8h18.
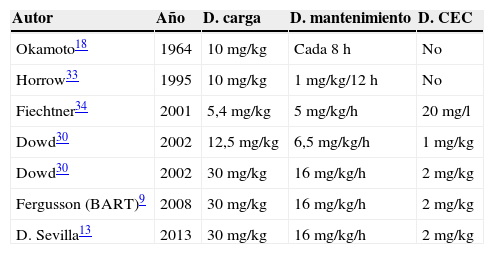
Se trata de un fármaco bien tolerado con escasos efectos secundarios y del que no se conoce con exactitud cuál es dosificación óptima necesaria para prevenir la fibrinólisis in vivo, lo que explicaría la gran variedad de dosis y pautas de administración en CC (tabla 1), que varía en cada ensayo publicado, en cada centro y algunas veces dentro del mismo centro según criterios del anestesista o del cirujano. Así, en el trabajo de Leal-Noval et al. (Consensus Document on alternatives to allogenic blood transfusion)13 publicado recientemente, los autores recomiendan la utilización en CC con CEC de una dosis inicial de AT de 30mg/kg seguida de la infusión de 16mg/kg hasta el final de la cirugía y 2mg/kg en el circuito de CEC. Es decir, se recomienda la utilización de dosis altas de AT, pero la administración de dosis elevadas de AT no está exenta de polémica debido a la aparición de efectos secundarios, fundamentalmente convulsiones que además están ligadas a un incremento de la mortalidad19.
Dosis utilizadas de ácido tranexámico en cirugía cardiaca
| Autor | Año | D. carga | D. mantenimiento | D. CEC |
|---|---|---|---|---|
| Okamoto18 | 1964 | 10mg/kg | Cada 8h | No |
| Horrow33 | 1995 | 10mg/kg | 1mg/kg/12h | No |
| Fiechtner34 | 2001 | 5,4mg/kg | 5mg/kg/h | 20mg/l |
| Dowd30 | 2002 | 12,5mg/kg | 6,5mg/kg/h | 1mg/kg |
| Dowd30 | 2002 | 30mg/kg | 16mg/kg/h | 2mg/kg |
| Fergusson (BART)9 | 2008 | 30mg/kg | 16mg/kg/h | 2mg/kg |
| D. Sevilla13 | 2013 | 30mg/kg | 16mg/kg/h | 2mg/kg |
CEC: circulación extracorpórea; D. carga: dosis bolo; D. CEC: dosis en CEC, por kg de peso del paciente o por L de cebado de la máquina de CEC; D. mantenimiento: dosis durante la intervención.
De las guías clínicas consultadas, la guía americana3 no recomienda una dosificación concreta de AT en CC. La guía de manejo de sangrado perioperatorio de la Sociedad Europea de Anestesiología14 habla de una dosis inicial de AT de hasta 25mg/kg, pudiendo repetirse la dosis inicial o continuar con una perfusión de 1-2mg/kg/h, pero estas dosificaciones no son específicas para CC. El trabajo de Leal-Noval et al.13 es el único que recomienda una dosis concreta en CC, y esta dosis es la utilizada en el estudio BART9, un estudio con un gran impacto mediático en la anestesiología y la CC, debido a que provocó la retirada de la aprotinina del mercado, pero que al mismo tiempo fue un trabajo muy criticado metodológicamente. De hecho, diversas bases de datos tanto clínicas como administrativas revelan una profunda divergencia en los resultados20. Una valoración independiente de los datos del ensayo BART y su análisis por un modelo estadístico bayesiano demuestra que la aprotinina no se asocia con un incremento de la mortalidad en los pacientes de alto riesgo21,22. Estos datos y una nueva evaluación del fármaco ha hecho que en septiembre de 2011 la administración sanitaria de Canadá autorizase el uso de aprotinina en pacientes con alto riesgo de sangrado sometidos a revascularización coronaria23. Es curioso mencionar que estas indicaciones aprobadas para la aprotinina son las mismas que en 1993 utilizó la FDA al aprobar por primera vez en CC el uso de la aprotinina (pacientes de alto riesgo que se sometían a revascularización coronaria24) y posteriormente se ampliaron sus indicaciones generalizándose su uso también en pacientes de bajo riesgo hemorrágico. A partir de la retirada de la aprotinina se empieza a relacionar la presencia de convulsiones con la utilización de AT25,26.
En el estudio BART9 se utiliza una pauta de administración del AT que según los autores está basada en regímenes eficaces de AT utilizados en ensayos previos aleatorizados y citan 3 artículos de Karski et al.27–29, aunque en ninguno de ellos las dosis de AT tienen nada que ver con las que se utilizaron en el estudio BART. Así, en el primero de los artículos citados27 las dosis varían de 50 a 150mg/kg de peso en una dosis única. En el segundo artículo citado se administran dosis de 10g de forma única o bien una segunda dosis, y 10g en forma de perfusión continua; y en el tercer artículo se administran dosis únicas de AT de 6g o de 10g. En realidad la dosificación del estudio BART fue propuesta por Dowd et al.30 a los que por cierto ni siquiera se cita en el ensayo.
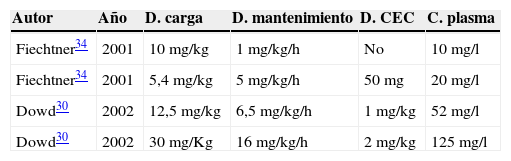
Dowd et al.30 estudiaron la farmacocinética del AT en CC intentando encontrar una dosificación de AT que fuera capaz de producir una inhibición completa de la fibrinólisis. Se sabía, basándose en antiguos trabajos31 que medían la actividad fibrinolítica y la concentración plasmática de AT en el plasma y en piezas de tejido humano (colon, riñones, próstata), que para reducir un 98-100% la actividad de t-PA se requiere una concentración plasmática de AT de 100mg/l, mientras que una inhibición del 80% del t-PA requiere concentraciones plasmáticas de AT de 10mg/l. Los autores de estos estudios insisten en que a nivel clínico es suficiente un 80% de la inhibición, es decir, serían suficientes concentraciones plasmáticas de AT de 10mg/l o incluso menores, del orden de 5-10mg/l32, para el control de la fibrinólisis.
Otros autores habían utilizado en CC dosis parecidas a las que se usaban fuera del campo de la CC, administrando una dosis de carga de 10mg/kg y posteriormente una perfusión de 1mg/kg/h; y estudiando la relación dosis-respuesta vieron que los pacientes con esta dosis sangraban menos que con dosificaciones más altas (dosis de carga de 20 y 40mg/kg y perfusiones posteriores de 2-4mg/kg/h)33. El estudio de la farmacocinética de esta dosificación demuestra que es suficiente para producir una inhibición del 80% de t-PA34 durante CEC (tabla 2). Dowd et al.30 creen que aunque estas dosis (10mg/kg de dosis de carga seguida de 1mg/kg/h) bastarían para pacientes con bajo riesgo de hemorragia perioperatoria, en pacientes con riesgo más elevado se tendrían que utilizar dosis suficientes para inhibir en su totalidad la fibrinólisis y para esto se requerirían concentraciones plasmáticas de AT mayores de 125mg/l. Para ello los autores utilizaron 2 tipos de dosis: una para pacientes con bajo riesgo de hemorragia perioperatoria (dosis de carga de 12,5mg/kg y posteriormente una perfusión de 6,5mg/kg/h junto con 1mg/kg en CEC con lo que se alcanzarían concentraciones plasmáticas de 52mg/,); y otra para pacientes con alto riesgo de hemorragia perioperatoria (dosis de carga de 30mg/kg y una perfusión de 16mg/kg/h añadiendo además al circuito de CEC 2mg/kg con lo que se conseguirían concentraciones plasmáticas de AT del orden de 125mg/l). Un reciente artículo que estudia la farmacocinética del AT con la dosis de BART confirma que las concentraciones plasmáticas de AT se sitúan entre 100 y 150mg/L durante toda la intervención35.
Dosis de ácido tranexámico y concentración plasmática
| Autor | Año | D. carga | D. mantenimiento | D. CEC | C. plasma |
|---|---|---|---|---|---|
| Fiechtner34 | 2001 | 10mg/kg | 1mg/kg/h | No | 10mg/l |
| Fiechtner34 | 2001 | 5,4mg/kg | 5mg/kg/h | 50mg | 20mg/l |
| Dowd30 | 2002 | 12,5mg/kg | 6,5mg/kg/h | 1mg/kg | 52mg/l |
| Dowd30 | 2002 | 30mg/Kg | 16mg/kg/h | 2mg/kg | 125mg/l |
AT: ácido tranexámico; C. plasma: concentración plasmática; CEC: circulación extracorpórea; D. carga: dosis bolo; D. CEC: dosis en CEC, por kg de peso del paciente o por L de cebado de la máquina de CEC; D. mantenimiento: dosis durante la intervención; t-PA: activador tisular del plasminógeno.
Concentraciones plasmáticas de AT de 100mg/l inhiben el 98-100% del t-PA. Concentraciones plasmáticas de AT de 10mg/l inhiben 80% del t-PA31,32.
A nivel clínico es suficiente un 80% de la inhibición de la actividad de t-PA, es decir, serían suficientes concentraciones plasmáticas de AT de 10-15mg/l para el control de la fibrinólisis34,36, y estas concentraciones se consiguen con dosis bajas de AT. La administración de dosis altas de AT, por ejemplo la dosis empleada en el estudio BART, para conseguir una inhibición de la fibrinólisis del 100%, no ha demostrado una disminución de las necesidades de transfusión y sí un incremento en la aparición de efectos secundarios, fundamentalmente convulsiones. Esto ha hecho que en los 2 últimos años muchos autores aconsejen las dosificaciones más bajas posibles para evitar la aparición de convulsiones20,37,38. El AT se elimina por el riñón y la administración de dosis altas podría producir su acumulación sobre todo en pacientes con disfunción renal. Los pacientes con alto riesgo de sangrado en CC tienen una alta prevalencia de disfunción renal preoperatoria que se puede agravar en el postoperatorio35. Las dosis altas de AT favorecerían la aparición de convulsiones en estos pacientes.
¿Existe una dosis ideal de ácido tranexámico en cirugía cardiaca?Aunque la dosis óptima de AT permanece en debate, la dosificación utilizada en BART se ha hecho muy popular35, y en el estudio CONSERV-239 utilizando las dosis de BART y comparando con dosis más bajas de AT se describe que la mortalidad, el sangrado y la aparición de convulsiones fue mayor en los pacientes que recibieron dosis bajas de AT. Este estudio fue diseñado solo para pacientes con alto riesgo de sangrado y la administración de AT se hacía después de la heparinización. Estos buenos resultados no son la norma cuando se utilizan las dosis del estudio BART.
Existe por tanto una enorme controversia sobre la dosificación óptima de AT. Tanto en artículos que comparan los resultados de la administración de dosis bajas versus dosis altas de AT33,40 como en metaanálisis que estratifican grupos con dosis altas o dosis bajas de AT17 se observa que no existen diferencias significativas en cuanto al sangrado postoperatorio. En otros trabajos sí que parece apreciarse una disminución del sangrado39,41. Esto puede deberse a que existe una gran variabilidad en la activación del sistema fibrinolítico durante la CEC; así, un tercio de los pacientes no tienen cambios en la actividad fibrinolítica, mientras que otros tienen una importante activación en este periodo42. La utilización de dosificaciones más bajas proporciona buenos resultados: por ejemplo, Fox43 utiliza 5,4mg/kg de dosis de carga de AT, seguida de 5mg/kg/h y añadiendo 20mg por litro de cebado de CEC; esta dosificación está basada en un trabajo de Fiechtner et al.34. Con estas dosis no hay convulsiones y además se aprecia una adecuada actividad antifibrinolítica medida por tromboelastografía. Utilizando 10mg/kg como dosis de carga seguida de una perfusión de 1mg/kg/h se observa cómo los niveles de dímero D disminuyen al compararlos con pacientes a los que no se les había administrado AT y se produce un ahorro de sangre de 300ml37. En cualquier caso, la administración de una simple dosis de AT después de la inducción de la anestesia y la aplicación tópica de una dosis de AT antes del cierre demostraron que son efectivos para reducir el sangrado postoperatorio y los requerimientos transfusionales en estudios con suficiente poder estadístico44.
Efectos adversos del ácido tranexámicoEl AT ha sido un fármaco conocido por su seguridad y con unos efectos secundarios prácticamente anecdóticos hasta el año 200845 en el que comenzó a relacionarse la presencia de convulsiones con la utilización de AT y que coincidió con la publicación del estudio BART y el cese del empleo de aprotinina en CC. La incidencia de convulsiones en CC oscila entre el 0,4-0,5%46,47, aunque es mucho mayor en pacientes de CC con apertura de cavidades. Diversas investigaciones han demostrado un importante incremento en la aparición de convulsiones en pacientes que recibieron AT, alcanzando cifras del 2,7-7,6%25,26,48,49.
Los mecanismos de las convulsiones en relación con el AT son multifactoriales. El AT cruza la barrera hematoencefálica cuando esta está comprometida, uniéndose de forma competitiva dosis dependiente a los receptores tipo A del ácido gamma aminobutírico con lo que se produce una disminución de la actividad inhibitoria y un incremento de la excitación neuronal50. Cambios producidos en la barrera hematoencefálica por la isquemia, proteínas o mediadores inflamatorios pueden incrementar la permeabilidad para el AT y la concentración cerebral tóxica del mismo. El embolismo aéreo difuso en CC de cavidades abiertas y un incremento de la respuesta inflamatoria sistémica secundaria a tiempos de CEC prolongados así como alteraciones electrolíticas en pacientes con alteraciones renales pueden causar alteraciones de la barrera hematoencefálica19. También podría contribuir a la aparición de convulsiones el empleo de cefalosporinas que tienen un conocido potencial epileptógeno y se utilizan en la profilaxis de las infecciones en CC51.
Las convulsiones aparecen en las 6 primeras horas, son de tipo «grand mal» y su aparición se explicaría por una alta concentración de AT combinado con la retirada de la sedación37. Posiblemente la incidencia de convulsiones esté infraestimada ya que en el postoperatorio inmediato muchos pacientes están sedados52.
La dosis de AT parece tener relación con la aparición de convulsiones, incluso el uso de dosis bajas de AT resulta en la aparición de convulsiones pero con un rango 10 veces menor que con dosis altas53. Por ejemplo, en cirugía de aorta torácica con CEC, la administración de AT a dosis de 10mg/kg seguida de una perfusión de 1mg/kg/h demuestra un incremento en la aparición de convulsiones54; y lo mismo ocurre cuando se administran dosis moderadas, así una dosis total de 24mg/kg produce una incidencia de convulsiones de un 2,5%, 2 veces más alta que la del grupo de referencia al que no se le había administrado AT19.
Diversos autores ven un incremento de la incidencia de convulsiones utilizando dosis altas de AT38: el régimen de BART produce un incremento de la incidencia de convulsiones 8 veces mayor que la que producirían dosis muchos más bajas (1-2g)37. Manji et al.37, que antes del estudio BART utilizaban dosis de 1-2g de AT, al utilizar la dosificación BART observaron un incremento en la aparición de convulsiones 8 veces superior con una incidencia de 0-0,03% hasta un 1,8%. Por ello, estos autores abandonaron esta dosificación y empezaron a utilizar una dosis baja de AT establecida por Dowd30 (12,5mg/kg como dosis de carga más 6,5mg/kg/h, añadiendo a CEC 1mg/kg), viendo una reducción de las convulsiones del 1,8% al 0,8%, y comprobando en un modelo multivariante que la reducción de las convulsiones está directamente relacionada con la disminución de la dosis de AT y no con otros factores.
En un reciente artículo se comparan 2 dosis de AT, una dosis baja y una dosis alta que se corresponde con la dosificación del estudio BART, y se observa que aunque las dosis altas no reducen la cantidad total de sangre transfundida (aunque sí la de plasma, plaquetas, pérdidas sanguíneas y reintervenciones por sangrado) sí se ve un incremento en la incidencia de convulsiones del 1,8% frente al 1,1% de los pacientes con dosis bajas41.
Aún más inquietante es la relación entre la aparición de convulsiones en el postoperatorio de CC y el incremento de la mortalidad. La mortalidad es mucho más alta en pacientes que tuvieron convulsiones19. Además la aparición de convulsiones después de CC son un predictor de déficit neurológico permanente, de mortalidad52 y de mayor estancia en UCI que se asocia también a una mayor tendencia a la mortalidad, sobre todo en pacientes con insuficiencia renal38.
ConclusionesLa aparición de convulsiones está relacionada con la dosis de AT administrada. Esto pone de relieve la necesidad de usar las dosis más bajas posibles de AT necesarias para alcanzar concentraciones plasmáticas terapéuticas para inhibir la fibrinólisis (por ejemplo 10mg/l) lo cual minimizaría la exposición del sistema nervioso al AT y por tanto reduciría el riesgo de convulsiones44. El AT ha demostrado que es efectivo a dosis bajas y la disponibilidad actual de equipos de análisis de la coagulación a la cabecera del paciente como la tromboelastografía permitirían utilizar regímenes de administración a dosis bajas y orientar la terapia si aparece sangrado55. Nuestro grupo de trabajo utiliza una dosificación modificada del régimen de Horrow et al33 consistente en administrar una dosis de carga de AT de 10mg/kg, seguida de una perfusión continua de 2mg/kg/h y añadiendo al circuito de CEC 50mg56; con esto la incidencia de convulsiones es inferior al 0,8%.
Por tanto, se debería ser prudente a la hora de utilizar regímenes con dosis elevadas de AT hasta que se disponga de ensayos prospectivos aleatorizados y controlados que de forma definitiva demuestren la seguridad del AT a estas dosis y logren encontrar la dosis mínima eficaz con menores efectos adversos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.