Presentar la experiencia inicial del abordaje toracoscópico unilateral como técnica para la ablación de la fibrilación auricular (FA) aislada.
Material y métodos.Entre abril y octubre de 2007, en cinco pacientes con FA aislada sintomática se realizó un procedimiento quirúrgico de ablación mediante toracoscopia derecha, consistente en un patrón de aislamiento eléctrico epicárdico circunferencial alrededor de las cuatro venas pulmonares (VP) con un dispositivo de ablación por microondas flexible.
ResultadosLa mortalidad en el perioperatorio fue nula y la estancia hospitalaria media de 4 días. Un paciente requirió conversión in situ a miniesternotomía. El aislamiento eléctrico de las VP, comprobado intraoperatoriamente, fue efectivo en tres casos. Al final del seguimiento, en mayo de 2008, en tres pacientes había recidivado la FA clínica.
ConclusionesLa técnica de la ablación de la FA por toracoscopia unilateral es reproducible y tiene una baja morbilidad. La tecnología empleada, única para este tipo de abordajes unilaterales, no ha ofrecido la efectividad esperada. Hemos abandonado el procedimiento en espera de nuevos medios tecnológicos.
To present the initial experience with thoracoscopic approach as a treatment option for lone atrial fibrillation (AF).
MethodsBetween April and October 2007, five patients with symptomatic lone AF underwent a surgical ablation procedure through right thoracoscopic approach, consisting in a circunferential epicardial electric isolation pattern of the four pulmonary veins with a flexible microwave ablation device.
ResultsThere were no hospital deaths and the average hospital stay was 4 days. In one patient an in situ conversion to mini-sternotomy was needed. At the end of the follow-up, three patients were again in AF.
ConclusionsThe thoracoscopic ablation surgery is reproducible and has a low morbidity rate. The technology used, unique for this kind of unilateral approaches, did not show the expected effectiveness. We have abandoned this procedure waiting for new technical means.
La FA es la arritmia clínica más frecuente, considerada en la actualidad como un factor de riesgo cardiovascular independiente predictor de mortalidad1. Su prevalencia se sitúa en torno al 6% en población mayor de 65 años y constituye la causa más frecuente de ictus en el anciano. El tratamiento quirúrgico de la FA asociada a enfermedad coronaria o valvular mediante las técnicas descritas por Cox ha sido ampliamente desarrollado, y hoy en día es una técnica habitual en muchos centros2. Sin embargo, un 30% de los pacientes con FA carecen de otra enfermedad cardíaca evidenciable clínica o ecocardiográfica, aplicándose en estos casos el término FA aislada3. Pese a que estos enfermos presentan un buen pronóstico en relación con eventos tromboembólicos y mortalidad, éste empeora con la edad o el desarrollo de otras comorbilidades cardiovasculares4,5.
La ablación quirúrgica está reconocida como el tratamiento más efectivo para la eliminación de la FA. La aceptación de esta técnica en pacientes con FA aislada no ha sido universal debido a la naturaleza invasiva de la misma. En muchos centros la ablación percutánea con catéter se sitúa como opción preferida, aunque tal evidencia no está contrastada científicamente.
En los últimos años han sido desarrolladas diversas técnicas quirúrgicas de mínimo acceso para ablación epicárdica. Una opción es el aislamiento circunferencial conjunto de las VP, creando una lesión de aislamiento eléctrico con microondas empleando una sonda de ablación flexible, técnica descrita por La Meir, et al.6. Presentamos una reducida serie con nuestra experiencia inicial en esta técnica.
Material y métodosEntre abril y octubre de 2007, cinco pacientes con FA aislada sintomática y ablación percutánea inefectiva previa fueron intervenidos por toracoscopia unilateral para realizar un patrón de aislamiento circunferencial alrededor de las cuatro VP (box-lesion). Dado que se trata de un procedimiento novedoso, se solicitó aprobación al Comité de Ética del Instituto Cardiovascular de nuestro centro y se solicitó la autorización mediante consentimiento informado en cada uno de los pacientes. Se establecieron como criterios de inclusión la presencia de FA aislada sintomática refractaria al tratamiento médico convencional, independientemente de su condición de permanente o paroxística, y la ausencia de cualquier otra enfermedad cardíaca susceptible de tratamiento quirúrgico. Los criterios de exclusión fueron: la presencia de trombos en la orejuela de la aurícula izquierda diagnosticados mediante ecocardiografía; antecedentes de cirugía cardíaca previa, o cualquier otra intervención que condicionara la presencia de adherencias pleurales o pericárdicas que imposibilitaran la técnica.
En total, se incluyó a cuatro hombres y una mujer con edades comprendidas entre 42-56 años. Dos pacientes fueron catalogados como FA permanente y tres como paroxística, todos ellos en régimen de anticoagulación oral previa. En todos los casos se comprobó durante la intervención el aislamiento eléctrico de las VP. El análisis del ritmo cardíaco se efectuó al final de la misma, antes del alta hospitalaria y periódicamente durante el seguimiento.
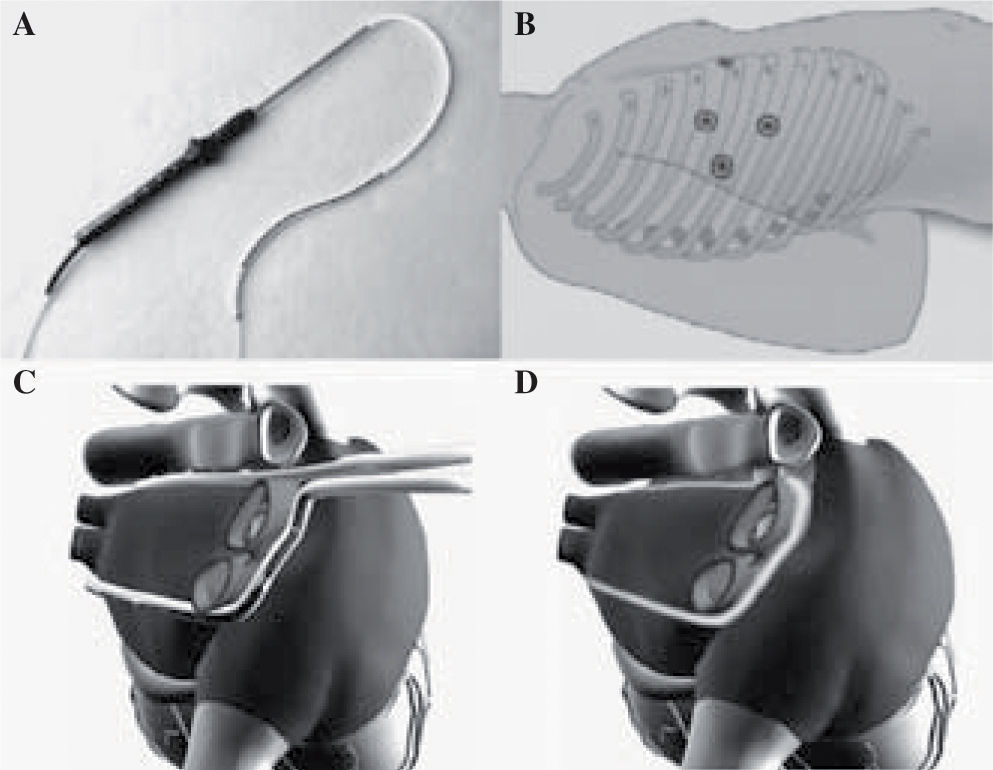
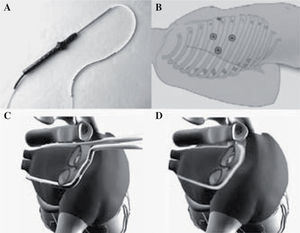
Dispositivo de ablaciónLa ablación se realizó con la sonda de microondas Flex 10® (Guidant Cardiac Surgery, Santa Clara, CA, USA), que muestra la figura 1A. Sonda de gran longitud y pequeño diámetro que permite ser introducida por un puerto toracoscópico y con flexibilidad para rodear conjuntamente todas las VP.
A: sonda de microondas Flex 10®. B: ubicación de los tres puertos torácicos derechos para la introducción de instrumentos, óptica, pinzas, disectores, etc. C: esquema de la aurícula izquierda con sus VP donde se puede apreciar como la sonda abraza para su ablación y aislamiento eléctrico. D: representación del patrón de lesión, box-lesion.
El paciente se colocó en decúbito supino con una rotación de 30° hacia la izquierda. Se requirió intubación selectiva, así como insuflación de CO2 a través de uno de los puertos para colapsar el pulmón derecho. El acceso a la cavidad torácica se estableció mediante tres puertos de 12mm en el hemitórax derecho. Quinto espacio intercostal, línea axilar media, para la óptica-cámara, y en los espacios intercostales cuarto y sexto, línea axilar anterior, como puertos de trabajo (Fig. 1 B). El pericardio se abrió longitudinalmente entre las venas cavas superior e inferior por encima del nervio frénico, y se retrajo mediante dos suturas en su porción más posterior para facilitar la exposición de las VP. Para la disección del pericardio se usó un disector recto de punta roma y un retractor endoscópico convencional, con los que se accedió a los senos transverso y oblicuo tras disecar las reflexiones pericárdicas de las cavas superior e inferior, respectivamente.
A continuación se posicionó el Flex 10® abrazando las cuatro VP con la ayuda de una guía metálica (Figs. 1 C y D). Ésta se introdujo previamente a través del seno oblicuo, rodeando las VP izquierdas hasta la orejuela de la aurícula izquierda y el seno transverso, lo que facilita el paso del Flex 10® al retirar la guía en sentido inverso. Es necesario asegurarse de que el dispositivo queda por debajo de la orejuela izquierda, abrazando las VP, para no lesionar la arteria circunfleja durante la ablación.
El Flex 10® permite realizar ablaciones secuenciales por tramos a lo largo de toda su longitud. Éstas se realizaron en dos ciclos de ablación con una potencia entre 65-75W durante 120s en cada tramo. El aislamiento eléctrico de las VP se comprobó al finalizar la ablación. Para ello, se recuperó el ritmo sinusal tras cardioversión eléctrica, y se aplicó dentro del área aislada una estimulación a frecuencia 1,5 veces superior a la basal, con un impulso eléctrico de 2ms y 10V. En caso de captura auricular se aplicó un nuevo ciclo de ablación. En ningún caso se procedió a la exclusión del apéndice auricular izquierdo, al resultar imposible mediante un abordaje unilateral derecho y con la sonda utilizada.
SeguimientoLa profilaxis antiarrítmica y la terapia anticoagulante oral se iniciaron el primer día del postoperatorio, incluyendo un mínimo de 3 meses de terapia, a valorar a partir de entonces su discontinuidad en función del análisis del ritmo cardíaco (mediante ECG-Holter) y de las características clínicas y ecocardiográficas de cada paciente. Se utilizó amiodarona como antiarrítmico de elección y, como alternativa, sotalol. Durante el seguimiento se aplicó similar protocolo que en la cirugía de la FA7. La primera visita ambulatoria se realizó entre el segundo y el tercer mes tras el alta hospitalaria, y las sucesivas cada 3 meses a partir de entonces.
ResultadosMortalidad hospitalaria nula. Todos fueron extubados durante las primeras 3h. La estancia hospitalaria media fue de 4 días. Ningún paciente necesitó transfusión de hemoderivados. No se documentó ninguna complicación medicoquirúrgica hospitalaria.
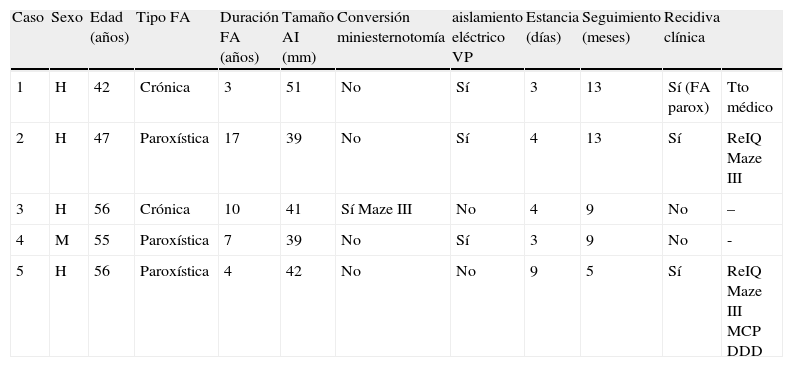
En un caso se produjo una perforación puntiforme en la cara inferior de la vena cava inferior que imposibilitó la visión del proceso, optando por la conversión a miniesternotomía media inferior en «J» invertida derecha, y, en consecuencia, se realizó un patrón de lesiones Maze III epicárdico con la misma sonda. El aislamiento eléctrico de las VP sólo fue efectivo en tres casos (Tabla I). Los cinco pacientes se encontraban en ritmo sinusal al finalizar la intervención. Un enfermo (caso 5) requirió la implantación de un marcapasos definitivo DDD por disfunción sinusal sintomática durante el postoperatorio hospitalario.
Características de los pacientes
| Caso | Sexo | Edad (años) | Tipo FA | Duración FA (años) | Tamaño AI (mm) | Conversión miniesternotomía | aislamiento eléctrico VP | Estancia (días) | Seguimiento (meses) | Recidiva clínica | |
| 1 | H | 42 | Crónica | 3 | 51 | No | Sí | 3 | 13 | Sí (FA parox) | Tto médico |
| 2 | H | 47 | Paroxística | 17 | 39 | No | Sí | 4 | 13 | Sí | ReIQ Maze III |
| 3 | H | 56 | Crónica | 10 | 41 | Sí Maze III | No | 4 | 9 | No | – |
| 4 | M | 55 | Paroxística | 7 | 39 | No | Sí | 3 | 9 | No | - |
| 5 | H | 56 | Paroxística | 4 | 42 | No | No | 9 | 5 | Sí | ReIQ Maze III MCP DDD |
H: hombre; M: mujer; AI: aurícula izquierda; VP: venas pulmonares; ReIQ: reintervención; MCP: marcapasos; parox: paroxística.
Durante el seguimiento clínico, máximo de 13 meses, en tres de los cuatro pacientes con ablación circunferencial de las VP recidivó la FA clínica (Tabla I). Uno de ellos pasó a tener episodios oligosintomáticos de FA paroxística, fue controlado con medicación oral y, por criterio de edad, sin anticoagulación; y los otros dos continuaron con episodios frecuentes sintomáticos de FA paroxística pese a dos intentos de cardioversión eléctrica cada uno de ellos, realizados entre el segundo y el tercer mes postoperatorio. Por este motivo, se indicó una nueva cirugía de ablación Maze III por miniesternotomía media con resultado satisfactorio, recuperando el ritmo sinusal en ambos casos.
El caso 3, convertido durante la intervención (y recibiendo un patrón de ablación Maze III), recuperó el ritmo sinusal, manteniéndolo tras 9 meses de seguimiento libre de medicación antiarrítmica y sin anticoagulación oral. La única paciente con patrón de ablación circunferencial de las VP efectivo (caso 4) tiene estudio ECG-Holter de 24h sin episodios de FA y se encuentra en la actualidad libre de tratamiento médico, sin antiarrítmicos ni anticoagulación oral, tras 9 meses de seguimiento.
DiscusiónEl actual tratamiento ablativo de la FA aislada contempla dos vertientes, el percutáneo con catéter y la cirugía. Dependiendo de la experiencia de los equipos, la efectividad es variable y sus complicaciones diversas. Una de las mayores ventajas de la cirugía es su efectividad, el mayor control anatómico de las lesiones, la rapidez de los procedimientos y su inocuidad en términos de radiación. En contra se le atribuye como proceso quirúrgico una supuesta mayor morbilidad respecto al acceso percutáneo, aunque las complicaciones descritas con el catéter siguen siendo mayores y más frecuentes, de un 6%8,9.
Ya que en el tratamiento de la FA la cirugía tiene menos complicaciones y mayor efectividad, tan sólo es necesario que nuestro abordaje quirúrgico tenga una mínima invasión y en lo posible similar al abordaje percutáneo. La ablación quirúrgica toracoscópica unilateral puede representar un patrón referencia en invasión. En nuestra escasa experiencia, este abordaje representa un procedimiento de mínima morbilidad que ofrece una aproximación anatómica adecuada y suficiente para acceder al aislamiento eléctrico de las VP, aunque requiere un proceso de aprendizaje previo como cualquier otra técnica quirúrgica. Sin embargo, nuestros resultados no han alcanzado la efectividad deseable, razón por la que actualmente ya no realizamos este procedimiento. Creemos que existen tres razones que pueden explicar estos resultados, dos de los cuales son también motivo de controversia entre otros grupos quirúrgicos, como el tipo de fuente de energía y el patrón de lesiones óptimo en el tratamiento quirúrgico de la FA aislada.
Las ablaciones epicárdicas con fuentes de energía unipolar, tanto en frío como con calor, presentan dificultades in vivo para crear lesiones transmurales, debido al efecto barrera de la grasa epicárdica y la refrigeración de la sangre circulante. La fuente de energía de las microondas ha demostrado efectividad en nuestra propia experiencia y entre diversos autores cuando es aplicada por vía endocavitaria bajo circulación de extracorpórea con corazón exangüe. Sin embargo la aplicación epicárdica puede no alcanzar transmuralidad en las lesiones tal como han señalado algunos autores. Éste ha sido, a nuestro entender, uno de nuestros errores, el supeditar la ergonomía del sistema (flexibilidad para rodear las VP desde un solo flanco torácico) a la efectividad supuesta en transmuralidad.
Un segundo error, a nuestro entender, es el tipo de patrón de lesión. La sonda Flex 10® ha sido la única del mercado (en la actualidad ya no está comercializada), por el momento, que permite el acceso unilateral para la exclusión conjunta de las VP. Sin embargo, esta sonda no permite realizar otras lesiones ni acceder al tratamiento (exclusión) del apéndice auricular izquierdo. Es ya conocido y publicado en diversos metaanálisis la efectividad de los diversos patrones según el tipo de FA. En la paroxística y persistente es probable que la exclusión de las VP sea suficiente para alcanzar efectividad del 90%. Sin embargo, en la FA permanente, el patrón con mejores resultados es el Maze III biauricular10. No debemos caer en la tentación, como hemos comprobado en esta pequeña serie, de minimizar el patrón de lesiones en la FA permanente, pues con el aislamiento exclusivo de las VP los resultados apenas alcanzan el 60%11. Estos resultados están en desacuerdo y no coinciden con lo publicado en series de ablación con catéter, aunque hay que recordar que durante los procedimientos en electrofisiología la metodología de trabajo es diferente, es decir, se analizan los mecanismos de la FA (focos o reentradas) y se prueba de forma constante y sistemática las lesiones de ablación. Esta metodología no es procedimiento habitual en cirugía, y aunque se comprueba durante la intervención el aislamiento en agudo de las VP, no es de por sí un método fiable, como hemos podido comprobar en este estudio y otros autores han documentado.
Y, finalmente, en tercer lugar, la inexperiencia del grupo con una técnica inicial. Es más que probable que el procedimiento no se haya realizado de forma efectiva y gran parte del problema resida en la técnica del cirujano. No obstante, dos de los casos inefectivos se realizaron bajo la supervisión de un compañero cirujano experto. La Meir, et al. publican con esta técnica un 100% de efectividad en la FA paroxística, y del 60% en la permanente, tras 4 meses de seguimiento6. En nuestro estudio el protocolo de seguimiento es diferente y el tiempo de seguimiento algo superior, de 13 meses.
En conclusión, el abordaje quirúrgico videoasistido por toracoscopia unilateral es una técnica con baja morbilidad. La técnica unilateral toracoscópica requiere un aprendizaje previo. Y la efectividad del procedimiento con la tecnología utilizada no ha sido el esperado, muy probablemente por la baja transmuralidad alcanzada con el tipo de sonda empleado. Quizás nuevos desarrollos tecnológicos en sondas quirúrgicas de ablación permitan alcanzar una mayor efectividad con esta técnica.