Durante los últimos años, los avances alcanzados en resonancia magnética cardiaca (RMC) han propiciado una mejora significativa en el campo de las cardiopatías congénitas y han permitido reemplazar tanto al cateterismo diagnóstico invasivo como a la tomografía computarizada en gran número de indicaciones. Las ventajas de la RMC se resumen en su capacidad para obtener datos en 3 dimensiones, el no estar limitada por ventanas acústicas como la ecocardiografía y la ausencia de emisión de radiaciones ionizantes como el cateterismo cardiaco o la tomografía axial computarizada. Según las últimas guías de práctica clínica1, la RMC constituye una de las técnicas de elección para la evaluación de cardiopatías complejas, ventrículo derecho, anomalías de la aorta torácica, cuantificación de shunts cardiovasculares, evaluación de shunts, patología univentricular, malformaciones coronarias2, tumores cardiacos y cardiomiopatías, entre otras indicaciones. Dichas indicaciones quedan recogidas en uno de los más recientes artículos de revisión publicados por miembros de nuestro grupo, al cual remitimos3. Sin embargo, a pesar de dichos avances, la esperanza de vida de los pacientes con cardiopatías congénitas sigue siendo reducida en comparación con la población normal. Es por ello que la RMC precisaría de un nuevo impulso si se pretende que sea una herramienta útil para identificar precozmente los procesos patológicos antes de que se hayan instaurado. Las directrices de la investigación en imagen deben tener por objetivo la visualización y la detección temprana de los cambios metabólicos y celulares que se producen en los estadios iniciales de la enfermedad y que nos permitan redefinir nuestros criterios de actuación terapéutica. Esta ambiciosa y desafiante tarea solo puede ser lograda mediante la cooperación y el abordaje multidisciplinar entre cardiólogos infantiles, radiólogos, bioingenieros y biólogos, sin olvidar la necesaria implicación de la industria que favorezca el desarrollo de nuevas secuencias y dispositivos adaptados a la población pediátrica. Este artículo editorial versa sobre las nuevas secuencias de RMC y sobre cómo las nuevas líneas de investigación y cooperación multidisciplinar se están trasladando, ya en la actualidad, a la práctica clínica.
La forma se adapta a la funciónLa adaptación de las células musculares cardiacas es un proceso secuencial y complejo. Tal capacidad de respuesta dinámica ante procesos patológicos de mayor demanda funcional ocurre por ejemplo en la insuficiencia cardiaca, donde complejos mecanismos cardiacos de interacción molecular, neurohormonal y celular modulan la interacción entre ambos ventrículos. Es por ello que la identificación temprana de pacientes con riesgo de desarrollar insuficiencia cardiaca, los cuales se podrían beneficiar de tratamiento precoz, sería de incalculable valor considerando que más de la mitad de las muertes por insuficiencia cardiaca producidas en niños se deben a cardiopatías congénitas.
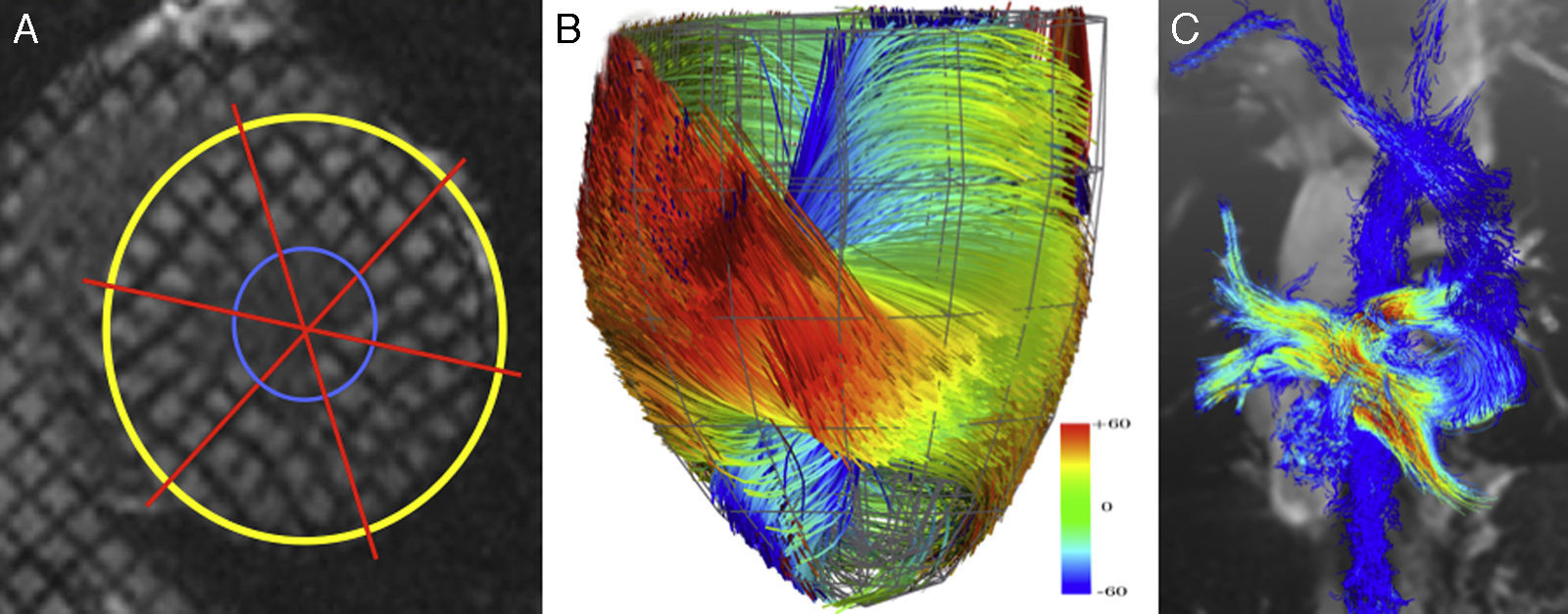
Los parámetros y las escalas actuales de estratificación de riesgo se basan en la valoración de la contractilidad global miocárdica por técnicas de imagen convencional como la ecocardiografía o la RMC. Sin embargo, dichas técnicas rutinarias son incapaces de detectar reducciones en la contractilidad regional y, por tanto, pueden pasar por alto la presencia de patología subyacente. En este campo, la cuantificación detallada de la contractilidad regional mediante parámetros como strain, strain-rate y torsión se presentan como una técnica muy prometedora para la mejora en la identificación temprana de individuos en riesgo de fallo cardiaco. El tagging miocárdico (myocardial tagging) se basa en la creación no invasiva de finas perturbaciones ortogonales en varios planos del campo magnético con el fin de obtener una malla de marcadores (tags), como se muestra en la figura 1A. Tradicionalmente, el tagging miocárdico se reconstruía mediante adquisiciones de varios planos en 2D, pero hoy en día es posible la adquisición de un verdadero volumen en 3D y, por tanto, la evaluación auténtica de la deformación cardiaca mediante técnicas de post-procesado avanzadas4. El tagging mediante RMC ha demostrado ser una herramienta útil para la detección de disfunción miocárdica precoz en pacientes con miocardiopatías que de otra forma hubiesen pasado inadvertidas mediante las técnicas de imagen convencional. En los pacientes con distrofia muscular de Duchenne se evidenció que, a pesar de mantener fracción de eyección global y volúmenes de ventrículo izquierdo normales, el tagging miocárdico demostraba una reducción significativa en la deformación (strain) de los segmentos basales y medio al ser comparados con controles sanos5. Poco a poco estamos comenzando a utilizar el tagging miocárdico en pacientes con cardiopatías congénitas, pero es evidente que aún son necesarias mejoras técnicas adicionales para aumentar tanto la resolución espacial como la temporal, particularmente para extender también la evaluación al ventrículo derecho. En comparación con otras técnicas, la ecocardiografía speckle tracking posee mayor disponibilidad a pie de cama del paciente, menor coste y mejor resolución temporal que el tagging RMC (<4 vs. 15-20ms/frame)6. Esta limitación en la resolución temporal puede resultar insuficiente para evaluar la fase diastólica de llenado rápido, y por tanto puede resultar ineficaz para detectar disfunción diastólica. Sin embargo, y pese a dichas limitaciones, el tagging miocárdico podría ser considerado una de las herramientas diagnósticas de mayor calidad para la cuantificación de la contractilidad regional cardiaca debido a su solidez, independientemente del sistema o equipo utilizado, su reproducibilidad interobservador y los estudios de validación publicados7. En resumen, aún existe poca bibliografía de estudios en pacientes con cardiopatías congénitas, y el tagging miocárdico permanece más como una herramienta de investigación que como una técnica de aplicación clínica. Futuras mejoras en la técnica de adquisición y análisis ayudarán con certeza a su incorporación en la práctica clínica y a la detección precoz y el manejo de pacientes con insuficiencia cardiaca.
A)Tagging miocárdico en el ventrículo izquierdo, vista del eje corto. B)La tractografía mediante diffusion tensor imaging (DTI) muestra las fibras miocárdicas del ventrículo izquierdo; vista inferior. Cortesía de Nicolas Toussaint. C)4D-flow en las venas pulmonares y aorta de un paciente con cirugía paliativa de Fontan.
Dentro del campo de la morfología y de la función cardiaca, otras líneas de investigación de imagen tratan de cuantificar la función cardiaca a niveles estructurales más profundos aún. Desde largo tiempo atrás es conocido que la estructura de las fibras miocárdicas juega un papel determinante en la propagación del impulso eléctrico y la fisiología de la contractilidad cardiaca. La conducción del impulso eléctrico es 3 veces más rápida en la dirección de las fibras miocárdicas y, por tanto, el remodelado de la geometría ventricular y de la orientación de sus fibras puede ser determinante en la inducción de arritmias y fallo ventricular. En esta línea cabe destacar el interés que ha despertado la técnica de tensores de difusión de RMC (diffusion tensor imaging, DTI). El DTI se basa en la teoría de la difusión caótica preferencial de las moléculas de agua en los tejidos. Dentro de su movimiento anárquico y al azar, las moléculas de agua difunden de forma más rápida en la dirección en la que están orientadas las fibras miocárdicas. La velocidad de difusión de las moléculas de agua, y más específicamente de sus núcleos de hidrógeno, puede ser cuantificada mediante RMC para reconstruir un modelo tridimensional que muestre las conexiones microscópicas entre las células miocárdicas (fig. 1B). Aunque desafortunadamente aún queda un gran camino por recorrer, se están dando los primeros pasos para trasladar esta aplicación a la práctica clínica. Recientemente Toussaint et al. han demostrado que la determinación in vivo en 3D de la estructura miocárdica específica de cada paciente es posible mediante la mejora de la secuencia de adquisición y los algoritmos matemáticos de reconstrucción8. Esta técnica de RMC tiene el potencial de desvelar la orientación microscópica de las fibras miocárdicas en ambos ventrículos y su interacción. Se abre por tanto una puerta al conocimiento para la evaluación del ventrículo derecho en patologías como la tetralogía de Fallot o hipoplasia de cavidades izquierdas.
La cardiología es flujoA pesar de que las técnicas de imagen actuales permiten una descripción anatómica completa y detallada, nuestra comprensión de los patrones de flujo vascular queda limitada a una (ecocardiografía M-doppler) o a 2 dimensiones del espacio (2D-doppler o secuencia RMC 2D contraste de fase). Dicha reflexión queda recogida en el exquisito y elegante editorial publicado por Richtter et al. en Circulation («Cardiology is about flow», 2006): «Nuestro conocimiento de la mecánica de flujo sanguíneo, su relación con la morfología y su efecto sobre el remodelado vascular está aún lejos de ser comprendido y por tanto somos incapaces de predecir las complicaciones tardías que de forma casi invariable se producen en pacientes con cardiopatías congénitas»9.
En este contexto la secuencia de RMC de contraste de fase en 4 dimensiones (4D-flow) presenta varias ventajas sobre las técnicas convencionales. Esta novedosa secuencia permite la evaluación del flujo sanguíneo en las 3 direcciones del espacio a lo largo del tiempo (fig. 1C). Comparado con la secuencia tradicional de RMC de contraste de fase en 2D que está limitada a la perfecta alineación ortogonal del plano de investigación con la dirección del flujo, la técnica 4D-flow permite una mayor precisión para la cuantificación del flujo independientemente del ángulo de investigación incluso en la presencia de jets turbulentos. Es más, en aquellas patologías en las que se precisa la cuantificación de flujo en varios vasos, como por ejemplo en pacientes con cirugía de paliación en fisiología univentricular, una única adquisición de 4D-flow resulta temporalmente más eficiente que varias adquisiciones 2D-flow10. Otras ventajas incluyen la cuantificación retrospectiva de flujo en las estructuras de hallazgo inesperado durante el post-procesado y que, por tanto, no fueron analizadas durante la adquisición de RMC. Ello es posible al poder analizar cualquier estructura contenida en el volumen 3D adquirido. Pero las ventajas del 4D-flow van más allá de las aplicaciones clínicas rutinarias de cuantificación de flujo en los vasos sanguíneos. Las nuevas áreas de investigación incluyen el análisis de la turbulencia del flujo y su efecto en el remodelado vascular, la evaluación del patrón de flujo intraventricular basado en el análisis de partículas de flujo o la estimación de gradientes de presión asociados a los cambios de momento en las partículas, entre otras muchas áreas11. El potencial que brinda el análisis de 4D-flow para detectar patrones de flujo alterados, así como para incorporar nuevas perspectivas y conocimiento que nos permitan comprender el rol de la dinámica de flujo en la iniciación y progresión de la patología, parece ilimitado. Gracias al desarrollo de nuevas técnicas de adquisición que permiten reducir el tiempo de estudio y mejorar la precisión del 4D-flow, dicha técnica se está aplicando ya en la clínica y creemos que su incorporación rutinaria será inmediata en un futuro muy próximo.
Predicción de la evolución específica en cada pacienteEl manejo clínico de los pacientes con cardiopatías congénitas se basa generalmente en nuestra propia experiencia, en el consenso con otros colegas o en guías de actuación fundamentadas en estudios poblacionales. Sin embargo, la decisión clínica y la expectativa de éxito de una intervención deben basarse en la predicción de cada paciente en particular más que en la estadística de otros pacientes con características similares.
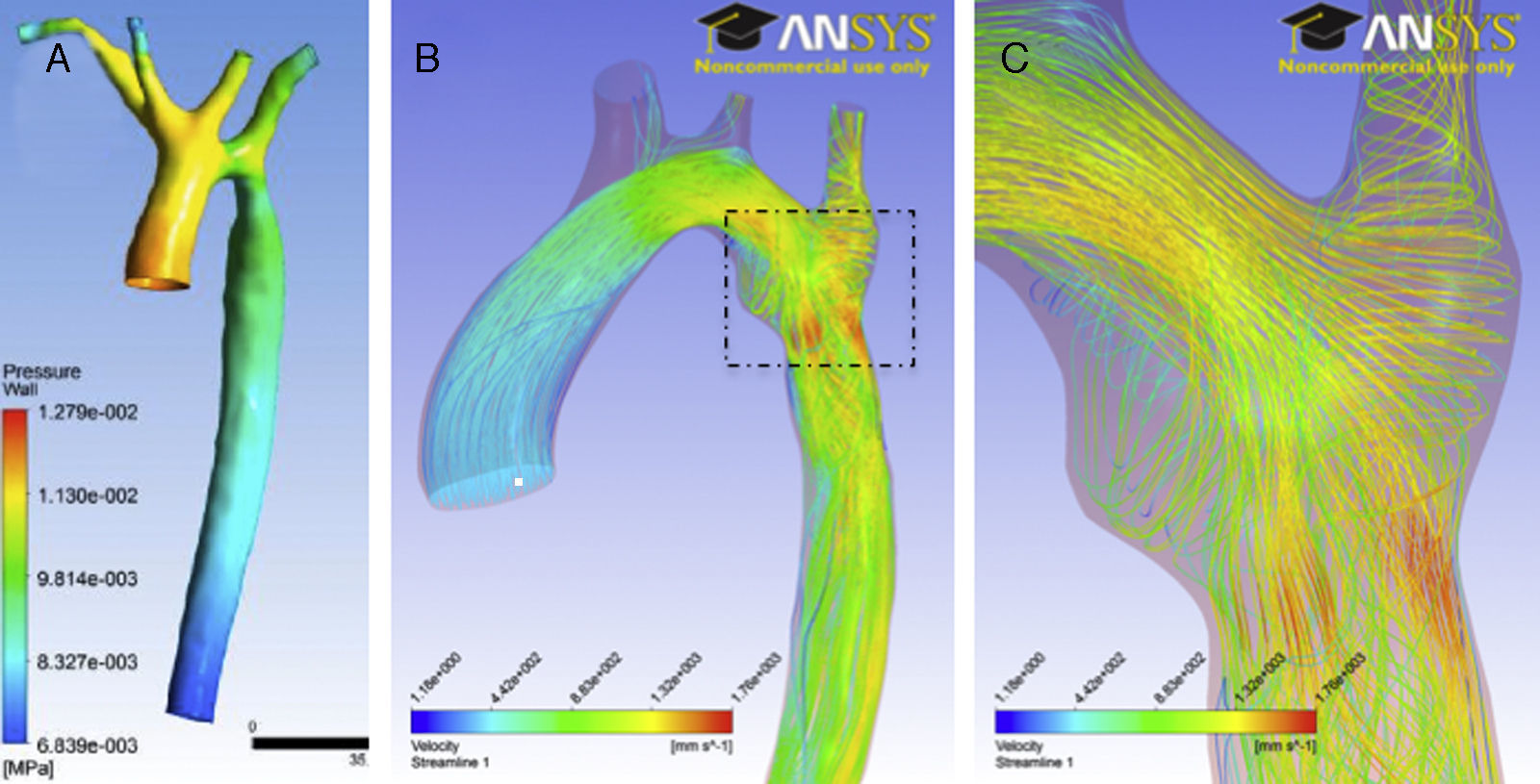
La mecánica de fluidos computacional se va a convertir en una herramienta fundamental en la predicción de la evolución y en la decisión clínica específica en pacientes con cardiopatías congénitas. Dicha rama de la mecánica de fluidos utiliza métodos numéricos y algoritmos para resolver problemas de fluidos utilizando herramientas informáticas para realizar los millones de cálculos necesarios para simular la interacción de los líquidos con los tejidos. Tradicionalmente, las simulaciones utilizaban modelos anatómicos generales basados en moldes cadavéricos. Sin embargo, gracias a la RMC es posible hoy en día definir la anatomía (geometría) y fisiología (flujo) de cada individuo y, por tanto, obtener predicciones específicas en cada paciente en particular (fig. 2). Por tanto, dichos modelos de simulación tienen el potencial de simular y predecir de forma no invasiva la hemodinámica individual de cada persona y ayudar en el manejo y seguimiento de los pacientes con cardiopatías congénitas. El potencial de incorporar los nuevos avances en mecánica de computación bio-sólido-fluidos y los nuevos conocimientos en biología de remodelado vascular para predecir la evolución fisiopatológica en la pared aórtica ha sido demostrado recientemente por Figueroa et al.12. Para ello evaluaron cómo el patrón de flujo afectaba al wall-shear stress tras la pérdida concéntrica de elastina en la pared vascular de las arterias basilares. En un intento brillante de comprender por primera vez la relación a largo plazo entre crecimiento y cinética de remodelado vascular simularon la evolución de la forma y de las propiedades tisulares en dichas arterias. Otras líneas de investigación se centran en otras patologías, como la circulación de Fontan o la predicción no invasiva de gradientes en la coartación de aorta desarrollada por miembros de nuestro grupo13. La predicción mediante simulación de las mejores opciones terapéuticas es otra área de investigación con gran potencial. Recientemente la mecánica de fluidos computacional ha sido usada para evaluar el éxito de reparación endovascular con stent en la coartación de aorta mediante la simulación y el análisis de diferentes tamaños de stent y evaluación de cómo afectaban al wall-shear stress14. Otros estudios han correlacionado el diseño del stent vascular y el desarrollo de hiperplasia de la íntima15 o la migración vascular del dispositivo16. Un paso más en las posibilidades de esta aplicación es el diseño de dispositivos específicos para las condiciones anatómicas de cada paciente, tales como stents, prótesis valvulares o injertos arteriales o venosos. Por otro lado, aún son necesarios estudios de validación a mayor escala, y sobre todo simulaciones más sencillas y más orientadas a la clínica.
Simulación mediante mecánica de fluidos computacional en un paciente con coartación de la aorta residual. La geometría de la aorta y el flujo específico a través de la válvula aórtica han sido adquiridos mediante resonancia magnética cardiaca. A)Mapa de presión en superficie de la aorta durante el momento sistólico de mayor gradiente a través de la coartación. B)La simulación de las líneas de flujo (streamlines) durante la sístole muestra las áreas con mayor velocidad y wall-shear stress en la región ístmica. C)Ampliación del área rectangular mostrada en B; nótese el patrón de turbulencia en la zona de la coartación residual.
Los nuevos avances en RMC son la llave para la investigación, el perfeccionamiento del diagnóstico y la mejora del tratamiento en todos los aspectos de las cardiopatías congénitas. La exploración de las nuevas fronteras del conocimiento de la dinámica de flujo, de la biomecánica y del remodelado cardiovascular nos permitirá anticiparnos a las adaptaciones fisiopatológicas y, por tanto, mejorar el seguimiento y el tratamiento de nuestros pacientes. Sin embargo, para que dichos cambios se produzcan y se incorporen a nuestra práctica clínica habitual, la industria y los centros de investigación deben trabajar de forma multidisciplinar con la comunidad médica para así poder aportar soluciones específicas para este importante y prevalente conjunto de pacientes.
Conflicto de interesesLos autores ceclaran no tener ningún conflicto de intereses