El tratamiento con insulina puede ser necesario en la diabetes tipo 2, dado que muchos pacientes, con el tiempo, no consiguen alcanzar o mantener los objetivos glucémicos para prevenir las complicaciones crónicas asociadas a la hiperglucemia sostenida. Inicialmente, la adición de insulina basal al tratamiento previo con agentes orales suele ser la pauta más habitual. Esta estrategia se basa en el control óptimo de la glucemia en ayunas. Sin embargo, un porcentaje significativo de pacientes no consiguen alcanzar o mantener el objetivo de HbA1c ≤7%, debido a que presentan elevaciones excesivas de la glucemia posprandial. En consecuencia, el paso siguiente en la intensificación del tratamiento podría ser la adición de una dosis única de insulina prandial antes de la comida que provoca la mayor excursión posprandial (estrategia basal plus), manteniendo el tratamiento previo con insulina basal y agentes orales. Este régimen ha demostrado ser sencillo, eficaz y adecuado para un gran número de pacientes. Además, en caso necesario, facilita la introducción progresiva de inyecciones adicionales de insulina prandial hasta una estrategia bolo basal. En este artículo se resumen las recomendaciones de un grupo de trabajo multidisciplinar para una adecuada implementación de la estrategia basal plus en la práctica clínica habitual.
Insulin treatment may be necessary in type 2 diabetes, because many patients are not able over the time to achieve or maintain glycemic targets to prevent chronic complications associated to sustained hyperglycemia. Initially, addition of basal insulin to previous treatment with oral agents is the most commonly used regimen. This strategy is based on optimal control of fasting plasma glucose. However, a significant proportion of patients does not achieve or maintain HbA1c target ≤7%, because they show excessive postprandial glucose values. Therefore, the next step for intensification of treatment might be the addition of a single dose of prandial insulin before the main meal, which is associated with the greatest postprandial glucose excursion (basal plus strategy), maintaining previous treatment with basal insulin and oral agents. This regimen has demonstrated to be easy to use, effective and appropriate for many patients. Furthermore, if necessary, it makes easier progressive introduction of additional injections of prandial insulin until the basal bolus strategy. In this manuscript, recommendations from a multidisciplinary working group are summarized for an adequate implementation of the basal plus strategy in the routine clinical practice.
American Diabetes Association
análogo de insulina de acción prolongada
análogo de insulina de acción rápida
agentes orales
A Parallel design comparing an OAD combination therapy with either Lantus once daily or Lispro at mealtime in type 2 diabetic patients failing Oral treatment
diabetes mellitus tipo 2
dipeptidilpeptidasa 4
European Association for the Study of Diabetes
glucagon-like peptide-1
neutral protamine aspart
neutral protamine Hagedorn
neutral protamine lispro
Oral Plus Apidra and Lantus
Proof Of Concept
United Kingdom Prospective Diabetes Study.
La diabetes mellitus tipo 2 (DM2) es una enfermedad progresiva caracterizada por un aumento de la resistencia a la insulina y un descenso de la función beta pancreática. La hiperglucemia crónica resultante se asocia a la aparición de complicaciones crónicas microangiopáticas y macroangiopáticas, que acaban convirtiéndose en un importante problema de salud. Numerosos estudios de intervención han demostrado que el control estricto de la glucemia en niveles próximos a la normalidad reduce estas complicaciones crónicas1–3, por lo que las últimas recomendaciones de la American Diabetes Association (ADA) sitúan el objetivo de control glucémico en una HbA1c ≤7%4.
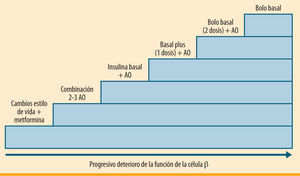
La compleja fisiopatología de la DM2 hace que, además de una dieta adecuada y modificaciones del estilo de vida, sea necesaria con frecuencia la combinación de varios fármacos de mecanismo sinérgico para alcanzar el objetivo de HbA1c, escalonando el tratamiento farmacológico desde la monoterapia con metformina hasta combinaciones de dos o tres agentes orales (secretagogos, inhibidores de la dipeptidilpeptidasa 4 [DPP-4], glitazonas), o la administración subcutánea de agonistas del receptor del glucagon-like peptide-1 (GLP-1) o insulina5,6. El United Kingdom Prospective Diabetes Study (UKPDS)7 puso de manifiesto que el deterioro de la función de la célula beta era el principal responsable de la progresión de la DM2, por lo que un elevado porcentaje de pacientes necesitarán tratamiento con insulina para restablecer la normoglucemia, entre 5 y 10 años después de su diagnóstico5,6,8. Sin embargo, el inicio del tratamiento con insulina a menudo se retrasa por diferentes motivos, como el temor a inyectarse la insulina por el propio paciente, el miedo a las hipoglucemias o la percepción de que se trata de un tratamiento complejo9.
La mayoría de guías clínicas recomiendan el inicio de la insulinización con una dosis de insulina basal, ya sea una insulina de acción intermedia como la insulina NPH (neutral protamine Hagedorn) o la NPL (neutral protamine lispro), administradas preferentemente por la noche, o bien análogos de insulina de acción prolongada (AIAP, insulina glargina o detemir), manteniendo el tratamiento previo con los agentes orales (AO)5,6,10. Esta sencilla estrategia inicial consigue alcanzar unos niveles de HbA1c ≤7% en un 60-70% de pacientes en los primeros 6-12 meses11–13, y mantenerlos incluso hasta 2-3 años desde el inicio del tratamiento14. Sin embargo, un porcentaje significativo de pacientes va a necesitar dosis adicionales de insulina rápida en las comidas para alcanzar o mantener los objetivos de HbA1c. Entre las opciones terapéuticas disponibles, se acepta cambiar a dos dosis de insulina premezclada de un análogo de insulina de acción rápida (AIAR) con una insulina de acción intermedia (NPH, NPL o NPA [neutral protamine aspart]), o pasar a una estrategia bolo basal, manteniendo la insulina basal y añadiendo dosis de insulina de acción rápida antes de cada una de las comidas principales.
Recientemente ha aparecido una tercera opción terapéutica para estos pacientes. Esta alternativa se basa en mantener el tratamiento previo con insulina basal en combinación con AO, añadiendo una única dosis de insulina rápida antes de la comida principal, que se define como la que provoca la mayor elevación de la glucemia posprandial. Esta estrategia, denominada basal plus, es una aproximación lógica a la intensificación del tratamiento con insulina y puede representar un escalón intermedio entre la adición de insulina basal y la -más completa- estrategia bolo basal15,16. Este régimen novedoso debe permitir, por su sencillez, una mayor aceptación por los pacientes de la intensificación del tratamiento insulínico, sin que ello suponga un aumento importante del riesgo de hipoglucemias17.
El objetivo del presente documento de trabajo es ofrecer unas recomendaciones sencillas y prácticas para el inicio de la administración de insulina prandial (estrategia basal plus) en pacientes con DM2 que no consiguen alcanzar los objetivos de HbA1c con una insulina basal en combinación con AO.
Iniciación de la insulina basal en la diabetes mellitus tipo 2La adición de una sola dosis de un AIAP, como insulina glargina o detemir, o de una insulina de acción intermedia, como insulina NPH o NPL (en general, antes de acostarse), manteniendo el tratamiento previo con AO, es la forma más sencilla de iniciar el tratamiento con insulina en pacientes con DM2. Este tratamiento permite conseguir importantes reducciones en los niveles de HbA1c utilizando un sencillo algoritmo para titular la insulina hasta alcanzar el objetivo marcado para la glucemia basal (en general <100-110 mg/ dL). Este régimen, además, reduce el número de inyecciones y de controles de glucemia capilar al mínimo.
En el estudio Treat to Target, con una dosis de insulina glargina o NPH, ambas antes de acostarse, aproximadamente el 60% de los pacientes alcanzaron el objetivo de HbA1c ≤7% a las 24 semanas del inicio del tratamiento11. Sin embargo, el porcentaje de pacientes que alcanzaron dicho objetivo sin hipoglucemias fue un 25% mayor en el grupo de tratamiento con insulina glargina. Del mismo modo, en este grupo también fue menor el riesgo de hipoglucemias nocturnas, comparado con el grupo de insulina NPH. Estudios posteriores con insulina glargina12,18,19 y con insulina detemir20,21 han confirmado estos hallazgos.
La adición de insulina glargina también se ha comparado con las insulinas premezcladas, en combinación con metformina y secretagogos. Este régimen ha demostrado ser tan eficaz como la utilización de dos dosis de insulina premezclada, con menor incremento de peso y menor riesgo de hipoglucemias22–24. Sin embargo, la utilización de dos dosis de insulina premezclada junto con metformina podría ser más eficaz en aquellos pacientes con mayor deterioro glucémico al inicio (HbA1c >9%).
Finalmente, en el estudio APOLLO (A Parallel design comparing an OAD combination therapy with either Lantus once daily or Lispro at mealtime in type 2 diabetic patients failing Oral treatment) se ha comparado la estrategia de insulinización basal con la estrategia de insulinización prandial25. La adición de una dosis de insulina glargina comparada con la utilización de tres dosis de insulina lispro, antes de las principales comidas, resultó en un control glucémico similar (reducción de la HbA1c de −1,7% con insulina glargina frente a −1,9% con insulina lispro), pero con un menor número de inyecciones, de autoanálisis y de hipoglucemias en el grupo de tratamiento con insulina glargina.
¿Cómo controlar la hiperglucemia posprandial tras la optimización de la glucemia en ayunas con insulina basal?Hasta ahora, la administración de dos inyecciones diarias de insulina premezclada ha sido utilizada preferentemente como una forma de proporcionar una cobertura de insulina prandial en diversas situaciones, en algunos casos, al inicio del tratamiento con insulina, y en otros, como sustituto de la insulina basal cuando esta última no es suficiente para alcanzar o mantener los niveles de HbA1c ≤7% a pesar de utilizar dosis optimizadas para conseguir el objetivo fijado de glucemia en ayunas26. Sin embargo, las pautas con insulinas premezcladas no reproducen de forma adecuada la secreción fisiológica de insulina, son poco flexibles y se asocian a un mayor número de hipoglucemias, frente a otras estrategias de insulinización27. Frente a las mezclas con insulina regular, las nuevas insulinas premezcladas con AIAR han demostrado un mejor control de la glucemia posprandial28.
La estrategia bolo basal es la que mejor representa la secreción fisiológica de insulina, y si se utiliza correctamente puede reducir la HbA1c de forma considerable, aunque generalmente requiere al menos cuatro inyecciones diarias3,29. Con esta estrategia, Bergenstal et al.30 consiguieron que un 70% de pacientes con DM2 mal controlados con dos dosis de insulina alcanzaran una HbA1c ≤7% (HbA1c final 6,6%, reducción media −1,6%) utilizando insulina glargina como basal e insulina glulisina como prandial. Estos resultados se obtuvieron, además, con independencia de que el ajuste de la insulina prandial se realizara en función de un algoritmo según la glucemia posprandial o según las raciones de hidratos de carbono, aunque en el ajuste por raciones la frecuencia de hipoglucemias fue superior.
A continuación, aparte de las modalidades de tratamiento insulínico comentadas anteriormente, se describe una alternativa sencilla y eficaz para la intensificación del tratamiento insulínico en aquellos pacientes que no consiguen alcanzar o mantener los objetivos glucémicos (HbA1c ≤7%).
Estrategia basal plusEl régimen clásico bolo basal proporciona la estrategia más fisiológica de tratamiento con insulina. Sin embargo, los pacientes pueden encontrar complicado el paso desde la insulina basal en combinación con AO a la insulina basal más tres dosis de insulina prandial, existiendo un mayor riesgo potencial de falta de adherencia28,31. Una aproximación lógica a la intensificación del tratamiento con insulina basal es introducir, al menos inicialmente, una única inyección de insulina prandial antes de la comida que provoca la mayor excursión glucémica posprandial. Esta alternativa terapéutica se conoce como estrategia basal plus. Además, en caso necesario, permite introducir inyecciones adicionales de insulina prandial de forma gradual en el resto de las comidas, según el impacto de cada una de ellas sobre la glucemia posprandial28,31,32. Esta pauta ha demostrado su eficacia y seguridad en varios estudios publicados recientemente.
Estudios relevantes que han utilizado la estrategia basal plusEn el estudio POC15 (Proof Of Concept), 106 pacientes con DM2 que no alcanzaron el objetivo de HbA1c ≤7% fueron aleatorizados a continuar el mismo tratamiento (grupo control) o a añadir una dosis de insulina glulisina antes de la comida principal (grupo de intervención). A los 3 meses de tratamiento, el 22% de los pacientes tratados con insulina prandial alcanzaron el objetivo, frente al 9% del grupo control, con una reducción significativa de la HbA1c (respectivamente, de −0,37 y −0,11%), sin aumento del número de hipoglucemias.
En el OPAL16 (Oral Plus Apidra and Lantus), otro estudio donde se evaluó de nuevo la estrategia basal plus, se incluyeron 393 pacientes con DM2 mal controlados con insulina basal y AO. Los pacientes fueron aleatorizados a recibir una dosis de insulina glulisina antes del desayuno o antes de la comida principal. Desde una HbA1c de 7,4%, ambos grupos alcanzaron una reducción de HbA1c de −0,4% a las 24 semanas de tratamiento, consiguiendo el objetivo de HbA1c ≤7% el 52% del grupo tratado antes de la comida principal, frente al 37% del grupo de tratamiento antes del desayuno.
Finalmente, en el estudio 1-2-317, 343 pacientes con DM2 mal controlada con insulina glargina y AO fueron aleatorizados a recibir tratamiento con una, dos o tres dosis de un AIAR (insulina glulisina) antes de las comidas principales. La reducción media de la HbA1c a los 6 meses de tratamiento fue mayor en el grupo de tres dosis, aunque no significativa (respectivamente, de −0,46, -0,46 y −0,58%). Sin embargo, sí fue significativamente superior el porcentaje de pacientes que alcanzaron una HbA1c ≤7% con tres dosis de insulina prandial (respectivamente, 30, 33 y 45%), aunque con el incremento del número de dosis de insulina glulisina aumentó la frecuencia de hipoglucemias graves (con 1x, 2x y 3x dosis de glulisina, 0,10, 0,30 y 0,26 eventos/paciente-año, respectivamente; p= 0,043 entre 1x frente a 2x dosis de glulisina).
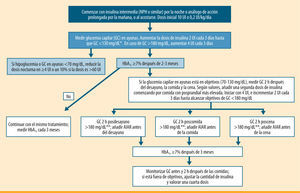
En resumen, los resultados de estos estudios respaldan un enfoque simplificado, progresivo y escalonado en la intensificación del tratamiento con insulina prandial. Esta estrategia está basada en la adición inicial de una única inyección de insulina prandial (basal plus), aumentando posteriormente a dos o tres dosis de insulina prandial (bolo basal) si no se alcanza el objetivo de HbA1c (figura 1). En la práctica, muchos profesionales ya utilizan este escalón intermedio en la insulinización de pacientes con DM2. Sin embargo, las directrices previas, sugeridas por un grupo de expertos de la ADA/EASD, ofrecen pocas indicaciones específicas sobre el inicio, el ajuste y la intensificación de la dosis de insulina prandial (figura 2), por lo que se han suscitado numerosas cuestiones que necesitan una respuesta apropiada.
Secuencia escalonada lógica en la Intensificación del tratamiento de la diabetes mellitus tipo 2 conforme progresa la enfermedad. Basal plus: insulina basal más análogo de insulina de acción rápida antes de la comida que provoca la mayor glucemia posprandial. Bolo basal: insulina basal más análogo de insulina de acción rápida antes de las tres comidas principales
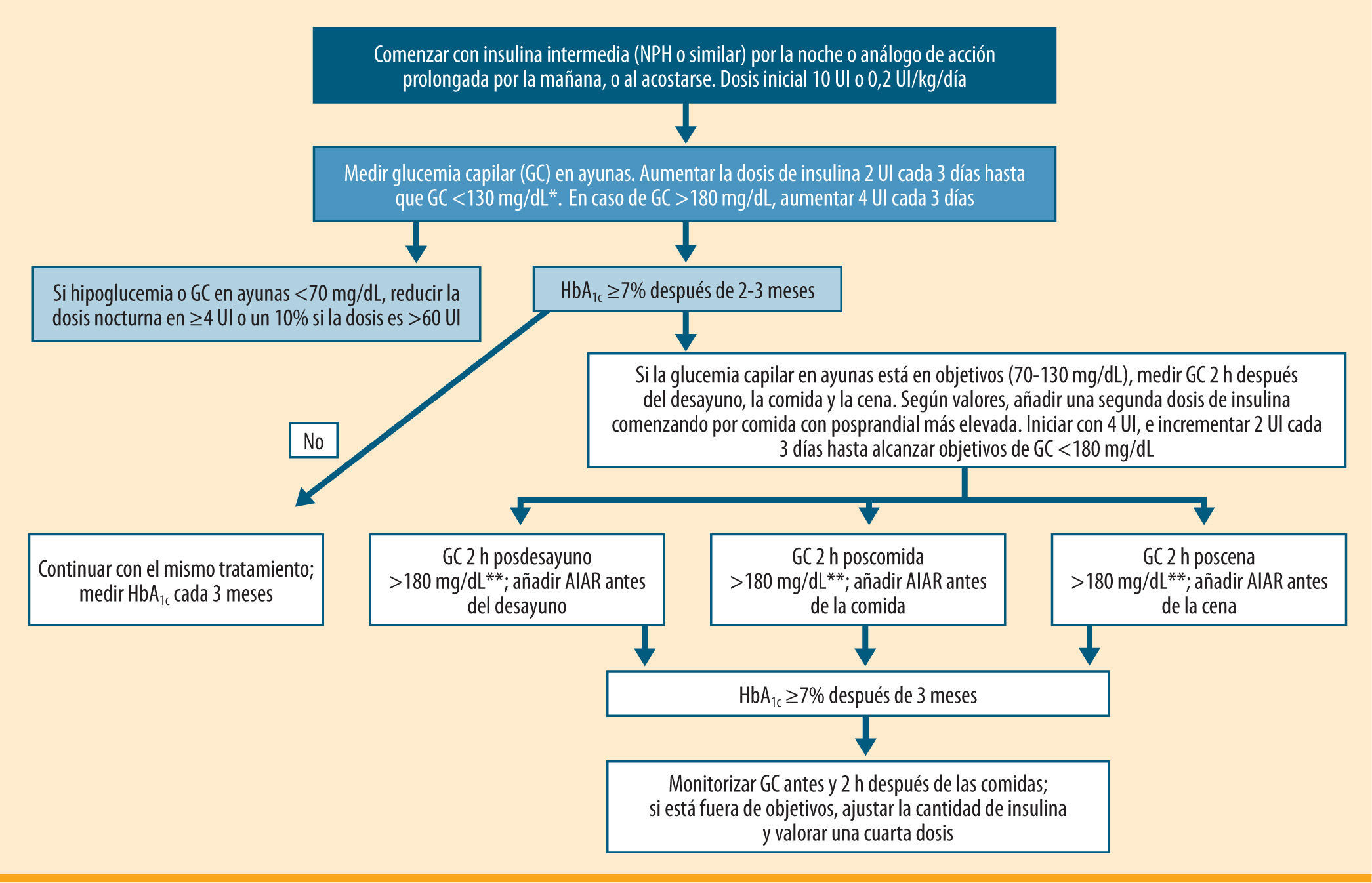
Algoritmo de inicio y ajuste del tratamiento insulínico para pacientes con diabetes tipo 2. Modificado del algoritmo de la ADA/EASD 20095. GC: glucemia capilar; AIAR: análogo de insulina de acción rápida. *El objetivo para la glucemia basal en numerosos trabajos es <110 mg/dL11,12. **El tratamiento con un AIAR se recomienda si la GC a las 2 h después de las comidas es >180 mg/dL, siendo el objetivo que alcanzar una GC <140 mg/dL
A continuación se exponen unas pautas de actuación sencillas para progresar en el tratamiento con insulina prandial de forma escalonada, con el objetivo de controlar las oscilaciones glucémicas posprandiales excesivas y poder alcanzar/mantener los objetivos glucémicos adecuados a cada paciente.
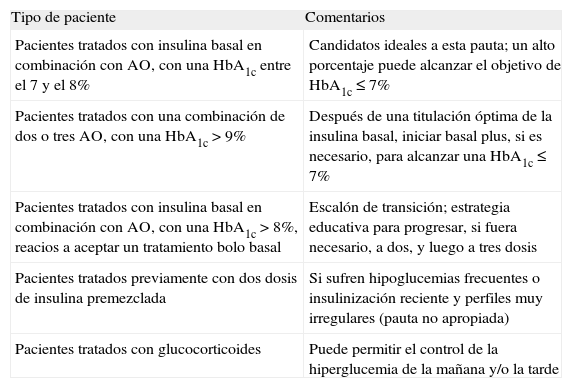
Selección del paciente adecuado para la intensificación con basal plus (tabla 1)Pacientes tratados con insulina basal en combinación con AO y con HbA1c entre 7 y 8%Los pacientes candidatos para esta estrategia serían aquellos que no son capaces de alcanzar los objetivos de control glucémico con la combinación de AO y una única dosis de insulina basal optimizada (glucemias basales <100-110 mg/dL, y/o una dosis de >0,7 UI/kg), o bien aquellos que están limitados por la aparición de hipoglucemias nocturnas28,31,32. Estos candidatos deben tener una HbA1c no muy elevada (entre 7 y 8%), aunque este objetivo podría individualizarse en función de la edad, los años de evolución, la presencia de enfermedades cardiovasculares y el riesgo de hipoglucemias.
Selección del paciente más apropiado para la intensificación con basal plus
| Tipo de paciente | Comentarios |
| Pacientes tratados con insulina basal en combinación con AO, con una HbA1c entre el 7 y el 8% | Candidatos ideales a esta pauta; un alto porcentaje puede alcanzar el objetivo de HbA1c ≤7% |
| Pacientes tratados con una combinación de dos o tres AO, con una HbA1c >9% | Después de una titulación óptima de la insulina basal, iniciar basal plus, si es necesario, para alcanzar una HbA1c ≤7% |
| Pacientes tratados con insulina basal en combinación con AO, con una HbA1c >8%, reacios a aceptar un tratamiento bolo basal | Escalón de transición; estrategia educativa para progresar, si fuera necesario, a dos, y luego a tres dosis |
| Pacientes tratados previamente con dos dosis de insulina premezclada | Si sufren hipoglucemias frecuentes o insulinización reciente y perfiles muy irregulares (pauta no apropiada) |
| Pacientes tratados con glucocorticoides | Puede permitir el control de la hiperglucemia de la mañana y/o la tarde |
AO: antidiabéticos orales; HbA1c: hemoglobina glucosilada.
En el estudio LANMET12, la HbA1c se redujo desde un 9,5% inicial hasta un 7,1% a las 36 semanas de tratamiento con insulina glargina o NPH. Aunque la mayoría de pacientes alcanzaron un control de glucemia basal excelente, casi la mitad de los pacientes no pudieron alcanzar una HbA1c ≤7%. En estos pacientes, los valores de glucemia después de la comida principal fueron habitualmente superiores a 180 mg/dL.
La adición de una sola dosis de insulina prandial antes de la comida principal -definida como la que provoca el mayor pico glucémico posprandial- es un tratamiento eficaz para alcanzar el objetivo de HbA1c en un amplio grupo de pacientes, como han demostrado los estudios POC15 y OPAL16. Además, es un tratamiento que provoca menos hipoglucemias que el régimen bolo basal, como demuestra el estudio 1-2-317, por lo que podría ser utilizado en un amplio grupo de pacientes independientemente de su edad o índice de masa corporal.
Pacientes tratados con la combinación de dos o tres AO y con HbA1c >9%Después de la introducción de la insulina basal, y una vez conseguida una titulación óptima de la dosis, algunos de estos pacientes no conseguirán alcanzar/mantener un control glucémico adecuado11,12, pudiendo necesitar una o más dosis de insulina prandial para alcanzar los objetivos de HbA1c. En estas circunstancias, la adición precoz de una dosis de insulina prandial a la insulina basal, previamente optimizada (estrategia basal plus), puede permitir alcanzar, de forma sencilla, el deseado objetivo de control glucémico a un mayor número de pacientes de estas características
Pacientes con DM2 reacios a aceptar el tratamiento intensivo bolo basalServiría de escalón de transición y de estrategia educativa hacia el tratamiento intensivo bolo basal. Probablemente, la secuencia lógica de tratamiento sería de basal más AO a basal plus y, de éste, progresar a bolo basal.
Pacientes mal controlados con dos dosis de insulina premezcladaEn esta situación, resulta recomendable transferir al paciente a una terapia bolo basal añadiendo un AIAR antes de la comida. Sin embargo, existen dos situaciones clínicas en las que podría estar indicado el cambio a una estrategia basal plus:
- 1.
En pacientes que sufren hipoglucemias frecuentes con esta pauta.
- 2.
En pacientes insulinizados recientemente y con perfiles glucémicos muy irregulares que ponen de manifiesto que la elección previa de dos dosis de insulina premezclada no fue la mejor opción.
Tanto si estaban siendo tratados con AO como con insulina basal, en pacientes tratados con una sola dosis de glucocorticoides administrada por la mañana, la adición de una o dos dosis de insulina prandial antes del desayuno y de la comida podría evitar la hiperglucemia habitual en estos pacientes durante la mañana y en las primeras horas de la tarde.
¿Cómo identificar la comida principal, es decir, aquella que provoca la mayor hiperglucemia posprandial?Lo recomendable, según los diferentes estudios que han evaluado esta estrategia, sería realizar dos o tres perfiles glucémicos a lo largo de una semana, con controles glucémicos antes y 2 horas después de las comidas principales, y calcular la media de los diferentes puntos. Aquella ingesta que se acompañe, en varios días, de la mayor excursión posprandial identificará a la comida principal15,17. Por tanto, ésta sería la comida antes de la cual se debería añadir la insulina prandial. En caso de utilizar un AIAR, podría ser suficiente con realizar las glucemias 2 horas después de las comidas para identificar la comida principal.
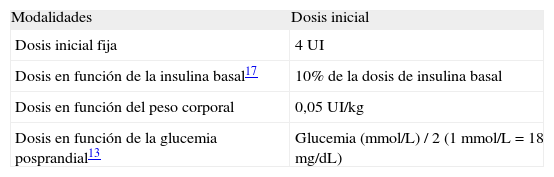
Dosis inicial de insulina prandial en la estrategia basal plus (tabla 2)Existen numerosas formas de calcular la dosis de insulina rápida inicial en la estrategia basal plus, aunque todas ellas van a dar resultados muy similares en la práctica clínica.
Dosis inicial fija de 4 unidadesEs el método más sencillo. Con esta pauta se da prioridad a la seguridad para evitar hipoglucemias, aunque en algunos pacientes puede resultar insuficiente.
Dosis en función de la cantidad de insulina basalEs más personalizada. Se recomienda empezar con el 10% de la dosis de insulina basal total. Fue el algoritmo utilizado en el estudio 1-2-317.
Dosis en función del peso corporalPuede resultar especialmente útil en pacientes obesos. La dosis inicialmente recomendada son 0,05 UI/kg y por ingesta.
Dosis en función de la glucemia posprandialFue la que se utilizó en el estudio POC15. Se calcula con la siguiente fórmula: «glucemia (en mmol/L) / 2». Para pasar de mg/dL a mmol/L, utilizar «glucemia / 18».
En cualquier caso, la dosis inicial quedará a discreción del facultativo responsable.
Recomendaciones sobre el empleo de agentes oralesEn líneas generales, se recomienda mantener los mismos AO que el paciente llevaba previamente con la pauta de insulina basal, aunque podría ser un buen momento para replantearnos el tratamiento. En general, al inicio de la insulinización se recomienda retirar las glitazonas, por la mayor retención hídrica y el aumento de peso asociado a esta opción. La metformina se debe mantener siempre, independientemente de la pauta de insulina administrada. Los tratamientos basados en las incretinas, y los secretagogos de acción prolongada (sulfonilureas), se pueden mantener si se añade una sola dosis de insulina prandial. Aunque algunos prefieren retirar los secretagogos, otros piensan que su retirada temprana podría implicar un importante aumento de las necesidades de insulina4,5,10. En el caso de secretagogos de insulina de acción rápida (glinidas), se recomienda interrumpir la administración de éstos en la comida en la que se administra la insulina prandial. La necesidad de dos o más dosis de insulina prandial podría indicar un agotamiento casi completo de la reserva pancreática de insulina, siendo éste el momento de retirar todos los secretagogos y, probablemente también, los tratamientos basados en las incretinas.
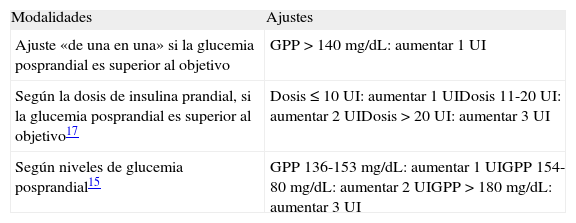
Ajuste y optimización de la insulina prandial (tabla 3)El objetivo recomendable para la glucemia posprandial es <140 mg/dL o una excursión glucémica inferior a 40-50 mg/dL sobre el valor preprandial. Es un objetivo adecuado para mejorar el control y la HbA1c sin aumentar el riesgo de hipoglucemias. La dosis de insulina se ajustará en función de los controles posprandiales y/o preprandiales. Sin embargo, en pautas de insulina prandial, como la estrategia basal plus, lo más razonable sería utilizar AIAR y centrarnos en el control posprandial a las 2 horas.
Ajuste y optimización de la insulina prandial
| Modalidades | Ajustes |
| Ajuste «de una en una» si la glucemia posprandial es superior al objetivo | GPP >140 mg/dL: aumentar 1 UI |
| Según la dosis de insulina prandial, si la glucemia posprandial es superior al objetivo17 | Dosis ≤10 UI: aumentar 1 UIDosis 11-20 UI: aumentar 2 UIDosis >20 UI: aumentar 3 UI |
| Según niveles de glucemia posprandial15 | GPP 136-153 mg/dL: aumentar 1 UIGPP 154-80 mg/dL: aumentar 2 UIGPP >180 mg/dL: aumentar 3 UI |
GPP: glucemia posprandial.
El ajuste de dosis se puede realizar cada 3 días, o mejor semanalmente.
Es importante educar al paciente y proporcionarle instrucciones sencillas para el ajuste de la insulina prandial.
La forma más sencilla para optimizar la dosis de insulina prandial es aumentar o disminuir una unidad si no se alcanzan los objetivos de glucemia posprandial.
En el estudio 1-2-317 se propuso un ajuste de la dosis de insulina prandial en función de la cantidad actual de insulina prandial: 1 UI si ≤10 UI, 2 UI entre 11 y 20 UI, y 3 UI si >20 UI.
En el estudio POC15 se utilizó un algoritmo de ajuste de la insulina prandial en función de la glucemia posprandial: 1 UI entre 136 y 153 mg/dL, 2 UI entre 154 y 180 mg/dL, y 3 UI si >180 mg/dL.
El ajuste de dosis se puede realizar cada 3 días, o mejor semanalmente. Es importante educar al paciente y proporcionarle instrucciones sencillas para el ajuste de la insulina prandial.
Elección de la insulina prandialEl régimen de insulina ideal es el que mejor imite la liberación normal de insulina, y que sea flexible y cómodo de utilizar. El desarrollo de análogos de insulina rápida con un perfil farmacocinético mejorado nos ha acercado de forma considerable a este ideal33. En la actualidad hay tres AIAR disponibles: insulina lispro, insulina aspart e insulina glulisina. Todos tienen perfiles farmacocinéticos similares y son capaces de reproducir los perfiles de insulina fisiológica de forma más parecida que las preparaciones de insulina regular humana convencional. Por otro lado, el requerimiento de administración de la insulina rápida humana 30 minutos antes de las comidas conlleva un enorme compromiso por parte de la persona con diabetes para evitar la hiperglucemia precoz y la hipoglucemia tardía. Muchos pacientes se administran la insulina humana inmediatamente antes de la comida, lo que les impide alcanzar un control glucémico óptimo. Por el contrario, todos los AIAR pueden administrarse inmediatamente antes de la comida, e incluso justo después, y por lo tanto su utilización es mucho más cómoda y segura34,35.
Necesidad de ajuste de la insulina basalNo se considera necesario disminuir la dosis de insulina basal, a no ser que la comida principal coincida con la cena, en cuyo caso se recomienda reducir un 10% la dosis de insulina basal.
Controles de glucemia capilar recomendadosCon una dosis de insulina prandial y una única dosis de insulina basal, el número mínimo de controles de glucemia capilar diarios que realizar serían dos: glucemia basal y glucemia posprandial a las 2 horas de la comida principal. En función de los resultados de la HbA1c o del criterio médico, podría recomendarse la realización de un perfil de 4 o 6 puntos cada 1-2 semanas para identificar la siguiente comida con mayor impacto sobre la glucemia posprandial susceptible de adición de la segunda dosis de insulina prandial.
Progresión de basal plus a bolo basalUna vez alcanzada la glucemia posprandial deseada con la primera inyección de insulina prandial, y si el nivel de HbA1c sigue por encima del 7%, los autocontroles deben dirigirse a evaluar otros periodos posprandiales responsables de esta situación. Puede ser necesaria una segunda o tercera inyección de insulina prandial para alcanzar niveles de glucemia casi normales. La introducción y ajuste de las dosis adicionales de insulina prandial debería seguir el mismo procedimiento utilizado para el ajuste de la primera inyección prandial. Al mismo tiempo que se introduce la segunda dosis de insulina prandial, como ya se ha comentado, debe considerarse la retirada de los secretagogos y de los inhibidores de la DPP-4, manteniendo únicamente metformina17,32.
Otras medidas aconsejablesMedidas educativasEl paciente debe recibir información cualitativa sobre los diferentes grupos de alimentos y conocer otros conceptos como insulina prandial e insulina basal, y cuáles deben ser los objetivos que conseguir en relación con la glucemia basal y la glucemia posprandial. Con esta estrategia no es imprescindible ajustar la dosis de insulina prandial por raciones de hidratos de carbono, ya que no parece aportar ventajas adicionales y podría complicar su implementación en los pacientes con diabetes tipo 230.
Ajustes según la actividad física en el periodo posprandialSi el ejercicio físico se realiza de forma regular, puede ser necesario reducir la dosis o cambiar la insulina a otra comida para evitar hipoglucemias.
Lugar de administración recomendable para la insulina prandialDebe ser el abdomen, ya que es la zona corporal con más rápida absorción de la insulina.
ConclusionesEl progresivo deterioro de la función de la célula beta pancreática condiciona la historia natural de la DM2. Desde el momento del diagnóstico, la estrategia terapéutica que utilizar en estos pacientes está basada en un tratamiento escalonado, añadiendo nuevos tratamientos conforme fracasan los anteriores. Así, a la dieta, los cambios en el estilo de vida y el tratamiento en monoterapia con metformina les sigue un segundo escalón consistente en la adición de un segundo fármaco de efecto sinérgico a metformina.
El siguiente escalón suele ser la adición de insulina basal. La adición de una única dosis de un AIAP como insulina basal al tratamiento previo con AO, titulando la dosis según los niveles de glucemia en ayunas, ha demostrado ser el método más sencillo, eficaz y seguro para el inicio del tratamiento con insulina. Como alternativa, en algunos casos, podría añadirse un tercer agente oral, aunque la eficacia de esta opción terapéutica con el tiempo resulta controvertida.
Siguiendo esta estrategia de tratamiento escalonado, cuando los pacientes con DM2 no alcanzan el control glucémico adecuado con una insulina basal optimizada, el siguiente escalón podría ser la adición de una única dosis de insulina prandial antes de la comida que provoca la mayor excursión glucémica posprandial (figura 1). Esta opción, denominada estrategia basal plus, además de ser el paso lógico en la intensificación del tratamiento, es más flexible y puede adaptarse mejor a las necesidades y al estilo de vida de los pacientes. En caso de que no puedan alcanzarse o mantenerse los objetivos de control glucémico, pueden ser necesarias inyecciones adicionales de insulina prandial, con lo que la estrategia basal plus progresaría hasta una modalidad terapéutica más completa o estrategia bolo basal.
Declaración de potenciales conflictos de interesesTodos los miembros de este grupo de trabajo recibieron soporte de sanofi-aventis para la realización de una reunión multidisciplinar presencial, que dio origen a la elaboración de este documento de consenso.




 ADA/
ADA/
