Determinar la utilidad del diagnóstico precoz de la enfermedad de Lyme (EL) en los Centros de Atención Primaria (CAP) empleando el ELISA como técnica de cribado serológico.
MétodosSe realiza un estudio retrospectivo (2006-2013) consistente en la determinación mediante ELISA de la seropositividad a Borrelia de 2.842 personas consideradas en riesgo de padecer EL. Se estudia la relación entre el hábitat y la zona de residencia de las personas con seropositividad a Borrelia, según la procedencia de las muestras (CAP/Hospital).
ResultadosEl 15,2% de los sueros resultaron positivos frente a Borrelia spp. La seropositividad fue significativamente superior en las muestras remitidas desde los CAP que desde el Hospital y en los habitantes del rural y la montaña frente al área urbana y la meseta. El porcentaje de seropositividad se incrementó con el transcurso de los años.
Los médicos de Atención Primaria detectaron mayor porcentaje de enfermos de Lyme en Fase I y tras la instauración del tratamiento no se observaron secuelas.
ConclusionesEl papel del médico de atención primaria es primordial en el diagnóstico precoz de la EL, constatándose un mayor porcentaje de seropositivos entre las muestras remitidas desde los CAP con predominio del diagnóstico en Fase I de enfermedad y la resolución sin secuelas.
La detección de anticuerpos específicos frente a Borrelia, mediante ELISA, es una prueba útil para el cribado de pacientes en riesgo de EL.
The main aim of this study was to determine the usefulness of an early diagnosis of Lyme disease (LD) in Primary Health Care Centres (PHCC) using the ELISA test as serological screening technique.
MethodsA retrospective study (2006-2013) was performed in order to determine the anti-Borrelia seropositivity in 2,842 people at risk of having LD. The possible relationship between the environment and the area of residence with anti-Borrelia seropositivity was also studied according to the origin of the specimens (PHCC/Hospital).
ResultsOverall, 15.2% of samples were positive to Borrelia spp. Seropositivity was significantly higher in samples sent by PHCC doctors than those sent by Hospital doctors. Seropositivity was significantly higher in rural than in urban populations and in those who live in mountainous or flat areas. The percentage of seropositivity has increased over the years.
ConclusionsThe role of the PHCC doctor is essential for achieving an early diagnosis of Lyme disease, as a higher percentage of seropositives was detected in samples submitted from PHCC. Furthermore, most early localised LD patients were diagnosed in PHCC, avoiding the appearance of sequelae. Therefore, detection of Borrelia specific antibodies using an ELISA assay is a useful screening test for patients at risk of LD.
La enfermedad de Lyme (EL) es una zoonosis cosmopolita causada por una bacteria Gram negativa perteneciente al complejo Borrelia burgdorferi sensu lato y transmitida por la picadura de una garrapata dura del género Ixodes ricinus (I. ricinus) en Europa1. La abundancia de esta garrapata dura y de sus hospedadores, así como el aumento de las actividades al aire libre, que generan un mayor contacto del hombre con la naturaleza influyen, entre otros factores, en la seroprevalencia y tasa de incidencia de la EL1-3, condicionando las diferencias observadas entre países4-7 y entre regiones de un mismo país3,8-10. El número de casos de EL se está incrementando de forma generalizada en toda Europa, hasta el punto de ser considerada una enfermedad emergente1,11. En España, también se ha constatado un aumento en la incidencia de la enfermedad y se han identificado algunas zonas endémicas en el norte de la península1,3,11.
La EL es una infección multisistémica, con sintomatología fundamentalmente a nivel cutáneo, neurológico, cardíaco y reumatológico11-13. La lesión dermatológica patognomónica es el eritema migrans11. Las manifestaciones neurológicas más frecuentes son la meningitis, la radiculitis y la mononeuritis. Entre las cardíacas, son habituales las alteraciones del ritmo y en la clínica reumatológica predomina la artritis12.
Debido al ciclo vital de la garrapata, la enfermedad suele iniciarse a finales de la primavera o en el verano, aunque puede aparecer en cualquier época del año. Generalmente, para la transmisión de la espiroqueta es necesario que la garrapata se alimente de su hospedador un mínimo de 24-48 h6,13.
Las manifestaciones clínicas varían en función de la fase de enfermedad: fase i o localizada: eritema migratorio; fase ii o diseminada precoz: eritema migratorio múltiple, meningitis, radiculitis, parálisis de pares craneales, alteraciones del ritmo cardíaco entre otros y fase iii o diseminada tardía: artritis, encefalopatía, polineuropatía, acrodermatitis crónica atrófica13.
Los primeros signos de infección se hacen evidentes en pocas semanas o meses después de la picadura pero los tardíos lo hacen meses o incluso años más tarde. Las manifestaciones tempranas suelen responder adecuadamente a un correcto tratamiento antibiótico, mientras que las tardías pueden cronificarse e incluso generar un daño orgánico irreversible, con la morbilidad que ello supone, de ahí la importancia de un diagnóstico y tratamiento precoz12-14.
La gran variedad de manifestaciones hace que el diagnóstico de certeza de la EL pueda resultar difícil, siendo necesario además de realizar una exhaustiva historia clínica y una exploración física minuciosas, un apoyo microbiológico1,15. Se recomienda una primera determinación serológica mediante enzimoinmunoanálisis (ELISA) y su posterior confirmación mediante una prueba más específica como es el Western-Blot1,3,6,16, considerando que habitualmente no se detectan las IgM frente a Borrelia burgdorferi hasta pasadas 3-4 semanas de la infección y unas 6-8 semanas para la IgG6.
El tratamiento de la enfermedad está basado en una adecuada terapia antibiótica que dependerá fundamentalmente de la clínica y fase de enfermedad al diagnóstico. El pronóstico de la enfermedad dependerá en gran medida de un adecuado tratamiento antibiótico precoz12-14.
Los objetivos de este trabajo son: 1) determinar la utilidad del diagnóstico precoz de la EL en los centros de Atención Primaria (CAP) empleando el ELISA como técnica de cribado serológico, y 2) analizar la influencia del hábitat y la zona de residencia de las personas sobre la seropositividad a Borrelia.
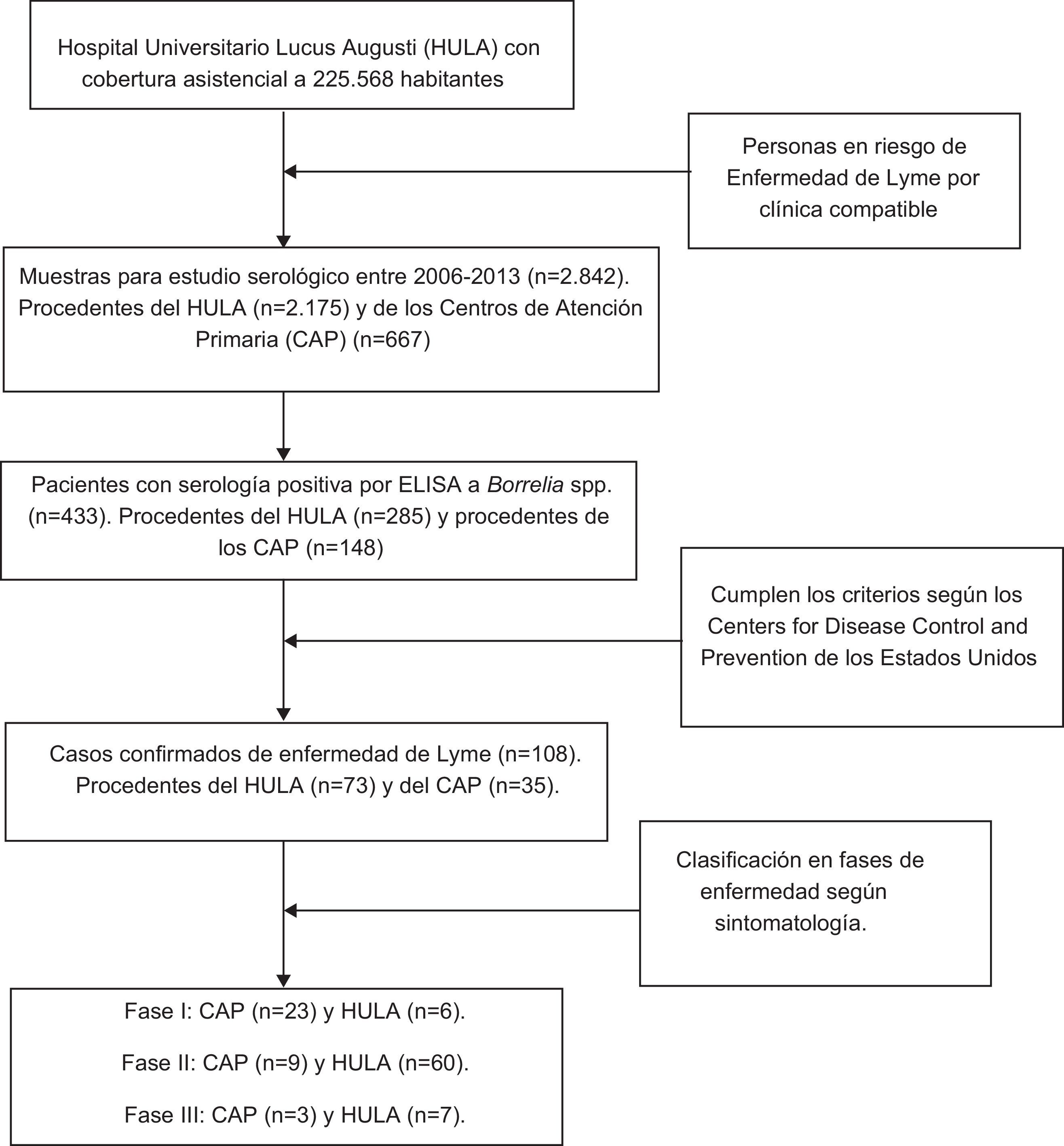
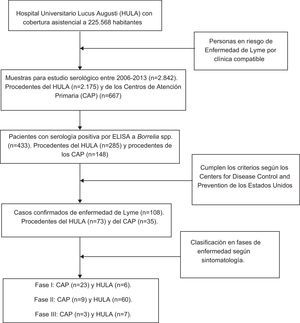
MétodosEl Hospital Universitario Lucus Augusti (HULA) da cobertura asistencial a una media de 225.568 personas distribuidas en 41 ayuntamientos que se corresponden geográficamente con la franja central de la provincia de Lugo (España). Entre los años 2006 y 2013, ambos inclusive, desde los CAP de cada uno de los ayuntamientos y desde los diferentes servicios del HULA, se remitieron un total de 2.842 muestras de sangre al Servicio de Microbiología del HULA con objeto de determinar la presencia de anticuerpos frente a Borrelia spp (tabla 1).
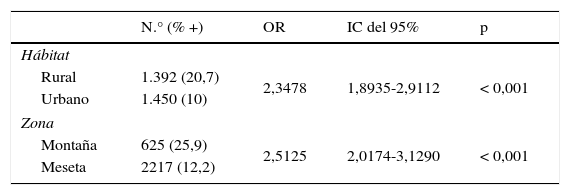
Seropositividad a Borrelia spp. hallada entre los años 2006 al 2013, al considerar el hábitat y la zona de procedencia de las muestras
| N.° (% +) | OR | IC del 95% | p | |
|---|---|---|---|---|
| Hábitat | ||||
| Rural | 1.392 (20,7) | 2,3478 | 1,8935-2,9112 | < 0,001 |
| Urbano | 1.450 (10) | |||
| Zona | ||||
| Montaña | 625 (25,9) | 2,5125 | 2,0174-3,1290 | < 0,001 |
| Meseta | 2217 (12,2) | |||
IC: intervalo de confianza; N.°=número de muestras analizadas; OR: odds ratio; (% +): porcentaje de seropositividad.
Se solicitó la determinación de anticuerpos (por los médicos de CAP y del HULA) a las personas consideradas en riesgo de presentar EL. Estas serían las que en un contexto epidemiológico compatible pudieran recordar la picadura de garrapata o presentasen una clínica compatible con la enfermedad, que se especifican en la tabla 2.
Manifestaciones clínicas de la EL
| Fase I o localizada precoz (días-mes desde la picadura) |
| Eritema migratorio |
| Síntomas asociados: astenia, malestar, letargia, cefalea, rigidez de nuca, mialgias, artralgias, linfadenopatía regional |
| Fase II o diseminada precoz (semanas-meses desde la picadura) |
| Carditis (bloqueo AV, cardiomiopatía, miopericarditis) |
| Afectación neurológica (meningitis linfocitaria, neuropatía craneal con afectación frecuente del nervio facial, neuropatía periférica) |
| Afectación musculoesquelética (artralgias migratorias) |
| Afectación cutánea (eritema migratorio múltiple) |
| Linfadenopatías |
| Afectación ocular (conjuntivitis, iritis, coroiditis, hepatitis) |
| Enfermedad hepática(disfunción hepática, hepatitis) |
| Enfermedad renal (microhematuria, proteinuria) |
| Fase III o diseminada tardía (meses-años desde picadura) |
| Síntomas musculoesqueléticos (artritis oligo o monoarticular con afectación frecuente de rodilla) |
| Enfermedad neurológica (neuropatía periférica, encefalomielitis) |
| Afectación cutánea (acrodermatitis crónica atrófica, lesiones similares a esclerodermia) |
Tomado de Olmo Montes et al.13.
La mayoría de los sueros procedían del HULA debido a que los pacientes acudían al hospital en fases más avanzadas de la EL (tabla 2), lo que facilita la sospecha clínica. Por el contrario, la sospecha de la enfermedad por los médicos de los CAP en fase inicial es mucho más complicada debido a la inespecificidad de los síntomas, lo que justifica que se envíen un menor número de sueros para determinar anticuerpos específicos frente a Borrelia.
La determinación de anticuerpos frente a Borrelia spp. se realizó mediante el test VIDAS® Lyme IgG and IgM (bioMérieux, St. Louis, Mo., EE. UU.), ELISA con sensibilidad y especificidad del 100 y el 92%, respectivamente13. Los sueros con resultado positivo por ELISA se remitieron al Centro Nacional de Microbiología Carlos III para confirmar su seropositividad por Western-Blot comercial (EUROLINE-WB Euroimmun AG, Lübeck, Alemania) y de esta manera identificar los casos confirmados de EL siguiendo los criterios de vigilancia epidemiológica de los Centers for Disease Control and Prevention17. Según estos criterios, ni todos los casos con serología positiva se consideran enfermos, ni todos los casos con clínica compatible tienen serología positiva.
Debido a la confidencialidad de los datos personales, solo se conocía si los análisis se habían solicitado desde los CAP o desde los diferentes servicios del HULA. Además, se dispuso de la información relativa al hábitat (rural o urbano) y a la zona (montaña o meseta) de residencia de las personas. La distribución de la población se obtuvo del Instituto Nacional de Estadística (padrón municipal, años 2006 al 2013), considerando residentes del hábitat rural los que vivían en entidades singulares de población menores de 2.000 personas (n=101.101) y el resto de hábitat urbano (n=124.467). En la zona de estudio, el 62% de las personas del medio rural se dedican a la ganadería y la agricultura. El área de estudio se dividió según sus características edafoclimáticas en zona de montaña y de meseta. La montaña se caracteriza por altitudes elevadas (650-1.500m), temperaturas medias bajas (10°C) y elevadas precipitaciones anuales (> 1.500mm) y en ella viven 33.554 habitantes. La meseta tiene menor altitud (200-600 metros), temperaturas medias moderadas (12°C) y precipitaciones más bajas (< 1.300mm), y habitan 192.014 personas.
También se contó con la aprobación del Comité de Ética e Investigación de Galicia para la revisión de las historias clínicas11. Esto nos permitió disponer de los datos relativos a las diferentes manifestaciones clínicas de los pacientes, la fase de la enfermedad en la que se encontraban al diagnóstico (i, ii y iii), así como los tratamientos recibidos, su evolución y sus posibles secuelas.
Los datos se procesaron con la hoja de cálculo Microsoft Excel 2007. Los análisis estadísticos se realizaron con el programa IBM SPSS Statistics versión 20. La presencia de anticuerpos específicos frente a Borrelia se expresó en porcentaje (seropositividad). Para constatar si existían diferencias en la seropositividad entre las muestras al considerar las variables hábitat y la zona se utilizó el test de la chi al cuadrado (χ2) y se calcularon los odds ratio (OR) con intervalos de confianza (IC) del 95%. Con el test de Mantel-Haenszel se estudió la presencia de variables de confusión.
Asimismo, mediante la χ2 y la OR, se comprobó si al considerar el origen de las muestras existían diferencias significativas en la seropositividad entre los 2 hábitats y entre las 2 zonas.
Para determinar la seropositividad anual de las muestras procedentes de los CAP o del HULA, se halló el porcentaje de sueros positivos en cada año respecto al total de muestras analizadas ese año.
Con el test χ2 se comprobó si existían diferencias en la existencia de secuelas según la fase de diagnóstico. También se utilizó este test para constatar si había diferencias en las fases en la que la EL era diagnosticada por los CAP o por el HULA.
ResultadosDe los 2.842 sueros analizados, en el 15,2% (IC del 95%, 14,0-16,6%) se detectaron anticuerpos específicos frente a Borrelia spp. Se observó que la seropositividad, en los 8 años de estudio, fue significativamente superior en los habitantes del medio rural que en los del urbano y en los residentes en la montaña que en los de la meseta (tabla 1). Los valores de las OR indican que tanto las personas que viven en el medio rural como las de la montaña tienen una probabilidad de ser seropositivos a Borrelia más de 2 veces superior a la de los habitantes en el medio urbano y a la de los residentes en la meseta. Con el test de Mantel-Haenszel se demostró (p<0,001) que no existía efecto de confusión entre las variables estudiadas.
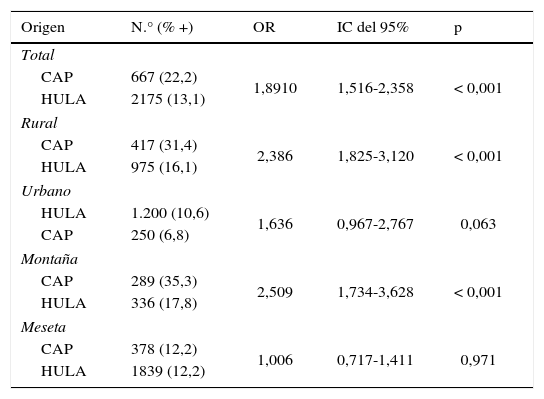
Al analizar el origen de procedencia de los sueros (tabla 3) se comprobó que el porcentaje de seropositividad era significativamente superior en las muestras remitidas por los médicos de los CAP que las enviadas desde los diferentes servicios del HULA. Así mismo, en los residentes del medio rural los CAP detectaron una seropositividad significativamente superior a la hallada en el HULA. De igual modo, en los habitantes de la montaña, los CAP obtuvieron un porcentaje de seropositividad a Borrelia spp. significativamente superior al observado en el hospital. Por el contrario, no se observaron diferencias significativas entre los 2 orígenes de procedencia de las muestras respecto a los residentes en el medio urbano y en los habitantes de la zona de la montaña.
Seropositividad a Borrelia spp., hallada entre los años 2006 al 2013, al considerar el origen de las muestras, el hábitat y la zona de procedencia de las muestras
| Origen | N.° (% +) | OR | IC del 95% | p |
|---|---|---|---|---|
| Total | ||||
| CAP | 667 (22,2) | 1,8910 | 1,516-2,358 | < 0,001 |
| HULA | 2175 (13,1) | |||
| Rural | ||||
| CAP | 417 (31,4) | 2,386 | 1,825-3,120 | < 0,001 |
| HULA | 975 (16,1) | |||
| Urbano | ||||
| HULA | 1.200 (10,6) | 1,636 | 0,967-2,767 | 0,063 |
| CAP | 250 (6,8) | |||
| Montaña | ||||
| CAP | 289 (35,3) | 2,509 | 1,734-3,628 | < 0,001 |
| HULA | 336 (17,8) | |||
| Meseta | ||||
| CAP | 378 (12,2) | 1,006 | 0,717-1,411 | 0,971 |
| HULA | 1839 (12,2) | |||
IC: intervalo de confianza; N.°: número de muestras analizadas; OR: odds ratio; (% +): porcentaje de seropositividad.
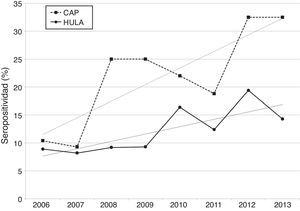
El porcentaje anual de muestras seropositivas a Borrelia se incrementó con el transcurso de los años, tanto en las remitidas por los CAP como en las procedentes de los diferentes servicios del HULA y, en ambos casos, se observó una tendencia ascendente en el tiempo (fig. 1). No obstante, a partir del año 2008 y hasta el final del estudio, el porcentaje anual de muestras seropositivas detectadas por los CAP fue netamente superior a la hallada en el HULA.
En los 8 años de estudio (2006-2013) se identificaron 108 casos confirmados de EL11. De estos, 29, 69 y 10 pacientes se diagnosticaron en fase i, ii y iii, respectivamente. No se observaron secuelas en los enfermos en fase i, mientras que sí se observaron en 16 y 10 pacientes diagnosticados en fase ii y iii, respectivamente. Según la fase de diagnóstico, con χ2, se constató que existían diferencias significativas (p=0,005) respecto a la presencia de secuelas.
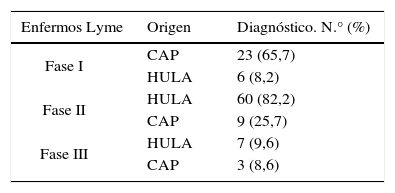
De los 108 casos confirmados como enfermos de Lyme, 35 fueron diagnosticados por los médicos de los CAP y el resto (73) en el HULA. Como se aprecia en la tabla 4, la mayoría de los enfermos de Lyme en fase i fueron diagnosticados por los médicos de Atención Primaria, mientras que en los diferentes servicios del HULA predominaron los pacientes diagnosticados en fases ii y iiii de la enfermedad; comprobándose con χ2 que estas diferencias eran significativas (p<0,001).
Fases de la enfermedad de Lyme en la que fueron diagnosticados los pacientes al considerar quién realizó el diagnóstico
| Enfermos Lyme | Origen | Diagnóstico. N.° (%) |
|---|---|---|
| Fase I | CAP | 23 (65,7) |
| HULA | 6 (8,2) | |
| Fase II | HULA | 60 (82,2) |
| CAP | 9 (25,7) | |
| Fase III | HULA | 7 (9,6) |
| CAP | 3 (8,6) |
N.°: número de pacientes con diagnóstico confirmado de EL; (%): porcentaje.
En un estudio previo18, también con los datos de entre 2006 y 2013, y en los 41 ayuntamientos de este estudio, la tasa de incidencia de EL era de 48,34 por 100.000 habitantes. Al comparar esta tasa con el porcentaje de seropositividad de Borrelia spp. mediante el coeficiente de correlación de Spearman, se comprobó que estaban correlacionados positivamente (r=0,726; p<0,001). Por tanto, la detección de anticuerpos específicos frente a Borrelia es útil para un primer cribado serológico mediante ELISA y sirve para identificar zonas de riesgo. No obstante, es imprescindible su posterior confirmación mediante Western-Blot, para el diagnóstico definitivo de la enfermedad, excepto en aquellos pacientes con eritema migratorio1,6,16.
La seropositividad a Borrelia varía de unos países europeos a otros, oscilando entre el 5 y el 25%6,19, por lo que la hallada en este estudio (15,2%) se aproxima a los valores altos descritos en Europa.
La mayor seropositividad hallada por los médicos de los CAP (22,2%) respecto a la obtenida en el HULA (13,1%) coincide con los resultados obtenidos en Italia, donde los médicos de Atención Primaria también encontraron un mayor porcentaje de seropositivos entre personas en riesgo de EL (7,8%)18 que el detectado a nivel hospitalario (3,2%)5.
El porcentaje de seropositivos obtenido por los médicos de los CAP fue superior al hallado por los profesionales de otros CAP en Navarra (4,4%)10 o en Castilla y León (13,3%)3. No obstante, la seropositividad observada en los CAP resultó ligeramente más baja que la señalada en un estudio realizado en diversos centros de salud de Polonia (27-29%)7. El porcentaje de seropositivos a Borrelia detectado por los diversos servicios del HULA también fue superior al obtenido en los complejos hospitalarios de La Coruña (3,04%)20 y de Cartagena (3,7%)9.
Al igual que en nuestro estudio, otros autores señalan que la seropositividad a Borrelia es más baja en los residentes en zonas urbanas que en los del medio rural3,4, ya que estos últimos se dedican fundamentalmente a labores agrícolas y ganaderas que les obligan a un mayor contacto con la naturaleza10,21,22. Así mismo, los habitantes de la montaña presentaron mayor riesgo de infección por Borrelia que los de la meseta, probablemente debido a que están más expuestos a ser picados por garrapatas puesto que, en estudios previos, se comprobó que los animales de esta zona estaban más parasitados por I. ricinus2.
La seropositividad a Borrelia se incrementó con el transcurso de los años, siendo los médicos de los CAP los que detectaron un mayor número de muestras seropositivas a partir del año 2008. El conocimiento de esta alta seropositividad y su incremento en el tiempo favorecerán que el personal sanitario esté más sensibilizado frente al diagnóstico precoz de la EL y, en consecuencia, se instauren los correspondientes tratamientos que reducirán el riesgo de la aparición de secuelas1,12-14.
Hemos comprobado como todos los pacientes diagnosticados precozmente (fase i) evolucionaron hacia la curación completa sin secuelas, coincidiendo con lo descrito por otros autores13,23,24,25. La mayoría de los enfermos en fase i fueron diagnosticados por los médicos de los CAP, constatando la importancia de estos en el diagnóstico precoz y en la reducción de secuelas. La mayoría de los pacientes diagnosticados más tardíamente procedían fundamentalmente del HULA y presentaban secuelas en el 25% de los casos, lo que coincide con lo señalado por otros autores1,23,25.
Como conclusión, la detección de anticuerpos específicos frente a Borrelia es de gran utilidad para que los médicos de Atención Primaria identifiquen poblaciones de riesgo que les permitan alcanzar un mayor índice de sospecha de esta enfermedad, lo que ayudará a realizar un diagnóstico temprano, instaurando el correspondiente tratamiento y evitando las secuelas que conlleva esta enfermedad.
Considerando que la seropositividad a Borrelia se está incrementando en los últimos años, la identificación de zonas de riesgo por parte de los médicos de Atención Primaria permitirá recomendar las medidas de protección necesarias a la población para evitar la picadura de garrapata especialmente a las personas que realicen actividades al aire libre.
- –
La enfermedad de Lyme es una patología emergente en muchas zonas de Europa, cuyo diagnóstico se basa en clínica compatible y confirmación por serologías.
- –
La gran variedad de manifestaciones clínicas hace que su diagnóstico sea complejo. Un mejor conocimiento epidemiológico ayuda a optimizar el uso de las herramientas diagnósticas y terapéuticas disponibles.
- –
El diagnóstico precoz de la enfermedad es fundamental para la instauración de un tratamiento eficaz.
- –
El porcentaje de seropositividad fue superior en las muestras remitidas por los médicos de los Centros de Atención Primaria (CAP) que en las enviadas por los diferentes servicios del Hospital, y más elevada en los residentes del medio rural y en los habitantes de la montaña. Se observa una tendencia ascendente en el tiempo en el porcentaje anual de muestras seropositivas a Borrelia.
- –
La mayoría de los enfermos de Lyme en fase I o precoz fueron diagnosticados por los médicos de Atención Primaria y no presentaron secuelas, lo que confirma la importancia de los CAP en el diagnóstico precoz de esta enfermedad.
Los autores declaran no tener ningún conflicto de intereses.
Al Servicio de Microbiología del Hospital Carlos III, por su colaboración en la realización de este estudio. A la Secretaría General de Universidades por la concesión de una ayuda para la estructuración de Grupos de Investigación Competitiva, modalidad de Grupos de Referencia Competitiva (GRC2015/003, Xunta de Galicia).