Introducción
En el año 1993 realizamos una revisión de los antiagregantes plaquetarios y de sus indicaciones en la práctica clínica dirigiendo los comentarios sobre todo con relación a la atención primaria (AP)1. Creemos que ha transcurrido suficiente tiempo como para volver a hacer una nueva valoración del tema, intentando aportar nuevas proposiciones prácticas, a través de una revisión bibliográfica reciente.
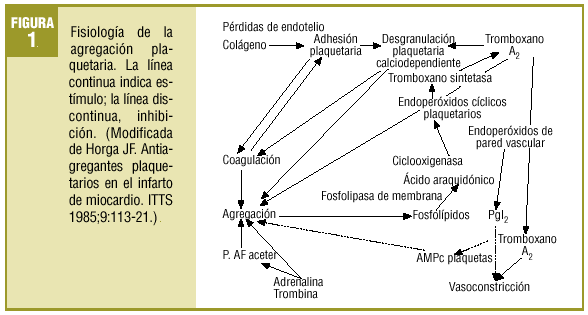
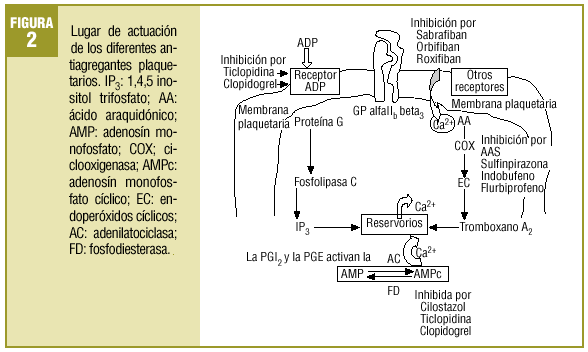
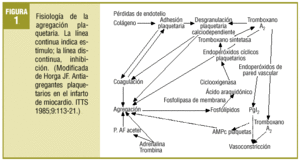
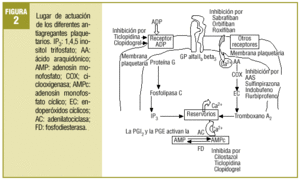
Comenzaba el mencionado artículo haciendo un repaso conceptual y fisiopatológico de los mecanismos de anticoagulación y de la actividad plaquetaria. Aun existiendo algunas variaciones menores, puede seguir siendo útil para explicar el fenómeno de la agregación plaquetaria el que se resume de nuevo en la figura 1. Se añade ahora un esquema sobre los lugares donde actúan los fármacos que se comentan, bien bloqueando activadores o activando enzimas que influyen en vías metabólicas liberadoras de Ca2+, agente final desencadenante de los procesos de agregación (fig. 2).
Continuaba dicha revisión comentando algunos fármacos sobre los que no existían aún datos provenientes de estudios controlados y, así, respecto al ácido eicosapentanoico se afirmaba: «en la práctica su uso como antiagregante plaquetario debe considerarse en fase de experimentación». Hoy sigue sin un desarrollo clínico práctico, sin que puedan hacerse recomendaciones definidas para su uso en AP.
Con respecto a la prostaciclina (PGI2) se afirmaba que «... debido a su vida media corta, su inestabilidad a pH neutro, su vía de administración y su propensión a originar efectos hipotensores, será difícil que se aplique en el futuro como fármaco de interés para su uso en procesos extrahospitalarios».
En efecto, debido a estas circunstancias no anuladas por compuestos de nueva síntesis, las prostaglandinas siguen estudiándose dentro de un contexto hospitalario. La PGI2 se ha ensayado en diabéticos, en los que se ha observado una mejoría en el dolor anginoso y curación de las úlceras dérmicas; sin embargo, es dudoso que esta terapéutica prevenga la amputación en las fases tardías de la enfermedad2.
Se han realizado dos estudios con la PGE1. En el primero de ellos3, con un número discreto de pacientes, se observó una mejoría espectacular en el grupo tratado con PGE1 frente a otros dos, uno tratado con ejercicio y otro con ejercicio más pentoxifilina por vía intravenosa. En el segundo4 (más reciente), con 1.560 pacientes, los resultados se revelaron más modestos y al cabo de los 6 meses la diferencia entre los grupos no fue significativa.
También se ha ensayado un compuesto, el AS-013 (un profármaco de la PGE1) con resultados esperanzadores, pero su investigación se ha detenido al detectarse dos importantes complicaciones: hipotensión grave y prolongada, y fibrilación auricular5.
Se puede concluir, pues, que en la práctica, a falta de compuestos orales, y dados los efectos hemodinámicos secundarios, así como la ausencia de una evidente superioridad de estos compuestos sobre agentes convencionales, como el ácido acetilsalicílico (AAS), estos fármacos siguen teniendo un uso limitado sin aplicación práctica en la clínica extrahospitalaria.
Con respecto al dipiridamol, inhibidor de la fosfodiesterasa que impide el paso del 3'5' AMPc plaquetario a AMP, se comentaba su indicación en pacientes con superficies valvulares artificiales, ya que, en algunos estudios, parecía favorecer la supervivencia de las mismas. Hoy cada vez es más escaso el número de usuarios que portan este tipo de prótesis y los que aún lo hacen suelen asociar anticoagulación oral (ACO), por lo que esta indicación no persistirá largo tiempo.
También se comentaba del dipiridamol: «En el tratamiento o la prevención de la isquemia cerebral transitoria (ICT) no ofrece beneficios adicionales asociado al AAS»6.
Hoy se está revaluando este aserto en función de los resultados del estudio ESPS, en el que se ha incluido a 6.602 pacientes que habían sufrido ataques isquémicos transitorios previos. Los resultados demuestran una reducción del riesgo del 18% con AAS solo, de un 16% con dipiridamol solo y de un 37% con dipiridamol más AAS frente a placebo7. Está pendiente de comprobar si estos resultados dependen de la mayor dosis de dipiridamol empleada en este ensayo (400 frente a 250 mg diarios) y de una biodisponibilidad mejorada recientemente en comparación con la formulación anterior, o bien refleja un mayor grupo de pacientes estudiados y, por tanto, un refuerzo estadístico importante frente a estudios anteriores.
Con respecto a su uso en patología coronaria, se puede seguir afirmando que, en la prevención secundaria de nuevos episodios en pacientes que han sufrido un infarto de miocardio (IM), no hay evidencias suficientes que demuestren su efectividad. La opinión general sigue siendo también que el dipiridamol asociado a AAS no ofrece claras ventajas frente a este último usado aisladamente en la prevención de fenómenos trombóticos y embolismos sobre superficies biológicas.
Pentoxifilina
No siendo propiamente un antiagregante plaquetario, se indicaba como tratamiento en la claudicación intermitente y se concluía que «los diferentes resultados de los diversos estudios hacen dudar de que la pentoxifilina ofrezca más beneficios en el tratamiento de la arteriopatía periférica que el entrenamiento...».
De nuevo, una revisión crítica de los ensayos realizados con pentoxifilina en la claudicación intermitente permite concluir que la mejoría real en la marcha, sin síntomas de claudicación, atribuible a la pentoxifilina es a menudo impredecible y puede no ser clínicamente importante cuando se compara con el placebo, no justificando el gasto añadido en muchos pacientes8. Con todo, se podría admitir su uso siempre que se hubiera abandonado el hábito tabáquico y existiera imposibilidad física para el entrenamiento.
Cilostazol
No se comentaba en la revisión citada, ya que es el agente más recientemente aprobado por la Food and Drug Administration (FDA) en el tratamiento de la claudicación intermitente. Se trata de un inhibidor de tipo III de la fosfodiesterasa y posee propiedades antiagregantes y vasodilatadoras. El mecanismo de actuación en el tratamiento de la claudicación intermitente se desconoce. Existen varios ensayos clínicos para valorar la efectividad de la sustancia. En el primero de ellos mejoró significativamente la distancia recorrida sin claudicación, comparado con el placebo; del mismo modo existieron más efectos colaterales en el grupo con cilostazol en forma de cefaleas (30%) y diarreas (12,6%)9. Otros dos estudios posteriores demuestran igualmente beneficios con este fármaco pero, contrariamente al ensayo anterior, sin complicaciones asociadas10-12. En la actualidad está comercializado en Japón y presumiblemente pronto estará disponible en Europa.
Ticlopidina
En la anterior revisión se comentaban los estudios CATS13 (ensayo clínico aleatorizado y doble ciego realizado para evaluar la prevención de la recurrencia de ictus con 250 mg/12 h), TASS14, que comparaba aleatoriamente a doble ciego la ticlopidina a dosis de 250 mg/12 h y 650 mg/12 h de AAS para la prevención del ictus y otras complicaciones cardiovasculares, y también se hacía referencia al STAI (Studio della Ticlopidina nell'Angine Instabile)15. Los resultados de estos estudios concluían en beneficios y auguraban un prometedor porvenir para el fármaco, siempre que fuera apoyado por índices de coste/beneficio positivos. De hecho, textualmente se afirmaba: «... Globalmente la mayoría de los autores determina que la ticlopidina es útil en prevención de recurrencias de episodios micro y macrovasculares, deduciéndose una disminución de riesgo de IM, de mortalidad cardiovascular en la angina inestable y de morbimortalidad cardiovascular en enfermos con ictus siendo más efectiva que el AAS en la ICT».
Sin embargo, y aunque el tiempo no haya negado estos asertos o aunque la FDA aprobara su uso para la prevención de ictus en pacientes que no toleran el AAS, los efectos adversos del fármaco (diarreas y exantemas) y, entre los más graves, las neutropenias (moderadas en el 2,4% de los casos pero con cifras de granulocitos inferiores a 450 * 109/l en otros) han dificultado su uso. Además, el hecho de que haya aparecido otra tienopiridina más efectiva y con menos efectos secundarios (el clopidogrel) ha sido determinante para que vaya cayendo, si no lo ha hecho ya, en desuso. Con todo, y aunque su indicación siga proviniendo del medio intrahospitalario, en AP deberemos seguir manteniendo los niveles de precaución en cuanto a los controles hemáticos (necesidad periódica de hemogramas) en pacientes aún tratados con ticlopidina.
Clopidogrel
Es un fármaco que comparte estructura bioquímica con la ticlopidina pero aporta mayor actividad antiagregante con menos efectos adversos. Se trata de una especialidad farmacéutica con receta médica y visado de inspección, pero dado que aumenta su indicación, consideramos adecuado hacer una breve revisión de este fármaco, ya que el médico de AP contará sin duda con pacientes que lo usen.
Como la ticlopidina, el clopidogrel basa su efecto en un metabolito generado tras su paso hepático (metabolismo dependiente del citocromo P-450) no siendo, por tanto, activo in vitro16. Su acción antiagregante es 100 veces superior a la de ticlopidina sin que exista efecto acumulativo con la administración prolongada17.
El clopidogrel inhibe irreversiblemente la agregación inducida por ADP, atenúa el bloqueo de la adenilciclasa inducido por el ADP y reduce el número de puntos de unión del ADP sin afectar la afinidad por el receptor. También inhibe la fosforilación de los residuos tirosina acoplada con la agregación18-21. Estos efectos son dependientes de la dosis; así, a altas dosis (375 mg o más) reduce la agregación plaquetaria mediada por el ADP; a dosis de carga (525 mg o más y a las 2 h de su ingesta) produce una inhibición completa, y a la dosis habitual (75 mg/día) produce, en enfermos con enfermedad vascular y a las 48 h de la toma, una reducción modesta de la agregación.
El lugar de actuación del clopidogrel parece radicar en la unión del ADP y en un efecto sobre el catabolismo de la adenilatociclasa22-26. No influye en la síntesis de la ciclooxigenasa o el tromboxano, en la de la fosfodiesterasa o en la incorporación de adenosina. El inicio del efecto antiagregante se da a las 2 h de administrar 75 mg/día, pero este tiempo se reduce a 30 min tras la administración de 350 mg como dosis de carga, hecho que puede interesar en algunos casos, como en la implantación de stents27.
Los estudios sobre su efecto en el crecimiento de los trombos tienen únicamente una base experimental, siendo la combinación de clopidogrel (75 mg/día) y AAS (350 mg/día) superior en efectividad a la acción del AAS solo28.
El clopidogrel también prolonga el tiempo de sangría en voluntarios sanos y en pacientes con enfermedad arteriosclerótica sintomática, efecto que disminuye en los 8 días siguientes a la interrupción del tratamiento23,29.
Propiedades farmacocinéticas
El clopidogrel se metaboliza rápidamente en el hígado tras su absorción en el tracto gastrointestinal. El principal metabolito y compuesto activo es un derivado carboxílico desesterificado que se detecta en individuos sanos en menos de 1 h de la administración oral del fármaco30. Se desconoce el efecto en el embarazo y la lactancia, por lo que no se aconseja su uso en estas circunstancias. También está contraindicado en la insuficiencia hepática grave y en situaciones de hemorragia patológica activa. No se debe utilizar en los primeros días tras un IM y entre sus recomendaciones aún no figuran el injerto aortocoronario y el ictus isquémico agudo de menos de 7 días de evolución. Si el paciente debe ser sometido a una intervención quirúrgica, debe suspenderse su administración 7 días antes. Como contraindicaciones relativas (extremar la vigilancia) figuran la insuficiencia renal y la insuficiencia hepática moderada.
Interacciones farmacocinéticas y farmacodinámicas
El AAS asociado al clopidogrel produce un alargamiento no significativo del tiempo de sangría sin modificarse la agregación inducida por ADP, lo que indica que se permite la administración simultánea de ambos fármacos, pero con las debidas precauciones. La asociación de clopidogrel y warfarina no es recomendable por aumentar la tendencia hemorrágica; sin embargo, no se ha demostrado ninguna interacción farmacológica entre el clopidogrel y la heparina cuando se administran a voluntarios sanos, aunque queda por evaluar la seguridad de esta asociación31.
No se han observado mayores efectos hemorrágicos en los pacientes tratados con el activador tisular del plasminógeno recombinante más heparina frente a otro grupo con el mismo tratamiento y AAS en lugar de heparina. Se desconoce el efecto con otros agentes trombolíticos. Existe un aumento de hemorragias cuando se asocian al tratamiento antiinflamatorios no esteroides. No se han observado modificaciones con los activadores (fenobarbital) o inhibidores (cimetidina) del citocromo P-450, agente que da origen al metabolito activo del fármaco.
Estudios de aplicación
El estudio CAPRIE32 (Clopidogrel versus Aspirin in Patients at Risks for Ischemic Events) se diseñó para valorar la hipótesis de que el clopidogrel (75 mg/día) era capaz de reducir los acontecimientos vasculares en los pacientes de alto riesgo vascular frente a la aspirina (325 mg/día) en al menos un 15%. El universo de la muestra consistía en pacientes con arteriosclerosis manifiesta con accidentes isquémicos recientes, IM reciente o enfermedad vascular periférica. Se incluyó a un total de 19.185 pacientes, y el seguimiento medio fue de 1,91 años. Los pacientes tratados con clopidogrel presentaron una incidencia de accidentes isquémicos del 5,32%, frente al 5,8% en el grupo con aspirina; esto supone una reducción relativa del 8,7%, lo que implica una prevención de un 26% más de acontecimientos a favor de este fármaco que frente al AAS. El porcentaje de accidentes cerebrales establecidos fue del 7,15 frente al 7,71% en el grupo con AAS, y la reducción relativa, del 7,3%. En pacientes con IM el efecto no fue superior al AAS; sin embargo, en los pacientes con enfermedad vascular periférica, un 3,71% presentó complicaciones, frente a un 4,86% en el grupo con AAS, lo que significa una reducción relativa del riesgo de un 23,5%32. Las ventajas del clopidogrel fueron las mismas con independencia de la magnitud de la aterosclerosis33.
El número de hemorragias intracraneales no mortales o de muertes por hemorragia en pacientes tratados con clopidogrel fue menor que con AAS34.
El estudio CURE35 (Clopidogrel in Unstable angina to prevent Recurrent Events) ha demostrado un beneficio clínico significativo del clopidogrel cuando se administra junto con AAS para el tratamiento de los síndromes coronarios agudos (angina inestable e infarto de miocardio no Q). Se ha comprobado una reducción relativa de la muerte de causa cardiovascular, IM o accidente cerebrovascular, existiendo un incremento de la tendencia hemorrágica que puede ser aceptable si se tienen en cuenta los beneficios observados.
En conclusión, el clopidogrel es un fármaco que tiene actualmente amplio predicamento, y están en marcha nuevos estudios para confirmar la reducción de acontecimientos ateroescleróticos en pacientes con antecedentes de ateroesclerosis sintomática (infarto cerebral isquémico, IM y arteriopatía periférica).
Ácido acetilsalicílico
Fármaco clásico y versátil que esconde todavía sorpresas terapéuticas y del que en el artículo anterior se destacaba que «... a dosis de tan sólo 1 mg/kg/día (y de forma prolongada) acetila irreversiblemente la ciclooxigenasa plaquetaria que transforma el ácido araquidónico en tromboxano A2 (TXA2)36. Con relación a su acción sobre la función plaquetaria y sobre el tiempo de hemorragia esta dosis realiza el mismo efecto que otra 10 veces mayor y con menor gastrolesividad37. Los estudios mejor diseñados con este fármaco se han realizado empleando dosis que oscilaban entre 100 y 1.500 mg observándose efectos antitrombóticos con bajo índice de gastrolesividad cuando se usaban dosis de 160 a 325 mg/24 h38». Asertos todavía válidos y a tener presentes cuando se indique este fármaco.
En la prevención primaria del IM se analizaban dos estudios, el American Physicians Health Study39 y el British Doctors Trial40, concluyéndose de ellos que no había razones para el empleo generalizado del AAS (fuera cual fuera la dosis) como forma de prevención primaria de la mortalidad cardiovascular en individuos sanos (se preconiza para prevención primaria actuar sobre los factores de riesgo cardiovascular conocidos). Esta propuesta sigue también vigente y se ve reforzada por los resultados de un trabajo reciente diseñado para valorar los beneficios de dosis bajas de AAS en pacientes con hipertensión41; del análisis colectivo, los datos aportados demuestran que el AAS reduce la probabilidad de IM, pero a costa de un riesgo significativo de complicaciones, incluido el accidente cerebrovascular.
Con respecto a la angina inestable y la mortalidad durante un infarto, se constatan las aserciones del artículo anterior apostando por su utilidad y añadiendo que nuevas revisiones de estudios ya realizados42 refieren que, en general, en los pacientes de alto riesgo, y en conjunto, la terapéutica antiplaquetaria (predominantemente con AAS) reduce el IM no fatal en un tercio de los casos y la muerte vascular casi en un cuarto. Y eso a pesar de que los acontecimientos cardíacos que ocurren mientras se está tomando AAS se consideran a menudo «fracasos de la terapéutica», cuando la naturaleza del acontecimiento y el resultado clínico deberían ser considerados cuidadosamente, ya que los pacientes con síndromes coronarios agudos es menos probable que sufran una elevación del segmento ST o un IM si han tomado AAS en los días o semanas previos al proceso cardíaco43.
Para el médico de AP tiene que seguir siendo inexcusable la presencia de AAS en su botiquín de urgencias y su administración oral ante la sospecha de un IM agudo desde que el ISIS-244 determinara el beneficio de su pronta administración al disminuir la mortalidad cardiovascular y la frecuencia de reinfarto no fatal a la quinta semana, aun usado solo pero dentro de las primeras 24 horas (el estudio se realizó asociando estreptocinasa y los resultados mejoraban claramente al asociarse).
Además, esta práctica presenta escasas contraindicaciones en relación con el potencial beneficio y no aumenta el riesgo hemorrágico posterior.
En la prevención secundaria del IM su utilización sigue apuntalada por el metaanálisis de 6 ensayos, donde se constata una disminución de la mortalidad global en pacientes con IM del 8-13%45. En conjunto se admite que el AAS disminuye la mortalidad o el riesgo de presentación de nuevo infarto46,47, siendo ésta una indicación aprobada por la FDA48. Al parecer debe instaurarse antes de los 6 meses tras el diagnóstico49, aunque también se valoran los resultados de un ensayo50 en el que el AAS instaurado varios años tras el padecimiento de un IM disminuía la mortalidad total y la incidencia de procesos coronarios.
¿Cuánto tiempo dura la protección y a qué dosis debe mantenerse? El mayor efecto beneficioso se observa en el primer año y va descendiendo, sin que existan todavía datos que avalen su eficacia tras dos años de sufrir el IM, exceptuando el caso del anterior comentario. En estas indicaciones de larga duración se siguen prefiriendo dosis pequeñas (100-300 mg/24 h), pues son las que ofrecen más relación riesgo-beneficio, asociadas o no, según casos clínicos, a anticoagulación oral u otros antiagregantes.
En la enfermedad de la válvula mitral (prevención de embolismos) el AAS continúa siendo una opción de segunda línea después de que el estudio AFASAK51 y otros52,53 concluyeran que la warfarina es de uso indiscutible (estenosis mitral con fibrilación auricular o con antecedentes de embolia sistémica o aurícula mayor de 55 mm medida por ecografía). Sólo cuando existe contraindicación para la anticoagulación puede usarse el AAS a dosis de 325 mg/24 h de forma indefinida.
Los beneficios del AAS en la fibrilación auricular de origen no valvular siguen siendo discutidos, aunque algunos autores lo indican si existe contraindicación para la anticoagulación.
En la ICT o el accidente vascular cerebral transitorio (AVC), en el anterior artículo comentábamos que, a partir del análisis de diversos estudios, la FDA había autorizado el uso de AAS para la prevención de la ICT en varones48. La autorización persiste. En general se infiere que el AAS puede ser útil en la prevención secundaria del AVC en varones no diabéticos y sin IM previo. Nuevas aportaciones del año 1997, como el ITS (International Stroke Trial)54 y el Chinese Acute Stroke Trial55, valoran el uso de AAS en una dosis diaria de 300 mg y 160 mg, respectivamente, en casi 40.000 pacientes con ICT. El tratamiento se inició a las 48 h del comienzo de los síntomas y continuó de dos a 4 semanas. Los resultados combinados demuestran un beneficio absoluto en el primer mes de tratamiento, aunque el riesgo de AVC hemorrágico se incrementara. Se confirma que la administración a largo plazo de AAS reduce las probabilidades de AVC en pacientes con ICT o AVC menores56.
En conjunto, los metaanálisis realizados han confirmado que la terapéutica antiplaquetaria con AAS protege frente a los acontecimientos vasculares en pacientes con angina estable, claudicación intermitente y (si los anticoagulantes están contraindicados) en situaciones de fibrilación auricular.
La terapia debe iniciarse tempranamente, y en lo que se refiere a la patología vascular cerebral, preferiblemente en la fase isquémica aguda del ataque cerebral, debiendo ser continuada a largo plazo. La dosis diaria de AAS de 75 a 150 mg parece ser tan efectiva como las dosis altas en tratamientos a largo plazo (el clopidogrel constituye una opción apropiada en los pacientes con contraindicación al mismo).
La asociación a corto plazo de inhibidores de la glucoproteína beta3 con aspirina previene frente a los accidentes vasculares en pacientes con intervenciones coronarias percutáneas y en aquellos con angina inestable pero, como contrapartida, la tendencia hemorrágica es mayor57.
La asociación de dosis bajas de AAS (100 mg/día) a la vitamina E (300 mg/día), para aprovechar el efecto antioxidante de la última, no ha demostrado efectos concluyentes en los estudios realizados58.
Inhibidores reversibles de la ciclooxigenasa (COX)
Respecto a los inhibidores reversibles de la COX que han sido probados en ensayos aleatorizados se encuentran la sulfinpirazona, el indobufeno y el flurbiprofeno.
Como se comentaba, la sulfinpirazona originaba discrepancias en cuanto a su utilidad como preventivo de acontecimientos cardiovasculares estando sólo indicada en pacientes intolerantes al AAS59 o en asociación con anticoagulación oral en pacientes portadores de válvulas mecánicas antiguas (potenciación del efecto de los cumarínicos)60. También se comentaba que parecía disminuir la tasa de oclusión de los injertos de vena safena61. Las dudas persisten y los resultados negativos respecto a su efectividad en la prevención secundaria del IM (o en lo que respecta a la patología vasculocerebral) ya no sólo provienen de las carencias metodológicas de los ensayos realizados62-66, sino de la constatación in vitro de su débil efecto inhibidor sobre las plaquetas. No sucede así con la potencia del indobufeno, que inhibe la formación sérica de TXB2 y reduce la excreción urinaria de TXA2 en la misma proporción que el AAS, aunque ninguno de los estudios, que han incluido en total a más de 4.000 pacientes para valorar su efecto en enfermos con riesgo embólico cardíaco, ha revelado beneficios superiores a los tratamientos convencionales67.
El flurbiprofeno se ha evaluado en un ensayo68 frente a placebo en un total de 461 pacientes que han sufrido infarto agudo de miocardio. El porcentaje de reinfartos a los 6 meses fue menor en el grupo tratado (3%) que en el placebo (10,5%); sin embargo, el tamaño de la muestra limita la interpretación de los resultados.
Otros agentes
Triflusal
A esta sustancia se le ha reconocido una acción estimulante de la producción de óxido nítrico (NO) en los neutrófilos. Estas células inhiben tanto la agregación como la secreción plaquetaria, pero sólo la agregación es dependiente del NO69.
El triflusal ha demostrado en varios estudios aleatorizados que tiene una eficacia similar al AAS en la prevención de los acontecimientos cardiovasculares tras el infarto de miocardio y, además, sin sus efectos indeseables70; sin embargo, sus indicaciones se restringen a situaciones en las que está contraindicado el primero.
Inhibidores orales de la glucoproteína IIb/IIIa (*Iibß3)
Recientemente se han desarrollado inhibidores no peptídicos que, administrados por vía oral, inhiben la glucoproteína *Iibß3, receptor responsable de la última fase de la agregación plaquetaria; sin embargo, se enfrentan a una serie de problemas no resueltos, como son el desconocimiento del bloqueo óptimo de los receptores para maximizar la seguridad, eficacia y la dificultad para establecer pruebas de laboratorio (como la agregación al ADP) con objeto de monitorizar su efecto. El mayor ensayo clínico ya completado se ha realizado con el sibrafibán. Se trata del SYMPHONY71, que agrupa a 9.233 pacientes con síndromes coronarios agudos estabilizados, los cuales se aleatorizaron bien con AAS, bien con altas o bajas dosis de sibrafibán. La incidencia, como punto final de muerte, reinfarto no fatal o isquemia recurrente aguda, fue la misma en los grupos con AAS y en los de altas o bajas dosis de sibrafibán. La incidencia de hemorragias fue mayor en el de los inhibidores de los receptores.
Otros dos grandes ensayos con antagonistas de la glucoproteína *Iibß3, el OPUS y el EXCITE72, se interrumpieron prematuramente debido a un exceso de mortalidad en uno de los grupos en el que se usaba el orbifibán, mortalidad que se atribuyó a trombosis coronaria, lo que ha llevado a pensar que estos agentes pueden causar efectos paradójicos.
Los antagonistas de la *Iibß3 no han demostrado ser más útiles en la profilaxis cuando se comparan con el AAS o incluso con la ticlopidina; sin embargo, la aparición de nuevos agentes con nuevas formulaciones, como el roxifibán, que se disocia más lentamente de las plaquetas, o la creación de nuevos métodos de control de la terapéutica con ellos está en marcha y hace de esta línea de investigación una de las más prometedoras73.
Conclusiones
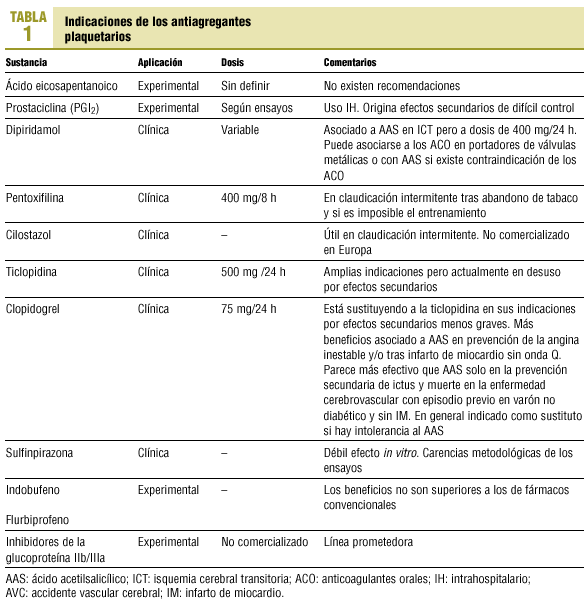
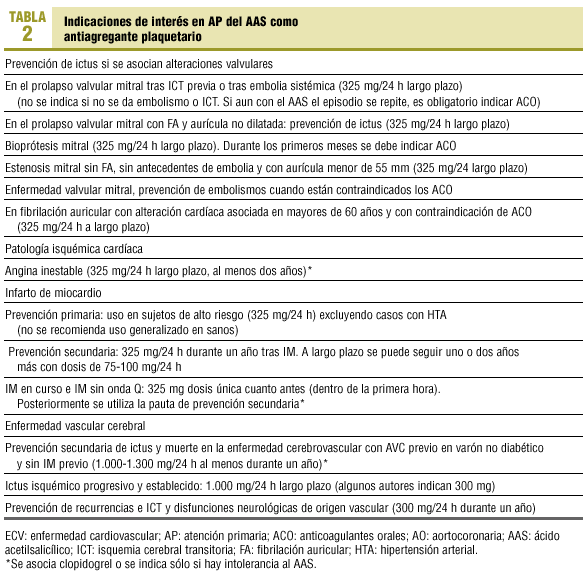
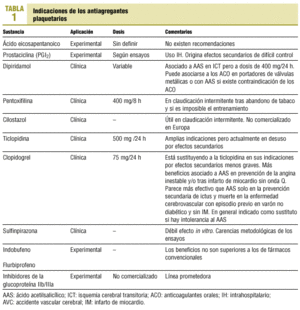
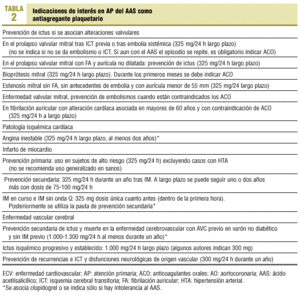
Para el médico práctico de AP siguen siendo útiles (con exclusiones y modificaciones) las indicaciones del tratamiento antiplaquetario que resumíamos en 1993 (tablas 1 y 2).
Si exceptuamos la aparición del clopidogrel (de uso hospitalario) en estos 8 años no ha habido grandes aportaciones farmacológicas y, sin embargo, el paso del tiempo sí ha reforzado la afirmación con que cerrábamos aquel artículo: «No se debe olvidar que el fenómeno trombótico tiene otras «cerraduras» de apertura más sencilla para acceder a la salud. Eliminar hábitos favorecedores de este tipo de patología será siempre más importante y oportuno que confiar a una sustancia el remedio de lo que pudo haberse evitado».