Programa de Actividades Preventivas y de Promoción de la Salud-PAPPS 2024
Más datosEl cáncer es una de las principales causas de morbimortalidad. Los factores medioambientales junto con el estilo de vida: el consumo de tabaco y alcohol, la dieta poco saludable, el sedentarismo y la falta de actividad física, son algunos de los factores de riesgo que han provocado un aumento del cáncer.
En este artículo se actualizan las evidencias y las recomendaciones de las estrategias de prevención para el cáncer a través del cribado en los pacientes asintomáticos, así como la detección temprana de los signos y síntomas en la población de riesgo medio y de riesgo elevado.
Cancer is one of the main causes of morbidity and mortality. Environmental factors along with lifestyle: tobacco and alcohol consumption, unhealthy diet and sedentary lifestyle and lack of physical activity, are some of the risk factors that have caused an increase in cancer.
This article updates the evidence and recommendations for cancer prevention strategies through screening in asymptomatic patients, as well as early detection of signs and symptoms in medium-risk and high-risk populations.
El cáncer es una de las principales causas de muerte, y una limitación importante para aumentar la esperanza de vida en todos los países del mundo3,4. En la población general, el cáncer es la segunda causa de muerte después de las enfermedades del aparato circulatorio, aunque en los varones es, desde el año 2000, la primera causa de muerte. En 2022, un 24,7% de todas las defunciones fueron a causa del cáncer5 siendo el número de defunciones por cáncer de 232 por cada 100.000 (tasa de mortalidad). Los tumores fueron la primera causa de muerte en los varones (con 280 fallecidos por cada 100.000 varones) y la segunda en mujeres (con 185 por cada 100.000 mujeres). El número de defunciones por tumores descendió un 0,9% entre los varones, mientras que aumentó un 1% en las mujeres6.
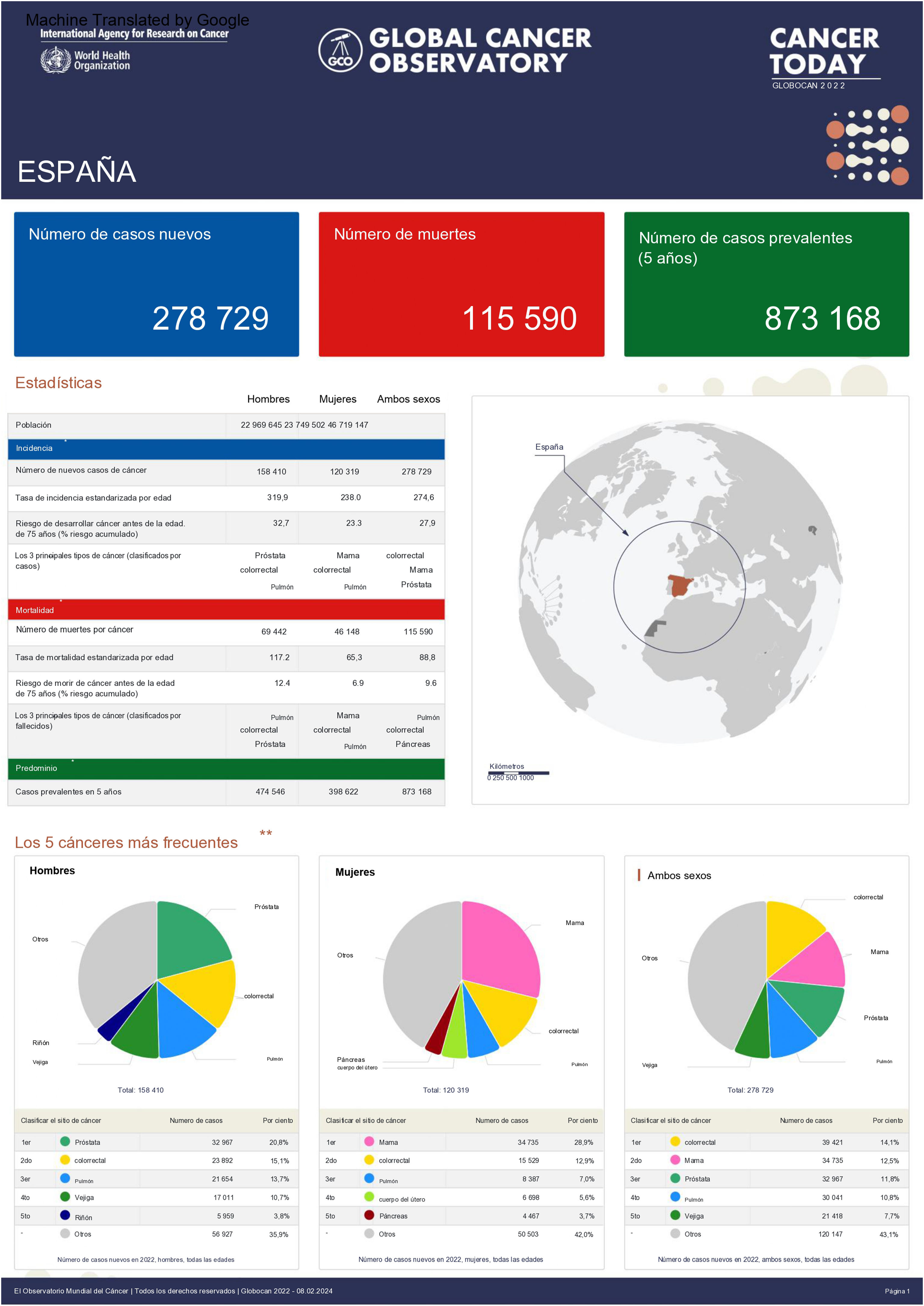
En el conjunto de la población, el tumor más frecuente es el de colon y recto con un total de 44.294 nuevos casos (29.648 de colon y 14.646 de recto). Le siguen el cáncer de mama (CM) femenina con 36.395 nuevos casos, el cáncer de pulmón (CP) con 32.768 nuevos casos y el de próstata con 30.316 nuevos casos. A más distancia se sitúa el cáncer de vejiga urinaria con 22.097 nuevos casos (fig. 1). Por sexos, los cánceres más frecuentes en los varones fueron el de próstata (30.316 casos), colon y recto (27.009), pulmón (22.483 casos) y vejiga urinaria (18.247 casos). En las mujeres los más frecuentes fueron el de mama (36.395 casos), colon y recto (17.285 casos), pulmón (10.285 casos) y cuerpo uterino (7.305 casos).
Infografía sobre incidencia y mortalidad de los cánceres más frecuentes en España.
Fuente: globocan: https://gco.iarc.fr/today/en/fact-sheets-cancers7.
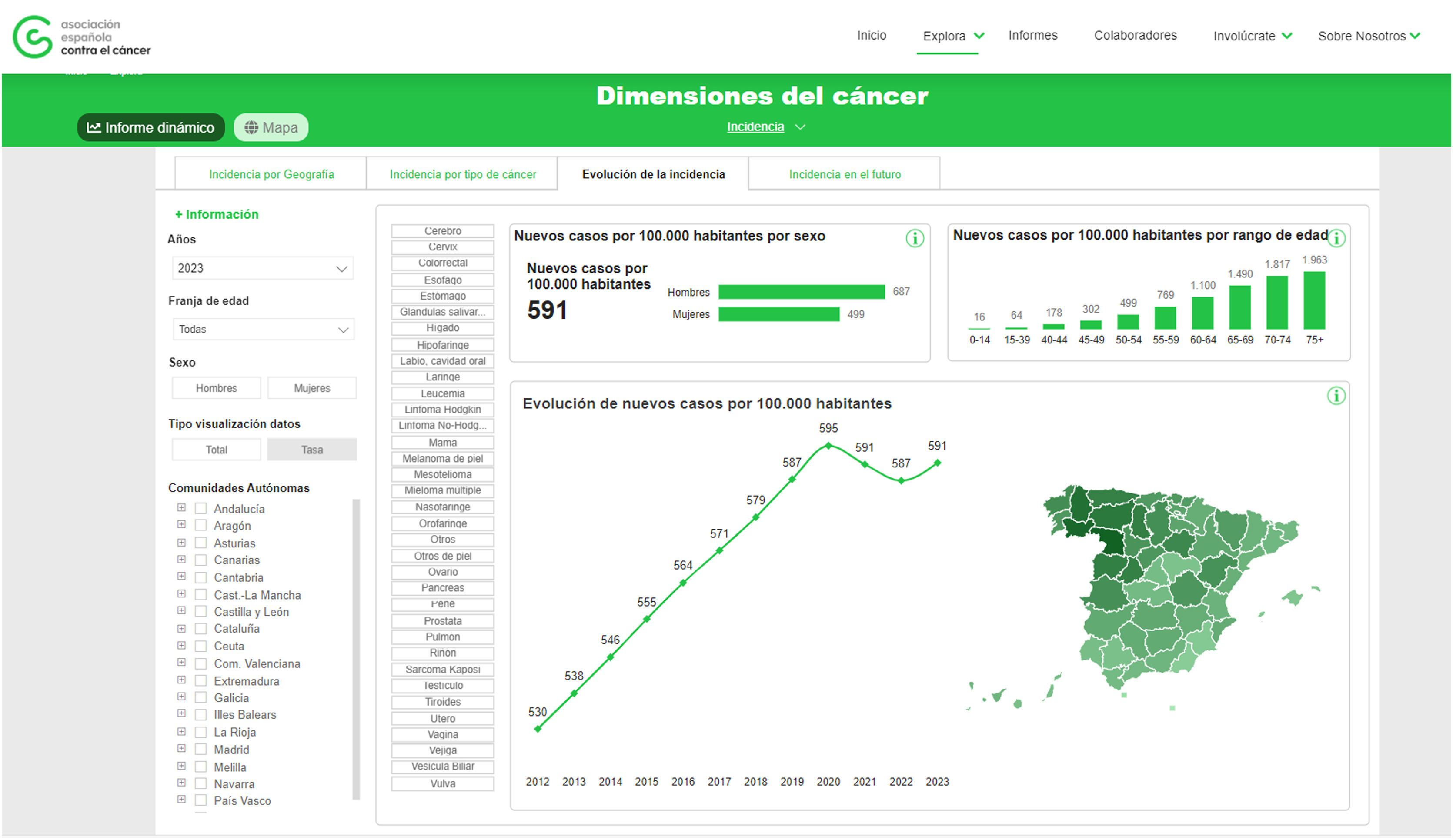
La incidencia global del cáncer ha seguido aumentando a causa del envejecimiento de la población y de la tendencia creciente de estilos de vida poco saludables (fig. 2).
Evolución de la incidencia del cáncer en España (casos nuevos por 100.000 habitantes).
Fuente: Observatorio del cáncer: https://observatorio.contraelcancer.es/explora/dimensiones-del-cancer)8.
Considerando todos los cánceres en global, ha aumentado la estimación de la supervivencia a los 5 años de un cáncer, es decir, la probabilidad de sobrevivir desde el diagnóstico y en ausencia de otras causas de muerte. Comparando el periodo 2002-2007 con 2008-2013, en los varones pasó del 52 al 55,3%, y en las mujeres del 59,1 al 61,7%9.
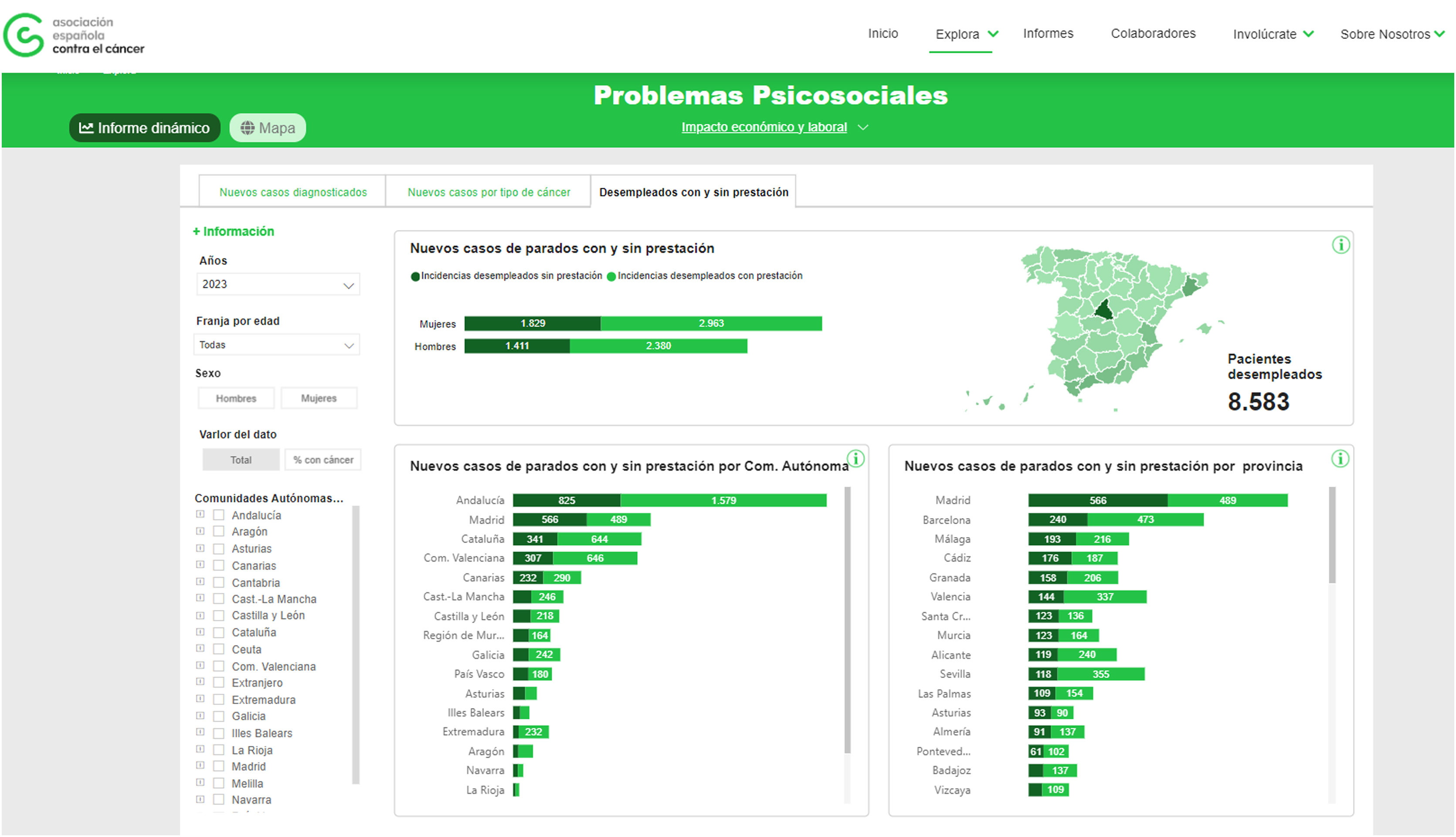
La carga del cáncer va más allá de la magnitud en términos de incidencia, mortalidad, prevalencia, pues también tiene consecuencias en términos de impacto laboral y económico en los/las pacientes y en sus familias8. En general, el cáncer es un proceso que requiere una incapacidad temporal en algún momento durante la enfermedad y los tratamientos. La mayor parte de las bajas por cáncer van a tener una duración media entre 280 y 365 días. La situación sociolaboral en el momento del diagnóstico condiciona claramente las consecuencias que la enfermedad va a tener en los diferentes aspectos de la vida de la persona con cáncer. Un diagnóstico de cáncer puede ser el causante y/o agravante de un riesgo socioeconómico para la subsistencia de la persona y su familia (fig. 3).
Nuevos casos de cáncer en las personas en situación de desempleo con o sin prestación.
Fuente: Observatorio del cáncer: https://observatorio.contraelcancer.es/explora/problemas-psicosociales)8.
El cáncer es el resultado de la interacción multifactorial entre los factores genéticos del paciente y agentes externos (estilos de vida y carcinógenos ambientales).
Los estilos de vida no son otra cosa que comportamientos relacionados con la salud. Como cualquier otra conducta, su adquisición y mantenimiento se relacionan íntimamente con el contexto en el que el individuo se desarrolla. De este contexto destacan por su influencia los determinantes socioeconómicos y los comerciales, tal y como se explicará más adelante. La conceptualización de los estilos de vida como hábitos individuales elegidos libremente impide afrontar su relación con el contexto y, por lo tanto, diseñar medidas estructurales aguas arriba que reduzcan su prevalencia.
En general, los cánceres esporádicos aparecen en edades avanzadas (a partir de los 50 años) y son consecuencia de mutaciones que afectan a las células somáticas adquiridas a lo largo de los años. El cáncer hereditario representa entre un 5-10% de los cánceres10,11, y la edad de presentación del cáncer es más precoz. Sin embargo, ser portador de una mutación genética no siempre implica que se desarrolle el cáncer y que se manifieste la enfermedad10,11. El conocimiento de la historia familiar permite identificar a aquellos individuos con un posible síndrome de predisposición hereditaria al cáncer (SPHC), en cuyo caso deben ser dirigidos a unidades de consejo genético para, en caso necesario, realizar el test genético, asesorar y recomendar vigilancia específica a los portadores (cribados en la población de alto riesgo). Los nuevos avances tecnológicos permiten, cada vez más, una mejor comprensión de la biología y la genética del cáncer hereditario y de los SPHC. Hasta la fecha se han descrito más de 200 SPHC10,11.
A nivel práctico, la estratificación del riesgo individual de cáncer se basa en la edad, los antecedentes personales (enfermedades predisponentes y factores de riesgo) y los antecedentes familiares12. Con esta información es posible clasificar el riesgo individual en 3 categorías: riesgo bajo (menos de 50 años, sin antecedentes personales ni familiares de cáncer), riesgo medio (50 o más años, sin antecedentes personales ni familiares de cáncer) y riesgo elevado (cualquier edad, con antecedentes personales y/o familiares de cáncer). El valor predictivo positivo (VPP) de las pruebas de cribado varía en función de la categoría de riesgo.
Factores de riesgo y prevención primariaEl tabaco es la principal causa de cáncer y de muerte por cáncer. La disminución de las tasas de tabaquismo y el aumento de las tasas de obesidad hace pensar que en las próximas décadas la obesidad desplazará al tabaco como principal factor de riesgo de cáncer evitable13. La dieta saludable, el consumo moderado de alcohol, el control de peso y la actividad física pueden prevenir un tercio de los cánceres más comunes14. Las desigualdades socioeconómicas condicionan los estilos de vida saludables y los patrones de comportamiento. Asimismo, en grupos de población específicos, son factores de riesgo destacables la exposición a carcinógenos ocupacionales, la contaminación atmosférica, los agentes infecciosos y determinados aspectos de la vida sexual y reproductiva.
Diversos factores de riesgo en relación con el cambio climático pueden afectar al control del cáncer, principalmente la contaminación atmosférica (partículas en el aire, diésel, etc.), la exposición a la radiación ultravioleta, las alteraciones en la calidad y suministro de alimentos y agua, la exposición a tóxicos industriales y, posiblemente, las causas infecciosas del cáncer15. Estos factores están asociados principalmente al CP y de las vías respiratorias superiores, cáncer de piel, del tracto gastrointestinal y de hígado15. En 1993, la Agencia Internacional de Investigación sobre el Cáncer (IARC) reconoció la contaminación ambiental como factor cancerígeno para humanos del grupo I16. Más recientemente, también se han identificado los llamados «determinantes comerciales de la salud», que apuntan a los efectos nocivos que ciertos intereses comerciales y económicos tienen para la salud de las poblaciones como, por ejemplo, la comercialización masiva de productos poco saludables como comida rápida o bebidas azucaradas diseñados, distribuidos y publicitados con el objetivo de influenciar el comportamiento de la población para aumentar su consumo17.
Ante este complejo panorama de amenazas para la salud poblacional, la prevención de enfermedades y la promoción de estilos de vida saludables se presentan como medidas fundamentales e imprescindibles, que deben impulsarse a nivel político y económico, y no solo desde las sociedades científicas o el sistema sanitario. Además, es fundamental que involucren a toda la comunidad. Por ello, es primordial el papel de estrategias comunitarias (fundamentadas en la evidencia y medibles con indicadores objetivos)18.
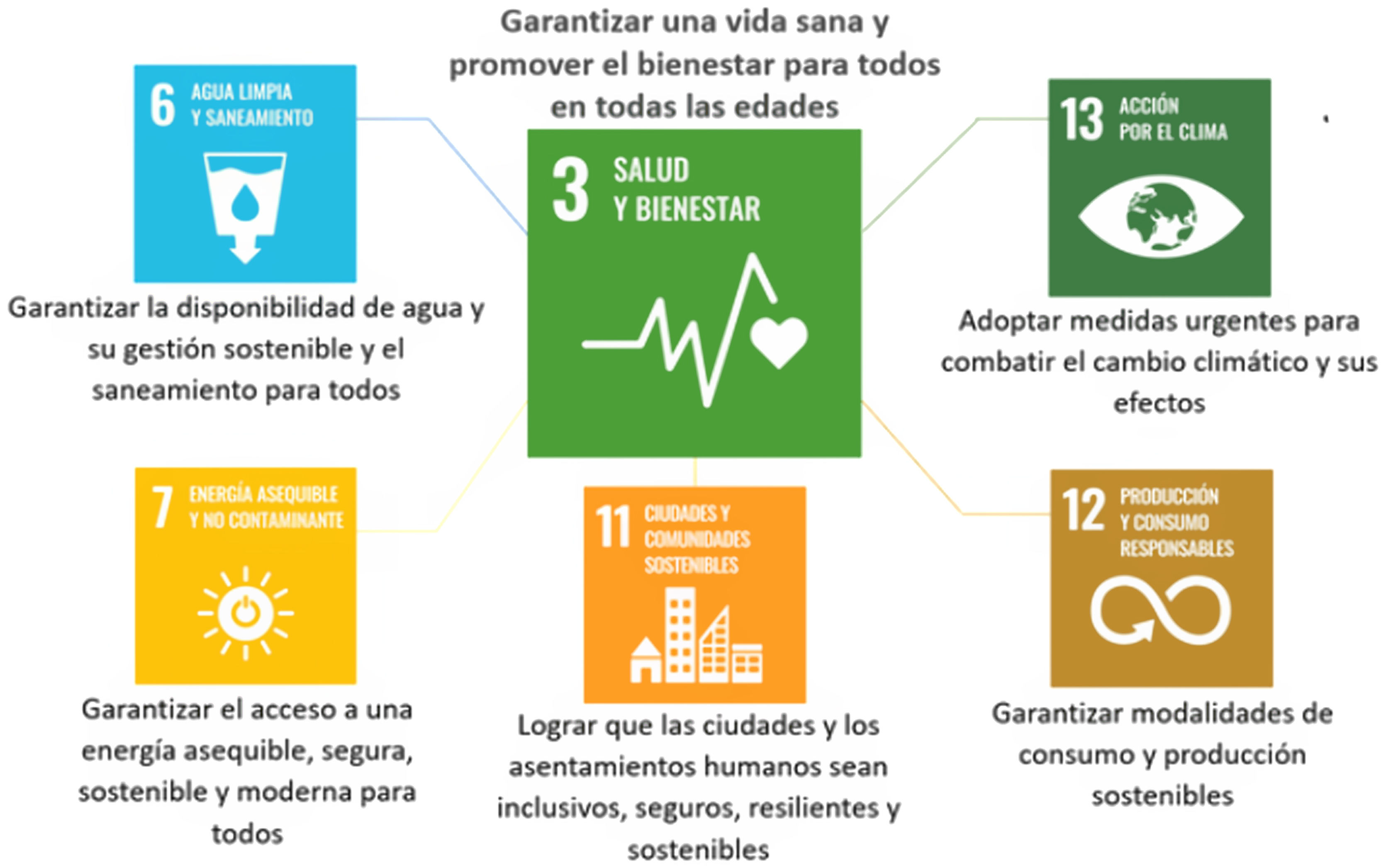
La Asamblea General de las Naciones Unidas adoptó la Agenda 2030 para el Desarrollo Sostenible. En ella se describe como un medioambiente saludable es vital para «garantizar una vida sana y promover el bienestar para todos en todas las edades». El objetivo 3 aborda los determinantes ambientales de la salud incluyendo 5 objetivos que contribuyen directa e indirectamente a su consecución: temas de agua, saneamiento e higiene, calidad del aire, seguridad química, y acción por el clima (fig. 4).
Objetivo 3 de la Agenda 2030 para el Desarrollo Sostenible de la Asamblea General de las Naciones Unidas junto con los 5 objetivos asociados para conseguirlo.
Fuente: Organización Panamericana de la Salud19: https://www.paho.org/es/temas/determinantes-ambientales-salud.
El microbioma humano, considerado un actor en el mantenimiento de la salud humana, al verse alterado puede contribuir al desarrollo de diferentes enfermedades, entre ellas el riesgo de desarrollar cáncer20.
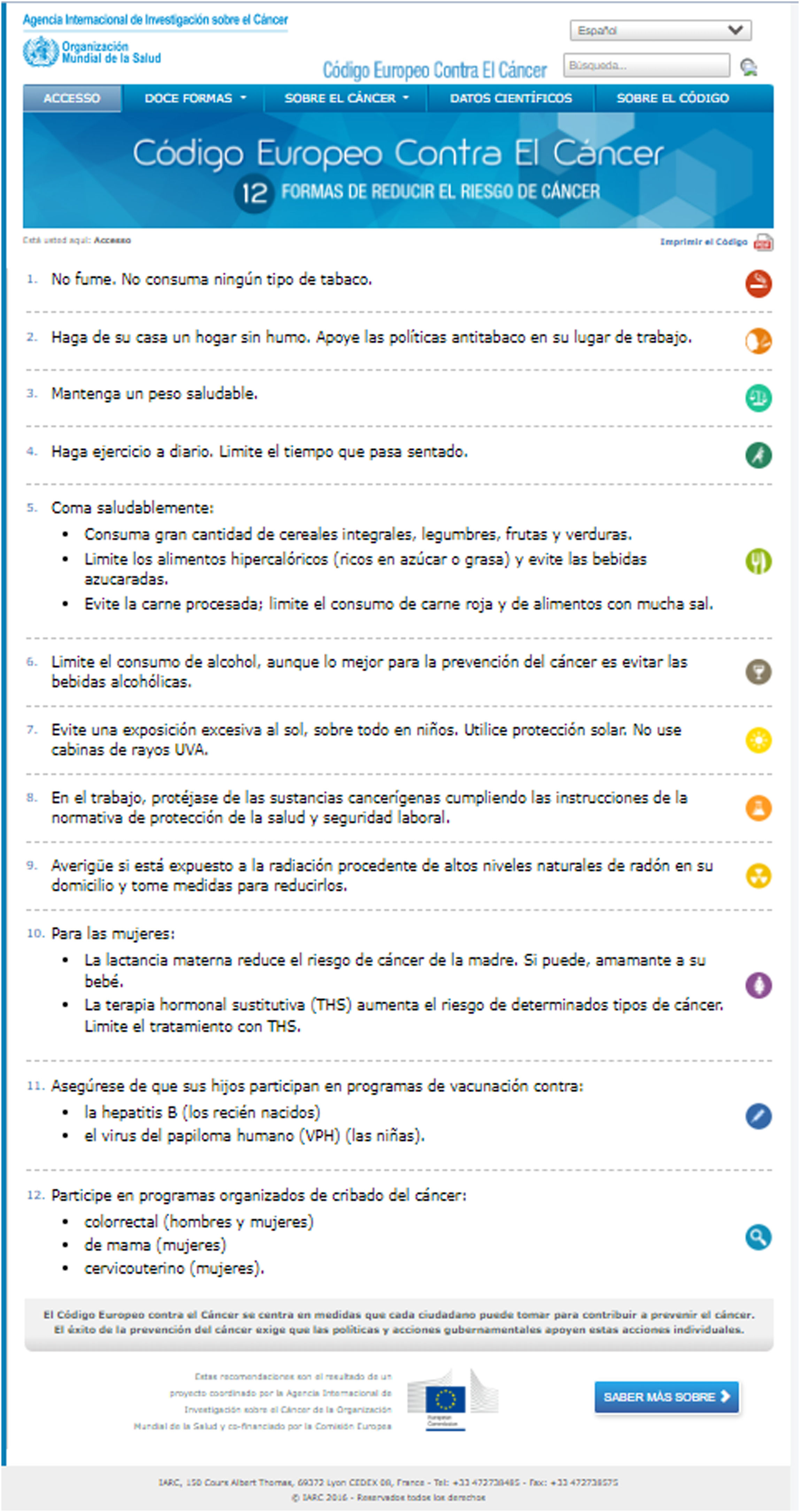
En la tabla 1 se describen los factores de riesgo y factores de protección asociados de forma más significativa a los diferentes tipos de cáncer. El Código Europeo Contra el Cáncer21 insiste en las recomendaciones sobre prevención de los principales factores de riesgo de cáncer (fig. 5). El World Cancer Research Fund22 remarca las recomendaciones en relación con la dieta, alimentación, peso y ejercicio físico, para reducir el riesgo de cáncer y aumentar la supervivencia (fig. 6).
Factores de riesgo y factores protectores para cáncer
| Factores de riesgo | Factores protectores |
|---|---|
| Cáncer de mama47 | |
| • Edad, sexo femenino, raza blanca, talla alta | • Actividad física vigorosa regular |
| • Obesidad en mujeres posmenopáusicas (estrógenos, hiperinsulinemia) | • En mujeres posmenopáusicas, dieta baja en grasas y pérdida de peso |
| • Lesiones proliferativas mama, tejido mamario denso, densidad mama | • Lactancia materna |
| • Estrógenos endógenos (exposición prolongada a altas concentraciones de estrógenos) | • Quimioprevención: tamoxifeno, raloxifeno, inhibidores aromatasa |
| • Uso de TH combinada en la menopausia a largo plazo | • Mastectomía profiláctica |
| • Factores reproductivos: menarquia temprana (<12 años), menopausia tardía (>52 años), nuliparidad, primer embarazo en edad avanzada | |
| • Antecedentes personales de CDIS o cáncer invasivo mayor riesgo de cáncer de mama contralateral | |
| • Antecedentes familiares cáncer mama de primer grado y factores hereditarios: mutaciones BRCA1 y BRCA2 (SCHMO), TP53 (Li Fraument), PTEN (Cowden, Bannayan-Riley-Ruvalcaba), PALB2 | |
| • Consumo de alcohol, tabaco, trabajar en turno de noche | |
| • Exposición a radiaciones ionizantes terapéuticas | |
| Cáncer de cuello de útero66 | |
| • Factores asociados a infección persistente por el VPH: inicio temprano relaciones sexuales, múltiples parejas sexuales, pareja sexual de alto riesgo, antecedentes de ETS (Chlamydia, herpes genital), antecedentes de neoplasia intraepitelial escamosa, vulvar o vagina o de cáncer, inmunosupresión (portadora de VIH, tratamiento inmunosupresor) | • Cribado adecuado• Parejas sexuales son varones circuncidados |
| • Nivel socioeconómico bajo, raza (mujeres negras no hispanas) | |
| • Anticonceptivos orales | |
| • Tabaco (carcinoma de células escamosas) | |
| • Historia familiar y diversos polimorfismos | |
| Cáncer de endometrio tipo 1 (bajo grado e histología endometrioide)86 | |
| • Exposición a largo plazo a estrógenos endógenos o exógenos (TH) sin una adecuada oposición de progestágenos | • Anticonceptivos (estrógeno-progesterona, o progesterona sola) |
| • Tamoxifeno en mujeres posmenopáusicas (cáncer de mama) | • Número de embarazos y paridad |
| • Anovulación crónica (climaterio y síndrome de ovario poliquístico) | • Maternidad en edad avanzada |
| • Obesidad | • Lactancia materna |
| • Diabetes | • Tabaco en mujeres posmenopáusicas |
| • Tumor de los cordones sexuales y del estroma del ovario e hiperplasia endometrial | • Actividad física |
| • Menarquia temprana, menopausia tardía y nuliparidad | • Dieta (consumo de café y té) |
| • Factores hereditarios: mutaciones MMR (síndrome de Lynch); mutaciones identificadas PTEN (síndrome de Cowden); historia familiar de primer grado de cáncer de endometrio | |
| Cáncer de ovario87 | |
| • Edad, mujeres ≥50 años | • Anticonceptivos |
| • Menarquia temprana, menopausia tardía y nuliparidad | • Número de embarazos |
| • Endometriosis (carcinoma células claras, endometrioide) | • Lactancia materna |
| • Tabaco (para el tipo histológico mucinoso) | • Histerectomía y ligadura de trompas |
| • Asbesto | |
| • Radiación pélvica | |
| • Factores hereditarios: mutaciones BRCA1 y BRCA2 (SCHMO). Mutaciones MMR (síndrome de Lynch) | |
| Cáncer colorrectal104 | |
| • Edad, mujeres ≥50 años | • Actividad física |
| • Factores hereditarios: síndrome de Lynch, poliposis adenomatosa familiar. Otras mutaciones de elevada penetrancia: APC, biallelic MUTYH, BRCA1 y BRCA2, PALB2, CDKN2A y TP53 | • Dieta rica en vegetales crucíferos, fruta, cereales integrales, calcio y productos lácteos, folatos |
| • Historia personal/familiar de pólipos (adenomas, pólipos serrados) adenomatosos y CCR esporádico | • Quimioprevención: ácido acetilsalicílico y otros antiinflamatorios no esteroideos |
| • Colitis ulcerosa, enfermedad de Crohn | |
| • Exposición a radiaciones ionizantes terapéuticas (cáncer de próstata) | |
| • Fibrosis quística | |
| • Raza (afroamericanos) | |
| • Acromegalia | |
| • Obesidad, diabetes e hiperinsulinemia, sedentarismo | |
| • Dieta (carne procesada y roja) | |
| • Tabaco y alcohol | |
| • Terapia de privación de andrógenos a largo plazo | |
| Cáncer de páncreas (adenocarcinoma ductal)126,132 | |
| • Edad, raza negra | • Actividad física |
| • Tabaco, alcohol | • Dieta rica en frutas, vegetales, granos integrales, leche y otras pautas de dieta saludable |
| • Obesidad, IMC, talla alta | |
| • Infecciones: hepatitis B, Helicobacter pylori | |
| • Sedentarismo | |
| • Diabetes mellitus (no está claro si es causa o consecuencia) | |
| • Dieta rica en carne roja y procesada, alcohol, bebidas ricas en fructosa, ácidos grasos | |
| • Pancreatitis crónica no hereditaria | |
| • Entre el 10-15% atribuibles a causas genéticas: a) cáncer asociado a síndromes hereditarios: mama y ovario (BRCA1, BRCA2), melanoma de nevo múltiple atípico familiar (CDKN2A), Peutz-Jeghers (STK 11), pancreatitis hereditaria (PRSS1, SPINK1), Lynch (MLH1) y ataxia-telangiectasia; b) cáncer de páncreas familiar de primer grado | |
| Cáncer de próstata133 | |
| • La edad es el factor de riesgo más importante, sobre todo a partir de los 50 años | • Dieta rica en vegetales crucíferos (brócoli y coliflor), licopenos (tomate, sandía, albaricoque, arándanos, frutos rojos), fitoestrógenos, café |
| • Origen étnico: ascendencia africana y ocurre en edades más tempranas | |
| • Factores genéticos, especialmente mutaciones de la línea germinal en los genes de reparación del ADN (BRCA2) y pueden estar asociados con enfermedad más agresiva | |
| • Antecedentes del cáncer de próstata y otros cánceres en familiares de primer grado | |
| • Dieta (carne roja, productos lácteos) | |
| • Obesidad y sedentarismo | |
| Cáncer de pulmón144 | |
| • Consumo de tabaco: cigarrillos mayor riesgo que puros o pipa | • Dieta rica en antioxidantes, vegetales crucíferos, fitoestrógenos |
| • Exposición ambiental o laboral al humo del tabaco, asbesto, radón, metales (arsénico, cromo y níquel), radiación ionizante e hidrocarburos aromáticos policíclicos | |
| • Humo en interiores de combustibles de biomasa sin procesar, como madera o carbón (cocina, calefacción) | |
| • Exposición a radiaciones ionizantes terapéuticas (linfoma de Hodgkin, cáncer mama) (los nuevos equipos y la planificación de las dosis reducen el riesgo) | |
| • Fibrosis pulmonar, sarcoidosis, esclerodermia, TBC, EPOC | |
| • Individuos con infección por VIH | |
| • Antecedentes familiares de primer grado de cáncer pulmón diagnosticados en edad joven | |
| Melanoma157 | |
| • Exposición solar intensa e intermitente en áreas expuestas esporádicamente (espalda en los varones, piernas en las mujeres) o crónicamente (cabeza y cuello); múltiples quemaduras solares en la infancia | • Protección solar: limitar la exposición y usar protector solar, sombreros y ropa de protección solar |
| • Psoraleno y fototerapia con UVA (PUVA) | |
| • Lámparas y camas de bronceado | |
| • Piel y ojos claros, pelo rubio o pelirrojo | |
| • Número de nevus (>25), nevus congénito, nevus displásicos o atípicos (>1), síndrome del melanoma múltiple y melanoma atípico familiar (50-100 nevus atípicos) | |
| • Historia personal de melanoma y de cáncer de piel basocelular o escamoso | |
| • Historia familiar y factores hereditarios: mutación genes BRAF, NRAS, CDKN2A | |
| • Pacientes inmunosuprimidos: trasplantes de órganos, linfoma, VIH | |
| Cáncer de tiroides172 | |
| • Antecedentes de exposición a la radiación durante la infancia | |
| • Antecedentes de cáncer de tiroides en un familiar de primer grado o antecedentes familiares de un síndrome de cáncer de tiroides (poliposis familiar, complejo de Carney, neoplasia endocrina múltiple tipo 2 [MEN2], síndrome de Werner o síndrome de Cowden) | |
CDIS: carcinoma ductal in situ; CCR: cáncer colorrectal; EPOC: enfermedad pulmonar obstructiva crónica; ETS: enfermedades de transmisión sexual; IMC: índice masa corporal; SCHMO: síndrome de cáncer hereditario de mama y ovario; TBC: tuberculosis; TH: tratamiento hormonal; UVA: rayos ultravioleta A; VPH: virus del papiloma humano; VIH: virus de la inmunodeficiencia humana.
Código europeo contra el cáncer.
Fuente: Código europeo contra el cáncer21: https://cancer-code-europe.iarc.fr/index.php/es/.
Recomendaciones para reducir el riesgo del cáncer y aumentar la supervivencia del cáncer, con relación a la dieta, la nutrición, la actividad física y el peso.
Fuente: World Cancer Research Fund International22: https://www.wcrf.org/diet-activity-and-cancer/cancer-prevention-recommendations/.
La atención primaria de salud es el marco idóneo para recomendar intervenciones de prevención primaria del cáncer, ya que brinda acceso y cobertura universal. Las intervenciones breves en la consulta para disminuir el consumo de riesgo de alcohol o el abandono del tabaco son efectivas para cambiar las conductas de salud de los pacientes, y también pueden mejorar las conductas dietéticas a corto plazo, aunque la evidencia del cambio de comportamiento a largo plazo es limitada. Las intervenciones sobre el estilo de vida se pueden consultar en las recomendaciones del grupo de expertos del PAPPS sobre estilos de vida23.
Prevención secundariaEl objetivo del cribado es detectar el cáncer antes de que se manifieste clínicamente, con la finalidad de poder ofrecer un tratamiento precoz y aportar beneficios a las personas en términos de reducción de la mortalidad y aumento de la calidad de vida24. Un cribado se considera poblacional cuando de forma sistemática se invita a toda la población diana definida, garantizando los principios de eficiencia y equidad. Los cribados poblacionales están organizados e integrados en el sistema de salud y son evaluados de forma continua. Los cribados oportunistas (case-finding) son los que se solicitan y/o son realizados en la consulta, a iniciativa del profesional o a petición del paciente, y están dirigidos a personas de riesgo medio y riesgo elevado24.
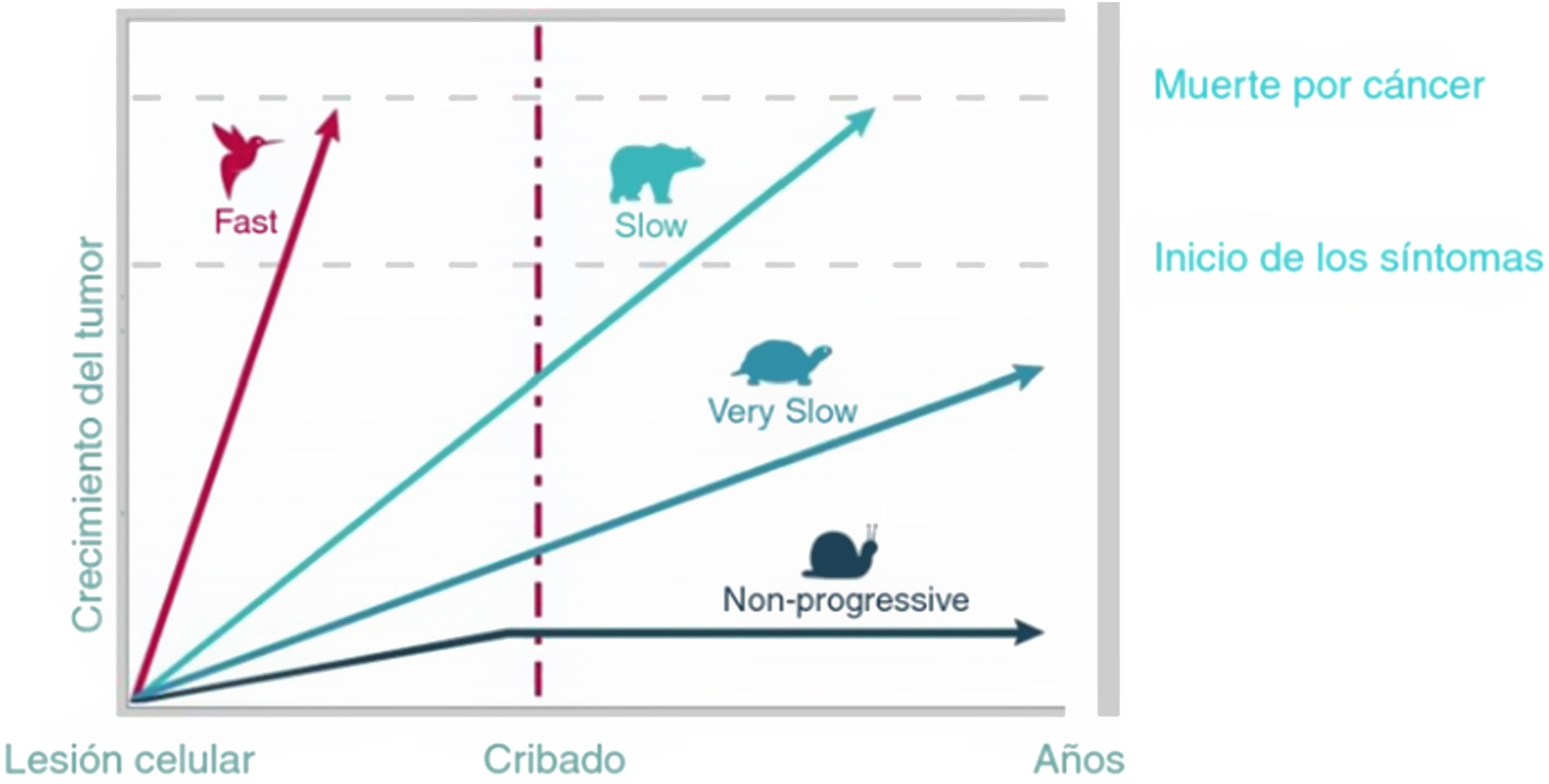
No obstante, la progresión del cáncer está influida por el órgano y el tejido en el que se origina y por la biología del tumor. En la figura 7 se muestran los diferentes modelos de progresión de distintos cánceres. Solo cuando los tumores crecen lenta pero progresivamente el cribado resulta eficaz25.
Heterogeneidad de la progresión del cáncer.
Fuente: Adaptado de Welch y Black25:https://doi.org/10.1093/jnci/djq099.
Los cribados pueden presentar riesgos, principalmente falsos positivos y exposición a pruebas adicionales innecesarias, falsos negativos, sobrediagnóstico y sobretratamiento de lesiones indolentes. El sobrediagnóstico se define como el diagnóstico de una condición/enfermedad que nunca causaría síntomas en la vida de la persona25,26. La enfermedad se detecta correctamente, pero el diagnóstico es irrelevante. El sobrediagnóstico del cáncer es consecuencia de la no progresión tumoral o bien, de la mortalidad competitiva debida a otras causas (el paciente morirá a consecuencia de otra enfermedad antes de que el cáncer cause síntomas)25,26. El sobrediagnóstico del cáncer convierte a personas asintomáticas, en principio sanas, en enfermas (etiquetadas de por vida), conduce a tratamientos innecesarios (cirugía, quimioterapia, radioterapia, tratamientos sustitutivos) que, al no aportar ningún beneficio en términos de salud, solo causan daño físico y psicosocial (efectos secundarios a corto, medio y largo plazo)25,26. El aumento de la supervivencia podría erróneamente interpretarse como consecuencia de la eficacia del cribado, cuando en realidad se debe a la detección de tumores de nulo o lento crecimiento.
Cualquier estrategia y modalidad de cribado requiere informar a las personas sobre el balance entre beneficios y riesgos, tener en cuenta los valores y las preferencias personales, garantizar la calidad de las pruebas de cribado y la accesibilidad a las pruebas de confirmación diagnóstica en un plazo de tiempo adecuado24. Asimismo, el coste de los cribados no debería ser una carga onerosa para el sistema de salud24.
El Código Europeo Contra el Cáncer recomienda el cribado de cáncer poblacional de cuello de útero, colorrectal y de mama21 (fig. 5), que son los 3 cribados poblacionales actualmente contemplados en la actualización de la Estrategia en Cáncer del Sistema Nacional de Salud (SNS)9 e incluidos en la cartera de servicios como prestación básica del SNS27. A nivel europeo, en marzo de 2022, el grupo de asesoramiento científico y tecnológico de la Comisión Europea (GCSA) lanzó una propuesta para actualizar la Recomendación del Consejo Europeo de diciembre de 2003 (2003/878/CE) sobre el cribado del cáncer28, centrada en la mejora de la participación de los programas de cribado existentes. Una de las iniciativas del Europe's Beating Cancer Plan es garantizar que, en 2025, se ofrezca el cribado del CM, cervical y colorrectal al 90% de la población29. Asimismo, plantea extender los programas de cribado del CP y de próstata. A su vez, aconseja aprovechar el rápido desarrollo de las posibilidades tecnológicas y los conocimientos científicos para optimizar el diagnóstico precoz y el cribado del cáncer basado en el riesgo y hacerlo extensivo a toda la UE. Actualmente se están incorporando biomarcadores genéticos y se generaliza la disponibilidad de perfiles genéticos en los puntos de atención que permiten disponer de modelos de riesgo más precisos.
La atención primaria tiene un importante papel en el desarrollo de los programas de cribado del cáncer, con diversas funciones como la promoción, captación y selección de personas teniendo en cuenta el riesgo de desarrollar el cáncer, las decisiones informadas y el seguimiento de los casos positivos30. Sin embargo, en la mayoría de las comunidades autónomas (CC. AA.) y, también, en los países europeos, los programas de cribado recomendados (CM, cáncer colorrectal [CCR] y cáncer de cuello de útero [CCU]) suelen funcionar de forma independiente de la atención primaria, ignorando las oportunidades que este nivel asistencial podría aportar para mejorar el cribado, promoviendo la aceptación y la elección informada31.
Detección temprana de signos y síntomas de cáncerLa mayoría de los cánceres que se presentan en atención primaria (AP) son sintomáticos, incluso cuando existe el cribado poblacional para determinados cánceres. Los cánceres que presentan síntomas necesitan un diagnóstico rápido para ser tratados con éxito. Las médicas y médicos de familia son a menudo el primer contacto del paciente con el servicio sanitario, son quienes deciden qué pruebas hacer y cuándo y dónde derivar al paciente. Según una encuesta realizada en el Reino Unido, el 80% de los pacientes diagnosticados de cáncer han consultado previamente a sus médicas o médicos de atención primaria una o 2 veces antes de ser derivados a la atención secundaria y el 20% restante, necesita 3 o más consultas32. Esto es debido a que los VPP de los síntomas y los signos para el diagnóstico de cáncer en AP, son generalmente bajos, dada la alta frecuencia de los síntomas consultados y la baja incidencia del cáncer en la población general atendida en las consultas de atención primaria. Una médica o un médico de familia del Reino Unido a tiempo completo diagnosticarán un cáncer en uno de sus pacientes cada mes33. El principal reto para atención primaria consiste en mantener un difícil equilibrio entre evitar intervenciones innecesarias o inapropiadas y no demorar las actuaciones necesarias ante síntomas de alarma34. Sin embargo, el nivel de riesgo de cáncer que un paciente y su médica o médico están dispuestos a aceptar varía.
A lo largo de las últimas décadas se han desarrollado cientos de modelos y algoritmos validados para cuantificar el riesgo de cáncer a partir de los síntomas en entornos de atención primaria basados en datos clínicos y/o analíticos35: como las herramientas de evaluación de riesgos CAPER sobre 15 tumores basadas en los VPP de Cancer Research UK (disponible en: https://www.cancerresearchuk.org/sites/default/files/rats.pdf), con un sistema de colores para los VPP: menos del 1% blanco, del 1 al 2% amarillo, del 2 al 5% naranja y más del 5% rojo. Las recomendaciones NICE, desde 2015, consideran que un VPP deL 3% es suficiente para iniciar el proceso diagnóstico36.
Además estos modelos se han traducido en herramientas electrónicas de apoyo a la toma de decisiones sobre el cáncer para uso clínico como la desarrollada para el CP por el gobierno de Australia (disponible en: https://islcguide.canceraustralia.gov.au/) o las derivaciones de la vía rápida del National Institute for Health and Care Excellence NICE en el Reino Unido, actualizadas en 2023 (disponible en: https://www.nice.org.uk/guidance/NG12) que han servido de base para el diseño de un mapa mental denominado «mapa del cáncer» basado en los síntomas que presenta un paciente (disponible en: https://www.gatewayc.org.uk/cancer-maps/). En la tabla 2 se describen los signos y síntomas con mayor VPP para los cánceres más comunes y las recomendaciones adecuadas en cada caso37.
Signos y síntomas con mayor valor predictivo positivo para distintos tipos de cáncer y recomendaciones
| Tipo | Signos y síntomas | Recomendación |
|---|---|---|
| Mama | Nódulo mamario con o sin dolor | Mamografía o ecografía (jóvenes) antes de 2 semanas |
| Adenopatía axilar unilateral | ||
| Retracción pezón y cambios en la forma de la mama | ||
| Telorrea/telorragia unilateral | ||
| Edema, eritema, celulitis, ulceración | ||
| Cuello uterino | Sangrado vaginal anormal espontáneo o poscoital | Colposcopia y biopsia dirigida antes de 2 semanas |
| Secreción vaginal | ||
| Dolor o presión en la zona pelviana | ||
| Endometrio | Metrorragia posmenopáusica | Ecografía y legrado endometrial antes de 2 semanas |
| Secreción vaginal | La biopsia endometrial es esencial para el diagnóstico y no puede ser sustituida por la imagen | |
| Hematuria | ||
| Trombocitosis | ||
| Ovario | Persistencia (>3 semanas) o frecuencia (>12 veces al mes) uno o más de estos síntomas: | Ascitis o masa abdomino-pélvica palpable: derivación urgente |
| • Dolor abdominal o pélvico | Ca-125>35 o ecografía indicativa: derivación antes de 2 semanas | |
| • Saciedad precoz o pérdida de apetito | ||
| • Hinchazón o distensión abdominal | ||
| • Urgencia o frecuencia urinaria (excluyendo otras causas) | ||
| • Cambio del ritmo intestinal | ||
| • Dolor de espalda o costal | ||
| • Hemorragia vaginal anómala | ||
| • Pérdida de peso, fatiga inexplicada | ||
| • Masa abdomino-pélvica (no miomas) | ||
| • Ascitis | ||
| Colorrectal | Rectorragia más: | Masa abdominal o rectal palpable y oclusión intestinal, derivación urgente: |
| • Cambio de hábito intestinal (aumento de frecuencia y disminución de consistencia) | Colonoscopia antes de 2 semanas | |
| • Moco en heces | ||
| • Ausencia de síntomas anales (prurito, escozor, dolor) | ||
| • Anemia ferropénica en >60 años (<12g/dl varones y <11g/dl mujeres) <12g/dl varones y <11g/dl mujeres | ||
| • SOH+ | ||
| • Cambio del ritmo intestinal >3 meses | ||
| • Masa abdominal o rectal palpable | ||
| • Oclusión intestinal | ||
| • Pérdida de peso y dolor abdominal | ||
| Páncreas | Diarrea | Dolor abdominal con pérdida de peso en ≥60 años, considerar TC antes de 2 semanas, y en caso de no disponibilidad, ecografía urgente |
| Dolor de espalda | ||
| Dolor abdominal | ||
| Náuseas | ||
| Vómitos | ||
| Estreñimiento | ||
| Diabetes de nueva aparición | ||
| Próstata | Dificultad para iniciar la micción, polaquiuria, disminución de la fuerza, goteo terminal, nicturia, obstrucción, disuria | Tacto rectal sospechoso o PSA elevado: biopsia transrectal dirigida por ecografía antes de 2 semanas |
| Hematuria | ||
| Hemospermia | ||
| Eyaculación dolorosa | ||
| Disfunción eréctil | ||
| Dolor óseo (metástasis) | ||
| Pulmón | Hemoptisis | Hemoptisis inexplicada o radiografía de tórax sugestiva: |
| Persistencia (>3 semanas) de: | Broncoscopia antes de 2 semanas | |
| Dolor torácico | ||
| Cambios en la tos o expectoración | ||
| Disfonía | ||
| Disnea | ||
| Neumonía de lenta resolución o de repetición | ||
| Acropaquia, trombocitosis | ||
| Adenopatía supraclavicular o cervical | ||
| Síndrome tóxico acompañado de cualquiera de los anteriores síntomas | ||
| Signos de compresión de la vena cava superior | ||
| Estridor laríngeo | ||
| Melanoma | Cambio del tamaño, forma o color, ulceración de un nevus | Dermatoscopia indicativa: resección quirúrgica |
| A. Asimetría | antes de 2 semanas | |
| B. Bordes irregulares | ||
| C. Color no uniforme | ||
| D. Diámetro >7mm de crecimiento rápido | ||
| Tiroides | Nódulo tiroideo con o sin adenopatía cervical | Ecografía de tiroides y PAAF antes de 2 semanas |
PAAF: punción aspiración aguja fina; PSA: antígeno prostático específico; SOH: sangre oculta heces; TC: tomografía computarizada.
Fuente: Adaptado de Suspected cancer: recognition and referral NICE guidelines37.
Otras herramientas desarrolladas como la QCancer Oxford permiten conocer el riesgo de padecer cáncer hoy (disponible en: https://qcancer.org/) o de 11 tipos diferentes de tumores en los próximos 10 años (disponible en: https://qcancer.org/10yr/).
La implementación de estas herramientas ha arrojado resultados mixtos. Un estudio que probó herramientas de evaluación de riesgos para el CP e intestinal encontró por un lado que su uso aumentó las solicitudes de radiografías de tórax, las colonoscopias y las interconsultas preferentes/urgentes y, por otro lado, aumentaron los diagnósticos de cáncer38.
Los circuitos de diagnóstico rápido (CDR), ya sean vías específicas y/o preferentes, desde la AP a la atención secundaria por tipo de tumor o multidisciplinarios, tienen como objetivo reducir el tiempo entre la sospecha fundamentada de cáncer, la confirmación diagnóstica y el inicio del tratamiento. Reducir la demora atribuible al sistema sanitario puede contribuir a reducir la ansiedad que experimenta una persona en estas circunstancias, a un diagnóstico y tratamiento más tempranos y a la mejora de la calidad de todo el proceso asistencial.
El tiempo transcurrido desde la aparición del primer síntoma hasta el inicio del tratamiento está influenciado por una combinación de factores sociodemográficos, culturales y clínicos del paciente, la biología del tumor y, también, del acceso y las características del sistema sanitario (listas de espera, acceso a pruebas desde la atención primaria a la atención hospitalaria).
Prevención terciariaSu finalidad es mejorar la calidad de vida del paciente largo superviviente de cáncer, mediante rehabilitación, cuidados paliativos, detección precoz de recidivas y medidas preventivas39. Se considera como largo superviviente de cáncer a aquella persona que se encuentra libre de enfermedad a los 5 años del diagnóstico y el tratamiento40. Un estudio europeo reveló una supervivencia a 5 años del 77% para el cáncer de próstata (CPR), del 82% para el de mama, pero solo del 57% en colon41.
El impacto psicosocial del cáncer es considerable, con supervivientes que presentarán hasta en un 20% otros cánceres, por lo que es necesario diseñar programas basados en la evidencia para la vigilancia de las recurrencias, y secuelas moderadas/graves y efectos tardíos físicos y psicosociales a corto, medio o largo plazo, requiriendo atención continuada40,42. Se ha enfatizado en la necesidad de programas integrales de promoción de la salud, coordinación de la atención a diferentes niveles tanto sanitarios como sociales, rehabilitación, apoyo emocional y cuidados paliativos durante todo el proceso oncológico que permitan garantizar la calidad de vida de estos pacientes40,42.
Prevención cuaternariaSe entiende como «la intervención que evita o atenúa las consecuencias de la actividad innecesaria o excesiva del sistema sanitario»43, y trataría de evitar que la actividad sanitaria, dirigida en este caso a la prevención, no provocase cadenas diagnósticas o terapéuticas innecesarias o imprudentes que terminasen provocando un daño innecesario y formaría parte de la necesaria «seguridad del paciente»43.
Recomendaciones de prevención del cáncer específicas por tipo de tumorCáncer de mamaEl CM es el cáncer más frecuente en la mujer a nivel mundial. En España, en 2024 sigue siendo la primera causa de muerte por cáncer en la mujer5. La tendencia es que está aumentando la incidencia, pero la mortalidad disminuye y su alta supervivencia (85,5% a los 5 años), conlleva una prevalencia elevada. Esto se explicaría por un grado de efectividad en las políticas de prevención tanto primaria como secundaria y en las mejoras terapéuticas5.
La historia natural del CM, que es generalmente de evolución lenta y progresiva, permite la detección precoz mediante una prueba de cribado, que en este caso es la mamografía. Se estima que el cribado, en la población de riesgo medio, mediante mamografía reduce la mortalidad por CM entre un 15-20% y se evitará una muerte por CM por cada 235 mujeres cribadas durante 20 años, pero no se ha encontrado que disminuya la mortalidad por todas las causas44. Los programas de cribado han contribuido a que aumente la incidencia de los carcinomas ductales in situ (CDIS) que antes de estos cribados apenas se diagnosticaron. Existe controversia sobre si el CDIS es la etapa ideal para la detección temprana del CM, o si representa un sobrediagnóstico. Esta es una de las razones por las que existe controversia en este cribado, a lo que hay que añadir los riesgos no ajenos a los cribados, como los falsos positivos o negativos, entre otros muchos, y que, por ser de evolución lenta, podría detectar tumores que posiblemente no producirían síntomas durante la vida de la mujer, con el consiguiente sobrediagnóstico. Se estima que el sobrediagnóstico alcanza más del 19% de los casos detectados por cribado y algunos estudios del 50%. Al ser una enfermedad que tiene gran impacto emocional y psicológico, el sobrediagnóstico, y el tratamiento innecesario, se considera el efecto adverso más grave de la detección precoz45,46.
En la tabla 1 se describen los factores de riesgo del CM47. Aproximadamente la mitad de los cánceres de mama pueden explicarse por factores reproductivos y la enfermedad mamaria proliferativa47. Un 10% adicional está asociado a los antecedentes familiares y hereditarios. En estos casos, y aunque es un tema controvertido y en estudio en la actualidad, se sugiere, dependiendo de la historia familiar, tener en cuenta la edad de la familiar con CM más joven para determinar la edad de comienzo del cribado48.
Las mutaciones en los genes BRCA1 y BRCA2 aumentan el riesgo del CM del 45 al 65% a los 70 años. El riesgo de cáncer de ovario, trompa de Falopio o peritoneal primario aumenta un 39% para las mutaciones BRCA1 y del 10 al 17% para las mutaciones BRCA249. Las variantes patogénicas de los genes BRCA1 y BRCA2 representan la mayoría de los cánceres de mama hereditarios y se utilizan, cada vez más, para determinar cómo seleccionar la terapia con inhibidores de PARP (PARPi) del cáncer relacionado con BRCA. Debido a que los problemas de las pruebas de BRCA en la práctica clínica se superponen con el manejo preventivo y terapéutico, se necesitan guías prácticas actualizadas y completas. Para el genotipado de BRCA se encargó a un grupo de expertos internacionales la elaboración de una guía de práctica clínica que orientase en estas directrices50. Aunque hay controversia en la edad de comienzo y de finalización, en la periodicidad y el tipo de prueba, se sugiere empezar desde los 25-30 años, siendo la propuesta más aceptada realizar cada 12 meses ecografía mamaria y/o resonancia magnética (RM) (en algunas guías alternando ambas) hasta los 40-50 años. A partir de esa edad mamografía y/o RM (por su mayor sensibilidad en mamas densas) acompañado del cribado disponible para cáncer de ovario (ver apartado de cáncer de ovario más adelante)48.
En antecedentes de radioterapia torácica antes de los 30 años, se sugiere comenzar con 25 años o 8 años después de la radioterapia, lo que sea más tarde de las 2 cosas48.
En la revisión sistemática de Cochrane de 201351, considerando de los 7 ECA encontrados los 3 con una asignación aleatoria adecuada, no encontraron un efecto del cribado sobre la mortalidad total por cáncer, incluido el CM, después de 10 años (RR: 1,02; IC 95%: 0,95-1,10) o sobre la mortalidad por todas las causas después de 13 años (RR: 0,99: IC 95%: 0,95-1,03). Esta revisión Cochrane pone de manifiesto que para salvar una vida es necesario cribar 2.000 mujeres a lo largo de 10 años, en 30% de ellas habrá sobrediagnóstico y sobretratamiento, y a 10 mujeres sanas se les diagnosticará indebidamente de CM y se someterán a tratamiento. Además 200 mujeres sufrirán ansiedad e incertidumbre durante años por resultados que fueron falsos positivos51. Los ensayos clínicos (EC) realizados hace décadas, y que mostraron reducción de la morbimortalidad con los cribados poblacionales de cáncer, no serían reproducibles hoy en día debido a los importantes avances en el tratamiento y a la mayor concienciación sobre el CM desde que se realizaron los ensayos, es probable que el efecto absoluto del cribaje en la actualidad sea menor que en los ensayos. Estudios observacionales recientes muestran más sobrediagnósticos que los ensayos, así como muy poca o ninguna reducción en la incidencia de cánceres avanzados con el cribaje51.
La literatura científica visibiliza cada vez más la necesidad de avanzar hacia un cribado personalizado, basado en el riesgo individual y ofreciendo la estrategia más adecuada, combinando las edades de inicio y final, el tipo de pruebas usadas en el cribado y la frecuencia52,53. En definitiva, se intensificaron los exámenes de detección en las mujeres con riesgo elevado y se reducirían en las mujeres con riesgo bajo, en un intento por minimizar los efectos adversos, y haciendo un uso más eficiente de los recursos. En las mujeres de riesgo muy elevado se podrían plantear estrategias preventivas o terapéuticas de reducción de riesgo como quimioprevención o mastectomía54. En este sentido está trabajando la Colaboración Europea para la Detección precoz «personalizada» y prevención del CM53 dirigida a la investigación de estimaciones y estratificaciones de riesgos individuales para el CM, así como de modelar el balance de daños y beneficios personalizados y valorar la implementación de programas de cribado basados en el riesgo.
El Sistema Nacional de Salud (SNS) introdujo el cribado del CM a nivel poblacional en el año 2006 y, al igual que la mayoría de los programas europeos de Detección Precoz del Cáncer de Mama, el riesgo se identifica en base a la edad y se ofrece una mamografía cada 2 años a las mujeres entre los 50 y 69 años y en algunas CC. AA. a partir de los 45 años9. La tasa de participación en estos programas en 2017 fue superior al 75%, aunque con amplias diferencias entre CC. AA.9,55.
Respecto a la edad de inicio del cribado, para las mujeres de menos de 50 años con riesgo medio, los beneficios absolutos del cribado cuando se miden según el número de muertes por CM evitadas, son relativamente bajos56. En una revisión sistemática y un metaanálisis de nueve ensayos se sugiere que, por cada 10.000 mujeres examinadas durante 10 años, se podrían prevenir 3 muertes por CM. En las mujeres de 39 a 49 años que fueron asignadas aleatoriamente a exámenes mamográficos no hubo diferencias estadísticamente significativas en la mortalidad por CM (RR: 0,92; IC 95%: 0,75-1,02). Además, en un análisis de los resultados combinados de 4 ensayos, la detección en las mujeres de 39 a 49 años no afectó al riesgo de CM avanzado (RR: 0,98; IC 95%: 0,74-1,37)57. En el estudio realizado en Reino Unido, a un grupo de mujeres invitadas a realizarse mamografías a los 40 años, en comparación con un grupo de atención habitual, y con un seguimiento medio de 10,7 años, se sugirió que la mortalidad por CM disminuyó en el grupo que se hizo mamografía, aunque la diferencia no fue significativa (RR: 0,83; IC 95%: 0,66-1,04)58.
En cambio, no se han modificado desde 2021 las recomendaciones del Programa BreastScreen de Australia que consideran que las investigaciones y la evidencia muestra que la mayoría de las mujeres de 40 a 49 años no se beneficiarán de las mamografías periódicas y mantienen la edad de cribado de 50 a 74 años59.
Tampoco en Inglaterra, donde el programa de detección NHS ofrece mamografía a las mujeres entre 50 y 71 años y donde actualmente hay un ensayo para examinar la eficacia de ofrecer a algunas mujeres una mamografía adicional entre los 47 y 49 años, y otra entre los 71 y 73 años60.
Una de las recomendaciones del resumen ejecutivo de la Unión Europea (UE)61 desde 2022 es la de ampliar el cribado del CM a las mujeres menores de 50 años con mamografía o tomosíntesis digital de mama y para las mujeres con mamas densas con imágenes por RM. Y en el mismo año se publicó la recomendación 2003/878/CE62 relativa a la mejora de la prevención mediante la detección precoz: un nuevo enfoque de la UE para el cribado del cáncer en la que se recomienda el cribado del CM con mamografía en las mujeres de entre 50 y 69 años. Se propone un límite de edad inferior de 45 años y un límite superior de 74 años. Se sugiere el uso de tomosíntesis digital de mama o de mamografía digital. Debe considerarse el uso de imágenes por RM cuando sea apropiado desde el punto de vista médico.
Además, las propuestas de la UE sobre el cribado del cáncer29, plantean una mayor participación en los programas de cribado del cáncer de mama (90% en 2025), y seguir desarrollando y aplicando el cribado estratificado por riesgos para mejorar la relación daño/beneficio de los programas de cribado50.
El Grupo de Trabajo Canadiense63 sobre atención médica preventiva recomienda las siguientes pautas desde 2023: a las mujeres de 40 a 49 años: no se recomiendan mamografías periódicas; de 50 a 74 años: se recomiendan mamografías periódicas (cada 2 a 3 años) y a partir de los 75 años recomiendan toma de decisiones compartidas.
La USPSTF de 202464, sobre el cribado del CM recomienda que todas las mujeres (incluye a las mujeres cisgénero y otras personas asignadas como las mujeres al nacer que tienen 40 años o más, las mujeres con riesgo medio de CM, así como aquellas con antecedentes familiares de CM y aquellas con senos densos) se hagan pruebas de detección de CM cada 2 años, a partir de los 40 años y hasta los 74 años, para reducir el riesgo de morir a causa de esta enfermedad (recomendación B). Básicamente, se ha pasado de recomendar que las mujeres comiencen a hacerse pruebas de detección entre los 40 y 50 años a recomendar que todas las mujeres comiencen a hacerse las pruebas cuando cumplan 40. Este cambio se ha justificado por el aumento de las tasas de CM en las mujeres de 40 años de aproximadamente un 2 por ciento cada año, lo que significa que las pruebas de detección tienen mayores beneficios potenciales en EE. UU. Entre otras causas porque el CM tiene mayor incidencia y mortalidad en las mujeres de raza negra. Concluye con una petición para aumentar la investigación sobre este cribado en las mujeres negras, hispanas, latinas, asiáticas, isleñas del Pacífico, nativas americanas y nativas de Alaska. También sobre la necesidad de estudiar la mejor manera de hacer seguimiento en el caso de las mujeres con senos densos (ya que casi la mitad de todas las mujeres tienen senos densos, lo que aumenta su riesgo de CM y significa que es posible que las mamografías no funcionen tan bien en ellas pero no hay evidencia suficiente a favor o en contra de exámenes de detección adicionales con ultrasonido mamario o RM), y la mejor evidencia sobre los beneficios y daños de las pruebas de detección en las mujeres mayores, ya que concluyen que hasta ahora no hay suficiente evidencia para hacer una recomendación a favor o en contra de las pruebas de detección en las mujeres de 75 años o más.
En nuestro país el Ministerio de Sanidad ha encargado un informe de Evaluación de Tecnologías Sanitarias que estará realizado a finales de 2024 para estudiar la idoneidad de rebajar a los 45 años la edad de iniciar este cribado, tal y como recomienda la Unión Europea a sus estados miembros, sin que en estos momentos haya cambiado la evidencia disponible y habrá que tener en cuenta las repercusiones y el impacto en el sistema sanitario actual.
A la luz de las controversias en la evidencia de los beneficios y daños del cribado del CM, así como de la variabilidad en las preferencias, las mujeres deben recibir apoyo para tomar una decisión informada y contrastada que sea congruente con sus propios valores y preferencias65. Y se deben identificar a las mujeres con riesgo elevado (antecedentes personales y/o con antecedentes familiares de cáncer hereditario asociado a mutaciones BRCA) y su derivación a las unidades de consejo genético.
Recomendaciones cáncer de mama, PAPPS 2024
- •
En las mujeres de 40 a 44 años con riesgo medio de cáncer de mama no debería recomendarse la mamografía de cribado (evidencia moderada, recomendación débil en contra)
- •
En las mujeres de 45 a 49 años, existe controversia en su inclusión en el cribado: (evidencia moderada, recomendación débil en contra). Se sugiere realizar previamente una evaluación coste/efectividad en nuestro entorno
- •
En las mujeres de 50 a 69 años con riesgo medio de cáncer de mama se sugiere recomendar la mamografía de cribado cada 2 años (evidencia moderada, recomendación débil a favor)
- •
En las mujeres de 70 a 74 años con riesgo medio de cáncer de mama se sugiere recomendar la mamografía de cribado cada 2 años (evidencia baja, recomendación débil a favor)
- •
Hay que identificar a las mujeres con riesgo elevado (antecedentes personales y/o familiares) y/o con antecedentes familiares de cáncer hereditario asociado a mutaciones BRCA y derivarlas a centros especializados y/o unidad de consejo genético
- •
Se ha de proporcionar información objetiva y contrastada que permita a cada mujer tomar su propia decisión, en el sentido de participar o no, en los programas de cribado
La incidencia y la mortalidad por el CCU en España son de las más bajas de Europa y del mundo, existiendo diferencias entre comunidades autónomas. No obstante, entre los años 2012 y 2020, se estima que las tasas aumentaron un 6%9.
En la tabla 1 se describen los factores de riesgo del CCU66. El virus del papiloma humano (VPH), una causa común de infección de transmisión sexual en los varones y las mujeres es el principal factor de riesgo. La infección por el VPH es condición necesaria pero no suficiente, estando presente en el 99,7% de los CCU66. La mayoría de las mujeres sexualmente activas están expuestas al VPH en algún momento de su vida, pero la infección suele ser transitoria y desaparece a los 12-24 meses; por tanto, es irrelevante desde el punto de vista oncogénico. La infección persistente por el VPH de alto riesgo (VPH-AR) causa lesiones cervicales precancerosas de alto grado (como la neoplasia intraepitelial cervical [CIN] grados 2 y 3) que pueden progresar a CCU. La persistencia de enfermedad es más común si intervienen cofactores (tabaco, multiparidad, uso prolongado de anticonceptivos orales (más de 5 años) o historia de infecciones de transmisión sexual como el herpes virus tipo 2, aunque se necesitan más investigaciones sobre este tema)66. Aproximadamente el 30% de las lesiones CIN grado 3 progresan a cáncer invasivo66.
La vacunación frente a la infección por el VPH ofrece la posibilidad de prevenir la infección inicial por el VPH frente a los genotipos incluidos en ellas67. Actualmente, existen 3 vacunas profilácticas frente al VPH registradas en España: la vacuna bivalente Cervarix® (vacuna VPH-2), la vacuna tetravalente Gardasil® (vacuna VPH-4) y la vacuna nonavalente Gardasil 9® (vacuna VPH-9). Las 3 vacunas presentan un adecuado perfil de seguridad y un balance beneficio/riesgo favorable67. El momento óptimo para iniciar la vacunación es antes del inicio de relaciones sexuales. Inicialmente solo se vacunaba a las chicas, la inclusión, en el calendario vacunal de los chicos de 11-12 años, además de conferirles protección, responde a criterios de equidad e igualdad. El momento óptimo para iniciar la vacunación es antes del inicio de relaciones sexuales de la mujer. La edad óptima de vacunación es a los 12 años. Las mujeres de 13 a 26 años no vacunadas son un grupo de alta prioridad de vacunación y pueden beneficiarse de la misma sin necesidad de cribado citológico o viral previo67. La vacunación frente al VPH en la mujer tratada por SIL/CIN protege frente a nuevas infecciones por tipos vacunales diferente al VPH que ha causado la lesión tratada. Los resultados de una reciente revisión sistemática mostraron una reducción significativa del riesgo de desarrollo de nuevas lesiones intraepiteliales de alto grado tras la vacunación contra el VPH (RR: 0,41; IC 95%: 0,27-0,64), independientemente del tipo de VPH68.
Otras estrategias de prevención primaria son el consejo sobre tabaco, alcohol y protección en contactos sexuales69. El preservativo reduce el riesgo de contagio del VPH, aunque solo lo evita en un 60-70% de los casos, debido al contacto de zonas genitales no cubiertas o a su uso inadecuado. Se recomienda consejo sobre el uso correcto y constante del preservativo en los contactos sexuales69. El uso del preservativo evita embarazos y constituye una práctica sexual segura por su eficacia para prevenir otras enfermedades de transmisión sexual. Otro factor preventivo descrito es la circuncisión en varones, ya que esta práctica reduce la prevalencia de infección en el varón, acorta el tiempo de aclaramiento viral y paralelamente puede disminuir el riesgo de contagio en la mujer69.
La larga fase preclínica desde la transformación del epitelio cervical hasta su invasión (10-15 años) permite la identificación y tratamiento de las lesiones. En los últimos años, la evidencia científica ha demostrado que, el cribado con una prueba del VPH tiene mayor sensibilidad que la citología para la detección de lesiones premalignas y mejor rendimiento en la prevención del CCU, pero presenta una menor especificidad70,71. Esta menor especificidad significa que un elevado porcentaje de mujeres con prueba del VPH positiva no presentan lesiones premalignas o CCU y, por tanto, necesitan un triaje (citología, genotipado, etc.) que permita estratificar el riesgo de HSIL/CIN2+72.
En un ensayo aleatorizado realizado en Manchester73 a 24.510 mujeres publicado en 2019, se encontró un nivel de protección similar 10 años después de una prueba del VPH negativa y 3 años después de una citología negativa. Estos datos respaldan un intervalo de detección considerablemente más largo después de una prueba del VPH negativa que después de una prueba de citología negativa. Además, aproximadamente 3 cuartas partes de las mujeres con infección por el VPH y citología normal eliminan la infección en aproximadamente 3 años. Su riesgo de CIN3+ dentro de este período es bajo (1,5%), lo que sugiere que la política actual de repetición anual de pruebas y derivación después de 2 años puede ser innecesariamente cautelosa. Aproximadamente el 40% de las mujeres que permanecieron VPH+ habían eliminado su infección inicial y adquirido un nuevo tipo de VPH.
Diversos estudios revelan diferencias en la participación de las mujeres en la detección del CCU y para mejorar la participación y facilitar el acceso al cribado del CCU se propone la autotoma. Una revisión sistemática74 y estudios posteriores75 confirman que la autotoma tiene un rendimiento comparable en la detección de lesiones cervicales al de una muestra recogida en la consulta.
Antes de los 25 años, el cáncer de cuello uterino es poco común (el 0,8% se diagnostican en este grupo de edad), por ello no se recomienda iniciar los cribados antes de esta edad76. Además, estudios observacionales previos, han mostrado que en las mujeres de 20 a 24 años desaparece espontáneamente la infección por el VPH y sus anomalías asociadas en el 90 y 95% de los casos77. Por eso precisamente se recomienda la citología, en lugar de la prueba del VPH (ya sea primaria o co-prueba), (para pacientes de 21 a 29 años), para evitar las tasas altas de falsos positivos con la prueba del VPH debido a las tasas más altas de infección transitoria en este grupo de edad.
Respecto a la edad de finalizar el cribado que puede estar en controversia, a favor de suspender el cribado a los 65 años en pacientes de riesgo medio que hayan participado previamente en el programa de cribado, está el hecho de que las lesiones de alto grado son poco frecuentes de nueva aparición en este grupo de edad76. Además, las anomalías en la prueba de Papanicolaou pueden tener un VPP deficiente para lesiones histológicas de alto grado de malignidad, lo que provoca la necesidad de pruebas de confirmación diagnóstica y de seguimiento, que no serían necesarias78. En un estudio realizado en las mujeres antes y después de la menopausia, que se sometieron a pruebas de Papanicolaou, se encontró que el resultado: «células escamosas atípicas: no se puede excluir una lesión de alto grado (ASC-H)» en las mujeres antes de la menopausia correspondía con una histología de malignidad de alto grado en el 22% en comparación con el 6% en el caso de las mujeres tras la menopausia79.
En nuestro ámbito, históricamente el cribado del CCU se ha ofertado de manera oportunista a las mujeres de edades comprendidas entre 25 y 65 años, mediante citología cervical cada de 3 a 5 años, y, actualmente, la mayoría de los programas y sociedades científicas (AEPCC) recomiendan la prueba del VPH72. Desde el 1 de julio de julio de 2019 entró en vigor la orden de actualización de la cartera de servicios de la sanidad pública del Sistema Nacional de Salud (SNS) que obliga a las CC. AA. A implantar un cribado poblacional del CCU de manera progresiva y en el plazo máximo de 5 años. Según esta orden, antes de 2024 las CC. AA. Deberán invitar expresamente por carta a todas las mujeres de entre 25 y 65 años a realizarse el cribado. Concretamente, a las mujeres de 25 a 34 años se les realizará citología cada 3 años, y a las mujeres de 35 a 65 años se les determinará el VPH-AR. Si este último resulta negativo, se repetirá a los 5 años, mientras que, si es positivo, se realizará una citología. Los profesionales de AP tienen un papel fundamental para promocionar la participación en el cribado, especialmente en las mujeres con mayor riesgo y/o cribado inadecuado.
La actualización de las recomendaciones de la American Cancer Society (ACS)80 van esta misma dirección: realizar exámenes de cribado del CCU mediante el uso de la prueba del VPH sola cada 5 años desde los 25 años hasta los 65 años.
La USPSTF6481 está actualizando estas recomendaciones, y hasta que se publiquen, siguen vigentes las de 2018, donde se recomienda la detección del cáncer de cuello uterino cada 3 años solo con citología cervical en las mujeres de 21 a 29 años. Para las mujeres de 30 a 65 años, el USPSTF recomienda realizar pruebas de detección cada 3 años con citología cervical sola, cada 5 años con prueba del VPH de alto riesgo sola, o cada 5 años con prueba del VPH en combinación con citología (prueba conjunta).
El programa de detección cervical del NHS en Inglaterra82 se ofrece a personas con cuello uterino de entre 25 y 64 años mediante VPH cada 3 años hasta los 49 años y cada 5 años desde los 50 a los 64 años (última actualización en 2021).
Una de las recomendaciones del resumen ejecutivo de la unión europea desde 2022 para el cáncer de cuello uterino, es priorizar la detección mediante pruebas del VPH y apoyar su erradicación mediante la vacunación contra el VPH a los menores de 15 años. Y en el mismo año se publicó la recomendación 2003/878/CE relativa a la mejora de la prevención mediante la detección precoz62: un nuevo enfoque de la UE para el cribado del cáncer en la que se recomienda realizar prueba del VPH a las mujeres de entre 30 y 65 años, con un intervalo de al menos 5 años. Además de considerar la posibilidad de adaptar las edades y los intervalos al riesgo individual basándose en el historial personal de vacunación contra el VPH, así como la posibilidad de ofrecer la autotoma, especialmente a aquellas que no respondan a las invitaciones al cribado.
El Grupo de Trabajo Canadiense sobre atención médica preventiva recomienda las siguientes pautas desde 202383: a las mujeres menores de 25 años no se recomiendan los exámenes de detección de rutina; de 25 a 69 años se recomienda realizar pruebas de detección con el VPH (autotoma o por sanitario) cada 3 años y en las mujeres de 70 años y más, si han tenido 3 resultados negativos de la prueba de Papanicolaou en los últimos 10 años, ya no realizan más cribados, solo si no se había realizado exámenes de detección regulares, se les propone continuar hasta obtener 3 resultados negativos.
En 2024 se han actualizado las recomendaciones del programa nacional de cribado cervical de Australia84, que lo mantienen para mujeres o personas con cuello uterino, que alguna vez hayan tenido contacto sexual y están entre los 25 y los 74 años.
Al igual que en otros cribados, enfatizar la importancia de individualizar la estrategia del cribado del CCU según riesgo. Actualmente, a nivel europeo está en marcha el proyecto Risk-based Screening for Cervical Cáncer (RISCC)85 donde se propone definir umbrales de riesgo, teniendo en cuenta el historial del cribado, la valoración con colposcopia y el genotipo VPH, edad, estado vacunal, consumo de tabaco, y basar la conducta clínica en función del riesgo personal para conseguir un cribado más eficaz y eficiente.
Recomendaciones cáncer de cuello de útero, PAPPS 2024
- •
Los profesionales de AP deben proporcionar consejo sobre protección en los contactos sexuales (evidencia moderada, recomendación fuerte a favor)
- •
En las mujeres menores de 25 años no se recomienda el cribado (evidencia moderada, recomendación fuerte a favor)
- •
En las mujeres asintomáticas de 25 a 34 años, se recomienda la citología de cribado cada 3 años (evidencia alta, recomendación fuerte a favor)
- •
En las mujeres asintomáticas de 35 a 65 años se recomienda la prueba del VPH cada 5 años (evidencia moderada, recomendación fuerte a favor) o la citología de cribado cada 3 años (nivel de evidencia moderada, recomendación fuerte a favor)
- •
El cribado se finalizará a los 65 años siempre que exista un cribado previo adecuado y negativo (10 años) y no haya antecedentes de CIN o CCU (20 años) (nivel de evidencia moderada, recomendación fuerte a favor)
- •
No se realizará cribado en las mujeres que no han tenido relaciones sexuales ni en las mujeres que han tenido una histerectomía con extirpación del cuello de útero (nivel de evidencia moderada, recomendación fuerte a favor)
- •
Los profesionales de AP deben realizar una búsqueda activa dirigida a aumentar la participación de la población diana, con especial énfasis en la población con mayor riesgo
El cáncer de endometrio es el cáncer ginecológico más frecuente en los países desarrollados y con una incidencia ascendente. Entre los años 2012 y 2020, se estima que las tasas han aumentado un 4%, que probablemente se debe al incremento de la prevalencia de los principales factores de riesgo como la obesidad o la exposición estrogénica9. En el 70% de los casos el cáncer de endometrio se diagnostica en estadio temprano, lo que repercute positivamente en las tasas de supervivencia (supervivencia a un año: 89%; a 5 años: 74,4%).
Los factores de riesgo y de protección86 se describen en la tabla 1. El exceso de estrógenos endógenos o exógenos (tratamiento hormonal sustitutivo) sin la oposición adecuada de un progestágeno, puede inducir hiperplasia endometrial y potencialmente cáncer de endometrio de tipo I que es el más común (adenocarcinoma, bajo grado e histología endometrioide)86. La obesidad es uno de los factores de riesgo más importantes: el riesgo se triplica en las mujeres con un índice de masa corporal superior a 3086. La incidencia alcanza su punto máximo entre los 60 y los 70 años y un pequeño porcentaje de los casos se producen antes de los 40 años (anovulación crónica y/o obesidad)86. El síndrome de Lynch (cáncer de colon hereditario sin poliposis) predispone a un riesgo de cáncer de endometrio a lo largo de la vida del 27 al 71% en comparación con el 3% en la población general86. El tratamiento con tamoxifeno en las mujeres posmenopáusicas tras sufrir un CM incrementa el riesgo de cáncer de endometrio86.
En las mujeres asintomáticas, ninguna prueba no invasiva de cribado (examen pélvico, citología, ecografía) es suficientemente sensible y específica para el cribado de cáncer de endometrio ni ha demostrado tener impacto sobre la reducción de mortalidad87.
En las mujeres con síndrome de Lynch, aunque no se ha establecido claramente su utilidad, los expertos recomiendan ecografía transvaginal (ETV), y biopsia/aspirado endometrial, con periodicidad anual, desde los 30-35 años (o 5-10 años antes de la edad del familiar más joven diagnosticado de cáncer)11. Como medidas reductoras de riesgo se recomiendan los anticonceptivos orales combinados (píldora anticonceptiva con estrógeno y progestina) y una histerectomía cuando el deseo de maternidad está completo86.
En las mujeres con síndrome de Cowden se sugiere realizar examen anual con ecografía y/o biopsia de endometrio o histerectomía a partir de los 30-35 años88.
El sangrado uterino anormal es un signo presente en el 75-90% de los casos de cáncer de endometrio87 (tabla 2). Proporcionar información educativa a las mujeres y a los profesionales sanitarios sobre los síntomas relacionados con el cáncer de endometrio puede aumentar la concienciación sobre la enfermedad y reducir el retraso en el tratamiento, sin embargo, no hay estudios que avalen esta recomendación89. Ante un sangrado uterino anormal o un sangrado, especialmente en aquellas mujeres con riesgo elevado de cáncer de endometrio (tras la menopausia, tratamiento con tamoxifeno, obesidad, ciclos anovulatorios), se debe realizar una biopsia de endometrio de forma urgente87.
El National Cancer Institute (NIH)90 determina que no existe ninguna prueba de cribado estándar o rutinaria para el cáncer de endometrio por el momento y que se está estudiando y realizando EC de cribado en la actualidad.
Recomendaciones cáncer de endometrio, PAPPS 2024
- •
En las mujeres asintomáticas sin factores de riesgo de cáncer de endometrio conocidos no se debe recomendar el cribado de cáncer de endometrio (evidencia moderada, recomendación fuerte en contra)
- •
Los profesionales de AP han de aconsejar a las mujeres, especialmente a aquellas con riesgo elevado de cáncer de endometrio (tras la menopausia, tratamiento con tamoxifeno, obesidad, ciclos anovulatorios), para que consulten ante cualquier sangrado vaginal anómalo
El cáncer de ovario pese a su baja incidencia es la primera causa de muerte por cáncer ginecológico. La supervivencia está relacionada con el tipo histológico y el estadio en el momento del diagnóstico (más del 70% se diagnostican en estadios avanzados). La supervivencia del cáncer de ovario es la más baja de los cánceres ginecológicos (40,9% a los 5 años), constatándose un apreciable aumento en los últimos años9. El 90% de los cánceres de ovario son de origen epitelial. El cáncer de ovario, trompas de Falopio y peritoneo son clínicamente similares y generalmente se consideran una misma entidad. El carcinoma seroso de alto grado representa el 70-80% de los cánceres de ovario.
En la tabla 1 se describen los factores de riesgo y protección para el cáncer de ovario87. La mediana de edad de la mujer cuando se le diagnostica un cáncer de ovario es de 63 años, siendo más temprana (entre los 54 y 59 años) en las pacientes con síndrome de cáncer mama y ovario hereditario (SHMO) y en las pacientes con síndrome de Lynch (entre los 43 y 49 años). Para algunos autores, la asociación inversa entre los factores de riesgo (menarquia precoz, menopausia tardía) y los factores protectores (número de embarazos, anticonceptivos) estaría relacionada con el número de ovulaciones que tiene cada mujer a lo largo de la vida.
El hecho de que la supervivencia relativa a 5 años del cáncer de ovario diagnosticado en estadio I, sea muy elevada (93% según el Programa de Vigilancia, Epidemiología y Resultados Finales (SEER), mantenida por el Instituto Nacional del Cáncer), ha hecho dirigir muchos esfuerzos al cribado de este cáncer en las mujeres asintomáticas. La revisión sistemática de la USPSTF concluye que el cribado con CA-125 (utilizando un único valor de corte o el Risk of Ovarian Cancer Algorithm (ROCA), o la ecografía transvaginal (ETV), no reduce la mortalidad y que los daños son, como mínimo, moderados y en algunos casos sustanciales (falsos positivos que conllevan una cirugía diagnóstica innecesaria, extirpaciones innecesarias o complicaciones quirúrgicas), por lo que la USPSTF no recomienda el cribado de cáncer de ovario mediante ningún método en las mujeres asintomáticas con un riesgo poblacional medio91.
Los últimos resultados publicados del ensayo clínico aleatorizado UKCTOCS muestran que el brazo CA-125 con algoritmo ROCA para seleccionar a las candidatas a la ETV (cribado multimodal), muestra una reducción de la incidencia de los estadios III y IV, pero no suficiente para traducirse en disminución de la mortalidad por cáncer de ovario92.
El Grupo de Asesores Científicos de la Comisión Europea para la mejora del cribado del cáncer28 concluye que, en la actualidad, ni los expertos ni la revisión de la literatura encuentran fundamentos científicos para recomendar el cribado poblacional del cáncer de ovario. Las nuevas tecnologías que involucran técnicas de muestreo menos invasivas o análisis de sangre y estrategias de detección estratificadas por riesgo pueden tener potencial para el futuro28.
En las pacientes de alto riesgo (pacientes con AF o síndrome de cáncer hereditario (BRCA1, 2 o Lynch) sugieren realizar una ecografía transvaginal, la detección de CA-125 y estudio genético. Las mujeres con sospecha de una alteración genética que predisponga a un cáncer de ovario (mutaciones BRCA1 o BRCA2 en el SCMOH, síndrome de Lynch) deben ser remitidas a las unidades de consejo genético y recibir consejo sobre las diversas opciones preventivas e indicaciones de estudio genético. El riesgo acumulado de cáncer de ovario hasta la edad de 80 años es del 44% en portadoras de BRCA1 y del 17% en portadoras BRCA293. En portadoras BRCA1/2 se recomienda realizar una salpingo-ooforectomía bilateral entre los 35 y los 40 años para las portadoras de BRCA1 y entre los 40 y los 45 para las portadoras de BRCA2 cuando el deseo gestacional se haya completado93. Una edad temprana de diagnóstico de cáncer de ovario en la familia puede hacer que se considere esta cirugía profiláctica a una edad más temprana. El cribado (CA-125 y ETV) solo se recomienda en portadoras que no se han sometido a cirugía y, aunque sin evidencias de calidad, cada 6 meses a partir de los 30-35 años. El riesgo de cáncer de ovario en las mujeres con antecedentes familiares de cáncer de ovario, aunque el test genético sea negativo, es más elevado que en la población general94. En estos casos, en las mujeres antes de la menopausia se recomiendan los anticonceptivos orales y en las mujeres tras la menopausia, una salpingo-ooforectomía bilateral. No se recomienda el cribado (CA-125 y ETV) dada su limitada eficacia.
El 85-90% de las mujeres diagnosticadas de cáncer de ovario presentan algún síntoma, predominantemente de tipo gastrointestinal y/o genitourinario, meses previos al diagnóstico95 (tabla 2). El reconocimiento e identificación de los síntomas y signos iniciales del cáncer de ovario permite diagnosticar la enfermedad en estadios más precoces y mejorar el pronóstico. Las mujeres, especialmente las postmenopáusicas, con síntomas inespecíficos abdomino-pélvicos, persistentes o recurrentes no justificados, requerirán examen pélvico, determinación de CA-125 y ETV95.
Según la Guía Screening Cancer Australia96,97 no hay pruebas de que las mujeres asintomáticas se beneficien de ninguna prueba, incluidos el Ca-125, la ecografía transvaginal, el examen clínico u otros biomarcadores, al igual que en Escocia (SIGN)98 y otras guías europeas99–101.
Recomendaciones cáncer de ovario, PAPPS 2024
- •
En las mujeres con riesgo medio de cáncer de ovario no se debe recomendar el cribado de cáncer de ovario (evidencia moderada, recomendación fuerte en contra)
- •
Las mujeres con sospecha de una alteración genética que predisponga al cáncer de ovario deben ser derivadas a centros especializados y/o unidades de consejo genético
El CCR es la neoplasia maligna más frecuente en el mundo desarrollado. En España, en 2024, ocupa el segundo lugar en frecuencia tanto en los varones (27.009 casos nuevos) como en las mujeres (17.285), el primer lugar si se consideran los casos en ambos sexos 44.294 casos nuevos5. En líneas generales, el riesgo de CCR comienza a incrementarse a partir de los 50 años, pero en las últimas décadas se está observando un aumento significativo en los menores de 50 años102. Los pacientes con CCR esporádico de presentación temprana, suelen presentar una enfermedad avanzada localizada en el colon izquierdo103. En los últimos años, la supervivencia del CCR ha aumentado de forma más marcada para cáncer de colon que para cáncer de recto9.
Existe un amplio conocimiento sobre la historia natural del CCR y sus factores de riesgo. El riesgo individual de CCR depende de la edad, sexo, factores genéticos (poliposis adenomatosa familiar PAF, Lynch, poliposis MUTYH, etc.) e historia familiar (CCR, pólipos colorrectales avanzados) y puede estar también influenciado por el tabaco, alcohol, actividad física, dieta y la microbiota intestinal (tabla 1)104. El 85% son cánceres esporádicos que tienen como lesiones precursoras el pólipo adenomatoso (60-70%) o las lesiones serradas (15-30%). La mayoría de las cuales no progresan a CCR y las que progresan lo hacen lentamente (10-15 años) y tienen unas características histológicas definidas105,106. En consecuencia, el CCR es idóneo tanto para su prevención (identificación y resección del pólipo, para disminuir incidencia de CCR) como para su cribado (detección del CCR en estadio temprano).
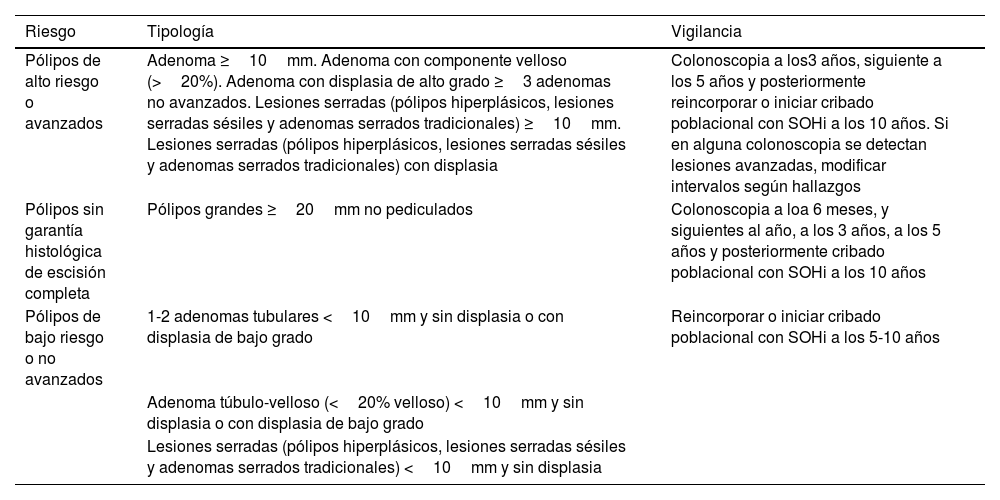
Actualmente están disponibles varias opciones de pruebas de cribado para la detección precoz del CCR. Existe evidencia sólida de la eficacia del cribado, a través de detección de sangre oculta en heces (SOH) y de la sigmoidoscopia106,107. Una reciente revisión sistemática de ensayos y estudios observacionales en Europa muestra un efecto positivo del cribado del CCR mediante sigmoidoscopia o detección de sangre oculta en heces en la mortalidad por este tumor108. El beneficio de la detección precoz sobre la mortalidad del CCR se atribuye principalmente a la reducción de la incidencia del cáncer y, en menor medida, a la detección temprana y tratamiento del CCR. La revisión sistemática realizada en el proyecto BMJ Rapid Recommendations en colaboración con MAGIC Group107, muestra que el cribado por sigmoidoscopia reduce ligeramente la incidencia del CCR incluso 15 años después de un cribado único. Tanto la sigmoidoscopia como la detección de sangre oculta en heces guayaco (SOHg) anual y bienal reducen ligeramente la mortalidad por CCR en la misma perspectiva temporal. Es probable que la sigmoidoscopia sea más eficaz en los varones que, en las mujeres, tanto para la incidencia como para la mortalidad por CCR. Ninguna de las intervenciones de cribado muestra un efecto sobre la mortalidad por todas las causas. Estos resultados muestran que el efecto relativo del cribado único mediante sigmoidoscopia se mantiene hasta 15 años después del cribado. La revisión sistemática de ensayos y estudios observacionales en Europa también muestra un efecto positivo del cribado de CCR mediante SOHg o sigmoidoscopia en la mortalidad por CCR108. La evidencia sobre la efectividad del cribado con sangre oculta en heces inmunológica (SOHi) o con colonoscopia es más reducida. Sin embargo, son 2 pruebas de cribado muy utilizadas106. Los estudios atribuyen una mayor sensibilidad y similar especificidad a la SOHi en comparación con la SOHg, por lo que se le supone mayor superioridad para identificar CCR, adenomas avanzados y lesiones serradas sésiles109.
Estudios de cohortes muestran que la colonoscopia consigue reducción importante de la incidencia y mortalidad por CCR106 en cambio en los ECA realizados como NordICC110 el riesgo de muerte por CCR fue del 0,28% en el grupo con cribado y del 0,31% en el grupo sin cribado (cociente de riesgo: 0,90; IC 95%: 0,64-1,16). El número necesario para invitar a someterse a pruebas de detección para prevenir un caso de CCR fue 455 (IC 95%: 270-1429). El riesgo de muerte por cualquier causa fue del 11,03% en el grupo con cribado y del 11,04% en el grupo sin cribado (RR: 0,99; IC 95%: 0,96-1,04). A espera de los resultados de otros ensayos su reducción relativamente pequeña en el riesgo de CCR y la reducción no significativa en el riesgo de muerte son a la vez sorprendentes y decepcionantes111.
En la actualidad, la colonoscopia es la prueba de cribado de CCR menos aceptada, más costosa, menos disponible en nuestro entorno por las listas de espera y la que expone a más riesgos, además de requerir limpieza de colon y sedación, lo que puede determinar una relación coste/efectividad menos favorable que con SOH o SG.
En 2003, el Consejo Europeo recomendó la implantación del cribado organizado del CCR con SOH para los varones y las mujeres de 50 a 74 años en los países europeos108. Sin embargo, el cribado del CCR no se ha implementado de forma homogénea en toda Europa. Los programas organizados existentes difieren en cuanto a las edades objetivo (entre 40 y 80 años), el intervalo de cribado y la prueba primaria (SOHg, SOHi, sigmoidoscopia)108. A pesar de las diferencias en estos programas, la incertidumbre sobre la mejor opción de cribado de CCR, así como los valores y preferencias de la población con respecto a este cribado, el cribado de CCR es uno de los cribados más coste/efectivos. La actual propuesta de la UE sobre el cribado CCR es utilizar la prueba SOHi como la prueba preferida de triaje para remitir a las personas a una colonoscopia de seguimiento29.
Las recomendaciones USPSTF112 de 2021 contempla cualquier prueba de cribado (SOHg o SOHi cada año, DNA-SOHi en heces cada uno a 3 años, colonografía por tomografía computarizada cada 5 años, sigmoidoscopia flexible cada 5 años, sigmoidoscopia flexible cada 10 años más SOHi anual o colonoscopia cada 10 años). Con una recomendación A en el grupo de edad de 50 a 75 años, con recomendación B en el de 45 a 49 años y con recomendación C de forma selectiva en adultos de 76 a 85 años, teniendo en cuenta la salud general del paciente, los resultados de los cribados previos y las preferencias112. La U.S. Multi-Society Task Force (MSTF) on Colorectal Cancer que representa a la American College of Gastroenterology (AGA), la American Gastroenterological Association (ACG) y la American Society for Gastrointestinal Endoscopy (ASGE), aunque no hay datos clínicos sobre el impacto del cribado del CCR en individuos menores de 50 años sobre la incidencia del CCR o la mortalidad relacionada con el mismo, afirman que hay suficientes datos de apoyo para recomendar que el cribado del CCR de riesgo medio comience a los 45 años113.
El cribado de CCR en nuestro medio se incorporó a la cartera de servicios común del SNS en 2014. El cribado se realiza a través de programas organizados poblacionales dirigidos a adultos entre 50 y 69 años, ofreciendo la prueba de SOHi con periodicidad bienal. Según datos de la Red de Programas de Cribado de Cáncer, la cobertura en el año 2017 es del 44% de la población diana y la tasa de participación es del 46%, muy variable entre Comunidades Autónomas (19-74%)114. Para alcanzar impacto poblacional sobre la mortalidad por CCR con un coste/efectividad adecuado es necesario mejorar la participación (UE 90% en 2025)29, y garantizar la realización de la prueba de confirmación diagnóstica en personas con prueba de cribado positiva. A la vez, se deben de abordar las desigualdades existentes (mujeres, personas mayores, grupos desfavorecidos, etc.) a lo largo de toda la trayectoria de la enfermedad29.
Al igual que en otros cribados señalar la importancia de individualizar la estrategia de detección precoz29. Los modelos de riesgo del CCR tienen el potencial de estratificar a la población general en categorías de riesgo y permitir que las estrategias de cribado y prevención se dirijan a los que tienen más probabilidades de beneficiarse, sin exponer a los de bajo riesgo de CCR a los daños directos e indirectos de los programas de cribado. Esta estrategia podría mejorar la relación coste/eficacia del cribado del CCR. Existen varios modelos para predecir el riesgo de desarrollar CCR, de colon o rectal en poblaciones asintomáticas, con modelos que solo incluyen datos como la edad, el sexo y el índice de masa corporal, hasta modelos más complejos que contienen información detallada sobre factores de estilo de vida y biomarcadores genéticos115. La validación de estos modelos de riesgo basados en datos fáciles de obtener en poblaciones externas del European Prospective investigation into cancer and nutrition (ePic)116 y del Reino Unido (cohorte UK Biobank)116,117 mostraron una buena calibración y discriminación y, por tanto, son modelos candidatos potencialmente adecuados para facilitar la estratificación del riesgo en los programas de cribado CCR poblacionales.
El programa NHS desde 2021 y de forma gradual durante 4 años, ha ampliado el programa de cribado de los pacientes con edades entre 60 y 74 años a las personas de entre 50 y 59 años118.
La USPSTF119 concluye que la detección del CCR en adultos de 50 a 75 años (con riesgo medio y siempre que su esperanza de vida sea de 10 años o más) tiene un beneficio neto sustancial con alta evidencia (recomendación grado A), la detección del CCR en adultos de 45 a 49 años tiene un beneficio neto moderado de evidencia moderada (recomendación grado B) y la detección del CCR en adultos de 76 a 85 años, que ya se han sometido a pruebas de detección, tiene un pequeño beneficio neto y con baja evidencia. Como los datos que respaldan la continuación de la detección a partir de los 75 años son limitados, en EE. UU. se recomienda que la decisión a partir de esa edad sea individualizada, teniendo en cuenta la salud general del paciente y su historial de pruebas de detección previo y siempre que su esperanza de vida sea de 10 años o más, aunque para algunos autores bastaría con que fuese de 5 años o más120. Igualmente, respecto al inicio antes de los 50 años, en EE. UU se recomienda iniciar la detección a los 45 años en adultos con riesgo medio de acuerdo con las recomendaciones del Grupo de Trabajo de Servicios Preventivos de EE. UU. Se reconoce que la incidencia del CCR es mayor a medida que aumenta la edad y que la mayoría de los casos de CCR ocurren después de los 50 años. Aun así, justifican el iniciar la detección a los 45 años en base a que se considera que los posibles beneficios de la detección y la prevención pueden ser superiores a la carga para el paciente y el riesgo de daños derivados de la detección.
Según las recomendaciones del Consejo Europeo de 202262, la prueba inmunoquímica fecal (PIF) cuantitativa se considera la prueba de cribado preferible para derivar a una colonoscopia de seguimiento a las personas de entre 50 y 74 años. La información cuantitativa de los resultados de las PIF podría utilizarse, si se avanza en la investigación, para aplicar estrategias adaptadas al riesgo, introduciendo umbrales determinados en función del sexo, la edad y los resultados de pruebas anteriores. Puede adoptarse la endoscopia como herramienta principal para aplicar estrategias combinadas
A partir del 1 de julio de 2024, el Programa Nacional de Detección de Cáncer del Gobierno de Australia121, reduce la edad de selección de 50 a 45 años. Esto significa que las personas de 45 a 49 años pueden unirse al programa.
En cambio, otros países como Canadá122 o Escocia123 (que actualizó sus recomendaciones en agosto de 2023 sobre cribado de CCR) no han adelantado la edad de cribado y continúan recomendando el cribado de 50 a 74 años justificado por la mayor prevalencia a partir de los 50 años.
En los pacientes sintomáticos con sospecha de CCR (tabla 2), las herramientas de evaluación del riesgo de presencia o ausencia de una enfermedad en atención primaria combinan los síntomas de presentación y las características del paciente. Los resultados de una revisión sistemática identificaron 8 modelos para CCR124. Los autores concluyeron que la validación y la evaluación del impacto de estos modelos en contextos determinados es actualmente limitada. Los modelos QCancer son, en general, los que mejor funcionan y pueden utilizarse tanto en los pacientes sintomáticos (modelos de diagnóstico) como asintomáticos (modelos de pronóstico). QCancer está disponible como calculadora en línea (www.qcancer.org)
El impacto del programa de cribado depende en buena medida de la participación en el mismo, estudios como el de Dressler125 en 2021 tratan de identificar las posibles barreras facilitadoras y factores modificables que incrementen la participación en los mismos.
La implicación de los profesionales de atención primaria en la sospecha diagnóstica del CCR, en los programas de cribado poblacional y en la identificación y vigilancia de las personas con riesgo elevado de CCR es fundamental. Una historia clínica dirigida permite identificar a las personas con riesgo elevado familiar y/o personal y derivarlas a unidades especializadas para cribado, diagnóstico molecular, consejo genético y seguimiento, puesto que requieren recomendaciones específicas105. Además, para la prevención del CCR es de gran importancia la adecuada vigilancia de las personas a las que se le han resecado pólipos con riesgo de progresión105,114 (tabla 3).
Vigilancia de pólipos colorrectales
| Riesgo | Tipología | Vigilancia |
|---|---|---|
| Pólipos de alto riesgo o avanzados | Adenoma ≥10mm. Adenoma con componente velloso (>20%). Adenoma con displasia de alto grado ≥3 adenomas no avanzados. Lesiones serradas (pólipos hiperplásicos, lesiones serradas sésiles y adenomas serrados tradicionales) ≥10mm. Lesiones serradas (pólipos hiperplásicos, lesiones serradas sésiles y adenomas serrados tradicionales) con displasia | Colonoscopia a los3 años, siguiente a los 5 años y posteriormente reincorporar o iniciar cribado poblacional con SOHi a los 10 años. Si en alguna colonoscopia se detectan lesiones avanzadas, modificar intervalos según hallazgos |
| Pólipos sin garantía histológica de escisión completa | Pólipos grandes ≥20mm no pediculados | Colonoscopia a loa 6 meses, y siguientes al año, a los 3 años, a los 5 años y posteriormente cribado poblacional con SOHi a los 10 años |
| Pólipos de bajo riesgo o no avanzados | 1-2 adenomas tubulares <10mm y sin displasia o con displasia de bajo grado | Reincorporar o iniciar cribado poblacional con SOHi a los 5-10 años |
| Adenoma túbulo-velloso (<20% velloso) <10mm y sin displasia o con displasia de bajo grado | ||
| Lesiones serradas (pólipos hiperplásicos, lesiones serradas sésiles y adenomas serrados tradicionales) <10mm y sin displasia |
El Ministerio de Sanidad ha encargado un informe de idoneidad a la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud para determinar si se debería aumentar la edad de este cribado hasta los 74 años. Se prevé que se publicará a finales de 2024.
Recomendaciones cáncer colorrectal, PAPPS 2024
- •
La SOH con el test inmunológico se sugiere realizar como prueba de cribado del CCR a las personas de 50 a 74 años, con periodicidad, anual o
- •
bienal (evidencia moderada, recomendación débil a favor)
- •
La sigmoidoscopia cada 15 años (o única a la edad de máximo riesgo, entre 55 y 64 años) se sugiere realizar como método de cribado a las personas de 50 a 74 años allí donde esté disponible (evidencia moderada, recomendación débil a favor)
- •
La colonoscopia cada 15 años (o única a la edad de máximo riesgo, entre 55 y 64 años) se sugiere realizar como prueba de cribado a las personas de 50 a 74 años (evidencia moderada, recomendación débil a favor)
- •
Los profesionales de atención primaria tienen que identificar a las personas con riesgo elevado de CCR (sospecha de CCR hereditario y familiar) y derivarlas a las unidades especializadas y/o unidades de consejo genético
- •
Los profesionales de atención primaria tienen que facilitar el cumplimiento de las recomendaciones de las colonoscopias de seguimiento de los pólipos
El 95% de los cánceres de páncreas son adenocarcinomas y un 5-10% están relacionados con diversos síndromes de predisposición hereditaria al cáncer (tabla 1). Su incidencia está aumentando, posiblemente en relación con los factores de riesgo (tabaco).
Los síntomas de presentación del cáncer de páncreas son inespecíficos (tabla 2) y el 80-85% de los pacientes se diagnostican en etapas avanzadas. En muchos casos, los pacientes desarrollan enfermedad metastásica o localmente avanzada durante la fase asintomática del tumor126.
La USPSTF127 en 2019 revisó la evidencia sobre los beneficios y daños del cribado del cáncer de páncreas, la precisión diagnóstica de las pruebas (ultrasonido endoscópico, RM o tomografía) y los beneficios y daños del tratamiento del cáncer de páncreas detectado por el cribado en los pacientes asintomáticos. No existen pruebas de que el cribado mejore la morbilidad o la mortalidad específicas, o la mortalidad por todas las causas. La USPSTF reafirma su conclusión anterior de que los beneficios potenciales del cribado del cáncer de páncreas en adultos asintomáticos no superan los daños potenciales por lo que recomienda no realizar cribado del cáncer de páncreas en adultos asintomáticos127. Actualmente, ninguna organización recomienda la detección del cáncer de páncreas en la población general de adultos asintomáticos.
La USPSTF concluye que el cribado basado en pruebas de imagen en grupos con alto riesgo familiar puede detectar adenocarcinoma pancreático con evidencia limitada sobre los daños127. Se desconoce el efecto del cribado sobre la morbilidad y la mortalidad en personas con predisposición familiar y hereditaria y no se dispone de datos en población de no riesgo. La evidencia sobre beneficios y daños de la intervención quirúrgica para el adenocarcinoma pancreático detectado por cribado es limitada.
Tanto el Consejo Europeo28 como la guía europea para el cribado del cáncer61, refieren que no es posible realizar cribado mediante análisis de biomarcadores de ADN para toda la población.
Ni se contempla realizar el cribado del cáncer de páncreas en personas de riesgo medio.
En Australia128 se desaconseja la práctica de cribado en la población de bajo y medio riesgo. Para la población de alto riesgo recomienda monitorización mediante ecografía y RM abdominal. Al igual que en Canadá129 o en Escocia130.
En una revisión sistemática publicada en 2023131 se concluyó que el CA 19.9 de forma aislada presenta un VPP bajo y no se recomienda para cribado en la población asintomática de riesgo medio.
En la revisión de Canto132 de 2024 se concluye que no se puede recomendar el cribado en la población general para los pacientes de riesgo medio.
Cáncer de próstataEl CPR es el tumor más frecuente en los varones de los países occidentales. Es una enfermedad muy heterogénea, en la que posiblemente solo un tercio de los cánceres crecen de forma agresiva. El amplio uso de la prueba del antígeno prostático específico (PSA) aumenta la casuística de tumores de crecimiento lento que no causarán síntomas en la vida de la persona (sobrediagnóstico) y, en consecuencia, mantiene una cifra de supervivencia elevada y con tendencia al aumento (2,2% en el periodo 2008-2013).
La edad constituye el principal factor de riesgo, con un aumento de la incidencia a partir de los 50 años. Por otra parte, se ha constatado que en un 5-10% de los casos este cáncer tiene un componente genético. El origen familiar negro africano/caribeño es un factor de riesgo adicional. En la tabla 1 se describen los factores de riesgo133. Un estudio que analiza el riesgo de CPR en mujeres transgénero134 que no reciben terapia hormonal de afirmación de género (GAHT) o que no se han sometido a una cirugía de afirmación de género (GAS) y en personas con género no conforme (que tal vez nunca comiencen GAHT o tengan GAS) es el mismo que el de la población masculina cis. En estos pacientes, los profesionales de la salud deben poder discutir las opciones de detección, diagnóstico y tratamiento considerando los deseos futuros de un tratamiento de afirmación de género. La incidencia de CPR en las mujeres transgénero que reciben GAHT o después de GAS es menor que la de sus homólogos masculinos cis de la misma edad, pero el diagnóstico y el tratamiento tienen más matices.
Durante las 2 últimas décadas ha habido un intenso debate internacional sobre los beneficios y daños del cribado de CPR. No hay evidencia de que los resultados de los cánceres diagnosticados a partir del cribado sean mejores que los de cánceres diagnosticados a partir de los síntomas clínicos135 (tabla 2). Un rango de PSA total se considera normal entre 0,1 y 4ng/ml. El PSA puede estar aumentado, con valores de PSA entre 4 y 10ng/ml en diversos procesos benignos136. Por encima de los 10ng/ml, se debe sospechar un proceso maligno. Asimismo, valores por debajo de 4ng/ml, tampoco garantizan la ausencia de CPR. Es decir, la determinación del PSA es una prueba sensible pero poco específica (alrededor del 33%), con muchos resultados falsos positivos y también falsos negativos, y con gran riesgo de sobrediagnóstico y con un pequeño beneficio en la reducción de la mortalidad por CPR136. Por sí sola no permite distinguir entre cánceres de crecimiento lento que permanecen latentes (indolentes) y aquellos cánceres de crecimiento rápido, capaces de diseminarse y que pueden ser letales. En este sentido acaba de publicarse un ensayo aleatorizado que comparaba la mortalidad por CPR y por todas las causas, tras una mediana de seguimiento de 15 años, en los varones de 50 a 69 años en Inglaterra, a los que se les ofrecía detección de PSA comparados con los que no se les realizaba dicha invitación137 y no se ha encontrado ningún efecto significativo de la detección del PSA sobre la mortalidad. En el grupo de intervención 1.199 varones (0,69%; IC 95%: 0,65-0,73%) y 1.451 varones en el grupo de control (0,78%; IC 95%: 0,73-0,82%) murieron de CPR (cociente de tasas [RR]: 0,92; IC 95%: 0,85-0,99; p=0,03). En comparación con el control, la intervención de detección de PSA aumentó la detección de bajo grado (puntuación de Gleason [GS]≤6: 2,2 frente al 1,6%; p<0,001) y localizado (T1/T2: 3,6 frente al 3,1%; p<0,001), pero no tumores intermedios (GS: 7), de alto grado (GS≥8), localmente avanzados (T3) o distalmente avanzados (T4/N1/M1). Hubo 45.084 muertes por todas las causas en el grupo de intervención (23,2%; IC 95%: 23,0-23,4%) y 50.336 muertes en el grupo de control (23,3%; IC 95%: 23,1-23,5%) (RR: 0,97; IC 95%: 0,94-1,01; p=0,11). Ocho de las muertes por CPR en el grupo de intervención (0,7%) y 7 muertes en el grupo de control (0,5%) estuvieron relacionadas con una biopsia de diagnóstico o un tratamiento para el CPR. Aunque hubo una reducción absoluta de la mortalidad a los 15 años fue mínima y no se encontró diferencias estadísticamente significativas en la mortalidad por todas las causas, lo cual, sumado a los daños encontrados por el sobrediagnóstico, sugieren seguir siendo conservadores a la hora de generalizar este cribado.
Respecto a la evidencia científica en base a las revisiones sistemáticas de la USPSTF138 y la del proyecto BMJ Rapid Recommendations Project de UK en colaboración con MAGIC research and innovation programme (http://magicproject.org/)139: el cribado con PSA aumenta la detección de los estadios I y II y disminuye ligeramente la de los estadios III y IV y da lugar a una reducción modesta de las muertes de CPR, pero el beneficio de la mortalidad tiende a equilibrarse con el sobrediagnóstico y el sobretratamiento de la enfermedad de bajo riesgo. Entre los daños del cribado hay que destacar los falsos positivos y las complicaciones de la biopsia (infección, sangrado o dificultades urinarias). La incontinencia urinaria y la disfunción eréctil son efectos secundarios de la prostatectomía radical y la disfunción eréctil puede ser una complicación de la radioterapia.
La USPST140 en sus recomendaciones de 2018 recomienda para el grupo de 50 a 69 años que las médicas y los médicos informen sobre los posibles beneficios y daños del cribado con PSA y que la decisión sea individualizada (recomendación C) y está en contra del cribado de CPR en los varones mayores de 70 años (recomendación D).
Tras la revisión de la evidencia en 2020, el Comité Nacional de Detección del Reino Unido recomendó no implementar un programa de detección a nivel nacional basado en pruebas de PSA. Llegó a la conclusión de que «la determinación de PSA no es lo suficientemente precisa para detectar el CPR que precisa tratamiento y aún no está claro si otras pruebas, como RM, con o sin PSA, son lo suficientemente precisas. Se esperan los resultados del estudio TRANSFORM141 (Prostate Cancer UK launches the transform trial) publicado en Lancet en 2024, el cual evalúa PSA, las RM y las puntuaciones de riesgo poligénico como herramientas de detección, durante 3 años en la primera fase y durante 10 años en la segunda fase.
El EU Beating Cancer Plan29 de 2022 y el grupo de asesoramiento GCSA28 plantean el objetivo de ampliar los programas de cribado del CPR basado en el antígeno PSA, en combinación con la exploración adicional por RM como prueba de seguimiento de un PSA elevado, ya que hay evidencia de que el cribado con la prueba del PSA puede reducir las muertes por CPR.
El riesgo de sobrediagnóstico y sobretratamiento ha dominado durante mucho tiempo los debates sobre el cribado del CPR. Sin embargo, estos riesgos pueden reducirse limitando la edad superior para este cribado, el seguimiento de los individuos con PSA positivo mediante RM (lo que permite identificar mejor los tumores malignos y dirigir mejor las biopsias) y la estratificación del riesgo (teniendo en cuenta los antecedentes familiares de CPR, el tacto rectal y el volumen de la próstata, y, adicionalmente, la ascendencia afroamericana). El cribado del CPR puede ser rentable y es necesario seguir investigando cómo se puede mejorar la relación coste/eficacia y daño/beneficio utilizando las estrategias mencionadas. Para reducir el sobretratamiento, se propone la vigilancia activa en los CPR de riesgo bajo e intermedio. En el contexto del CPR, es necesario equilibrar cuidadosamente los daños y los beneficios, y se recomienda la toma de decisiones compartida para todos los varones en función también de la esperanza de vida restante.
En resumen, las recomendaciones más actuales abogan por un cribado con PSA individualizado, tras una decisión compartida médico/paciente, teniendo en cuenta los grupos de alto riesgo e informando y valorando los posibles beneficios y daños del cribado. El balance entre beneficios y daños es más negativo en los CPR localizados de bajo riesgo de progresión, que requerirán observación o vigilancia y los pacientes con alto riesgo de progresión que pueden beneficiarse de un tratamiento activo (prostatectomía radical, radioterapia) para reducir los daños del sobretratamiento. Los profesionales de atención primaria deben favorecer que el paciente tome una decisión personal de acuerdo con sus preferencias.
Recomendaciones cáncer de próstata, PAPPS 2024
- •
En el grupo de población de menores de 55 años asintomáticos, sin factores de riesgo, no se recomienda la determinación del PSA para el cribado de cáncer de próstata (evidencia baja, recomendación fuerte en contra)
- •
En el grupo de población entre 55 y 69 años asintomáticos se recomienda evaluar individualmente el riesgo y realizar la determinación del PSA en función de un riesgo elevado (antecedentes familiares de cáncer de próstata: familiar de primer grado diagnosticado antes de los 65 años, raza afroamericana) y las preferencias de la persona (evidencia moderada, recomendación débil a favor)
- •
En el grupo de población de 70 años o más asintomáticos no se recomienda la determinación del PSA (evidencia baja, recomendación fuerte en contra)
- •
No se ofrecerá la realización de PSA a la población asintomática de forma activa. Si la persona lo solicita será necesario ofrecer información exhaustiva y detallada sobre el balance entre riesgos y beneficios
El CP es el cáncer con mayor mortalidad a nivel mundial. Es el cuarto tumor más frecuente diagnosticado en la Unión Europea (UE) y el tercero en nuestro país en 20245. En 2022 fue la primera causa de muerte por cáncer en ambos sexos en España. En los últimos años se observa una tendencia descendente o estabilización en la incidencia del CP entre los varones (debido a la reducción del hábito tabáquico) y en las mujeres un incremento global (debido a su incorporación al mismo y al aumento del consumo de tabaco)14.
En la tabla 1 se describen los diferentes factores de riesgo asociados al CP142. Se han identificado diversos factores que aumentan el riesgo de desarrollar CP entre los que destacan: el tabaquismo, la exposición ambiental o laboral a sustancias carcinógenos (como el radón o el asbesto), la presencia de enfermedad pulmonar (como la enfermedad pulmonar obstructiva crónica o la fibrosis pulmonar idiopática) o los antecedentes familiares de CP. El tabaquismo pasivo también se asocia a un mayor riesgo de CP, de manera que la exposición al humo del tabaco en los no fumadores aumenta su riesgo en un 20-30% comparado con los nunca fumadores no expuestos al humo pasivo. La Organización Mundial de la Salud (OMS) clasifica como cancerígeno el humo pasivo (carcinógeno clase A según la IARC y la Agencia de Protección Ambiental [EPA]), y considera perjudiciales todas las formas de consumo de tabaco (incluidos los cigarrillos electrónicos, el tabaco calentado y el tabaco sin humo), no existiendo niveles seguros de exposición.
De todos ellos la adicción al tabaco es la causa evitable más importante del CP; responsable del 90% de los casos en los varones y del 80% en las mujeres. Según la Encuesta Europea de Salud en España (EESE) de 2020, el porcentaje de varones mayores de 15 años fumadores diarios es del 23,3% y del 16,4% en mujeres143. Se estima que los fumadores tienen 11 veces más probabilidades de padecer un CP que los nunca fumadores (RR: 10,92; IC 95%: 8,28-14,40). El riesgo es similar para los varones (9 veces mayor) y las mujeres (12 veces mayor) y aumenta con la cantidad (número de cigarrillos) y duración del hábito tabáquico. Un consumo de cigarrillos de menos de 20 paquetes/año aumenta 3 veces el riesgo de CP y se incrementa en 7, 11 y 12 veces con un consumo de 20-40 paquetes/año, 40-60 paquetes/año y más de 60 paquetes/año, respectivamente. La exposición al radón domiciliario (emisiones de gas radiactivo en subsuelos ricos en uranio) y la exposición laboral (a arsenio o amianto entre otros) incrementan el riesgo en fumadores, pero también son factores de riesgo en los no fumadores. Dejar de fumar reduce el riesgo de CP, de manera que al cabo de 15-20 años disminuye en un 90% y se aproxima al riesgo de los no fumadores.
El riesgo basal de CP modula la relación beneficio/riesgo de este cribado. Como el beneficio neto es favorable, pero muy discreto, resulta de gran importancia identificar los factores (tabla 1) que clasifican adecuadamente el riesgo individual de CP, para seleccionar a las personas que pueden obtener un mayor beneficio. De ellos, la edad (50 a 80 años), la exposición acumulada al tabaco (índice paquetes-año [IPA]≥20) y el tiempo desde el cese del hábito de fumar (menos de 15 años), determinan un riesgo alto para el desarrollo de CP en la mayoría de los modelos de predicción de riesgo estudiados144, y son los que consiguen la mejor relación beneficio/riesgo con el cribado. De esta manera, el 80% de las muertes por CP evitadas por el cribado se concentran en el 60% de las personas con riesgo alto. En cualquier caso, un punto de corte de IPA≥20 permite incluir a más mujeres en el cribado.
El consejo personalizado para dejar de fumar y evitar el inicio del hábito tabáquico entre los jóvenes es la estrategia más efectiva para reducir la incidencia y mortalidad por CP23. El papel más importante de la atención primaria en la reducción de las cifras de incidencia del CP se encuentra en la lucha contra el tabaco mediante los programas de deshabituación tabáquica contenidos en la cartera de servicios de atención primaria, complementados con estrategias basadas en terapias de sustitución de la nicotina o con los fármacos financiados por el SNS como la citisina, el bupropion y la vareniclina.
Durante las 2 últimas décadas ha habido un intenso debate internacional sobre los beneficios y daños del cribado de CP. Para la realización de este cribado la única prueba que actualmente recomiendan las guías es la tomografía de baja dosis (TCBD), y se está evaluando la incorporación de otras pruebas como los biomarcadores.
A raíz de los resultados del ECA National Lung Screening Trial (NLST), en EE.UU., en una población de fumadores, y ex fumadores de entre 55 y 74 años, examinada por TCBD en comparación con la radiografía de tórax, demostró una reducción de la mortalidad por CP del 15%, estimando un número necesario a cribar (NNC) para prevenir 1 muerte por CP de 323 personas durante 6,5 años de seguimiento145. En base a este ECA, algunos organismos como la USPSTF o la Canadian Task Force on Preventive Health Care formularon recomendaciones a favor del cribado del CP. Posteriores ECA realizados en Europa como son los de NELSON (Bélgica), MILD y DANTE (Italia), DEPISCAN (Francia), DLCST (Dinamarca) y LUSI (Alemania), han ido acumulando evidencia de reducciones de mortalidad asociadas al cribado146. Estos ECA, van dirigidos a la población de alto riesgo de CP: fumadores o exfumadores con una historia importante de consumo de tabaco, aunque con diferentes protocolos de estudio. El estudio NELSON (LDCT en fumadores y exfumadores de entre 55 y 74 años) estima una reducción de la mortalidad por CP del 25% (RR: 0,75; IC 95%: 0,61-0,90) y se precisa cribar a 130 personas durante 10 años de seguimiento con TCBD para prevenir una muerte por CP147. A pesar de reducir la mortalidad, el cribado con TCBD también provoca resultados falsos positivos que conducen a pruebas innecesarias y procedimientos invasivos, sobrediagnóstico, hallazgos incidentales o ansiedad145,146,148, además de los costes que supone.
Según el ensayo NLST145, se desconoce el coste de las pruebas de detección por cada vida salvada, pero es probable que sea alto, dada la alta tasa (aproximadamente 96%) de falsos positivos que lleva a la necesidad de estudios adicionales, la necesidad de pruebas de detección continuas y el relativo número absoluto bajo de muertes evitadas (73 por 100.000 personas/año). Se necesitarán estudios de modelización para determinar la rentabilidad real. Un análisis, basado en un modelo diseñado antes de completar el NLST, sugirió que la detección mediante LDCT podría disminuir la mortalidad por CP a los 10 años entre un 18 y un 25%, a un costo que oscila entre 126.000 y 269.000 $ por año de vida ajustado por calidad. Además, el modelo encontró que un programa para dejar de fumar era más rentable que el examen de LDCT solo o el examen de LDCT combinado con dejar de fumar. Otro modelo, realizado después de completar el NLST, estimó que el cribado con LDCT costaría 81.000 dólares por AVAC. El modelo señaló que las estimaciones variaban ampliamente según los subgrupos, siendo la detección con LDCT más rentable en mujeres y en grupos con mayor riesgo de CP.
La USPST149 actualmente recomienda el cribado anual con TCBD en las personas de 50 a 80 años que han fumado 20 o más paquetes/año, que son fumadores en la actualidad o han dejado de fumar en los últimos 15 años. Se excluye a las personas que no han fumado durante los últimos 15 años, o que desarrollan un problema de salud que limita sustancialmente la esperanza de vida o que no tienen la capacidad o la voluntad de someterse a un tratamiento quirúrgico de pulmón (recomendación B). En esta actualización se ha ampliado el rango de edad (antes 55-80 años), y se ha reducido el historial de paquetes/año (antes 30 paquetes/año).
En el contexto de Europa, la revisión sistemática realizada por la Red de Agencias de Evaluación de Tecnologías Europea150 y financiado por la Unión Europea (UE), no es concluyente respecto a la relación beneficio/riesgo de este cribado y no establece recomendación de implantación de cribado de CP a nivel europeo (OTCA28: «Lung cancer screening in risk groups» en 2021).
El Beating Cancer Plan29 de 2022 y el grupo de asesoramiento GCSA28 plantean el objetivo de ampliar los programas de cribado al del CP. También señalan avanzar en nuevos estudios científicos sobre el uso de biomarcadores combinados con los resultados del cribado, introducción del riesgo basal individual de CP en los participantes, o el uso de la radiómica en la interpretación de las imágenes, que permitan mejorar la relación entre daños y beneficios, rentabilidad, ventajas de la detección precoz de este cáncer y viabilidad en toda la UE29.
Siguiendo las recomendaciones de 2022 del Consejo Europeo, el Ministerio de Sanidad solicitó a la Red de Agencias de Evaluación de Tecnologías Sanitarias el informe de evaluación correspondiente sobre el cribado de CP en 2023 para poder evaluar el balance riesgo-beneficio del cribado del CP mediante TCBD en personas de alto riesgo comparado con no cribar o con el diagnóstico habitual151. Se incluyeron nueve ensayos aleatorizados (DANTE, DLCST, ITALUNG, LSS, LUSI, MILD, NELSON, NLST y U KLS). Todos incluyeron a fumadores activos y exfumadores, y uno (U KLS), también incluyó a personas con otros factores de riesgo. En resumen, el resultado del metaanálisis indicó que el cribado de CP con TCBD podría reducir la mortalidad específica por CP en comparación con el no cribado (evidencia de calidad moderada), pero no se observó una reducción significativa en la mortalidad global con poca o ninguna diferencia en comparación con el no cribado (evidencia de calidad alta).
Además, se estimó que por cada 81 personas cribadas se registraría un evento adverso tras la cirugía, y por cada 184 personas cribadas se registraría un evento adverso de gravedad. Es decir que puede aumentar los eventos adversos en comparación con el no cribado (evidencia de calidad baja).
Sobre el daño relacionado con las consecuencias de los resultados FP el cribado de CP con TCBD provoca daños derivados de las consecuencias de los resultados FP en comparación con el no cribado (calidad de la evidencia alta).
Por último, sobre el daño relacionado con un sobrediagnóstico, se llegó a la conclusión de que el diagnóstico de CP requiere una confirmación histológica o citológica. Cabe suponer que casi todos los casos con diagnóstico de CP también fueron tratados. Todo procedimiento de diagnóstico y tratamiento conlleva el riesgo de efectos secundarios y complicaciones. Los estudios estimaron que de cada 1.000 personas invitadas a someterse al cribado de CP, hasta 22 fueron diagnosticadas de un CP que no habría causado síntomas durante el resto de su vida y en presencia de un diagnóstico de CP el riesgo de sobrediagnóstico puede ser hasta de un 63%. El cribado de CP con TCBD provoca daños, en comparación con el no cribado, en términos de sobrediagnóstico, por los procedimientos diagnósticos invasivos y el tratamiento resultante, incluidas las complicaciones y los efectos secundarios asociados (evidencia de calidad alta).
Para la inclusión de una enfermedad en el programa de cribado, es necesario reunir la evidencia suficiente en relación a la efectividad, seguridad y coste/efectividad, así como cumplir los 18 criterios del Documento Marco de Cribado Poblacional152. En el momento actual, el cribado de CP solo cumple 6 de los 18 criterios por falta de evidencia suficiente, y por ese motivo, el informe recomienda seguir ampliando la información acerca de este programa de cribado mediante la realización de programas piloto.
En nuestro país, está actualmente en marcha el proyecto CASSANDRA153 (Cancer Screening, Smoking Cessation and Respiratory Assessment) es un proyecto liderado por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) que tiene como objetivo implementar programas de cesación del hábito tabáquico y el cribado de CP de forma piloto.
La implantación del cribado de CP, organizado como programa de base poblacional, requiere realizar investigaciones muy rigurosas mediante «estudios piloto», que clarifiquen las incertidumbres actuales y evaluar la factibilidad de su aplicación en nuestro medio.
Actualmente, se dispone de modelos que proporcionan de forma sistemática la evaluación del riesgo de CP, teniendo en cuenta factores como la duración de exposición al tabaco, las enfermedades respiratorias previas, los antecedentes familiares de CP, la edad y la exposición laboral (asbesto, radón).
Los profesionales de atención primaria en el cribado del CP, tiene un papel fundamental, por un lado, en la estratificación del riesgo y selección de la población objetivo y por otro en el control y ayuda al cese tabáquico. Y por otro en la toma de decisiones compartidas. En el proceso de toma de decisiones compartida con los pacientes, se sugiere el siguiente asesoramiento: si elige someterse a una prueba de detección de CP, existe un riesgo de muerte del 13,93% a los 10 años con la prueba y un riesgo de muerte del 13,76% sin ella, y esos porcentajes son estadísticamente indistinguibles. En cuanto al riesgo de muerte por CP, se reduce del 3,2 al 2,4% con el cribado, una diferencia del 0,74%154.
También hay que señalar que en atención primaria la mayoría de los cánceres de pulmón se presentan con síntomas comunes e inespecíficos (tabla 2) como son el dolor torácico, la disfonía/afonía, la tos y la disnea155,156. A la vez, el CP suele surgir en un contexto de enfermedad respiratoria crónica y de síntomas de tos crónica, normalmente en los pacientes que fuman, lo que hace difícil identificar cambios en los síntomas crónicos de estos pacientes.
Recomendaciones cáncer de pulmón, PAPPS 2024
- •
Se recomienda realizar consejo personalizado para dejar de fumar a todas las personas fumadoras (evidencia alta, recomendación fuerte a favor)
- •
No se recomienda realizar radiografía de tórax y/o citología de esputo como pruebas de cribado del cáncer de pulmón (evidencia moderada, recomendación fuerte en contra)
- •
Se sugiere no realizar tomografía de baja dosis en la población de alto riesgo como prueba de cribado del cáncer de pulmón hasta que no se evalúe la factibilidad y coste/efectividad de su aplicación en nuestro medio (evidencia moderada, recomendación débil en contra)
El cáncer de piel engloba 3 enfermedades neoplásicas que tienen diagnóstico, tratamiento y pronóstico muy diferente. El carcinoma de células basales es la forma más común, seguido del carcinoma de células escamosas (espinocelular), ambos conocidos como cáncer de piel no melanoma y con pronóstico muy favorable. El melanoma es el menos frecuente, pero es el cáncer de piel más agresivo y responsable del 80% de la mortalidad por cáncer de piel. Los factores de riesgo del cáncer de piel son genéticos, familiares y ambientales y se describen en la tabla 1157. La radiación solar (rayos ultravioleta [UV]) es el factor etiopatogénico más importante.
La mayoría de los melanomas se localizan en la piel y rara vez se desarrollan en mucosas (boca, iris, retina y órganos internos). En los varones, las localizaciones más frecuentes son el tronco, incluidos hombros, cabeza y cuello, y en las mujeres, en los brazos y piernas. Los criterios ABCDE (asimetría, bordes irregulares, color no uniforme, diámetro >6mm y evolución) ayudan a identificar una lesión como sospechosa de malignidad (tabla 2)158.
Las medidas de prevención primaria del cáncer de piel incluyen intervenciones de consejo de protección solar para reducir la exposición a la radiación UV: el uso de protector solar de amplio espectro con un SPF de 30 o más; usar sombreros, gafas de sol o ropa protectora contra el sol; evitar la exposición al sol; buscar sombra durante las horas del mediodía; y evitar el uso de camas de bronceado en interiores159. Desde el punto de vista de la salud pública, es especialmente importante proteger a los grupos de población más vulnerables. Respecto al uso de las cabinas de autobronceado, el grupo de trabajo de la IARC concluyó que los jóvenes que las usaron durante la adolescencia presentaron un aumento de la incidencia de melanoma del 75%160. El Código Europeo Contra el Cáncer recomienda evitar la exposición solar (fig. 5). También aconseja consultar sobre cualquier lunar o úlcera de nueva aparición de la piel.
En este sentido, la USPSTF en 2018161,162 recomienda aconsejar a los adultos jóvenes, los adolescentes, los niños y los padres de niños pequeños sobre cómo minimizar la exposición a la radiación UV para las personas de 6 meses a 24 años con tipos de piel clara para reducir su riesgo de cáncer de piel (recomendación B).
Las medidas educacionales mejoran los comportamientos de las personas, pero se debe estudiar el impacto que tienen en incidencia y la mortalidad163. Se han realizado campañas como la australiana SunSmart164 o la europea Euromelanoma165 y en algunas guías166 se recomienda proporcionar a la población información sobre prevención primaria y factores de riesgo a través de diversos recursos y medios de comunicación como mediante el uso de redes sociales y nuevas tecnologías.
Con respecto a la prevención secundaria, una revisión Cochrane ha evaluado la efectividad del cribado del melanoma en la población de riesgo medio mediante el autoexamen visual de la piel y la inspección visual por un profesional de la salud167. El potencial sesgo de los 2 ECA incluidos en la revisión es elevado. Los autores concluyen que no existe evidencia para recomendar o rechazar el cribado de melanoma (autoexamen o examen médico) en la población general adulta. En Alemania, en el año 2008, tras los resultados favorables del programa piloto SCREEN (con examen clínico de la piel por un profesional que mostró un alto rendimiento en la detección de tumores cutáneos malignos), se implementó un programa de cribado poblacional del cáncer de piel, el cual no ha mostrado un descenso de la mortalidad por melanoma158. Se necesitan estudios que evalúen la mortalidad global, el sobrediagnóstico, las cirugías innecesarias, las consecuencias psicosociales, y determinar el balance entre beneficio y daños, así como el coste/efectividad del cribado poblacional del melanoma maligno158,167.
La USPSTF recomienda que las médicas y los médicos ofrezcan selectivamente asesoramiento a los adultos mayores de 24 años con tipos de piel clara sobre cómo minimizar su exposición a la radiación UV para reducir el riesgo de cáncer de piel. La evidencia existente indica que el beneficio neto de asesorar a todos los adultos mayores de 24 años es pequeño (recomendación C). La USPSTF concluye que la evidencia actual es insuficiente para evaluar el balance de beneficios y daños de aconsejar a los adultos sobre el autoexamen para prevenir el cáncer de piel. Tampoco existe evidencia suficiente para evaluar el cribado mediante examen visual realizado por un profesional sanitario, según la actualización de 2023168.
Algunas organizaciones, como la guía SIGN (2023)166, la Australian Cancer Network169 y la Canadian Cancer Society170 sugieren el cribado en poblaciones de alto riesgo. En la revisión de Geller de 2024158 también se realiza una recomendación débil en el mismo sentido (grado 2C). En los grupos de riesgo elevado la detección precoz del cáncer de piel implica un examen de la piel de todo el cuerpo realizado anualmente por una médica o médico con capacitación adecuada en la identificación del melanoma mediante examen clínico, así como educación para los pacientes sobre los factores de riesgo del melanoma y consejos para alertar si el autoexamen detecta lunares cambiantes u otras lesiones cutáneas sospechosas158.
El enorme aumento de su incidencia en las últimas décadas parece responder más al sobrediagnóstico que a un verdadero crecimiento de la enfermedad. Por este motivo, algunos autores abogan por un reenfoque multidisciplinar del proceso diagnóstico del melanoma y de las estrategias de prevención secundaria171.
Los profesionales de atención primaria juegan un papel importante en la prevención y detección precoz del cáncer de piel. Deben dar consejo sobre factores de riesgo modificables y estrategias para evitar el sol, particularmente en los pacientes con antecedentes personales o familiares de cáncer de piel, en los que tienen la piel clara (fototipos I y II: rubios o pelirrojos de ojos azules o verdes) y trabajan o realizan actividades de ocio al aire libre.
Recomendaciones cáncer de piel, PAPPS 2024
- •
No se recomienda el cribado sistemático del cáncer de piel en la población de riesgo medio o bajo (evidencia baja, recomendación fuerte en contra)
- •
En individuos con factores de riesgo elevado se recomienda el examen de la piel anual dirigido a la identificación de lesiones sugestivas de cáncer (evidencia moderada, recomendación fuerte a favor)
- •
Se recomienda proporcionar consejo para evitar la exposición excesiva a radiación tanto en cabinas autobronceadoras como solar, y, el uso de protectores solares (evidencia moderada, recomendación fuerte a favor)
En España su incidencia en el periodo 2012-2020 ha aumentado de manera considerable (un 30% en los varones y un 18% en las mujeres)9, debido a la detección de cánceres papilares de pequeño tamaño por el mayor uso de la ecografía de tiroides. El microcarcinoma papilar de tiroides (diámetro inferior a 1cm), es un hallazgo común (hasta en el 15-30%) en las autopsias de personas que han muerto por otra causa172.
Los estudios ecológicos y transversales sugieren que el cribado del cáncer de tiroides conduce a un aumento de la incidencia sin ningún cambio resultante en la mortalidad. La mejor evidencia ecológica sobre el sobrediagnóstico del cáncer de tiroides proviene de Corea del Sur, que ha tenido un programa organizado de detección de cáncer de tiroides desde 1999. En 2011, la tasa de diagnóstico de cáncer de tiroides fue 15 veces mayor que la tasa de diagnóstico en 1993, mientras que la tasa de mortalidad por cáncer de tiroides se mantuvo estable.
La USPSTF desde 2017, concluye con una certeza moderada (nivel de evidencia D) que el cribado del cáncer de tiroides en personas asintomáticas produce daños que superan los beneficios173. La mayoría de los cánceres son tratados con la extirpación de la glándula tiroides. Los daños quirúrgicos permanentes más frecuentes de la tiroidectomía, con o sin disección de los ganglios linfáticos, incluyen hipoparatiroidismo no reversible (hipocalcemia) y la parálisis recurrente del nervio laríngeo (parálisis de las cuerdas vocales). Las personas que se han sometido a una tiroidectomía necesitarán tomar levotiroxina diariamente, de manera indefinida.
En Canadá129, no se recomiendan las pruebas de detección de cáncer de tiroides en personas asintomáticas.
Los individuos con mayor riesgo de cáncer de tiroides (tabla 1) debido a una historia de exposición a la radiación ionizante (tratamiento médico como la radioterapia de baja dosis para las condiciones benignas o la radiación de alta dosis para la malignidad), los síndromes genéticos heredados asociados con el cáncer de tiroides (por ejemplo, poliposis adenomatosa familiar), o uno o más familiares de primer grado con antecedentes de cáncer de tiroides se podrían beneficiar del cribado174.
FinanciaciónEste trabajo se ha realizado con medios propios, sin fuentes de financiación externa.
Consideraciones éticasSe trata de una revisión.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de intereses
En este artículo, el grupo de Prevención del Cáncer del Programa de Actividades Preventivas y de Promoción de la Salud (PAPPS) de la Sociedad Española de Medicina Familiar y Comunitaria (semFYC) actualiza las evidencias y las recomendaciones sobre prevención y detección precoz del cáncer en la población de riesgo medio y riesgo elevado1.