Introducción
La infección de vías urinarias (IVU) es la segunda causa de consulta por enfermedad infecciosa en las clínicas de primer nivel de atención médica, después de las del tracto respiratorio. El paciente diabético no es ajeno a ellas: la condición de diabético determina características peculiares en el tratamiento de los síndromes clínicos que lo diferencian de la población general sana1.
Se acepta que los diabéticos tienen una mayor susceptibilidad a presentar infecciones. También se ha demostrado que la diabetes mellitus (DM) es un factor de riesgo independiente de infección urinaria nosocomial; además, las infecciones urinarias a menudo pueden conducir a complicaciones graves de la DM, como la cetoacidosis1.
La prevalencia de bacteriuria en la mujer diabética varía del 8 al 20%, frente a un 5% en la no diabética2, no así en el varón, donde las diferencias no son significativas. Sin embargo, en la mayoría de estos estudios no se diferencia entre bacteriuria sintomática o asintomática, por lo que se desconoce la incidencia de IVU en la población diabética.
El diagnóstico se presupone por medio de la sintomatología y la exploración clínica, y se confirma mediante el cultivo de orina. Sin embargo, se ha demostrado que no siempre hay concordancia entre uno y otro. Ibarburu et al3, en 744 urocultivos, obtuvieron un 42,4% de positivos y Palacios et al4, en un estudio con 1.080 muestras, sólo obtuvieron 145 cultivos positivos (13,4%).
Lo anterior puede deberse a factores como una vejiga neurogénica en diabéticos, una prostatitis en varones o una tumoración de suelo pélvico. Asimismo, algunos microorganismos generalmente no se asocian de manera sistemática a IVU. Entre ellos destacan los hongos del género Candida y sus diferentes especies. Mur et al5 refieren una frecuencia de un 1,1% de aislamientos de
C. albicans, Palacios et al4 obtuvieron un 2,9% de aislamientos de C. albicans, Khan et al6 obtuvieron un 10,5% de diferentes especies de Candida e incluso Phillips et al7 notifican un 42% de aislamientos de diversas especies de Candida, pero en una unidad de cuidados intensivos. Está claro que la frecuencia está en función de la población de estudio y que C. albicans no es la única especie involucrada. Dorko et al8, de 94 aislamientos de vías urinarias de Candida, obtuvieron 58 C. albicans, 23 C. parapsilosis, 6 C. tropicalis, 3 C. krusei y otras 4 Candida spp. De Oliveira et al9 refieren un 53% de C. tropicalis y un 36% de C. albicans. Fidel et al10 mencionan que cerca del 50% no es C. albicans y que
C. glabrata es la más común.
No se conocen con exactitud las causas que motivan la mayor incidencia de IVU y de sus complicaciones en los diabéticos. Como factores predisponentes se han citado la disfunción neurógena vesical, la mayor presencia de alteraciones anatómicas de las vías urinarias (cistocele, rectocele), la alteración de la función leucocitaria11, la presencia de enfermedad coronaria y un tiempo de evolución de la DM > 10 años12.
Otros factores son: ser portador de una sonda urinaria permanente, los tratamientos con antibióticos de amplio espectro y con corticoides, la presencia de uropatía obstructiva y las situaciones clínicas que producen inmunodepresión13.
Ante la presencia de hongos en la orina, la diferenciación entre colonización vesical y una verdadera infección no siempre es fácil. Voss et al14 mencionan que la presencia de Candida en la orina no es considerada normal, aunque no necesariamente indica una infección del tracto urinario. Por otro lado, la presencia de levaduras en la orina puede ser el primer signo de una infección sistémica por hongos. Hay discrepancia respecto al número de colonias de levaduras que debe considerarse como significativo, y se aceptan valores > 10.000-15.000 unidades formadoras de colonias (UFC)/ml14. Tokunaga et al15 consideran significativos los recuentos de 104 UFC/ml y la piuria de 5 leucocitos por campo (40). De Oliveira et al9 y Majoros et al16 sugieren que son significativos los recuentos de 104 UFC/ml o más, si las bacterias están ausentes o los recuentos son bajos.
A pesar de los datos anteriormente expuestos, poco se sabe acerca del papel de las diferentes especies de Candida en las IVU, tanto sintomáticas como asintomáticas, en los pacientes diabéticos, por lo que el objetivo fue determinar la frecuencia y las características de la candidiasis urinaria en estos pacientes que acuden a control de su enfermedad a la Clínica de Medicina Familiar (CMF) Dr. Ignacio Chávez del ISSSTE y compararla con las de un grupo de pacientes sin dicha afección.
Sujetos y método
Diseño del estudio
Estudio longitudinal, descriptivo y observacional.
Población y emplazamiento del estudio
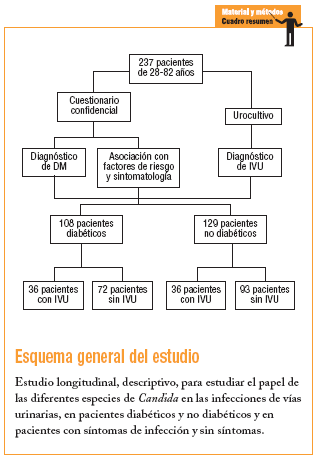
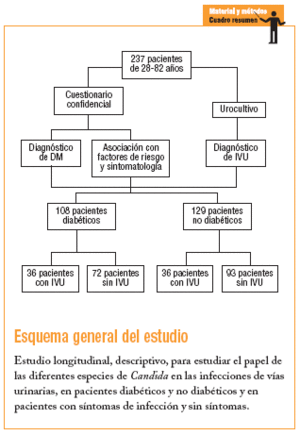
Se realizó en la CMF Dr. Ignacio Chávez del Instituto de Seguridad y Servicios Sociales para los Trabajadores del Estado (ISSSTE), Subdelegación Sur, México DF, entre octubre del 2003 y diciembre del 2004, con 2 tipos de pacientes: uno con diagnóstico de DM con y sin cuadros clínicos de probable IVU y que acudieron a consulta de control por su afección, y un segundo tipo sin DM y con o sin un cuadro clínico de probable IVU y que acudieron a la consulta médica por otras causas, formándose de esta manera 4 grupos:
Grupo 1: pacientes diabéticos con infección de las vías urinarias.
Grupo 2: pacientes diabéticos sin infección de las vías urinarias.
Grupo 3: pacientes no diabéticos con infección de las vías urinarias.
Grupo 4: pacientes no diabéticos sin infección de las vías urinarias.
Criterios de inclusión
Se incluyó a pacientes de 28-82 años usuarios del servicio médico social en la clínica que aceptaron participar en el estudio, que no hubieran tomado ningún antibiótico o que lo hubieran tomado al menos 15 días antes del estudio. A cada paciente se le solicitó la firma de aceptación de participación, además de realizarle un cuestionario confidencial.
Tamaño de la muestra
Con un error tipo I (alfa) de 0,05 y un error tipo II (beta) de 0,10, el número de muestra aceptado según las tablas fue 108 pacientes diabéticos e igual número para no diabéticos (216 en total). Por tanto, se incluyó a 237 pacientes, cuya elección fue dirigida y continua en función de la presencia o no de DM, así como la presencia o no de IVU. Todos los pacientes incluidos en el estudio lo concluyeron.
Definiciones
El diagnóstico clínico de IVU se realizó sobre la base de la propuesta de Gray et al17, que la definen en función de la presencia de al menos 3 de los siguientes síntomas: disuria, polaquiuria, urgencia miccional y dolor suprapúbico.
Se consideró que un cultivo de orina era positivo para Candida si el número de UFC de hongos era >= 104/ml y si las bacterias estaban ausentes o sus recuentos eran bajos. Para los demás microorganismos, en pacientes sintomáticos se consideró que el cultivo era positivo cuando se obtuvieron > 105 UFC/ml, de acuerdo con los criterios de Kass18. En pacientes asintomáticos se consideró que el cultivo era positivo cuando se tuvieron 2 cultivos > 105 UFC/ml.
Estudios microbiológicos
El cultivo de orina se realizó en un recipiente estéril de boca ancha; se indicó al paciente que realizara un aseo genital con benzal diluido y una gasa estéril antes de la recolección, para después depositar de 20 a 30 ml de orina del chorro medio de ésta. Las siembras se realizaron de inmediato; se utilizó un asa calibrada para transferir 0,001 ml en los medios de agar dextrosa de Sabouraud para Candida, agar McConkey para bacterias gramnegativas, agar Gelosa sangre para bacterias grampositivas y HBT (human blood tween) para Gardnerella vaginalis19. Las placas se incubaron a 37 °C durante 24-48 h. La identificación de Candida se realizó sobre la base de su morfología colonial y microscópica, la prueba de tubo germinal para C. albicans y las pruebas de asimilación y fermentación de los hidratos de carbono glucosa, maltosa, lactosa y sacarosa para las demás especies.
El aislamiento y la identificación de los demás microorganismos se realizó conforme a esquemas establecidos20.
Análisis estadístico
Para analizar el papel que representan los probables factores de riesgo estudiados y la posibilidad de que pudieran condicionar la presencia de una bacteriuria se utilizó el estadístico de la *2, con un nivel de significación estadística del 5% (p < 0,05), así como la prueba exacta de Fisher para frecuencias bajas; se utilizó el programa EpiInfo versión 6.0.
Resultados
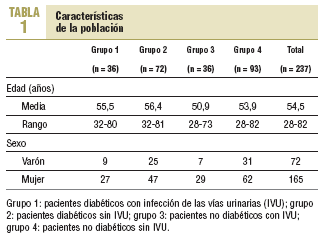
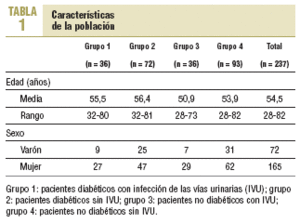
Se incluyó a 237 pacientes con edades entre 28 y 82 años (media, 54,5 años) que aceptaron participar en el estudio. De estos, 165 eran mujeres y 72, varones. Las características de la población por grupos se describen en la tabla 1.
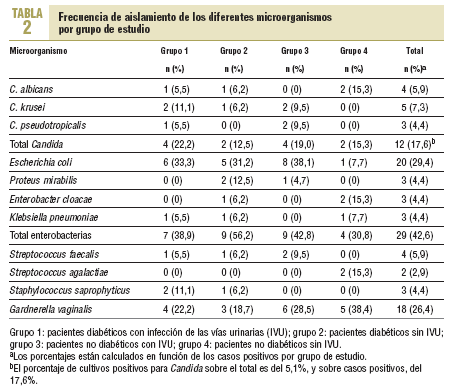
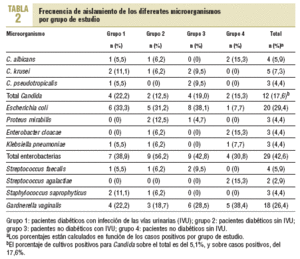
En ningún caso se presentaron cultivos mixtos y el porcentaje total de cultivos contaminados y que fue necesario repetir fue del 5,2%. La prevalencia total de bacteriuria fue del 28,69% (68/237). Los resultados por grupo de estudio y por microorganismo se presentan en la tabla 2. En total, se obtuvieron 12 cultivos positivos para las diferentes especies de Candida, el 5,1% del número total de estudios realizados (12/237). Sin embargo, el porcentaje sobre el número de casos positivos fue de 17,6% (12/68). De los 12 aislamientos, 4 fueron C. albicans, 5 C. krusei y 3 C. pseudotropicalis.
De los demás microorganismos identificados, Escherichia coli fue el más común, con un total de 20 casos, el 29,4% del total de casos positivos, seguido de G. vaginalis, con 18 casos y el 26,5% del mismo total.
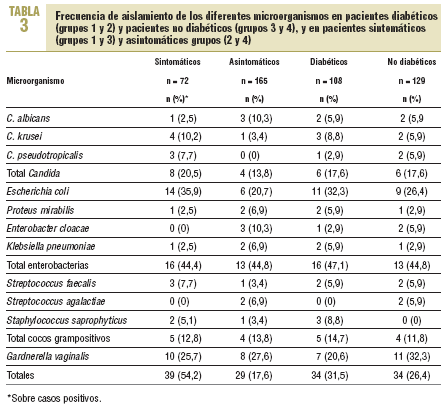
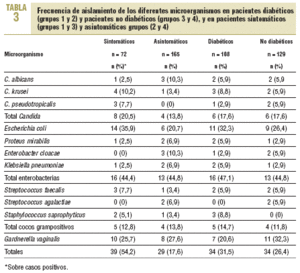
Los resultados al dividir a los pacientes en diabéticos y no diabéticos, así como en sintomáticos y asintomáticos, se describen en la tabla 3. Se obtuvo el mismo número de casos positivos total (n = 34) entre los pacientes con y sin DM, con porcentajes similares, del 31,5% para los primeros y del 26,4% para los segundos. Lo mismo ocurrió con Candida, con
6 casos positivos para cada grupo y porcentajes sobre el total del 5,5 y el 4,6%, respectivamente. Con respecto a la presencia de síntomas, se observaron en el 54,2% de los casos positivos totales (39/72) en pacientes sintomáticos frente a sólo el 17,6% (29/165) en pacientes asintomáticos. Con respecto a Candida, 8 de los 12 casos positivos correspondieron a pacientes sintomáticos.
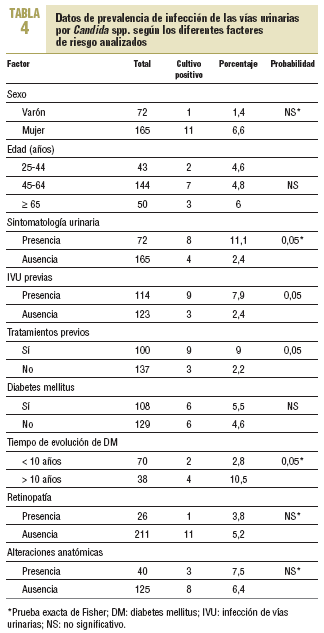
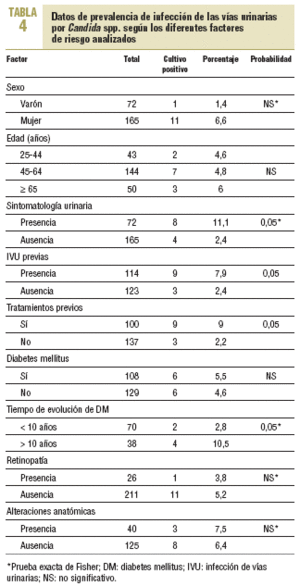
En la tabla 4 se describen los datos de prevalencia de Candida y su probable asociación con los diferentes factores de riesgo analizados. No se encontró asociación con la DM y la presencia de Candida, pero sí en función del tiempo de evolución de la afección, que era más frecuente en aquellos cuya evolución era > 10 años (el 2,8 frente al 10,5%), con diferencias estadísticamente significativas. No se encontró asociación con los demás factores de riesgo analizados, a excepción de la presencia de tratamientos previos y de infecciones urinarias previas, también con diferencias significativas.
En total, 8 de 72 pacientes con sintomatología tuvieron Candida (11,1%) frente a sólo 4 de 165 pacientes asintomáticos (2,4%); esta diferencia fue estadísticamente significativa.
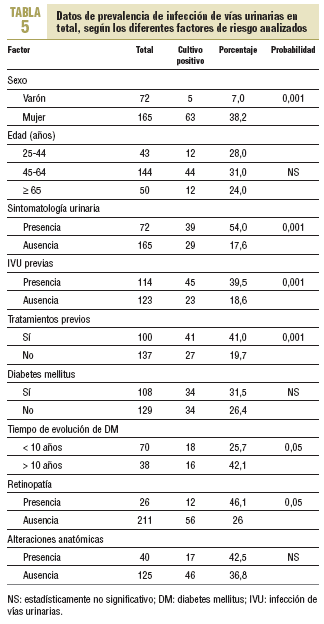
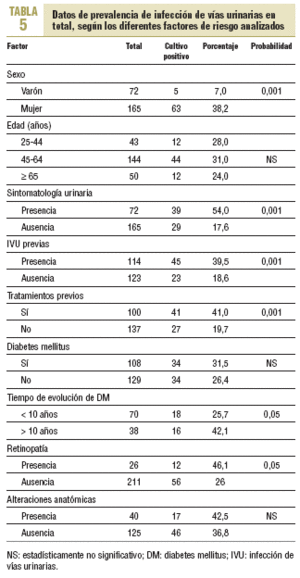
Al efectuar el mismo análisis, pero considerando la totalidad de los casos positivos (tabla 5), tampoco se observaron diferencias estadísticamente significativas en pacientes con y sin DM; sin embargo, sí las hubo en función del tiempo de evolución de la afección (el 42,1 frente al 25,7%) y, por lo tanto, con la presencia de retinopatía (el 46,1 frente al 26,1%), así como con otros factores, como el sexo, la presencia de IVU previas y, por ende, de tratamientos previos.
Con respecto a la sintomatología, 39 de 72 pacientes sintomáticos presentaron IVU (54,2%) frente a sólo 29 de 165 pacientes asintomáticos (17,6%), diferencia que fue estadísticamente significativa.
Discusión
La importancia de mantener un control epidemiológico sobre los diferentes géneros de hongos involucrados en procesos patológicos es incuestionable debido al incremento de estas infecciones a lo largo de la última década y, en especial, el género Candida con su variedad de especies, al que ahora se le reconoce su potencial patogénico.
Entre los procesos invasivos en los que Candida está involucrada destacan las IVU, tanto por su frecuencia como por las complicaciones con las que se asocia.
Con respecto a la prevalencia de Candida en las IVU, en la bibliografía se comunican datos tan variables como el 1,1% de Mur et al5, el 10,5% de Khan et al6, el 11% de Morera et al21 en una unidad de cuidados intensivos, hasta el 22% de Kobayashi et al22 en pacientes hospitalizados; nosotros obtuvimos una prevalencia del 5,1% del total de cultivos realizados, pero del 17,6% sobre casos positivos. Por tanto, resulta evidente que la prevalencia depende en buena medida de la población del estudio.
A diferencia de otros trabajos, se identificó a pacientes con y sin sintomatología urinaria; en los primeros se encontró una mayor prevalencia de Candida (el 11,1 frente al 2,4%), con diferencias significativas, lo que remarca el papel de estos microorganismos como causales de IVU con cuadros clínicos bien definidos.
Además, la prevalencia de las diferentes especies de Candida fue superior a la totalidad de los cocos grampositivos y, a excepción de E. coli, a la totalidad de los bacilos gramnegativos, ambos grupos aceptados en la bibliografía como causales de IVU; por ello consideramos importante incluir la búsqueda intencionada por el médico y por el laboratorio de estos microorganismos.
Con respecto a las diferentes especies de Candida involucradas en las IVU, obtuvimos un 66% de no C. albicans (un 41,6% de C. krusei y un 25% de C. pseudotropicalis). De Oliveira et al9 notificaron un 53% de C. tropicalis y sólo un 36% de C. albicans; Mujica et al23 comunicaron un 24,8% de C. glabrata, un 20% de C. tropicalis y un 47% de C. albicans; Mlinaric-Missoni et al24 notificaron un 8,4% de C. krusei, un 10% de C. glabrata y un 60% de C. albicans, y Kobayashi et al22 describieron sólo el 35% de C. albicans. Está claro que la mayoría de los autores coinciden en que las especies diferentes de C. albicans representan más del 50% de sus aislamientos, y que esto tiene particular interés debido a que la mayoría de las resistencias a los antimicóticos se produce por especies diferentes de C. albicans23,25.
Diversos autores asocian la presencia de diabetes mellitus con IVU y, en particular, con infección por Candida26-28. En este trabajo no encontramos esta asociación ni con la totalidad de los casos positivos ni con Candida en particular; sin embargo, se encontró con respecto al tiempo de evolución de la enfermedad > 10 años, similar a lo publicado por Zhanel et al12 y por nuestro equipo en un trabajo con adultos mayores29, por lo que consideramos que, al igual que con otras complicaciones asociadas con DM, como la retinopatía, es el tiempo y la gravedad de la enfermedad lo que condiciona una IVU.
Otros factores de riesgo referidos de manera importante en la bibliografía como asociados con IVU son los tratamientos previos con antibióticos y las infecciones de vías urinarias previas. En este estudio, tanto para la totalidad de los casos positivos como para los casos con Candida se encontraron diferencias estadísticamente significativas en ambos casos, lo que coincide con lo notificado22,26,28,30.
Otros factores, como la edad y las alteraciones anatómicas, considerados por algunos autores26,27 como factores asociados a IVU, no presentaron diferencias estadísticas significativas para Candida y para el total.
Finalmente, el hecho de ser mujer no fue estadísticamente significativo en la asociación del sexo con los casos de candidiuria; sin embargo, sí lo fue al realizar el análisis con la totalidad de los casos positivos.
Por lo anterior deducimos que, con respecto a los factores de riesgo analizados, el comportamiento fue similar en los casos con cultivo positivo para Candida y los casos con cultivo positivo por otro microorganismo.
Agradecimientos
Nuestro agradecimiento a Erika Yolanda Oropeza por su apoyo para la elaboración del manuscrito.