Analizar si un programa de ejercicio físico (EF) modifica la hemoglobina glucosilada (HbA1c), la presión arterial (PA), el índice de masa corporal (IMC), la lipidemia, el riesgo cardiovascular (RCV), el estado de salud autopercibido (ESA) y el gasto farmacéutico (GF).
DiseñoEnsayo clínico aleatorizado controlado, simple ciego. Intervención: programa de EF aeróbico supervisado. Análisis por intención de tratar.
EmplazamientoAtención primaria: 2 zonas de salud rurales. Área Salud Navalmoral, Cáceres, Servicio Extremeño de Salud.
ParticipantesCien diabéticos tipo 2, de 65-80 años, sedentarios; 50% grupo control (GC), 50% grupo intervención (GI). Abandonos: 12%.
IntervenciónEF aeróbico supervisado: 50 min, 2 días/semana, 3 meses.
Mediciones principales: HbA1c, PA, IMC, lipidemia, RCV, ESA, GF, complicaciones durante EF.
ResultadosDiferencias postintervención entre grupos en HbA1c, PA, IMC, colesterol y ESA. En GI disminución de HbA1c: 0,2±0,4% (IC del 95%, 0,1 a 0,3); PA sistólica: 8,5±11,8mmHg (IC del 95%, 5,1 a 11,9); IMC: 0,5±1 (IC del 95%, 0,2 a 0,8); colesterol: 14±28,2mg/dl (IC del 95%, 5,9 a 22,2); LDL: 18,3±28,2mg/dl (IC del 95%, 10,2 a 26,3), RCV: 6,7±7,7% (IC del 95%, 4,5 a 8,9), GF: 3,9±10,2 € (IC del 95%, 0,9 a 6,8) y aumento del ESA: 4,7±5,7 (IC del 95%, 3 a 6,3).
ConclusionesEn diabéticos mayores de 65 años un programa de EF aeróbico supervisado de fácil ejecución mejora la HbA1c, la PA, la colesterolemia, el RCV, el GF y el ESA.
To analyze whether an exercise program can modify glycated hemoglobin (HbA1c), blood pressure (BP), body mass index (BMI), lipids, cardiovascular risk profile (CVR), self-perceived health status (SHS), and pharmaceutical expenditure (PE).
DesignA randomized, single blind, controlled trial. Intervention: program of supervised aerobic physical exercise. Analysis by intention to treat.
LocationPrimary Care: 2 rural health areas. Health Area of Navalmoral. Cáceres. Extremadura. Spain.
Participants100 type 2 diabetic patients, aged 65 to 80 years, sedentary. Distribution: 50% control group (CG) and 50% intervention group (IG). Abandoned 12%.
Interventionmonitored aerobic exercise: 40minutes, 2 days/week, 3 months.
Key measuresHbA1c, BP, BMI, lipid, CVR, SHS, PE. Complications during exercise.
ResultsThere were post-intervention differences between groups in HbA1c, BP, BMI, cholesterol and SHS. In the IG, there was a significant decrease in; HbA1c: 0.2±0.4% (95% CI: 0.1 to 0.3), systolic BP: 11.8±8.5mmHg (95% CI: 5.1 to 11.9), BMI: 0.5±1 (95% CI: 0.2 to 0.8), total cholesterol: 14±28.2mg/dl (95% CI: 5.9 to 22.2), LDL: 18.3±28.2mg/dl 95% CI: 10.2 to 26.3), CVR: 6.7±7.7% (95% CI: 4.5 to 8.9), PE: 3.9±10.2 € (95% CI: 0.9 to 6.8), and an increase in SHS; 4.7±5.7 (95% CI: 3 to 6.3).
ConclusionsIn diabetics over 65 years, a program of monitored aerobic exercise, of easy implementation, improves HbA1c, BP, cholesterol, CVR, PE, and SHS.
La diabetes mellitus tipo 2 (DM2) es uno de los principales problemas de salud en España, estimándose su prevalencia en el 10% de la población1.
Para lograr un control óptimo de la enfermedad el paciente diabético debe involucrarse activamente en su autocuidado, siendo el ejercicio físico (EF) una parte fundamental del mismo2. Que el EF sea considerado una de las bases del tratamiento de la DM2 se debe principalmente a sus efectos beneficiosos sobre el metabolismo de la glucosa. A corto plazo, produce un aumento de la sensibilidad a la insulina3-5, logrando posteriormente un mejor control glucémico, con una reducción de la hemoglobina glucosilada (HbA1c) del 0,5-0,7%6-10, lo que se ha asociado a menor riesgo cardiovascular (RCV)11 y menor incidencia de complicaciones microvasculares12. Además el EF se ha asociado también en diabéticos a mejores cifras de presión arterial (PA), índice de masa corporal (IMC) o lipidemia8,13. No hay datos derivados de ensayos clínicos que demuestren que todos estos cambios impliquen una reducción de la morbimortalidad cardiovascular, pero numerosos estudios de cohortes señalan su relación13-17. Asimismo se ha constatado la asociación del EF en diabéticos con la disminución de la mortalidad por cualquier causa18,19. Además, en la población general, la práctica de EF se relaciona con mejor salud mental y menor gasto sanitario20,21.
El tipo de EF recomendable para un diabético depende de factores como su situación física basal, preferencias, medios disponibles o presencia de limitaciones físicas22. Algunos ensayos clínicos señalan que la combinación de EF aeróbico con entrenamiento de resistencia puede ser mejor que cualquiera de ellos por separado23,24, sin embargo la American Diabetes Association recomienda un mínimo de 150 min semanales de EF aeróbico moderado repartidos en al menos 3 días a la semana2. La Sociedad Española de Diabetes recomienda sesiones de al menos 45 min, al menos 3 veces a la semana, divididas en precalentamiento, fase principal y relajación22. Para los pacientes que estén en buena forma física, se indica un ejercicio aérobico más intenso25.
Antes de iniciar un programa de EF, es recomendable una exploración física y un electrocardiograma en reposo, dada la relación descrita entre el inicio de ejercicio en sedentarios y la incidencia de infarto de miocardio26-28. Es importante advertir a los pacientes de la necesidad de hacer un seguimiento más estrecho de su glucemia, principalmente a aquellos que usan insulina, sulfonilureas o glinidas. En las primeras sesiones se recomienda medir la glucemia antes, durante y después del ejercicio, para documentar los cambios asociados y predecir los que sucederán en sesiones posteriores29.
Los programas de EF que incluyen material o formación especial de los pacientes presentan un problema del cumplimiento a largo plazo30,31, problema que se atenúa en los programas basados en orientación conductual sencilla durante las visitas clínicas32,33. Un metaanálisis sobre programas de ejercicio aeróbico de 2 a 12 meses de duración encontró mayores descensos de porcentaje de HbA1c en las intervenciones inferiores a 3 meses, asociados a un mejor cumplimiento13. El imprescindible cambio radical desde un sedentarismo asentado durante años a un nuevo estilo de vida es un factor fundamental en el incumplimiento, acompañándose de otros que limitan la tolerancia al EF, como la enfermedad vascular coronaria o periférica oculta o la neuropatía diabética. La edad avanzada y un menor nivel socioeconómico también se han asociado a mayor dificultad para vencer el sedentarismo30,34,35.
La mayoría de los estudios publicados sobre programas de EF en diabéticos presentan algunas características que limitan su aplicabilidad a la realidad clínica. Por un lado, la mayoría de ellos están realizados en pacientes urbanos menores de 65 años, desconociéndose si los programas de EF son realizables en otros entornos y si implican los mismos beneficios en sujetos de más edad7-10. Por otro lado, sus conclusiones están limitadas al no informarse en muchos casos del método de asignación al azar o del cegamiento de los evaluadores, y al no realizarse el análisis de resultado sobre una base de intención de tratar13. Además, los estudios publicados se centran en las variables analíticas y antropométricas de respuesta, pero no evalúan el impacto del EF sobre variables importantes para el paciente, como la autopercepción del estado de salud, o para el paciente y el proveedor de salud, como el gasto farmacéutico (GF).
El objetivo principal del presente estudio es evaluar el efecto de un programa de EF aeróbico supervisado en el control de la DM2, estimado mediante el porcentaje de HbA1c, en pacientes mayores de 65 años del medio rural. Como objetivos secundarios se plantea analizar si el programa se asocia a una mejora de factores de RCV como el IMC, la PA y la lipidemia, así como evaluar su efecto sobre el RCV, el estado de salud autopercibido (ESA) y el GF. También trata de conocer la incidencia de complicaciones asociadas al EF, como hipoglucemia, lesiones deportivas o síndrome coronario agudo.
Material y métodosRealizamos un ensayo clínico, con asignación aleatoria de los pacientes a un grupo de intervención (GI) y a un grupo de control (GC), desarrollado en 2 centros de salud rurales del Área de Salud de Navalmoral, Extremadura.
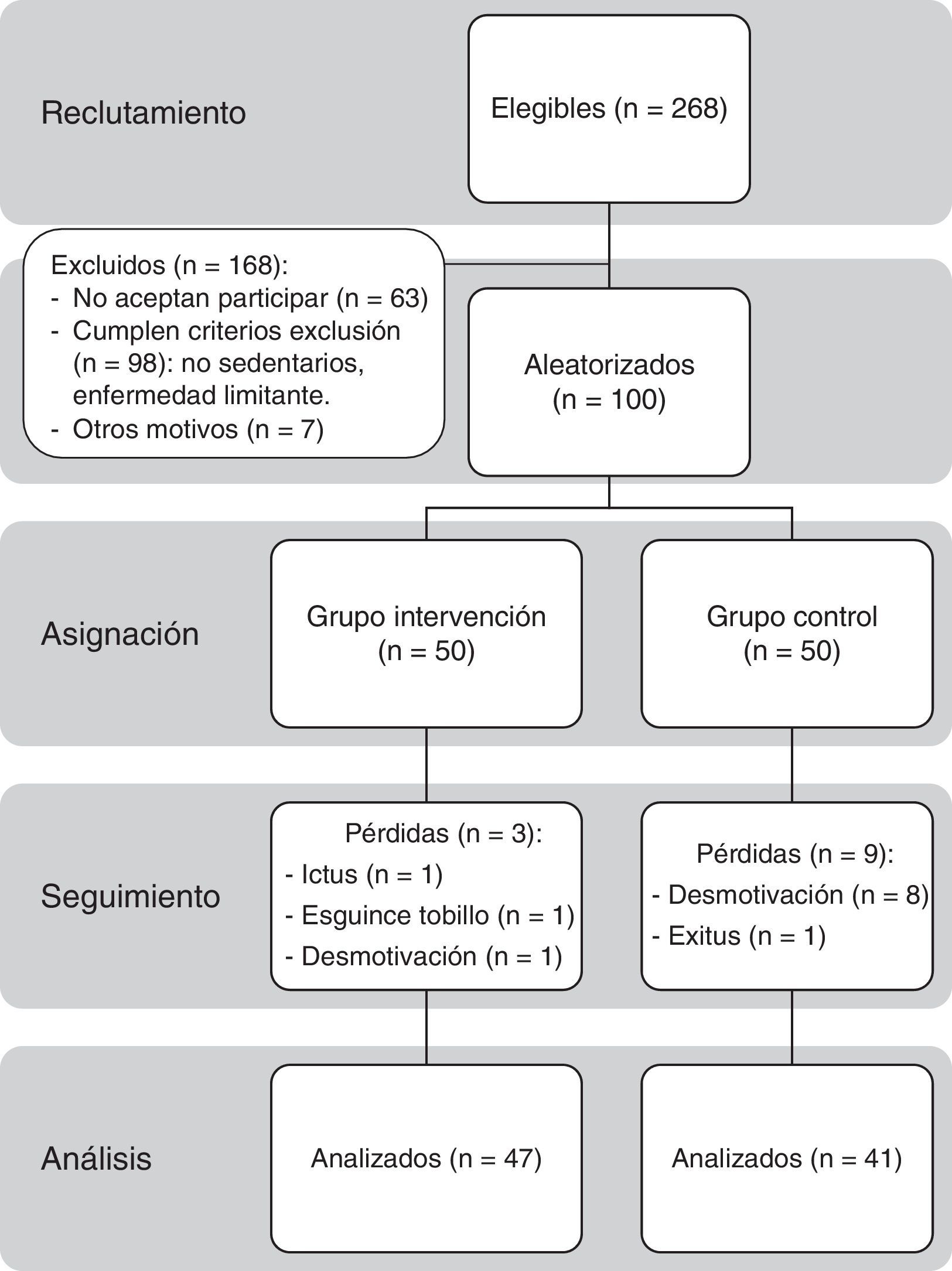
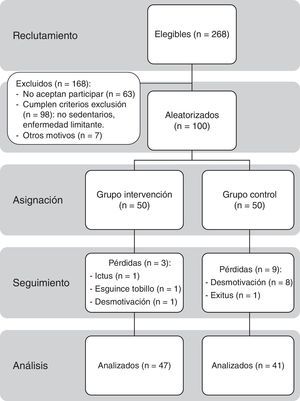
Durante un mes se ofreció participar en el estudio a los 268 pacientes de 65 a 80 años diagnosticados previamente de DM2, mediante captación oportunista en consulta o llamada telefónica. Sesenta y tres pacientes rechazaron inicialmente participar; a los restantes se les citó individualmente para una consulta informativa más extensa. Finalmente, firmaron el consentimiento informado (véase el anexo 1) 100 personas que no cumplían cualquiera de los 2 criterios de exclusión: presentar enfermedad que impidiera o no hiciera recomendable la realización de EF aeróbico de intensidad ligera (incapacidad para reconocer o tratar hipoglucemias, retinopatía proliferativa, nefropatía avanzada, neuropatía periférica con hipoestesia o úlceras crónicas en pies, disnea superior a clase ii NYHA, insuficiencia cardiaca congestiva, angina inestable, infarto agudo de miocardio o ictus en los últimos 3 meses, déficit sensorial, psicológico o físico que impidiera realizar el programa) o no ser sedentario (realizar EF superior a 30 min al menos 2 días/semana).
Posteriormente, se hizo una asignación aleatoria mediante el programa SPSS 15, asignándose 50 pacientes al GI y 50 al GC. Finalizaron el seguimiento 88 pacientes, 47 del GI y 41 del GC.
La intervención consistió en la primera fase (iniciación) de un programa de EF aeróbico dirigido por monitores deportivos y realizado de forma grupal en pabellones municipales 2 días a la semana no consecutivos, durante 3 meses. Cada sesión de EF se distribuyó en calentamiento (estiramientos de los principales grupos musculares, 10 min), paseo (en llano, circular, a velocidad que permitiera hablar sin entrecortarse, 40 min), enfriamiento (estiramientos, 10 min). Los monitores fueron instruidos previamente en el tipo de ejercicio a realizar y en la detección de las posibles complicaciones; se les proporcionó un número telefónico de contacto rápido con los sanitarios locales en caso de aparición de las mismas.
La variable de estudio primaria fue el porcentaje de HbA1c, medido en muestras sanguíneas extraídas en consultorios locales por enfermeros y analizadas en laboratorio hospitalario de referencia (Hospital Campo Arañuelo). Las variables secundarias fueron: PA sistólica (PAS) y diastólica (PAD), estimadas por enfermeros mediante esfigmógrafos aneroides siguiendo las recomendaciones de la Sociedad Europea de Hipertensión; IMC, calculado por enfermeros que emplearon tallímetros y básculas calibradas; RCV, estimado por médicos mediante tabla de Framingham, versión D¿Agostino36, empleándose calculadora de UpToDate®37; GF en antidiabéticos por vía oral e insulina, analgésicos y medicación para trastornos de ansiedad y depresión, calculado por médicos mediante revisión en el programa de gestión clínica JARA®; ESA, evaluado mediante la escala visual analógica del EQ-5D38, autoadministrada por los pacientes; lipidemia: colesterol total, colesterol-HDL, colesterol-LDL y triglicéridos, e incidencia de complicaciones durante el ejercicio: lesiones deportivas, hipoglucemia, síndrome coronario agudo. Todas las variables se midieron antes y después de la intervención.
El seguimiento de los pacientes tras la primera cita preintervención, con medida de PA e IMC, fue realizado cada 15 días por médicos y enfermeros de atención primaria, en 6 citas intermedias, para facilitar la adhesión al estudio. Se realizó una última cita postintervención de contenido similar a la primera,
Se estableció cegamiento en la asignación a grupos, el registro de datos y el análisis y la evaluación de resultados. Se realizó análisis por intención de tratar.
El tamaño muestral, para encontrar diferencias en HbA1c de al menos 0,6% en un contraste bilateral tras la intervención, se fijó en 30 pacientes por grupo, asumiendo error α de 0,05 y β de 0,20. Estimando una tasa de pérdidas del 15%, consideramos suficiente incluir al menos a 40 pacientes en cada grupo de estudio.
El análisis estadístico fue realizado mediante el programa informático SPSS 15.0. Se realizó estimación de medias ± desviación estándar para los datos descriptivos. Utilizamos el test t de la Student para el análisis bivariante del factor de estudio cualitativo, realizar o no el programa de EF, y las variables respuesta cuantitativas. El test t de la Student para datos apareados se utilizó en el cálculo de la magnitud del efecto de la intervención. El valor de significación estadística empleado fue 0,05.
El trabajo ha sido realizado cumpliendo las normas éticas de la Declaración de Helsinki.
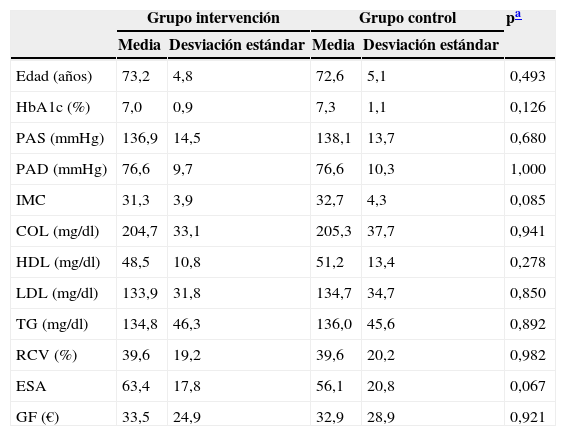
ResultadosLas características basales de los sujetos de cada grupo de estudio figuran en la tabla 1. No se encontraron diferencias estadísticamente significativas en los valores medios de las variables estudiadas.
Datos descriptivos de los sujetos de estudio preintervención
| Grupo intervención | Grupo control | pa | |||
|---|---|---|---|---|---|
| Media | Desviación estándar | Media | Desviación estándar | ||
| Edad (años) | 73,2 | 4,8 | 72,6 | 5,1 | 0,493 |
| HbA1c (%) | 7,0 | 0,9 | 7,3 | 1,1 | 0,126 |
| PAS (mmHg) | 136,9 | 14,5 | 138,1 | 13,7 | 0,680 |
| PAD (mmHg) | 76,6 | 9,7 | 76,6 | 10,3 | 1,000 |
| IMC | 31,3 | 3,9 | 32,7 | 4,3 | 0,085 |
| COL (mg/dl) | 204,7 | 33,1 | 205,3 | 37,7 | 0,941 |
| HDL (mg/dl) | 48,5 | 10,8 | 51,2 | 13,4 | 0,278 |
| LDL (mg/dl) | 133,9 | 31,8 | 134,7 | 34,7 | 0,850 |
| TG (mg/dl) | 134,8 | 46,3 | 136,0 | 45,6 | 0,892 |
| RCV (%) | 39,6 | 19,2 | 39,6 | 20,2 | 0,982 |
| ESA | 63,4 | 17,8 | 56,1 | 20,8 | 0,067 |
| GF (€) | 33,5 | 24,9 | 32,9 | 28,9 | 0,921 |
COL: colesterol total; ESA: estado de salud autopercibido; GF: gasto farmacéutico; HbA1c: hemoglobina glucosilada; HDL: colesterol ligado a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: colesterol ligado a lipoproteínas de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RCV: riesgo cardiovascular D¿Agostino; TG: triglicéridos.
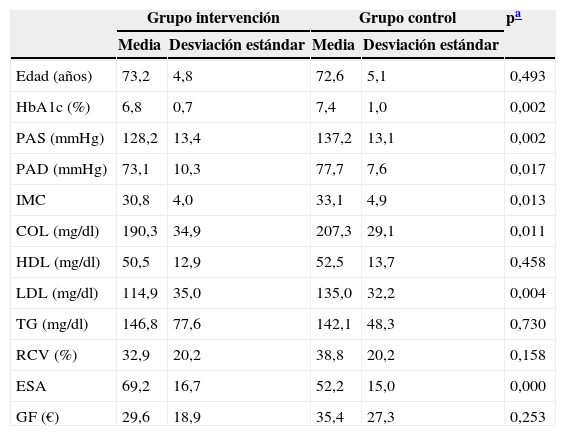
Tras la intervención, la diferencia en el valor medio de HbA1c de los 2 grupos se amplió hasta el 0,6%, p = 0,002. En cuanto al resto de las variables, encontramos resultados significativos para PAS, PAD, IMC, colesterol total, colesterol-LDL y ESA (tabla 2).
Datos descriptivos de los sujetos de estudio postintervención
| Grupo intervención | Grupo control | pa | |||
|---|---|---|---|---|---|
| Media | Desviación estándar | Media | Desviación estándar | ||
| Edad (años) | 73,2 | 4,8 | 72,6 | 5,1 | 0,493 |
| HbA1c (%) | 6,8 | 0,7 | 7,4 | 1,0 | 0,002 |
| PAS (mmHg) | 128,2 | 13,4 | 137,2 | 13,1 | 0,002 |
| PAD (mmHg) | 73,1 | 10,3 | 77,7 | 7,6 | 0,017 |
| IMC | 30,8 | 4,0 | 33,1 | 4,9 | 0,013 |
| COL (mg/dl) | 190,3 | 34,9 | 207,3 | 29,1 | 0,011 |
| HDL (mg/dl) | 50,5 | 12,9 | 52,5 | 13,7 | 0,458 |
| LDL (mg/dl) | 114,9 | 35,0 | 135,0 | 32,2 | 0,004 |
| TG (mg/dl) | 146,8 | 77,6 | 142,1 | 48,3 | 0,730 |
| RCV (%) | 32,9 | 20,2 | 38,8 | 20,2 | 0,158 |
| ESA | 69,2 | 16,7 | 52,2 | 15,0 | 0,000 |
| GF (€) | 29,6 | 18,9 | 35,4 | 27,3 | 0,253 |
COL: colesterol total; ESA: estado de salud autopercibido; GF: gasto farmacéutico; HbA1c: hemoglobina glucosilada; HDL: colesterol ligado a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: colesterol ligado a lipoproteínas de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RCV: riesgo cardiovascular D¿Agostino; TG: triglicéridos.
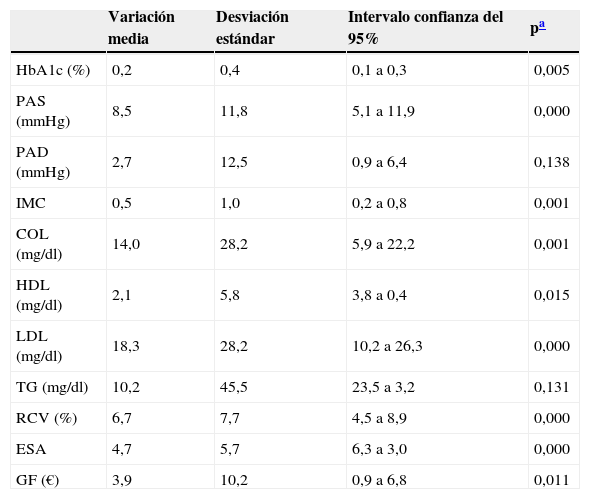
La tabla 3 recoge la magnitud de la variación de las variables de estudio en el GI tras la intervención. La HbA1c disminuyó un 0,2%, p = 0,005. Se observaron cambios significativos en la PAS, el IMC, colesterol total, el colesterol-LDL, el RCV y el ESA. El GF disminuyó en casi 4 €, principalmente a expensas de ansiolíticos y analgésicos (78% del total).
Magnitud del efecto. Grupo intervención
| Variación media | Desviación estándar | Intervalo confianza del 95% | pa | |
|---|---|---|---|---|
| HbA1c (%) | 0,2 | 0,4 | 0,1 a 0,3 | 0,005 |
| PAS (mmHg) | 8,5 | 11,8 | 5,1 a 11,9 | 0,000 |
| PAD (mmHg) | 2,7 | 12,5 | 0,9 a 6,4 | 0,138 |
| IMC | 0,5 | 1,0 | 0,2 a 0,8 | 0,001 |
| COL (mg/dl) | 14,0 | 28,2 | 5,9 a 22,2 | 0,001 |
| HDL (mg/dl) | 2,1 | 5,8 | 3,8 a 0,4 | 0,015 |
| LDL (mg/dl) | 18,3 | 28,2 | 10,2 a 26,3 | 0,000 |
| TG (mg/dl) | 10,2 | 45,5 | 23,5 a 3,2 | 0,131 |
| RCV (%) | 6,7 | 7,7 | 4,5 a 8,9 | 0,000 |
| ESA | 4,7 | 5,7 | 6,3 a 3,0 | 0,000 |
| GF (€) | 3,9 | 10,2 | 0,9 a 6,8 | 0,011 |
COL: colesterol total; ESA: estado de salud autopercibido; GF: gasto farmacéutico; HbA1c: hemoglobina glucosilada; HDL: colesterol ligado a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: colesterol ligado a lipoproteínas de baja densidad; TG: triglicéridos; RCV: riesgo cardiovascular D¿Agostino; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
Se perdió un 12% de los sujetos de estudio. Hubo 3 pérdidas en el GI (6%), una por ictus isquémico, otra por esguince de tobillo leve durante el ejercicio y una tercera por desmotivación. Ningún paciente presentó hipoglucemia ni síndrome coronario agudo durante la intervención. En el GC hubo 9 pérdidas (18%), 8 por desmotivación y una debida a defunción por ictus isquémico.
DiscusiónEl programa de EF aeróbico realizado se asocia, en pacientes de 65 a 80 años, a una mejoría en el control de la DM2, estimado mediante el porcentaje de HbA1c. Además se asocia a una mejora en otros factores de RCV: PA, IMC, colesterol total y colesterol-LDL; también ha supuesto una mejoría en el ESA y una disminución del GF.
Los cambios en los niveles de HbA1c en el GI están en la línea descendente señalada por estudios previos6-10, pero su intensidad es menor. La menor magnitud del efecto encontrado, lejano a la media de 0,8%10,13,39-44 de otras intervenciones breves, podría explicarse por la menor intensidad del ejercicio realizado, consecuencia de la edad media de los pacientes, su condición basal de sedentarios y del carácter subjetivo del límite máximo empleado, probablemente menor que el de la mayoría de los estudios previos.
En concordancia con trabajos anteriores, no hemos hallado un efecto significativo del EF sobre los niveles de HDL o triglicéridos, aunque sí se ha modificado el colesterol-LDL13,45.
Tras la intervención, no hallamos diferencias significativas entre los grupos en su RCV, probablemente porque la diabetes aporta un elevado porcentaje del RCV en la escala utilizada y porque las puntuaciones para los valores de PA, colesterol total o colesterol-HDL se otorgan según unos intervalos que pueden no haberse modificado en muchos de los pacientes. Dentro del GI, la disminución del RCV asociado al ejercicio aeróbico es acorde con el conocimiento previo46.
Por otro lado, sí ha habido cambios significativos en otras variables, en concordancia con los estudios precedentes. El cambio, en el IMC es ligeramente superior al descrito por Thomas et al.13 (−0,33, IC del 95%, −1,26 a 0,61); también la disminución de la PAS (−6,08, IC del 95%, −10,79 a −1,36). Encontramos diferencias significativas entre grupos tras la intervención en la PAD, algo no descrito previamente. Ningún estudio anterior ha evaluado el ESA, aunque Tessier et al.47 valoraron la calidad de vida, sin encontrar cambios debidos al ejercicio. La asociación de esta intervención con una mejora del ESA sería relevante a la luz de las conclusiones de los estudios ACCORD48 y ADVANCE49, que han llevado a señalar la necesidad de abordar la DM2 como un síndrome complejo con componentes culturales y sociales, más allá de la búsqueda de un objetivo de HbA1c.
La diferencia de 3,9 € hallada en el grupo de intervención tras el programa se debe principalmente al menor consumo de analgésicos y ansiolíticos. Esta diferencia es susceptible de aumentar en una fase posterior del estudio, ya que los ajustes en la insulina y antidiabéticos se realizarán principalmente en virtud del control metabólico. No hemos encontrado estudios que evalúen cambios producidos por el EF en el GF de los diabéticos.
Entre las limitaciones de este estudio debemos señalar que el porcentaje de pacientes contactados que no quisieron participar, 23% del total, pudiera suponer que los que sí lo hicieron sean realmente las personas más preocupadas por su enfermedad o aquellas más proclives a realizar cambios en su estilo de vida. Dadas las características de la intervención no fue posible realizar un enmascaramiento doble ciego, lo que puede haber influido principalmente en las variables con más carga de subjetividad, como el ESA.
Cabe pensar si, como se ha observado en estudios previos en pacientes más jóvenes, la magnitud de la reducción de HbA1c es mayor en los primeros 3 meses para disminuir posteriormente, o si en los pacientes de esta edad no sigue esta tendencia. Asimismo será importante comprobar si el elevado porcentaje de abandonos descrito en estudios previos3,30,34 aparece también en este programa. A la fase de iniciación del programa aquí presentada seguirán las de mejora (3 meses) y mantenimiento (24-36 meses) que permitirán valorar estas tendencias, a la vez que posibilitarán valorar variables finales, como las complicaciones de la DM2, comorbilidad asociada y mortalidad. Un estudio más estructurado en cuanto a la intervención, pero manteniendo su sencillez, podría ayudar a establecer qué intensidad de EF es efectiva, de modo que la experiencia sea más fácilmente reproducible.
Por último, concluimos señalando que la participación de pacientes de 65 a 80 años en un programa de EF aeróbico supervisado, de fácil ejecución y baja incidencia de complicaciones puede ser una estrategia efectiva para el control de la DM2, dada su asociación a la mejora de variables intermedias, como la HbA1c, la PA, la colesterolemia o el RCV, y de otras de interés para el paciente como el ESA, o para los proveedores sanitarios, como el GF.
- •
El ejercicio físico es considerado una de las bases del tratamiento de los pacientes con diabetes mellitus tipo 2, pues mejora el control glucémico y se asocia a una disminución del riesgo de enfermedad cardiovascular.
- •
La mayoría de los estudios publicados en este campo están realizados en pacientes menores de 65 años.
- •
Estos estudios evalúan intervenciones en las que es necesario el uso de material o mediciones poco accesibles para la población rural de nuestro medio.
- •
El ejercicio físico aeróbico supervisado en diabéticos mayores de 65 años se asocia a una mejoría en la hemoglobina glucosilada y el riesgo cardiovascular. Además mejora el estado de salud autopercibido y disminuye el gasto farmacéutico.
Estudio becado por la Fundación para la Formación y la Investigación de los Profesionales de la Salud de Extremadura (FundeSalud).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los ayuntamientos de Serrejón, Romangordo, Higera de Albalat y Talayuela, por la cesión de sus pabellones municipales.
A los monitores de tiempo libre que han participado desinteresadamente en este estudio, especialmente a Raquel Yustino y Jorge Hernández.
A Manuel Ángel Gómez Marcos, por su inestimable ayuda para la realización de este proyecto.
A FundeSalud y el Servicio Extremeño de Salud, por su financiación y contribución a la investigación en Atención Primaria de Salud.
Proyecto de investigación seleccionado en la I Convocatoria de Ayudas a Proyectos de Investigación en materia de Diabetes en Atención Primaria. Convocado por el Servicio Extremeño de Salud y FundeSalud, con el apoyo de Novo Nordisk. Premio al mejor trabajo original en el «I Encuentro de la Atención Primaria de Extremadura», SEMG, SEMERGEN, SEXMFYC, Cáceres 2014.