Puntos clave
- •
En los pacientes con enfermedades reumatológicas la administración de las vacunas no solo no está contraindicada, sino al contrario, altamente recomendada.
- •
La vacunación en este grupo de pacientes tiene un papel fundamental en la prevención de infecciones.
- •
A veces, no hay datos suficientes de seguridad y eficacia, lo que ocasiona dudas y frecuentes omisiones en su administración.
- •
Los pacientes vacunados 2 semanas antes del inicio del tratamiento o durante el mismo pueden necesitar ser revacunados al menos 3–12 meses después de suspendida la inmunosupresión.
- •
Las vacunas de organismos vivos, en general, están contraindicadas en pacientes con altas dosis de inmunosupresión o fármacos biológicos; mientras no haya más datos disponibles, se debe respetar siempre para vacunar el periodo entre 2 semanas antes y 3 meses desde su finalización.
Los pacientes pediátricos con enfermedades reumatológicas son un grupo con una alta susceptibilidad a las infecciones, que, además, aumentan el riesgo de exacerbación. Por ello es imprescindible conocer cuál es la pauta de vacunación más adecuada.
La posibilidad de reagudización de la enfermedad tras la administración de las vacunas, sugerida a raíz de casos esporádicos o pequeñas series de casos, el riesgo teórico de infección tras la vacunación con microorganismos vivos y las dudas en relación con la inmunogenicidad de las vacunas en estos pacientes han tenido como consecuencia una práctica vacunal heterogénea entre distintos profesionales y una cobertura vacunal insuficiente1. Recientemente, se han publicado recomendaciones sobre vacunación por parte de varias sociedades científicas y algunos estudios pediátricos que evalúan la seguridad y la respuesta a diferentes vacunas2.
La evaluación de la respuesta vacunal es compleja. La mayoría de los trabajos estudian la respuesta humoral y/o celular y muy pocos tienen en cuenta el impacto clínico de la vacuna. Los resultados sobre seguridad deben ser interpretados con precaución, ya que la mayoría de los estudios incluyen a pacientes en remisión y se han diseñado para evaluar la inmunogenicidad y no la seguridad2,3.
El objetivo de este artículo es conocer cuáles son las recomendaciones actuales de vacunación en pacientes pediátricos con enfermedades reumatológicas.
Reglas generales para la vacunación en estos pacientes- 1.
Siempre que sea posible, deben administrarse todas las vacunas del calendario vacunal y este debe actualizarse en cualquier sujeto antes de iniciar un tratamiento inmunosupresor (tablas 1 y 2).
Tabla 1.Pautas de vacunación y dosificación.
Vacuna Pauta Comentarios Hepatitis B Recomendada, según calendario. Cuantificar anticuerpos posvacunales en niños con altas dosis de inmunosupresores, infliximab o anti-TNF especialmente si exposición 3 dosis: pauta 0, 1, 6 meses Dentro de calendario vacunal : 0, 2, 6 o 2, 4, 6 meses de edad. (Si hexavalente, se acepta 0, 2, 4, 6 meses de edad) Gripe Recomendada, anualmente Administrar también a convivientes 2 dosis separadas al menos 4 semanasen < 9 años (salvo que la recibieran en la temporada previa) No puede administrarse en alérgicos al huevo o personas con antecedentes de Guillain-Barré No aprobada en < 6 meses Neumococo Recomendada, según calendario. Véase la tabla 1 Véase la tabla 1 Meningococo Meningococo C: recomendada, según calendario Considerar 2 dosis en mayores de 12 meses sin vacunar si inmunosupresión importante 3 dosis en < 12 meses (2, 4–6 meses, 12–15 mese edad) Vacuna ACWY si viaje a zona de riesgo Una dosis en > 12 meses, sin vacunar Hepatitis A Valorar 2 dosis separadas 6–12 meses Administrar si viaje a zona de riesgo o infección por virus de hepatitis B o C Papiloma Humano Recomendada (algunas precauciones), según calendario, en mayores de 9–11 años hasta los 26 años. 3 dosis: pauta según preparado comercial No hay estudios concluidos Polio Recomendada, según calendario la vacuna inactivada im Contraindicada vacuna oral en el paciente y en los familiares 4 dosis en < 24 meses (2, 4, 6, 15–18 meses de edad) En > 24 meses, 4 dosis si 3.a dosis antes de los 3 años de edad. Si la 3.a dosis se administró después, solo 3 dosis HiB Recomendada, según calendario 4 dosis en < 24 meses (2, 4, 6, 15–18 meses) > 12 meses sin vacunación previa o solo una dosis administrar 2 dosis, intervalo 2 meses Triple vírica No puede administrarse en todos los casos (consultar recomendaciones) Contraindicaciones generales vacunas con microorganismos vivos En pacientes en los que se pueda vacunar, hacerlo según calendario: Planificar vacunación antes de inmunosupresión/tras suspender inmunosupresión 2 dosis a los 12–15 meses y 2–3 años edad Evitar si enfermedad ↑ actividad, especialmente si nefritis En > 24 meses no vacunados: 2 dosis separadas al menos 4 semanas Si exposición en niño no vacunado que no se puede vacunar: administrar Ig específica Valorar Ig específica si inmunosupresión grave Varicela No puede administrarse en todos los casos (consultar recomendaciones: inmunosupresión grave/o fármaco biológico…) Contraindicaciones generales vacunas con microorganismos vivos En pacientes en los que se pueda vacunar, hacerlo según calendario: N2 dosis: 1.ª 12–15 meses y 2.ª 2–3 años Planificar vacunación antes de inmunosupresión/tras suspender inmunosupresión En < 1 3 años, 2 dosis intervalo 3 meses Evitar si enfermedad ↑ actividad, especialmente si nefritis. En > 1 3 años, 2 dosis intervalo un mes DTPa/Tdpa Recomendada, según calendario (2, 4, 6 meses y 1 8 meses, 4–6 años) En >14 años usar la Tdpa, por tener menor carga antigénica Tétanos Recomendada, según calendario o pauta acelerada si es preciso Inmunizar antes de rituximab si es posible; si herida tetagénica y rituximab en 24 semanas previas administrar una dosis devacuna y gammaglobulina específica Fiebre amarilla No puede administrarse en todos los casos (consultar recomendaciones: inmunosupresión grave/o fármaco biológico…) Contraindicada en < 9 meses Una dosis cada 10 años Contraindicaciones generales vacunas con microorganismos vivos No puede administrarse en alérgicos al huevo E. japonesa Administrar según destino de viaje (si zona de riesgo), guías de vacunación nacionales Vacuna de virus inactivados Aprobada en > 17 años E. centro-europea Administrar según destino de viaje (si zona de riesgo), guías de vacunación nacionales. Vacuna de virus inactivados Aprobada en > 1 año Evitar picaduras de garrapata y de producirse extraer lo antes posible. Fiebre Tifoidea Administrar según destino de viaje (si zona de riesgo), guías de vacunación nacionales Vacuna de virus inactivados Aprobada en > 1 año Evitar picaduras de garrapata y de producirse extraer lo antes posible. Cólera Administrar según destino de viaje (si zona de riesgo), guías de vacunación nacionales Aprobada en > 2 años 2–6 años: 3 dosis separadas una semana con revacunación cada 6 meses En inmunodepremidos puede inducir menos respuesta vacunal > 6 años: 2 dosis separadas una semana, con revacunación cada 2 años La protección puede no ser completa BCG No debe administrarse en pacientes con inmunosupresión por riesgo de diseminación Bacilo atenuados de M. bovis Rotavirus No puede administrarse en todos los casos (consultar recomendaciones:inmunosupresión grave/o fármaco biológico…) Contraindicaciones generales de vacunas con microorganismos vivos Se administra según calendario Contraindicada en niños 2 o 3 dosis en los primeros 6 meses de vida según el preparado farmacéutico < 6 meses hijos de madre que recibieron infliximab durante el embarazo Titulación de anticuerpos Siempre si se administran las vacunas durante el tratamiento con dosis altas de inmunosupresores, de corticoides o tratamiento con rituximab. Considerar si anti-TNF En hijos de madres que han recibido infliximab durante el embarazo, se contraindican las vacunas de virus vivos hasta al menos 6 meses de edad Pacientes con MTX que reciben vacuna polisacarídica neumocócica: si no buena respuesta, se debe vacunar con la conjugada. Valorar también con otros inmunosupresores Contraindicaciones generales vacunas con microorganismos vivos (dosis altas de corticoides, FARME o biológicos Valorar dosis de refuerzo tras supresión de inmunosupresión a dosis altas, sobre todo si no hay títulos de anticuerpos considerados protectores FARME: fármaco antirreumáticos modificadores de enfermedad; Ig: inmunoglobulina; MTX: metotrexato; TNF: factor de necrosis tumoral.
Para completar información sobre las pautas de vacunación consulte calendario vacunal en la página http://vacunasaep.org/profesionales/calendario-de-vacunaciones-de-la-aep-2012
Modificada de: General Recommendations on Immunization: Recommendations of the Advisory Committee on Immunization Practices (ACIP). Disponible en: http://www.cdc.gov/vaccines/pubs/vis/downloads/vis-pcv.pdf
Tabla 2.Dosificación vacuna neumocócica (VCN)
Edad VCN < 1 año 6 semanas-6 meses: VCN 13v pauta 3+1 (3 dosis separadas mínimo un mes, dosis refuerzo entre los 12–15 meses de edad) 7–11 meses: 2 dosis separadas al menos por un mes. Dosis refuerzo en el segundo año separada al menos 2 meses de la última dosis 12–23 meses: una dosis de primovacunación y otra de refuerzo separadas al menos 2 meses 24–53 meses: Una dosis 2–5 años VCN 13v: 2 dosis (si ninguna dosis previa) separadas al menos 2 meses Al menos una dosis si solo han recibido VCN 7v > 5 años ACIP: recomienda una dosis en pacientes inmunodeprimidos en pacientes entre 6–18 años Considerar al menos una dosis si solo han recibido VCN 7va Edad Vacuna neumocócica polisacarídica < 2 años No indicada > 2 años Altamente recomendable (al menos 2 meses desde conjugada) Repetir a los 5 años segunda y última dosis (hay datos que sugieren que dosis repetidas pueden afectar la inmunogenicidad a largo plazo) VNG: vacuna neumocócica conjugada
- 2.
Si el tratamiento va a ser solo transitorio, sepuede esperar a finalizarlo, mientras que si va a ser prolongado, se debería vacunar cuando el paciente esté con las dosis más bajas de inmunosupresores
- 3.
En niños con tratamiento inmunosupresor,hay que elegir siempre que se pueda el mejor momento para vacunar teniendo en cuenta que la respuesta inmunitaria es adecuada entre las 2 semanas antes de iniciar el tratamiento y un periodo de entre 3 y 12 meses después de suspendida la inmunosupresión3.
- 4.
Los pacientes vacunados 2 semanas antes del inicio del tratamiento o durante el mismo pueden necesitar ser revacunados 3–12 después de suspendida la inmunosupresión.
- 5.
No deben administrarse vacunas de virus atenuados entre 2 semanas antes y 3 meses después de un tratamiento inmunosupresor.
- 6.
Las vacunas de organismos no vivos son seguras en pacientes con enfermedades reumatológicas, si bien su eficacia puede no ser tan alta en algunos casos.
- 7.
Todos los convivientes deben tener actualizado el calendario vacunal incluyendo triplevírica, virus de la varicela zóster y gripe anual, estando contraindicadas el polio oral, la vacuna tifoidea oral (Salmonella typhy Ty21).
- 8.
En pacientes con dosis altas de inmunosupresión (tabla 3) se recomienda determinar los anticuerpos séricos a las 4–6 semanas de la vacunación, sobre todo si puede existir exposición.
Lectura rápida
Los pacientes pediátricos con enfermedades reumatológicas son un grupo con una alta susceptibilidad a las infecciones, que además aumentan el riesgo de exacerbaciones.
Actualmente, existe una práctica vacunal heterogénea entre distintos profesionales y una cobertura vacunal insuficiente.
Siempre que sea posible, deben administrarse todas las vacunas del calendario vacunal. Este debe actualizarse en cualquier sujeto antes de iniciar un tratamiento inmunosupresor y en aquellos que lo reciben debe elegirse el mejor momento (menor dosis, menor actividad de la enfermedad…).
Las vacunas de microorganismos no vivos son seguras y suficientemente eficaces en estos pacientes, aunque en algunos grupos, especialmente aquellos con lupus o con enfermedad activa, su eficacia parece ser algo menor. Su administración no se ha relacionado con empeoramiento de la enfermedad de base.
Las vacunas de organismos vivos, en general, están contraindicadas en pacientes con dosis altas de inmunosupresión o fármacos biológicos, y mientras no haya más datos disponibles debe respetarse siempre para vacunar el periodo entre 2 semanas antes y 3 meses desde su finalización. La vacuna oral frente a la polio y la fiebre tifoidea están contraindicadas en los pacientes con enfermedades reumatológicas, ya que existe una forma vacunal de microorganismos no vivos. Tanto en el paciente como en los contactos, se deben administrar de forma intramuscular.
Los pacientes vacunados 2 semanas antes del inicio del tratamiento o durante el mismo pueden necesitar ser revacunados al menos 3–12 después de suspendida la inmunosupresión, sobre todo en el caso de dosis altas de inmunosupresión o tratamiento con rituximab.
Se recomienda determinar los títulos de anticuerpos tras la vacunación en pacientes con dosis altas de corticoides o con rituximab y considerarlo en pacientes en tratamiento con antifactor de necrosis tumoral o dosis altas de otros inmunosupresores, así como en pacientes con metotrexato que reciban la vacuna neumocócica polisacarídica.
La respuesta vacunal en pacientes que reciben rituximab es mejor cuanto más alejada se administra de la infusión, por lo que su administración debería realizarse antes del inicio del tratamiento o varios meses más tarde. En pacientes con herida tetagénica que recibieron rituximab en las 24 semanas previas se recomienda administrar además la gammaglobulina antitetánica.
En cuanto ala vacunación antineumocócica, tras la ampliación de la indicación de la vacuna conjugada 13 valente a toda la edad pediátrica, se recomienda su administración (y muy especialmente en este grupo de pacientes) siguiendo el calendario vacunal, y en mayores de 2 años se debe administrar además la conjugada 23 valente. En aquellos mayores de 4 años, se debe administrar la vacuna conjugada en aquellos que nola hubieran recibido previamente.
La vacuna antigripal ha demostrado una disminución del riesgo de neumonía, bronquitis o infección viral en paciente con artritis reumatoide o lupus eritematoso sistémico, por lo que es fundamental administrarla.
Se vacunará a los contactos familiares, si está indicado por edad y estado de susceptibilidad, con la vacuna triple vírica, varicela y rotavirus, y anualmente con la vacuna antigripal. Está contraindicada la administración de la vacuna oral frente a la polio en los convivientes, en los que se debe vacunar con vacuna inactivada.
Elegir el momento óptimo de vacunación es un aspecto clave, que idealmente sería aquel en el que no haya fármaco inmunosupresor o la dosis sea baja y en el que la enfermedad esté inactiva o estable con baja actividad.
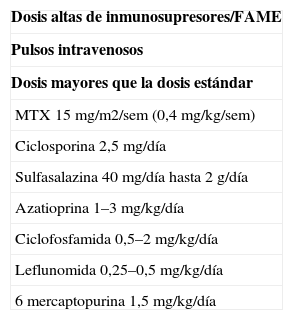
Tabla 3.Pautas que se consideran altamente inmunosupresoras
Dosis altas de inmunosupresores/FAME Pulsos intravenosos Dosis mayores que la dosis estándar MTX 15mg/m2/sem (0,4mg/kg/sem) Ciclosporina 2,5mg/día Sulfasalazina 40mg/día hasta 2g/día Azatioprina 1–3mg/kg/día Ciclofosfamida 0,5–2mg/kg/día Leflunomida 0,25–0,5mg/kg/día 6 mercaptopurina 1,5mg/kg/día FAME: fármacos modificadores de la enfermedad; MTX: metotrexato.
- 9.
Se consideran dosis inmunosupresoras de prednisona (tabla 4):
- –
>2mg/kg/día durante > 14 días.
- –
>1mg/kg/días durante > 28 días.
- –
>10kg: > 20mg/día durante > 14 días.
- –
Adultos con > 60mg/día.
Tabla 4.Dosis de corticoides considerados inmunosupresores.
Dosis inmunosupresoras de prednisona > 2mg/kg/día durante > 14 días > 1mg/kg/día durante > 28 días > 10kg: > 20mg/kg/día durante > 14 días Adultos con > 60mg/día Dosis no inmunosupresoras de prednisona Dosis fisiológicas por insuficiencia suprarrenal Corticoides tópicos o inhalados Orales pero a dosis bajas y en días alternos - –
En estos casos, deben evitarse las vacunas vivas atenuadas o al menos esperar 3 meses desde el final del tratamiento, antes de vacunar con virus vivos. En el caso de las inactivadas, su eficacia puede disminuir, por lo que puede ser preciso revacunar y, siempre que sea posible, se debe vacunar antes del inicio de la pauta corticoidea.
Aquellos que reciben dosis fisiológicas por insuficiencia suprarrenal, o corticoides tópicos o inhalados u orales pero a dosis bajas y en días alternos, pueden vacunarse de forma normal según el calendario.
Vacunas de organismos no vivosLas vacunas de organismos no vivos son seguras en pacientes con enfermedades reumatológicas. No hay datos que relacionensu administración con empeoramiento de la enfermedad de base y los efectos secundarios descritos no se diferencian de aquellos hallados en población sana2,4
Difteria-tétanos y tos ferinaLos pacientes con enfermedad reumatológica deben ser inmunizados frente a difteria, tétanos y tos ferina acelular (TDPa), siguiendo las indicaciones del calendario vacunal. Así, se recomienda la vacunación a los 2, 4,6 meses con dosis de recuerdo a los 18 meses y a los 4–6 años, si bien en mayores de 14 años se recomienda la administración de Td o incluso Tdpa (si está disponible), por tener menor carga antigénica.
Respecto a la vacunación antitetánica, parece ser igual de eficaz en el paciente con artritis reumatoide (AR) que en adultos sanos. El uso de esteroides o fármacos modificadores de la enfermedad (FAME) no parece disminuir su eficacia. Sin embargo, en pacientes que reciben tratamiento con rituximab (RTX) la respuesta es mejor si la vacunación se administra alejada de la infusión5. En pacientes con lupus se ha observado una adecuada respuesta vacunal, sin efectos adversos relevantes6.
Se recomienda administrar la vacuna antitetánica según el calendario vacunal o usar pautas aceleradas si es preciso. Siempre que sea posible, se debe realizar la inmunización antitetánica antes de iniciar el tratamiento con RTX o hacerlo lo más alejado posible de su infusión. En pacientes con herida tetagénica que recibieron RTX en las 24 semanas previas se recomienda administrar además la gammaglobulina antitetánica2,4.
Vacuna frente a la polioSe debe administrar la vacuna inactivada según el calendario vacunal con la misma pauta de primovacunación. Ni los pacientes ni los contactos deben recibir la vacuna oral3. No hay estudios en pacientes con enfermedades reumatológicas.
Vacuna conjugada Haemophilus influenzae tipo BSe recomienda administrar según el calendario vacunal. La vacuna conjugada Haemophilus influenzae tipo B ha demostrado ser segura y eficaz en pacientes con lupus. El 88% de los pacientes desarrollaron anticuerpos a títulos protectores7. No hay estudios en pacientes con otras afecciones reumatológicas, pero la recomendación es que debe administrarse según el calendario vacunal. Se debe considerar su administración en niños no vacunados hasta los 18 años3.
Vacuna frente a hepatitis B y ALa vacunación frente a hepatitis B ha demostrado ser segura y eficaz. Se recomienda su administración según el calendario vacunal, con una pauta de 0,1 y 6 meses por ser más inmunógena8.
En pediatría, un ensayo clínico en pacientes con artritis idiopática juvenil (AIJ) en remisión, en tratamiento con metotrexato (MTX) y/o corticoides, demuestra una respuesta de anticuerpos efectiva en la mayoría de los pacientes, independientemente del tratamiento con MTX o corticoides8. En pacientes con lupus eritematoso sistémico (LES) juvenil, se encuentran tasas de sero-conversión del 80–93%. El tratamiento con prednisona, azatioprina o hidroxicloroquina no influyó en la respuesta9. Otros estudios prospectivos encuentran resultados similares (tasas de seroconversión cercanas al 93%). En pacientes con enfermedad de Behcet también se ha comunicado una buena respuesta protectora (92,8% pacientes y 83,8% controles)9. En 4 pacientes se produjo una reacción de patergia en el lugar de inoculación. Se ha sugerido que el grado de actividad podría influir en la capacidad inmunogénica de la vacuna10.
En niños con dosis altas de inmunosupresores debe cuantificarse la respuesta de anticuerpos tras la vacunación; sin embargo, no existe un criterio unánime en cuanto a la actitud ante un niño vacunado que no tiene títulos protectores sobre la administración de solo una dosis de refuerzo o pauta completa de 3 dosis, si bien esta última opción, parece asegurar mayor protección3,11,12.
La vacuna frente a la hepatitis A ha sido estudiada en pacientes con hepatitis autoinmunitaria y se ha mostrado eficaz y segura. Se debe administrar según las guías nacionales o el destino del viaje, y siempre si el paciente tiene infección por el virus de la hepatitis B o C.
Vacunación antineumocócicaSe recomienda la administración de la vacuna neumocócica conjugada 13 valente (VNC-13) en todos los pacientes con enfermedad reumatológica siguiendo el calendario vacunal, teniendo en cuenta que se ha ampliado su indicación hasta los 17 años de edad. En mayores de 2 años, se debe administrar también la 23 valente. En la tabla 2 se especifica la pauta vacunal en estos pacientes en función de la edad.
Las vacunas neumocócicas conjugadas han demostrado ser más efectivas que las polisacarídicas debido a su mayor inmunoge-nicidad, la duración de la protección e la inducción de memoria inmunológica, y son de elección también en los pacientes inmu-nocompetentes.
En pediatría no se encontraron diferencias entre pacientes con AIJ que recibían MTX y antifactor de necrosis tumoral (anti-TNF) frente a anti-TNF o ciclosporina sin MTX (87–100% seroconversión) tras la administración de la vacuna conjugada heptavalente. Es difícil atribuir esta diferencia al MTX, ya que en este grupo había más pacientes con formas sistémicas, poliarticulares o de mayor evolución. No hubo infecciones neumocócicas invasivas durante 2 años de seguimiento13. Algunos estudios en adultos con AIJ han encontrado que el tratamiento con MTX disminuye la respuesta a las vacunas polisacarídicas (Pneumo23V) y recomiendan su administración previamente al inicio del tratamiento. Sin embargo, tras el tratamiento con anti-TNF la respuesta es similar a la de los controles sanos o a la de los que reciben placebo7,14. En pacientes adultos con AIJ se encontró también una menor respuesta en el grupo que en tratamiento con RTX. Su administración debería realizarse previamente al inicio del tratamiento o lo más alejado de la infusión que sea posible5.
Vacunación meningocócicaSe recomienda administrar a todos los pacientes según el calendario y la pauta vacunal establecida. La vacunación con vacuna conjugada MenC en pacientes con AIJ no agrava la enfermedad reumatológica y produce unos adecuados niveles de anticuerpos y actividad bactericida de los mismos15. No hay estudios sobre la vacuna tetravalente (ACWY), pero se recomienda administrar a personas que van a viajar a zonas endémicas. En caso de pacientes no vacunados previamente muy inmunodeprimidos al recibir la vacuna, se debe considerar la administración de una segunda dosis.
Vacuna antigripalSe ha demostrado una notable disminución del riesgo de neumonía, bronquitis o infección viral en adultos con LES o AR que reciben la vacunación antigripal, por lo que está recomendada su administración anual (salvo contraindicación) en todos los pacientes con enfermedades reumatológicas y sus convivientes2,3,16.
La vacuna antigripal es segura en niños con enfermedades reumatológicas. La estacional es muy eficaz en niños con AIJ, pero la respuesta, tanto humoral como celular, es menos firme en pacientes con LES17. Sin embargo, la vacunación con la cepa pandémica H1N1/2009 tuvo una eficacia menor en ambos grupos de pacientes18. En pacientes con AIJ no hubo diferencias de respuesta según el tipo de inmunosupresor, que fue adecuada incluso en 2 pacientes con más de 20mg/día de prednisona18. En pacientes con lupus en edad adulta, la respuesta parece más disminuida en aquellos tratados con azatioprina o corticoides19.
Otros estudios apoyan el hecho de que los pacientes con LES tienen una respuesta peor y menos sostenida tras vacunación antigripal. Una mayor dosis de antígeno, dosis adicionales, nuevos coadyuvantes u otras estrategias deben ser evaluadas para conseguir optimizar su respuesta18.
La vacunación antigripal generó una buena respuesta humoral en los pacientes con AR a los que se administró el mismo día del infliximab, pero fue discretamente peor en aquellos en los que se hizo 3 semanas más tarde. En pacientes con espondilitis anquilosante fue buena, independientemente del momento de su administración20. Otros estudios han encontrado resultados similares, con una leve disminución de la respuesta en los pacientes tratados con anti-TNF, pero sin diferencias importantes. El mayor tiempo de tratamiento condiciona una menor respuesta21,22.Sin embargo, la administración de RTX afecta de forma severa a la respuesta humoral durante varios meses23–25.
Se recomienda inmunizar antes de iniciar el tratamiento con RTX, ya que el periodo que debe pasar hasta que se restablece la respuesta es muy largo y no está bien establecido. Además, si fuera posible, se podría realizar titulación de anticuerpos posvacunales. Se desconoce el efecto de una segunda dosis de vacuna en primovacunación o escasa vacunación en los años previos y que efecto tendrá una vacunación repetida anualmente a largo plazo.
Vacuna frente al papiloma humanoNo existen datos sobre la seguridad o eficacia de la vacuna con Gardasil® o Cervarix® en pacientes con enfermedad reumatológica. Los datos preliminares de un estudio en 22 pacientes sugieren un buen perfil de seguridad26.
Puesto que los pacientes con LES tienen un mayor riesgo de infección persistente por virus linfotrópico de linfocitos T del ser humano y de lesiones intraepiteliales o cáncer de cerviz, parece interesante la administración de la vacuna en este grupo. Sin embargo, y puesto que se han descrito fenómenos tromboembólicos tras la vacunación con Gardasil®, se debe ser especialmente prudente, aunque es incierto si estos fenómenos tromboembólicos estuvieron o no relacionados con la vacuna14. Se desconoce la utilidad de una dosis extra de refuerzo.
Vacunas de organismos vivos atenuadosSe recomienda administrarlas según el calendario vacunal, respetando las contraindicaciones para las vacunas de microorganismos vivos (contraindicados en pacientes con altas dosis de inmunosupresión o fármacos biológicos, debe respetarse siempre para vacunar el periodo entre 2 semanas antes y 3 meses desde su finalización).
Actualmente, no hay un consenso sobre la mínima dosis de fármacos inmunosupresores que causa inmunodepresión clínicamente significativa. La falta de evidencia ha obligado a los fabricantes a recomendar precaución y a desaconsejar la administración de vacunas de virus vivos atenuados en pacientes con alteración de la inmunidad. Sin embargo, los pacientes con enfermedades reumatológicas tienen un mayor riesgo de presentar complicaciones o reactivaciones tras infecciones virales (p. ej., tienen una mayor probabilidad de desarrollar un síndrome de activación macrofágica o infecciones por el estreptococo del grupo A si reciben antiinflamatorios no esteroideos). El Colegio Americano de Reumatología contraindica la administración de vacunas de virus vivos en pacientes que reciben fármacos biológicos, pero no contraindica formalmente su administración en pacientes que reciben FAME no biológicos. Por otro lado, el Advisory Committee on Immunization Practices (http://www.cdc.gov/vaccines/pubs/vis/downloads/vis-pcv.pdf) no contraindica la vacuna del virus de la varicela zóster en pacientes con enfermedades inflamatorias que reciben dosis bajas de MTX, azatioprina o corticoides en dosis menores de 20mg/día.
El consenso EULAR y otros organismos recomiendan evitar las vacunas de virus vivos durante el tratamiento con dosis altas de corticoides, dosis altas de fármacos antirreumáticos modificadores de enfermedad (FARME) o fármacos biológicos al menos en el periodo que va desde las 2 semanas antes de su inicio hasta los 3 meses después de su suspensión (tabla 2). Aunque hay casos descritos de pacientes que han recibido vacunas de virus vivos atenuados con dosis altas, de momento no se puede recomendar su administración sistemática27. Ahora bien, en casos puntuales de mucho riesgo de infección (brotes epidémicos, etc.), se podría valorar en función del riesgo-beneficio que suponga la vacunación.
En recién nacidos de madres en tratamiento inmunosupresor, se ha demostrado que infliximab atraviesa la placenta y puede detectarse en sangre de lactantes a los 6 meses. Así, estos niños no deberían recibir vacunas de virus vivos atenuados durante este tiempo, incluyendo rotavirus
Vacunación frente a varicelaSe recomienda administrarla según el calendario vacunal, respetando las contraindicaciones para las vacunas de microorganismos vivos.
La vacunación en 20 pacientes pediátricos con enfermedades reumatológicas juveniles y entre 2 y 19 años, en tratamiento con MTX con dosis, en algunos casos, incluso mayores de 20mg/m2/semana (algunos de ellos con corticoides y otros FARME asociados), fue segura, aunque con tendencia a una menor inmunogenicidad que en los controles (el 50 frente al 75% alcanzaron títulos positivos). La diferencia no fue estadísticamente significativa (baja potencia del estudio). Se estimó una tasa de ataque del 25% tras la exposición posterior a varicela (efectividad esperada en niños sanos: 44–100%). Uno de los pacientes que recibía anti-TNF en el momento del contacto con un paciente con varicela desarrolló una varicela grave28. En pacientes con LES inactivo o con baja actividad se encontró una adecuada inmunogenicidad tras la administración de una dosis de vacuna de varicela sin efectos secundarios importantes29. Se recomienda administrar 2 dosis de vacuna de varicela, preferiblemente antes de iniciar el tratamiento inmunosupresor, respetando las contraindicaciones generales de vacunas con agentes vivos vigentes en el momento actual (http://www.cdc.gov/vaccines/pubs/vis/downloads/vis-pcv.pdf).
Sarampión, rubéola, paperas (triple vírica)Se recomienda administrarla según el calendario vacunal, respetando las contraindicaciones para las vacunas de microorganismos vivos.
El aumento de casos de sarampión en los últimos años en diferentes países europeos plantea su prevención como una prioridad en este grupo de pacientes30. En pacientes pediátricos con AIJ que recibieron la vacuna durante el tratamiento con MTX, no hubo diferencias estadísticamente significativas respecto al grupo sano control, aunque hubo una tendencia hacia una menor respuesta, tanto humoral como celular. En aquellos que recibían MTX y etanercept hubo una tendencia a un menor número de células productoras de interferón gamma específicas, mientras que la respuesta humoral aparecía levemente aumentada. Las diferencias no alcanzaron significación estadística, pero el tamaño muestral era pequeño27. No hubo efectos secundarios relevantes ni empeoramiento, como tampoco se ha encontrado en un estudio retrospectivo en pacientes que habían recibido la segunda dosis de triple vírica durante el curso de su enfermedad (los pacientes recibieron tratamiento con MTX hasta incluso dosis de 25mg/m2/semana)31.
Se recomienda administrar la vacuna triple vírica según el calendario vacunal, excepto en pacientes con dosis altas de inmunosupresores, FARME y dosis altas de corticoides, dado que no hay datos suficientes para garantizar su seguridad en este grupo. Se debe evitar la vacunación en pacientes con enfermedad activa, especialmente nefritis3.
RotavirusNo hay estudios en pacientes con enfermedades reumatológicas en relación con la vacunación frente a rotavirus. Se mantienen las consideraciones generales respecto a las vacunas de microorganismos vivos y se recomienda su administración, si esta es posible.
Vacunación frente a fiebre amarillaSe recomienda administrarlas según el calendario vacunal, en los países en los que se recomienda su administración, respetando las contraindicaciones para las vacunas de microorganismos vivos.
Existe poca bibliografía en relación con su seguridad y eficacia en pacientes reumatológicos. Mientras no haya más datos disponibles, se mantienen las recomendaciones relativas a la vacunación con otro tipo de vacunas vivas atenuadas, ya que existe riesgo de enfermedad viscerotrópica. Si no se puede vacunar al niño, se deben recomendar estrictas medidas de protección frente los mosquitos (repelentes, mosquiteras en las camas, etc.)12.
Un estudio que evalúa los resultados de la administración de una dosis de recuerdo (booster) en pacientes en tratamiento con MTX e infliximab encontró una buena respuesta vacunal. No hubo efectos secundarios importantes ni enfermedad por el virus vacunal. Estos resultados de seguridad no son extrapolables a pacientes viajeros sin vacunación previa32.
Otras vacunasNo hay datos sobre vacunación contra cólera, encefalitis japonesa, encefalitis centroeuropea, fiebre tifoidea o rotavirus. Se recomienda que estas vacunas sean administradas según las guías de vacunación nacional o el destino del viaje, teniendo en cuenta que en el caso de la fiebre tifoidea se debe administrar únicamente la intramuscular (la vacuna oral es atenuada) y que para las vacunas de virus vivos hay que seguir las recomendaciones en pacientes con inmunosupresores o fármacos biológicos12.
La vacuna BCG no debe administrarse sistemáticamente, ya que es una vacuna de bacilos vivos atenuados y existe riesgo de diseminación en pacientes inmunodeprimidos.
Titulación de anticuerpos tras la vacunaciónSe recomienda determinar los títulos de anticuerpos tras la vacunación en pacientes con dosis altas de corticoides o con RTX y considerarlo en pacientes en tratamiento con anti-TNF o dosis altas de otros inmunosupresores. También en pacientes con MTX que reciban la vacuna neumocócica polisacarídica2,3.
Vacunación de familiaresSe vacunará a los contactos familiares, si está indicado por edad y estado de susceptibilidad, con vacuna triple vírica, varicela y rotavirus, y anualmente con la vacuna antigripal. Está contraindicada la administración de la vacuna frente a la polio oral en los convivientes, en los que se debe vacunar con vacuna de polio inactivada3. En el caso del rotavirus, existe excreción al menos una semana después de la vacunación, por lo que se aconsejan medidas higiénicas de lavado de manos, etc., de los conviviente vacunados.
ConclusionesLos pacientes con enfermedades reumatológicas son un grupo especialmente vulnerable a las infecciones en los que es necesario instaurar todas las medidas a nuestro alcance para evitarlas.
Es importante anticipar la necesidad de inmunosupresión de un paciente reumatológico, con el fin de vacunar antes de su instauración.
Elegir el momento óptimo de vacunación es un aspecto clave, que idealmente sería aquel en el que no haya fármaco inmunosupresor o la dosis sea baja y en el que la enfermedad esté inactiva o estable con baja actividad.
Es fundamental tener siempre presente que, al contrario de la antigua tendencia a no vacunar a estos pacientes por diversas razones, se trata de un grupo donde la vacunación es esencial y debemos vacunar pronto y de la forma más completa posible.
Los autores declaran no tener ningún conflicto de intereses.