Puntos clave
- •
El grado de alerta diagnóstica es clave para mejorar el retraso diagnóstico en la enfermedad inflamatoria intestinal pediátrica (EII-P).
- •
Un adecuado diagnóstico del tipo de enfermedad, extensión y severidad es básico para optimizar el tratamiento.
- •
La enterorresonancia magnética debe sustituir al tránsito digestivo completo o tomografía computarizada por su rentabilidad y menor radiación.
- •
El tratamiento de la EII-P debe establecer estrategias para minimizar el uso de corticoides, como el empleo precoz de tiopurinas o, ante recaídas, el uso de antifactor de necrosis tumoral (TNF). La nutrición enteral debe ofrecerse como primera opción terapéutica en la enfermedad de Crohn.
- •
Aunque muy eficaces en la inducción y mantenimiento, la terapia top-down con anti-TNF se reserva para casos severos o complicados por los riesgos potenciales del tratamiento y la ausencia de estudios en Pediatría.
- •
Los pacientes en tratamiento con inmunomoduladores o anti-TNF deben seguir medidas preventivas de infecciones y tener actualizado su calendario vacunal.
La colitis ulcerosa (C U) y la enfermedad de Crohn (EC) son las formas clínicas de la enfermedad inflamatoria intestinal (EII). Tras exponer en la primera parte aspectos de su clasificación, etiopatogenia y clínica, se consideran ahora su diagnóstico y tratamiento. El diagnóstico debe basarse inicialmente en la sospecha clínica, optimizando criterios de derivación a centros especializados, donde se realizarán tanto un estudio endoscópico protocolizado, como pruebas de imagen de intestino delgado en la EC. El tratamiento debe perseguir la mejoría clínica, la curación de las lesiones intestinales y el mantenimiento de la remisión sin brotes de actividad, preservando la nutrición y el crecimiento. La nutrición enteral es el tratamiento de elección en la EC frente a los corticoides. Los inmunomoduladores y los fármacos biológicos se emplean con precocidad en los esquemas terapéuticos por su beneficio clínico y ahorro de esteroides, considerando siempre aspectos de seguridad por sus potenciales efectos adversos.
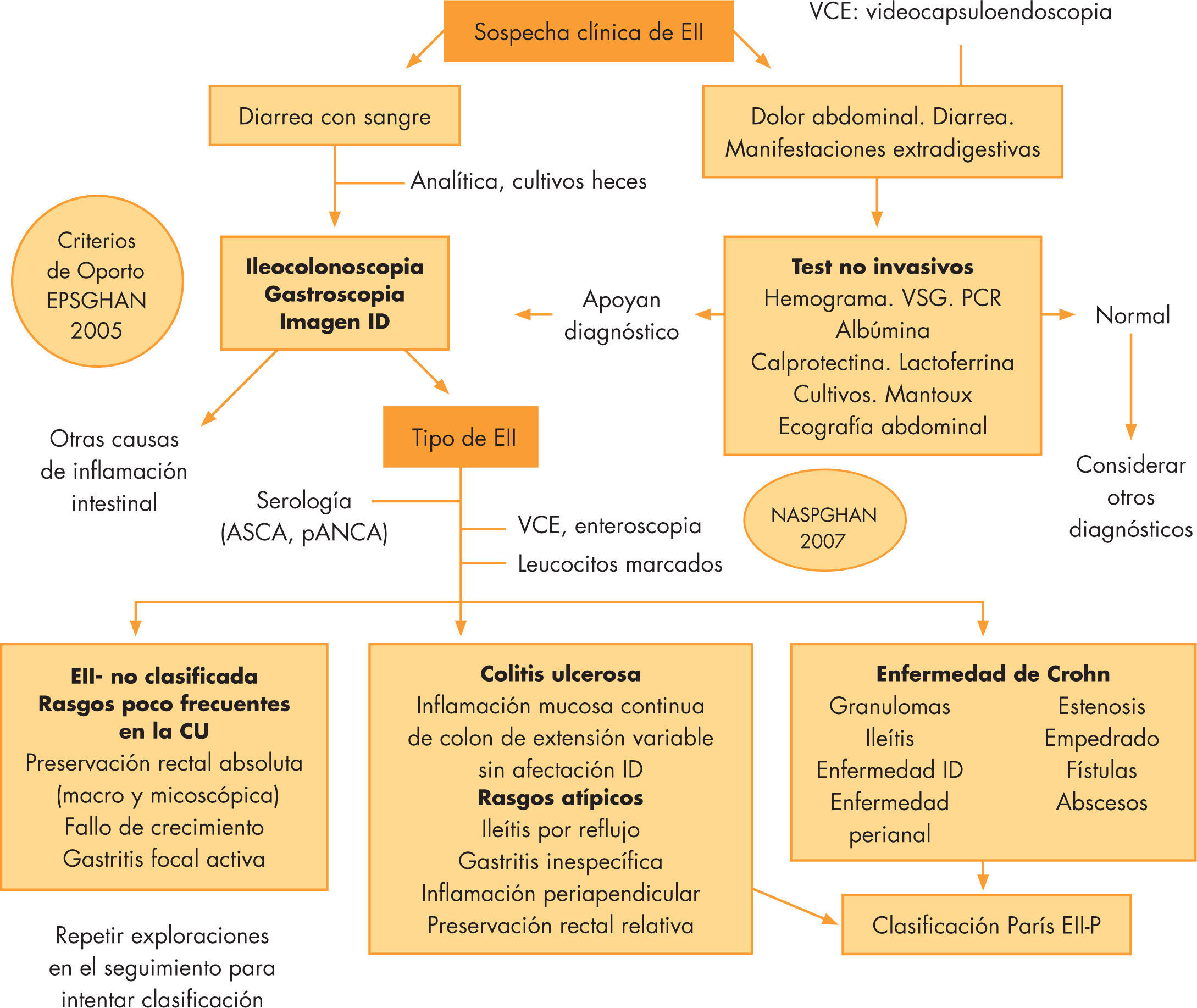
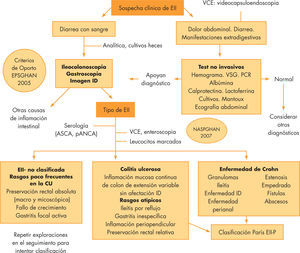
Diagnóstico de la enfermedad inflamatoria intestinalEl diagnóstico se basa en la combinación de una serie de hallazgos clínicos, analíticos, endoscópicos o radiológicos, que deben determinar el tipo de EII y su correcta clasificación (fig. 1).
Esquema diagnóstico de la enfermedad inflamatoria intestinal en pediatría, basado en los Criterios de Oporto y de la NASPGHAN10,11. CU: colitis ulcerosa; EII-P: enfermedad inflamatoria intestinal pediátrica; ID: intestino delgado; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Ambas son claves para el diagnóstico de sospecha. El retraso en el diagnóstico, mayor en la EC, puede conducir a que la enfermedad esté más evolucionada, con más afectación del crecimiento y peor respuesta al tratamiento1. Algunas situaciones que se deben destacar, entre las muchas que pueden surgir, serían las siguientes. Deben derivarse a aquellos niños con diarrea con sangre de más de 1 semana de evolución con coprocultivo negativo o cuando la diarrea sea severa (más de 6 deposiciones al día o con síntomas asociados)2. Debe sospecharse la EII ante enlentecimientos del crecimiento y la pubertad, con edad ósea retrasada y estudios etiológicos negativos; en casos de dolor abdominal crónico o diarrea con síntomas o signos de alarma según los criterios de Roma de la patología funcional; en casos de fisuras anales crónicas o múltiples, fuera de la línea media, y otros hallazgos de la enfermedad perianal; con aftas bucales recurrentes, anorexia persistente, artritis y otras manifestaciones extradigestivas que pueden anticiparse a las intestinales. Y, sobre todo, ante niños con historia familiar de EII, uno de los principales factores de riesgo.
La exploración física debe ser completa, incluyendo la región perianal. Deben valorarse aspectos de la nutrición realizando una historia dietética y un cálculo de la cantidad de nutrientes, la medición de la velocidad de crecimiento, el estadio puberal y el cálculo la talla diana genética, importante predictor de la talla final.
El diagnòstico diferencial es amplio e incluye causas infecciosas, alérgicas, vasculitis o inmunodeficiencias (tabla 1).
Diagnóstico diferencial de la enfermedad inflamatoria intestinal en pediatría
| Enfermedad | EC | CU |
| Causas infecciosas | ||
| Apendicitis aguda | ++ | – |
| Adenitis mesentérica | ++ | – |
| Tiflitis | ++ | ++ |
| Colitis o ileítis (Yersinia, E. coli enteropatógeno, Campylobacter, Shigella, Mycobacterium TBCa, Anisakisa, Entamoeba, Clostridium difficile) | + | +++ |
| Vasculitis | ||
| Púrpura de Schönlein-Henoch, síndrome hemolítico urémico; lupus eritematoso sistémico, isquemia… | + | +++ |
| Inmunodeficiencias | ||
| Enfermedad granulomatosa crónicaa | ++ | + |
| Síndrome de Wischkot Aldrich, NEMO… | ++ | + |
| Alérgicas | ||
| Colitis o enteritis eosinofílica | + | +++ |
| Otras | ||
| Glucogenosis tipo 1b | ++ | – |
| Sarcoidosisa | ++ | – |
| Úlcera rectal solitaria | + | |
| Enterocolitis Enfermedad de Hirschprung | + | ++ |
| Linfoma | ++ | + |
| Síndrome de Hermansky-Pudiaka | ++ | + |
- –
En sangre:
- 1.
Determinaciones combinadas de rutina: hemograma, bioquimica y marcadores de inflamación comò la velocidad de sedimentación (VS) o la proteina C reactiva (PCR). Cuando los resultados estàn alterados los test son de ayuda, pero pueden ser normales en formas leves, sobre todo en la CU3. Elio no debe demorar el estudio diagnòstico si la sospecha cllnica es alta. La PCR es mejor marcador de inflamación que la VS en la EH, especialmente en la EC. De vida media mas corta, su elevación es mas precoz y su normalización mas ràpida con el tratamiento. Es un marcador de curación mucosa y en los ensayos con fàrmacos biológicos la elevación de la PCR es predictor de buena respuesta4. En la CU, una vez identificado cuàl se asocia mejor a inflamación en un paciente determinado, ese marcador suele ser fiel a lo largo del tiempo5. La hipoalbuminemia en la EC aporta severidad en el Pediatrie Crohn's Disease Activity Index (PCDAI) y se ha correlacionado con un mayor riesgo de cirugia y de enfermedad ósea. La elevación de las transaminasas puede relacionarse con la actividad inflamatoria, problemas nutricionales o enfermedades asociadas (colangitis esclerosante primaria o hepatitis autoinmunitaria).
- 2.
Serologia: la determinación de varios anticuerpos comò anticuerpos antineutrófilo de patron perinuclear (pANCA), anticuerpos anti-Saccaromyces cerevisae (ASCA) y otros dirigidos frente a antigenos bacterianos (anti-OmpC, anti-CBirl, anti-I2, antiglucanos), algunos no disponibles aùn en la pràctica, puede usarse en varios escenarios. Para la distinción entre EH y otras enfermedades no ofrece un rendimiento diagnòstico superior a las determinaciones de rutina, porque individualmente los anticuerpos tienen sensibilidad baja. La utilización de un panel serológico con multiples anticuerpos no supera tampoco las determinaciones analiticas de rutina6. Ademàs, la positividad en si misma comò test de cribado no es suficiente para el diagnòstico, siendo necesaria la evaluación endoscópica. La serologia puede ser ùtil, sin embargo, para la distinción fenotipica entre EC o CU, los ASCA positivos en la EC y pANCA en la CU o la EC de afectación còlica, e incluso llegar a tener un valor pronostico: la positividad de los ASCA se ha relacionado con enfermedad ileal y el fenotipo estenosante7. La positividad a un mayor nùmero de anticuerpos condiciona un mayor riesgo de evolución a formas complicadas8. Los anticuerpos tienen un perfil dependiente de la edad9 (ASCA mas frecuentes en ninos mayores y adolescentes, anti-CBirl mas frecuente en ninos pequenos).
Lectura rápida
El diagnóstico precoz de la enfermedad inflamatoria intestinal en pediatría (EII-P) debe basarse en mantener un grado especial de alerta o sospecha, dada la creciente incidencia de la misma, identificando síntomas o signos de alarma que sugieran una ágil derivación al especialista por parte del pediatra de atención primaria.
- 3.
Las determinaciones genéticas no están disponibles en la clínica de rutina. Es posible que en el futuro, junto a determinaciones serológicas, puedan ayudar a identificar y clasificar mejor la EII.
- 1.
- –
En heces: la calprotectina y lactoferrina son proteinas liberadas por los neutrófilos que migran a la pared intestinal y que pueden determinarse cuantitativamente en las heces, permaneciendo estables 7 dias en el caso de la primera y un dia la segunda. Valores elevados pueden ayudar a diferenciar la EH de procesos funcionales. En pacientes con sospecha de Eli, la sensibilidad de la calprotectina es del 92% y la especifìcidad del 76%10. Los marcadores fecales predicen los brotes en el curso de la enfermedad y su negativización se correlaciona con la curación mucosa4.
Al diagnòstico y en brotes de actividad, deben realizarse cultivos en heces para enteropatógenos habituales y Clostridium difficile.
Endoscopia e histologiaLa endoscopia es la exploración inicial de elección ante la sospecha de EII. La Sociedad Europea de Gastroenterologia, Hepatologia y Nutrición Pediàtricas estableció en 2005 un protocolo para la evaluación inicial del paciente con sospecha de EII , destacando la importancia de realizar una ileocolonoscopia y una endoscopia alta con toma seriada de biopsias para una valoración diagnòstica adecuada (Criterios de Oporto)11. Este protocolo inicial permite valorar adecuadamente la localización y la extension de las lesiones y diferenciar entre EC y CU, disminuyendo la probabilidad del diagnòstico de EH no clasificada (EII-noC)12 (fig. 1).
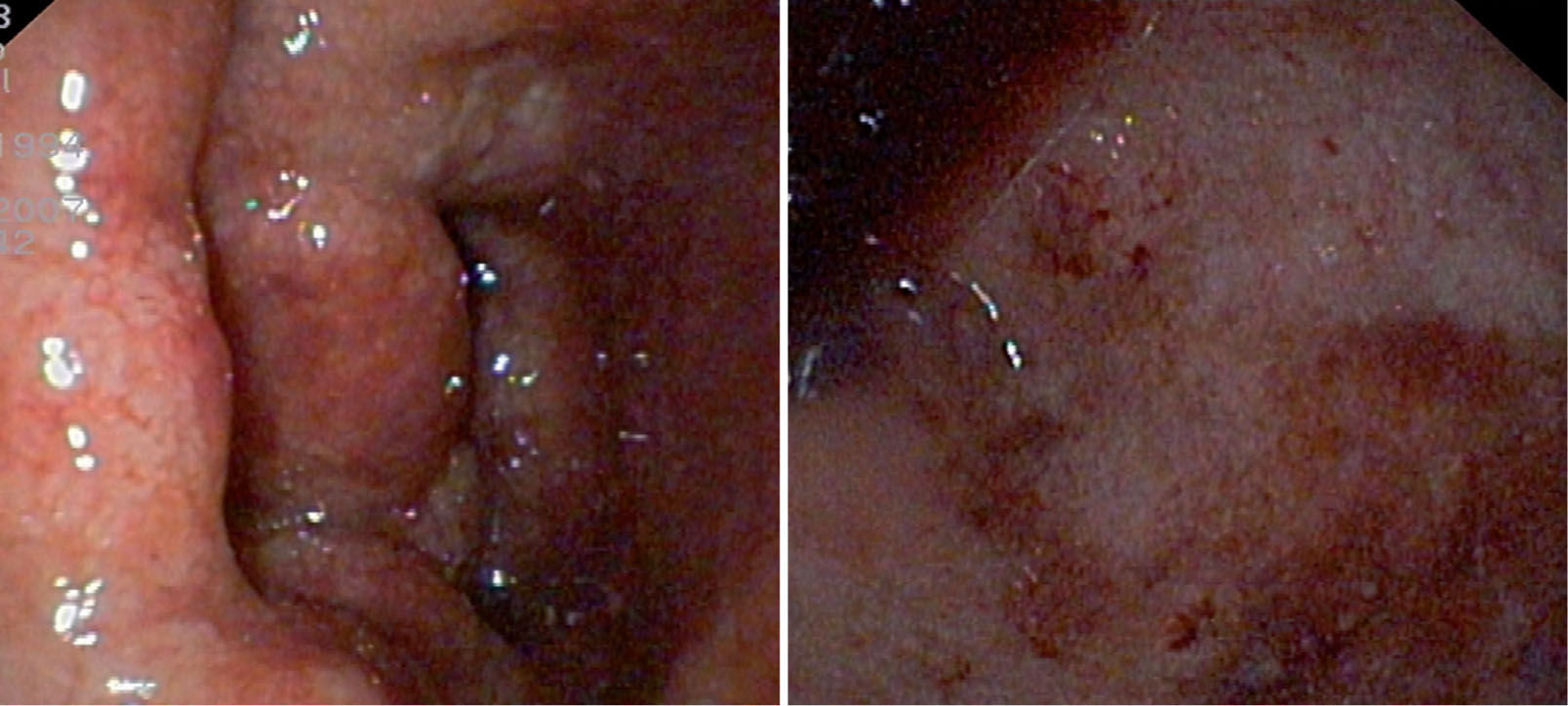
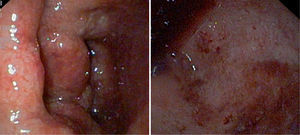
Tipicamente, en la CU la enfermedad comienza en el recto y alcanza una variable extension proximal. Se puede apreciar diferente intensidad de la inflamación con pérdida del patron vascular normal de colon, friabilidad al roce, hiperemia, ùlceras pequenas o confluentes, mucosa de aspecto granujiento y hemorragias espontàneas (fig. 2). En las formas evolucionadas aparecen seudopólipos, pérdida de haustración y de pliegues mucosos. La inflamación mucosa es continua, pero se han descrito en los ninos rasgos atipicos comò la distribución parcheada con preservación rectal en un 23% de los ninos con CU sin tratamiento, la ileitis por reflujo o la inflamación periapendicular con proctitis12. Los hallazgos histológicos afectan a la mucosa y submucosa superficial, son inespecificos y deben diferenciarse de otras formas de colitis infecciosas o alérgicas donde no suelen encontrarse hallazgos de cronicidad, a saber: distorsión arquitectural de la mucosa, infiltrado inflamatorio en la profundidad de las criptas, metaplasia células de Paneth y depleción de moco. Un 10–30% de los casos iniciales de CU pediàtrica pueden no mostrar estos signos de cronicidad especialmente en ninos menores de 10 afios13. La presencia de abscesos cripticos y de infiltrado neutrofilico superficial indica actividad.
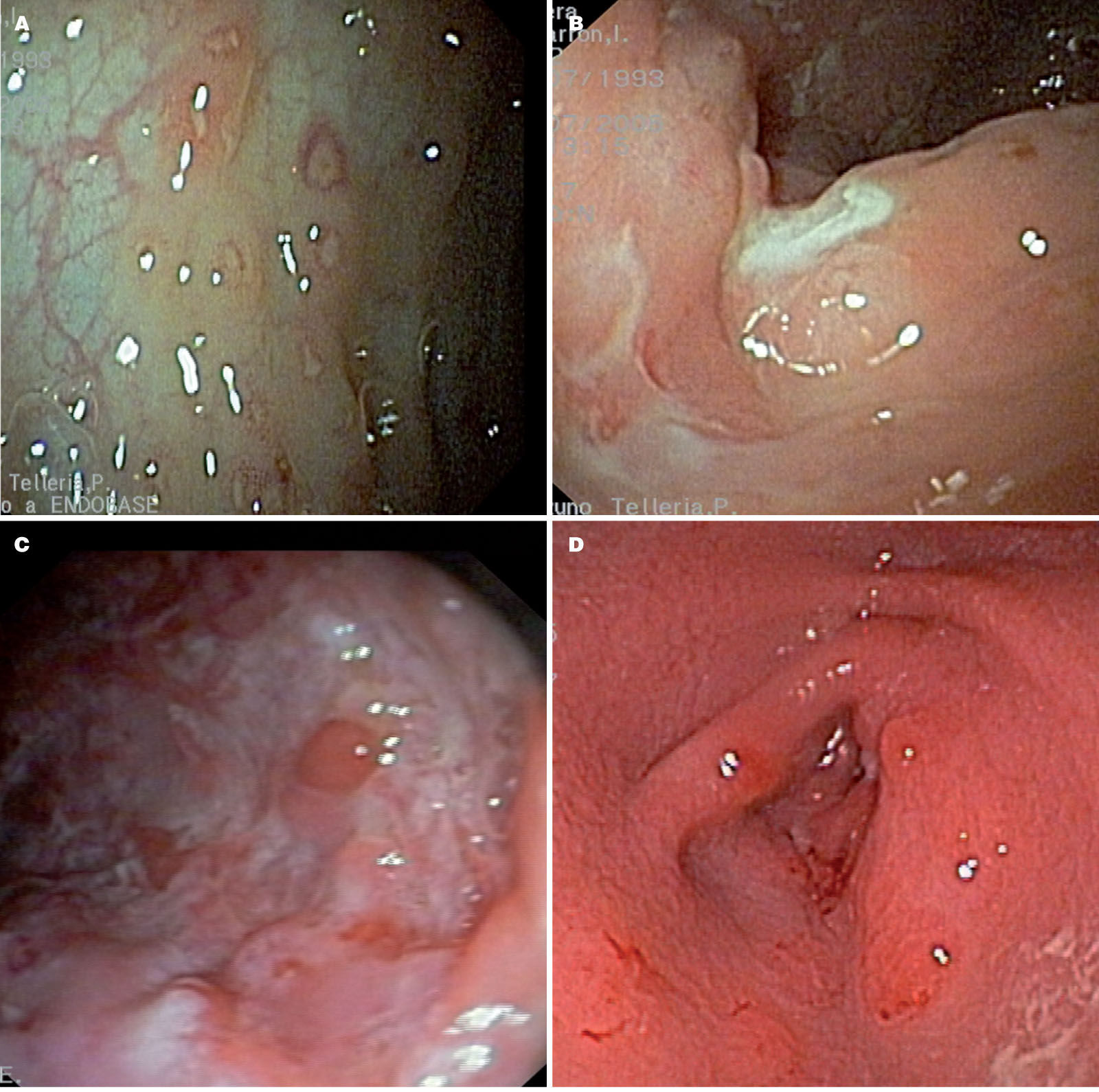
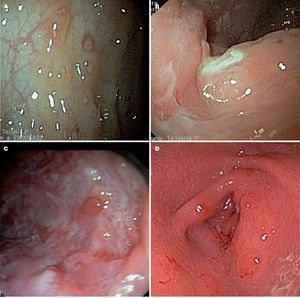
En la EC la zona mas frecuentemente afectada es la region ileocecal. La afectación còlica se produce con mas frecuencia en ninos. Se encuentra afectación en la endoscopia alta en un porcentaje variable de casos (hasta en 40%), contribuyendo a su diagnòstico14,15. Las lesiones son segmentarias y profundas. Inicialmente ùlceras aftosas, pequenas, hasta irregulares y lineales con aspecto de la mucosa en empedrado (fig. 3). Las lesiones histológicas son focales, pueden existir fisuras hacia capas profundas y especialmente granulomas no necrotizantes, lejos de las criptas, en la submucosa o foliculos linfoides. Se identifican en el 61% de los casos pediàtricos cuando la investigación es completa y, de ellos, el 42% se encuentra en ileon terminal o tracto digestivo superior16.
Técnicas de imagenSe emplean para estudiar el intestino delgado en la EC, la enfermedad perianal y valorar la extension de la EH y sus posibles complicaciones extraluminales. Las técnicas de corte axial, comò la ecografia o la enterorresonancia, han sustituido al trànsito digestivo con contraste baritado, por su mejor sensibilidad y especificidad, y por la credente preocupación por las dosis acumuladas de radiación. Permiten la identificación de la EC transmurai y extraluminal, no valorables por endoscopia17.
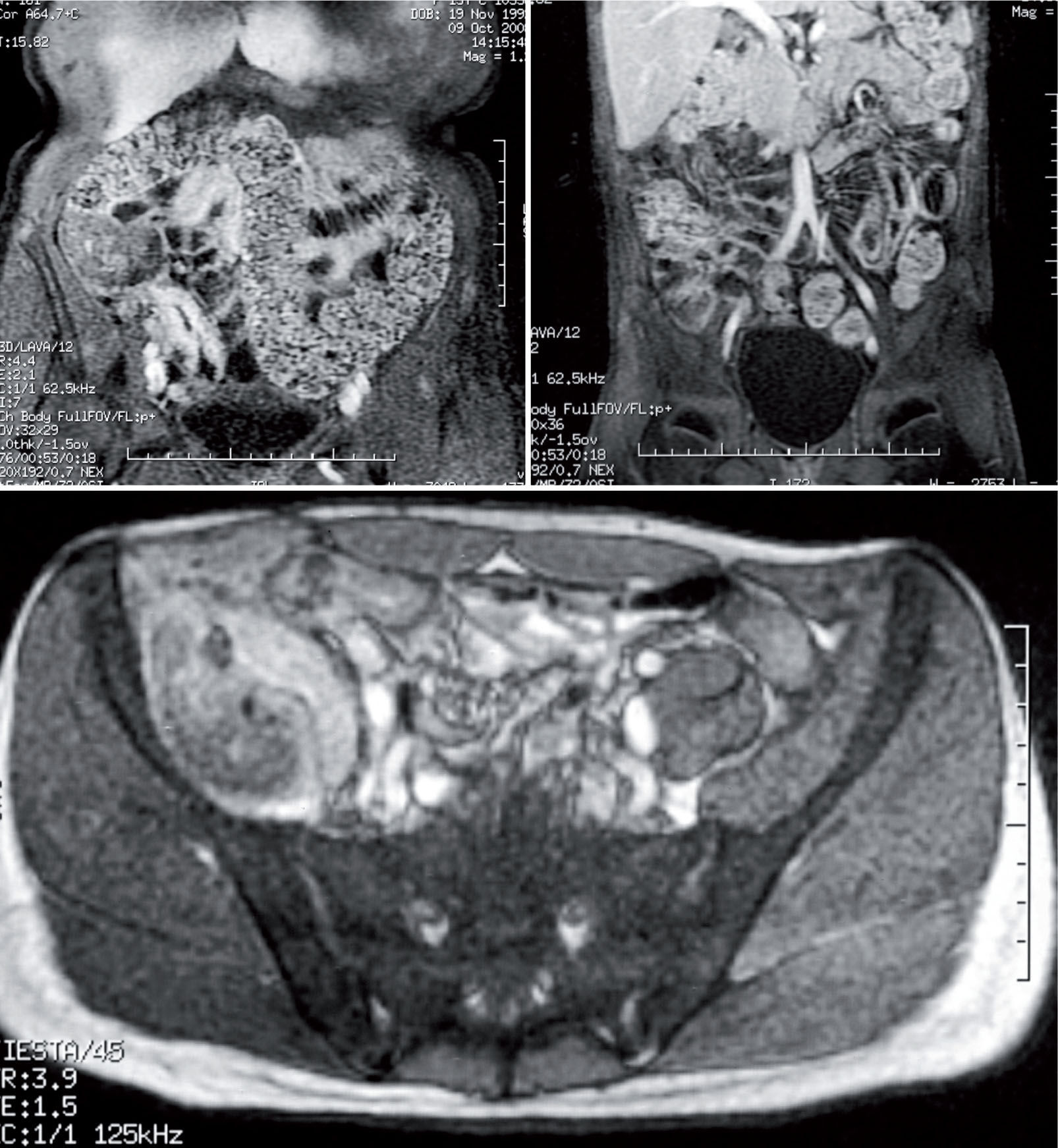
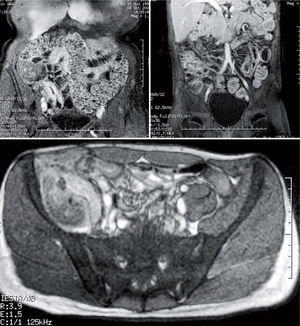
La ecografia es una tècnica inicial adecuada, disponible, no invasiva, aunque explorador dependiente que, sin o con contraste orai, valora la afectación ileal y de colon (grosor de la pared, estratificación, rigidez, pérdida de haustración…) pudiendo graduarse la afectación si se dispone de la cuantificación por Doppler de la vascularización intestinal. La enterorresonancia necesita de la colaboración del paciente que debe ingerir un contraste orai abundante (polietilenglicol) o bien darlo por sonda (enteroclisis). Se realiza con contraste por via intravenosa (gadolinio). Permite valorar la actividad inflamatoria por el engrosamiento de la pared con hipercaptación de contraste, ulceración, aumento de la vascularización mesentérica e inflamación perientérica18 (fig. 4), con una sensibilidad y especificidad elevadas, y distinguir entre estenosis por fibrosis o inflamación. La resonancia magnètica pèlvica es crucial junto con la exploración bajo anestesia para el estudio de la enfermedad perianal y descartar abscesos que contraindiquen el uso de tratamiento biològico hasta su tratamiento. La tomografia computarizada debe reservarse para situaciones especiales o de urgencia, por las elevadas dosis de radiación que supone19.
Lectura rápida
Los antecedentes de EII en familiares cercanos son un importante factor de riesgo. Las determinaciones analíticas de rutina (hemograma, albúmina, bioquímica, velocidad de sedimentación globular o proteína C reactiva) contribuyen al diagnóstico y superan en sensibilidad a la serología ante la sospecha de EII.
La gammagrafia con leucocitos marcados (Tc99 HMPAO) puede ayudar a definir la extension de la enfermedad, diferenciar EC de CU o valorar una estenosis corno inflamatoria por la captación de trazador. Aunque atractiva por sus bajas dosis de radiación hay falsos positivos y negativos, y es una tècnica imprecisa en la localización anatòmica.
Lectura rápida
La serología es útil sin embargo en la diferenciación del tipo de EII y puede tener en ocasiones valor pronóstico (peor evolución). Los marcadores fecales como la calprotectina y lactoferrina ayudan en el diagnóstico diferencial entre EII y otras enfermedades, y sirven de control no invasivo de la curación de las lesiones mucosas. Ante la sospecha de EII en el niño, debe realizarse una ileocolonoscopia y una endoscopia alta, con estudio radiológico del intestino delgado en la enfermedad de Crohn (EC), porque ello permite la diferenciación del tipo de EII y efectuar un tratamiento adecuado.
La capsuloendoscopia20 (CE) y la enteroscopia con doble balón21 permiten en casos seleccionados la valoración de la mucosa del intestino delgado y, ademàs con la segunda, tornar biopsias o realizar procedimientos terapéuticos comò dilataciones de estenosis. Utiles en casos de EII-noC o en casos de EC con sintomas o signos no explicados. La CE debe ir precedida de una tècnica de imagen para descartar estenosis (riesgo de retención de la càpsula) o bien utilizar antes la llamada càpsula patency, inactiva, que se disolveria espontàneamente tras 30h si es atrapada. La CE puede usarse en ninos pequenos colocàndola con endoscopia en duodeno.
TratamientoLos objetivos del tratamiento de la EII-P son inducir la remisión cllnica de la enfermedad activa, mantenerla sin recaidas o brotes de actividad, permitir un crecimiento adecuado al potencial genètico y minimizar efectos adversos. Se acepta que ademàs es conveniente procurar la curación de las lesiones intestinales y no conformarse solo con la mejoria de los sintomas. Deben perseguirse también objetivos de calidad de vida atendiendo a aspectos psicológicos, familiares, escolares o sociales.
El tratamiento mèdico se basa en la localización, extension y severidad de la afectación. El empieo de medicaciones especificas en la EH se extrapola en muchas ocasiones de evidencias de los estudios en población adulta, por la escasez de ensayos clinicos aleatorizados en pediatria22.
Tratamiento medico de la enfermedad de CrohnTratamiento de la enfermedad de Crohn activaEl tratamiento inicial o de primera linea suele ser el tratamiento nutricional o los corticoides. En las formas severas o complicadas pueden usarse de entrada los tratamientos biológicos. Al elegir alguno de ellos es importante disenar una estrategia adecuada para el mantenimiento de la remisión y valorar la situación y el impacto potencial en el crecimiento.
Nutrición enteral exclusivaEs el tratamiento de elección en la mayoria de los paises de Europa23 en la EC de cualquier localización. Se utiliza una dieta polimèrica, de proteina entera, por su mejor aceptación por via orai, durante 6 a 8 semanas de forma exclusiva. Las dietas elementales tienen la misma eficacia por via oral o por sonda. Consigue la remisión en un 60-80% de los pacientes en el debut de la enfermedad mejorando de forma global la situación nutricional del paciente24. Ofrece peores resultados en el tratamiento de las recaidas. Tiene una mayor eficacia que los corticoides para inducir la curación de las lesiones mucosas25. El paciente precisa de adecuado soporte mèdico y dietètico para asegurar la ingesta de volùmenes adecuados. No se conoce el mecanismo de acción, especulàndose que podria estar mediado por la modificación de la flora intestinal26. Tras el cese del tratamiento, las recaidas son frecuentes, por lo que la estrategia de mantenimiento puede ser el uso de nutrición enteral parcial (combinar dieta normal y dieta polimèrica liquida) con distintas estrategias o el uso de inmunomoduladores (azatioprina) de forma precoz.
Lectura rápida
Las técnicas radiológicas de corte axial (ecografía y, en especial, resonancia magnética intestinal) permiten valorar mejor que el tránsito digestivo la afectación inflamatoria, definir el grado de actividad y valorar complicaciones extraluminales sin aumentar la exposición a radiación. El tratamiento de la EII-P se basa en la intensidad y localización de las lesiones. Debe perseguirse tanto la mejoría clínica como la curación de las lesiones mucosas. En la EC la nutrición enteral y los corticoides ofrecen la misma eficacia clínica en inducir la remisión, aunque la primera es mejor en la curación mucosa.
Lectura rápida
Se recomienda la introducción precoz de tiopurinas para el mantenimiento de la remisión bien al diagnóstico en casos de riesgo o ante la primera recaída. Los antifactor de necrosis tumoral (TNF) se emplean cada vez más precozmente por su eficacia en formas refractarias y sus beneficios en el crecimiento y calidad de vida. La terapia top-down (empleo inicial de anti-TNF) se reserva para los casos de comienzo o complicado. La mesalazina es útil en la colitis ulcerosa (CU), tanto para inducir la remisión como en el mantenimiento.
Son eficaces para inducir la remisión cllnica (no asi la curación mucosa) en pacientes con EC moderada o severa a dosis de 1 o 2mg/kg, con un màximo de 40–60mg al dia hasta la mejoria cllnica con descenso progresivo de la dosis hasta su retirada completa en 8–12 semanas. Las estrategias actuales aconsejan minimizar su uso, empleando precozmente un inmunomodulador comò mantenimiento. La corticodependencia ocurre en un 30% de los pacientes27. En las formas leves ileocólicas es eficaz la budesonida por via orai28 de liberación selectiva en ileon y colon proximal, de acción tòpica, con menos efectos adversos que los corticoides convencionales por su ràpido metabolismo hepàtico. La dosis es de 9mg al dia durante varias semanas con descenso posterior.
Fàrmacos biológicosSon diferentes anticuerpos monoclonales frente a mediadores de la inflamación, en especial antifactor de necrosis tumoral alfa (anti-TNF-α): infliximab (quimérico, ùnico autorizado hasta el momento, de infusion intravenosa) y adalimumab (humanizado, se administra por via subcutànea, precisa autorización especial para su uso). Con certulizumab (anti-TNF humanizado unido a una molécula de polietilenglicol) no existen aùn estudios pediàtricos. Otro biològico de uso esporàdico es el natalizumab, anticuerpo monoclonal anti ocintegrina. Los anti-TNF han supuesto un avance considerable en el control de la EC severa o refractaria a los tratamientos anteriores. Un estudio pediàtrico, multicéntrico con infliximab, aleatorizado y abierto, compara 2 regimenes de administración de mantenimiento en 112 pacientes (estudio REACH)29. Tras la inducción con 5mg/kg/dosis a las 0, 2 y 6 semanas, en un 88% hubo respuesta cllnica (mejoria PCDAI en al menos 15 puntos) y un 59% estaba en remisión (PCDAI < 10) a las 10 semanas. Adalimubab suele emplearse tras la pérdida de eficacia con infliximab comò tratamiento de rescate. También en un estudio multicéntrico internacional se trató a 192 ninos con EC moderada severa en los que fracasó el tratamiento convencional. De ellos, 83 habian recibido previamente infliximab (pérdida de eficacia o intolerancia). Aunque el estudio se disenó para valorar distintas dosis de mantenimiento tras la inducción, està consiguió unas tasas altas de respuesta cllnica a las 4 semanas (en el 80% descenso PCDAI de < 15 puntos) con una pauta de 160mg/80mg (0 y 2 semanas) en los pacientes de mas de 40kg, o de 80mg/40 mg en los menores de 40kg30. El tratamiento con anti-TNF se emplea cada vez de una forma mas precoz ya que asi parece mas eficaz en la inmunomodulación y en el objetivo de la curación mucosa31, con el posible beneficio de cambiar la historia naturai de la enfermedad y evitar las complicaciones de la acumulación del dano tisular. Su uso comò primera linea de tratamiento (terapia topdown) en estudios aleatorizados en adultos se ha mostrado mas eficaz que la terapia convencional (enfermedad libre de esteroides al ano 62 frente al 42%; p=0,03)32. En los ninos solo existe un estudio retrospectivo de 36 pacientes distribuido en 3 grupos (azatioprina/infliximab, corticoides/5-ASA y corticoides/azatioprina) en el que el que el nùmero de recaidas al ano y 2 anos era significativamente menor con este esquema33. Sin embargo, la prolongada evolución de està enfermedad, la incertidumbre sobre efectos adversos a largo plazo de estos tratamientos y la ausencia de estudios prospectivos amplios indican prudencia y selección adecuada del paciente por balance riesgo-beneficio. Ademàs de las formas severas (sobre todo si tienen enfermedad perianal), podria considerarse la terapia topdown en formas inflamatorias muy extensas o con afectación del crecimiento. Identificar precozmente factores de riesgo (clinicos, serológicos, genéticos) ayudarà en el futuro a seleccionar los pacientes que se puedan beneficiar de este esquema terapèutico.
Mantenimiento de la remisión en la enfermedad de Crohn pediàtricaInmunomoduladoresLas tiopurinas, azatioprina (AZA) o mercaptopurina (6-MP), son hoy ampliamente empleadas comò terapia de mantenimiento en los ninos, por su eficacia en los estudios de adultos y especialmente por el ahorro de esteroides. En pediatria, un importante estudio demostró que la introducción de 6-MP en la inducción a la remisión con corticoides, favorecia el mantenimiento de la remisión libre de esteroides frente al grupo de corticoides y placebo a los 18 meses (el 98 frente al 50%)34 sin aumentar los efectos adversos. Ambas son profàrmacos tras cuyo metabolismo intracelular se generan metabolitos activos en la inmunosupresión. Tardan unos 2 o 3 meses en alcanzar eficacia por lo que hay que anticipar su uso. La mayoria de los pacientes pueden recibir dosis de 2 a 3mg/kg/dia de AZA o 1,5mg/kg/dia de 6-MP, aunque se recomienda la determinación de la actividad de la enzima tiopurilmetiltransferasa (TPMT) para detectar aquellos pacientes con actividad muy baja y riesgo de mielosupresión. Si son eficaces deben mantenerse al largo plazo, sobre todo en caso de fracaso o intolerancia a las tiopurinas puede usarse metotrexato. En estudios retrospectivos consigue el mantenimiento de la remisión en alrededor del 40% de los pacientes35. Parece mas eficaz por via subcutànea semanai que por via oral. Se recomienda la administración de àcido fólico oral.
Fàrmacos biológicosAl iniciar la terapia con biológicos, la administración pautada es mas eficaz que la esporàdica o a demanda. En el estudio REACH los pacientes que consiguieron la remisión con infliximab continuaron tratamiento cada 8 o cada 12 semanas, consiguiéndose mejores resultados con la primera pauta. Un 56% permanecia en remisión a las 54 semanas. Un 38% requirió aumentar la dosis o acortar el intervalo de dosifìcación29. Es frecuente que en la pràctica cllnica un porcentaje variable necesite ajustar la dosis o los intervalos para mantener la remisión por el desarrollo de anticuerpos antiinfliximab y bajos niveles del fàrmaco. El tratamiento combinado con AZA en este sentido ha demostrado ser mas eficaz en el mantenimiento de la remisión y en la curación mucosa que infliximab en monoterapia en el estudio SONIC de adultos36. No obstante, en los pacientes pediàtricos, existe el riesgo de desarrollar linfoma hepatoesplénico de células T, una forma infrecuente y mortai de linfoma, descrito sobre todo en varones jóvenes por lo que el tratamiento combinado debe individualizarse con precaución especial en varones jóvenes37 (riesgo estimado 1:3.534 pacientes varones < 35 anos con tratamiento combinado). Con adalimumab, los pacientes del estudio prospectivo anterior, tras la inducción, se aleatorizaron para recibir dosis de 40 o 20mg (> 40kg) y de 20 o10 mg (< 40kg) cada 2 semanas. En la semana 26, un 57% de los pacientes anti-TNF naìve estaban en remisión cllnica (PCDAI < 10), un 45% en la semana 52. Los resultados fueron mejores con las dosis mas altas y peores en los pacientes con tratamiento anti-TNF previo30.
En el estudio REACH y en otros retrospectivos se ha demostrado un beneficio en el crecimiento y en la calidad de vida38.
Tratamiento de la colitis ulcerosaTratamiento de la enfermedad activaEl tratamiento se realizarà en función de la extension y severidad (Pediatrie Ulcerative Colitis Activity Index [PUCAI]). Las formas de proctitis o proctosigmoidits, raras, se tratan con 5-aminosalicilatos (5-ASA) rectales (supositorios, espuma o enemas segùn la extension de la afectación). Son mas eficaces que la budesonida rectal. Suele ser necesario el uso de mesalazina orai (5-ASA con protección entèrica) (50–75mg/kg/dia, màximo 4g), debiendo elegir la preparación adecuada al cumplimiento del paciente (comprimidos o grànulos). Estos fàrmacos no pueden partirse o disgregarse puesto que la protección permite que lleguen al lugar de acción en ileon y colon. La protección de 5-ASA en las formulaciones de mesalazina es variable: con Eudagrit (liberación pH dependiente, Claversal®, Lixacol®, Salofalk®), con etilcelulosa (liberación secuencial por disgregación en intestino delgado y grueso, Pentasa®) o sistema MMX, doble matriz lipofilico e hidrofilico que permite su liberación prolongada (Mezavant®). Solo el profàrmaco sulfasalazina (sulfapiridina-5ASA) puede preparase en solución.
En las formas extensas, los corticoides se necesitan para inducir la remisión junto a los 5-ASA, con unas tasas de respuesta del 60%. En la CU no es eficaz la nutrición enteral. En casos de colitis severa (PUCAI > 65) un 30% de los pacientes son refractarios a los corticoides, uuìizàndose entonces ciclosporina, tacrolimùs o infliximab para evitar la colectomia39. Los 2 primeros se mantienen unos meses para después conseguir el mantenimiento con tiopurinas. En el caso de infliximab, suele dejarse de mantenimiento. En todos los pacientes con brotes severos debe descartarse la sobreinfección por citomegalovirus y Clostridium difficile.
Tratamiento de mantenimientoEl tratamiento con mesalazina o sulfasalazina por via orai es eficaz en el mantenimiento de la remisión a dosis mas bajas que en la inducción. La administración en dosis ùnica favorece el cumplimiento. En casos de corticodependencia, se usan las tiopurinas y en casos refractarios el infliximab. Con azatioprina se consigue que un 50% de los pacientes se mantengan en remisión al ano40. Tras conseguir la remisión con infliximab, aproximadamente un 40% la mantiene con dosifìcación bimensual41.
Tras 8 anos de evolución, los pacientes con CU deben someterse a colonoscopias periódicas para la detección de displasia y càncer de colon.
Otros tratamientosLos antibióticos se emplean en la enfermedad perianal (metronidazol o ciprofloxacina) comò tratamiento de primera linea. También en la reservoritis tras la colectomia en CU. En un redente estudio, el uso combinado de azitromicina y metronidazol fue eficaz en la remisión de formas leves de EC42. Los probióticos se han utilizado comò tratamiento adjunto a los 5-ASA en el mantenimiento de la CU y en las formas crónicas de reservoritis. De interés en pediatria es el uso granulocitoféresis para el tratamiento de las formas corticodependientes de CU en ninos de mas de 25kg de peso, por sus escasos efectos adversos43.
Lectura rápida
En las formas severas se utilizan los corticoides, ciclosporina o anti-TNF y en las formas localizadas el tratamiento tópico rectal con mesalazina. La cirugía es la opción en las complicaciones o la refractariedad al tratamiento médico. Deben considerarse los riesgos del tratamiento con inmunomoduladores y anti-TNF, en especial las infecciones y el linfoma, e instaurar medidas de optimización y prevención como la determinación de la actividad de la tiopurilmetiltransferasa, el cribado de la tuberculosis, la serología y la actualización vacunal.
En la EC las indicaciones quirurgicas son la refractariedad al tratamiento, la enfermedad localizada con retraso de crecimiento para permitir el catch up en estadios puberales, las estenosis intestinales (tècnica de estrictureplastia para preservar intestino), o la enfermedad perianal severa. En casos de resección, debe realizarse una adecuada profilaxis de la recidiva postoperatoria con controles endoscópicos y tratamiento medico (tiopurinas o biológicos en los pacientes de riesgo).
En la CU la colectomia urgente se realizarà en casos de colitis severa sin respuesta al tratamiento o megacolon tóxico. También de forma programada en casos de refractariedad: proctoclectomia y anastomosis ileoanal con reservorio. Debe informarse a la familia de la posibilidad de reservoritis que precise de tratamiento crònico, de la mayor frecuencia de deposiciones que pueden provocar alteración de la calidad de vida y del riesgo de infertilidad en mujeres.
Efectos adversos y aspectos de seguridadSe resumen en la tabla 2 los principales efectos adversos de los distintos fàrmacos.
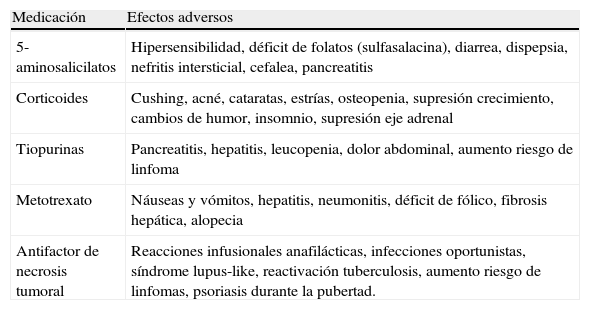
Efectos adversos del tratamiento médico en la enfermedad inflamatoria intestinal
| Medicación | Efectos adversos |
| 5-aminosalicilatos | Hipersensibilidad, déficit de folatos (sulfasalacina), diarrea, dispepsia, nefritis intersticial, cefalea, pancreatitis |
| Corticoides | Cushing, acné, cataratas, estrías, osteopenia, supresión crecimiento, cambios de humor, insomnio, supresión eje adrenal |
| Tiopurinas | Pancreatitis, hepatitis, leucopenia, dolor abdominal, aumento riesgo de linfoma |
| Metotrexato | Náuseas y vómitos, hepatitis, neumonitis, déficit de fólico, fibrosis hepática, alopecia |
| Antifactor de necrosis tumoral | Reacciones infusionales anafilácticas, infecciones oportunistas, síndrome lupus-like, reactivación tuberculosis, aumento riesgo de linfomas, psoriasis durante la pubertad. |
Al iniciar el tratamiento con inmunosupresores o biológicos debe darse una información adecuada a la familia y al paciente sobre el riesgo y el beneficio de dichos tratamientos, y tener en cuenta los siguientes aspectos:
- 1.
Mejorar el estado nutricional del paciente si està afectado ya que la malnutrición favorece las infecciones oportunistas.
- 2.
Determinar actividad TPMT antes de iniciar tiopurinas.
- 3.
Realizar una prueba de Mantoux y una radiografia de tórax antes de iniciar tratamiento con biológicos, ya que los anti-TNF pueden reactivar una infección tuberculosa latente.
- 4.
Descartar abscesos perianales o intestinales por riesgo de infección diseminada con anti-TNF.
- 5.
Revisar el calendario vacunal y realizar serologias (hepatitis B y C, virus de la inmunodeficiencia humana, virus herpes). En el caso de la varicela, considerar la vacunación previa al tratamiento (al menos 3 semanas) o profilaxis postexposición con gammaglobulina. Los ninos no deben recibir vacunas de virus vivos una vez iniciado el tratamiento o hasta 3 meses después de su retirada, incluyendo los que hayan recibido dosis de corticoides de 20 mg de prednisona (2 mg/kg en pacientes con menos de 10 kg) durante 2 semanas o mas. Testar en lo posible la respuesta a vacunas puestas durante el tratamiento. Vacunación en mujeres jóvenes sin actividad sexual frente al papiloma antes del inicio del tratamiento.
- 6.
Vacunación antigripal anual.
- 7.
En el recién nacido cuya madre ha recibido tratamiento con biológicos en el embarazo, deben evitarse las vacunas de virus vivos durante los primeros 6 meses de vida.
- 8.
No està contraindicada la lactancia en caso de que la madre reciba tiopurinas o antiTNF.
El manejo del nino con EH deberia realizarse en centros especializados con servicios que ofrezcan agilidad y calidad en los cuidados: atención telefònica a demanda y accesibilidad ràpida ante sintomas de recaida, equipación radiològica y endoscópica apropiada con disposición de anestesia en la sala de endoscopias, equipo multidisciplinar que incluya, entre otros, al endocrinòlogo, psicòlogo y cirujano pediàtrico. Se debe establecer un pian anticipado de la transición del paciente a Unidades de adultos, preferiblemente con visitas conjuntas para facilitar el cambio de especialista.
Ademàs de las recomendaciones vacunales, desde un punto de vista generai desde Atención Primaria, debe tenerse en cuenta evitar la sobreutilización de antiinflamatorios no esteroideos y de antibióticos (posibilidad de favorecer la infección por Clostridium difficile), mantener una cierta alerta ante infecciones serias en pacientes con inmunosupresores o biológicos, consejos en la educación sanitaria para evitar alimentos con riesgo de contaminación, evitar el inicio del hàbito de fumar, favorecer la adherencia al tratamiento y colaborar en el tratamiento y el soporte nutricional. En especial, debe considerarse el impacto psicològico de la enfermedad (vergiienza y limitaciones por frecuentes deposiciones, aspecto fisico por corticoides, retraso puberal, preocupación por el futuro, etc.), la repercusión familiar o escolar (ausencias, no fàcil disposición de aseos, acoso, fracaso escolar, etc.) y abordar de forma conjunta estos aspectos.
Los autores declaran no tener ningùn conflicto de intereses.