El objetivo del presente estudio fue determinar la sensibilidad y especificidad de la tomografía computarizada (TC) multidetector en la detección de placas carotídeas ateroscleróticas complicadas con hemorragia intraplaca. Examinamos las placas carotídeas de 31 pacientes intervenidos quirúrgicamente por estenosis de la arteria carótida. Se compararon los resultados del análisis preoperatorio con TC multidetector de las placas carotídeas con los del análisis histológico de dichas placas. Se practicó una endarterectomía carotídea en la semana siguiente a la realización del estudio con TC multidetector. Se aplicaron los criterios de la American Heart Association para la clasificación histológica de las placas ateroscleróticas. La mediana de la densidad tisular de las placas carotídeas complicadas con hemorragia intraplaca fue de 22 unidades Hounsfield (UH). La mediana de la densidad tisular de los segmentos no calcificados de las placas no complicadas fue de 59 UH (p=0,0062). La mayor densidad tisular observada para placas complicadas fue de 31 UH. La TC multidetector detectó placas complicadas con hemorragia con una sensibilidad del 100% y una especificidad del 64,7% con una densidad tisular de 31 UH como valor umbral. La TC multidetector mostró una sensibilidad alta y una especificidad moderada en la detección de placas carotídeas ateroscleróticas complicadas con hemorragia.
Estudios controlados con asignación aleatoria a gran escala han demostrado un efecto beneficioso de la endarterectomía carotídea1,2 (EAC). Los pacientes asintomáticos obtienen un beneficio menor de esta intervención, con una reducción absoluta del riesgo de tan sólo alrededor del 1% anual durante un seguimiento de 5 años3,4. Por esta razón, es necesario intervenir a un elevado número de pacientes asintomáticos para prevenir tan solo un reducido número de acontecimientos neurológicos. El número total de pacientes asintomáticos intervenidos podría disminuir si se pudieran identificar aquellos subgrupos de pacientes asintomáticos con mayor beneficio de la EAC. En diversos estudios se ha demostrado una mayor incidencia de acontecimientos neurológicos en pacientes con las llamadas placas blandas5-10 (placas que consisten predominantemente en lípidos, detritos tisulares y hemorragia). El análisis ecográfico de las placas carotídeas demostró que las placas hipoecoicas representan un factor de riesgo independiente de incidencia de ictus en adultos a partir de los 65 años11. Takaya et al12 realizaron un seguimiento de pacientes asintomáticos durante 38 meses y revelaron que aquellos con hemorragia intraplaca demostrada en la resonancia magnética (RM) inicial presentaron una incidencia de acontecimientos vasculares cerebrales 5,2 veces mayor. La clasificación de la American Heart Association (AHA) de las placas ateroscleróticas define ocho tipos de placas, de acuerdo con la composición histológica13,14 (tabla I). Se considera que las placas carotídeas ateroscleróticas complicadas con hemorragia intraplaca (tipo VIb de la AHA) son inestables y se asocian con mayor incidencia de acontecimientos vasculares cerebrales12,15-17. La angiografía por tomografía computarizada (TC) demostró una alta precisión en el diagnóstico de la estenosis de la arteria carótida18-22. Una característica adicional de la TC es su capacidad para medir la densidad tisular (expresada como número de unidades Hounsfield [UH]). Por lo tanto, puede proporcionar información sobre el tipo de tejido analizado. Las placas carotídeas ateroscleróticas con una menor densidad tisular en la TC multidetector (TCMD) se asocian con una menor incidencia de acontecimientos vasculares cerebrales6,7. Mientras la TC de cortes únicos mostró resultados contradictorios en la determinación de la composición de la placa carotídea, la TCMD demostró una correlación satisfactoria de los hallazgos con el análisis histológico de las placas coronarias23-27. El análisis histológico de dichas placas coronarias demostró que el remodelado de la placa aterosclerótica cambia su contenido histológico. Por lo tanto, el período entre la práctica del estudio por imagen y el análisis histológico debe ser lo más breve posible28. Comparamos los resultados de la TCMD y el análisis histológico, y calculamos la sensibilidad y especificidad de esta técnica en la detección de placas carotídeas ateroscleróticas del tipo VIb de la AHA (placas complicadas con hemorragia intraplaca, que contienen en la mayoría de los casos una combinación de lípidos, hemorragia y detritos necróticos). La EAC se realizó en el plazo de una semana después de la TCMD.
Clasificación de la AHA de las placas ateroscleróticas
| Clasificación de la AHA | Descripción |
| I | Presencia de células espumosas (macrófagos) dispersas |
| II | Capas de células espumosas y células musculares lisas cargadas de lípidos que constituyen la estría grasa |
| III | Tipo II con acumulaciones de lípidos extracelulares |
| IV | Núcleo de lípidos extracelular confluente |
| V | Núcleo de lípidos y capa gruesa de tejido conectivo fibroso (previamente tipo Va, también llamado “fibroateroma de múltiples capas”) |
| VI | Tipos IV o V con rotura de la superficie de la lesión (VIa), hematoma o hemorragia (VIb), o trombosis (VIc) |
| VII | Placa calcificada en su mayor parte (previamente Vb) |
| VIII | Consiste principalmente en tejido conectivo fibroso y escasa presencia de lípidos o de calcio acumulados (previamente Vc) |
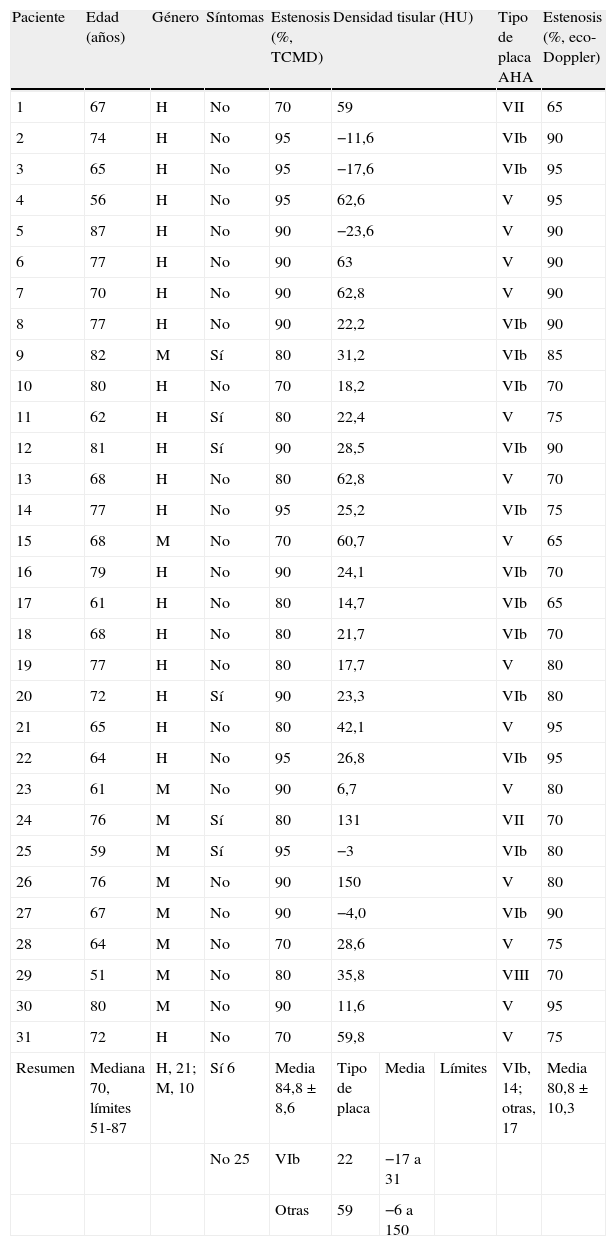
En el presente estudio prospectivo se incluyeron las placas carotídeas de 31 pacientes consecutivos intervenidos por estenosis de la arteria carótida. Veintiún pacientes eran hombres y 10 mujeres, de edades comprendidas entre los 51 y los 87 años, con una mediana de 70 años. Seis pacientes estaban sintomáticos y 25 asintomáticos (tabla II). Se consideraron sintomáticos aquellos pacientes que presentaron una lesión cerebral, un episodio isquémico transitorio o uno de amaurosis fugax homolateral a la arteria carótida afectada en el plazo de 6 meses después de la TCMD.
Características de los pacientes, TCMD, hallazgos histológicos, y del eco-Doppler
| Paciente | Edad (años) | Género | Síntomas | Estenosis (%, TCMD) | Densidad tisular (HU) | Tipo de placa AHA | Estenosis (%, eco-Doppler) | ||
| 1 | 67 | H | No | 70 | 59 | VII | 65 | ||
| 2 | 74 | H | No | 95 | −11,6 | VIb | 90 | ||
| 3 | 65 | H | No | 95 | −17,6 | VIb | 95 | ||
| 4 | 56 | H | No | 95 | 62,6 | V | 95 | ||
| 5 | 87 | H | No | 90 | −23,6 | V | 90 | ||
| 6 | 77 | H | No | 90 | 63 | V | 90 | ||
| 7 | 70 | H | No | 90 | 62,8 | V | 90 | ||
| 8 | 77 | H | No | 90 | 22,2 | VIb | 90 | ||
| 9 | 82 | M | Sí | 80 | 31,2 | VIb | 85 | ||
| 10 | 80 | H | No | 70 | 18,2 | VIb | 70 | ||
| 11 | 62 | H | Sí | 80 | 22,4 | V | 75 | ||
| 12 | 81 | H | Sí | 90 | 28,5 | VIb | 90 | ||
| 13 | 68 | H | No | 80 | 62,8 | V | 70 | ||
| 14 | 77 | H | No | 95 | 25,2 | VIb | 75 | ||
| 15 | 68 | M | No | 70 | 60,7 | V | 65 | ||
| 16 | 79 | H | No | 90 | 24,1 | VIb | 70 | ||
| 17 | 61 | H | No | 80 | 14,7 | VIb | 65 | ||
| 18 | 68 | H | No | 80 | 21,7 | VIb | 70 | ||
| 19 | 77 | H | No | 80 | 17,7 | V | 80 | ||
| 20 | 72 | H | Sí | 90 | 23,3 | VIb | 80 | ||
| 21 | 65 | H | No | 80 | 42,1 | V | 95 | ||
| 22 | 64 | H | No | 95 | 26,8 | VIb | 95 | ||
| 23 | 61 | M | No | 90 | 6,7 | V | 80 | ||
| 24 | 76 | M | Sí | 80 | 131 | VII | 70 | ||
| 25 | 59 | M | Sí | 95 | −3 | VIb | 80 | ||
| 26 | 76 | M | No | 90 | 150 | V | 80 | ||
| 27 | 67 | M | No | 90 | −4,0 | VIb | 90 | ||
| 28 | 64 | M | No | 70 | 28,6 | V | 75 | ||
| 29 | 51 | M | No | 80 | 35,8 | VIII | 70 | ||
| 30 | 80 | M | No | 90 | 11,6 | V | 95 | ||
| 31 | 72 | H | No | 70 | 59,8 | V | 75 | ||
| Resumen | Mediana 70, límites 51-87 | H, 21; M, 10 | Sí 6 | Media 84,8 ± 8,6 | Tipo de placa | Media | Límites | VIb, 14; otras, 17 | Media 80,8 ± 10,3 |
| No 25 | VIb | 22 | −17 a 31 | ||||||
| Otras | 59 | −6 a 150 | |||||||
AHA: American Heart Association; H: hombre; M: mujer; TCMD: TC multidetector.
Las indicaciones para la práctica de la EAC fueron la estenosis de la arteria carótida>60% en pacientes sintomáticos y la>70% en pacientes asintomáticos. Se realizó el mismo estudio por imagen en todos los pacientes: en primer lugar un eco-Doppler color, y una TCMD en aquellos pacientes en los que el eco-Doppler detectó una estenosis carotídea>60%.
La endarterectomía se realizó en el plazo de una semana después de la evaluación mediante la TCMD. Se obtuvo la aprobación del comité de investigación del hospital.
Dos radiólogos con experiencia practicaron el estudio eco-Doppler utilizando un ecógrafo Logiq 9 con sondas de 7-9 y 9-14MHz (GE Healthcare, Milwaukee, Estados Unidos).
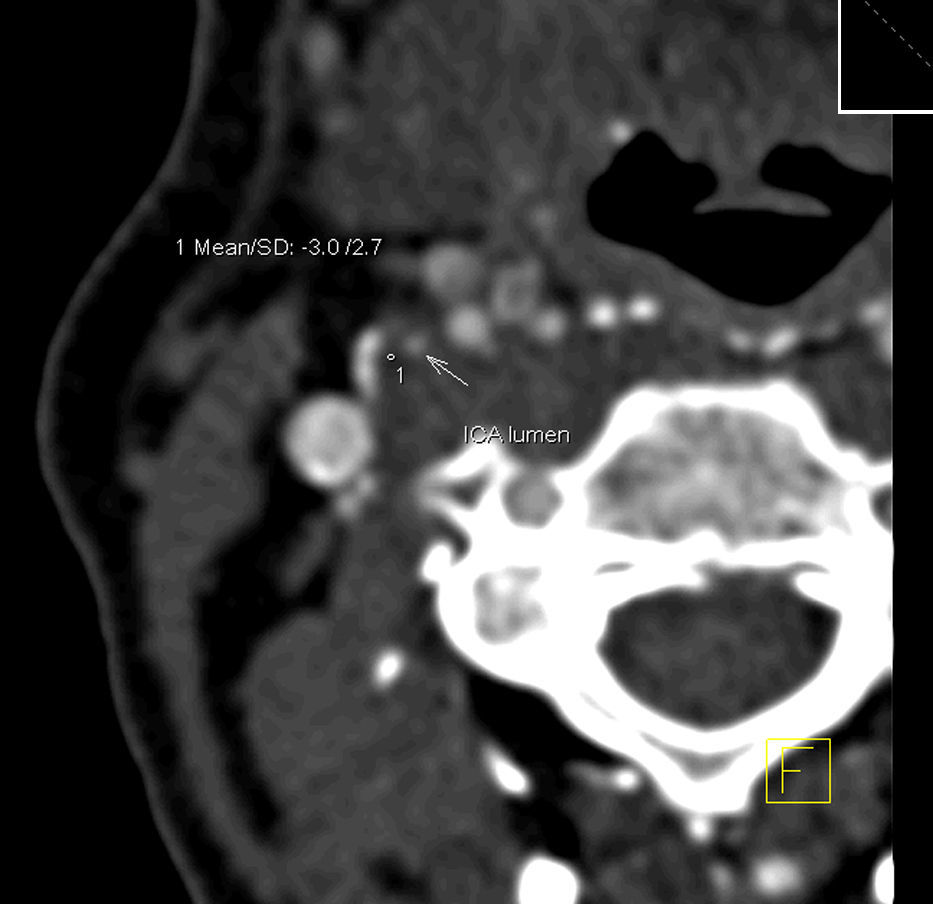
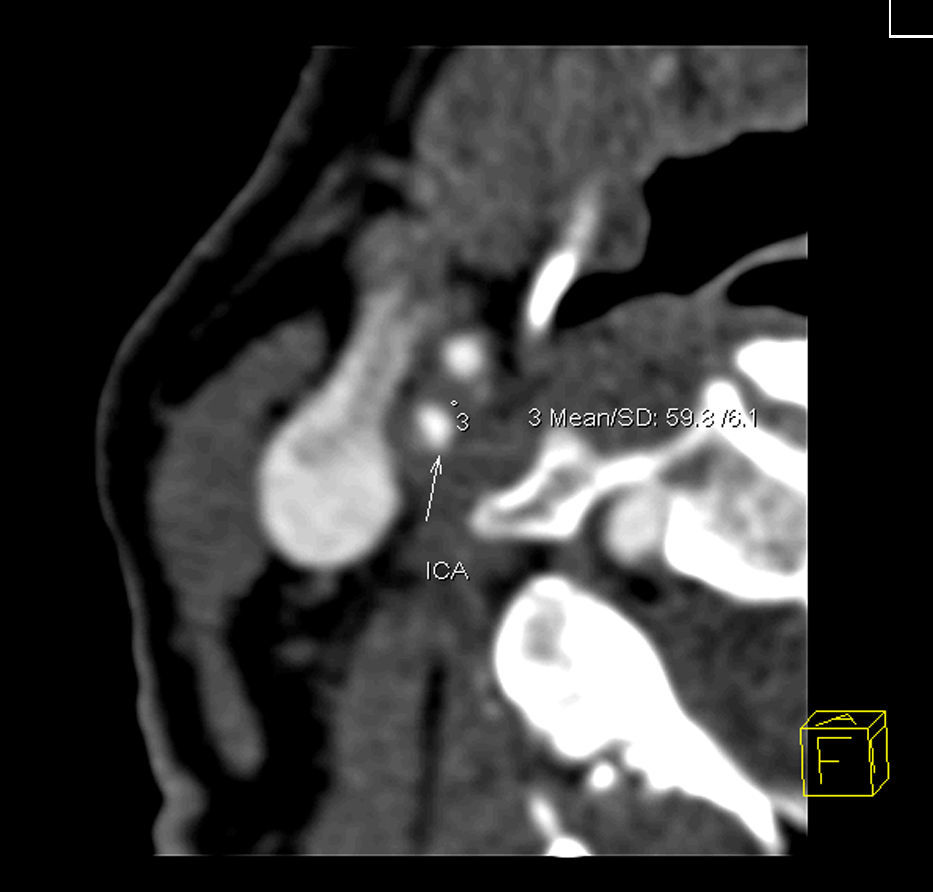
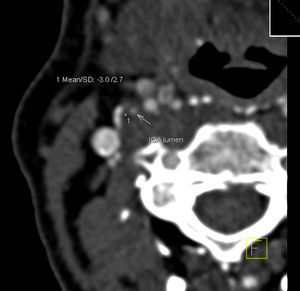
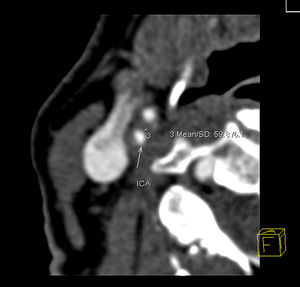
Análisis TCMDSe utilizó un equipo de TCMD de 16 cortes Siemens (Erlangen, Alemania) Somatom Sensation. Un radiólogo evaluó los datos en una estación de trabajo Siemens Leonardo Syngo2004A. Se aplicó un protocolo optimizado estandarizado con realce de contraste y reconstrucción intermedia: 120 kVp, 120mAs, colimación de 16 x 0,75mm, pitch (paso) de 1 y grosor de los cortes de 0,75mm. Se utilizó como medio de contraste iopamidol (370mg de iodo/ml, 4ml/s, 70mm3, 325 psi). Para el análisis de la placa, se realizaron reconstrucciones multiplanares transversales, ortogonales al eje largo del vaso tanto en el plano coronal como en el sagital. Se practicaron tres determinaciones de la densidad tisular en el área de la placa visualmente menos densa a nivel de la estenosis máxima. Las mediciones se realizaron en un área circular de 2mm2, y se registró el valor menor (figs. 1 y 2). Las calcificaciones son evidentes en la TCMD y no se les realizó un estudio adicional. Se registró la distancia entre la bifurcación de la carótida y el nivel de estenosis máxima para ayudar al anatomopatólogo a encontrar el nivel correspondiente para el análisis histológico. El grado de estenosis se calculó aplicando los criterios del North American Symptomatic Carotid Endarterectomy Trial14 (NASCET).
Se practicó una EAC con anestesia locorregional o general con la utilización selectiva de una derivación intraluminal en el primer grupo de pacientes y sistemática en todos los del segundo. Cuatro pacientes fueron intervenidos bajo anestesia general. En dos de ellos se practicó cirugía cardíaca concomitante, otro paciente tenía antecedentes de convulsiones epilépticas y el cuarto, con oclusión contralateral, había expresado su deseo explícito de recibir anestesia general. Se prestó atención en preservar la integridad de las placas en la mayor medida posible. No se demostraron lesiones perioperatorias. En el paciente con oclusión de la carótida contralateral se produjo un cuadro de debilidad transitoria de la mano contralateral postoperatoria, sin evidencia de lesión cerebral isquémica en el estudio con TC.
Análisis histológicoInmediatamente después de la EAC, las placas se fijaron con formol (una solución tamponada de formaldehído al 10%) y se remitieron para análisis histológico. Un anatomopatólogo ciego para los resultados de la densidad de la placa en el estudio con TCMD realizó el estudio histológico. Si las calcificaciones eran extensas, se realizó en primer lugar la descalcificación de las placas con un 20% de ácido nítrico. Este procedimiento elimina las calcificaciones al mismo tiempo que preserva el contenido histológico residual. Las muestras se cortaron de forma seriada, empezando desde la bifurcación, seguido de cortes de 2mm en dirección a la arteria carótida interna. La técnica de cortes seriados garantizó la determinación precisa de la distancia entre la bifurcación y el nivel de estenosis máxima.
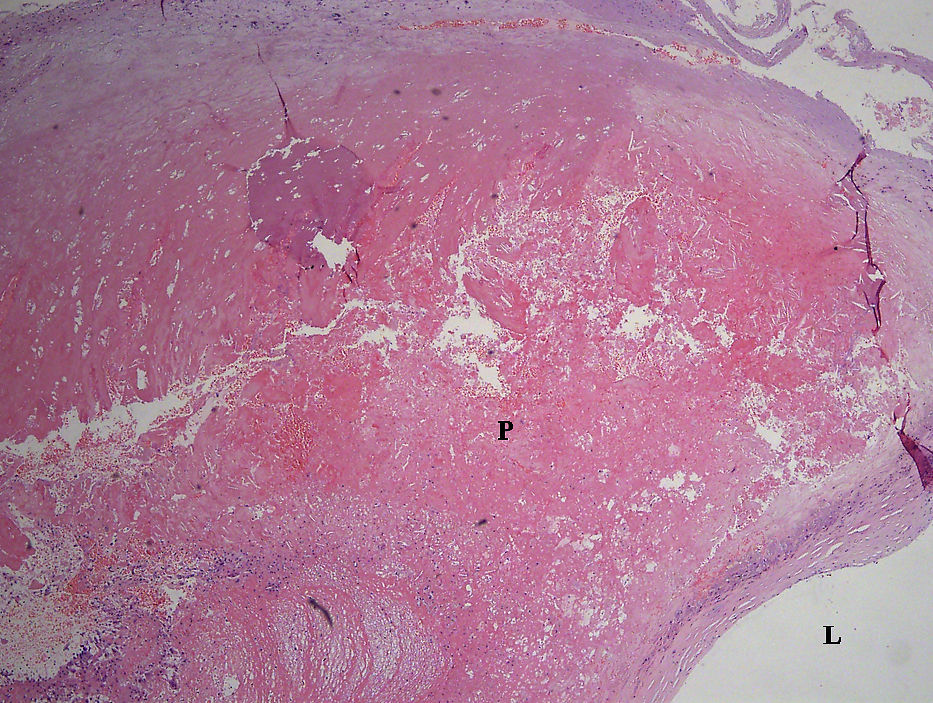
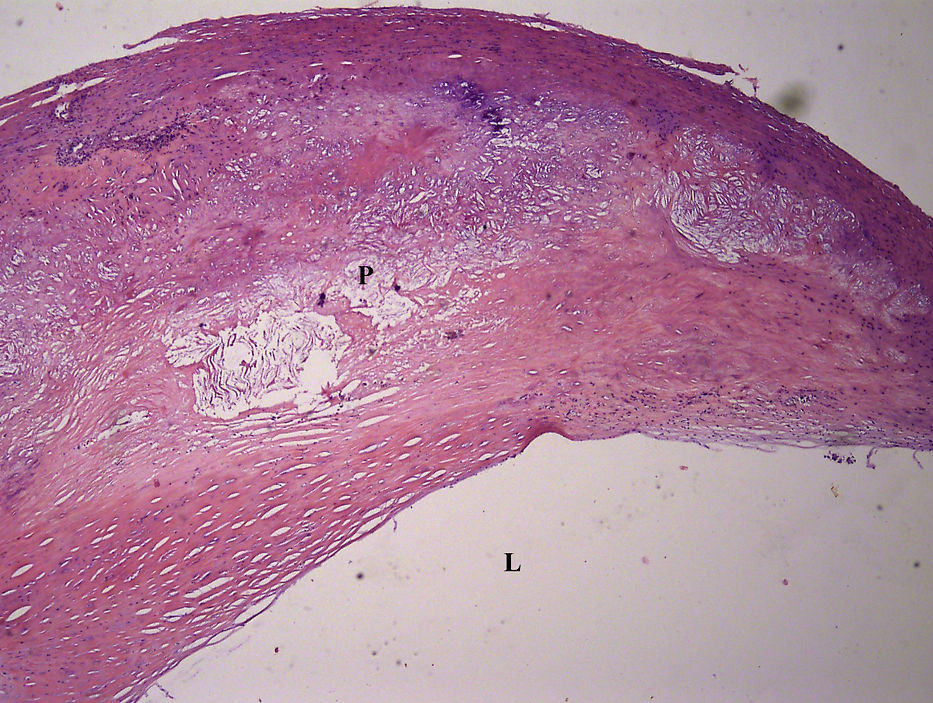
Las muestras de placas se fijaron en parafina y se cortaron en secciones finas de 4 μm, utilizando el proceso estándar. Las secciones se tiñeron con hematoxilina y, si fue necesario, con tinción tricómica de Mallory (figs. 3 y 4). Un anatomopatólogo examinó todas las placas y las clasificó de acuerdo con la clasificación de las placas ateroscleróticas de la AHA. El radiólogo que realizó el análisis con TCMD participó en el examen histológico para garantizar que en ambos estudios se analizaban las áreas de la misma placa.
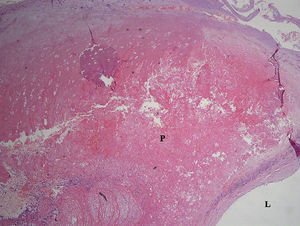
Hemorragia en la placa (placa de tipo VIb). La misma placa que en la figura 1. Tinción con hematoxilina y eosina, aumento original x 40. L: luz; P: placa.
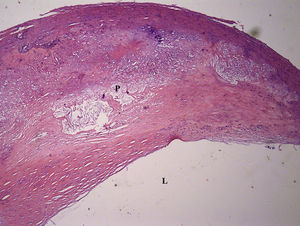
Fibroateroma de múltiples capas (placa de tipo V). La misma placa que en la figura 2. Tinción con hematoxilina y eosina, aumento original x 40. L: luz; P: placa.
Se calculó la diferencia de la mediana de la densidad tisular de las placas de tipo VIb de la AHA respecto a los otros tipos de placa utilizando la prueba U de Mann-Whitney. Se consideró estadísticamente significativo un valor de p<0,05. Para determinar el valor de corte de la densidad tisular, se construyeron curvas de eficacia diagnóstica (receiver operating characteristic, ROC).
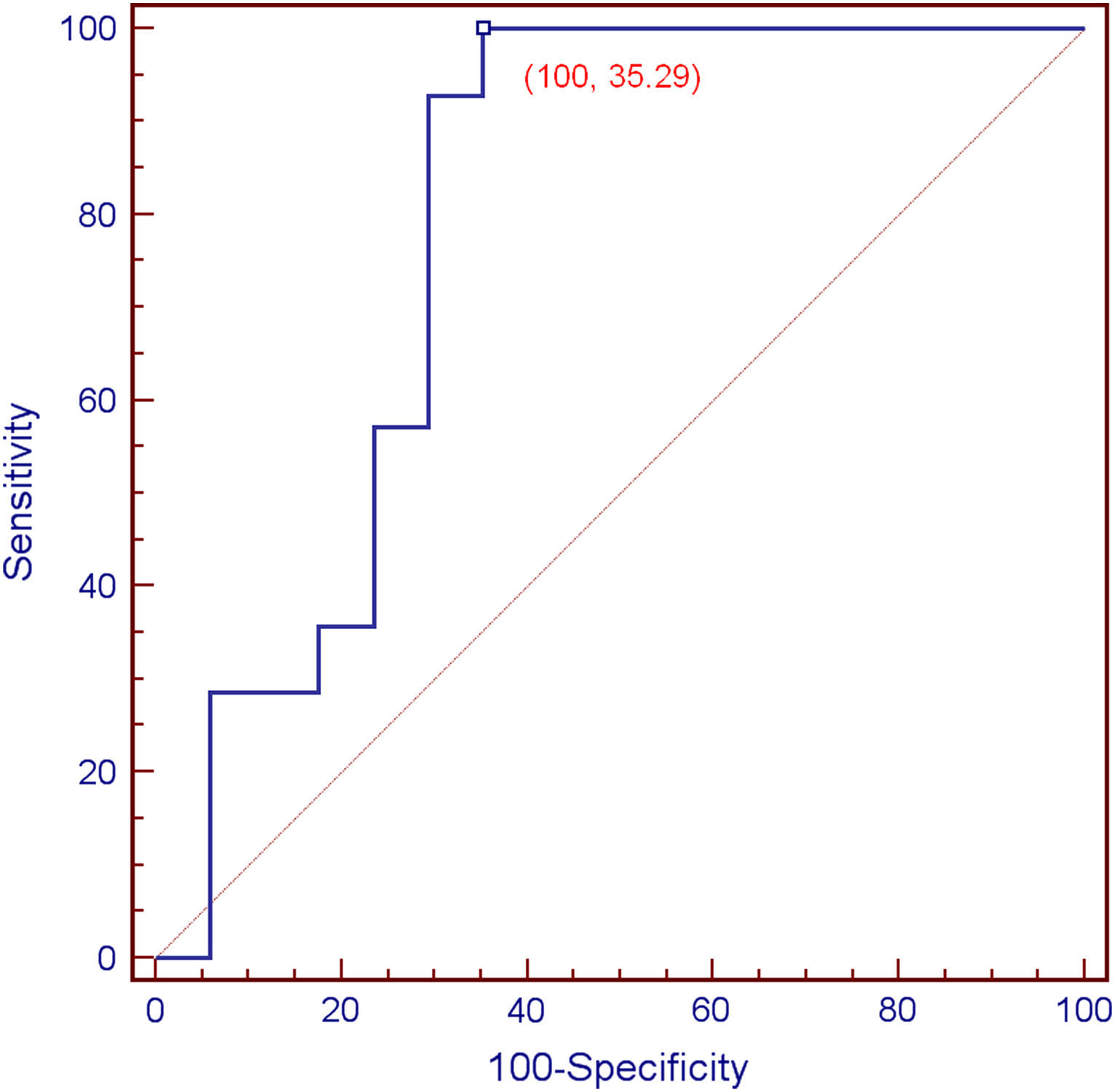
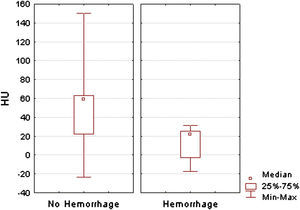
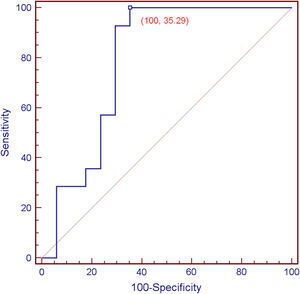
ResultadosLas placas carotídeas analizadas fueron 14 (45%) de tipo VIb de la AHA y 17 (55%) de otros tipos (de tipo V, VII y VIII). La mediana de la densidad tisular de las placas de tipo VIb en el estudio por TCMD fue de 22 UH (rango –17 a 31), y la de los segmentos no calcificados de las placas no complicadas fue de 59 UH (rango –6 a 150) (p=0,0062, prueba U de Mann-Whitney) (fig. 5). El análisis de las curvas ROC demostró una sensibilidad del 100% y una especificidad del 64,7% de la TCMD en la detección de placas complicadas con hemorragia intraplaca, con una densidad tisular de 31 UH como valor umbral (es decir, ninguna placa con una densidad tisular de más de 31 UH estaba complicada con hemorragia intraplaca) (fig. 6). Cuatro de las seis placas procedentes de pacientes sintomáticos y 10 de las 25 procedentes de pacientes asintomáticos eran de tipo VIb de la AHA.
El presente estudio demostró que la TCMD pudo detectar la placa carotídea aterosclerótica complicada con hemorragia con una sensibilidad del 100%, con una densidad tisular de 31 UH como valor umbral. En los estudios previos se han descrito resultados poco concluyentes en relación con la precisión de la TC de un solo corte en el análisis de la composición de la placa23,24. De Weert et al29 demostraron una adecuada concordancia entre los hallazgos TCMD in vivo y los histológicos; sin embargo, en su análisis de 15 placas carotídeas, el período transcurrido entre la evaluación TCMD y la endarterectomía alcanzó los 3 meses. Durante dicho período, el remodelado de las placas pudo cambiar su aspecto histológico. El análisis histológico de placas coronarias realizado durante la semana posterior a un episodio de infarto demostró características morfológicas de inestabilidad, mientras que las placas obtenidas posteriormente fueron similares desde un punto de vista histológico a las de pacientes con angina estable28. Para reducir a un mínimo la falta de precisión como consecuencia de este hecho, en el presente estudio todos los pacientes fueron intervenidos durante la semana siguiente al estudio por TCMD.
No tenemos conocimiento, de entre los estudios que comparan la TCMD in vivo y el análisis histológico de las placas carotídeas y en los que el período transcurrido entre la TCMD y la endarterectomía es menor a una semana, de una serie con un número de pacientes mayor o igual a la de este estudio.
Nuestro objetivo fue identificar las placas con hemorragia intraplaca (tipo VIb de la AHA) mediante el estudio por TCMD. En la mayoría de los casos, las placas carotídeas son heterogéneas y cuentan con frecuencia con pequeñas áreas de la placa con un contenido histológico mixto. En la TCMD los lípidos, la hemorragia y los detritos necróticos (“tejido blando”) tienen la menor densidad tisular, y otros componentes (fibrosis o calcificaciones) presentan una densidad tisular mayor. Esto puede influir en los resultados de la exploración al proporcionar unos valores de densidad tisular mayores, incluso en áreas predominantemente blandas de placa debido al efecto del volumen parcial. El medio de contraste produce un efecto similar en la luz del vaso y en zonas calcificadas de la placa. Para minimizar la influencia de este efecto, llevamos a cabo tres determinaciones por corte en el área de la placa elegida (área visualmente menos densa) y sólo registramos el valor más pequeño ya que ningún componente de la placa tiene una densidad tisular menor que los lípidos, la hemorragia o los detritos necróticos.
En cada medición se evaluó un volumen de tejido de 1,5mm3, con un área de 2mm2 en la que se determinó la densidad tisular y un grosor de los cortes de 0,75mm. Incluso las placas con una cantidad tan pequeña de tejido blando detectable con TCMD (que suele ser una combinación de lípidos, hemorragia y detritos necróticos) deben considerarse potencialmente vulnerables ya que es imposible identificar por medio de la técnica de imagen si la hemorragia dentro de la placa se está expandiendo o está reduciéndose debido al remodelado de la placa. Para proporcionar el mismo nivel de placa para la TCMD y el análisis histológico, determinamos la distancia desde la bifurcación hasta el nivel de estenosis máxima en la TCMD, y el anatomopatólogo usó este valor para encontrar el nivel correspondiente de la muestra. Podría haber sucedido que se hubiera producido un mínimo acortamiento de la placa durante el procesamiento histológico, pero es poco probable que fuera significativo debido al bajo contenido total de agua de las placas. No obstante, los cortes seriados y la fijación de toda la placa (incluidos los planos por debajo y por encima del nivel de estenosis máxima determinado con TCMD) y la posibilidad de realizar cortes adicionales a partir de niveles más profundos del material fijado en parafina aseguran que se eligió el nivel de menor luz (estenosis máxima) para el análisis.
En el tratamiento de pacientes asintomáticos con estenosis de la arteria carótida, la práctica clínica actual difiere entre diferentes países e incluso entre diferentes centros y hospitales de un mismo país30-43. En general, los pacientes asintomáticos se tratan de forma más conservadora en Europa que en Estados Unidos. En Europa y en Estados Unidos, respectivamente, estos pacientes representan el 11-52% y 37-92% de los intervenidos para estenosis de la arteria carótida30-43. Diversos autores han indicado que el tratamiento quirúrgico de estos pacientes debe considerarse únicamente en aquellos pacientes estables desde un punto de vista médico con estenosis≥80% y una esperanza de vida de, como mínimo, 5 años y sólo si puede obtenerse una tasa de complicaciones perioperatorias<3%44,45. Los pacientes asintomáticos con una placa complicada y una estenosis carotídea<80%, que no deberían ser tratados si se aplican las recomendaciones mencionadas previamente, pueden beneficiarse de un método diagnóstico capaz de detectar algunas características de la placa carotídea asociadas con un mayor riesgo de un episodio vascular cerebral. Probablemente, los pacientes asintomáticos con estenosis<80% y una placa no complicada sólo requieren el mejor tratamiento médico44-47. Las decisiones como qué método diagnóstico usar y cuándo tratar a los pacientes asintomáticos no sólo están influenciadas por los resultados de los grandes ensayos sino también por los recursos diagnósticos disponibles, la financiación del sistema médico y la posibilidad de tratar a los pacientes con estenosis de la arteria carótida con una morbimortalidad reducida en un centro particular. La TCMD aumenta el coste de la evaluación diagnóstica para cada paciente si se compara con el análisis exclusivo con eco-Doppler y expone a los pacientes a la radiación. Sin embargo, este procedimiento no es cruento y es muy preciso en el diagnóstico de esta entidad18-22. Además, ha demostrado una buena concordancia interobservador en la evaluación del grado de estenosis de la carótida y también puede proporcionar información sobre el tipo de tejido analizado y la presencia de estenosis arterial intracraneal18-22,29,48,49. En los estudios que describen el examen con eco-Doppler de esta entidad patológica se demuestran notables variabilidades interobservador50-52. En diversos estudios basados en la determinación de la mediana de la escala de grises de las placas de la carótida se han revelado resultados conflictivos con respecto a la correlación de los hallazgos con el contenido histológico, mientras que los estudios basados en la evaluación visual de los hallazgos ecográficos han demostrado una variabilidad elevada de la concordancia intra e interobservador53. En nuestra opinión, el eco-Doppler y la TCMD son estudios complementarios. En primer lugar realizamos un estudio dúplex, seguido de la TCMD, si se demuestra la presencia de una estenosis>60%. Consideramos que el mayor coste de la evaluación diagnóstica que incluye la TCMD puede ser compensado en parte por la reducción potencial del número de pacientes asintomáticos intervenidos.
ConclusiónLa TCMD demostró un elevado nivel de sensibilidad y un nivel moderado de especificidad en la detección de hemorragia dentro de la placa carotídea aterosclerótica. Aquellas placas cuya densidad tisular era de más de 31 UH en la TCMD no estuvieron complicadas con hemorragia intraplaca. Es probable que los progresos técnicos de los equipos de TC aumenten la especificidad del método.