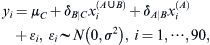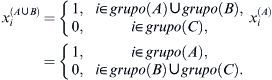Los resultados de estudios previos han sugerido que la edavarona intravenosa en dosis altas (3-10mg/kg) protege frente a la lesión isquémica de la médula espinal. El presente estudio examinó si la inyección directa del fármaco en dosis bajas en el segmento clampado de aorta previene dicha lesión. Mediante clampaje aórtico por debajo de la arteria renal y por encima de la bifurcación aórtica, se indujo isquemia de la médula espinal en conejos durante 15min en condiciones de normotermia. En los grupos A y B se inyectaron 3 y 1mg/kg de edaravona, respectivamente, en el segmento clampado de la aorta inmediatamente después del clampaje. En el grupo C, se inyectó suero salino. La función neurológica se evaluó a las 8, 24 y 48h y a los 7 días después de la reperfusión con los criterios de Tarlov. La médula espinal se examinó histológicamente a los 7 días con tinción de hematoxilina-eosina y con la técnica de tinción TUNEL (in situ terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling). Durante todo el período, en los grupos A y B, la puntuación de Tarlov permaneció en un grado 4, mientras que, a los 7 días, disminuyó hasta un grado 0 o 1 en el grupo C, siendo significativamente más alta en los dos primeros grupos. Comparado con el grupo C, el número de neuronas motoras intactas fue significativamente mayor en los grupos A y B con menos neuronas motoras necróticas. Entre los grupos A y B, no se identificó una diferencia significativa con respecto a la protección de la médula espinal. En ningún grupo se observaron neuronas TUNEL positivas, indicativo de la ausencia de la apoptosis. La inyección de edavarona intraaórtica en dosis bajas previene la lesión neuronal inmediata al reducir la lesión de las neuronas en un estadio inicial, al igual que la diferida a los 7 días.
Después de cirugía de aorta torácica y toracoabdominal, la lesión de la médula espinal es una complicación catastrófica. Se han utilizado diversos métodos para prevenirla, como la perfusión aórtica distal, hipotermia sistémica, drenaje del líquido cefalorraquídeo y administración de fármacos1-3. La incidencia de paraplejía asociada a esta cirugía varía del 4,5 al 11,4%4-7. Además, en ocasiones los pacientes sometidos a corrección de un aneurisma torácico y toracoabdominal experimentan paraplejía diferida8.
Describimos que la utilización de espinoplejía fría y la aplicación transvertebral de compresas frías redujeron eficazmente la lesión isquémica de la médula espinal. La infusión de suero salino frío en el segmento clampado de aorta también ejerció un efecto protector sobre la médula espinal9. Estos resultados sugirieron que los fármacos inyectados en el segmento clampado de médula espinal podían suprimir la lesión neuronal si la arteria intercostal crítica se localizaba en la aorta clampada.
La edavarona (Mitsubishi Pharma, Tokio, Japón), un scavenger de los radicales libres, disponible comercialmente, se ha utilizado como agente antioxidante en los procesos de isquemia aguda cerebral10. En modelos de conejo se ha descrito su efecto protector por vía intravenosa frente a la lesión isquémica de médula espinal11-14. Sin embargo, fue necesaria una dosis de más de 3mg/kg, administrada por vía intravenosa, para reducir eficazmente dicha lesión11-14. En un contexto clínico, la información del fármaco indica la posible incidencia de insuficiencia renal aguda y deterioro funcional hepático cuando la dosis supera la establecida clínicamente15.
Formulamos la hipótesis de que una dosis más baja de edavarona inyectada en el segmento clampado de aorta podría proteger la médula espinal, con menor riesgo de complicaciones hepáticas o renales. No obstante, la inyección en el segmento clampado de aorta suscita la preocupación de que se asocie a toxicidad neuronal debido a la elevada concentración del fármaco en el tejido, aunque no se dispone de pruebas de una lesión neuronal dosisdependiente con edavarona16. En el presente estudio, examinamos 1) si una dosis baja del fármaco es eficaz cuando se inyecta en el segmento clampado de aorta (efectividad) y 2) si la inyección en el segmento clampado de aorta provoca lesión neuronal (toxicidad).
Materiales y MétodosCuidados de los animalesLos cuidados de los animales y todos los procedimientos del estudio se efectuaron en cumplimiento con la Guide for the Care and Use of Laboratory Animals, preparada por el Institute of Laboratory Animal Resources, National Research Council, y publicada por la National Academy Press, revisada en 1996. El protocolo experimental y el de los cuidados de los animales fueron aprobados por los Research Facilities for Laboratory Animal Science of the Hiroshima University School of Medicine.
Modelos animalesSe dividió en tres grupos a 18 conejos blancos, domesticados, japoneses, que pesaban alrededor de 2,5-3,0kg: isquemia transitoria, seguida de tratamiento con 3mg/kg de edavarona intraaórtica (grupo A, n=6), 1mg/kg de edavarona intraaórtica (grupo B, n=6) o suero salino (grupo C, n=6). En los estudios previos en animales, la dosis mínima que resultó eficaz fue de 3mg/kg11-14. Puesto que, en último término, la edavarona intraaórtica penetra en la circulación sistémica, se esperaba un efecto protector sobre la médula espinal en el grupo A (control positivo). En Japón, en la práctica clínica, se administra habitualmente una dosis intravenosa de 1mg/kg, pero esta dosis es inferior a la intravenosa mínima eficaz de 3mg/kg. El grupo C sirvió de control negativo. Se permitió a todos los conejos libre acceso al alimento y agua antes y después del procedimiento. Todos los animales se asignaron aleatoriamente a un grupo A, B, o C antes de la preparación quirúrgica. Previamente demostramos que la isquemia transitoria de la médula espinal mediante clampaje exclusivo de la aorta abdominal por debajo de la arteria renal izquierda durante 15min daba lugar sistemáticamente a paraplejía en los animales9. En el presente estudio se utilizó este modelo animal.
Anestesia y monitorizaciónLa anestesia se indujo con la administración intramuscular de hidrocloruro de ketamina en una dosis de 50mg/kg. Se insertó un catéter de calibre 24 en la vena marginal de la oreja para la infusión intravenosa continua de solución de lactato sódico compuesta. A través del catéter, se inyectó cefazolina (10mg/kg). Después de la traqueostomía e intubación endotraqueal, se ventiló mecánicamente a los animales con isoflurano al 2% en oxígeno para inducir la anestesia suficiente. La presión arterial de la aorta proximal y distal se determinó mediante catéteres (JMS cutdown tube; C3, Hiroshima, Japón) implantados en la arteria axilar derecha y la arteria femoral derecha. También se monitorizó continuamente el trazado ECG. La intervención se efectuó en condiciones de normotermia. La temperatura rectal se monitorizó continuamente y se mantuvo en 38,0±0,5°C durante el procedimiento mediante una manta térmica.
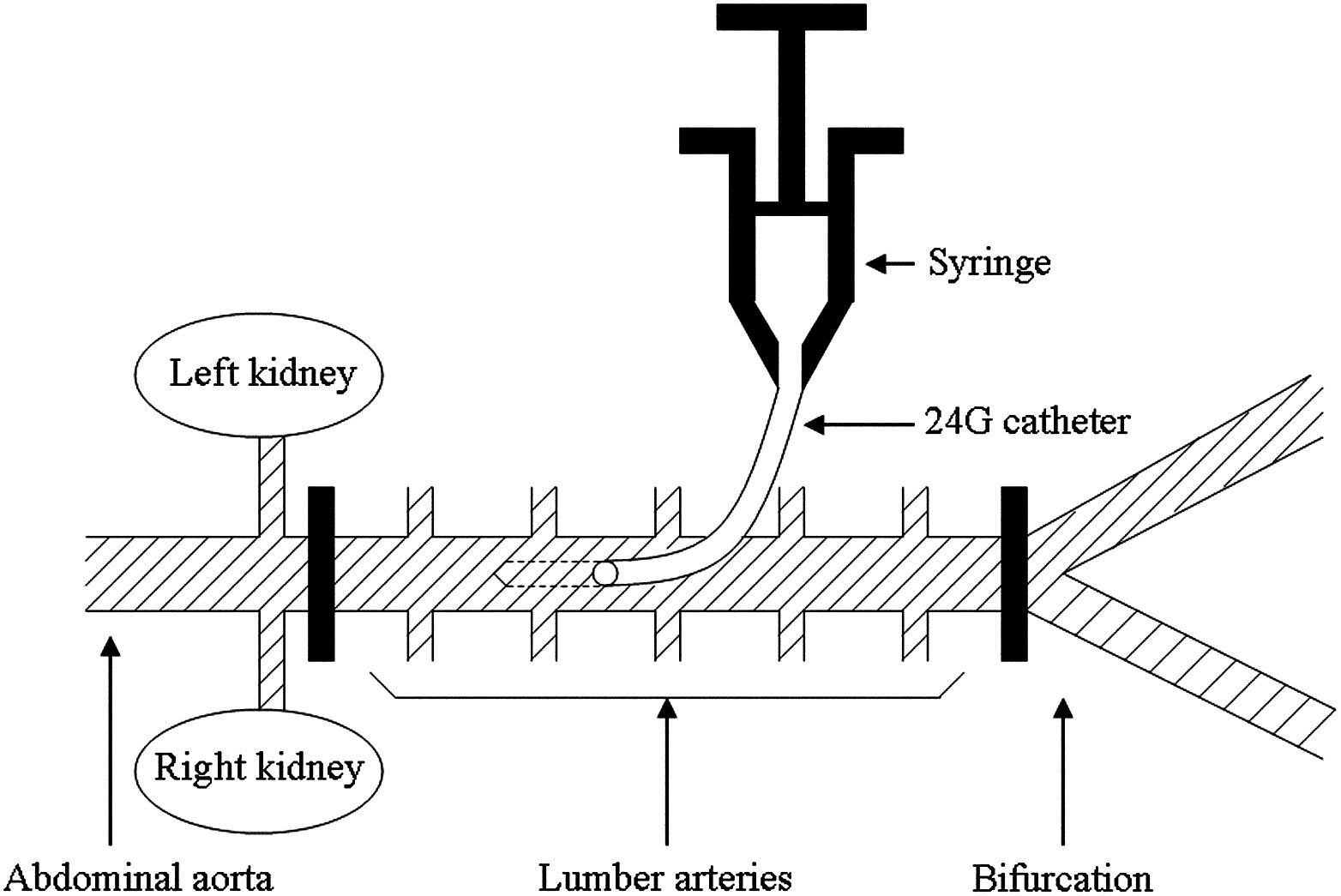
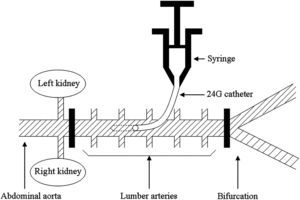
Procedimiento quirúrgicoEn posición de decúbito lateral derecho, se efectuó un abordaje en la piel del flanco izquierdo paralela a la columna vertebral. Se aisló la aorta abdominal y se rodeó entre los niveles de la arteria renal y la bifurcación con un abordaje retroperitoneal. Se administró sulfato de heparina por vía intravenosa (100 U/kg). La aorta abdominal se interrumpió mediante clampajes vasculares por debajo de la arteria renal y por encima de la bifurcación, con la inducción de isquemia de la médula espinal durante 15min. Inmediatamente después del clampaje de la aorta abdominal, se insertó un catéter de calibre 24 en la aorta y se inyectó edavarona o suero salino en el segmento aórtico clampado durante un minuto a temperatura ambiente (fig. 1). Se administró un volumen total de líquido de 6ml en la aorta clampada en cada grupo. Después de la inyección, se retiró de inmediato el catéter, y su punto de entrada se cerró con una sutura de polipropileno de 8-0 (Ethicon, Somerville, NJ). Después de 15min, se suprimió el clampaje aórtico. Se cerró el abdomen y se retiraron todos los catéteres. Se permitió que los animales se restablecieran de la anestesia, se les extubó y se procedió a los cuidados postoperatorios habituales.
Diagrama del método de producción de isquemia de la médula espinal e inyección de edavarona en el presente estudio. La aorta abdominal se interrumpió con clampajes vasculares por debajo de la arteria renal y por encima de la bifurcación. Inmediatamente después del clampaje, se inyectó el fármaco en el segmento aórtico clampado a través de un catéter de calibre 24 durante un minuto. Left kidney = Riñón izquierdo. Syringe = Jeringa. 24G catéter = Catéter de calibre 24. Right kidney = Riñón derecho. Abdominal aorta = Aorta abdominal. Lumber arteries = Arterias lumbares. Bifurcation = Bifurcación.
A los 7 días de la reperfusión isquémica, se sacrificó a los animales y se extrajeron de inmediato las médulas espinales. Todas las muestras se fijaron por inmersión en un 10% de paraformaaldehído y, acto seguido, se almacenaron durante una semana. La muestra a nivel de L5 se fijó en parafina y se cortó para tinción y examen microscópico.
Evaluación neurológicaLa función neurológica se evaluó a las 8, 24 y 48h y 7 días después de la reperfusión y se clasificó utilizando una escala de 5 puntos, de acuerdo con la puntuación de Tarlov: 0, paraplejía espástica y ausencia de movimiento de las extremidades inferiores; 1, paraplejía espástica y ligero movimiento de las extremidades inferiores; 2, movimiento apropiado de las extremidades inferiores pero incapaz de mantenerse erguido; 3, capaz de mantenerse erguido pero incapaz de andar normalmente; 4, restablecimiento completo y marcha/saltos normales17. Un observador, enmascarado para el protocolo, clasificó la función neurológica.
Evaluación histológicaPara evaluar los cambios patológicos de la médula espinal después de la isquemia, los cortes obtenidos 7 días después de la reperfusión en cada grupo se tiñeron con hematoxilina-eosina y se examinaron mediante microscopio óptico. En cinco cortes de cada animal, se contó el número de grandes neuronas motoras intactas en el asta anterior de la médula espinal (anteriores a una línea dibujada a través del canal central, perpendicular a la cisura media anterior). Un observador, que desconocía el grupo del animal y su desenlace neurológico, examinó cada extensión (x 200). Con la tinción de hematoxilina-eosina, se consideró presente “muerte” celular si se observó una eosinofilia difusa del citoplasma y se consideraron “viables” si se demostró un punteado basófilo18 (es decir, contenían gránulos de Nissl).
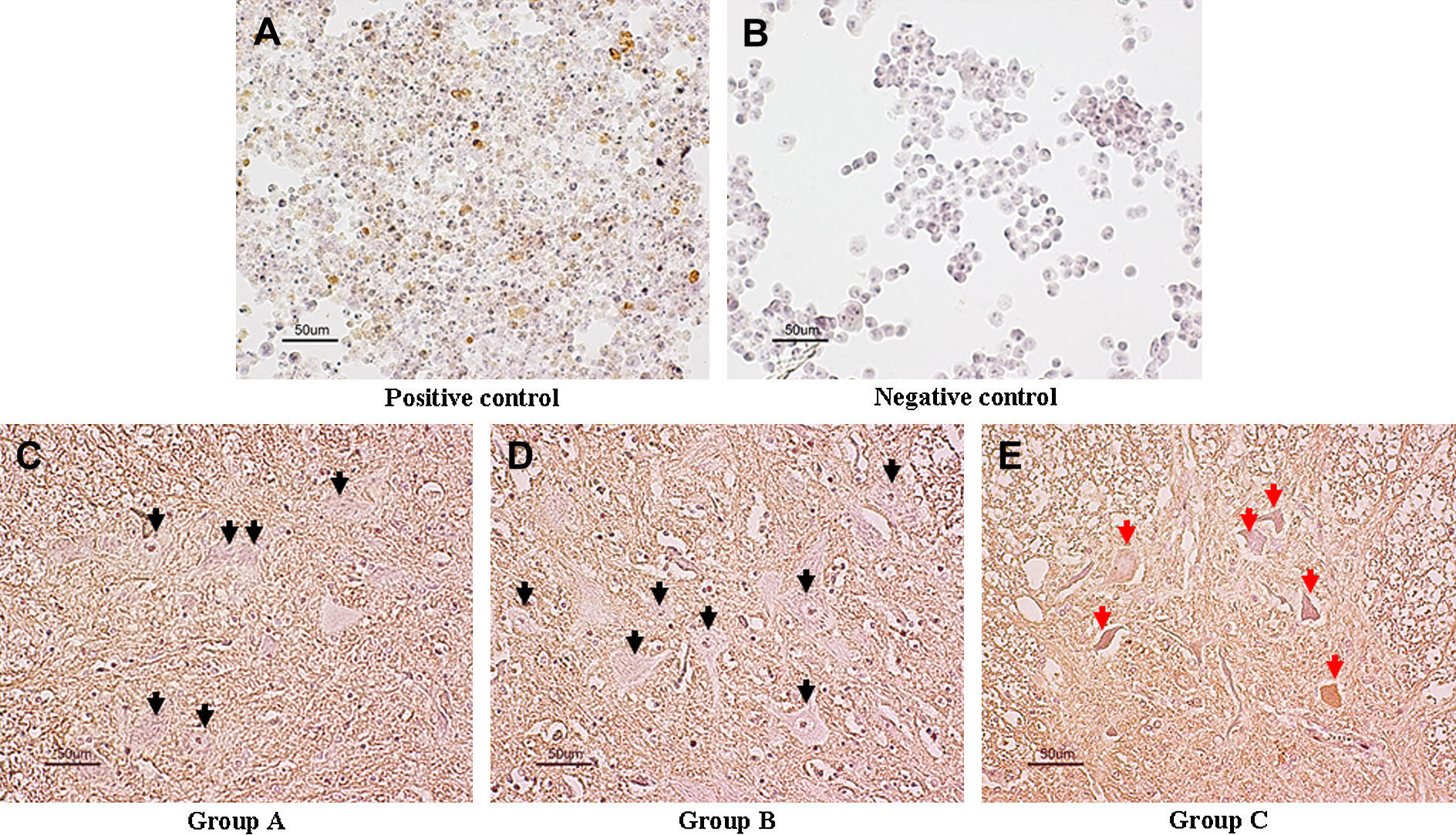
Tinción TUNELPor medio de la técnica de tinción in situ terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling (TUNEL) se examinaron las células con roturas de la doble cadena de ADN, que son sugestivas de apoptosis. Para la tinción TUNEL se utilizaron cortes fijados en parafina con el equipo Neuro TACS II in situ Apoptosis Detection Kit (Trevigen, Gaithesburg, MD), de acuerdo con las instrucciones del fabricante. Brevemente, después de su desparafinación, los cortes fueron tratados con proteasa y H2O2 al 0,3%. Acto seguido, los cortes se incubaron durante 60min con desoxinucleotidil transferasa terminal a 37°C. Con una solución de diaminobencidina/H2O2 se desarrolló color. Los cortes se contratiñeron con hematoxilina. Se definió la “apoptosis” cuando sólo se tiñeron el núcleo y los cuerpos apoptóticos, mientras que se definió “necrosis” cuando se tiñó el citoplasma, con o sin tención del núcleo. Se prepararon extensiones de control positivo con células HeLa, tratadas con radiación microscópica ultravioleta (UV) a 50J/m2 mediante una lámpara germicida con una emisión máxima a 254nm19 y se prepararon extensiones de control negativo con células HeLa, no tratadas con radiación UV.
Análisis estadísticoTodos los resultados se expresaron como medias ± desviación estándar (DE). Se estableció la significación estadística con un valor de p<0,05. Para identificar las diferencias de grupo que representaban un valor de p significativo se usaron la prueba de la U de Mann-Whitney, un análisis de la variancia de una vía (ANOVA) y una prueba post hoc con diferencia mínima significativa protegida de Fisher. También evaluamos la relación dosis-respuesta entre el número de neuronas motoras intactas en el asta anterior de la médula espinal y la dosis aplicada de edavarona usando el modelo ANOVA. Los detalles de este modelo se describen en el apéndice.
ResultadosEstado fisiológicoDurante la intervención, no se observaron diferencias significativas en las presiones arteriales medias proximales y distales y las frecuencias cardíacas entre grupos. Los 18 animales sobrevivieron durante 7 días y no hubo muertes operatorias.
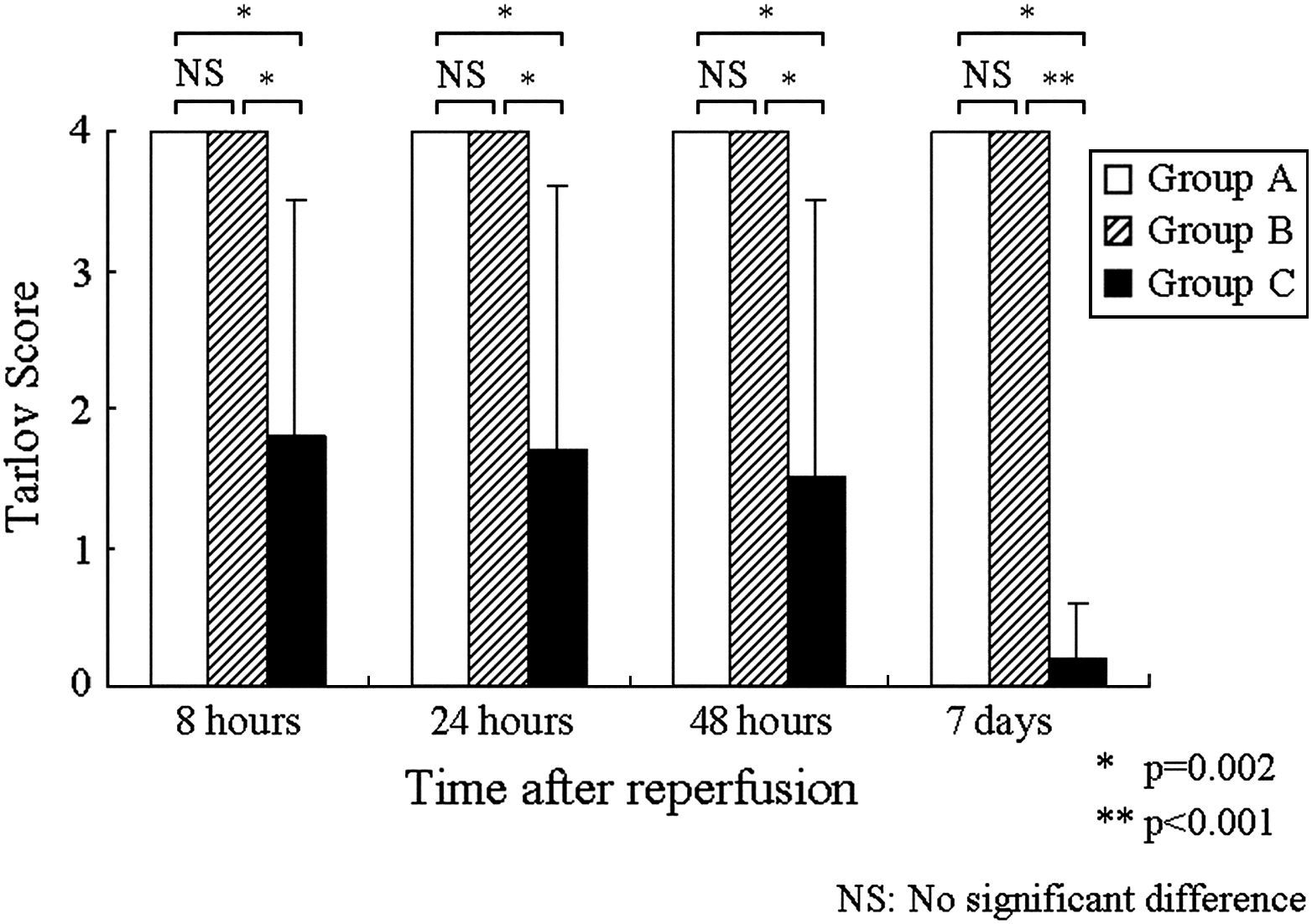
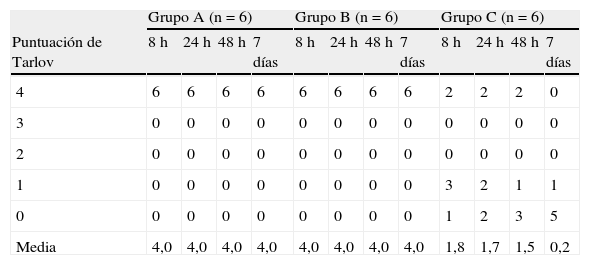
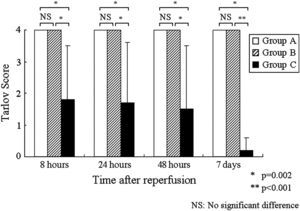
Hallazgos neurológicosLos resultados de la evaluación neurológica se resumen en la tabla I. No hubo una variabilidad interobservador en la puntuación de Tarlov. Ésta fue de 4,0±0,0 durante todo el período de observación en los grupos A y B; la función motora de las patas traseras se restableció en los dos grupos tratados con edavarona. No obstante, en el grupo C, las puntuaciones de Tarlov fueron de 1,8±1,7 a las 8h, 1,7±1,9 a las 24h, 1,5±2,0 a las 48h y 0,2±0,4 a los 7 días después de la reperfusión. La puntuación fue significativamente más alta en todos los puntos de tiempo en el grupo A que en el C (p=0,002, p=0,002, p=0,002 y p<0,001, respectivamente). Así mismo, en el grupo B fue significativamente más alta que en el C (p=0,002, p=0,002, p=0,002 y p<0,001, respectivamente). No se identificaron diferencias significativas de la función neurológica entre en el grupo A y el B (fig. 2).
Desenlace neurológico a la 8, 24, y 48h y 7 días después de la reperfusión
| Grupo A (n=6) | Grupo B (n=6) | Grupo C (n=6) | ||||||||||
| Puntuación de Tarlov | 8h | 24h | 48h | 7 días | 8h | 24h | 48h | 7 días | 8h | 24h | 48h | 7 días |
| 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 2 | 2 | 2 | 0 |
| 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 2 | 1 | 1 |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 3 | 5 |
| Media | 4,0 | 4,0 | 4,0 | 4,0 | 4,0 | 4,0 | 4,0 | 4,0 | 1,8 | 1,7 | 1,5 | 0,2 |
Cambios de la puntuación de Tarlov a las 8, 24 y 48h y 7 días después de la reperfusión. En los grupos A y B, la puntuación fue significativamente más alta en todos los puntos de tiempo que en el grupo C (∗p=0,002, ∗∗p<0,001). No se identificó una diferencia significativa en la función neurológica entre los grupos A y B. NS: no significativo. Tarlov Store = Puntuación de Tarlov. Time alter reperfusion = Tiempo después de la repercusión. NS = NS. Hours = Horas. Days = días. Group A = Grupo A. Group B = Grupo B. Group C = Grupo C. NS: No significant difference = NS: diferencia no significativa.
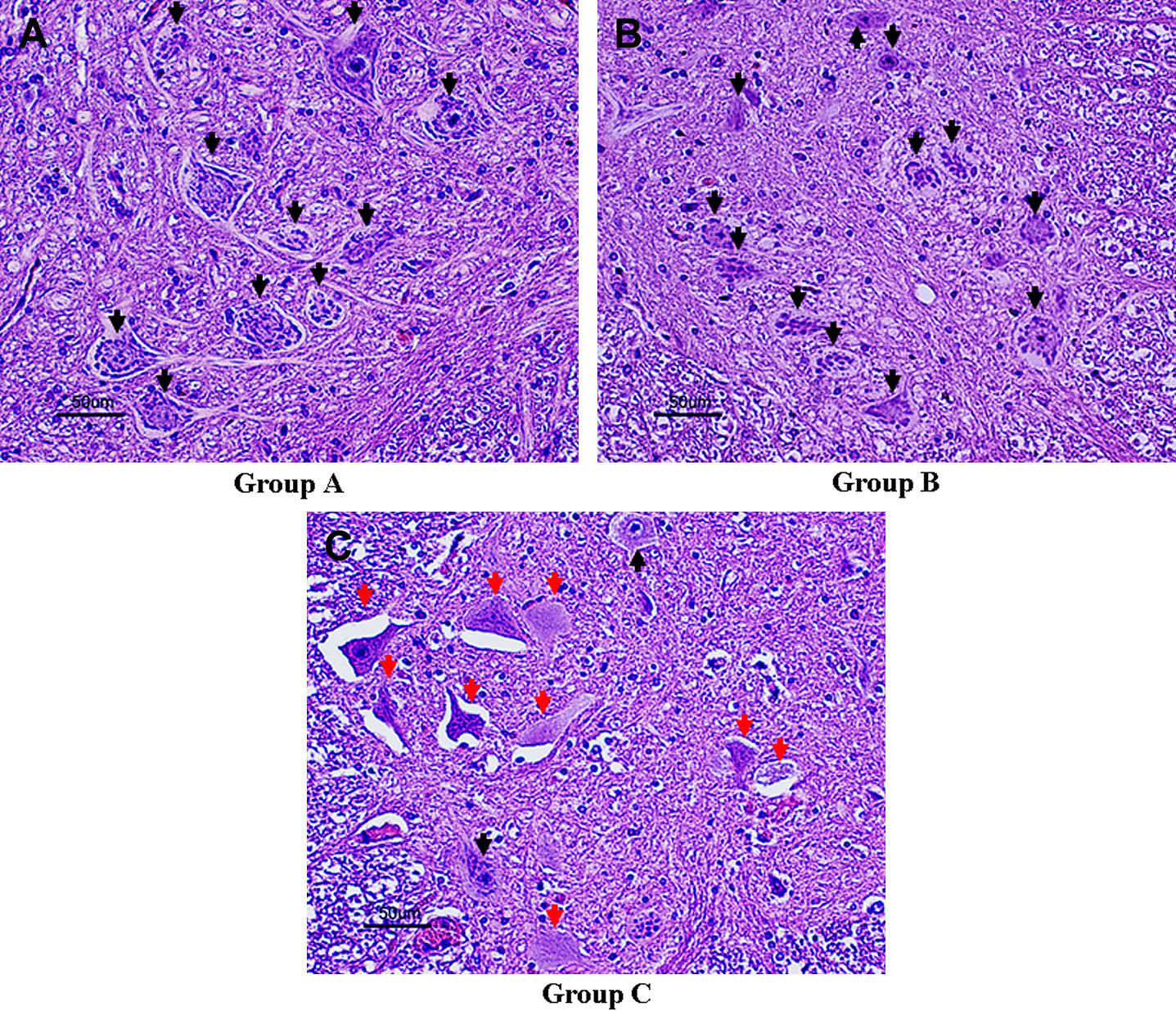
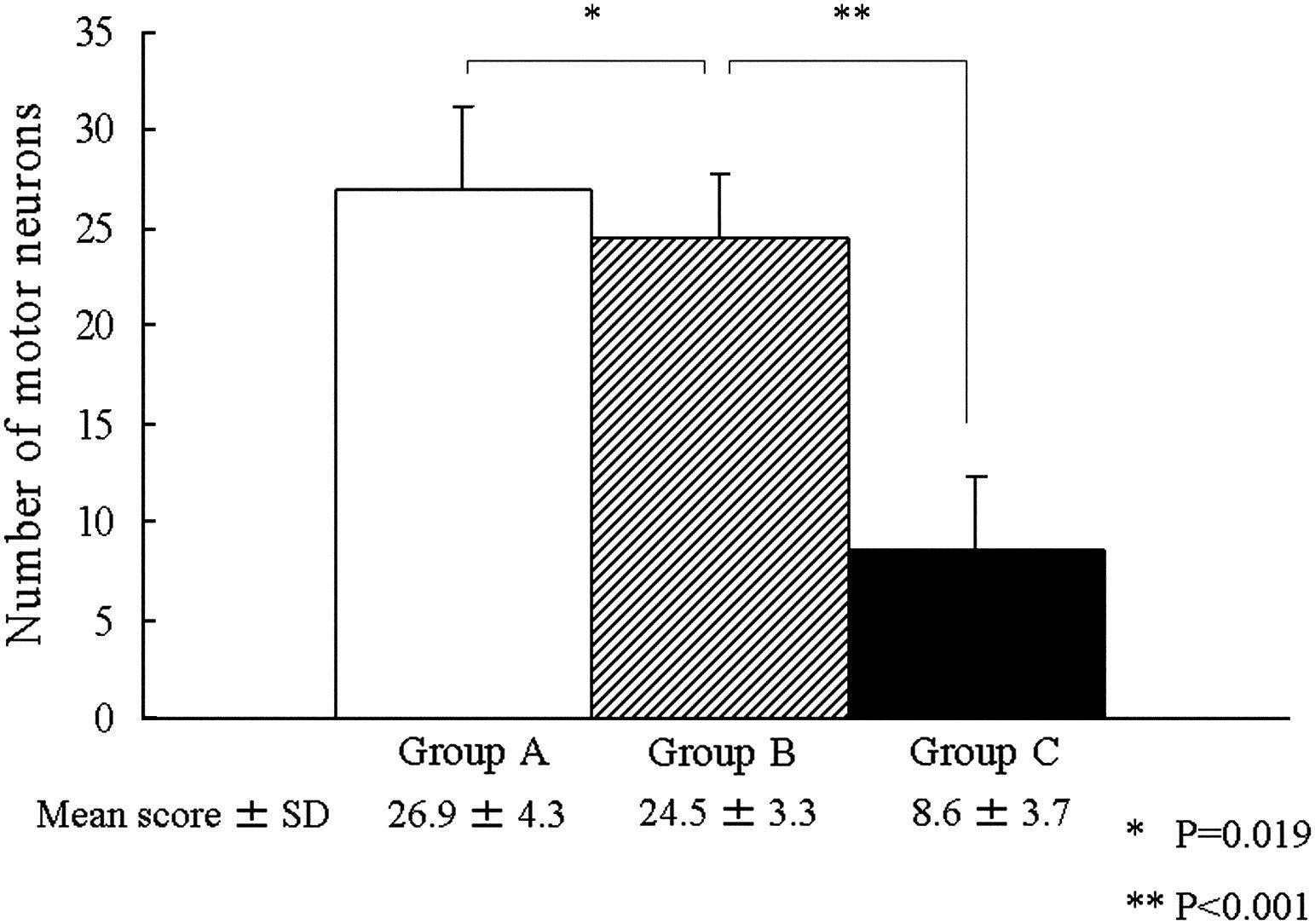
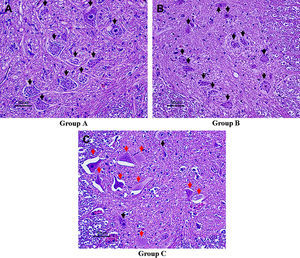
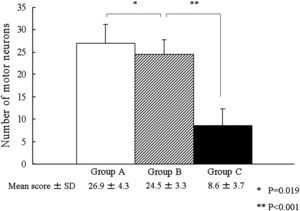
En el día 7 después de la reperfusión, en los grupos A y B, una mayoría de neuronas motoras permanecían intactas en el asta anterior de la médula espinal (figs. 3A y 3B; flechas negras), mientras que, en el grupo C, una mayoría de neuronas motoras estaban necróticas (flechas rojas). En este grupo, se observó lesión neuronal grave con degeneración neuronal eosinófila, vacuolización y necrosis franca y presencia de algunas células inflamatorias (fig. 3C). El número de neuronas motoras intactas en el asta anterior de la médula espinal fue de 26,9±4,3 en el grupo A, 24,5±3,3 en el grupo B y 8,6±3,7 en el grupo C (fig. 4). Además, el análisis ANOVA demostró una diferencia significativa en el número de neuronas motoras intactas entre los grupos A y B y entre los grupos B y C (p=0,019 y p<0,001, respectivamente). Hubo una relación dosis-respuesta entre dicho número y la dosis aplicada de edavarona.
Hallazgos histológicos en el asta anterior de la médula espinal a nivel de L5, teñida con hematoxilina-eosina en el día 7 después de la reperfusión (aumento x 200). Las flechas negras indican neuronas motoras intactas; las flechas rojas, neuronas motoras necróticas. En el grupo A (A) y en el grupo B (B), una mayoría de neuronas motoras permanecieron intactas. En el grupo C (C), muchas neuronas motoras estaban necróticas; se observó lesión neuronal grave con degeneración neuronal eosinófila, vacuolización y necrosis franca, así como la presencia de algunas células inflamatorias. Group A = grupo A. Group B = grupo B. Group C = grupo C.
Número de neuronas motoras del asta anterior de la médula espinal en el día 7 después de la reperfusión. Se identificó una diferencia significativa en el número de neuronas motoras intactas entre los grupos A y B y entre los grupos B y C (∗p=0,019 y ∗∗p<0,001, respectivamente). SD: desviación estándar. Number of motor neurons = Número de neuronas motoras. Group A = grupo A. Group B = grupo B. Group C = grupo C. Mean score ± SD = Puntuación media ± DE.
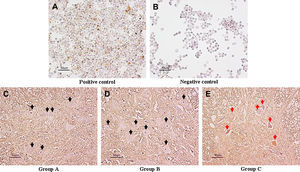
En las células HeLa apoptóticas tratadas con radiación UV (control positivo) se observaron núcleos parduscos con la tinción TUNEL (fig. 5A), mientras que no se demostraron en ninguna de las células sin radiación UV (control negativo) (fig. 5B). En el día 7 después de la reperfusión, en las neuronas motoras del asta anterior de la médula espinal de los grupos A y B no se observaron núcleos con dicha coloración, indicativo de la ausencia de apoptosis (figs. 5C y 5D). Entre los grupos A y B no se observó ninguna diferencia. En el grupo C, en el asta anterior en algunas neuronas motoras se observó tinción difusa del citoplasma sin núcleos parduscos (fig. 5E). Este hallazgo se interpretó como una tinción TUNEL negativa, indicativo de necrosis de las neuronas de la médula espinal pero no de apoptosis.
Tinción TUNEL característica de la médula espinal a nivel de L5 en el día 7 después de la reperfusión (aumento x 200). En el control positivo (A), las células HeLa apoptóticas tratadas con radiación UV mostraron núcleos parduscos con la tinción. En el control negativo (B) ninguna de estas células sin radiación UV mostró dicha coloración. En los grupos A (C) y B (D), no se observaron neuronas motoras teñidas (flechas negras). En el grupo C (E), en algunas células se demostró tinción difusa del citoplasma pero sin núcleos parduscos, es decir, TUNEL negativas, indicativo de necrosis de las neuronas de la médula espinal (flechas rojas) pero no de apoptosis. Positive control = control positivo. Negative control = control negativo. Group A = grupo A. Group B = grupo B. Group C = grupo C.
El presente estudio demostró que 1) la edavarona inyectada en el segmento clampado de aorta impide la lesión neuronal tanto inmediata como diferida después de isquemia de la médula espinal, 2) el efecto protector es adecuado con 1mg/kg de edavarona intraaórtica y 3) la inyección en la aorta clampada no da lugar a una lesión evidente de las células neuronales.
El fármaco inyectado en el segmento clampado de aorta protegió la médula espinal con tanta eficacia como la administración intravenosa. Los estudios previos han descrito los mecanismos de los efectos citoprotectores del fármaco: efecto scavenger de radicales libres, reducción de la óxido nítrico sintasa neuronal, aumento de la óxido nítrico sintasa endotelial y reducción de la lesión oxidativa del ADN11-13. Suzuki et al11 describieron que la edavarona elimina los radicales libres producidos después de lesión de isquemia-reperfusión y que la función neurológica se restablece con la inyección intravenosa profiláctica del fármaco en un modelo de isquemia raquídea en el conejo.
En función de estos resultados, buscamos una vía eficaz de administración del fármaco. Cuando se administra por vía intravenosa, una dosis de 3mg/kg, o más alta, es eficaz para la protección de la médula espinal, pero no confiere una protección completa porque en ocasiones se observó disfunción motora de las patas traseras, manifestada por ataxia12,13 (salto no coordinado) o posición de sedestación exclusiva14. En comparación, 1mg/kg (la dosis clínica administrada por vía intravenosa para tratar el infarto cerebral) es de eficacia suficiente cuando se inyecta en el segmento clampado de aorta. La información sobre el fármaco advierte de la posible incidencia de insuficiencia renal aguda o lesión hepática cuando se supera la dosis de 1mg/kg, mientras que estos efectos adversos rara vez se presentan cuando la dosis se encuentra en este intervalo. Inyectada en la aorta, en último término, penetra en la circulación sistémica y es probable que produzca efectos adversos similares. La administración intraaórtica de una dosis baja puede ser beneficiosa para mejorar el efecto protector en la médula espinal, al mismo tiempo que se reducen a un mínimo los efectos adversos sobre otros órganos. Svensson et al20 documentaron que la infusión local de una solución cristaloide fría redujo eficazmente la atenuación de la amplitud de los potenciales evocados motores raquídeos pero, en apariencia, no redujo la tasa de déficit neurológico en un estudio de experimentación en animales. En comparación, en el presente estudio, una dosis clínicamente pertinente inyectada en el segmento clampado de aorta redujo la tasa de déficit neurológico.
Sin embargo, la inyección en la aorta clampada suscita la preocupación de toxicidad neuronal debido a la elevada concentración en el tejido de la médula espinal. En el presente estudio, no se observó una disfunción motora evidente en la evaluación neurológica ni pruebas histológicas de lesión neuronal. En los estudios futuros será necesario determinar la dosis mínima eficaz que protege frente a la lesión de médula espinal sin provocar lesiones de otros órganos.
En la lesión neuronal causada por isquemia de médula espinal se observan dos patrones: inmediato y diferido21. Con frecuencia, el primero se debe a la grave agresión isquémica y la necrosis rápida de las neuronas. El segundo se debe a apoptosis22-24 o necrosis21,25,26. En estos estudios previos también se describió que la interrupción del flujo sanguíneo aórtico abdominal infrarrenal durante 15min provocó una lesión neuronal inmediata en 2 días y una paraplejía diferida en 7 días22-26. En el presente estudio, comparado con el grupo de control (grupo C), en los grupos tratados con edavarona (grupos A y B) no se observó lesión neuronal inmediata ni paraplejía diferida. En estos grupos los hallazgos histológicos a los 7 días demostraron la preservación de muchas neuronas motoras intactas, con una disminución del número de neuronas necróticas y sin neuronas motoras apoptóticas, mientras que, en el grupo de control negativo, los hallazgos histológicos demostraron lesión neuronal grave, ausencia de apoptosis y presencia de algunas células inflamatorias. El hecho fue que la muerte neuronal total originada por la lesión de isquemia-reperfusión se atenuó con la inyección intraaórtica profiláctica de edavarona, aunque no queda claro el mecanismo exacto, ya que su dilucidación no era el objetivo de la presente investigación. En este modelo la lesión neuronal diferida podría ser un evento mediado por la inflamación, como describieron Papakostas et al21, aunque, en el presente estudio, no se demuestra claramente sin evaluaciones histológicas en la fase aguda.
En los grupos tratados con el fármaco, el examen histológico reveló la presencia de algunas neuronas motoras necróticas, sugiriendo que el efecto protector del fármaco no es perfecto. Se ha anticipado una investigación adicional sobre la efectividad y toxicidad. Otros protocolos de administración, como las inyecciones escalonadas o el uso combinado de edavarona con enfriamiento tópico/central, podrían compensar esta limitación. Aunque es de importancia primordial la preservación de la arteria que irriga la médula espinal, no siempre puede identificarse preoperatoriamente. El efecto protector del fármaco, inyectado directamente en la aorta, o mediante un protocolo de “raquidoplejía” integrada, podría ser de utilidad en estos casos.
En conclusión, la inyección de edavarona en el segmento clampado de aorta es viable y eficaz sin ninguna lesión neuronal de la médula espinal en un modelo de conejo. Este método podría proteger esta estructura frente a una lesión isquémica, con una dosis del fármaco similar a la utilizada en la práctica clínica. El presente estudio indica que este método puede ser un adyuvante útil para la protección de la médula espinal durante la cirugía de aorta torácica y toracoabdominal.
Los autores desean expresar su agradecimiento al Sr. Kazunori Iwase y a la Srta. Emi Fukuda por su excelente ayuda técnica.
Evaluamos la relación dosis-respuesta entre el número de neuronas motoras intactas en el asta anterior de la médula espinal (yi) y la dosis aplicada de edavarona(xi(A∪B),xi(A)) utilizando el modelo ANOVA descrito más adelante:
Donde xi(A∪B) y xi(A) son variables indicadoras de grupo definidas por
Los parámetros δB|C y δA|B indican la diferencia de las medias entre el grupo C y el B y entre el grupo B y el A, respectivamente.