Recientemente, se ha emprendido una intensa búsqueda con el objetivo de encontrar fuentes de células apropiadas para la fabricación de tejido vascular. En los estudios previos se ha descrito que las células con un potencial multilinaje están presentes dentro del estroma conjuntivo de la piel. En coincidencia con esta información, los datos preliminares de nuestro grupo sugieren que los fibroblastos dérmicos humanos tienen la capacidad de alterar su fenotipo hacia uno similar a la célula endotelial in vitro. Como primer paso en el uso de estas células en la fabricación de tejidos vasculares, investigamos su capacidad para formar una capa de tipo célula endotelial en una estructura in vitro. Además, estudiamos la posibilidad de sembrar fibroblastos dérmicos en una estructura y, más tarde, iniciar la inducción hacia un fenotipo de tipo célula endotelial.
MétodosEn una estructura de gelatina se sembraron células cultivadas en un medio de fibroblastos normales o en un medio de inducción endotelial. Para estudiar la organización de las células, se efectuó una tinción sistemática. La diferenciación se confirmó mediante inmunotransferencia e inmunohistoquímica con anticuerpos dirigidos contra las moléculas usadas habitualmente para identificar las células endoteliales.
Resultado y conclusiónLos datos del presente estudio respaldan que los fibroblastos dérmicos humanos diferenciados hacia células de tipo endotelial ya presentaban una similitud histológica con las células endoteliales maduras antes de la siembra, mientras que una vez sembrados e inducidos hacia la diferenciación crecen en una estructura multicapa. Sin embargo, utilizando ambas técnicas se observó la expresión de diversas moléculas de superficie, indicativa de un fenotipo endotelial. En conclusión, los resultados presentados en este estudio indican que los fibroblastos dérmicos humanos diferenciados hacia un fenotipo similar a la célula endotelial pueden ser una nueva fuente de células para la endotelización de los injertos vasculares.
En la asistencia sanitaria moderna la enfermedad vascular constituye un problema importante. Los actuales métodos de tratamiento incluyen el uso de injertos autólogos o sintéticos1-3 (Dacrón o politetrafluoroetileno). No obstante, la limitación en la obtención de derivaciones autólogas y los problemas de trombosis de los injertos protésicos han hecho que se investiguen otras alternativas en el campo de la ingenieria tisular. Su objetivo final es crear sustitutos funcionales para las lesiones tisulares, con la aplicación de los principios de la biología y de la ingeniería4. Durante la pasada década, se han descrito diversas técnicas para crear injertos vasculares5-7. En 1998, L'Heureux et al8 describieron un método mediante el que se generó in vitro un vaso sanguíneo completo. Sin embargo, a pesar de los progresos recientes, todavía no se disponen de injertos vasculares apropiados para su uso clínico.
Una alternativa a la ingeniería tisular es la endotelización de los injertos sintéticos. En 1984, Herring et al9 publicaron su primer estudio en que demostraban los beneficios de sembrar prótesis vasculares con células endoteliales. Estudios posteriores han demostrado que la endotelización de las prótesis vasculares antes de su implantación confiere una protección frente a la formación del trombo y mejora la supervivencia a largo plazo del injerto2,5,10-12. Sin embargo, la obtención de células endoteliales autólogas humanas primarias puede ser difícil. La plasticidad de las células madre autólogas, como las mesenquimatosas y hematopoyéticas, ha sido extensamente estudiada como posible alternativa a la obtención de tejidos vasculares13,14. Sin embargo, los problemas a la hora de obtener y cultivar estas células impiden su uso clínico13,15,16.
En los últimos años, se han identificado poblaciones celulares que son capaces de alterar su fenotipo y diferenciarse hacia una extirpe celular distinta de la de su tejido de origen15-18. En una serie de estudios recientes se describe que las células con un potencial multilinaje están presentes en el estroma conjuntivo de la piel19-23. Los datos de nuestro grupo indican que los fibroblastos dérmicos humanos o, como mínimo, una subpoblación de ellos pueden diferenciarse en varios linajes mesenquimatosos, como el hueso, cartílago y grasa24,25. Los fibroblastos están presentes en un elevado número en la piel y puede obtenerse una alta producción de células mediante procedimientos mínimamente cruentos a partir de una pequeña biopsia de piel. Además, los datos preliminares de nuestro grupo sugieren que in vitro los fibroblastos dérmicos humanos tienen la capacidad para diferenciarse hacia un fenotipo similar a la célula endotelial. La diferenciación tuvo lugar cuando estas células se cultivaron en un medio de crecimiento que contenía suero humano. Las células de tipo endotelial expresaron el factor de von Willebrand (fvW), se incorporaron a las lipoproteínas de baja densidad marcadas con fluorocromo, y formaron redes de tipo capilar.
El objetivo principal del presente estudio fue investigar el uso de fibroblastos dérmicos humanos diferenciados hacia un fenotipo similar a la célula endotelial, como fuente de endotelización de los injertos vasculares. Usamos una estructura basada en una matriz de gelatina porcina de tipo A con abundantes enlaces cruzados. Las publicaciones previas han demostrado que la gelatina favorece la fijación y el crecimiento de diversos tipos de células de los mamíferos, en particular las células endoteliales26. La matriz de gelatina utilizada en el presente estudio se ha empleado previamente como estructura para la regeneración guiada de tejidos y los tratamientos celulares in vitro e in vivo, y sus propiedades indican que puede utilizarse en la ingeniería de tejidos vasculares27-32. El objetivo secundario del presente estudio fue investigar la posibilidad de sembrar las estructuras con fibroblastos dérmicos humanos y, más tarde, iniciar la inducción hacia una célula similar a la endotelial. Nuestra teoría fue que este procedimiento acortaría el tiempo de cultivo necesario para la endotelización de los injertos vasculares utilizando fibroblastos dérmicos humanos.
Materiales y métodosAislamiento de las célulasFibroblastos dérmicos humanosLos fibroblastos dérmicos humanos se obtuvieron a partir de muestras de tejido (tejido desechado) de individuos sanos sometidos a procedimientos habituales de cirugía plástica. El tejido se transportó en un apósito embebido en cloruro sódico y se procesó al cabo de 24 h. Los cultivos primarios de fibroblastos humanos se aislaron mecánicamente por disección de la capa dérmica de las muestras de piel y más tarde se incubaron los fragmentos a 37°C en un medio de Eagle modificado por Dulbeccós (DMEM) que contenía un 2% de suero de ternera fetal (SCF), colagenasa 165 U/ml (tipo 1; Worthington, Freehold, NJ), y Dispase® 2,5 U/ml (GIBCO BRL, Life Technologies, Karlsruhe, Alemania). Las células se expandieron mediante incubación en frascos de cultivo de 75 cm2 a 37°C con un 5% de CO2 y un 95% de humedad en un medio de crecimiento de fibroblastos (FGM; DMEM que contenía un 10% de STF, antibióticos y antimicóticos [penicilina 50 U/ml y estreptomicina 50 μg/ml]). El medio se cambió tres veces a la semana.
Fibroblastos clonados de una sola célulaPara eliminar el riesgo de tener células contaminantes en los cultivos primarios de fibroblastos, se usaron fibroblastos dérmicos normales y fibroblastos clonados de una sola célula. Para producir estos últimos, los cultivos de fibroblastos dérmicos humanos en las fases 1-4 se separaron enzimáticamente de la placa de cultivo lavando las células en un medio de ácido etilenodiaminotetraacético (EDTA) al 0,25% (v/v). Más tarde, las células se incubaron a 37°C en un 12,0% (v/v) de EDTA y un 0,12% (v/v) de tripsina. A continuación, se observó la suspensión de células con un microscopio invertido provisto de un micromanipulador (InjectMan NI 2; Eppendorf; Hamburgo, Alemania) y una micropipeta (CellTram Air, Eppendorf). Utilizando el micromanipulador, se transfirieron las células individuales a pocillos diferentes en placas de cultivo de 24 pocillos. En los pocillos donde se alcanzó la confluencia, las células se expandieron utilizando un pase seriado hasta que se obtuvo un número adecuado para los experimentos de diferenciación. El medio se cambió tres veces por semana.
Células endoteliales humanasLas células endoteliales humanas se aislaron utilizando el protocolo descrito por Jaffe et al33. Se obtuvieron cordones umbilicales de recién nacidos sanos y se almacenaron en suero salino tamponado con fosfato (PBS) a 4°C. Las venas se canularon, se lavaron con PBS y después se inyectaron con 165 U/ml de solución de colagenasa (tipo 1, Worthington). Después de 20 min de incubación a 37°C, se efectuó un masaje suave de los vasos que se perfundieron enérgicamente con PBS. La solución de células se centrifugó y el poso de células se resuspendió en un medio de crecimiento de células endoteliales (fibroblast growth medium [EGM]; DMEM, que contenía un 30% de suero humano combinado a partir de varios donantes, antibióticos y antimicóticos [penicilina 50 U/ml y estreptomicina 50 μg/ml] suplementado con 3,3 mM de isobutilmetilxantina [Sigma, Estocolmo, Suecia] y 0,8 mg/ml de toxina del cólera [Sigma]). Las células se cultivaron en frascos de cultivo de 75 cm2 revestidos de gelatina (2% de gelatina) a 37°C con un 5% de CO2 y una humedad del 95%. El medio se cambió tres veces por semana.
Tinción inmunohistoquímica de los cultivos primarios de célulasEl fenotipo de los cultivos primarios de células endoteliales, fibroblastos dérmicos normales, y fibroblastos de clonas de células individuales se caracterizó mediante inmunohistoquímica utilizando un antisuero frente a fvW, cadherina endotelial vascular (ve-cadherina), cluster of differentiation antigen 31 (CD 31) y óxido nítrico sintasa endotelial (NOS3). Todos los experimentos se efectuaron a temperatura ambiente a menos que se mencione lo contrario. Brevemente, las células se lavaron durante 3 x 5 min en PBS antes de fijarlas con un 4% de paraformaldehído amortiguado neutro (NBP) durante 15 min. Las células se lavaron de nuevo durante 3 x 5 min en PBS y, más tarde, se incubaron durante 45 min con un suero inhibidor (un 5% de albúmina de suero bovino) que contenía un 0,05% de Triton X-100 para impregnar las membranas de las células. Sólo se añadió cuando se tiñeron los epítopes intracelulares (fvW y NOS3). Más tarde, las células se incubaron durante una hora con anticuerpos primarios (dilución de fvW 1:200, clona F8/861, de Dako Cytomation, Glostrup, Dinamarca; dilución de VE-cadherina 1:200, clona F-8, de Santa Cruz Biotechnologies, Santa Cruz, CA; dilución de CD31 1:50, clona JC/70A, de Abcam, Cambridge, Reino Unido; y dilución de NOS3 1:50 de Santa Cruz Biotechnologies). Después de lavarlas en PBS, las células se incubaron durante una hora con un anticuerpo secundario conjugado AlexaFluor488 (dilución 1:500, Invitrogen, Estocolmo, Suecia). Por último, las células se lavaron durante 3 x 5 min en PBS y se montaron utilizando el reactivo ProLong Gold para evitar la pérdida de color (VWR, Estocolmo, Suecia) que contenía 4',6-diamidino-2-feniliindol (DAPI). Los controles incluyeron la omisión del anticuerpo primario. En la presente investigación los antisueros primarios y secundarios utilizados se han empleado en otros estudios y se han examinado con respecto tanto a la especificidad como a la reactividad cruzada34-39. Las muestras se visualizaron utilizando los microscopios ópticos/de fluorescencia Olympus (Solna, Suecia) BX41 e IX51 (x40/0,75) ajustados con unos filtros de excitación apropiados (U-MWIB2, BP 460-490 nm) y las imágenes se capturaron utilizando una cámara Olympus DP70CCD.
Inducción de la diferenciaciónLa diferenciación del cultivo monocapa de fibroblastos dérmicos humanos y fibroblastos de clonas de células individuales hacia un tipo de célula similar a la endotelial se indujo cambiando el medio de cultivo de la célula desde un FGM a un EGM, un medio en el que las células endoteliales maduras mantienen su estado diferenciado. La diferenciación se confirmó después de 10 días de cultivo mediante inmunotransferencia y análisis inmunohistoquímico empleando el protocolo descrito previamente para la caracterización inicial de las células endoteliales, fibroblastos y fibroblastos de clonas de células individuales.
Siembra de las células en las estructurasEn el presente estudio, usamos una estructura de matriz de gelatina porcina tipo A con un elevado número de enlaces cruzados (Percell Biolytica, Astorp, Suecia). La estructura incluía poros interconectados con un tamaño medio de los poros internos de alrededor de 30 μm, lo que ofrece áreas de superficie sustanciales para la adhesión celular y facilita la señalización paracrina. La estructura se preparó de acuerdo con las recomendaciones del fabricante. La estructura de alrededor de 1 mm de grosor se hidrató en PBS, se cortó en piezas circulares de 8 mm de diámetro y se esterilizó en autoclave (121°C, 20 min, 15 psi). Las estructuras esterilizadas se lavaron con DMEM y se colocaron en placas de cultivo de 24 pocillos.
Las estructuras se sembraron con (1) células endoteliales cultivadas en EGM (antes y después de la siembra), (2) fibroblastos y fibroblastos de clonas de células individuales cultivados en FGM (antes y después de la siembra), (3) fibroblastos diferenciados hacia un tipo de célula similar a la endotelial cultivados en FGM (antes y después de la siembra), y (4) fibroblastos y fibroblastos de clonas de células individuales cultivados en FGM (antes y después de la siembra). La diferenciación de estas células se indujo 24 h después de la siembra con un cambio del medio de cultivo de FGM por EFM. Las células endoteliales se sembraron a una densidad de 200.000/cm2, mientras que los fibroblastos dérmicos humanos y fibroblastos de clonas de células individuales se sembraron a una densidad de 20.000/cm2.
Tinciones con hematoxilina-eosina e inmunohistoquímica de las células sembradas en estructurasLas células cultivadas en las estructuras durante 10 días se lavaron durante 3 x 5 min en PBS, se fijaron inmediatamente en un 4% de NBP durante 24 h, se volvieron a deshidratar a través de una serie de etanolxileno, y se incluyeron en parafina. Se efectuaron cortes transversales de 7 μm de grosor usando un microtomo RM 2255 (Leica Microsystem, Helsingborg, Suecia). Las secciones se desparafinaron, se tiñeron con hematoxilina-eosina y con métodos inmunohistoquímicos. Para el análisis inmunohistoquímico, se usó un equipo Vectastain Elite ABC (Immunokemi, Järfälla, Suecia) para detectar los anticuerpos primarios. Las secciones transversales se incubaron con suero bloqueante durante 20 min para evitar la unión de proteínas inespecíficas antes de la incubación con los anticuerpos primarios dirigidos a fvW (dilución 1:20, clona F8/86; Dako Cytomation), ve-cadherina (dilución 1:50, clona F-8; Santa Cruz Biotechnologies), CD31 (dilución 1:50, clona JC/70A; Abcam); NOS3 (dilución 1:50, Santa Cruz Biotechnologies), y B2 (dilución 5 μg/ml; Sigma-Aldrich, St. Louis, MO) durante una hora. Antes de incubar las secciones transversales con anticuerpos dirigidos a CD31 o NOS3, se efectuaron dos pasos diferentes de recuperación de antígeno. Las secciones se tiñeron con un 0,5% de solución de epsina durante 10 min a 37°C. Las secciones teñidas con anticuerpos NOS3 se incubaron durante 20 min en una solución de recuperación diana (Dako Cytomation) precalentada a 95°C.
Más tarde, las secciones transversales se lavaron durante 3 x 5 min en PBS y se incubaron con un anticuerpo secundario biotinilado durante 30 min. Las muestras se lavaron de nuevo y se incubaron con el reactivo Vectastain Elite ABC durante 30 min. Después de un lavado durante 3 x 5 min en PBS, el anticuerpo unido se localizó con el equipo Vector VIP (Immunokemi). Todas las secciones transversales se contratiñeron con DAPI y se montaron con gelatina de glicerol (Merck, Darmstadt, Alemania). Los controles no contenían el anticuerpo primario.
Análisis de inmunotransferenciaSe efectuó una inmunotransferencia para confirmar la presencia de marcadores endoteliales en los fibroblastos diferenciados hacia un fenotipo endotelial. Se usaron las proteínas de las células cultivadas durante 10 días en frascos de cultivo celular y de las células cultivadas en las estructuras. Se eliminó el medio de cultivo celular, y se lavaron las células dos veces con PBS frío. Las células cultivadas en frascos se desprendieron utilizando un separador celular, mientras que las estructuras se fragmentaron en pequeñas piezas y después se separaron aún más utilizando un fragmentador. Las suspensiones de células se centrifugaron a 200 x g durante 5 min, y los posos de células se incubaron con un tampón de lisis durante 30 min en hielo. Los lisados de células se centrifugaron a 15.000 x g durante 5 min a 4°C y los sobrenadantes se recogieron y almacenaron a –20°C hasta su análisis posterior. El contenido total de proteínas se determinó utilizando el Bio-Rad Protein Assay con albúmina de suero bovino como estándar (Bio-Rad Laboratories, Estocolmo, Suecia).
Las muestras usadas para la inmunotransferencia se hirvieron a 95°C durante 5 min después de añadir el tampón de muestras Laemmli (Bio-Rad Laboratories) y beta-mercaptoetanol. La electroforesis se efectuó en un 7,5% de geles Ready Tris/HCl (Bio-Rad Laboratories), de acuerdo con los métodos estándar. Por carril se cargaron las mismas cantidades de la muestra (30 μg de proteína para las células cultivadas en frascos de cultivo celular y 60 μg para las cultivadas en la estructura). Los geles se equilibraron en un tampón de transferencia durante 15 min. Las proteínas se transfirieron a membranas de nitrocelulosa (Bio-Rad Laboratories) y se incubaron en una solución bloqueante (un 5% de leche en polvo en 0,05 M de Trizma [pH 7,5], 0,15 M de NaCl y 0,05% de Tween) durante 90 min a temperatura ambiente. Acto seguido, las membranas se incubaron durante toda la noche a 4°C con anticuerpos primarios: fvW (12.100, clona F8/86; Dako Cytomation) o NOS3 (dilución 1:200, Santa Cruz Biotechnologies) diluidos en un tampón de dilución (0,1% de leche en polvo en 0,05 M de Trizma [pH 7,5], 0,15 M de NaCl y 0,05% de Tween). Más tarde, las membranas se lavaron e incubaron durante una hora a temperatura ambiente con un anticuerpo secundario conjugado con peroxidasa, diluido 1:5.000 en un tampón de dilución (0,1% de leche en polvo en 0,05 M de Trizma [pH 7,5], 0,15 M de NaCl y 0,05% de Tween). Después de varios lavados, se visualizaron las bandas utilizando quimioluminiscencia de realce (Amersham ECL™ Western Blotting System; GE Healthcare, Uppsala, Suecia). Como control para la detección de fvW, se usaron plaquetas humanas (40 μg de proteína).
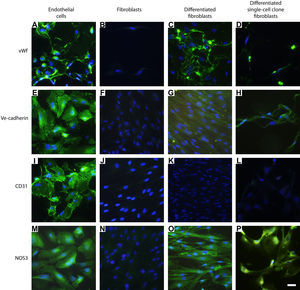
ResultadosCaracterización inicial de los fenotipos celularesPara eliminar el posible riesgo de contaminar los tipos de células en los cultivos de células primarios, se caracterizó el fenotipo de las células endoteliales, fibroblastos dérmicos y fibroblastos de clonas de células individuales, antes de sembrar las células en las estructuras. Durante el cultivo primario en monocapa, las células endoteliales mostraron una inmunotinción positiva cuando se usaron anticuerpos dirigidos hacia fvW, ve-cadherina, CD31 y NOS3 (figs. 1A, 1E, 1I y 1 M), no mostrada por los fibroblastos dérmicos (figs. 1B, 1F, 1 J y 1 N) o los fibroblastos de clonas de células individuales (resultados no mostrados) cultivados en FGM, utilizando el mismo protocolo experimental.
Caracterización inmunohistoquímica de los fenotipos celulares. Las células endoteliales mostraron inmunotinción positiva usando anticuerpos anti-fvW (A), ve-cadherina (E), CD31 (I) y NOS3 (M). Los fibroblastos diferenciados hacia un fenotipo similar a la célula endotelial manifestaron inmunotinción positiva usando los anticuerpos dirigidos hacia fvW (C) y NOS3 (O). Las células manifestaron una inmunotinción positiva menor utilizando antisueros dirigidos frente a ve-cadherina (G). No se pudo observar tinción frente a CD31 (K). Los fibroblastos de clonas de células individuales diferenciados hacia un tipo de célula similar a la endotelial manifestaron inmunotinción positiva utilizando anticuerpos dirigidos a fvW (D) y NOS3 (P). Las células también mostraron una inmunotinción positiva menor utilizando antisueros frente a ve-cadherina (H), pero no pudo detectarse tinción frente a CD31 (L). Utilizando los mismos anticuerpos primarios no se observó inmunorreactividad en los fibroblastos de control (B, F, J, N) o los fibroblastos de clonas de células individuales (resultados no mostrados). La tinción DAPI se usó para visualizar los núcleos de las células. Barra de escala = 25 μm para todas las imágenes. Differentiated fibroblasts: fibroblastos diferenciados; Differentiated single-cell clone fibroblasts: fibroblastos de clonas de células individuales diferenciados; Endothelial cells: células endoteliales; Fibroblasts: fibroblastos; Ve-cadherin: ve-cadherina; vWf: factor de von Willebrand.
El cambio fenotípico de los fibroblastos hacia un tipo de célula similar a la endotelial se indujo cultivando los dérmicos normales y los de clonas de células individuales en EGM durante 10 días. Antes de sembrar las células en las estructuras, se confirmó el cambio del fenotipo mediante un análisis inmunohistoquímico con anticuerpos primarios dirigidos a fvW, ve-cadherina, CD31 y NOS3. Una mayoría de las células mostraron inmunorreactividad tanto citoplasmática como extracelular frente a fvW (figs. 1C y 1D) y la localización citoplasmática de NOS3 (figs. 1O y 1P), mientras que se detectó una inmunotinción menos pronunciada cuando se usó un antisuero frente a ve-cadherina (figs. 1 G y 1H). Los fibroblastos o los fibroblastos de clonas de células individuales inducidos a diferenciarse hacia una célula de tipo endotelial no mostraron inmunorreactividad con la tinción con anticuerpos anti-CD31 (figs. 1 K y 1L). Para confirmar los resultados de la inmunotinción, también efectuamos un análisis de inmunotransferencia. Éste confirmó nuestros resultados previos y los fibroblastos se diferenciaron hacia un tipo de célula similar a la endotelial (fig. 2).
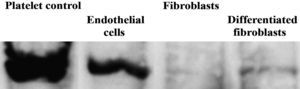
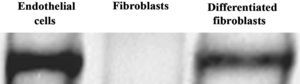
Análisis de inmunotransferencia del factor de von Willebrand (fvW). Las células endoteliales, fibroblastos y fibroblastos diferenciados hacia un tipo de células similar a la endotelial se analizaron usando inmunotransferencia con anticuerpos primarios dirigidos a fvW después de 10 días de cultivo en frascos de cultivo. En todos los tipos de células se analizó la misma cantidad de proteínas totales.
Platelet control: plaqueta (control);
Endothelial cells: células endoteliales;
Fibroblasts: fibroblastos;
Differentiated fibroblasts: fibroblastos diferenciados;
Las estructuras se sembraron con (1) células endoteliales (fig. 3A), (2) fibroblastos y fibroblastos de clonas de células individuales cultivados en FGM (fig. 3B), (3) fibroblastos diferenciados hacia un tipo de célula similar a la endotelial cultivados en EGM (fig. 3C), y (4) fibroblastos y fibroblastos de clonas de células individuales inducidos primero a diferenciarse hacia un tipo de célula similar a la endotelial después de ser sembrados en la estructura (fig. 3D). Para evaluar la organización y migración de las células cultivadas en las estructuras, las secciones transversales desparafinadas se tiñeron con DAPI y hematoxilina-eosina. Además, con inmunotransferencia e inmunotinción, usando anticuerpos primarios dirigidos a fvW, ve-cadherina, CD31, NOS3 y B2, se confirmó la diferenciación de los fibroblastos y fibroblastos de clonas de células individuales hacia un fenotipo similar a la célula endotelial.
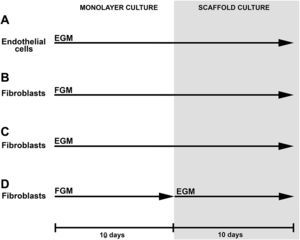
Esquema del estudio. Las células endoteliales cultivadas en EGM durante 10 días se sembraron en estructuras de gelatina y se cultivaron en EGM durante otros 10 días (A). Los fibroblastos dérmicos humanos y los fibroblastos de clonas de células individuales cultivados en FGM durante 10 días se sembraron en estructuras de gelatina y cultivaron en FGM durante otros 10 días (B). Los fibroblastos dérmicos humanos se indujeron a diferenciarse en un tipo de célula similar a la endotelial cultivando las células en EGM durante 10 días antes de sembrarlas en estructuras de gelatina. Las células se cultivaron en EGM en las estructuras durante otros 10 días (C). Los fibroblastos dérmicos humanos se cultivaron en FGM durante 10 días y después se sembraron en las estructuras de gelatina, y se indujo la diferenciación hacia un tipo de célula similar a la endotelial con un cambio del medio de cultivo FGM por EGM (D). 10 days: 10 días; EGM: medio de cultivo de células endoteliales; Endothelial cells: célula endoteliales; FGM: medio de crecimiento de fibroblastos; Fibroblasts: fibroblastos; MONOLAYER CULTURE: cultivo en monocapa; SCAFFOLD CULTURE: cultivo en estructuras.
La tinción DAPI reveló que todos los tipos de células fueron capaces de migrar a los poros de las estructuras. Se puso de relieve que los fibroblastos y fibroblastos de clonas de células individuales cultivados en FGM (antes y después de la siembra) migraron hasta un mayor grado que las células endoteliales o los fibroblastos inducidos a diferenciarse hacia un tipo de célula similar a la endotelial antes de la siembra. Sin embargo, la migración más prominente de células se detectó en los fibroblastos, que, después de ser sembrados en la estructura, primero se indujeron a diferenciarse hacia un tipo de célula similar a la endotelial.
Células endoteliales cultivadas en estructurasLas secciones transversales teñidas con hematoxilina-eosina y DAPI revelaron que las células endoteliales cultivadas durante 10 días en la estructura se organizaron como una monocapa confluente. Durante todos los experimentos, las células endoteliales manifestaron una inmunotinción positiva a fvW (fig. 4A), ve-cadherina (fig. 5A), CD31 (datos no mostrados), NOS3 (fig. 6A) y B2 (fig. 7A). Además, el análisis de inmunotransferencia confirmó nuestros resultados previos demostrando la presencia de NOS3 en estas células (fig. 8).
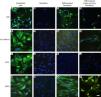
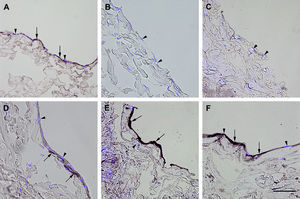
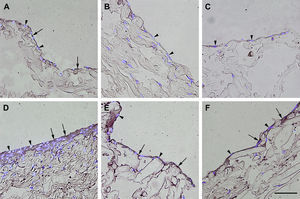
Inmunotinción con anticuerpos dirigidos a fvW. Imágenes representativas de las secciones transversales que muestran las células cultivadas en una estructura de gelatina durante 10 días, inmunoteñidas usando antisueros dirigidos a fvW. Su expresión se manifestó en las células endoteliales (A), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial en la estructura (D), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de su siembra en la estructura (E), y fibroblastos de clonas de células individuales diferenciados hacia un tipo de célula similar a la endotelial en la estructura (F). Obsérvese la presencia de inmunorreactividad, indicada por las flechas. No se detectó inmunorreactividad en los fibroblastos de control (B, C). La tinción DAPI se usó para visualizar los núcleos de las células (puntas de flecha). Barra de escala = 50 μm para todas las imágenes.
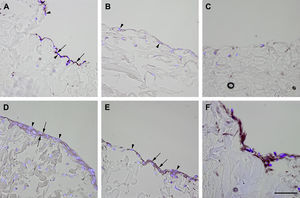
Inmunotinción con anticuerpos dirigidos hacia ve-cadherina. Imágenes representativas de las secciones transversales que muestran las células cultivadas en una estructura de gelatina durante 10 días, inmunoteñidas usando antisueros dirigidos a ve-cadherina. Su expresión se manifestó en las células endoteliales (A), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial en la estructura (D), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de su siembra en la estructura (E), y fibroblastos de clonas de células individuales diferenciados hacia un tipo de célula similar a la endotelial en la estructura (F). Obsérvese la presencia de inmunorreactividad, indicada por las flechas. No se detectó inmunorreactividad en los fibroblastos de control (B, C). La tinción DAPI se usó para visualizar los núcleos de las células (puntas de flecha). Barra de escala = 50 μm para todas las imágenes.
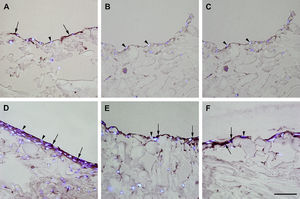
Inmunotinción con anticuerpos dirigidos hacia NOS3. Imágenes representativas de las secciones transversales que muestran las células cultivadas en una estructura de gelatina durante 10 días, inmunoteñidas usando anticuerpos dirigidos a NOS3. Su expresión se manifestó en las células endoteliales (A), los fibroblastos diferenciados hacia un tipo de célula similar a la endotelial en la estructura (D), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de su siembra en la estructura (E), y fibroblastos de clonas de células individuales diferenciados hacia un tipo de célula similar a la endotelial en la estructura (F). Obsérvese la presencia de inmunorreactividad indicada por las flechas. No se detectó inmunorreactividad en los fibroblastos de control (B, C). La tinción DAPI se usó para visualizar los núcleos de las células (puntas de flecha). Barra de escala = 50 μm para todas las imágenes.
Inmunotinción con anticuerpos dirigidos hacia el receptor B2 de la bradicinina. Imágenes representativas de las secciones transversales que muestran las células cultivadas en una estructura de gelatina durante 10 días, inmunoteñidas usando anticuerpos antirreceptor B2 de la bradicinina. Su expresión se manifestó en las células endoteliales (A), los fibroblastos diferenciados hacia un tipo de célula similar a la endotelial en la estructura (D), fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de su siembra en la estructura (E), y fibroblastos de clonas de células individuales diferenciados hacia un tipo de célula similar a la endotelial en la estructura (F). Obsérvese la presencia de inmunorreactividad indicada por las flechas. No se detectó inmunorreactividad en los fibroblastos de control (B, C). La tinción DAPI se usó para visualizar los núcleos de las células (puntas de flecha). Barra de escala = 50 μm para todas las imágenes.
Análisis de inmunotransferencia de NOS3. Las células endoteliales, fibroblastos y fibroblastos diferenciados hacia un tipo de célula similar a la endotelial se analizaron usando inmunotransferencia con anticuerpos primarios dirigidos a NOS3 después de 10 días de cultivo en frascos de cultivo. En todos los tipos de células se analizó la misma cantidad de proteínas totales. Differentiated fibroblasts: fibroblastos diferenciados; Endothelial cells: células endoteliales; Fibroblasts: fibroblastos.
Cuando se cultivaron en la estructura durante 10 días, los fibroblastos y fibroblastos de clonas de células individuales cultivados en FGM (antes y después de la siembra) formaron capas de células continuas, de un grosor de hasta tres capas. Utilizando el mismo protocolo experimental, las células no mostraron inmunotinción frente a fvW (figs. 4B y 4C), ve-cadherina (figs. 5B y 5C), CD31 (datos no mostrados), o NOS3 (figs. 6B y 6C). Sin embargo, los fibroblastos y fibroblastos de clonas de células individuales teñidos con antisuero frente al receptor B2 de la bradicinina mostraron una inmunotinción débil (figs. 7B y 7C). La inmunotransferencia confirmó nuestros resultados previos demostrando la ausencia de NOS3 en los fibroblastos dérmicos normales (fig. 8).
Fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de su siembra en las estructurasLos cortes transversales teñidos con hematoxilina-eosina y DAPI revelaron que los fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de la siembra crecieron en una monocapa confluente, similar a la observada en las células endoteliales. Las células mostraron una inmunotinción positiva utilizando un antisuero frente a fvW (fig. 4E). Sin embargo, no todas las células expresaron este marcador. Además, las células mostraron inmunotinción positiva frente a ve-cadherina (fig. 5E), NOS3 (fig. 6E) y B2 (fig. 7E) con un patrón de tinción similar al observado en las células endoteliales. No se observó inmunorreactividad cuando se usaron anticuerpos anti-CD31 (datos no mostrados). Además, el análisis de inmunotransferencia demostró la presencia de NOS3 en estas células (fig. 8).
Fibroblastos sembrados en estructuras y más tarde inducidos a diferenciarse hacia un tipo de célula similar a la endotelialEn intento de minimizar el tiempo de cultivo necesario para la endotelización de los injertos vasculares, se sembraron fibroblastos dérmicos humanos en las estructuras y, 24 h más tarde, se indujeron a diferenciarse hacia un tipo de célula similar a la endotelial. En comparación con los fibroblastos normales cultivados en FGM, estas células formaron una gruesa multicapa cuando se cultivaron en la estructura. No obstante, los fibroblastos de clonas de células individuales tratados del mismo modo no formaron una multicapa sino una monocapa confluente comparable con las células endoteliales y los fibroblastos diferenciados hacia un tipo de célula similar a la endotelial antes de ser sembrados. La inmunotinción de los fibroblastos y fibroblastos de clonas de células individuales sembrados en estructuras y más tarde inducidos a diferenciarse hacia un tipo de célula similar a la endotelial demostró resultados similares a los observados en los diferenciados antes de la siembra. Las células manifestaron inmunotinción positiva frente a fvW (figs. 4D y 4F), ve-cadherina (figs. 5D y 5F), NOS3 (figs. 6D y 6F) y B2 (figs. 7D y 7F). Los fibroblastos de clonas de células individuales manifestaron un alto grado de inmunotinción frente a ve-cadherina. Sin embargo, la intensidad de la tinción detectada en los fibroblastos diferenciados antes de la siembra aumentó y el patrón de tinción fue más similar al observado en las células endoteliales. No se detectó inmunorreactividad cuando se usaron anticuerpos anti-CD31 (datos no mostrados).
En ninguna de las muestras incubadas sin anticuerpos primarios se identificó una inmunotinción positiva (controles negativos, datos no mostrados).
DiscusiónLos resultados obtenidos en el presente estudio revelaron que los fibroblastos dérmicos humanos diferenciados hacia un tipo de célula similar a la endotelial formaron una monocapa confluente cuando se cultivaron en estructuras de gelatina, expresando las células los marcadores usados en general para caracterizar las células endoteliales maduras. Los fibroblastos sembrados en estructuras y más tarde inducidos a diferenciarse hacia un tipo de célula similar a la endotelial manifestaron una inmunotinción positiva aunque la organización de estas células mostró más similitudes con los fibroblastos dérmicos normales que con las células endoteliales.
Los primeros estudios han demostrado que el revestimiento de los injertos sintéticos con componentes naturales de la matriz extracelular, como el colágeno, fibronectina o gelatina, mejora la adhesión celular2,40-42. En el presente estudio, utilizamos una estructura de gelatina porcina, una matriz con diversas características atractivas para la ingeniería de tejidos. Por ejemplo, es biocompatible, biodegradable (en sustancias no tóxicas), se produce con facilidad y es de coste relativamente bajo. Los resultados obtenidos en el presente estudio mostraron que las células endoteliales, fibroblastos y fibroblastos diferenciados hacia un fenotipo similar a la célula endotelial se cultivan satisfactoriamente en esta estructura. La matriz se ha utilizado previamente en numerosos estudios in vitro e in vivo, demostrando buenos resultados con respecto a la viabilidad, migración y proliferación celular27-32. Los resultados del presente estudio respaldan estos hallazgos.
La presencia de células contaminantes en el cultivo primario de fibroblastos posiblemente podría producir un resultado falso positivo con respecto a la capacidad de diferenciación. Abordamos este problema de diferentes formas: en primer lugar, el FGM no favorece el crecimiento de las células endoteliales; en segundo lugar, rara vez se adhieren a las superficies no revestidas; en tercer lugar, el uso de fibroblastos clonados de células individuales reduce enormemente el riesgo de resultados falsos positivos como consecuencia de la contaminación; y, por último, antes de efectuar cualquier experimento, los fenotipos de los fibroblastos y los fibroblastos de clonas de células individuales se confirmaron mediante inmunohistoquímica indirecta utilizando anticuerpos dirigidos a moléculas específicas de las células endoteliales. Dado que los fibroblastos y los fibroblastos de clonas de células individuales no mostraron inmunorreactividad frente a estos marcadores, se eliminó el riesgo de la presencia de células contaminantes en los cultivos de células utilizados en estos experimentos.
Los datos del presente estudio respaldan la idea de que los fibroblastos dérmicos humanos diferenciados hacia células de tipo endotelial (antes de la siembra) muestran una similitud histológica con las células endoteliales maduras. Cuando se cultivaron en una estructura de gelatina in vitro las células formaron una monocapa confluente similar a la de las células endoteliales. Esto refuerza aún más la hipótesis de que los fibroblastos pueden ser inducidos hacia un fenotipo de célula endotelial. Por otra parte, los resultados del presente estudio revelaron que los fibroblastos diferenciados hacia células de tipo endotelial expresaron las moléculas de superficie observadas principalmente en las células endoteliales maduras. En general, la expresión de los diversos marcadores, indicativa de un fenotipo endotelial maduro, se usa como validación de la diferenciación endotelial.
Para disponer de un injerto vascular funcional es importante una capa de células endoteliales confluentes, anticoagulantes y antitrombogénicas. En los estudios previos se ha demostrado una correlación potente entre la producción de óxido nítrico (NO) y las tasas de permeabilidad de los injertos vasculares utilizados en la cirugía mediante bypass43. La NOS3 es una fuente clave de NO presente en el sistema cardiovascular44. La unión de la bradicinina al receptor B2 unido a la proteína G dará lugar a la activación de NOS3, induciendo la producción de NO44,45. Investigamos las posibilidades de la actividad de NO en nuestras células similares a las endoteliales utilizando inmunotransferencia e inmunohistoquímica indirecta con anticuerpos dirigidos hacia el receptor B2 de la bradicinina y NOS3. Los resultados del presente estudio mostraron que los fibroblastos diferenciados hacia células de tipo endotelial pueden servir como capa de célula funcional para sustituir a las células endoteliales. Sin embargo, antes de que estas células puedan usarse en aplicaciones clínicas, se requieren estudios adicionales que investiguen las propiedades no trombogénicas y hemostáticas de la capa de células.
Una desventaja de la mayoría de los injertos vasculares producidos por ingeniería tisular es el tiempo necesario entre el aislamiento de la célula y la implantación del injerto. En un intento de minimizar el tiempo de cultivo necesario, investigamos la posibilidad de sembrar fibroblastos dérmicos normales en una estructura y, más tarde, iniciar la diferenciación con la inducción hacia un fenotipo similar a la célula endotelial. En realidad, los resultados del presente estudio revelaron que los fibroblastos diferenciados hacia este tipo de célula en la estructura expresaban fvW, ve-cadherina, NOS3 y B2. Sin embargo, la organización de las células mostró más similitudes con los fibroblastos dérmicos normales que con las células endoteliales, con una multicapa de células que crecía en la superficie de la estructura. Esto podría explicarse por el hecho de que los fibroblastos sembrados primero y, más tarde, diferenciados ya han formado estructuras con un patrón de crecimiento “similar al fibroblasto” antes del cambio de su fenotipo. El patrón de crecimiento de los fibroblastos clonados de células individuales, diferenciados en la estructura, que manifestaron una morfología de monocapa, es de algún modo contradictorio. Además, las clonas de células individuales mostraron un grado sorprendentemente mayor de tinción frente a ve-cadherina. Un mayor número de conocimientos sobre los factores de inducción que dan lugar a la diferenciación endotelial de los fibroblastos contribuirá a una diferenciación más eficiente. Sin embargo, con la información disponible hoy día, parece ser que, para obtener un resultado óptimo, las células tienen que diferenciarse antes de su siembra en estructuras.
ConclusionesCon la corroboración de los resultados obtenidos en el presente estudio, concluimos que los fibroblastos diferenciados hacia un tipo de célula endotelial tienen la capacidad de endotelizar los injertos vasculares in vitro. Cuando se cultivan en estructuras de gelatina, los fibroblastos diferenciados hacia un tipo de célula endotelial antes de su siembra crecieron como una monocapa manifestando una similitud histológica con las células endoteliales maduras. Además, estas células mostraron una inmunotinción positiva frente a fvW, ve-cadherina, NOS3 y B2. Por otra parte, el análisis de inmunotransferencia confirmó los resultados observados mediante inmunohistoquímica demostrando la presencia de NOS3 en estas células. Los fibroblastos sembrados en estructuras y más tarde inducidos a diferenciarse hacia un tipo de célula similar a la endotelial se organizaron como una multicapa gruesa cuando se cultivaron en estructuras. Sin embargo, estas células también manifestaron la expresión de moléculas usadas en general para caracterizar las células endoteliales. Los resultados presentados en este estudio podrían tener una importante influencia en la ingeniería de tejidos vasculares. La capacidad de usar los fibroblastos dérmicos humanos como fuente de células facilitaría espectacularmente el uso de los métodos de ingeniería de tejidos vasculares autólogos, no sólo en la endotelización de injertos sino también en la producción de vasos sanguíneos completos y la vascularización de los constructos fabricados.
Deseamos expresar nuestro agradecimiento a A. Lönn y K. Briheim por su ayuda técnica. También deseamos dar las gracias al Professor C. Dabrosin y a A. Abrahamsson por su ayuda técnica concerniente al análisis de inmunotransferencia. Esta investigación se financió con becas de Materials in Medicine y el condado de Linköping, Suecia.