Revisiones recientes de las complicaciones específicas de los dispositivos de neuroprotección han analizado las dificultades técnicas durante la colocación, así como sus complicaciones durante la intervención y a los 30 días. Sin embargo, apenas existe información sobre las complicaciones relacionadas con la oclusión del filtro durante la colocación de stent carotídeo. Se llevó a cabo una revisión retrospectiva de los pacientes sometidos a intervenciones de stent en la arteria carótida utilizando una variedad de dispositivos neuroprotectores entre 2003 y 2007. Se examinaron las bases de datos prospectivas de dos centros en busca de la incidencia y el tratamiento de las oclusiones del filtro durante las intervenciones así como los episodios neurológicos adversos (intraoperatorios y a los 30 días) asociados con la oclusión del filtro. Se realizaron 283 colocaciones de stent en arteria carótida en 256 pacientes (163 hombres, 93 mujeres): 177 lesiones (62,5%) eran asintomáticas y 106 sintomáticas. Se produjeron episodios neurológicos adversos en 6 pacientes (2,1%); tres de ellos se resolvieron por completo a las 72 h. Se utilizó neuroprotección en el 95% de los pacientes, y se utilizaron filtros en 221 intervenciones de stent: Boston Scientific Filter Wire (n = 81), Guidant Accunet (n = 100), Angioguard (n = 17), y Abbot Emboshield (n = 23). Se produjeron oclusiones del filtro en 11 pacientes (4,9%) en los que se utilizó esta forma de neuroprotección: Angioguard (n = 5), Accunet (n = 2), Emboshield (n = 2), y EPI Filter Wire (n = 2). Dos de los 11 pacientes con oclusiones del filtro sufrieron un episodio neurológico. No existió ninguna correlación entre la oclusión del filtro y el sexo, los síntomas, el tipo de stent, o de sistema de neuroprotección (p > 0,05). La oclusión del filtro se trató mediante la aspiración por catéter export en 7 pacientes y con la retirada rápida del filtro en 5 pacientes. La oclusión del filtro es un suceso poco frecuente que no parece ser específico del tipo de sistema utilizado y que puede tratarse de forma satisfactoria mediante aspiración por catéter o mediante la retirada del mismo. La mayoría de los pacientes con oclusiones del sistema de neuroprotección no sufren episodios ateroembólicos como resultado de esta complicación.
La angioplastia con stent de la arteria carótida (SAC) ha alcanzado gran popularidad, debido en parte a los avances tecnológicos en este procedimiento. Los diseños de stents cónicos, el sistema de colocación de bajo perfil y el desarrollo de dispositivos de protección embólica (DPE) han contribuido a la evolución de la SAC al permitir una colocación y expansión fáciles y seguras del stent, y al mejorar las técnicas de neuroprotección. La preocupación creciente por el potencial de los ateroémbolos durante la SAC ha conducido al desarrollo y la expansión del uso de DPE1. De hecho, los ensayos prospectivos sugieren que el uso de DPE está asociado con una tasa menor de complicaciones operatorias2. En la actualidad existen 3 tipos de DPE en uso: filtros de malla, oclusión mediante balón proximal con reversión del flujo, y oclusión con balón distal.
A pesar de la ausencia de datos con prueba de nivel 1, existen informes recientes, incluido un metaanálisis a gran escala, que sugieren que los DPE están asociados con una reducción de los episodios adversos perioperatorios3. Además, no parecen existir diferencias en el resultado de la colocación de stent carotídeo con ninguno de los 3 DPE específicos comercializados2,4. Dejando de lado todos los datos de los DPE específicos, existen pocas publicaciones en las que se analice la relevancia de la oclusión de los filtros durante la SAC. Una revisión de 453 intervenciones carotídeas realizada por Casserly et al5 mostró una incidencia del 9,3% (n = 42) de fenómenos de “flujo lento”. Dado que la mayoría de estos episodios se produjeron en la angioplastia poststent, los autores propusieron que la microembolización contribuye al flujo lento y al ictus asociado.
Nuestro estudio examina una base de datos prospectiva de pacientes que fueron sometidos a SAC y la incidencia y resultados de las oclusiones relacionadas con el filtro.
MétodosObtención de datosLos datos para este análisis se obtuvieron de una base de datos institucional de SAC compilada por dos centros participantes. Los datos se obtuvieron de forma prospectiva a partir de 283 stents carotídeos, incluidas las reintervenciones, realizados en 256 pacientes en los dos centros entre los años 2003 y 2007 en la New York University School of Medicine y la Mt. Sinai University School of Medicine.
Los datos de los pacientes incluyeron la demografía, los síntomas neurológicos preoperatorios y el resultado postoperatorio. Los datos de la intervención consistieron en el lado intervenido, el porcentaje de estenosis, la presencia de anatomía bovina, el tipo de stent y de dispositivo de protección cerebral, la presencia de oclusión del filtro y su tratamiento.
Procedimiento operatorioEn todos los pacientes se realizó un examen con eco-Doppler preoperatorio y una angiografía por tomografía computerizada o por resonancia magnética, para identificar las lesiones susceptibles de tratamiento. Se realizó la SAC obteniendo el abordaje a la arteria carótida común con un introductor 6F o 7F y colocando un DPE según el manual de uso. La decisión de realizar una angioplastia pre y poststent dependió del operador. La predilatación se realizó, en general, solamente si se consideró que la estenosis era demasiado severa para poder colocar el stent con seguridad. En general, la postdilatación se realizó en estenosis residuales > 30%. La elección del DPE también dependió del operador. Se utilizó protección con filtro solamente si la arteria carótida interna distal dispuso de una zona adecuada para su colocación (es decir, porción recta > 3-4 cm).
Se administró tratamiento antiagregante plaquetario con Clopidogrel (Plavix) a todos los pacientes durante el preoperatorio y durante un mínimo de 30 días tras el procedimiento. Todos los pacientes fueron sometidos a evaluaciones neurológicas preoperatorias, perioperatorias, y a los 30 días, bien por parte de neurólogos (si participaban en algún ensayo clínico), bien por los médicos responsables. El stent carotídeo y el dispositivo de protección cerebral utilizados fueron elegidos por el cirujano y se sometieron a los requerimientos del ensayo clínico.
Criterios de valoraciónLas oclusiones del filtro se identificaron como patrones de flujo lento o de obstrucción completa y se analizaron en función del tipo de filtro. El tratamiento de las oclusiones se realizó mediante aspiración por catéter o mediante la rápida retirada del filtro. Se examinaron los filtros extraídos para la presencia de coágulos y/o residuos. Los sucesos adversos se definieron como fallecimiento, crisis isquémica transitoria (CIT, déficit neurológico con una duración < 24 h), e ictus (déficit neurológico con una duración > 24 h). Los episodios se identificaron de forma cronológica como intraoperatorios o a los 30 días (ocurridos durante la intervención y hasta 30 días después).
EstadísticasLos análisis estadísticos se realizaron utilizando el programa SPSS (SPSS, Inc., Chicago, IL). Se consideró que p < 0,05 fue estadísticamente significativo. El análisis primario comparó la incidencia de oclusión del filtro con respecto al sexo, presencia de síntomas preoperatorios, tipo de stent, o tipo de filtro. El análisis secundario comparó las tasas de sucesos adversos entre pacientes con y sin oclusión intraoperatoria del filtro. La comparación de las tasas de oclusión del filtro con el análisis primario se logró mediante una regresión logística. En el análisis secundario, la comparación de las tasas de sucesos entre los diferentes grupos se basó en un test χ2 bilateral. No se calcularon los cocientes de riesgo debido al tamaño reducido de la muestra.
ResultadosSe realizaron 283 SAC en 256 pacientes (163 hombres, 93 mujeres) desde los años 2003 hasta 2007. La media de edad fue de 72,4 (± 9) años, y 177 (62,5%) de las intervenciones se realizaron por estenosis asintomática. Se produjeron episodios neurológicos adversos en 6 pacientes en total (2,1%). Tres fueron permanentes y 3 se resolvieron a las 72 h. Se utilizó neuroprotección en el 95% de los pacientes: filtros (n = 221), balón distal PercuSurg GuardWire (n = 49), y reversión del flujo (n = 4). Los filtros utilizados con mayor frecuencia fueron: Accunet (n = 100, 45%), EPI FilterWire (n = 81, 37%), Emboshield (n = 23, 10%), y Angioguard (n = 17, 8%). Los stents utilizados fueron: Acculink (n = 132, 46%), Wall stent (n = 67, 24%), Xact (n = 28, 10%), Precise (n = 24, 8%), y Nexstent (n = 20, 8%) (tabla I).
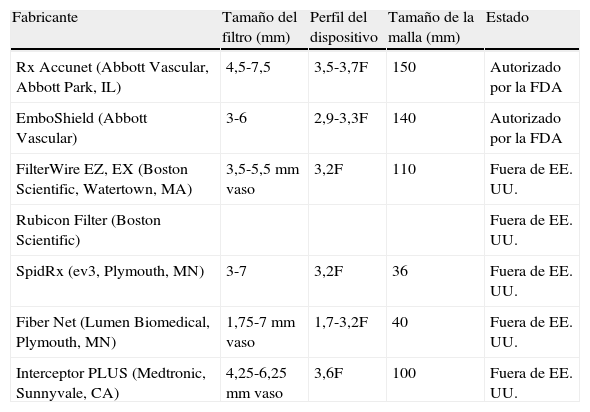
DPE comercializados en la actualidad: tipos de filtros8
| Fabricante | Tamaño del filtro (mm) | Perfil del dispositivo | Tamaño de la malla (mm) | Estado |
| Rx Accunet (Abbott Vascular, Abbott Park, IL) | 4,5-7,5 | 3,5-3,7F | 150 | Autorizado por la FDA |
| EmboShield (Abbott Vascular) | 3-6 | 2,9-3,3F | 140 | Autorizado por la FDA |
| FilterWire EZ, EX (Boston Scientific, Watertown, MA) | 3,5-5,5 mm vaso | 3,2F | 110 | Fuera de EE. UU. |
| Rubicon Filter (Boston Scientific) | Fuera de EE. UU. | |||
| SpidRx (ev3, Plymouth, MN) | 3-7 | 3,2F | 36 | Fuera de EE. UU. |
| Fiber Net (Lumen Biomedical, Plymouth, MN) | 1,75-7 mm vaso | 1,7-3,2F | 40 | Fuera de EE. UU. |
| Interceptor PLUS (Medtronic, Sunnyvale, CA) | 4,25-6,25 mm vaso | 3,6F | 100 | Fuera de EE. UU. |
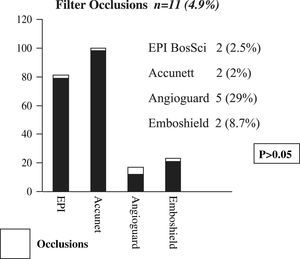
Las oclusiones del filtro se produjeron durante 11 colocaciones de stent carotídeo al utilizar un sistema DPE (4,9%). Ésta constituye la cohorte del estudio. La mayoría de las oclusiones se produjeron al utilizar el filtro Angioguard (n = 5, 46%). No se observó ninguna correlación estadística entre el tipo de filtro, el tipo de stent, el sexo, la presencia de síntomas, y la oclusión (p > 0,05) (fig. 1). Entre los once pacientes con oclusión de filtro, dos de ellos (1 Angioguard, 1 Accunet) sufrieron un episodio neurológico adverso (18%, p = 0,2). Ocho de las 11 oclusiones del filtro (72%) se produjeron tras la angioplastia poststent. Las 3 restantes se produjeron tras la expansión del mismo. El último grupo de pacientes no fue sometido a angioplastia poststent sino a la retirada rápida del filtro.
Un paciente presentó un déficit neurológico permanente cuando el filtro se ocluyó tras la angioplastia poststent por una estenosis residual del 30%. Se observó enlentecimiento del flujo y posterior cese del mismo. El filtro se retiró rápidamente sin intentar la aspiración. Un segundo paciente que presentó una oclusión del filtro con el cese completo del flujo fue sometido a una aspiración por catéter. Éste presentó un déficit neurológico transitorio, que se resolvió en 24 h. La oclusión del filtro no estuvo asociada con el aumento del riesgo de episodios neurológicos (p = 0,2).
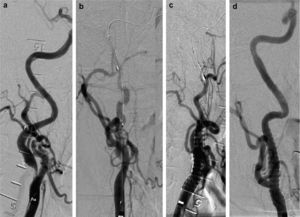
Tratamiento de la oclusión del filtroLas oclusiones del filtro se trataron mediante aspiración con catéter export (n = 6) o la rápida retirada del filtro sin aspiración (n = 5). El aspirado se irrigó en un filtro PercuSurg para su inspección. La decisión en cuanto al tratamiento de la oclusión del filtro se dejó en manos del médico responsable. La figura 2 muestra un ejemplo de oclusión del filtro. Solamente 2 filtros ocluidos presentaron residuos visibles.
DiscusiónLos primeros críticos de la SAC alertaron de que al atravesar la placa carotídea con guías, catéteres, balones y stents se produciría inevitablemente una embolización distal y, por tanto, sucesos neurológicos adversos prohibitivos. Ciertamente, utilizando modelos de flujo en un modelo experimental con placas carotídeas ex vivo tratadas con angioplastia y stent, Ohki et al6 demostraron que todas las muestras producían émbolos significativos. Al parecer, la morfología de placa ecolucente (heterogénea) así como las estenosis de alto grado conferían un mayor riesgo de embolia. Los estudios Doppler transcraneales han confirmado el fenómeno de embolización cerebral difusa durante una SAC. Jordan et al7 examinaron una serie de 105 pacientes (115 bifurcaciones) con Doppler transcraneal (DTC) durante la endarterectomía carotídea (n = 75) así como durante las intervenciones de SAC sin protección (n = 40). Observaron que el número de señales transitorias de alta intensidad compatibles con émbolos aumentó ocho veces durante la SAC en comparación con la endarterectomía. Éste y otros estudios apoyaron la implementación de los DPE consistentes en un filtro de la carótida interna durante la oclusión mediante balón (con o sin reversión del flujo).
Un metaanálisis realizado por Kastrup et al8 incluyó un total de 2.537 intervenciones de SAC realizadas sin DPE y 896 intervenciones que sí utilizaron dispositivos de protección cerebral. La tasa combinada ictus/fallecimiento a los 30 días fue significativamente menor en los pacientes en los que se utilizaron DPE (1,8 frente a 5,5%, p < 0,001). Si bien no existen ensayos aleatorizados que comparen la SAC con y sin neuroprotección, su uso se ha convertido en el cuidado estándar al realizar intervenciones de SAC en EE. UU. Realmente, en un corto espacio de tiempo se ha comercializado una amplia variedad de DPE con balones de oclusión distal, filtros, y sistemas de reversión del flujo; cada uno con sus propias ventajas e inconvenientes9.
Los filtros de malla quizá sean uno de los 3 tipos de DPE usados más habitualmente. En la actualidad se comercializan 8 filtros (tabla I). A diferencia de los DPE de oclusión distal con balón (PercuSurge Guard Wire, TriActive Proguard, y MoMa), los filtros de malla permiten un flujo anterógrado continuo hacia el cerebro durante toda la intervención. Puede realizarse la angiografía con el filtro protector colocado en su lugar. Además, los pacientes con un círculo de Willis incompleto, que de otro modo no tolerarían la interrupción del flujo, pueden tratarse con un filtro DPE. Entre los inconvenientes del filtro DPE destacan un elevado perfil, el riesgo de atravesar la lesión sin protección en primer lugar, el espasmo y/o la disección, su aposición incompleta a la pared, y la oclusión del filtro debido a trombosis o por detritus.
Existen algunos datos que comparan los resultados al utilizar un tipo de DPE o stent con otro. Rubartelli et al10 compararon 31 pacientes sometidos a DTC durante una SAC con oclusión mediante balón distal (Guard-Wire) o filtro DPE (FilterWire EX) y observaron que la cantidad total de señales microembólicas durante la intervención fue más alta cuando se utilizó el filtro (183,0 ± 42,1 frente a 31,7 ± 12,0, p < 0,0001). En un estudio retrospectivo a gran escala realizado por Iyer et al2 se revisaron 3.160 procedimientos de SAC que utilizaron 9 DPE y no observaron diferencias significativas en los sucesos adversos de la intervención con ninguno de los DPE cuando se compararon con el filtro de malla más utilizado. Además, no existieron diferencias significativas en el riesgo entre los filtros excéntricos y concéntricos. Otros autores, sin embargo, han observado que los filtros concéntricos pueden estar asociados con un mayor riesgo de sucesos neurológicos adversos a los 30 días11. En un estudio realizado sobre 701 intervenciones SAC consecutivas, Hart et al11 observaron que el subgrupo sintomático (n = 304) con un diseño de stent de celda abierta y el uso de filtros concéntricos DPE presentó odds ratios para ictus/fallecimiento/CIT a los 30 días de 4,1 (intervalo de confianza [IC] del 95% 1,4-12, p = 0,0136) y 3,3 (IC 95% 1,016-10, p = 0,0525), respectivamente. Si bien la influencia relativa del tipo de DPE sobre el resultado de la SAC sigue sin estar clara, parece que la propia oclusión del filtro confiere un aumento del riesgo de complicaciones.
Las oclusiones del filtro pueden estar relacionadas con numerosos factores exclusivos del diseño del filtro y con otras variables específicas del paciente o específicas de la anatomía. Un estudio llevado a cabo por Powell et al4 examinó las dificultades técnicas encontradas durante las intervenciones de SAC y destacó que se produjeron oclusiones del filtro en 2 de los 42 pacientes en los que se utilizó un filtro DPE (4,7%). En nuestro estudio, la incidencia de oclusión del filtro fue similarmente baja, ocurriendo solamente en 11 intervenciones (4,5%). Si bien la mayoría se produjeron al utilizar el filtro Angioguard (n = 5), no existió una correlación estadísticamente significativa entre el tipo de filtro y la oclusión. Es más, la oclusión no estuvo asociada con un aumento del riesgo de sucesos neurológicos en nuestra serie (p = 0,2). Otros autores han informado que la oclusión del filtro está asociada con un aumento significativo de fallecimiento e ictus a los 30 días. En su serie de 42 pacientes con flujo lento durante las intervenciones de stent carotídeo, Casserly et al5 observaron una incidencia de ictus del 9,5% en pacientes con un flujo lento frente a un 1,7% en los pacientes con un flujo normal (p = 0,03). Los factores predictivos de flujo lento fueron: antecedentes recientes (6 meses) de ictus o CIT, aumento del diámetro del stent, y aumento de la edad del paciente.
No logramos identificar factores predictivos de la oclusión del filtro en nuestro estudio. Es más, el mecanismo de obstrucción no está claro. Ocho de 11 oclusiones (72%) se produjeron tras la angioplastia poststent, lo que concuerda con la teoría de que la placa rota puede “fluir” hacia la luz a través de los intersticios del stent tras la angioplastia. Si bien la mayoría de los filtros ocluidos no tenían una gran carga de residuos/trombos, las técnicas actuales para visualizar los desechos son imperfectas y es probable que el material microembólico haya contribuido a la oclusión.
No parece que los pacientes en los que se produjo la oclusión del filtro tuviesen una arteria carótida interna distal tortuosa ni que el tamaño de los filtros fuese menor en relación con el diámetro del vaso en cuestión. El sexo y la sintomatología no fueron predictivos de oclusión del filtro. Además, a pesar de que los estados de hipercoagulabilidad intrínsecos no se evaluaron en cada paciente, el tiempo de coagulación activada se mantuvo en el rango terapéutico de forma constante en todas las intervenciones. Por último, la angiografía de comprobación no logró demostrar ningún indicio de espasmo y/o disección tras la retirada del filtro en la cohorte ocluida. De forma alternativa, el tiempo de intervención puede desempeñar un papel en la oclusión del filtro. Desgraciadamente, los registros de las intervenciones en nuestros centros no contienen estos datos. De forma intuitiva, cuanto más tiempo permanece colocado el filtro y las guías atraviesan la lesión, mayor es el riesgo de formación de trombos así como de espasmo.
El tratamiento de la oclusión del filtro y otras complicaciones relacionadas con los DPE durante la SAC no aparece especialmente analizado en la literatura. Powell et al4 revisaron 141 intervenciones de SAC, realizadas mediante oclusión con balón o filtro DPE, y observaron que las dificultades técnicas relacionadas con los DPE se produjeron en el 15% del grupo tratado con balón y en el 31% del grupo tratado con filtro (p < 0,05). Como cabía esperar, el balón tuvo una incidencia del 10% en el compromiso neurológico durante la oclusión frente a una incidencia del 0% en el grupo tratado con filtro (p = 0,002), si bien en el grupo tratado no se pudo atravesar la lesión antes de la predilatación con mayor frecuencia (12%) que en el grupo tratado con balón (0%) (p = 0,001). El espasmo que requirió tratamiento farmacológico se produjo con más frecuencia en el grupo tratado con neuroprotección (12%). Dos oclusiones del filtro en su estudio fueron tratadas mediante aspiración por catéter y 100 mg de nitroglicerina administrados a través del introductor sin secuelas adversas. En nuestro estudio, 11 oclusiones del filtro fueron tratadas con aspiración del cesto del filtro mediante un catéter export (PercuSurg Export Catheter, n = 6) o mediante la rápida retirada del mismo (n = 5). Dos pacientes sufrieron episodios neurológicos adversos (uno transitorio, uno temporal) tras la oclusión del filtro. En uno de estos pacientes no se realizó la aspiración por catéter antes de retirar el filtro.
Si bien la estrategia de tratamiento (retirada rápida del filtro frente a aspiración por catéter) no estuvo asociada con un aumento del riesgo de episodios adversos en este estudio, debe destacarse el tamaño reducido de la muestra de nuestra serie, dado que nos impide realizar recomendaciones estrictas en relación con el tratamiento de la oclusión del filtro. Los pacientes que presentaron una obstrucción completa del flujo presentan mayor riesgo, ya que es imposible determinar la carga de coágulos, lo que hace que la sola retirada del filtro no sea segura. En realidad, uno de 2 pacientes que sufrieron un ictus presentó un cese completo del flujo y, en ambos, se retiró el filtro sin realizar la aspiración por catéter. Si bien parecería que la rápida retirada del filtro es segura y satisfactoria en pacientes con un flujo lento en ausencia de obstrucción completa del filtro, el flujo enlentecido puede ser un precursor de la oclusión completa. Así pues, puede ser más prudente aspirar todos los filtros en casos de flujo lento y/o ausente, siempre que esto pueda realizarse de forma expeditiva.
En resumen, si bien la SAC se ha convertido en una alternativa viable a la EAC en un grupo seleccionado de pacientes, el riesgo de embolización, a pesar de la neuroprotección, sigue siendo una preocupación importante. La oclusión del filtro es un suceso poco frecuente, que no parece ser específico del tipo de dispositivo y puede tratarse con éxito mediante la aspiración por catéter o la retirada del sistema en pacientes seleccionados. La mayoría de los pacientes con oclusión del filtro no sufren episodios ateroembólicos como consecuencia de esta complicación. Son necesarios estudios de mayor tamaño que comparen el tipo de filtro y su diseño y que evalúen las estrategias terapéuticas para hacer frente a su eventual oclusión.