El objetivo del presente estudio fue determinar el resultado del abordaje para hemodiálisis usando un segmento de vena femoral (VF) como transposición de VF en muslo o translocación de VF a extremidad superior. Esta investigación se basa en la revisión retrospectiva de todos los pacientes con insuficiencia renal terminal (IRT) en los que se creó un acceso vascular con VF en el University of Colorado Health Sciences Center desde diciembre de 2004 a mayo de 2007. Se registraron la demografía, número de procedimientos previos, técnica de creación de abordaje para diálisis usando VF, complicaciones perioperatorias, seguimiento medio, procedimientos secundarios relacionados con el abordaje y función del mismo. Las complicaciones se subdividieron en las del lugar de obtención de VF y las relacionadas con isquemia. Durante el período del estudio se creó un abordaje con VF en 19 pacientes: 10 se sometieron a transposiciones de VF en muslo y nueve se sometieron a translocaciones de VF a extremidad superior. El promedio de abordajes previos fue de dos. La estancia hospitalaria media fue de 3 días y no se produjeron muertes perioperatorias. En ocho pacientes se produjeron complicaciones del lugar de obtención de VF: seis linfoceles, una infección de la FAV que requirió ligadura y un síndrome compartimental que requirió fasciotomía. En tres pacientes (16%) se produjeron complicaciones isquémicas: una requirió la ligadura de la FAV y dos requirieron ligadura intercalada con revascularización distal. Con un seguimiento medio de 6 meses (límites 23 días a 3 años), el 79% de los pacientes presentaba un acceso vascular funcionante. Cuatro abordajes con VF requirieron uno o más procedimientos endovasculares para mantener la función a los 12 meses. El acceso vascular con un segmento de VF presenta buenas tasas de permeable en el seguimiento intermedio pero se asocia a una morbilidad significativa. Este tipo de abordaje debe reservarse para pacientes en bajo riesgo en los que se han agotado otras opciones de injerto autólogo.
El United States Renal Data System documentó que, en 2004, casi 350.000 pacientes eran sometidos a hemodiálisis1 (HS). Durante los últimos años, la incidencia de insuficiencia renal terminal (IRT) ha aumentado a un ritmo constante. Las recomendaciones actuales de la Dialysis Outcomes Quality Initiative son que, inicialmente, el acceso vascular para HD se construya en la extremidad superior lo más distal que sea posible en forma de una fístula arteriovenosa (FAV). Más tarde, si la construcción de ésta no es posible, sólo deben usarse injertos arteriovenosos protésicos (IAV). Por último, es preciso evitar los catéteres venosos centrales para la HD y sólo se usarán cuando se hayan agotado otras opciones2.
Múltiples factores contribuyen al agotamiento de los lugares de abordaje. La hiperplasia intimal, el uso prolongado de catéteres venosos centrales y los catéteres centrales insertados de forma periférica, las infecciones y los electrodos de los marcapasos sólo son algunos de los factores que afectan a la permeabilidad y eficacia de las FAV. La vena femoral (VF) ha demostrado su utilidad en una diversidad de áreas anatómicas ya que favorece un amplio conducto autólogo incluido el injerto aórtico en el contexto de una infección3 y la creación de FAV4-12. El presente estudio describe la experiencia de un centro en la construcción de una transposición de VF en muslo y una translocación de VF a extremidad superior como acceso vascular para la HD.
MétodosEste estudio, aprobado por el comité ético del centro, es una revisión retrospectiva de los pacientes con IRT que, entre diciembre de 2004 y mayo de 2007, se sometieron a una transposición de VF en muslo o a una translocación de VF a extremidad superior en el University of Colorado Health Sciences Center (University of Colorado Hospital y Denver Veterans Affairs Medical Center).
En los pacientes sometidos a translocaciones de VF a extremidad superior, como criterios de inclusión se requirió el agotamiento de otros lugares de acceso vascular o la ausencia de una vena apropiada autóloga primaria para FAV y un índice tobillo-brazo (ITB) igual o superior a 0,8, en la extremidad inferior donde se obtuvo el segmento de VF. La extremidad superior se evaluó con una exploración física en la que se prestó atención al examen del pulso, prueba de Allen y presiones arteriales humerales bilaterales.
En los pacientes sometidos a transposiciones de VF en muslo, como criterios de inclusión se requirió el agotamiento de otros lugares de acceso vascular, una circulación normal en la extremidad inferior (pulsos palpables o un ITB=1,0), o una amputación mayor previa en la misma extremidad de construcción de la FAV. Por último, en todos los pacientes se requirió que el diámetro más pequeño de la VF fuera, como mínimo, de 6mm, determinado mediante ecografía.
Se obtuvieron y evaluaron los datos de demografía general, número de procedimientos previos de acceso vascular, tipo de procedimiento de acceso vascular con VF para hemodiálisis, complicaciones periprocedimiento, tiempo medio de seguimiento, procedimientos secundarios relacionados con el abordaje y función del abordaje en diversos intervalos de tiempo. Un investigador (C. A. R.) introdujo todos los parámetros en una base de datos diseñada al efecto.
El análisis de las variables fue tan sólo descriptivo, debido al número limitado de pacientes, y se agrupó por tipo de procedimiento (transposición de VF en muslo o translocación de VF a extremidad superior). Las variables analizadas incluyeron el número de pacientes con fístulas funcionales, tasas de permeabilidad primaria y asistida primaria, según lo definido por los Joint Councils en los informes de consenso13. Los procedimientos usados para el rescate o para revisar las FAV incluyeron trombólisis y angioplastia transluminal percutánea (ATP).
Las complicaciones se agruparon por tipo de procedimiento y se tipificaron en función del lugar de obtención de la VF y la presencia de complicaciones isquémicas. Las primeras se definieron como infección de la herida o linfocele, con o sin dehiscencia de la herida. Las complicaciones isquémicas se definieron como dolor isquémico, ulceración o gangrena relacionados con el procedimiento. Las intervenciones quirúrgicas necesarias para todas las complicaciones incluyeron la revascularización distal y la ligadura intercalada (RDLI), ligadura completa de la FAV, fasciotomía, abordaje y drenaje de las acumulaciones de líquido y cierre de la herida con la ayuda de un sistema de vacío.
La diabetes mellitus (DM) se definió como el uso de fármacos hipoglucemiantes (insulina o antidiabéticos orales) o diabetes controlada con dieta, documentado mediante revisión de la historia clínica. La IRT se definió como el fracaso renal que requería diálisis. La hipertensión arterial (HTA) se definió como un valor de presión arterial>140/90 mmHg o normotensión mediante tratamiento con fármacos antihipertensivos.
Descripción de los procedimientosPara evaluar el calibre, anatomía y permeabilidad del conducto de VF se utilizó un mapeo ecográfico preoperatorio de la vena. Para la FAV de translocación de VF a extremidad, se utilizó anestesia general y para la FAV con transposición de VF en muslo, anestesia general o un bloqueo regional.
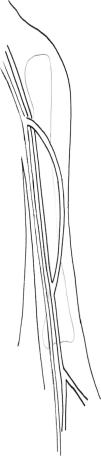
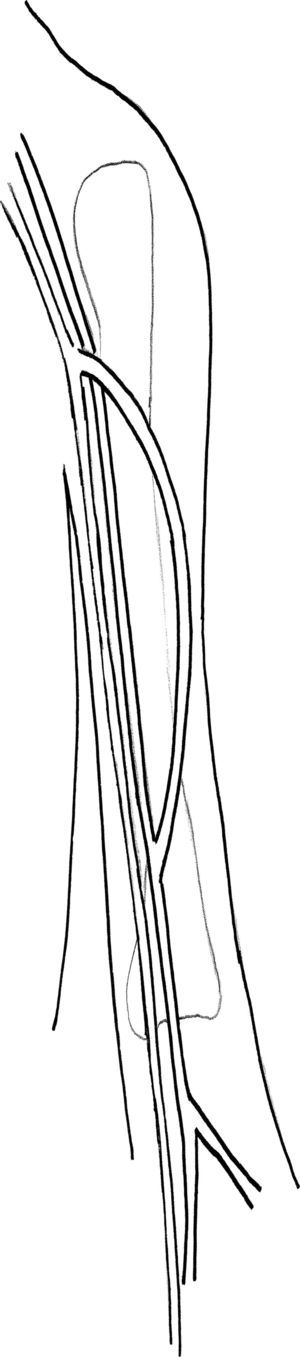
Obtención del segmento de VFSe efectúa un abordaje a lo largo del curso del músculo sartorio en dirección latero-medial dirigida hacia la rodilla, a fin de exponer la fascia profunda del muslo. Se penetra en ésta y se retrae lateralmente el músculo sartorio para exponer la VF en el tercio superior de muslo y, acto seguido, en dirección medial en el tercio más distal del muslo. En general, la VF tiene una localización medial y profunda a la arteria femoral superficial (AFS). La longitud de la VF se optimiza mediante una disección distal desde la confluencia de la vena profunda hasta la confluencia proximal de la vena poplítea. Se efectúa la ligadura de numerosas ramas venosas con una sutura no absorbible a lo largo del trayecto de la VF. Las ramas más largas pueden suturarse con una sutura continua de polipropileno para evitar la estenosis del conducto. La disección continúa en dirección distal a través del hiato del aductor. Durante la disección de la VF, se requiere precaución para preservar tanto el músculo sartorio como el nervio femoral. La vena poplítea se sutura con seda. Si se efectúa una translocación de VF a extremidad superior, se sutura la confluencia vena femoral común-vena femoral profunda con polipropileno en dos capas tratando de evitar una estenosis de la vena profunda. En nuestro centro invertimos la vena para la translocación y no invertimos o resecamos las válvulas venosas como han descrito otros autores14.
La extensa herida de la obtención del segmento venosa se cierra con múltiples capas de una sutura absorbible interrumpida. Después de diversas estrategias insatisfactorias para tratar las extravasaciones linfáticas en el lugar de obtención de la VF, nuestra estrategia actual es colocar dos grandes drenajes de Jackson Pratt (JP) en el lecho a través de la salida distal de las heridas y dejarlos durante varias semanas postoperatorias hasta que el drenaje linfático de cada uno ha disminuido hasta<30cm3/día. Debido a la naturaleza prolongada de los cuidados postoperatorios de la herida, utilizamos suturas cutáneas interrumpidas de nailon que pueden dejarse durante períodos prolongados. Los cuidados de la herida con drenajes JP según lo descrito previamente sólo se efectuaron en los ocho últimos pacientes de la presente investigación. En la actualidad se efectúan sistemáticamente cuando se obtiene un segmento de VF.
Transposición de VF a musloEste procedimiento consiste en el montaje de una FAV de AFS a VF mediante unos 25-30cm de VF no invertida. Después de la transección de la VF en la vena poplítea, se evalúa en busca de cualquier lesión mediante una distensión con suero salino heparinizado. Se tuneliza en el muslo en dirección lateral y por vía subcutánea utilizando una pinza recta con uno o dos contraabordajes laterales que ayudan a guiar el curso de la tunelización. Es importante efectuar abordajes generosos en la fascia en los lugares de salida y reentrada de la vena para evitar la compresión. En nuestro centro la tunelización inicial era la colocación de la vena en posición profunda con respecto a la AFS, según lo descrito por Gradman et al6 No obstante, durante el seguimiento, en esta área se desarrolló estenosis en varios pacientes, lo que requirió ATP, por lo que, en la actualidad, colocamos la vena en posición anterior a estas estructuras para evitar la compresión que puede aparecer con el tiempo. Tras la provisión de una longitud de 15-20cm para el curso superficial de la VF, el procedimiento de tunelización se dirige en profundidad hacia la AFS; se efectúan abordajes generosos en la fascia para evitar la compresión. Después de iniciar anticoagulación sistémica, se construye una anastomosis terminolateral con la VF en la AFS distal (fig. 1). La anastomosis del extremo de la VF con la cara lateral de la AFS se realiza proximalmente al hiato del abductor. No biselamos la VF y no hemos detectado que sea necesario reducir el diámetro de la VF para prevenir la isquemia de la extremidad inferior, según lo descrito por Gradman et al7 Se restablece el flujo sanguíneo, se evalúa la extremidad inferior del paciente en busca de los pulsos distales y se evalúa la FAV recién construida para la presencia de thrill a la palpación. Si se detecta un área de estenosis en la VF una vez se restablece el flujo, se requiere una disección adicional apropiada de la fascia en estos puntos. Se aplican drenajes JP en la herida a través de unos abordajes distales separados del muñón, y la herida se cierra en capas. La neutralización de la heparina es variable, en función de la hemostasia del campo operatorio.
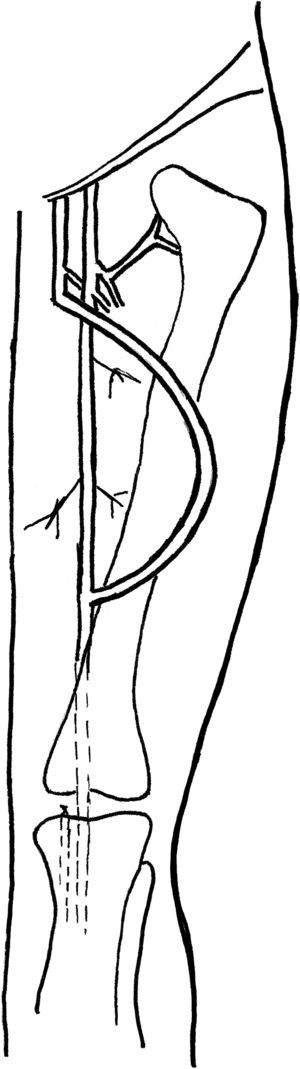
Translocación de VF a extremidad superiorEn este procedimiento se construye una FAV de arteria humeral a vena axilar utilizando 25-30cm de VF invertida, obtenida del muslo. Invertimos la VF para su translocación a la extremidad superior con el objetivo de evitar una valvulotomía, que podría lesionar la vena. Además, cuando se usa VF el desajuste del tamaño no es un problema ya que éste no cambia significativamente desde los segmentos proximales a los distales. Tras la obtención, la VF se distiende con una solución salina heparinizada. Se evalúa cuidadosamente para su tamaño uniforme y la hemostasia. Se efectúan un abordaje longitudinal por encima del codo para exponer la arteria humeral y se efectúa otro abordaje longitudinal en la axila para exponer la vena axilar. Tras la administración de anticoagulación sistémica con heparina, se obtiene el control proximal y distal de ambos vasos sanguíneos. Acto seguido, se construye una anastomosis terminolateral con la VF y la arteria humeral. Se requiere precaución para limitar la longitud de la anastomosis a un máximo de 6mm, con el objetivo de reducir el riesgo de un síndrome del robo. Nuestro grupo reduce el diámetro de la VF hasta 4,5-5,0mm, según lo descrito por Gradman et al7 para evitar los síntomas isquémicos.
Acto seguido, la VF se tuneliza subcutáneamente hasta la vena axilar en un túnel curvado lateralmente sobre el bíceps utilizando un contraabordaje y el dispositivo Impra Tunneler (CR Bard, Murral Hill, NJ). Utilizamos el cabezal de 8mm para efectuar un túnel de un tamaño aproximado al de la VF. La anastomosis proximal se libera breves momentos para distender la vena en el túnel y garantizar que no se producen compresión o acodaduras antes de efectuar la anastomosis distal. Se construye una anastomosis terminolateral con la VF y la vena axilar (fig. 2). Se restablece el flujo, se evalúa la extremidad superior del paciente en busca de los pulsos distales y se evalúa la FAV recién construida para identificar la presencia de thrill a la palpación. Con frecuencia, los defectos en la fascia a nivel de la arteria humeral y la vena axilar requieren una disección adicional para prevenir la compresión según lo descrito para la transposición VF en muslo (v. previamente). Las heridas de la extremidad superior se irrigan y se cierran en dos capas. El lugar de obtención de la vena en la extremidad inferior se trata como se ha descrito previamente. El tiempo característico de maduración de un abordaje con FAV VF es más breve que para otras FAV autólogas debido a la pared más gruesa de la vena. El tiempo hasta la maduración del abordaje es de 3-4 semanas para la translocación de VF a extremidad superior VF y de 1-2 meses para la transposición de VF en muslo debido a complicaciones de la herida en la extremidad inferior.
El seguimiento se inicia con una visita postoperatoria a los 10-15 días del alta hospitalaria o antes, si es necesario. La anamnesis debe prestar atención a los antecedentes de claudicación y edema de la extremidad inferior. La exploración física debe prestar atención a la herida/s, drenajes, fístula y pulsos distales, específicamente la formación de un linfocele o infección de la herida, cantidad diaria de drenaje de los JP, examen de la fístula en busca de un frémito y soplo y examen de los pulsos distales con la fístula abierta y comprimida. No se usan sistemáticamente técnicas de imagen, que se reservan para la investigación adicional de linfoceles, infecciones de la herida y problemas específicos de la fístula.
ResultadosEn la tabla I se muestra la demografía de los 19 pacientes incluidos. La mayoría eran hombres, con una edad media de 52 años. Alrededor de tres cuartas partes experimentaban IRT debida a DM o HTA y el resto debida a diversas causas, incluida nefritis intersticial, granulomatosis de Wegener, enfermedad antimembrana basal glomerular, glomerulonefritis y de causa desconocida (dos pacientes). La demografía específica de diálisis de la población incluyó el tiempo medio sometido a HD antes del abordaje con VF, que fue de 31 meses (límites 0-204 meses) y un promedio de dos FAV/IAV previas (límites 0-4). El índice medio de masa corporal (IMC) de esta serie de pacientes fue de 24kg/m2 (límites 20-27). En 16 pacientes (84%) se realizó ecografía preoperatoria de la VF, que demostraba una vena no duplicada, permeable, cuyos diámetros eran≥6mm. En los otros tres pacientes también se practicó examen ecográfico preoperatorio de la VF pero, en el momento de la obtención de los datos, no se disponía de sus resultados. La evaluación preoperatoria de la circulación arterial en la extremidad de obtención de la VF fue variable; el ITB estuvo disponible para 10 (53%) pacientes (límites del ITB 0,7-1). En el resto de los pacientes se comprobaron pulsos palpables (n=5) pero carecían de datos del ITB o habían sido sometidos a amputaciones previas infrageniculares (n=4).
Demografía y causas de IRT en 19 pacientes sometidos a transposición o translocación
| Demografía | |
| Número de pacientes | 19 |
| Edad (años, media) | 52 |
| Hombres (n, %) | 12 (63%) |
| Causa de IRT | |
| Diabetes mellitus | 10 (53%) |
| Hipertensión arterial | 3 (16%) |
| Otras | 6 (31%) |
| Tiempo medio de diálisis | 31 meses |
| Promedio de FAV previas | 2 |
FAV: fístula arteriovenosa; IRT: insuficiencia renal terminal.
Recibieron una transposición de VF en muslo 10 pacientes y nueve recibieron una translocación de VF a extremidad superior. Tras el procedimiento la estancia mediana hospitalaria fue de 3 días (límites 1-11). No se produjeron muertes perioperatorias. Se dejaron drenajes en el lugar de obtención de la VF en ocho (42%) pacientes, todos en la última parte del período del estudio. Un total de ocho (42%) pacientes experimentó complicaciones en el lecho de extracción de la VF. Seis de ellos desarrollaron linfocele, cinco de los cuales requirieron drenaje quirúrgico. Sólo en un paciente que desarrolló un linfocele los drenajes seguían insertados en el momento del procedimiento. Un paciente que recibió una transposición de VF presentó una infección de la FAV que dio lugar a la rotura súbita de la fístula y a una ligadura de urgencia. Este paciente ingresó a través del servicio de urgencias con una herida purulenta del muslo en el día 16 postoperatorio (DPO). Más tarde, en el DPO 19 se identificó una masa pulsátil y el paciente fue trasladado al quirófano de forma urgente para ligadura de la FAV debido a un pseudoaneurisma anastomótico infectado. Un paciente, que se sometió a una translocación de VF a extremidad superior, desarrolló un síndrome compartimental en la extremidad inferior y requirió fasciotomías múltiples. Este paciente, con IRT por nefropatía diabética, no había sido sometido a cirugía previa en la extremidad inferior donde se obtuvo la VF y su ITB era de 0,7 en dicha extremidad.
De los nueve pacientes, tres (33%) sometidos a translocación de VF a la extremidad superior experimentaron isquemia de la mano. Dos recibieron procedimientos de RDLI y uno requirió la ligadura de la FAV debido a una calcificación arterial grave en dicha extremidad y la ausencia de vasos distales aceptables para el procedimiento RDLI. Los resultados de dicho procedimiento fueron desiguales: un paciente presentó deterioro de la función en la mano no dominante debido a la isquemia continuada a pesar del procedimiento realizado al mismo tiempo que la translocación de la vena femoral. Sin embargo, cuando se iniciaron los síntomas isquémicos, la FAV no se ligó debido a la ausencia de otras opciones de abordaje. En el otro paciente la isquemia se resolvió con una translocación de VF a extremidad superior.
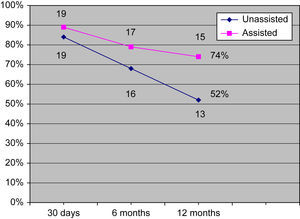
Con un seguimiento medio de 6 meses (límites 23 días a 3 años), 17 (79%) pacientes tenían una FAV de VF funcionante. Requirieron ATP de la FAV para mantener la permeabilidad cuatro pacientes, en la VF o del flujo venoso. En dos pacientes se efectuó ATP de las translocaciones de VF a extremidad superior. En los otros dos se efectuó ATP de las transposiciones de VF en muslo en el punto donde la VF se situaba por debajo de la AFS y la arteria femoral profunda. Más tarde, ningún paciente con transposiciones de VF a muslo con un recorrido anterior a la AFS y la arteria femoral profunda experimentó estenosis con necesidad de una intervención ATP. Un paciente adicional presentó trombosis de la FAV, y con las técnicas endovasculares y abiertas se consiguió restablecer la permeabilidad. Además, un paciente se perdió para el seguimiento después de la visita a los 6 meses. Las tasas de permeabilidad primaria acumulativa fueron del 84%, 68% y 52% a los 30 días, 6 meses y 12 meses, respectivamente (tabla II). Las tasas de permeabilidad asistida primaria acumulativa fueron del 89%, 79%, y 74% a los 30 días, 6 meses y 12 meses, respectivamente (tabla III) (fig. 3).
Tabla de vida de la tasa de permeabilidad primaria
| Intervalo (meses) | En riesgo al inicio del intervalo (n) | Fracaso durante intervalo (n) | Abandono durante intervalo | Tasa de fracaso del intervalo | Tasa acumulativa de permeabilidad primaria asistida | Error estándar |
| 0-1 | 19 | 3 | 0 | 0,158 | 84,21% | 7,68% |
| 1-6 | 16 | 3 | 0 | 0,188 | 68,42% | 9,61% |
| 6-12 | 13 | 3 | 1 | 0,240 | 51,99% | 9,99% |
Tabla de vida de la tasa de permeabilidad primaria asistida
| Intervalo (meses) | En riesgo al inicio del intervalo (n) | Fracaso durante intervalo (n) | Abandono durante intervalo | Tasa de fracaso del intervalo | Tasa acumulativa de permeabilidad primaria asistida | Error estándar |
| 0-1 | 19 | 2 | 0 | 0,105 | 89,47% | 6,66% |
| 1-6 | 17 | 2 | 0 | 0,118 | 78,95% | 8,79% |
| 6-12 | 15 | 1 | 1 | 0,069 | 73,50% | 9,77% |
El objetivo del presente estudio fue describir nuestra experiencia inicial utilizando la VF para construir FAV autólogas tanto en la extremidad superior como en el muslo, y por tanto, reproducir los resultados descritos por otros centros especializados en estos procedimientos4-12. También presentamos una técnica alternativa para labrar un túnel con la VF en dirección anterior a la AFS cuando se construye la transposición de la vena en el muslo y describimos nuestra experiencia con el drenaje en el lugar de obtención de la vena y la selección de los pacientes.
La serie del presente estudio refuerza el uso de VF como opción viable de acceso vascular en pacientes con IRT, en los que se han agotado todas las opciones para generar un abordaje de HD autólogo, estándar o carecen de una vena apropiada para FAV autóloga primaria, con una tasa de permeabilidad primaria asistida del 79% con un seguimiento medio de 6 meses. Casi la mitad de los pacientes experimentó una complicación en el lugar de obtención de la VF, pero dicha tasa se ha reducido con un drenaje activo de la herida en el momento de la intervención. Sin embargo, una cuarta parte de los pacientes experimentó morbilidad grave, incluida infección y/o isquemia de la extremidad superior, que causó la pérdida de la FAV en varios casos. Por último, aunque la población del presente estudio no era obesa, según los valores del IMC, los pacientes experimentaron las mismas complicaciones que en otros estudios en los se refiere una mayor incidencia de infección y fracaso de la FAV en pacientes con obesidad7. Las series previas, a mayor escala, que han prestado atención a las FAV con transposición de VF en muslo o translocación de VF a extremidad superior, han descrito resultados similares a los del presente estudio4-12. En estas publicaciones se describen varias técnicas, incluida la translocación en la extremidad superior utilizando vena safena-VF como conducto combinado para reducir el síndrome del robo9, la transposición de VF en muslo, con o sin una extensión del injerto de politetrafluoroetileno (PTFE) para mejorar la longitud de la VF4-8,11,12 y la translocación en muslo de la VF sola10,12. En estos estudios, las tasas de permeabilidad primaria asistida varían del 73 al 94% con un seguimiento de 6-24 meses. A pesar de una permeabilidad relativamente apropiada, estos procedimientos se asocian a sustanciales problemas en el lugar de la obtención y a una morbilidad isquémica.
En otras series las complicaciones en el lugar de obtención de la VF variaron un 23-28%6,8-10, con o sin el uso de drenajes. En los primeros 11 pacientes sometidos a un procedimiento de obtención de VF no usamos drenajes; cinco (45%) de aquellos sin drenaje desarrollaron linfoceles. En la última parte del estudio, usamos drenajes en ocho pacientes durante el procedimiento de obtención de la VF, y sólo uno (13%) desarrolló un linfocele. Consideramos que el uso de drenajes puede contribuir a evitar esta complicación.
En el presente estudio, en un caso se desarrolló un síndrome compartimental6,8,10. Este paciente tenía un ITB de 0,7 (un valor más bajo que nuestro umbral inicial de 0,8), además de otras comorbilidades, incluidas IRT y DM. Otros autores han asociado un valor bajo del ITB con un mayor riesgo de síndrome compartimental en casi el 18% de los pacientes sometidos a un procedimiento de obtención de VF para diversos usos15. Por lo tanto, en la actualidad sólo ofrecemos translocaciones de VF a extremidad superior a pacientes con un ITB≥0,8.
No se ha alcanzado un consenso por lo que respecta a los valores apropiados del ITB para pacientes sometidos a un procedimiento de obtención de la vena. Por ejemplo, Jackson11 efectuó transposiciones de VF a muslo en pacientes con valores normales del ITB y recomendó la evaluación de las extremidades inferiores con una ecografía si el índice era de 0,75-0,99. Sin embargo, Gradman et al6 construyeron satisfactoriamente transposiciones combinadas de VF en muslo en pacientes con un ITB<0,85. Nuestro grupo prefiere la estrategia más conservadora y decidimos construir transposiciones de VF en muslo en pacientes con una circulación normal en la extremidad inferior. Esto podría excluir a algunos pacientes sometidos a diálisis pero, de ellos, algunos podrían someterse a una translocación de VF a extremidad superior ya que, en nuestra opinión, en estos pacientes pueden permitirse valores más bajos del ITB para la obtención de la vena (≥ 0,8).
La isquemia afectó a un tercio de translocaciones de VF a extremidad superior pero a ningún paciente del grupo transposición de VF en muslo; esto probablemente se debe a la rápida evolución de la evaluación arterial preoperatoria que requiere una circulación arterial casi normal en la extremidad inferior. Huber et al10 describieron complicaciones isquémicas en el 43% de sus pacientes en los que se efectuaron translocaciones de VF a extremidad superior y el 27% requirió procedimientos RDLI. Inicialmente, en la serie del presente estudio, construimos translocaciones de VF a extremidad superior y anticipamos la necesidad de un procedimiento RDLI en tres pacientes con una circulación arterial deficiente en el examen preoperatorio. A pesar de la afectación de la circulación en la extremidad superior, y debido a la ausencia de otras opciones autólogas, construimos translocaciones de VF a extremidad superior con procedimientos RDLI profilácticos o postoperatorios en dos pacientes. Sin embargo, nuestra experiencia con estos procedimientos fue desigual, según lo descrito previamente; en uno de los pacientes no fue beneficioso. En función de estos resultados, actualmente cuando construimos translocaciones de VF a extremidad superior recomendamos que en los pacientes se identifique una circulación arterial normal en la extremidad superior con pulso palpable en la muñeca. Además, la disminución del diámetro de la VF en la anastomosis con la arteria humeral hasta<6mm (según lo descrito por Gradman et al7) puede contribuir a reducir las complicaciones isquémicas.
Por último, con respecto al tamaño de la VF, tenemos una experiencia favorable en la construcción de IAV en la extremidad superior con injertos de 6mm de PTFE y decidimos usar VF de 6mm (en su diámetro más pequeño) con la expectativa de obtener resultados similares o mejores. Una experiencia similar ha sido referida por Huber et al10 usando vena de diámetro igual o superior a 6mm para construir translocaciones a la extremidad superior.
Debido a la morbilidad de las FAV de VF, es prudente comparar esta técnica a otras alternativas de acceso vascular. El uso de materiales protésicos para la construcción de FAV de la extremidad inferior se caracteriza por una permeabilidad reducida y una morbilidad sustancial2. Hazinedaroglu et al8 describieron a 17 pacientes que se sometieron a IAV con PTFE en el muslo y 15 pacientes, a transposición de VF a muslo. La tasa de infección de los IAV de PTFE fue del 35%; cuatro infectadas requirieron resección. En comparación, sólo se efectuó la ligadura de una transposición en muslo debido a infección. Las tasas de permeabilidad primaria al año fueron del 37% para los IAV de PTFE y del 86% para las transposiciones de VF en muslo. En un análisis retrospectivo de 125 IAV protésicas en muslo se describió una tasa de infección del 41%, lo que incluyó seis muertes debidas a infección, y tasas de permeabilidad primaria y secundaria del 19 y 54%, respectivamente, a los 2 años, con numerosas reintervenciones para mantener la permeabilidad16.
Sin embargo, los IAV protésicos en la extremidad superior se han usado satisfactoriamente en poblaciones de pacientes seleccionadas con una tasa de infección próxima al 3,5%. Además, los mismos autores describieron que las infecciones de los IAV protésicos en la extremidad superior pueden tratarse con una resección total o subtotal del injerto17. Por último, en una revisión sistemática y un metaanálisis de estudios sobre resultados de permeabilidad, Huber et al18 han descrito IAV de PTFE y FAC autólogas en la extremidad superior. En los 34 estudios revisados los autores documentaron una tasa mediana de infección del 7% (límites del 0-30%). Las tasas de permeabilidad primaria fueron del 72% a los 6 meses y del 51% a los 18 meses para las FAV autólogas, y del 58% a los 6 meses y 33% a los 18 meses para las IAV de PTFE. En la serie del presente estudio se describen tasas de permeabilidad primaria y primaria asistida que son comparables o superiores a las obtenidas con el uso de material protésico en las extremidades superiores e inferiores con un número menor de complicaciones. Consideramos que estos hallazgos compensan la mayor morbilidad de las FAV con translocación de la vena femoral.
Se han utilizado injertos de PTFE revestidos de heparina con tasas de permeabilidad comparables a los injertos de venas autólogas para el tratamiento de la enfermedad vascular oclusiva de las extremidades inferiores19-22. Además, en un modelo animal se ha demostrado que el revestimiento de superficie con heparina en injertos de PTFE de pequeño calibre puede reducir el depósito de la agregación plaquetaria, hiperplasia neointimal anastomótica y proliferación celular23. No se han publicado ensayos prospectivos o retrospectivos sobre evaluación de injertos de PTFE revestidos de heparina para usar como acceso vascular para la HD. En un caso clínico publicado en el que se describen cinco pacientes que recibieron un injerto de policarbonato de uretano, revestido de heparina, se documentó el uso inmediato satisfactorio en todos los pacientes24. Las series prospectivas a gran escala desempeñarán un importante papel en la evaluación de esta tecnología nueva y prometedora.
En una revisión retrospectiva de 20 pacientes se evaluó el uso de vena femoral criopreservada para la construcción de IAV. Éstas se construyeron en el muslo, extremidad superior y pared torácica. El 64% de los injertos del muslo, 33% de los del brazo y 33% de los de la pared torácica se infectaron. Experimentaron rotura seis de ellos, dando lugar a la muerte de un paciente. Además, a los 17 meses, la tasa de permeabilidad primaria fue del 28% y la de permeabilidad secundaria fue del 31%. Los autores desaconsejaron el uso de VF criopreservada para la construcción de IAV y recomendaron que no se usara en el muslo25. En un estudio diferente se describió una mayor eficacia con VF criopreservada. Los autores asignaron aleatoriamente a 54 pacientes a un IAV de PTFE o de VF criopreservada, todos construidos en la extremidad superior. No se identificaron diferencias significativas de la permeabilidad primaria o secundaria, número de revisiones o trombectomías. Los autores no observaron infecciones en ninguno de ambos grupos y la tasa de fracaso fue del 30% en el grupo en el que se usó vena criopreservada y del 18% en el otro grupo26. Sin duda, esta tecnología también merece una investigación adicional y una definición de sus aplicaciones e indicaciones.
Los catéteres venosos centrales se asocian a numerosas complicaciones graves que no los hacen prácticos para usar en la HD crónica. En un estudio de seguimiento durante más de 10 años sobre uso de catéteres venosos centrales para la HD, Vanholder et al27 describieron 786 cateterizaciones. En su experiencia obtuvieron una tasa de complicaciones globales>27%. Las complicaciones más frecuentes fueron el flujo insuficiente, la retirada accidental del catéter y la bacteriemia, en particular durante los períodos prolongados de uso del catéter venoso central. En otros estudios también se proporcionan pruebas de que la infección es una de las causas principales de retirada y morbilidad del catéter en pacientes dializados28-30.
ConclusiónEstá claro que la construcción de una FAV con material autólogo proporciona una permeabilidad prolongada y es un abordaje fiable para pacientes sometidos a hemodiálisis. La transposición o translocación de VF es una opción práctica para el subgrupo de pacientes con IRT en los que se han agotado otras opciones de abordaje autólogo para la HD. Pueden obtenerse resultados razonables con una morbilidad moderada, en particular a partir de complicaciones en el lugar de obtención de la vena. Las complicaciones infecciosas disminuyen en comparación con las alternativas protésicas y las tasas de permeabilidad primaria asistida parecen superiores a las alternativas protésicas.
El algoritmo actual para el abordaje de la HD en nuestro centro es 1) FAV en el antebrazo, 2) FAV humerocefálica en el brazo, 3) FAV con transposición de basílica en dos estadios, 4) injerto de PTFE revestido de heparina en brazo (que puede evitarse si el paciente presenta un riesgo elevado de infección), 5) translocación de VF a extremidad superior, y, por último, 6) transposición de VF en muslo cuando se han agotado todas las opciones en la extremidad superior.
Los autores agradecen la ayuda de la Pacific Research Vascular Foundation y Jessica L. Frias de Rueda por las ilustraciones.
Presentado en el 18th Annual Winter Meeting de la Peripheral Vascular Surgery Society's, Snowmass, CO, 1-3 de febrero de 2008.