Editado por: Andrea Gallioli
Fundació Puigvert
Marco Moschini
San Raffaele Hospital
Última actualización: Junio 2025
Más datosLa resección transuretral del tumor vesical (RTU) es un procedimiento habitual en el cáncer de vejiga (CV), que se asocia con un bajo riesgo de tromboembolismo venoso (TEV). El objetivo de este estudio fue determinar los factores predictivos de TEV postoperatorio en los pacientes sometidos a RTU por CV.
Materiales y métodosEn este análisis de cohorte retrospectivo se identificaron pacientes de ≥18 años con diagnóstico de CV sometidos a RTU en las bases de datos desidentificados de Merative® Marketscan® Research en 2007-2021. Se excluyeron los pacientes con eventos previos de TEV. Se registraron los códigos diagnósticos preoperatorios y las prescripciones ambulatorias presentes en al menos el 1% de la cohorte (205 variables). A continuación, se realizaron regresiones logísticas incluyendo cada variable por separado, todas las variables juntas, así como variables seleccionadas por los métodos de selección escalonada (stepwise) y Least Absolute Shrinkage and Selection Operator (LASSO). Se calcularon las odds ratio ajustadas (aOR) con intervalos de confianza (IC) del 95%.
ResultadosEn total, 132.425 pacientes fueron incluidos en este estudio, con 1.959 (1,5%) individuos diagnosticados de TEV postoperatorio. Diversas neoplasias malignas diagnosticadas antes de la CV constituyeron factores de riesgo significativos de TEV postoperatorio, con una OR hasta 2,26 (IC 95%: 1,96-2,61). Otro factor predictivo importante de TEV fue el diagnóstico de nefritis, síndrome nefrótico y nefrosis (aOR: 1,67; IC 95%: escalonada 1,48-1,87; aOR: 1,65; IC 95%: LASSO 1,46-1,85). Asimismo, los pacientes con enfermedades del sistema urinario, síntomas inespecíficos, enfermedades del sistema respiratorio, anemia y otras enfermedades cardiovasculares se asociaron a un mayor riesgo de TEV. En cuanto a los fármacos, los antidiabéticos y los gastrointestinales redujeron la probabilidad de TEV.
ConclusionesNumerosos factores preoperatorios influyen en el riesgo de TEV tras la RTU. Estos hallazgos podrían facilitar la decisión clínica sobre la implementación de profilaxis tromboembólica en los pacientes adecuados.
Transurethral resection of the bladder tumor (TURBT) is a standard procedure in bladder cancer (BC), which is associated with low risk of venous thrombo-embolism (VTE). The aim of this study was to find the predictors of postoperative VTE in patients undergoing TURBT for BC.
Materials and MethodsIn this retrospective cohort analysis, patients aged ≥18 years with BC diagnosis undergoing TURBT were identified in the Merative® Marketscan® Research de-identified databases in 2007-2021. Patients with prior VTE events were excluded. Preoperative diagnostic codes and outpatient prescriptions present in at least 1% of the cohort were recorded (205 variables). Then, logistic regressions were performed including each variable separately, all variables together, as well as variables selected by stepwise and Least Absolute Shrinkage and Selection Operator (LASSO) selection methods. Adjusted odds ratios (aOR) with 95% confidence intervals (CI) were calculated.
ResultsIn total, 132,425 patients were included in this study, with 1,959 (1.5%) individuals diagnosed with postoperative VTE. Various malignant neoplasms diagnosed before BC were significant risk factors of postoperative VTE, with aOR reaching up to 2.26 (95% CI: 1.96-2.61). Another strong predictor of VTE was a diagnosis of nephritis, nephrotic syndrome, and nephrosis (aOR: 1.67; 95% CI: 1.48-1.87 stepwise; aOR: 1.65; 95% CI: 1.46-1.85 LASSO). Also, patients with diseases of the urinary system, non-specific symptoms, diseases of the respiratory system, anemias, and other cardiovascular diseases were associated with increased VTE risk. Regarding drugs, antidiabetic agents and gastrointestinal drugs reduced the probability of VTE.
ConclusionsNumerous preoperative factors have influence on the risk of VTE after TURBT. These findings might facilitate the clinical decision about the implementation of thromboprophylaxis in the appropriate patients.
La resección transuretral del tumor vesical (RTU) es un procedimiento diagnóstico habitual en el cáncer de vejiga (CV)1. Además, en el cáncer de vejiga no músculo invasivo (CVNMI), la RTU es una cirugía curativa que permite evitar intervenciones extensas, como la cistectomía radical (CR). A pesar de su carácter mínimamente invasivo, la RTU se asocia a cierto riesgo de complicaciones, entre ellas el tromboembolismo venoso (TEV) que puede desarrollarse en aproximadamente el 3% de los pacientes2.
Se ha documentado que la aparición de TEV afecta negativamente los resultados perioperatorios de diversas cirugías3,4. Por lo tanto, su prevención mediante la administración de medicación anticoagulante en los pacientes seleccionados es fundamental. Se han desarrollado diversas escalas para evaluar el riesgo de TEV que ayudan a seleccionar a los pacientes que requieren profilaxis tromboembólica, como las guías de la EAU o la puntuación de Caprini5,6. Sin embargo, en las guías de la EAU de 2024 se eliminó el capítulo de tromboprofilaxis y la puntuación de Caprini de 2009 tiene una sensibilidad y especificidad del 59 y del 57%, respectivamente, en los pacientes hospitalizados por cáncer1,7. Por ello, los facultativos deben tomar decisiones de manera arbitraria en los casos más complejos.
Además, la fulguración suele realizarse en un entorno ambulatorio, por lo que podría omitirse la evaluación rutinaria del riesgo de TEV. Por otro lado, incluso en los pacientes con indicación de tromboprofilaxis, los urólogos podrían no iniciar este tratamiento debido al riesgo de sangrado postoperatorio.
El objetivo de este estudio fue encontrar los factores predictivos de TEV postoperatorio en los pacientes sometidos a RTU por CV.
Materiales y métodosEste análisis de cohortes retrospectivo se ajusta a la Declaración STROBE.
Fuente de datosAlgunos datos han sido suministrados por Merative como parte de una o más bases de datos de MarketScan Research. Los análisis, las interpretaciones o las conclusiones basadas en estos datos son responsabilidad exclusiva de los autores y no de Merative.
Este estudio se basó en datos administrativos de reclamaciones de seguros de las bases de datos MerativeTM Marketscan® Research Commercial y Medicare (https://doi.org/10.57761/n5v8-0v21)8. Se han incluido datos individuales desidentificados de las características demográficas, de diagnóstico, procedimiento, costes generales relacionados con la salud, reclamaciones de facturas de farmacia de los pacientes hospitalizados y ambulatorios y tratamientos, lo que permitió un seguimiento longitudinal de los pacientes. Se utilizaron códigos de la Clasificación Internacional de Enfermedades, Modificación Clínica y Sistema de Codificación de Procedimientos (CIE-9-CM, CIE-10-CM, CIE-10-PCS), terminología procesal actual (CPT) y sistema de codificación de procedimientos médicos (HCPCS) para identificar la cohorte de interés, los tratamientos y las comorbilidades. Este método se ha utilizado en otros estudios3,4,9. Ya que los datos estaban desidentificados, el estudio fue eximido de los requisitos de consentimiento informado por la Junta de Revisión Institucional del Centro Médico de la Universidad de Stanford. Para acceder a los datos de este estudio se utilizó el centro de datos Population Health Sciences (PHS) de Stanford. El centro de datos PHS está financiado por el Clinical and Translational Science Award (CTSA) del National Center for Advancing Translational Sciences, NHI (UL1TR003142) y por fondos internos de Stanford.
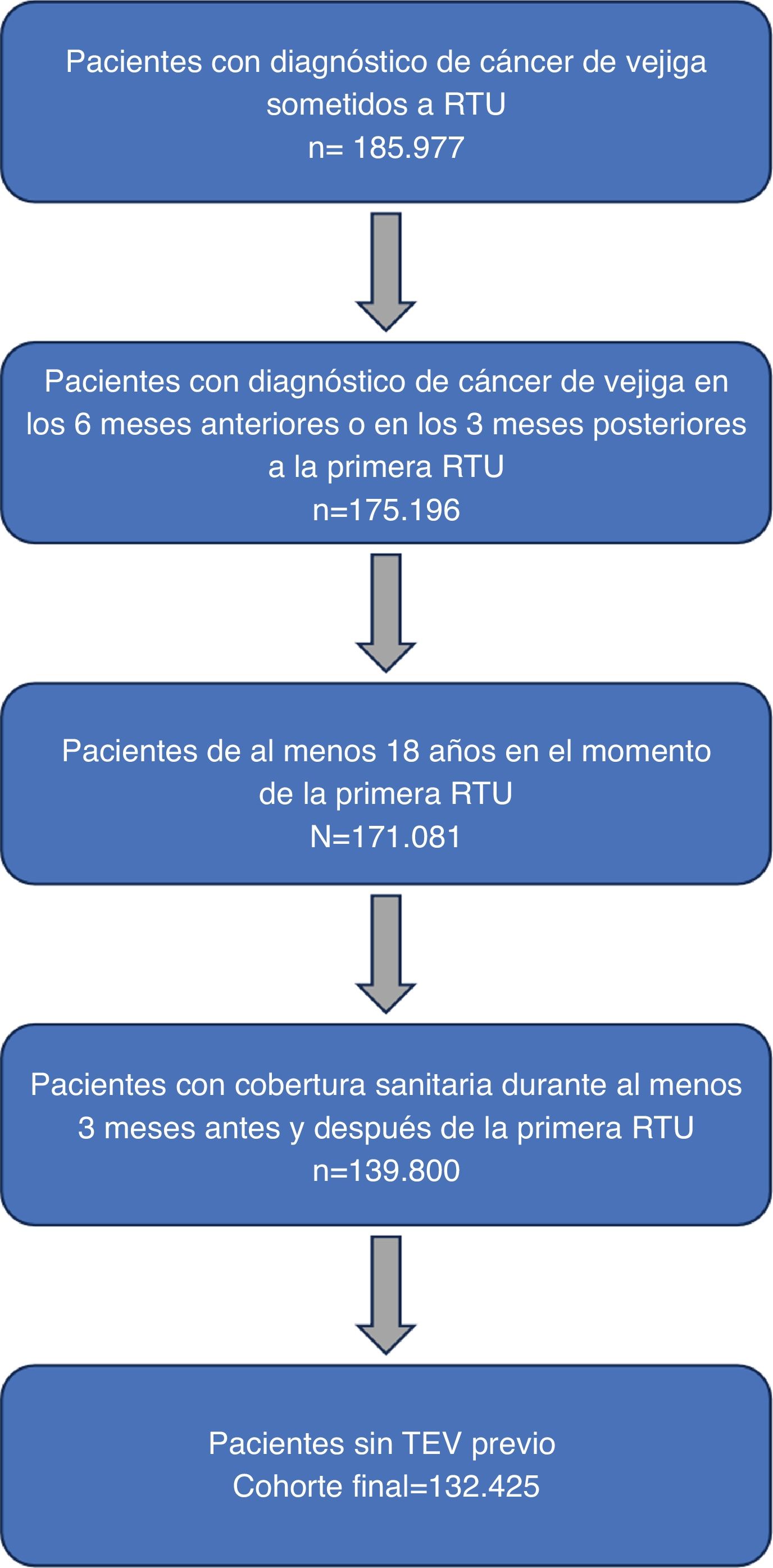
PacientesUtilizando los códigos de diagnóstico/tratamiento ICD-9/10-CM, ICD-10-PCS y CPT para CV y RTU, se revisaron los datos de los pacientes de al menos 18 años que se sometieron a una RTU por CV entre 2007 y 2021 para crear la cohorte de interés. Los pacientes seleccionados para el análisis se inscribieron en la base de datos al menos 3 meses antes y 3 meses después de la primera RTU. El momento de la primera RTU se designó como fecha índice para la evaluación posterior. Dentro de esta cohorte, se identificaron y revisaron los códigos de diagnóstico de TEV postoperatorio para garantizar la selección adecuada de los pacientes. El TEV se definió como embolia pulmonar, trombosis venosa profunda de las extremidades inferiores o superiores u otra flebitis/tromboflebitis periférica o superficial presente en el momento del ingreso. Además, se excluyeron los pacientes con episodios previos de TEV. La cohorte del estudio se estratificó además en subgrupos en función de la presencia de TEV tras la RTU («TEV postoperatorio») frente a la ausencia de antecedentes de TEV tras la RTU («sin TEV postoperatorio»). Además, se estratificó como RTU menor y RTU mayor. La RTU «menor» incluía procedimientos limitados a cistoscopia con biopsia y/o fulguración, a diferencia de la intervención «mayor», que identificaba procedimientos más complejos y que requerían resección. Para cada paciente, se registraron inicialmente los datos sociodemográficos, incluida la edad en la fecha índice, el sexo, la región de EE. UU. y el estado del seguro. El índice de comorbilidad de Charlson (ICC) se calculó según Charlson et al.10 y se adaptó según Deyo et al.11. También se registraron la prevalencia de comorbilidad específica, la duración de la estancia hospitalaria, el estado al alta, las intervenciones adicionales, el coste total, las complicaciones y los reingresos. Las características del tratamiento incluyeron los datos de procedimiento de la RTU (tamaño del tumor, número de RTU) y la utilización de modalidades perioperatorias relevantes para la RTU, como la administración de quimioterapia intravesical. En la figura 1 se muestra un diagrama de flujo que resume los pasos analíticos para el análisis de datos y los criterios de inclusión/exclusión, y en la tabla suplementaria 1 se presenta una lista detallada de los códigos ICD-9/10, CPT y HCPCS utilizados.
Determinación de resultadosEl principal objetivo de este estudio fue hallar los principales factores predictivos de la aparición de TEV tras la intervención de RTU en los pacientes estadounidenses diagnosticados de CV. Para alcanzar este objetivo, examinamos el impacto de 205 variables preoperatorias sobre el riesgo de TEV postoperatorio. La lista de las variables preoperatorias se presenta en la tabla suplementaria 2.
Análisis estadísticoLas variables continuas se presentaron como medias±desviaciones estándar (DE) o medianas y rangos intercuartílicos (RIQ). Las variables categóricas se presentaron como recuentos y porcentajes (%). Para el análisis estadístico se utilizó la prueba de Chi-cuadrado para la comparación de datos categóricos, la prueba de la t de Student para la edad y la suma de rangos de Wilcoxon para otras variables continuas, todas ellas estratificadas por aparición de TEV postoperatorio.
Se siguieron los siguientes pasos para investigar los factores de riesgo asociados a una mayor probabilidad de TEV tras una RTU. En primer lugar, se registraron los códigos diagnósticos preoperatorios y las prescripciones ambulatorias presentes en al menos el 1% de la cohorte (205 variables). A continuación, se aplicaron regresiones logísticas univariables para cada variable y regresiones logísticas multivariables para todas las variables incluidas. Además, se calcularon regresiones logísticas para las variables seleccionadas por el método de selección escalonada y por el método de selección Least Absolute Shrinkage and Selection Operator (LASSO). Se excluyeron manualmente las variables concretas cuyas regresiones no eran coherentes con el conocimiento médico bien establecido. Por último, se incluyeron regresiones para 15 variables del método de selección escalonada y para 10 variables del método de selección LASSO. En ambos modelos, cada regresión se ajustó por todas las variables elegidas. Todos los análisis fueron bilaterales, considerándose significativa una p<0,05, y se realizaron utilizando el programa estadístico SAS, versión 9.4 (SAS Institute Inc., Cary, NC, EE. UU.).
ResultadosCohorte del estudioEn total, se incluyó en este estudio una gran cohorte de 132.425 pacientes con diagnóstico de CV, que se sometieron a RTU entre 2007 y 2021 en los EE. UU. Sin embargo, solo 1.959 (1,5%) individuos fueron diagnosticados con TEV postoperatorio.
En la tabla 1 se presentan las características demográficas, clínicas y hospitalarias basales de los pacientes estratificados en subgrupos de «TEV postoperatorio» y «sin TEV postoperatorio». Los pacientes que presentaron episodios de TEV tras la RTU eran significativamente mayores (mediana de 70 frente a 66 años) y tenían una mediana de seguimiento un año más corta (mediana de 1,3 frente a 2,3 años). Los subgrupos estaban equilibrados en cuanto a sexo, región de EE. UU., fuente de los datos y tipo de seguro. Además, los pacientes con TEV postoperatorio tenían una mediana de CCI más alta (mediana de 3 frente a 2). El análisis de comorbilidades específicas reveló que los pacientes que desarrollaron TEV postoperatorio presentaban tasas significativamente más elevadas de insuficiencia renal (27,0 frente al 13,8%) y enfermedades hematológicas (34,5 frente al 24,4%). Curiosamente, el 13,5% de los pacientes de ambos subgrupos eran fumadores. Además, los pacientes con TEV postoperatorio presentaban más tumores de gran tamaño (55,7 frente al 35,2%) y fueron tratados mediante RTU «mayor» con mayor frecuencia (45,7 frente al 33,8%). Por último, los pacientes con TEV después de RTU presentaron tasas más bajas de inmunoterapia intravesical (12,8 frente al 23%), pero se sometieron a CR con más frecuencia (24,4 frente al 7,4%).
Características demográficas, clínicas y hospitalarias basales de los pacientes de la cohorte final del estudio según el diagnóstico de TEV tras la RTU (TEV postoperatorio frente a sin TEV postoperatorio)
| TEV postop. | Sin TEV postop. | p-valor | |
|---|---|---|---|
| Número | 1.959 (1,5) | 130.466 (98,5) | |
| Edad, mediana (IQR) | 70 (61-80) | 66 (58-77) | <0,0001 |
| 1st cuartil | 388 (19,8) | 33.966 (26,0) | <0,0001 |
| 2nd cuartil | 445 (22,7) | 32.940 (25,2) | |
| 3rd cuartil | 508 (25,9) | 31.738 (24,3) | |
| 4.° cuartil | 618 (31,5) | 31.822 (24,4) | |
| Años de seguimiento, mediana (RIQ) | 1,3 (0,6-3,1) | 2,3 (1,1-4,6) | <0,0001 |
| Sexo, n (%) | 0,5991 | ||
| Varón | 1.359 (69,4) | 91.223 (69,9) | |
| Mujer | 600 (30,6) | 39.243 (30,1) | |
| Región de EE. UU., n (%) | <0,0001 | ||
| Noreste | 460 (23,5) | 31.100 (23,8) | |
| Centro-Norte | 593 (30,3) | 34.752 (26,6) | |
| Sur | 561 (28,6) | 43.485 (33,3) | |
| Oeste | 290 (14,8) | 18.503 (14,2) | |
| Desconocido | 55 (2,8) | 2.626 (2,0) | |
| Fuente de datos, n (%) | <0,0001 | ||
| Pago por servicio | 690 (35,2) | 55.430 (42,5) | |
| Consulta | 82 (4,2) | 7.097 (5,4) | |
| Medicare | 1028 (52,5) | 59.997 (46,0) | |
| Consulta Medicare | 156 (8,0) | 7.799 (6,0) | |
| Tipo de seguro, n (%) | 0,007 | ||
| Completo | 490 (25,0) | 28.949 (22,2) | |
| HMO | 225 (11,5) | 14.082 (10,8) | |
| PPO | 966 (49,3) | 66.932 (51,3) | |
| Otros | 278 (14,2) | 20.503 (15,7) | |
| CCI, mediana (RIQ) | 3 (2 6) | 2 (1-4) | <0,0001 |
| 0-1 | 364 (18,6) | 37.832 (29) | <0,0001 |
| 2-4 | 916 (46,8) | 66.571 (51,0) | |
| ≥5 | 679 (34,7) | 26.063 (20,0) | |
| Comorbilidades prevalentes, n (%) | |||
| Obesidad | 223 (11,4) | 12.136 (9,3) | 0,0017 |
| Diabetes | 573 (29,2) | 34.609 (26,5) | 0,0068 |
| Hipertensión | 1.333 (68,0) | 80.169 (61,4) | <0,0001 |
| Insuficiencia renal | 529 (27,0) | 17.975 (13,8) | <0,0001 |
| Tabaquismo | 265 (13,5) | 17.623 (13,5) | 0,9799 |
| Infecciosa | 674 (34,4) | 37.469 (28,7) | <0,0001 |
| Hematológica | 675 (34,5) | 31.778 (24,4) | <0,0001 |
| Profilaxis anticoagulante, n (%) | |||
| 90 días antes de la RTU | 245 (12,5) | 11.926 (9,1) | <0,0001 |
| 90 días después de la RTU | 922 (47,1) | 11.723 (9,0) | <0,0001 |
| Tamaño del tumor, n (%) | n=1,505 | n=90,666 | <0,0001 |
| Pequeño (≤2 cm) | 215 (14,3) | 22.893 (25,2) | |
| Medio (2-5cm) | 452 (30,0) | 35.845 (39,5) | |
| Grande (>5cm) | 838 (55,7) | 31.928 (35,2) | |
| RTU menor, n (%) | <0,0001 | ||
| No | 896 (45,7) | 44.109 (33,8) | |
| Sí | 1.063 (54,3) | 86.357 (66,2) | |
| Re-RTU<90 días desde RTU, n (%) | 387 (19,7) | 23.178 (17,8) | 0,0223 |
| Tiempo entre RTU y Re-RTU, semanas, mediana (IQR) | 3,4 (1,4 - 6,1) | 4,1 (1,3-7,1) | 0,0505 |
| Quimioterapia intravesical, n (%) | 459 (23,4) | 44.081 (33,8) | <0,0001 |
| QTIVp (≤14 días después de RTU) | 135 (29,4) | 11.774 (26,7) | <0,0001 |
| QT adyuvante (>90 días después de RTU) | 173 (37,7) | 13.207 (30,0) | |
| BCG intravesical tras RTU, n (%) | 251 (12,8) | 30.004 (23,0) | <0,0001 |
| Tiempo entre RTU y BCG intravesical, meses, mediana (IQR) | 2,7 (1,4-5,7) | 1,9 (1,1-5,0) | 0,0023 |
| CR después de RTU (es decir, CVMI primario), n (%) | 479 (24,4) | 9.679 (7,4) | <0,0001 |
| Tiempo entre RTU y CR, meses, mediana (IQR) | 1,9 (1,2-4,6) | 4,0 (1,6-7,9) | <0,0001 |
| CUTS concomitante, n (%) | 73 (3,7) | 2.543 (1,9) | <0,0001 |
| NUR antes de RTU, n (%) | 26 (1,3) | 1120 (0,9) | 0,0262 |
| Tiempo entre NUR y RTU, meses, mediana (IQR) | 4,7 (2,7-15,8) | 7,3 (4,3-14,2) | 0,0706 |
| NUR tras RTU, n (%) | 96 (4,9) | 2.677 (2,0) | <0,0001 |
| Tiempo entre RTU y NUR, meses, mediana (RIQ) | 1,9 (1,0-5,3) | 3,6 (1,4-14,7) | 0,0004 |
BCG: bacilo de Calmette-Guérin; CR: cistectomía radical; CUTS: carcinoma urotelial del tracto superior; CVMI: cáncer vesical músculo invasivo; DE: desviación estándar; EE. UU.: Estados Unidos; HMO: organización para el mantenimiento de la salud; ICC: índice de comorbilidad de Charlson; IQR: rango intercuartílico; n: número; NUR: nefroureterectomía radical; PPO: organización de proveedores preferidos; QT: quimioterapia; QTIVp: quimioterapia intravesical postoperatoria; RIQ: rango intercuartílico; RTU: resección transuretral de tumor vesical; TEV: tromboembolismo venoso.
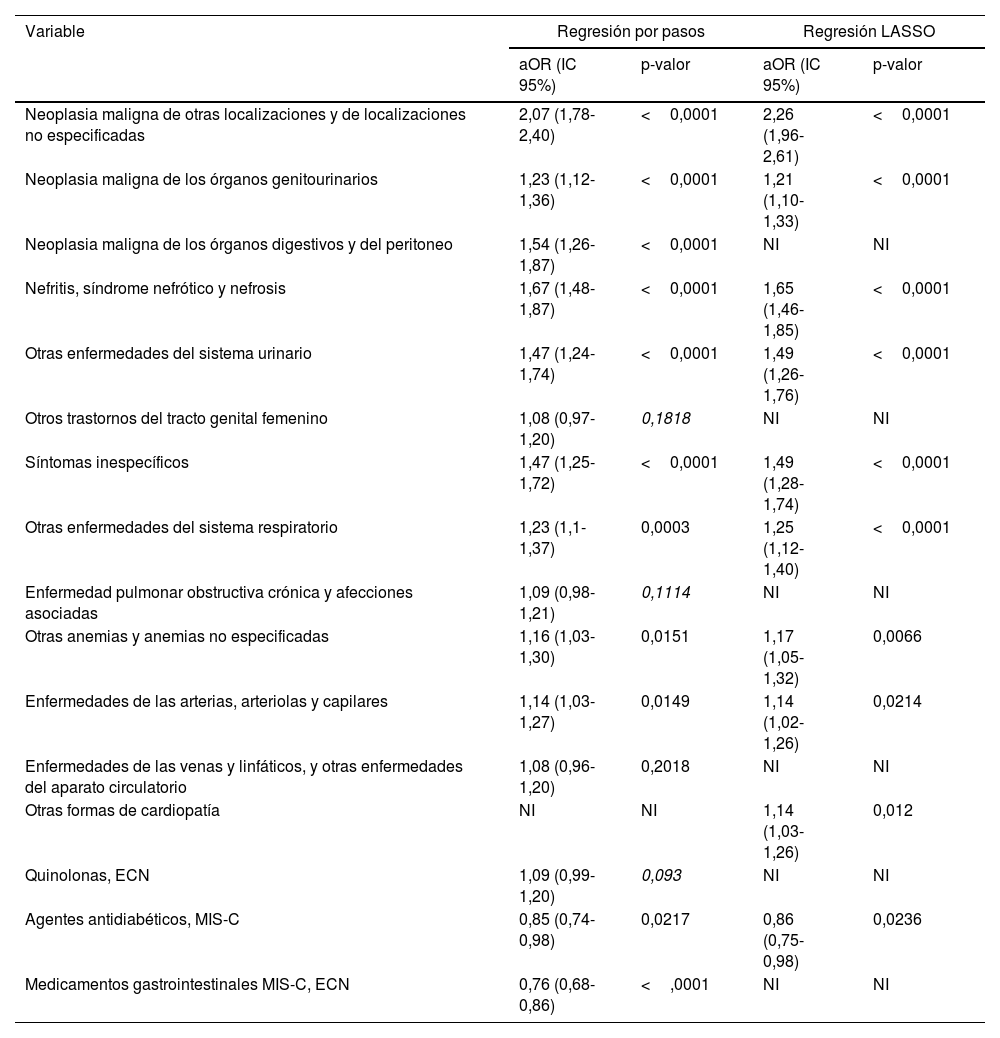
Los resultados de las regresiones paso a paso y LASSO para las variables seleccionadas se presentaron en la tabla 2, utilizando odds ratio ajustadas (aOR) con intervalos de confianza (IC) del 95%.
Regresiones escalonada y LASSO para el efecto de las variables seleccionadas en el riesgo de tromboembolismo venoso postoperatorio
| Variable | Regresión por pasos | Regresión LASSO | ||
|---|---|---|---|---|
| aOR (IC 95%) | p-valor | aOR (IC 95%) | p-valor | |
| Neoplasia maligna de otras localizaciones y de localizaciones no especificadas | 2,07 (1,78-2,40) | <0,0001 | 2,26 (1,96-2,61) | <0,0001 |
| Neoplasia maligna de los órganos genitourinarios | 1,23 (1,12-1,36) | <0,0001 | 1,21 (1,10-1,33) | <0,0001 |
| Neoplasia maligna de los órganos digestivos y del peritoneo | 1,54 (1,26-1,87) | <0,0001 | NI | NI |
| Nefritis, síndrome nefrótico y nefrosis | 1,67 (1,48-1,87) | <0,0001 | 1,65 (1,46-1,85) | <0,0001 |
| Otras enfermedades del sistema urinario | 1,47 (1,24-1,74) | <0,0001 | 1,49 (1,26-1,76) | <0,0001 |
| Otros trastornos del tracto genital femenino | 1,08 (0,97-1,20) | 0,1818 | NI | NI |
| Síntomas inespecíficos | 1,47 (1,25-1,72) | <0,0001 | 1,49 (1,28-1,74) | <0,0001 |
| Otras enfermedades del sistema respiratorio | 1,23 (1,1-1,37) | 0,0003 | 1,25 (1,12-1,40) | <0,0001 |
| Enfermedad pulmonar obstructiva crónica y afecciones asociadas | 1,09 (0,98-1,21) | 0,1114 | NI | NI |
| Otras anemias y anemias no especificadas | 1,16 (1,03-1,30) | 0,0151 | 1,17 (1,05-1,32) | 0,0066 |
| Enfermedades de las arterias, arteriolas y capilares | 1,14 (1,03-1,27) | 0,0149 | 1,14 (1,02-1,26) | 0,0214 |
| Enfermedades de las venas y linfáticos, y otras enfermedades del aparato circulatorio | 1,08 (0,96-1,20) | 0,2018 | NI | NI |
| Otras formas de cardiopatía | NI | NI | 1,14 (1,03-1,26) | 0,012 |
| Quinolonas, ECN | 1,09 (0,99-1,20) | 0,093 | NI | NI |
| Agentes antidiabéticos, MIS-C | 0,85 (0,74-0,98) | 0,0217 | 0,86 (0,75-0,98) | 0,0236 |
| Medicamentos gastrointestinales MIS-C, ECN | 0,76 (0,68-0,86) | <,0001 | NI | NI |
aOR: odds ratio ajustada; IC: intervalo de confianza; NI: no informado.
Diversas neoplasias malignas (de otras localizaciones y no especificadas, órganos genitourinarios, órganos digestivos y peritoneo) diagnosticadas antes del CV fueron factores de riesgo significativos de TEV postoperatorio, con una aOR que alcanzó el 2,26 (IC del 95%: 1,96-2,61) en la regresión LASSO. Otro potente factor predictivo de TEV tras la RTU fue el diagnóstico de nefritis, síndrome nefrótico y nefrosis (aOR: 1,67; IC 95%: 1,48-1,87 por regresión paso a paso; aOR: 1,65; IC 95%: 1,46-1,85 por regresión LASSO). Los pacientes con enfermedades del sistema urinario también eran más propensos a desarrollar TEV (aOR: 1,47; IC 95%: 1,24-1,74 por regresión paso a paso; aOR: 1,49; IC 95%: 1,26-1,76 por regresión LASSO). Cabe mencionar que los síntomas inespecíficos se asociaron con un aumento de hasta el 49% del riesgo de TEV en la regresión LASSO. Otros códigos diagnósticos que se asociaron significativamente con la aparición de TEV fueron: enfermedades del sistema respiratorio, anemia y otras enfermedades cardiovasculares. Sin embargo, los trastornos del aparato genital femenino y la enfermedad pulmonar obstructiva crónica (EPOC) no alcanzaron significación estadística como factores de riesgo de TEV.
En cuanto a los fármacos, los antidiabéticos y los gastrointestinales redujeron la probabilidad de TEV en un 15 y un 24%, respectivamente. Por otra parte, la administración de quinolonas fue un factor de riesgo de aparición de TEV postoperatorio, pero no tuvo significación estadística.
DiscusiónEl presente estudio se centró en los factores preoperatorios que podrían influir en la aparición de TEV tras la intervención de RTU. Este análisis no proporcionó una visión completa de los predictores de TEV postoperatorio. Por lo tanto, no debe tratarse como una guía sólida para la aplicación de la tromboprofilaxis, pero podría utilizarse como herramienta auxiliar en casos clínicos más complejos. Hasta donde sabemos, no hay estudios disponibles en la literatura sobre este tema en particular. Sin embargo, Zheng et al. hallaron que los antecedentes de TEV, el hematoma vesical postoperatorio, la edad >65 años y el dímero D >1,25mg/l se asociaban a un mayor riesgo de desarrollo de TEV tras la resección transuretral de la próstata12. Cabe señalar que los factores mencionados no se incluyeron en este análisis.
En nuestra investigación, debido al gran número de variables identificadas, se aplicaron de forma independiente los métodos de selección paso a paso y LASSO. Como resultado, se redujo la complejidad de los modelos de regresión y se identificaron e incluyeron las variables preoperatorias más relevantes.
Aunque las complicaciones trombóticas tras la RTU son poco frecuentes, pueden dificultar el tratamiento oncológico adecuado y deteriorar los resultados clínicos. Se ha demostrado que el TEV antes de la CR aumenta la morbilidad, la duración de la estancia hospitalaria, los reingresos y los costes sanitarios3. Debemos destacar que los pacientes con diagnóstico preoperatorio de TEV se excluyeron a propósito de este estudio, ya que el riesgo de aparición consecuente de TEV es tan elevado que impediría la evaluación adecuada de las demás variables. No obstante, debe tenerse en cuenta la fuerte asociación entre los episodios trombóticos preoperatorios y los postoperatorios.
Nuestro estudio ha puesto de manifiesto algunas asociaciones interesantes y novedosas tras la RTU. Según el presente análisis, las neoplasias malignas diagnosticadas antes del diagnóstico de CV fueron el factor de riesgo más potente de aparición de TEV. Estos resultados no son sorprendentes, ya que la trombosis asociada al cáncer es un problema frecuente en la práctica clínica. En la literatura, se informó de que los pacientes con cáncer tenían un riesgo hasta 12 veces mayor de desarrollar TEV a los 6 meses que aquellos sin neoplasias13.
Aunque no son ampliamente conocidas, la nefritis, el síndrome nefrótico y la nefrosis también son enfermedades típicas que suponen un riesgo de TEV, lo que coincide de forma similar con los resultados de este estudio14,15. La aparición de episodios trombóticos en las enfermedades renales se debe muy probablemente al desequilibrio de los factores pro/antitrombóticos y pro/anticoagulantes15.
Una de las enfermedades más comunes de los sistemas urinario y respiratorio son las infecciones. Las infecciones del tracto urinario (ITU) tienen una incidencia a lo largo de la vida del 50-60% en mujeres adultas, mientras que las infecciones respiratorias son extremadamente comunes en toda la población16,17. Existe literatura previa sobre el tema. Junto con otras infecciones agudas, las ITU y las infecciones del tracto respiratorio fueron factores de riesgo probados de TEV en un estudio de población realizado en el norte de Dinamarca, lo que coincide con nuestros resultados17. El mecanismo que subyace a este fenómeno no ha sido del todo esclarecido, pero probablemente esté asociado a la activación de las plaquetas causada por la inflamación18.
Los síntomas inespecíficos incluyen una variedad de síntomas de todos los sistemas. En este análisis, la presentación con síntomas aumentó el riesgo de TEV en un 47-49%. Nuestra hipótesis detrás de este fenómeno es que estos pacientes podrían haber presentado comorbilidad y, por lo tanto, tener un alto riesgo inicial de TEV. Además, los síntomas podrían haber instado a los médicos a solicitar pruebas adicionales y muchos de estos casos probablemente se diagnosticaron de forma incidental.
De forma similar a esta investigación, otros estudios informaron de un aumento significativo del riesgo y la incidencia de TEV en los pacientes con anemia hemolítica autoinmune y aplásica19,20.
Los factores de riesgo cardiovascular también se asocian a la incidencia de TEV21. Esto es un hecho bien conocido, ya que la relación entre las enfermedades cardiovasculares, incluida la insuficiencia cardiaca, y el TEV está bien establecida22. Los resultados de este estudio también han confirmado esta asociación.
Las enfermedades del tracto genital femenino y la EPOC no se asociaron significativamente con episodios de TEV. Sin embargo, las enfermedades del tracto genital femenino podrían causar niveles elevados de estrógenos o requerir tratamiento hormonal, lo que daría lugar a complicaciones trombóticas posteriores23. Además, en una cohorte poblacional, se observó que los pacientes con EPOC presentaban un riesgo de TEV 2 veces superior al de la población general24.
También hemos examinado los efectos de los fármacos en el riesgo de TEV. Los agentes antidiabéticos fueron protectores del TEV, lo que también se ha confirmado en la literatura. Una revisión sistemática de 2022 halló que la metformina reducía el riesgo de TEV en un 22-58%25. Asimismo, los fármacos gastrointestinales disminuyeron el riesgo de TEV en 0,76 veces. Sin embargo, no hemos podido proporcionar una justificación científica para este resultado. Las quinolonas no fueron un factor de riesgo significativo de TEV. Sin embargo, se ha demostrado que las infecciones tratadas con antibióticos se asociaron a una incidencia 5,5 veces mayor de TEV en las 2 primeras semanas26. Por lo tanto, lo más probable es que las infecciones agudas sean una causa real del desarrollo de trombosis.
Nuestra investigación tiene algunas limitaciones que es necesario revelar. Utiliza datos y códigos de reclamaciones de seguros que podrían ser imprecisos, dando lugar a errores de codificación y clasificación y, a su vez, carecer de generalizabilidad a nivel global. Otra limitación se debe a la naturaleza retrospectiva del estudio. Además, existe la posibilidad de que se produzca una infranotificación de la TEV, ya que podrían haberse pasado por alto a los pacientes asintomáticos. La exclusión manual de las variables clínicamente no relacionadas puede haber restringido el alcance del análisis. Nuestro trabajo incluyó un gran número de pacientes y variables, lo que puede constituir una fortaleza y una desventaja. Los resultados de este estudio podrían ser estadísticamente significativos, debido al gran tamaño de la muestra, sin ser clínicamente significativos. Por otra parte, el elevado número de pacientes incluidos y la potencia estadística resultante permitieron evaluar los casos de TEV tras la RTU, que son poco frecuentes. Además, en el presente análisis se utilizaron modelos muy avanzados de selección de variables escalonada y LASSO, lo que aumentó la fiabilidad de los resultados. Por último, hasta donde sabemos, se trata del primer artículo sobre este importante tema con una potencia estadística significativa.
ConclusionesLa RTU es un procedimiento diagnóstico habitual en el CV. Entre los factores preoperatorios de riesgo de TEV después de una RTU se encuentran las neoplasias malignas, nefritis, síndrome nefrótico, nefrosis, enfermedades del sistema urinario, síntomas inespecíficos, enfermedades del sistema respiratorio y enfermedades cardiovasculares. Las variables protectoras del TEV son los fármacos antidiabéticos y los fármacos gastrointestinales. Estos hallazgos podrían facilitar la decisión clínica sobre la aplicación de la tromboprofilaxis en los pacientes adecuados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Bases de datos Merative™ Marketscan Research.