Editado por: Andrea Gallioli
Fundació Puigvert
Marco Moschini
San Raffaele Hospital
Última actualización: Junio 2025
Más datosLas mutaciones del FGFR3, asociadas principalmente al subtipo papilar luminal (LumP) se encuentran entre las alteraciones genómicas más comunes en el cáncer urotelial (CU). Gracias al desarrollo de los inhibidores del receptor del factor de crecimiento de fibroblastos (FGFR), el tratamiento del CU se acerca cada vez más a la medicina personalizada. Se realizó una revisión sistemática utilizando Medline y publicaciones de congresos científicos según las directrices Preferred Reporting Items for Systematic Reviews and Meta-analyses (PRISMA) para evaluar el papel potencial de los inhibidores del FGFR utilizados en combinación con otras terapias para el tratamiento del CU. Se llevó a cabo una búsqueda sistemática en ClinicalTrials.gov para identificar ensayos clínicos en curso. En total, 11artículos a texto completo, 10resúmenes de congresos y 5ensayos fueron identificados. Según los estudios BLC2001 y THOR, erdafitinib es el único inhibidor de FGFR1-4 aprobado para el CU metastásico con alteraciones susceptibles en FGFR2/3 tras quimioterapia basada en platino.
Según los datos correspondientes a la cohorte 2 del ensayo THOR, erdafitinib no debe recomendarse en pacientes aptos para recibir tratamiento con inhibidores de puntos de control inmunitario (ICI) y que no lo hayan recibido previamente. Actualmente, un ensayo de fase 3 está evaluando el sistema de administración intravesical (TAR210) en el cáncer de vejiga no músculo-invasor de riesgo intermedio con alteraciones del FGFR (MoonRISe-1). Los estudios preclínicos indican que podrían considerarse estrategias basadas en terapias combinadas para mejorar la eficacia de los inhibidores del FGFR en pacientes con CU. Nueve ensayos de fase 1b/2 están enfocados a evaluar el papel de los inhibidores del FGFR en combinación con ICI, quimioterapia o enfortumab vedotina. En el contexto de la enfermedad metastásica, estudios preliminares han revelado resultados prometedores de estas combinaciones (por ejemplo, los estudios NORSE y FORT-2). Sin embargo, ningún estudio de fase 3ha finalizado, por lo que actualmente no existen datos de nivel 1 con resultados a largo plazo que respalden la combinación de inhibidores del FGFR con ICI, quimioterapia o terapias dirigidas. Aún se requiere un mejor entendimiento de los diferentes mecanismos de acción de los inhibidores de las vías de señalización del FGFR, la selección óptima de pacientes y los enfoques terapéuticos.
FGFR3 mutations are among the most frequent genomic alterations in urothelial cancer (UC) being mainly associated with the luminal papillary (LumP) subtype. With the establishment of fibroblast growth factor receptor (FGFR) inhibitors, the treatment of UC is now shifting more and more towards personalized medicine. A systematic review using Medline and scientific meeting records was carried out according to the Preferred Reporting Items for Systematic Review and Meta-analyses guidelines to assess the potential role of FGFR inhibitors in combination with additional therapies for the management of UC. Ongoing trials were identified via a systematic search on ClinicalTrials.gov. A total of 11full-text papers, 10congress abstracts, and 5 trials on ClinicalTrials.gov were identified. Following the BLC2001 and THOR study, erdafitinib is the only approved FGFR1-4 inhibitor for metastatic UC with susceptible FGFR2/3 alterations following platinum-based chemotherapy. According to the THOR data of cohort 2, erdafitinib should not be recommended in patients who are eligible for and have not received prior immune checkpoint inhibitors (ICIs). One phase 3 trial is currently evaluating the intravesical device system (TAR210) in FGFR-altered intermediate non-muscle invasive bladder cancer (MoonRISe-1). Preclinical evidence suggests that combination-based approaches could be considered to improve the efficacy of FGFR inhibitors in patients with UC. Nine phase 1b/2 trials are focusing on the combination of FGFR inhibitors with ICIs, chemotherapy, or enfortumab vedotin. In metastatic disease, some preliminary analyses have reported promising results from these combinations (e.g. NORSE and FORT-2 trial). However, no phase 3 trial is terminated, so there is currently no level 1 evidence with long-term outcomes to support the combination of FGFR inhibitors with ICIs, chemotherapy, or targeted therapies. A better understanding of the different mechanisms of action to inhibit FGFR signaling pathways, optimal patient selection and treatment approaches is still needed.
El cáncer de vejiga es el noveno cáncer más frecuente en el mundo, con más de 550.000 nuevos casos diagnosticados y más de 220.000 muertes al año en todo el mundo1. El cáncer de vejiga afecta de 3 a 5 veces más a los hombres que a las mujeres, lo que lo convierte en el sexto cáncer más común entre los hombres de todo el mundo1,2. El cáncer de vejiga no musculoinvasivo (CVNMI) representa el 70-75% de todos los nuevos casos diagnosticados de cáncer urotelial; el 20% presenta cáncer de vejiga musculoinvasivo (CVMI) y el 5-10% enfermedad metastásica primaria3. Las tasas de supervivencia son muy variables y dependen del estadio del tumor. Mientras que la tasa de supervivencia a 5 años para el CVNMI se sitúa en torno al 70%, esta desciende al 36% para el CVMI y al 6% para la enfermedad metastásica4,5. La introducción de los inhibidores de puntos de control inmunitario en 2017ha revolucionado el tratamiento de la enfermedad metastásica6 y, gracias al desarrollo de terapias dirigidas, como los anticuerpos conjugados a fármacos y los inhibidores del receptor del factor de crecimiento de fibroblastos (FGFR), el tratamiento del cáncer de vejiga está cada vez más orientado hacia la medicina personalizada7,8.
Vías de señalización e inhibición del FGFRLos FGFR se caracterizan por ser un subgrupo de receptores tirosina cinasa que están codificados por los genes FGFR1, FGFR2, FGFR3, FGFR4 y FGFRL19. Los FGFR constan de un dominio intracelular de tirosina cinasa, un dominio extracelular y un dominio transmembrana que conecta los 2dominios. El dominio extracelular contiene 3dominios de tipo inmunoglobulina (D1, D2 y D3)10. Los dominios D2 y D3 se caracterizan por servir de bolsillos de unión a ligandos, como los factores de crecimiento de fibroblastos (FGF). Los dominios D1 y D2 son importantes para la unión a proteoglicanos de heparán sulfato, los cuales desempeñan una función esencial en la estabilización11. Cuando los FGF se unen al receptor monomérico, se produce un cambio conformacional en el receptor que induce la dimerización del FGFR y, con ello, la fosforilación del dominio tirosina cinasa intracelular, provocando la activación del receptor12. Con esta activación se estimulan diferentes cascadas de señalización intracelular. La fosforilación del FGFR activa el sustrato 2 del FGFR (FRS2), que puede, a su vez, activar las vías de señalización Ras-MAPK (proteína del virus del sarcoma de rata/proteína cinasa activada por mitógenos) y PI3K-Akt-mTOR (fosfoinositida 3-cinasa/AKT/destino de rapamicina en mamíferos) a través de SOS1 (sevenless 1) y GRB2/GAB1 (proteína adaptadora del growth factor receptor-bound protein 2/proteína 1 de anclaje asociada a GRB2), respectivamente13-15. Además, la fosforilación del dominio intracelular de tirosina cinasa también puede conducir a la activación de las vías PLCγ/PKC (fosfolipasa Cγ/proteína cinasa C) y JAK/STATs (cinasas Janus/transductores de señales y activadores de la transcripción)16-19. Esta activación regula diferentes mecanismos celulares como la supervivencia celular, la apoptosis, la migración, la proliferación, la evasión tumoral a la respuesta inmunológica y la angiogénesis18,20,21. La figura 1 presenta una visión general de la vía de señalización del FGFR.
Vías de señalización e inhibición del FGFR. La unión del FGFR a ligandos análogos induce la dimerización del receptor, la cual puede estabilizarse mediante proteoglicanos de heparán sulfato (HSPG). Además, la unión del FGF-FGFR estimula la fosforilación intracelular de dominios cinasa del receptor, como el sustrato 2 del FGFR (FRS2), la fosfolipasa C gamma (PLCγ) y JAK, desencadenando 4vías intracelulares distintas que incluyen RAS-RAF-MEK-MAPK, PI3K-AKT-mTOR, JAK-STAT y PLCγ. La sobreactivación de estas vías regula la metástasis de las células tumorales, estimula la proliferación y diferenciación celular, inhibe la apoptosis, favorece la invasión tumoral y la metástasis y potencia la evasión tumoral a la respuesta inmunológica. La inhibición de la vía FGF/FGFR puede producirse a diferentes niveles. 1) Anticuerpos monoclonales (mAb) o trampas de FGFR que impiden la unión FGF/FGFR en el dominio extracelular y los inhibidores TK (TKI) de moléculas pequeñas que se dirigen al sitio de unión ATP en el dominio TK intracelular. 2) Los TKI selectivos pueden dirigirse específicamente a los dominios cinasa de FGFR. 3) Los TKI no selectivos se dirigen a varios receptores de factores de crecimiento (VEGFR, KIT y PDGFR). Actualmente se están realizando estudios clínicos sobre los mAbs contra FGFR3 (vofatamab), los TKI selectivos pan-FGFR (erdafitinib, rogaratinib, infigratinib, pemigatinib, futibatinib) y los TKI no selectivos dirigidos contra el FGFR 1/2/3 y otros receptores de factores de crecimiento (dovitinib, derazantinib) en el cáncer de vejiga.
Existen diferentes elementos que intervienen en la señalización del FGFR y también diferentes mecanismos de inhibición de la vía. Los anticuerpos monoclonales (mAb) y las trampas de ligandos de FGF interfieren inhibiendo la unión directa de FGF a FGFR. Al dirigirse a ligandos específicos de FGF o a isoformas del receptor, los mAb, como vofatamab y bemarituzumab, parecen ofrecer resultados prometedores en la inhibición de las vías de señalización del FGFR14,22,23. Las trampas del FGF, como la FP-1039, son moléculas que pueden unirse al FGF en el entorno extracelular, impidiendo la unión de FGF a FGFR14,24. Además, también se puede inhibir la señalización de FGFR actuando sobre el dominio intracelular de la tirosina cinasa mediante inhibidores selectivos de la tirosina cinasa (TKI). La anterior ha sido la forma más estudiada, con inhibidores como erdafitinib, rogaratinib, infigratinib, pemigatinib y futibatinib14. Erdafitinibl es un fármaco inhibidor pan-FGFR clínicamente aprobado para el carcinoma urotelial. Este puede unirse al dominio extracelular del FGFR, bloquear las fosforilasas e inhibir la transducción de señales25,26. Además de los TKI selectivos, también existen TKI no selectivos, como dovitinib y derazantinib, que se están estudiando actualmente en diferentes estudios clínicos14. En lugar de inhibir directamente la vía de señalización del FGFR, estos TKI no selectivos se dirigen a otros receptores de factores de crecimiento diferentes, como el receptor del factor de crecimiento endotelial vascular (VEGFR), c-KIT y el receptor del factor de crecimiento derivado de plaquetas (PDGFR)27. Si bien esta terapia podría incrementar la eficacia del tratamiento, sus desventajas incluyen el aumento de la toxicidad y la bioactividad inadecuada frente al FGFR como componente clave de señalización28,29. En la figura 1 se resumen los diferentes mecanismos de acción de la inhibición de las vías de señalización del FGFR.
Alteraciones de los genes que codifican el FGF y el FGFR en el cáncer urotelialEn el CVNMI de bajo riesgo, las mutaciones de FGFR3 son una de las alteraciones más frecuentes, estando presentes en cerca del 70% de los casos de cáncer de vejiga30. Sin embargo, las mutaciones somáticas de FGFR3 también se encuentran entre las características genéticas más comunes del CVMI, al menos en el 15-20% de los casos31,32. Las alteraciones del FGFR están relacionadas con los subtipos moleculares de CVNMI y CVMI. En el consenso de clasificación molecular de CVMI del grupo de Kamoun33, las alteraciones genómicas del FGFR3 (55%) se asociaron exclusivamente con el subtipo papilar luminal (LumP), lo que representa el 24% de las muestras de CVMI. Según la clasificación transcriptómica del CVNMI, UROMOL202134, las mutaciones frecuentes del FGFR se observaron en la clase 1 (54%) y en la clase 3 (94%). Cabe destacar que la mayoría de los tumores de UROMOL2021 (93%) se clasificaron como LumP, según las 6clases moleculares del CVMI obtenidas por consenso34.
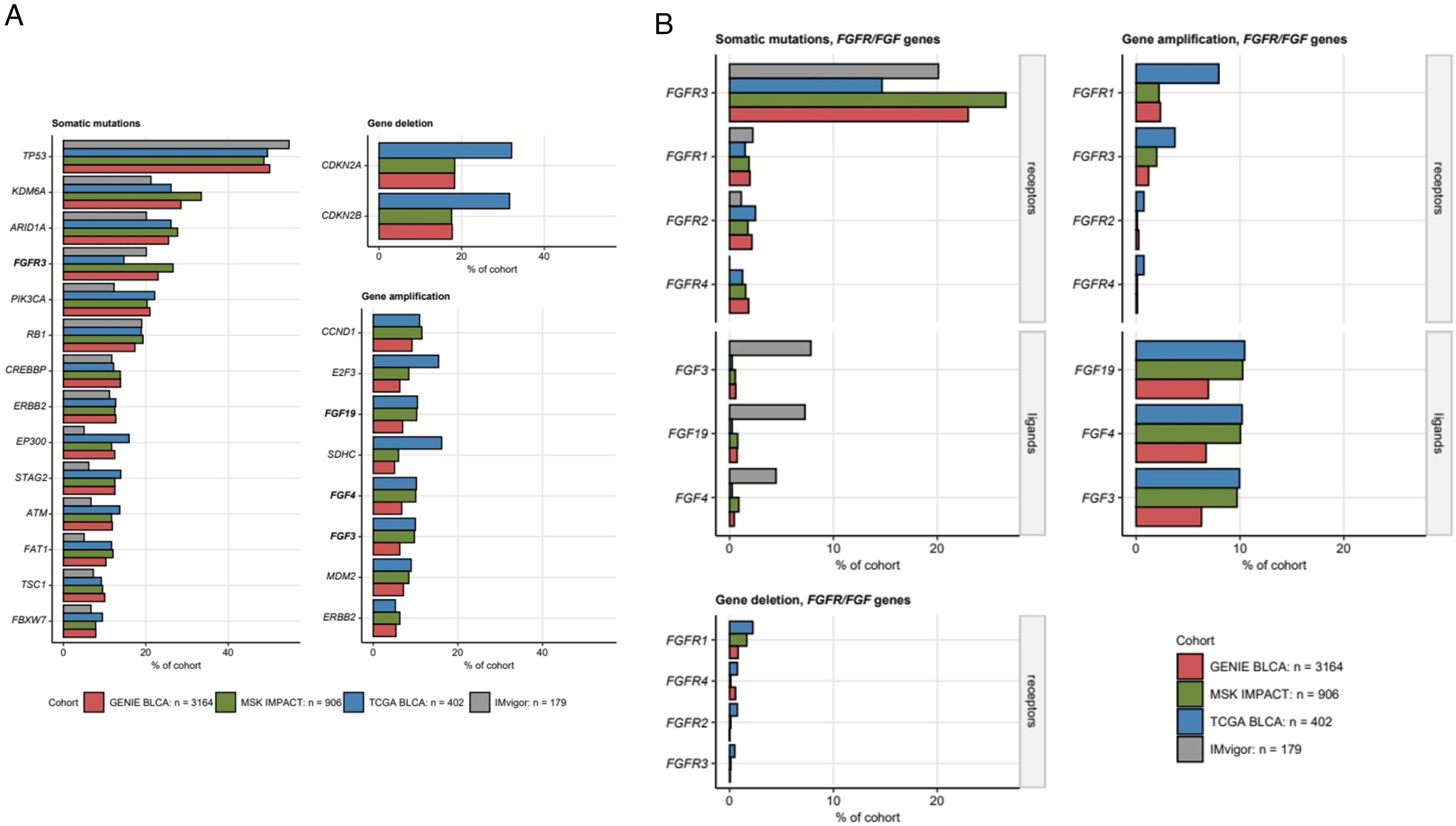
Con el fin de obtener más información sobre los efectos de las alteraciones genéticas y la modulación de la expresión de los genes que codifican para FGF y FGFR además de FGFR3 en el cáncer urotelial sobre la biología tumoral, la respuesta al tratamiento y los resultados clínicos, utilizamos 4poblaciones distintas de pacientes con carcinoma urotelial (GENIE BLCA35, MSK-IMPACT36, TCGA BLCA37,38 y la cohorte de IMvigor21039). Los conjuntos de datos de GENIE BLCA se obtuvieron de la API de cBioportal con herramientas proporcionadas por el paquete cbioportalR (http://cbioportal.org) y se formatearon con scripts R desarrollados internamente. Los conjuntos de datos de la cohorte TCGA BLCA37,38 se obtuvieron del repositorio cBioportal con scripts desarrollados internamente para 402 pacientes con cáncer urotelial predominantemente musculoinvasivo. Los conjuntos de datos IMvigor se obtuvieron del paquete R IMvigor210CoreBiologies. Los conjuntos de datos del estudio de MSK-IMPACT se descargaron de cBioportal y se implementaron en R con scripts internos. Los archivos JSON con las estructuras de dominio de las proteínas FGFR1 (ID: P11362), FGFR2 (ID: P21802), FGFR3 (ID: P22607) y FGFR4 (ID: P22455) se descargaron de UniProt y se procesaron con el paquete Jsonlite40. En el material complementario se ofrece una descripción detallada del análisis estadístico y bioinformático.
Las mutaciones somáticas de FGFR3, halladas en un 15-27% de las muestras de cáncer, también se encuentran entre las características genéticas más comunes de los CVMI. Las mutaciones somáticas de los otros receptores FGFR1, FGFR2 y FGFR4 fueron menos frecuentes (presentes en hasta el 2,5% de las muestras de cáncer). Las amplificaciones de los genes FGF3, FGF4 y FGF19 en los cánceres uroteliales provienen de la multiplicación de la región cromosómica 11q13, que también codifica un oncogén esencial, el CCDN1. Se detectaron amplificaciones de FGF3, FGF4 y FGF19 en el 6,3-10% de los especímenes (fig. 2). La gran mayoría de las mutaciones somáticas de FGFR1, FGFR2, FGFR3 y FGFR4 se clasificaron como mutaciones con cambio de sentido causadas por polimorfismos de un solo nucleótido (SNP). En particular, en el caso de FGFR3, los residuos de proteína afectados se ubicaban con frecuencia fuera de los dominios tipo Ig responsables de la unión al ligando y junto a los dominios cinasa, vitales para la activación de la cascada de señalización (fig. 3). La co-ocurrencia y exclusividad de las características genéticas se investigó mediante el índice de similitud de Jaccard para pares de alteraciones genéticas en muestras de cáncer urotelial. Este análisis reveló un escaso solapamiento entre las mutaciones somáticas de FGFR3 y otras alteraciones comunes, como las mutaciones de TP53 y RB1, la amplificación de la región cromosómica 11q13 caracterizada por variantes en el número de copias de FGF3/4/19 y CCND1, así como la deleción de la región cromosómica 9p21 con los genes MTAP, CDKN2A y CDKN2B (fig. 4).
A) Mutaciones somáticas y variaciones en el número de copias de genes más comunes en el cáncer urotelial. Los diagramas de barras muestran los porcentajes de mutaciones somáticas, deleciones y amplificaciones génicas presentes en al menos el 5% de las muestras de cáncer de todas las cohortes investigadas (GENIE BLCA, MSK IMPACT, TCGA BLCA e IMvigor. Nota: no se disponía de datos de amplificación y deleción génica para la cohorte IMvigor). Las alteraciones que afectan a los genes codificadores de FGF y FGFR se destacan en negrita. El número de muestras de cáncer analizadas se indica en el título del gráfico. B) Frecuencia de mutaciones somáticas y alteraciones del número de copias de los genes que codifican FGF y FGFR. Los porcentajes de mutaciones somáticas, deleciones y amplificaciones de los genes que codifican FGF y FGFR en la cohorte investigada se presentan en diagramas de barras. Los datos de amplificación y deleción no estaban disponibles para la cohorte IMvigor. El número de muestras de cáncer analizadas se indica en el título del gráfico.
A) Frecuencia de mutaciones somáticas en los genes FGFR1, FGFR2, FGFR3 y FGFR4, según el tipo de mutación. B) Frecuencia de mutaciones somáticas en los genes FGFR1, FGFR2, FGFR3 y FGFR4, según el tipo de variante. C) Frecuencia de mutaciones somáticas en los genes FGFR1, FGFR2, FGFR3 y FGFR4, según su dominio proteico. Las mutaciones en los genes FGFR1, FGFR2, FGFR3 y FGFR4 en las cohortes GENIE BLCA y TCGA BLCA se clasificaron por tipo de variante. Su frecuencia se expresó en porcentajes de muestras de cáncer y se presentó en diagramas de barras. El número de muestras de cáncer analizadas se indica en el gráfico.
DNP: polimorfismo de 2nucleótidos; ONP: polimorfismo de oligonucleótidos; SNP: polimorfismo de un nucleótido.
A) Co-ocurrencia de las alteraciones genéticas más comunes en el cáncer urotelial. Se investigó la co-ocurrencia de las alteraciones genéticas más comunes en el cáncer urotelial (al menos el 5% de las muestras de cáncer) en las cohortes GENIE BLCA, MSK IMPACT y TCGA BLCA mediante MDS (escalado multidimensional) bidimensional a partir del índice de similitud de Jaccard para pares. Los resultados del MDS se visualizan en gráficos de dispersión con cada alteración genética representada como un punto. El color del punto indica el tipo de alteración (mutación somática, deleción, amplificación) y el tamaño del punto representa la frecuencia de la alteración en el conjunto de datos. Nota: se espera que las características genéticas que aparecen cercanas entre sí coincidan en una fracción elevada de muestras de cáncer. El número total de muestras se indica en los títulos de los gráficos. B) Co-ocurrencia de alteraciones genéticas seleccionadas en el cáncer urotelial. Se investigó la co-ocurrencia de las alteraciones genéticas más frecuentes en el cáncer urotelial (al menos el 5% de las muestras de cáncer) en las cohortes GENIE BLCA, MSK IMPACT y TCGA BLCA mediante los índices de similitud de Jaccard. La significación estadística de la co-ocurrencia se evaluó mediante pruebas bootstrap ajustadas a la tasa de falso descubrimiento. La frecuencia de las muestras con y sin alteraciones genéticas se presenta con tablas de contingencia en mapas de calor para los pares de características genéticas seleccionados. Los porcentajes y recuentos de muestras dentro de los conjuntos de muestras totales se indican en los mosaicos del mapa de calor. Los valores J y p se presentan en las leyendas de los gráficos. C) Co-ocurrencia de alteraciones genéticas de los genes que codifican FGF y FGFR en el cáncer urotelial. Se investigó la co-ocurrencia de mutaciones somáticas, deleciones y amplificaciones de genes que codifican FGF y FGFR en las cohortes GENIE BLCA, MSK IMPACT y TCGA BLCA mediante MDS (escalado multidimensional) bidimensional a partir del índice de similitud de Jaccard para pares. Los resultados del MDS se visualizan en gráficos de dispersión con cada alteración genética representada como un punto. El color del punto indica el tipo de alteración (mutación somática, deleción, amplificación) y el tamaño del punto representa la frecuencia de la alteración en el conjunto de datos. Nota: se espera que las características genéticas que aparecen cercanas entre sí coincidan en una fracción elevada de muestras de cáncer. El número total de muestras se indica en las leyendas de los gráficos. D) Co-ocurrencia de alteraciones genéticas de los genes que codifican FGF y FGFR en el cáncer urotelial. Se investigó la co-ocurrencia de mutaciones somáticas, deleciones y amplificaciones de genes que codifican FGF y FGFR en las cohortes GENIE BLCA, MSK IMPACT y TCGA BLCA mediante MDS (escalado multidimensional) bidimensional a partir del índice de similitud de Jaccard para pares. Los resultados del MDS se visualizan en gráficos de dispersión con cada alteración genética representada como un punto. El color del punto indica el tipo de alteración (mutación somática, deleción, amplificación) y el tamaño del punto representa la frecuencia de la alteración en el conjunto de datos. Nota: se espera que las características genéticas que aparecen cercanas entre sí coincidan en una fracción elevada de muestras de cáncer. El número total de muestras se indica en las leyendas de los gráficos.
Es interesante señalar que, en cuanto a la corregulación de la expresión de los genes que codifican FGF y FGFR, se observó que los niveles de ARNm de FGFR1 y FGFR3 estaban asociados negativamente; esta asociación era débil pero significativa. En concreto, el aumento de la expresión de FGFR1 en el tejido canceroso se correlacionó significativamente con la regulación al alza de los genes que codifican para múltiples ligandos de FGF (FGF1, FGF2, FGF5, FGF7, FGF9, FGF10 y FGF18). Sin embargo, este fenómeno no se produjo en el caso de FGFR3 (fig. 5). En un análisis de expresión génica diferencial de cáncer con y sin mutaciones en el gen FGFR3, observamos que la presencia de mutaciones en FGFR3 se traducía en niveles significativa y considerablemente mayores de ARNm en FGFR3. Por el contrario, en los casos de cáncer con mutaciones en FGFR3, la expresión de FGF2, FGF5 y FGF7 fue significativamente menor (fig. 6).
Correlación de los niveles de ARNm en los genes que codifican FGF y FGFR. Se investigó la correlación por pares de los niveles de ARNm transformados log2 de los genes que codifican FGF y FGFR en las cohortes TCGA BLCA e IMvigor mediante la prueba de Pearson ajustada a la tasa de descubrimiento falso. Los coeficientes de correlación r para pares de genes significativos se representan en gráficos de burbujas. El color de los puntos indica la correlación. El tamaño de los puntos representa los valores absolutos de r. Los números de las muestras de cáncer analizadas se muestran en los pies de los gráficos.
Expresión de los genes que codifican FGF y FGFR en cánceres uroteliales estratificados por la presencia de mutaciones de FGFR3. Las diferencias en la expresión de los genes que codifican FGF y FGFR entre los cánceres con y sin mutaciones somáticas en el gen FGFR3 se evaluaron mediante una prueba t de 2colas con la medida de tamaño del efecto d de Cohen en el TCGA BLCA e IMvigor. Los valores p se corrigieron con el método de la tasa de falso descubrimiento (FDR). Los genes regulados diferencialmente se identificaron como aquellos pFDR <0,05 y con un nivel de expresión génica al menos 1,5 veces superior en las muestras mutadas en comparación con las muestras de tipo salvaje (WT). A) Los valores pFDR y las estimaciones de las diferencias (log2 fold-change) en los niveles de expresión génica entre las muestras mutadas y las muestras WT se presentan en gráficos de volcán. Cada punto representa un único gen. Los colores de los puntos indican cambios significativos y regulation sign, y los genes regulados diferencialmente se etiquetan con sus símbolos. La significación y los umbrales de significación y fold-change de la expresión génica diferencial se representan como líneas discontinuas. Los números de muestras de cáncer analizadas se indican en el gráfico. B) Los niveles de ARNm transformados en log2 para genes que se encuentran regulados diferencialmente en ambas cohortes se presentan en diagramas de cajas. La mediana de los valores de expresión con su rango intercuartílico se representa como cajas y bigotes superiores al 150% de los rangos intercuartílicos. Las observaciones individuales se visualizan como puntos. Los tamaños del efecto y los valores p se muestran en los títulos de los gráficos. El número de muestras de cáncer analizadas se indica en los ejes X.
Centrándonos en el consenso de clasificación molecular del CVMI, se observó un enriquecimiento significativo de mutaciones de FGFR3 en la clase LumP (TCGA: 33%, IMvigor: 52% de los especímenes). En la cohorte TCGA, las amplificaciones de los genes FGF3, FGF4 y FGF19 resultantes de la multiplicación de la región cromosómica 11q13 se encontraron en los cánceres LumP (18-19%), ricos en estroma (9,6 a 12%) y basales/escamosos (8,8% de los especímenes) (fig. 7).
Alteraciones de los genes que codifican FGF y FGFR, según el consenso de clases moleculares del cáncer urotelial. Las diferencias en la frecuencia de mutaciones somáticas y variaciones en el número de copias de los genes que codifican FGF y FGFR entre las clases moleculares establecidas por consenso se evaluaron mediante la prueba del tamaño del efecto estadístico V de Cramer. Los valores de p se corrigieron para comparaciones múltiples mediante la tasa de descubrimiento falso. Nota: la información sobre variaciones en el número de copias no estaba disponible para la cohorte IMvigor. A) Los porcentajes de muestras de cáncer en las clases moleculares establecidas por consenso se visualizan en el gráfico. La significación estadística de la diferencia en la distribución de clases entre las cohortes se evaluó mediante la prueba estadística del tamaño del efecto V de Cramer. El tamaño del efecto y el valor p se muestran en el título del gráfico. El número total de muestras de cáncer se indica en el eje Y. B) Presencia/ausencia de alteraciones genéticas seleccionadas en las clases moleculares establecidas por consenso visualizadas en mapas de calor. En el eje Y se indican los nombres de las alteraciones con el tamaño del efecto y los valores p de las diferencias entre las clases moleculares. Los efectos significativos están resaltados en negrita. Los números de muestras de cáncer en las clases consensuadas se muestran en los títulos de los gráficos.
Ba/Sq: basal/escamoso; LumNS: luminal no especificado; LumP: luminal papilar; LumU: luminal inestable; NE-like: neuroendocrino; Stroma-rich: rico en estroma.
Dado que los TVMI LumP se asocian a una firma FGFR3 fuertemente activada, estos albergan mutaciones más frecuentes de KDM6A y se presentan en pacientes más jóvenes (<60 años), con tasas más bajas de enfermedad extravesical y las mejores tasas de supervivencia en comparación con las otras clases moleculares de TVMI33,34. Sin embargo, los tumores LumP se caracterizan por ser «desiertos inmunitarios y estromales»41. La secuenciación del ARN unicelular reveló una mayor proporción relativa de células epiteliales en los cánceres uroteliales con mutaciones del FGFR3 que en los cánceres uroteliales FGFR3 de tipo salvaje (41,9% frente a 4,3%; p<0,001), mientras que las proporciones de células inmunitarias y estromales en los cánceres uroteliales con mutaciones del FGFR3 fueron significativamente inferiores a las de los cánceres uroteliales con FGFR3 de tipo salvaje42.
El impacto de las mutaciones en el FGFR3 y de las alteraciones genómicas en FGFR en el pronóstico del cáncer urotelial sigue siendo controvertido y parece depender de la línea terapéutica y de los agentes terapéuticos. Mientras que los pacientes con cáncer de vejiga y mutaciones en el FGFR3 muestran un pronóstico favorable con un grado tumoral bajo y enfermedad mayoritariamente papilar43, las mutaciones en FGFR3 podrían dar lugar a tasas más bajas de respuesta a la quimioterapia basada en platino, una menor supervivencia libre de recidiva en pacientes con cáncer urotelial localmente avanzado/metastásico (CUm)44 y una peor supervivencia global (SG) en comparación con los pacientes con FGFR de tipo salvaje tratados mediante inmunoterapia42. Analizando 4.035 muestras de cáncer urotelial con perfiles genómicos integrales mediante captura híbrida, los que tenían alteraciones del FGFR3 presentaban una carga mutacional tumoral inferior, una menor expresión del ligando de muerte programada y una mayor frecuencia de alteraciones genómicas en MDM2, por lo que se asocian a una ausencia de respuesta a los inhibidores de puntos de control inmunitario45.
Un análisis de emparejamiento por puntuación de propensión del ensayo IMvigor210 de fase 2 comparó la respuesta a los inhibidores de puntos de control inmunitario (ICI) entre pacientes con cáncer urotelial metastásico con mutación del FGFR3 y FGFR3 de tipo salvaje. En concreto, los pacientes con mutaciones en FGFR3 tuvieron peor SG en comparación con los pacientes con FGFR3 de tipo salvaje (HR=2,11; IC del 95%: 1,16-3,85; p=0,015) que recibían atezolizumab42. Esto podría deberse a que el cáncer urotelial con mutación del FGFR3 presenta un microambiente inmunosupresor más fuerte (menor infiltración inmunitaria, baja citotoxicidad de las células T) que el que tiene mutación del FGFR3 de tipo salvaje42. Sin embargo, los datos de la cohorte 2 del ensayo THOR no pudieron confirmar estos hallazgos. Al comparar erdafitinib con pembrolizumab en pacientes naive en tratamiento anti-PD-(L1) y en progresión tras una línea de tratamiento previa, no se detectaron diferencias en el criterio de valoración primario, la SG (10,9 frente a 11,1 meses, HR 1,18; IC 95%: 0,92-1,51)46. Por lo tanto, es posible que la mutación del FGFR3 no tenga un valor predictivo concluyente para la ausencia de respuesta a los ICI41,47.
Los beneficios clínicos de corta duración de los inhibidores del FGFR3 en monoterapia ponen de relieve la importancia del descubrimiento de terapias multidiana para futuros análisis combinatorios22. Debido a su posible sinergia, la terapia combinada con ICI e inhibidores del FGFR ha sido objeto de ensayos clínicos en curso. Como se ha mencionado anteriormente, se ha señalado que la disminución de la infiltración linfocitaria está asociada a las alteraciones del FGFR3 y los tumores que presentan un fenotipo luminal papilar están enriquecidos con estas alteraciones48. Las tasas de respuesta de los tumores LumP a la inmunoterapia son bajas (del 10 al 19%), lo que también se relaciona con peores resultados en pacientes con cáncer urotelial metastásico que han progresado tras la quimioterapia basada en platino49,50. Dado que la combinación de los inhibidores del FGFR y la inmunoterapia puede tener un efecto sinérgico, esta puede aumentar la activación de las células T y, de este modo, vencer la resistencia a los ICI51.
Adquisición de la evidenciaSe realizó una revisión sistemática de la bibliografía en PubMed (todo el tiempo hasta el 20 de junio de 2024) de acuerdo con la declaración Preferred Reporting Items for Systematic Reviews and Meta-analyses (PRISMA)52 (fig. 8). Además, se examinaron los informes de congresos de los últimos 5años desde la reunión anual de la American Society of Clinical Oncology (ASCO), ASCO Genitourinary Cancers (ASCO GU) y European Society of Medical Oncology (ESMO), hasta la reunión de ASCO 2024. Los estudios en curso se identificaron mediante una búsqueda sistemática en ClinicalTrials.gov. Los criterios de selección incluyeron estudios con pacientes con cáncer urotelial tratados con cualquier inhibidor del FGFR como monoterapia o en combinación con inmunoterapia o quimioterapia. Los resultados de la búsqueda se restringieron a estudios publicados en inglés. Las palabras clave de la búsqueda incluyeron «FGFRInhibitors», AND «urothelialcancer» AND «upperurinarytract» AND «clinicaltrial» OR acrónimos correspondientes. Se consideraron los informes más recientes de los estudios elegibles cuando las búsquedas dirigidas se realizaron después de la fecha de corte de la búsqueda en la base de datos. Se excluyeron los estudios que incluían revisiones o metaanálisis, investigación correlacional o preclínica no específica del cáncer urotelial (estudios pancáncer), fase clínica retrospectiva o indefinida, estudios que no evaluaban agentes terapéuticos dirigidos al FGFR en CVNMI, CVMI o CUm, e informes duplicados o de seguimiento o previos. Un total de 4autores (RP, NvC, JDS, JCV) participaron en el proceso de selección y, finalmente, 5autores (RP, NvC, JDS, JCV y AG) evaluaron los artículos incluidos.
Síntesis de la evidenciaCaracterísticas de los estudios incluidos en la revisión sistemáticaSe identificaron un total de 75 registros en la búsqueda bibliográfica, lo que dio lugar a un total de 10resúmenes de congresos de ASCO, ASCO-GU o ESMO53–62, 11artículos elegibles a texto completo en PubMed8,46,63–71 y 5ensayos clínicos en ClinicalTrials.org (NCT06263153, NCT04003610, NCT04294277, NCT03914794, NCT06319820).
Para los inhibidores del FGFR en monoterapia, se han publicado 10artículos a texto completo (2 de un ensayo de fase 3, 2estudios de fase 1b y 6ensayos de fase 2)8,46,64–71 y 4resúmenes de congresos con resultados provisionales57,59–61 y están en curso 3estudios (NCT04294277, NCT03914794, NCT06319820) (uno de fase 3, 2de fase 2). En cuanto a los inhibidores del FGFR en combinación con ICI, 6de 7 estudios investigan esta combinación en la enfermedad metastásica. De ellos, un ensayo se ha publicado como artículo de texto completo63, 2estudios de fase 2 están en curso (NCT04003610, NCT06263153) y se han publicado 4resúmenes de congresos con resultados provisionales (2 ensayos de fase 1b/2 y 2de fase 2)54,56,58,62. En un estudio de fase 1b se está evaluando actualmente la combinación de un inhibidor del FGFR y enfortumab vedotina y se han presentado ya resultados provisionales55. En un ensayo de fase 1b finalizado se ha evaluado la combinación de un inhibidor del FGFR con quimioterapia (docetaxel) en pacientes con CUm que han progresado tras una o más líneas previas de quimioterapia o menos de 12 meses desde la quimioterapia neoadyuvante53. La tabla 1 presenta información detallada de los estudios descritos anteriormente.
Sinopsis de estudios clínicos con inhibidores del FGFR como monoterapia o combinando inhibidores del FGFR con inhibidores de puntos de control inmunitarios o quimioterapia en cáncer urotelial
| Inhibición FGFR | Dirigido a | Vía de administración | Combinación | Estadio tumoral | Número de identificación | Cohortes de tratamiento | Pacientes inscritos (estimado) | Fase clínica | Estado actual /referencia |
|---|---|---|---|---|---|---|---|---|---|
| Erdafitinib | FGFR1/2/3/4 | Intravesical | - | TVNMI papilar de alto riesgoTVMI programado para CR pero rechaza o no es apto para QNA | NCT05316155 | 5 | 112 | 1 | Activo, reclutamiento, resultados provisionales59 |
| Erdafitinib | FGFR1/2/3/4 | Intravesical | - | TVNMI intermedio | NCT06319820(MoonRISe-1) | 2 | 540 | 3 | Activo, reclutamiento, sin resultados |
| Erdafitinib | FGFR1/2/3/4 | Oral | - | TVNMI riesgo intermedio+tumor marcador+RTU incompletaPapilar de alto riesgo (± CIS) con fallo a BCG | NCT04172675(THOR-2) | 3 | 107 | 2 | Activo, reclutamiento, resultados provisionales60,61 y (PMID 37871701) |
| Erdafitinib | FGFR1/2/3/4 | Oral | - | CUm con progresión tras Cx | NCT02365597(BLC2001) | 1 | 99 | 2 | Finalizado(PMID 31340094) |
| Erdafitinib | FGFR1/2/3/4 | Oral | - | CUm con progresión tras 1 o 2 tratamientos previos, al menos 1 con ICI (cohorte 1) o 1 tratamiento previo sin ICI (cohorte 2) | NCT03390504 (THOR) | 2 | 629 | 3 | Finalizado(PMID 37870920 y 37871702) |
| Erdafitinib | FGFR1/2/3/4 | Oral | Cetrelimab | CUm, no apto para, sin tto previo | NCT03473743(NORSE) | 2 | 125 | 2 | Activo, no reclutando, resultados provisionales58 |
| Erdafitinib | FGFR1/2/3/4 | Oral | Enfortumab Vedotina | CUm con progresión tras platino e ICI | NCT04963153 | 1 | 30 | 1b | Activo, reclutamiento, resultados provisionales55 |
| Pemigatinib | FGFR1/2/3 | Oral | - | CVNMI recurrente de riesgo bajo o intermedio | NCT03914794 | 1 | 43 | 2 | Activo, reclutamiento, sin resultados |
| Pemigatinib | FGFR1/2/3 | Oral | - | AdyuvanteAlto riesgo de recurrencia tras CR/(nefro)ureterectomía | NCT04294277 (PEGASUS) | 1 | 2 | 2 | Finalizado, sin resultados |
| Pemigatinib | FGFR1/2/3 | Oral | - | CUm con progresión tras ≥1 línea o no apto para platino | NCT0287714(FIGHT-201) | 2 | 263 | 2 | Finalizado(PMID 37956738) |
| Pemigatinib | FGFR1/2/3 | Oral | Pembrolizumab | CUm después de platino e ICI | NCT04003610(FIGHT-205) | 3 | 7 | 2 | Finalizado, sin resultados |
| Dovitinib | FGFR1/2/3 | Oral | - | CVNMI con fallo a BCG, no apto/rechaza CR | NCT01732107 | 1 | 13 | 2 | Finalizado(PMID 27932416) |
| Dovitinib | FGFR1/2/3 | Oral | - | CUm con progresión tras 1-3 regímenes de quimioterapia basada en platino o de combinación | NCT00790426 | 1 | 44 | 2 | Finalizado(PMID 25457633) |
| Rogaratinib | FGFR1/2/3/4 | Oral | - | CUm/CU localmente avanzado con ≥ 1 tratamiento previo de quimioterapia basada en platino | NCT03410693(FORT-1) | 2 | 175 | 2 | Finalizado(PMID 36240478) |
| Rogaratinib | FGFR1/2/3/4 | Oral | Atezolizumab | CUm/ CU localmente avanzado no tratado y no apto para cisplatino | NCT03473756(FORT-2) | 1 | 37 | 1b/2 | Activo, no reclutando, resultados provisionales56 |
| Infigratinib | FGFR1/2/3 | Oral | - | NeoadyuvanteCUTS de bajo grado y alto grado no elegibles para platino | NCT04228042 | 1 | 14 | 1b | Finalizado(PMID 38573872) |
| Infigratinib | FGFR1/2/3 | Oral | - | AdyuvanteCVMI de tracto superior (85% de los pacientes) o de vejiga (15%) de alto riesgo que rechazan o no son aptos para QNA basada en cisplatino | NCT04197986(PROOF-302) | 218 | 3 | Finalizado, resultados provisionales57 | |
| Infigratinib | FGFR1/2/3 | Oral | - | CUm refractario o no elegible para quimioterapia basada en platino | NCT01004224 | 1 | 67 | 1b | Finalizado(PMID 34782263) |
| Futibatinib | FGFR1/2/3/4 | Oral e intravenosa | Durvalumab | NeoadyuvantePacientes con CVMI y no aptos para cisplatino | NCT06263153 | 1 | 24 | 2 | Activo, no reclutando, sin resultados |
| Futibatinib | FGFR1/2/3/4 | Oral e intravenosa | Pembrolizumab | CUm sin tratamiento sistémico previo | NCT04601857 | 2 | 46 | 2 | Activo, no reclutando, resultados provisionales62 |
| Vofatamab | FGFR3 | Oral e intravenosa | Docetaxel | CUm con progresión tras 1 o más líneas previas de quimioterapia o progresión en <12 meses desde QNA | NCT02401542 (FIERCE-21) | 2 | 71 | 1b/2 | Finalizado, resultados provisionales53 |
| Vofatamab | FGFR3 | Oral e intravenosa | Pembrolizumab | CUm con fracaso a ≥ 1 línea de quimioterapia o recurrencia en ≤ 12 meses de QNA | NCT03123055(FIERCE-22) | 2 | 35 | 1b/2 | Finalizado, resultados provisionales54 |
| Derazantinib | FGFR1/2/3 | Oral e intravenosa | Atezolizumab | CUm con progresión con al menos 1 régimen de quimioterapia o ICI | NCT04046513 (FIDES-02) | 5 | 95 | 2 | Finalizado(PMID 38627238) |
TAR-210 es un sistema de administración intravesical diseñado para proporcionar la liberación local y de forma continua de erdafitinib en la vejiga durante 3 meses, limitando al mismo tiempo las toxicidades sistémicas en pacientes con CVNMI o CVMI y alteraciones de FGFR. En ESMO 2023 se presentaron los resultados preliminares de un estudio abierto y multicéntrico de fase 1 en el que se evalúa la seguridad y eficacia de TAR-210 en CVNMI. En pacientes con CVNMI de alto riesgo previamente tratados con bacilo Calmette-Guérin (BCG)/sin respuesta (cohorte 1), la tasa libre de recurrencia fue del 82%. Además, el 87% de los pacientes con CVNMI de riesgo intermedio y lesiones diana visibles antes del tratamiento (cohorte 3) lograron una respuesta completa. Además, TAR-210 fue bien tolerado, con una toxicidad sistémica limitada. En concreto, los efectos adversos de grado ≥2 relacionados con TAR-210 y la interrupción del tratamiento fueron infrecuentes, predominaron los efectos adversos de grado 1 en el tracto urinario. Estos resultados preliminares prometedores respaldan el inicio de estudios de fase 3 para estudiar TAR-210 en CVNMI con alteraciones de FGFR59.
El ensayo de fase 3 MoonRISe-1 (NCT06319820) iniciado recientemente está trabajando con pacientes con CVNMI de riesgo intermedio y alteraciones susceptibles del FGFR. Como criterio de valoración primario se compara la supervivencia libre de enfermedad entre TAR-210 y la quimioterapia intravesical elegida por el investigador (gemcitabina o mitomicina C). En este estudio, todos los tumores papilares visibles deben resecarse completamente antes de la aleatorización.
THOR-2 (NCT04172675) es un estudio multicohorte de fase 2 de erdafitinib, un inhibidor oral selectivo de la tirosina cinasa pan-FGFR, en pacientes con CVNMI, que incluye 3 cohortes distintas.
En la cohorte 1 se incluyeron 73 pacientes con CVNMI recurrente de riesgo alto tratado con BCG (solo enfermedad papilar, sin CIS) con alteraciones del FGFR y se comparó la supervivencia libre de recurrencia entre erdafitinib (6mg/día) y la quimioterapia intravesical de elección del investigador (gemcitabina o mitomicina C). Durante una mediana de seguimiento de 13,4 meses no se alcanzó la mediana de supervivencia libre de recurrencia para erdafitinib y fue de 11,6 meses para la quimioterapia intravesical. En el análisis final del estudio, la tasa de supervivencia libre de recurrencia a los 12 meses fue del 77% para erdafitinib y del 41% para la quimioterapia intravesical. Este beneficio observado en la RFS para erdafitinib fue consistente en todos los estadios tumorales y en el tratamiento previo con BCG (tratados con BCG frente a no respondedores a BCG). Sin embargo, la tolerabilidad de erdafitinib oral fue un factor problemático, ya que el 28,6% de los pacientes presentaron efectos adversos que condujeron a la interrupción del tratamiento.
La cohorte 2 corresponde a pacientes con CVNMI de alto riesgo no respondedores a BCG con alteraciones en FGFR3/2 que presentaban CIS, con o sin tumor papilar, y que rechazaron o no fueron elegibles para una cistectomía radical. Todos los pacientes recibieron erdafitinib oral continuo (6mg) una vez al día sin titulación ascendente en ciclos de 28 días. El primer análisis provisional mostró una tasa de respuesta completa (RC) del 100% a los 3 meses y del 75% a los 6 meses durante una mediana de seguimiento de 10 meses. Se produjeron efectos adversos relacionados con el tratamiento de grado ≥3 en el 40% de los casos, lo que condujo a la interrupción del tratamiento en el 20% de los 60 pacientes.
La cohorte 3 incluye pacientes con CVNMI de riesgo intermedio con alteraciones en FGFR3/2, con resección tumoral endoscópica completa dejando un tumor marcador (hasta 5-10mm). El criterio de valoración primario fue la RC, definida como la desaparición del tumor marcador sin aparición de nuevas lesiones. La tasa de RC de los pacientes que recibieron erdafitinib (6mg/día) fue del 75% (6 de 11 pacientes). Los efectos adversos relacionados con el tratamiento más frecuentes fueron hiperfosfatemia (n=9), diarrea (n=6), sequedad de boca (n=5), piel seca (n=3), disgeusia (n=3) y estreñimiento (n=3)61.
Enfermedad metastásicaLa fase 2 del ensayo BLC2001 (NCT02365597) de erdafitinib incluyó a pacientes con CUm y mutaciones en el gen FGFR3 o fusiones de FGFR2/3 que experimentaron progresión de la enfermedad tras la quimioterapia70. Tres cuartas partes de los 99 pacientes tenían enfermedad estable y se confirmó una ORR del 40%. Solo uno de los 22 pacientes que habían recibido inmunoterapia previamente obtuvo una respuesta al tratamiento, pero la tasa de respuesta a erdafitinib en este subgrupo fue del 59%. La mediana de SG fue de 11,3 meses (IC 95%: 9,7-15,2) y la mediana de supeervivencia libre de recurrencia fue de 5,5 meses (IC 95%: 4,0-6,0) en una mediana de seguimiento de 24 meses. En el 46% de los pacientes, los efectos adversos relacionados con el tratamiento fueron de grado 3 o superior. La hiponatremia (11%), la estomatitis (10%) y la astenia (7%) fueron los efectos adversos frecuentes de grado ≥ 370.
El ensayo aleatorizado de fase 3 THOR (NCT03390504) es un estudio confirmatorio, en el que la cohorte 1 evalúa si erdafitinib proporciona un beneficio en términos de supervivencia frente a la quimioterapia elegida por el investigador (docetaxel o vinflunina) en pacientes con cáncer urotelial metastásico y alteraciones susceptibles del FGFR3/2 que progresaron tras uno o 2 tratamientos previos, incluyendo inhibidores de puntos de control. De 266 pacientes, la mediana de supervivencia libre de recurrencia (5,6 meses frente a 2,7 meses; p<0,001) y de SG (12,1 meses frente a 7,8 meses; p=0,005) fue significativamente mayor con erdafitinib que con quimioterapia. La toxicidad relacionada con el tratamiento de grado ≥ 3 fue similar entre los 2grupos. Los efectos adversos relacionados con el tratamiento de grado 3 o superior más frecuentes fueron el síndrome de eritrodisestesia palmo-plantar (9,6%), la estomatitis (8,1%), la onicólisis (5,9%) y la hiperfosfatemia (5,2%) en el grupo de erdafitinib8. La cohorte 2 del ensayo THOR (NCT03390504) incluyó a 351 pacientes con alteraciones seleccionadas del FGFR, progresión de la enfermedad tras un tratamiento previo, naive a tratamiento anti-PD-(L)1. Los pacientes se asignaron aleatoriamente a erdafitinib (8mg) una vez al día con titulación ascendente guiada farmacodinámicamente a 9mg o pembrolizumab (200mg) cada 3 semanas.
El criterio de valoración primario no se alcanzó y no hubo diferencias en la mediana de SG (10,9 frente a 11,1 meses; HR 1,18; IC 95%: 0,92-1,51). La tasa de respuesta global fue del 40% y del 21,6% y la duración media de la respuesta fue de 4,3 y 14,4 meses para erdafitinib y pembrolizumab, respectivamente. El 64,7% y el 50,9% de los pacientes de los brazos de erdafitinib y pembrolizumab presentaron uno o más efectos adversos de grado 3-446.
PemigatinibCáncer de vejiga no musculoinvasivoEl pemigatinib es un inhibidor oral de la cinasa con una actividad inhibidora potente y selectiva72 de FGFR1, FGFR2 y FGFR3 y FGFR. Un ensayo de fase 2 (NCT03914794) está evaluando pemigatinib en pacientes con CVNMI con tumores recurrentes de riesgo bajo o intermedio. Los participantes recibirán pemigatinib durante 4-6 semanas antes del tratamiento estándar con RTU. El criterio de valoración primario será la RC determinada en la RTU.
Tratamiento adyuvantePEGASUS (NCT04294277) es un ensayo abierto, de fase 2, de un solo brazo, que evalúa la seguridad y la eficacia de pemigatinib como tratamiento adyuvante en pacientes con carcinoma urotelial de alto riesgo seleccionados molecularmente que han sido tratados con cirugía radical. Los pacientes recibirán tratamiento continuo con pemigatinib a una dosis diaria de 13,5mg. La duración del tratamiento es de 12 meses, hasta la recaída de la enfermedad o hasta una toxicidad inaceptable. Los pacientes de alto riesgo se definen como aquellos con cáncer urotelial de vejiga o UUT pT3-4 o pN1-3 tras cistectomía radical o nefroureterectomía radical confirmado histológicamente. Este ensayo ha finalizado.
Enfermedad metastásicaFIGHT-201 (NCT02872714) es un ensayo abierto de fase 2, de un solo brazo, que evalúa la eficacia y seguridad de pemigatinib en pacientes con carcinoma urotelial metastásico o irresecable previamente tratados y que presenten alteraciones del FGFR3. Los pacientes se estratificaron según las alteraciones del FGFR. La cohorte A incluyó a pacientes con mutaciones o fusiones o reordenamientos de FGFR3 y la cohorte B a pacientes con otras alteraciones del FGF/FGFR. Los pacientes recibieron 13,5mg de pemigatinib una vez al día de forma continua o intermitente hasta la aparición de toxicidad inaceptable o progresión. De los 260 pacientes, 107 presentaban mutaciones del FGFR3. En este grupo, la tasa de respuesta objetiva fue similar, independientemente de la modalidad de administración, continua (23,9%) o intermitente (24,6%). Por el contrario, pemigatinib tuvo una eficacia clínica limitada entre los pacientes de la cohorte B. Los efectos adversos relacionados con el tratamiento más frecuentes fueron diarrea (44,6%) y alopecia, estomatitis e hiperfosfatemia (42,7% cada uno)69.
DovitinibCáncer de vejiga no musculoinvasivoDovitinib (CHIR-258) es un potente inhibidor de la tirosina cinasa multidiana, activo por vía oral para FGFR1/2/3. Un ensayo de fase 2 de Hoosier Cancer Research Network GU12-157 evaluó la eficacia clínica de dovitinib (500mg una vez al día) por vía oral en pauta de 5 días y 2 días de descanso Q28D en CVNMI refractario a BCG con mutaciones en FGFR3. No se alcanzó el objetivo primario, con una tasa de RC a los 6 meses del 8%. La reducción de la dosis fue necesaria en el 77% (n=10). En resumen, la administración a largo plazo de dovitinib no fue factible debido a la frecuencia de efectos adversos relacionados con el tratamiento de grado 3/4 (fatiga, hipertrigliceridemia, hipertensión, estomatitis, hepatotoxicidad)68.
Enfermedad metastásicaUn ensayo de fase 2 (NCT00790426) incluyó a 44 pacientes con CUm y progresión tras 1-3 regímenes de quimioterapia con platino o quimioterapia combinada. Los pacientes recibieron 500mg de dovitinib una vez al día en una pauta de 5 días y 2de descanso. El estudio no alcanzó su objetivo primario, ya que la ORR fue baja, independientemente del estado de mutación del FGFR3 (0% en pacientes con mutación y 3,2% en pacientes con FGFR3 de tipo salvaje).
RogaratinibEnfermedad metastásicaFORT-1 es un ensayo abierto, aleatorizado, fase 2/3 que incluye a pacientes con carcinoma urotelial localmente avanzado o metastásico con alta expresión de ARNm de FGFR1/3 que progresaron tras ≥ 1 régimen previo con platino. Los pacientes recibieron rogaratinib (n=87) o quimioterapia (75mg/m2 de docetaxel, 175mg/m2 de paclitaxel o 320mg/m2 de vinflunina; n=88). La incorporación de os pacientes fue interrumpida antes de que pudiera iniciarse la fase 3 debido a la eficacia comparable de los tratamientos en el análisis provisional de la fase 2. La ORR fue del 20,7% (rogaratinib) y del 19,3% para la quimioterapia. La mediana de SG fue de 8,3 meses (rogaratinib) y 9,8 meses (quimioterapia). Con respecto a las alteraciones del FGFR3, estos pacientes mostraron una ORR del 52,4% con rogaratinib frente al 26,7% con quimioterapia. Así pues, las alteraciones del ADN del FGFR3 en asociación con la sobreexpresión del ARNm del FGFR1/3 podrían constituir un marcador favorable para predecir la respuesta al rogaratinib65.
InfigratinibTratamiento neoadyuvanteInfigratinib es un inhibidor selectivo de FGFR1-3 que presenta eficacia en el carcinoma urotelial avanzado con alteraciones de FGFR3. Un ensayo de fase 1b (NCT04228042) evaluó infigratinib como tratamiento neoadyuvante en 14 pacientes con CUTS localizado tratados mediante ureteroscopia o nefroureterectomía66. Se administraron 2 ciclos de 125mg de infigratinib una vez al día durante 21 días (ciclo de 28 días). De los 9 pacientes con alteraciones del FGFR3, 6 (66,7%) mostraron respuesta con una reducción del tamaño tumoral media del 67%. La preservación renal fue posible en 3 de los 5 pacientes con respuesta inicialmente programados para cirugía radical. La mediana de seguimiento en los pacientes que presentaron una respuesta al tratamiento fue de 24,7 meses66.
Tratamiento adyuvanteEl estudio PROOF-302 es un ensayo aleatorizado, doble ciego y controlado con placebo (NCT04197986) que incluye CVMI del tracto urinario superior (85% de los pacientes) o de vejiga (15%) de alto riesgo que ha sido extirpado quirúrgicamente con alteraciones susceptibles del FGFR3 y que rechazan o no son aptos para quimioterapia (neo)adyuvante basada en cisplatino. Los pacientes reciben infigratinib (125mg) por vía oral o placebo diariamente en el día 1-21 de un ciclo de 28 días hasta la progresión, toxicidad o muerte. En ASCO 202357 se presentó un análisis genómico sobre la prevalencia de alteraciones del FGFR3 en tejido primario de CVMI. Aunque las alteraciones genómicas del FGFR3 se producen con una frecuencia significativamente mayor en CUTS (hasta el 70%)74, solo se observaron alteraciones del FGFR3 en 119 de los 617 pacientes cribados para PROOF-302 (19%): 30% de carcinoma urotelial del tracto superior, 13% de carcinoma urotelial de vejiga y 9% de localización tumoral desconocida. Por lo tanto, el patrocinador detuvo el ensayo antes de tiempo57.
Enfermedad metastásicaEn un ensayo fase 1b (NCT01004224) participaron 67 pacientes con CUm refractarios o no aptos para quimioterapia basada en platino. Los pacientes recibieron 125mg diarios de infigratinib por vía oral (3 semanas, una semana de descanso). La ORR global fue del 25,4% y la tasa de control de la enfermedad del 64,2%, respectivamente. Infigratinib mostró una eficacia considerable en pacientes con CUm, con independencia de las líneas de tratamiento. La ORR fue del 30,8% en el contexto de primera línea (n=13) y del 24,1% para ≥2 líneas de tratamiento.
Los efectos adversos relacionados con el tratamiento de grado 3/4 más frecuentes fueron hiperlipasemia (10,4%), anemia (7,5%) e hiperfosfatemia (7,5%)64.
CombinacionesFutibatinib+durvalumabTratamiento neoadyuvanteEstá previsto realizar un ensayo de fase 2 para evaluar la combinación de futibatinib y durvalumab (NCT06263153) en pacientes con CVMI no aptos para cisplatino antes de programar una cistectomía radical, pero aún no se ha iniciado el reclutamiento. Los pacientes recibirán futibatinib por vía oral una vez al día (días 1-28) y durvalumab el día 1 de cada ciclo. El tratamiento se repetirá cada 28 días durante un máximo de 3 ciclos antes de la cistectomía radical.
Erdafitinib+cetrelimabEnfermedad metastásicaEl ensayo de NORSE58 fase 1b/2, evalúa erdafitinib en combinación con cetrelimab en el tratamiento de primera línea de pacientes con enfermedad metastásica no aptos para cisplatino con alteraciones susceptibles del FGFR (NCT03473743). Fueron aleatorizados 87 pacientes 1:1 a 8mg de erdafitinib una vez al día (con ajuste progresivo a 9mg) o a recibir 8mg de erdafitinib+cetrelimab (240mg) cada 2 semanas en los ciclos 1-4 y 480mg cada 4 semanas a partir de entonces. La tasa de respuesta objetiva para erdafitinib+cetrelimab fue del 54,5% (RC del 13,6%) y del 44,2% (RC del 2,3%) para erdafitinib en monoterapia. La tasa de SG a los 12 meses fue del 68% para erdafitinib+cetrelimab y del 56% para erdafitinib. Se produjeron efectos adversos relacionados con el tratamiento de grado ≥3 en el 45,5% (erdafitinib+cetrelimab) y el 46,5% (erdafitinib) de los pacientes. Los efectos adversos relacionados con el tratamiento (de cualquier grado) más frecuentes fueron hiperfosfatemia (68,9 frente a 83,7%), estomatitis (59,1 frente a 72,1%) y diarrea (45,5 frente a 48,8%) para erdafitinib+cetrelimab y erdafitinib en monoterapia58.
Pemigatinib+pembrolizumabEnfermedad metastásicaFIGHT-205 es un ensayo abierto, aleatorizado, en fase 2, que evalúa la eficacia y la seguridad de la combinación de pemigatinib y pembrolizumab frente a pemigatinib con el tratamiento estándar (gemcitabina/carboplatino o pembrolizumab en monoterapia) en pacientes con enfermedad metastásica, naive a tratamiento, no aptos para cisplatino y con mutacióno reordenamiento del FGFR373. En el caso de pemigatinib, se requiere una titulación a 18mg a partir del ciclo 2 para todos los pacientes sin hiperfosfatemia (PO4 sérica>5,5mg/dL) ni efectos adversos relacionados con el tratamiento de grado ≥2 durante el ciclo 173.
Rogaratinib+atezolizumabEnfermedad metastásicaFORT-2 (NCT03473756) es un ensayo fase 1b/2 que evalúa la eficacia clínica y el perfil de tolerabilidad de rogaratinib (600mg, 2veces al día)+atezolizumab (1.200mg cada 3 semanas) en pacientes con cáncer urotelial metastásico positivo para FGFR sin tratamiento previo, no aptos para cisplatino. La tasa de control de la enfermedad fue elevada, con un 83% (RC 13%; RP 42% y EE 29%). La ORR fue también elevada, del 56%, en pacientes con expresión negativa de PD-L1 y sobreexpresión del ARNm del FGFR3 sin mutación. Los acontecimientos adversos relacionados con la terapia llevaron a la interrupción, reducción o suspensión de rogaratinib en el 69%, 46% y 19% de los pacientes. Cabe destacar que los acontecimientos adversos relacionados con rogaratinib fueron hiperfosfatemia en 15 pacientes (58%) y desprendimiento del epitelio pigmentario de la retina en un paciente (4%)56.
Derazantinib± atezolizumabEnfermedad metastásicaEl ensayo de fase 2 FIDES-02 (NCT04046513) evaluó la eficacia de derazantinib, un inhibidor de la cinasa FGFR1-3, como agente único o en combinación con atezolizumab en pacientes con cáncer urotelial metastásico y alteraciones genéticas FGFR1/3. Sin embargo, los primeros datos comunicados en ASCO 2023 mostraron que la monoterapia con derazantinib no cumplió su criterio de valoración primario (ORR del 8%, mediana de SLP de 2,1 meses y SG de 6,6 meses), por lo que no quedó justificada la continuación de su desarrollo clínico en el cáncer urotelial metastásico. Sin embargo, la toxicidad fue bien controlada, con tasas bajas de toxicidades relacionadas con el tratamiento, como trastornos de la retina (16%), toxicidad ungueal (4%) y estomatitis (4%)63.
Vofatamab± docetaxelEnfermedad metastásicaFIERCE-21 es un estudio de fase 1b/2 (NCT02401542) diseñado para evaluar vofatamab, un anticuerpo monoclonal humano contra el FGFR3 que bloquea la activación del receptor de tipo salvaje y genéticamente activo, en monoterapia o en combinación con docetaxel53. El estudio incluyó a pacientes con enfermedad metastásica y progresión tras una o más quimioterapias previas. En 55 pacientes, el tratamiento demostró ser bien tolerado, con una baja frecuencia de efectos adversos de grado 3 relacionados con el tratamiento (1,8%). Los efectos adversos que se produjeron en ≥5% de los pacientes fueron astenia (19%), diarrea (9,5%), rubefacción 14%, escalofríos (9,5%), hipotensión (9,5%), disminución del apetito (19%) y aumento de la creatinina (9,5%). Sin embargo, la ORR solo se ha confirmado en 7 pacientes (12,5%), incluidos los que recibieron tanto monoterapia como combinación con docetaxel53.
Vofatamab± pembrolizumabEnfermedad metastásicaFIERCE-22 (NCT03123055) es un estudio de fase 1b/2 diseñado para evaluar vofatamab en monoterapia o en combinación con pembrolizumab en pacientes con metástasis que han progresado después de al menos una línea de quimioterapia, pero que no han recibido tratamiento previo con inhibidores de puntos de control inmunitario54. En 28 pacientes, la ORR fue del 29,6% y la mediana de SLP fue de 4,7 meses tras una mediana de seguimiento de 7,5 meses. El 32% (n=9) sigue en tratamiento y se encuentra en seguimiento para evaluar la supervivencia a largo plazo. Los acontecimientos adversos relacionados con el tratamiento más frecuentes en>20% de los pacientes fueron diarrea, fatiga, anemia y pirexia54.
Erdafitinib+enfortumab vedotinaEnfermedad metastásicaEstá en curso un ensayo de fase 1b (NCT04963153) que evalúa la combinación de erdafitinib con enfortumab vedotina después de tratamiento con platino e inhibidores de puntos de control inmunitario para el carcinoma urotelial metastásico con alteraciones genéticas FGFR2/355. Este estudio de dosis escalonada tiene como objetivo identificar la dosis máxima tolerable y establecer la dosis recomendada para la fase 2 de 1mg/kg de enfortumab y 1,25mg/kg de vedotina en combinación con 8mg de erdafitinib a una vez al día. Entre los 8 pacientes, los acontecimientos adversos de grado 3 relacionados con el tratamiento incluyeron síndrome mano-pie (50%), anemia (17%), erupción cutánea (17%), anorexia (17%) y paroniquia (17%). Los 8pacientes tuvieron una remisión parcial como mejor respuesta. Se está llevando a cabo el estudio de dosis escalonada para identificar la dosis máxima tolerable y la dosis recomendada para la ampliación del estudio55.
ConclusionesLos tumores LumP se caracterizan principalmente por mutaciones de FGFR3 y muestran un «desierto estromal e inmunitario» con firmas epiteliales y un microambiente tumoral altamente inmunosupresor, lo que hace suponer una baja respuesta a los ICI en monoterapia. Debido al posible efecto sinérgico de los ICI con inhibidores del FGFR, la terapia combinada está siendo sometida a investigaciones clínicas actuales. Así, los inhibidores del FGFR se están estudiando no solo como monoterapia, sino también en combinación con ICI, quimioterapia o conjugados anticuerpo-fármaco en numerosos estudios, que abarcan desde la enfermedad no musculoinvasiva hasta la metastásica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.