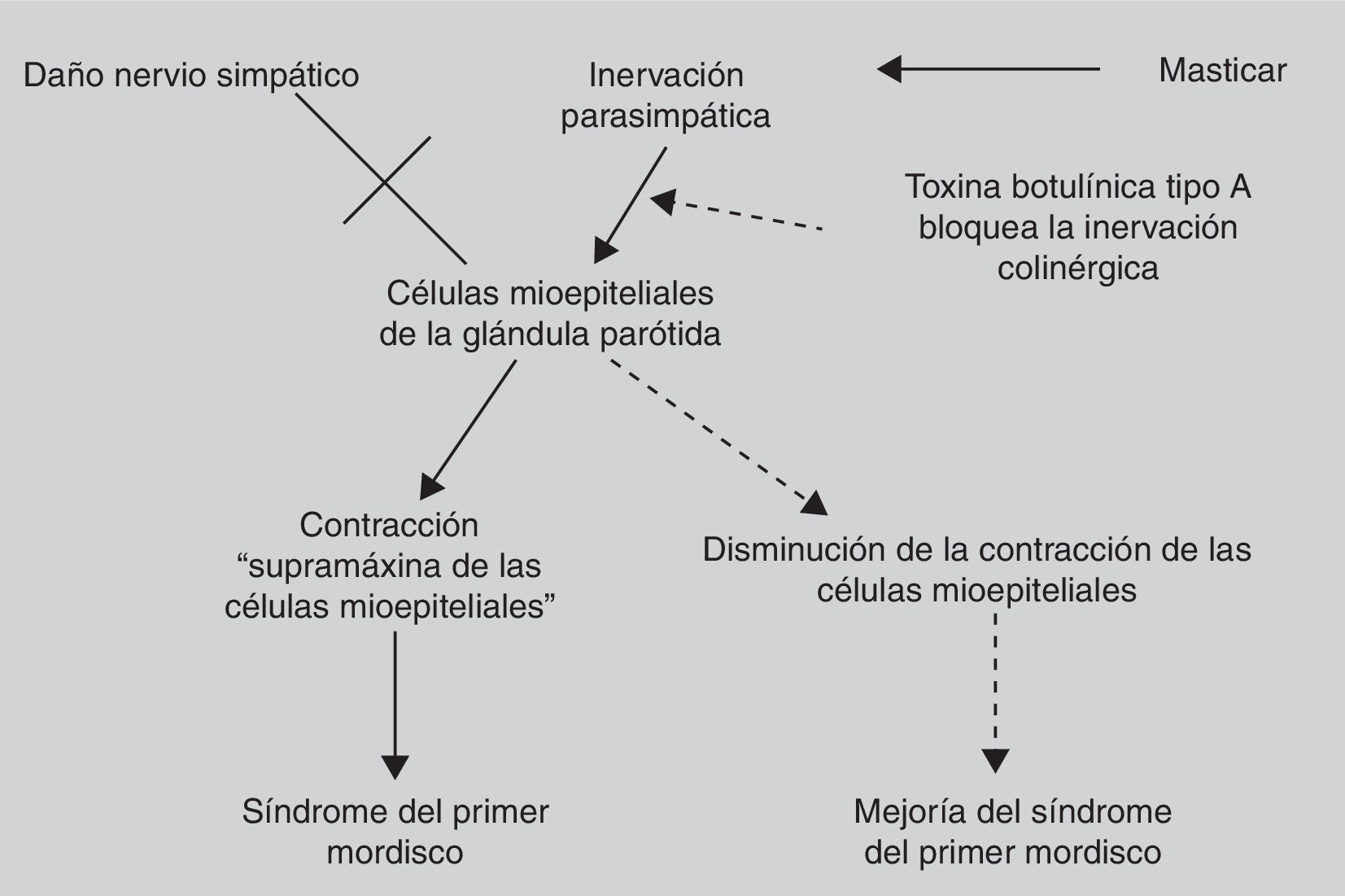
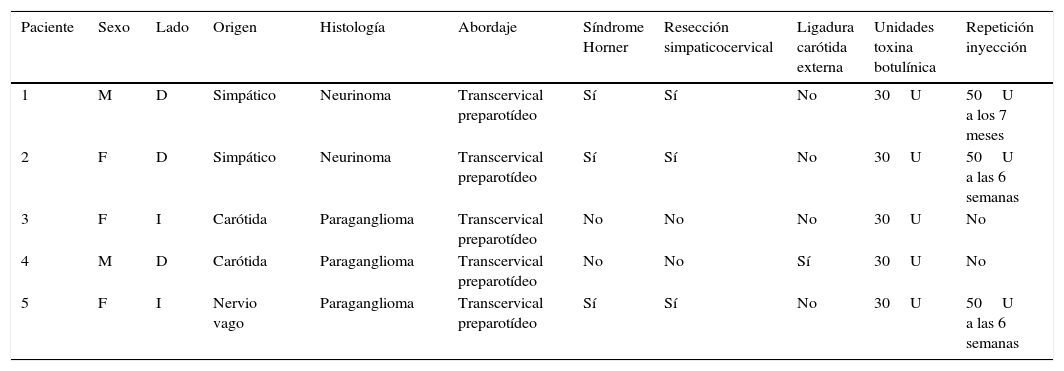
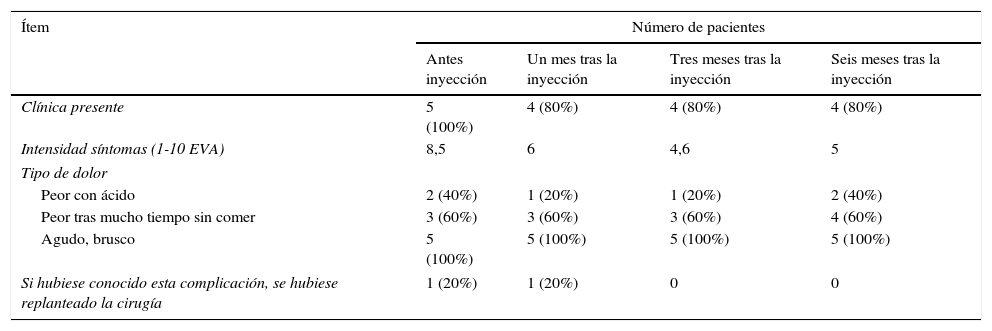
El síndrome del primer mordisco es una secuela potencial de la cirugía del espacio infratemporal, lóbulo profundo de parótida y del espacio parafaríngeo. Se trata de un dolor agudo e intenso en la región parotídea que se desencadena con el primer mordisco de cada comida. Se relaciona con el daño de las fibras simpáticas que inervan la parótida, lo que resulta en una hipersensibilidad de las células mioepiteliales a la inervación parasimpática, provocando una intensa contracción de las mismas, responsable del dolor causado. No responde a los analgésicos habituales. La inyección de toxina botulínica tipo A en la parótida afectada se presenta como un tratamiento sencillo y eficaz contra este problema por el bloqueo colinérgico que produce. Presentamos la técnica y los resultados de 5 pacientes a los que se les inyectó la toxina botulínica en la parótida afectada.
First bite syndrome is a potential complication of surgery involving the infratemporal fossa, deep lobe of the parotid gland and parapharyngeal space. It is described as an acute and intense pain in the parotid region caused with the first bite of each meal. It is related to damage to sympathetic innervation of the parotid gland. Parasympathetic hyperactivation is believed to stimulate an exaggerated myoepithelial cell contraction causing pain. Usual analgesic treatments have poor results. Botulinum toxin type A causes parasympathetic nerve paralysis of the parotid gland and this fact would minimize salivation and decrease first bite syndrome. The aim of this study is to show the details of the technique and our outcomes in 5 patients treated with botulinum toxin type A.