El reflujo faringolaríngeo (RFL) representa un desafío diagnóstico y terapéutico debido a la inespecificidad de sus manifestaciones clínicas y la ausencia de biomarcadores objetivos. Este trabajo tiene como objetivo establecer un consenso nacional sobre su definición, diagnóstico y tratamiento, mediante una metodología Delphi modificada que integre la visión de otorrinolaringólogos (ORL) y especialistas en aparato digestivo (AD).
Materiales y métodosSe conformó un comité científico compuesto por tres ORL y dos AD que elaboró 117 ítems distribuidos en siete bloques temáticos. El proceso Delphi contó con la participación de 73 panelistas en la primera ronda, de los cuales 65 (89%) completaron ambas rondas de votación. Los participantes eran representativos de las comunidades autónomas españolas, con una media de 17años de experiencia clínica, y un perfil multidisciplinar (63,1% ORL; 36,9% AD).
ResultadosTras dos rondas de votación, se alcanzó consenso positivo en 67ítems (64,9%), distribuidos de la siguiente manera: 14 sobre definición y fisiopatología; 12 sobre síntomas y hallazgos faríngeos; 2 sobre asociaciones con otras enfermedades ORL; 10 sobre métodos diagnósticos; 3 sobre cuestionarios validados; 15 sobre tratamiento y recomendaciones, y 11 sobre seguimiento clínico.
ConclusiónLos resultados del consenso reflejan la idoneidad y la eficacia de la metodología Delphi empleada para crear un documento de consenso sobre la definición, presentación, diagnóstico y manejo de una patología poco definida hasta ahora como el RFL, cuyo objetivo es ayudar a los especialistas en su práctica clínica diaria y que, a diferencia de otros, ha conseguido unificar en un mismo documento los criterios de las dos especialidades más implicadas en el manejo de estos pacientes.
Laryngopharyngeal reflux (LPR) represents a diagnostic and therapeutic challenge due to the nonspecific nature of its clinical manifestations and the absence of objective biomarkers. The aim of this work is to establish a national consensus on its definition, diagnosis, and treatment through a modified Delphi methodology that integrates the perspectives of otolaryngologists (ENT) and gastroenterologists (GI).
Materials and methodsA scientific committee composed of three ENTs and two GIs developed 117 items distributed across seven thematic sections. The Delphi process involved 73 panellists in the first round, of whom 65 (89%) completed both rounds of voting. Participants were representative of the Spanish autonomous communities, with an average of 17years of clinical experience and a multidisciplinary profile (63.1% ENT; 36.9% GI).
ResultsAfter two rounds of voting, positive consensus was reached on 67 items (64.9%), distributed as follows: 14 on definition and pathophysiology; 12 on symptoms and pharyngeal findings; 2 on associations with other ENT diseases; 10 on diagnostic methods; 3 on validated questionnaires; 15 on treatment and recommendations; and 11 on clinical follow-up.
ConclusionThe results of the consensus reflect the suitability and effectiveness of the Delphi methodology used to create a consensus document on the definition, presentation, diagnosis, and management of a condition that until now has been poorly defined, such as LPR. The aim is to support specialists in their daily clinical practice, and unlike previous efforts, it has succeeded in unifying within a single document the criteria of the two specialties most involved in managing these patients.
El reflujo faringolaríngeo (RFL) es una afección del tracto aerodigestivo superior causada por la exposición de la faringe y la laringe al contenido gastroduodenal, ya sea de forma directa o indirecta, lo que puede desencadenar alteraciones morfológicas y/o neurológicas en los tejidos afectados1. Aunque el RFL comparte algunas características fisiopatológicas con la enfermedad por reflujo gastroesofágico (ERGE), existen diferencias notables en cuanto a sus manifestaciones clínicas, métodos de diagnóstico y respuesta al tratamiento1,2.
Su diagnóstico sigue siendo un desafío, a pesar de su elevada prevalencia en consultas de otorrinolaringología, gastroenterología y atención primaria3,4, debido, principalmente, a la falta de especificidad de sus síntomas y a la ausencia de biomarcadores objetivos5,6.
El abordaje del RFL ha sido objeto de debate durante años. Mientras que la ERGE ha contado con guías clínicas y consensos internacionales bien definidos, el RFL solo ha comenzado a recibir mayor atención en los últimos años7. La limitada evidencia sobre la eficacia de los inhibidores de la bomba de protones (IBP)8 y la falta de pruebas diagnósticas universalmente aceptadas han generado discrepancias en su manejo clínico9.
Esta situación ha llevado a que los pacientes con RFL se sometan a múltiples consultas médicas y procedimientos de diagnóstico10, lo que no solo supone una carga para el sistema sanitario, sino que también repercute negativamente en su calidad de vida. Además, varios estudios han demostrado que los síntomas laríngeos crónicos se asocian a mayores niveles de ansiedad y depresión11.
Ante este panorama de incertidumbre, se creó un grupo de especialistas en otorrinolaringología (ORL) y aparato digestivo (AD) con experiencia en el manejo del RFL y la ERGE que se reunieron periódicamente para formar un comité de expertos y elaborar una declaración de consenso sobre RFL basado en la evidencia científica y la opinión de médicos de ambas especialidades, utilizando una metodología Delphi modificada. El objetivo de este consenso es recoger criterios para la definición y el diagnóstico del RFL, así como proporcionar recomendaciones consensuadas que ayuden a los especialistas a optimizar el abordaje clínico y el manejo de esta patología en la práctica clínica habitual.
Materiales y métodosEl desarrollo del consenso se ha basado en la combinación de los principios de la medicina basada en la evidencia y un enfoque Delphi modificado12. Los ítems iniciales fueron redactados y propuestos por el comité de expertos del consenso (CC), compuesto por tres ORL y dos AD, en base a las evidencias publicadas y su experiencia clínica. El proceso Delphi se organizó en un máximo de dos rondas de votación. Se invitó a médicos de ambas especialidades, mediante distribución que fuera representativa de la realidad asistencial de las comunidades autónomas españolas y que tuvieran un mínimo de 5años de experiencia como especialistas, a votar de forma anónima sobre los ítems a través de una plataforma online (Survio®, Brno, República Checa), permitiendo que cada participante completara la encuesta solo una vez por ronda de votación. Las declaraciones no validadas en la primera ronda (nivel de consenso <80%, pero >60%) fueron mejoradas según los comentarios del CC para la siguiente ronda. El establecimiento del consenso actual se ha llevado a cabo en seis pasos:
- 1.
Reunión de los miembros del CC y desarrollo de la declaración preliminar por parte del CC.
- 2.
La elección del panel de especialistas participantes y primera ronda de votaciones.
- 3.
La valoración de los resultados por el CC y la preparación del segundo cuestionario en función de los resultados.
- 4.
La presentación de los resultados de la primera ronda y la segunda ronda de votaciones.
- 5.
La valoración de los resultados por el CC y la redacción del documento de consenso definitivo.
- 6.
Redacción del presente documento y obtención del aval de la Sociedad Española de Otorrinolaringología y Cirugía de Cabeza y Cuello (SEORL-CCC).
Los expertos del CC elaboraron una lista inicial de 117 ítems sobre RFL, que abarcaban los siguientes temas: definición, fisiopatología y diferencias con la ERGE (n=29), principales síntomas y hallazgos faríngeos del RFL (n=24), asociaciones entre RFL y enfermedades del área de ORL (n=14), métodos de diagnóstico (n=18), cuestionarios validados (n=3), tratamientos habituales y recomendaciones (n=15) y manejo clínico y seguimiento de los pacientes con RFL (n=14).
Rondas de votación y discusiónEl proceso Delphi comenzó en diciembre de 2023 y se extendió hasta febrero de 2025. Se realizaron dos rondas de votación, separadas por períodos de revisión y discusión. Los ítems se evaluaron con una escala de 5puntos, que incluía «totalmente en desacuerdo», «parcialmente en desacuerdo», «ni de acuerdo ni en desacuerdo», «bastante de acuerdo» y «totalmente de acuerdo». La aceptación del consenso se definió como un acuerdo (bastante de acuerdo o totalmente de acuerdo) por al menos el 80% de los expertos. Las declaraciones que obtuvieron entre un 60% y un 80% de acuerdo fueron revisadas por el comité de expertos. Las declaraciones que no alcanzaron al menos un 60% de acuerdo fueron descartadas y no se sometieron a una revisión adicional ni a votación relacionada.
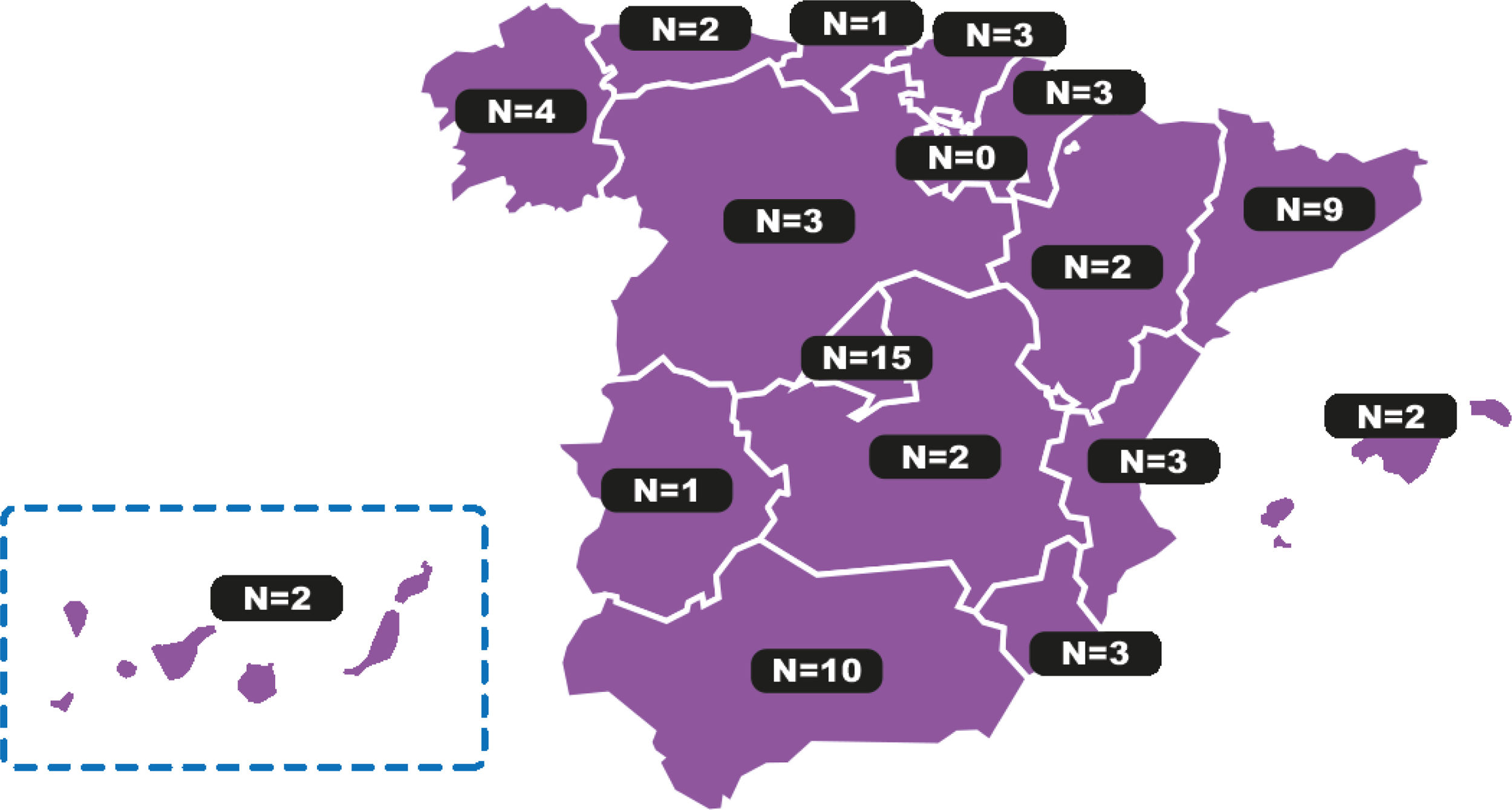
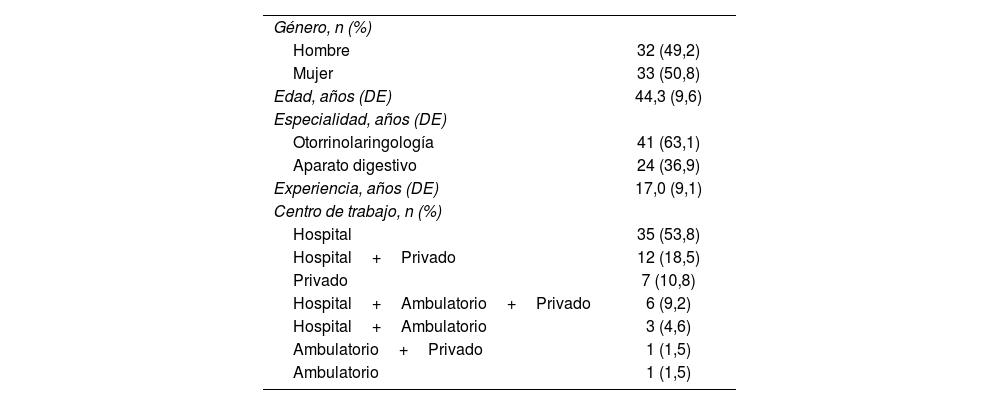
Panelistas participantesUn total de 73 panelistas de ambas especialidades (60,3% ORL y 39,7% AD) completaron la primera ronda del Delphi; de ellos, 65 (89,0%) completaron las dos rondas del Delphi (63,1% ORL y 36,9% AD) (Anexo I). Los especialistas representativos de las comunidades autónomas españolas (fig. 1) tenían una media de 17años de experiencia y el 53,8% ejercían en el ámbito hospitalario (tabla 1).
Distribución demográfica de los panelistas participantes (n=65)
| Género, n (%) | |
| Hombre | 32 (49,2) |
| Mujer | 33 (50,8) |
| Edad, años (DE) | 44,3 (9,6) |
| Especialidad, años (DE) | |
| Otorrinolaringología | 41 (63,1) |
| Aparato digestivo | 24 (36,9) |
| Experiencia, años (DE) | 17,0 (9,1) |
| Centro de trabajo, n (%) | |
| Hospital | 35 (53,8) |
| Hospital+Privado | 12 (18,5) |
| Privado | 7 (10,8) |
| Hospital+Ambulatorio+Privado | 6 (9,2) |
| Hospital+Ambulatorio | 3 (4,6) |
| Ambulatorio+Privado | 1 (1,5) |
| Ambulatorio | 1 (1,5) |
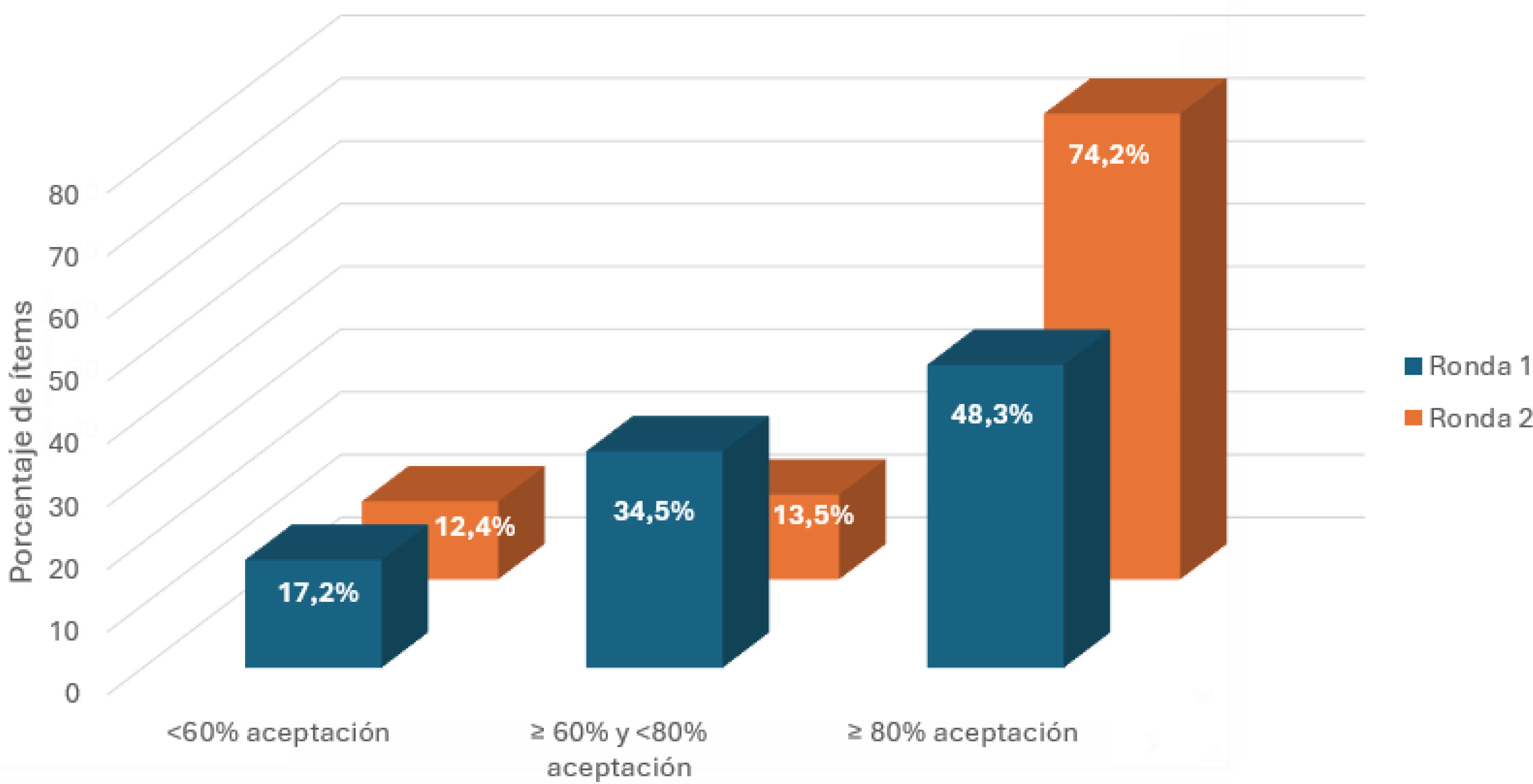
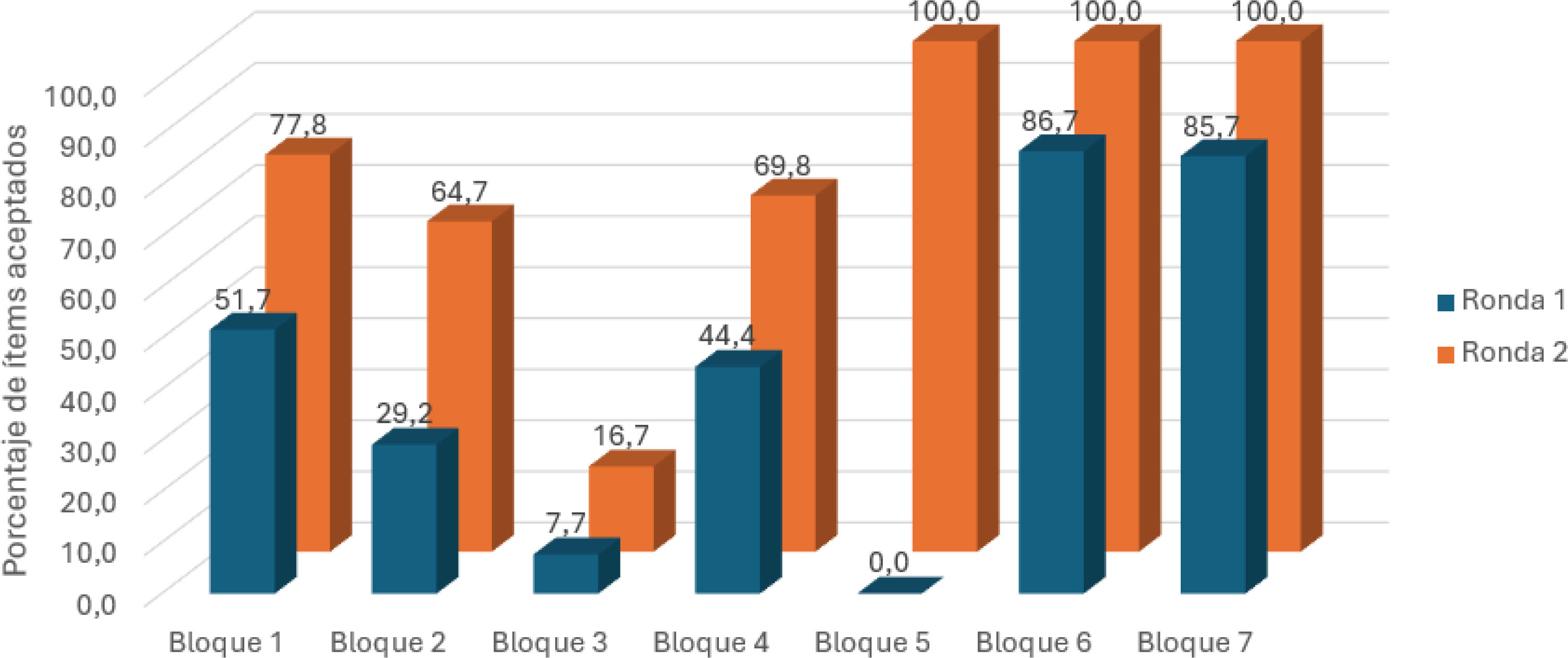
Después de analizar la primera ronda de validación, se aprobó el 48,3% de los ítems, mientras que en la segunda ronda este porcentaje aumentó al 74,2% (fig. 2). La distribución del porcentaje de ítems validados por bloque en cada ronda se presenta en la figura 3. Cabe destacar que en la segunda ronda de votaciones el 100% de los ítems de los bloques 5, 6 y 7 fueron aceptados.
En cuanto a la categorización de los ítems finales del consenso, 14 estaban relacionados con la definición, fisiopatología y diferencias con la ERGE; 12 estuvieron relacionados con los principales síntomas y hallazgos faríngeos del RFL, y 2 analizaron las asociaciones entre el RFL y diversas enfermedades otorrinolaringológicas (tabla 2). Respecto al diagnóstico, 13 ítems fueron enfocados a este tema, de los cuales 10 analizaron el papel de los distintos métodos diagnósticos y 3 se centraron en el uso de cuestionarios validados (tabla 2). En el ámbito del tratamiento y las recomendaciones, 15 ítems se dedicaron a este aspecto. De ellos, 7 consistieron en estrategias dietéticas y modificaciones en el estilo de vida. El manejo clínico y el seguimiento de los pacientes con RFL se trataron en 11 ítems (tabla 2).
Ítems del consenso ReFaL
| Ítems | Acuerdo |
|---|---|
| 1. Definición, fisiopatología y diferencias con la enfermedad por reflujo gastroesofágico (ERGE) | |
| 1.1 El reflujo faringolaríngeo (RFL) es una patología que se caracteriza por la presencia de síntomas, signos y alteraciones morfológicas en el tracto aerodigestivo superior. Estas manifestaciones son consecuencia de los efectos directos e indirectos del flujo retrógrado del contenido gastroduodenal hacia la faringe y la laringe97,0% | |
| 1.2 El reflujo faringolaríngeo también es conocido por varios nombres alternativos. El más común es el reflujo laringofaríngeo, pero también se le conoce como: | |
| 1.2.1. Manifestaciones extraesofágicas de la ERGE | 89,2% |
| 1.2.2. Manifestaciones otorrinolaringológicas de la ERGE | 78,5%* |
| 1.3. El hecho de que no exista una definición claramente consensuada del RFL dificulta el poder determinar su prevalencia. Por tanto, es de gran interés definir con precisión y alcanzar un consenso en esta patología y establecer criterios o consensos claros para su diagnóstico y tratamiento adecuados | 98,5% |
| 1.4. El reflujo gastroesofágico (RGE) y el RFL comparten ciertos mecanismos fisiopatológicos comunes. La presencia de RGE constituye un factor de riesgo para el desarrollo de RFL | 93,9% |
| 1.5. El RGE y el RFL pueden manifestarse con cuadros clínicos diferentes | 92,5% |
| 1.6. Hasta un 60% de los pacientes con RFL no presentan síntomas típicos de RGE, como son: | |
| 1.6.1. Regurgitación ácida | 86,2% |
| 1.6.2. Pirosis | 84,6% |
| 1.7. Entre los factores de riesgo que predisponen al desarrollo de RFL destacan: | |
| 1.7.1. Adopción precoz de la posición supina tras la ingesta | 92,3% |
| 1.7.2. Consumo de alcohol | 90,8% |
| 1.7.3. Obesidad | 90,8% |
| 1.7.4. Tabaquismo | 87,7% |
| 1.7.5. Dietas ricas en grasas, azúcares y/o contenidos ácidos | 89,2% |
| 1.7.6. El consumo de algunos fármacos que contribuyen a disminuir la presión del esfínter esofágico inferior | 89,2% |
| 2. Principales síntomas y hallazgos faríngeos del RFL | |
| 2.1. Las manifestaciones clínicas del RFL son muy inespecíficas, de ahí la dificultad para su diagnóstico y posterior tratamiento. Entre los síntomas más frecuentes, con distinto grado de evidencia, cabe destacar: | |
| 2.1.1. Tos seca, crónica o que aparece después de acostarse o comer | 95,4% |
| 2.1.2. Carraspera | 90,8% |
| 2.1.3. Disfonía | 90,7% |
| 2.1.4. Sensación de globo faríngeo | 84,6% |
| 2.1.5. Espasmos laríngeos en decúbito supino | 80,0% |
| 2.2. La baja especificidad de los síntomas habituales en los pacientes con RFL dificulta su correcto diagnóstico. De ahí la necesidad de establecer un diagnóstico diferencial con otras patologías de carácter infeccioso, inflamatorio, tumoral, traumático y/o neurológico que afectan a la vía aérea superior y presentan sintomatología semejante, como laringitis agudas, alergias o asma, entre muchas otras | 100,0% |
| 2.3. Aunque el diagnóstico de RFL no debe basarse únicamente en los hallazgos laríngeos, es recomendable realizar una exploración endoscópica laríngea a todos los pacientes con sospecha de RFL | 93,8% |
| 2.4. Los hallazgos esofágicos en la endoscopia y los resultados de los estudios de monitorización del reflujo son muy inespecíficos. Entre los principales hallazgos faringolaríngeos asociados con RFL se encuentran: | |
| 2.4.1. Eritema aritenoideo | 96,6% |
| 2.4.2. Paquidermia interaritenoidea o posterior | 93,1% |
| 2.4.3. Eritema laríngeo difuso | 85,5% |
| 2.4.4. Eritema faríngeo | 84,7% |
| 2.4.5. Eritema o edema de las cuerdas vocales | 78,0%* |
| 3. Asociaciones entre RFL y enfermedades otorrinolaringológicas | |
| 3.1. Se han propuesto numerosas asociaciones, con diferentes grados de confianza, entre el RFL y diferentes patologías otorrinolaringológicas, aunque la baja evidencia científica de estas posibles asociaciones hace que sean necesarios futuros estudios para poder establecerlas con mayor certeza | 95,4% |
| 3.2. En algunas patologías otorrinolaringológicas, como el granuloma laríngeo, se ha detectado cierto grado de asociación con el RFL | 83,3% |
| 4. Métodos de diagnóstico | |
| 4.1. Actualmente, el diagnóstico de RFL es clínico y se realiza a partir de los síntomas referidos por los pacientes y los hallazgos endoscópicos faringolaríngeos | 92,3% |
| 4.2. La pH-impedanciometría esofágica de 24horas está considerada el actual gold standard para el diagnóstico de RFL | 83,1% |
| 4.3. Más allá de la pH-metría con impedancia, las pruebas diagnósticas que pueden ayudar en el diagnóstico de RFL incluyen: | |
| 4.3.1. Tratamiento empírico o ensayo terapéutico con IBP | 92,1% |
| 4.3.2. Exploración de la cavidad oral y orofaringe | 89,1% |
| 4.3.3. Endoscopia gastrointestinal | 87,3% |
| 4.4. La endoscopia gastrointestinal superior, por sí misma, no permite diagnosticar el RFL, dado que es frecuente una endoscopia sin hallazgos relevantes en pacientes afectados por esta condición. Sin embargo, resulta útil para excluir la existencia de otras lesiones potenciales en el paciente | 98,5% |
| 4.5. En pacientes con sospecha de RFL, la pH-metría de doble canal esofágico podría ser útil para el diagnóstico del RFL causado por reflujo ácido. Sin embargo, su utilidad es limitada para el diagnóstico de la enfermedad causada por eventos no ácidos | 84,6% |
| 4.6. En aquellos centros sanitarios en los que no se disponga de la pH-impedanciometría esofágica, la pH-metría de doble canal esofágico ayuda al diagnóstico del paciente con sospecha de RFL | 76,9%* |
| 4.7. La gravedad del RFL percibido en la HEMI-pH no necesariamente se correlaciona con la gravedad de los síntomas y hallazgos exploratorios en el paciente | 80,0% |
| 4.8. La detección de la pepsina en la saliva (PEP-test), una prueba no accesible en la mayoría de los centros sanitarios, en la actualidad es una prueba rápida, sencilla y no invasiva que permite la detección de pepsina en una muestra salival | 88,7% |
| 5. Cuestionarios validados | |
| 5.1. El índice de síntomas de reflujo (RSI) es un cuestionario de resultados informado por el paciente que consta de nueve ítems. Este índice evalúa, de forma subjetiva, la gravedad y la frecuencia de los síntomas en una escala de 0 a 5. Una puntuación igual o superior a 13 indica que el paciente es susceptible de padecer RFL | 98,2% |
| 5.2. La puntuación de los síntomas de reflujo (RSS) es un cuestionario de resultados reportados por el paciente que consta de 22 ítems. Este cuestionario evalúa de manera subjetiva el impacto potencial en la calidad de vida del paciente. Existe una versión abreviada, el RSS-12, que parece ser igual de eficaz, pero más rápido de cumplimentar. Esta escala es más consistente que el RSI, aunque es menos utilizada en las consultas de otorrinolaringología. Por ello, sería beneficioso promover una mayor difusión de este cuestionario entre los especialistas, dada su mayor consistencia | 92,7% |
| 5.3. La puntuación de los hallazgos de reflujo (RFS) se utiliza para graduar los hallazgos obtenidos con endoscopia laríngea. Esta escala evalúa 8ítems que recogen los hallazgos laringoscópicos más comunes en pacientes con RFL. La RFS presenta mucha variabilidad tanto intraobservador como interobservador, por lo que una guía con imágenes podría ayudar a reducir esta variabilidad | 98,1% |
| 6. Tratamientos habituales y recomendaciones | |
| 6.1. Las modificaciones higiénico-dietéticas constituyen la primera modificación terapéutica en el manejo del RFL. Este enfoque se considera el mejor tratamiento empírico para los pacientes con RFL, independientemente de la gravedad de sus síntomas. Además, destaca por su favorable relación coste-efectividad | 90,8% |
| 6.2. Algunos pacientes, especialmente aquellos sin síntomas típicos de ERGE, pueden mostrar reticencia a seguir las recomendaciones higiénico-dietéticas al no comprender que sus síntomas otorrinolaringológicos sean secundarios a reflujo. En estos casos podría ser recomendable prescribir, además, tratamiento farmacológico durante las fases iniciales del manejo (1-2meses) | 93,9% |
| 6.3. Entre las medidas higiénico-dietéticas más destacadas para el tratamiento empírico de los pacientes con RFL se incluyen: | |
| 6.3.1. No comer ni beber durante las 2horas previas a la realización de ejercicio vigoroso o al acostarse | 93,8% |
| 6.3.2. Reducir la ingesta de grasas y evitar comidas copiosas | 93,8% |
| 6.3.3. Evitar el consumo de cafeína, alcohol y nicotina | 92,3% |
| 6.3.4. Elevar la cabecera de la cama | 90,8% |
| 6.3.5. Intentar disminuir los niveles de estrés | 89,2% |
| 6.3.6. Adoptar la posición de decúbito lateral izquierdo al acostarse | 87,7% |
| 6.3.7. No utilizar fajas, cinturones o ropa ajustada en la zona abdominal | 87,7% |
| 6.4. Los inhibidores de la bomba de protones (IBP) son fármacos considerados muy seguros en su administración a corto y a largo plazo. Sus posibles efectos secundarios son bien conocidos y asumibles, siempre y cuando se prescriban correctamente | 96,9% |
| 6.5. La combinación de IBP con alginatos podría ser una opción viable para disminuir la dosis de IBP. Esta combinación podría ayudar a mantener los síntomas de la enfermedad bajo control y reducir la duración del tratamiento | 93,8% |
| 6.6. En pacientes con RFL intenso puede ser adecuado incrementar al doble la dosis estándar del IBP. En estos casos, la administración de una dosis única doble de IBP en ayunas por la mañana puede ser efectiva; sin embargo, desde un punto de vista farmacocinético, parece más recomendable dividir la dosis doble única en dos dosis estándar separadas en 12horas, una antes del desayuno y otra antes de la cena | 92,3% |
| 6.7. Los reflujos alcalino y débilmente ácido se relacionan también con RFL. Por tanto, si un tratamiento empírico con IBP no produce una respuesta positiva, esto no debería excluir necesariamente el diagnóstico de RFL | 87,7% |
| 6.8. En pacientes con RFL alcalinos y débilmente ácidos, el uso de alginatos o la combinación de alginatos e IBP podría ser la opción de tratamiento más adecuada | 89,2% |
| 6.9. Los productos que contienen ácido hialurónico y agentes con efecto barrera específicos, como la queratina, presentan propiedades reparadoras y regenerativas para el epitelio dañado. Además, desempeñan un papel protector frente al daño oxidativo y las enzimas proteolíticas, como la pepsina. Estas propiedades los convierten en un tratamiento prometedor para reparar y prevenir el daño causado por el RFL | 95,4% |
| 7. Manejo clínico y seguimiento de los pacientes con RFL | |
| 7.1. El manejo del paciente con RFL debe realizarse de forma conjunta entre otorrinolaringólogos y especialistas en aparato digestivo, dado que es una manifestación clínica de una enfermedad digestiva que causa lesiones a nivel otorrinolaringológico | 93,8% |
| 7.2. A pesar de que los pacientes con RFL suelen presentarse inicialmente en las consultas de otorrinolaringología, es recomendable que en las consultas de gastroenterología se investigue siempre, de forma dirigida, la presencia de otros síntomas atípicos y/o manifestaciones extraesofágicas de la ERGE. Como es el caso del RFL, que es la manifestación extradigestiva más frecuente de esta patología | 90,8% |
| 7.3. Dado el carácter agudo, crónico o recurrente del RFL, en los pacientes con esta enfermedad será necesario mantener un tratamiento farmacológico prolongado en el tiempo (ya sea de forma continuada o intermitente) hasta intentar lograr el control de la sintomatología y la resolución de las lesiones otorrinolaringológicas | 92,3% |
| 7.4. Durante el seguimiento por parte del otorrinolaringólogo de un paciente con RFL se debe tener en cuenta: | |
| 7.4.1. Comprobar el cambio de hábitos del paciente y el manejo del estrés por su parte | 96,8% |
| 7.4.2. Ajuste de la medicación en caso de que el paciente haya experimentado una mejoría | 95,2% |
| 7.4.3. La evolución de la sintomatología repitiendo los cuestionarios RSI o RSS para comprobar la puntuación antes y después del tratamiento | 93,4% |
| 7.4.4. Una exploración física mediante una endoscopia faringolaríngea para observar posibles cambios en los signos endoscópicos | 86,9% |
| 7.5. Durante el seguimiento por parte del especialista en aparato digestivo de un paciente con RFL se debe tener en cuenta: | |
| 7.5.1. Descartar síntomas de alarma (disfagia, pérdida de peso) | 96,6% |
| 7.5.2. Comprobar la adherencia al tratamiento | 94,8% |
| 7.5.3. Una monitorización del control de síntomas | 91,4% |
| 7.6. En caso de pacientes con RFL refractarios al tratamiento, se recomienda valorar dichos casos de forma conjunta por especialistas en aparato digestivo y otorrinolaringólogos | 96,9% |
En el estudio que hemos realizado, con un nivel de acuerdo de 97% el RFL se ha definido como «una patología que se caracteriza por la presencia de síntomas, signos y alteraciones morfológicas en el tracto aerodigestivo superior. Estas manifestaciones son consecuencia de los efectos directos e indirectos del flujo retrógrado del contenido gastroduodenal hacia la faringe y la laringe». Esta definición integra los avances en la comprensión fisiopatológica, enfatizando tanto los mecanismos lesivos directos por contacto con la mucosa como los efectos indirectos que pueden manifestarse en tejidos no expuestos directamente al material refluido.
Esta definición coincide con otras definiciones recogidas en la bibliografía consultada. La conceptualización del RFL ha evolucionado significativamente a lo largo de los años y ha sido objeto de amplio debate en múltiples foros científicos internacionales, destacándose las definiciones establecidas en el consenso IFOS-Dubái13 y en el Consenso europeo para el manejo y el tratamiento de la enfermedad por reflujo laringofaríngeo1. Ambos coinciden en describir el RFL como una afección que afecta el tracto aerodigestivo superior y se origina por la exposición directa o indirecta al reflujo del contenido gastroduodenal. Esta exposición puede generar alteraciones tanto estructurales como funcionales en los tejidos involucrados. Entre los principales mediadores del daño en la mucosa destacan sustancias como la pepsina, los ácidos biliares, la elastasa y, posiblemente, la tripsina, que desempeñan un papel clave en la inflamación de la mucosa y en la manifestación de síntomas del RFL14,15.
El RFL también es conocido por varios nombres alternativos. El más común es el reflujo laringofaríngeo, pero también se le conoce como manifestaciones extraesofágicas de la ERGE y manifestaciones otorrinolaringológicas de la ERGE.
Probablemente estos términos hacen referencia al consenso de Lyon para la clasificación de la ERGE, donde las manifestaciones clínicas del reflujo se separaron en síndromes esofágicos y extra-esofágicos16.
En nuestro estudio, el 98,5% de los panelistas se mostraron de acuerdo con el hecho de que la no existencia de una definición claramente consensuada del RFL dificulta poder determinar su prevalencia. Por tanto, es de gran interés alcanzar un consenso que permita definir y establecer criterios claros para su diagnóstico y tratamiento.
La falta de una definición clara, sumada a la inespecificidad de sus manifestaciones clínicas, representa un obstáculo para determinar su incidencia en la población. No obstante, los síntomas y hallazgos asociados al RFL son frecuentes en consultas de atención primaria, otorrinolaringología y gastroenterología7,17,18.
Más del 90% de los médicos especialistas encuestados consideran que el reflujo gastroesofágico (RGE) y el RFL comparten ciertos mecanismos fisiopatológicos. Además, la presencia de RGE constituye un factor de riesgo para el desarrollo de RFL, a pesar de que ambas afecciones pueden manifestarse como cuadros clínicos diferentes. De hecho, hasta un 60% de los pacientes con RFL no presentan síntomas típicos de RGE, como son la regurgitación y la pirosis.
Los mecanismos fisiopatológicos de la ERGE han sido ampliamente investigados y se atribuyen, principalmente, a la relajación transitoria inapropiada del esfínter esofágico inferior (EEI) o a la hipotonía de este, que facilita el movimiento retrógrado del contenido gástrico hacia el esófago con la consecuente aparición de síntomas y/o complicaciones19. Por su parte, el RFL también se caracteriza por un flujo retrógrado del contenido gastroduodenal, pero con una extensión más allá del esfínter esofágico superior (EES), alcanzando la región laringofaríngea20. En consecuencia, aunque la ERGE y el RFL comparten ciertos mecanismos fisiopatológicos, presentan diferencias significativas en las respuestas fisiológicas y en la sintomatología. En la mayoría de los casos de RFL los pacientes no experimentan pirosis o regurgitación, síntomas que, en cambio, son característicos de la ERGE21. Sin embargo, la presencia de ERGE debe ser considerada como un factor contribuyente al evaluar la probabilidad de la existencia de RFL. De hecho, se ha sugerido una posible correlación entre la gravedad de la ERGE y el desarrollo de RFL22, lo que resalta la importancia de una evaluación integral en estos pacientes.
Analizados los resultados obtenidos en relación con los principales factores de riesgo que predisponen a la aparición de RFL se alcanzó un consenso con un nivel de acuerdo superior al 87,5% en todos los casos. Entre ellos destacan la adopción precoz de la posición supina tras la ingesta; el consumo de alcohol; la obesidad; el tabaquismo; las dietas ricas en grasas, azúcares y/o contenidos ácidos, y el consumo de algunos fármacos que contribuyen a disminuir la presión del EEI.
La evidencia científica disponible respalda el papel de estos factores en la fisiopatología del RFL. Se ha documentado que la adopción precoz de la posición supina tras la ingesta23, una dieta inadecuada y el consumo de alcohol tienen un impacto significativo sobre la motilidad gastroesofágica y la presión del EEI24. Asimismo, la obesidad, el tabaquismo y el consumo de ciertos fármacos también contribuyen a la disminución de la presión del EEI, lo que favorece el reflujo del contenido gastroduodenal hacia la región laringofaríngea25,26.
Principales síntomas y hallazgos faríngeos del RFLHubo consenso en que las manifestaciones clínicas del RFL son muy inespecíficas, de ahí la dificultad para su diagnóstico y posterior tratamiento. Entre los síntomas más frecuentes, con distinto grado de evidencia, destacan la tos seca, crónica o que se exacerba con el decúbito o al comer; la carraspera, la disfonía, la sensación de globo faríngeo y los espasmos laríngeos en decúbito supino21,27.
Estos síntomas clínicos derivan de un proceso inflamatorio de la mucosa en el tracto aerodigestivo superior, una respuesta común en diversas afecciones otorrinolaringológicas, con lo que dificulta el diagnóstico27,28. De ahí la necesidad de establecer un diagnóstico diferencial con otras patologías de carácter infeccioso, inflamatorio, tumoral, traumático y/o neurológico que afectan a la vía aérea superior y presentan sintomatología semejante, tales como laringitis agudas, alergias o asma, entre otras.
El 93,8% de los panelistas coincidieron en que, si bien el diagnóstico de RFL no debe basarse exclusivamente en los hallazgos laríngeos, es recomendable realizar una exploración endoscópica laríngea a todos los pacientes con sospecha de RFL. Sin embargo, al igual que los síntomas clínicos, los hallazgos endoscópicos carecen también de especificidad y pueden presentarse en diversas enfermedades inflamatorias que afectan la mucosa del tracto aerodigestivo superior29. Entre los principales hallazgos endoscópicos asociados al RFL se incluyen el eritema aritenoideo, la paquidermia interaritenoidea o posterior, el eritema laríngeo difuso, el eritema faríngeo y el eritema o edema de las cuerdas vocales30-32. Estas alteraciones deben ser interpretadas en el contexto clínico de cada paciente, a fin de optimizar el proceso diagnóstico y evitar tratamientos innecesarios o erróneos.
Asociaciones entre RFL y enfermedades otorrinolaringológicasDurante el desarrollo del consenso se han propuesto múltiples asociaciones, con diferentes grados de confianza, entre el RFL y diferentes patologías otorrinolaringológicas. Sin embargo, la limitada evidencia científica sobre estas asociaciones subraya la necesidad de futuros estudios que permitan establecerlas con mayor certeza31-36.
Entre los hallazgos otorrinolaringológicos más discutidos en este contexto, el granuloma laríngeo ha generado un alto grado de consenso (nivel de acuerdo del 83,3%). Diversos estudios han demostrado que el contenido gástrico refluido (ácido, pepsina, bilis) puede inducir daño en la mucosa laríngea, particularmente en la región aritenoidea, lo que desencadena procesos inflamatorios crónicos que pueden manifestarse en forma de granulomas laríngeos37-39.
Métodos de diagnósticoEl 92,3% de los expertos que han participado en el estudio coincidieron en que, actualmente, el diagnóstico del RFL se establece principalmente a través de la evaluación clínica, basada en los síntomas referidos por los pacientes y los hallazgos endoscópicos faringolaríngeos10. No obstante, la pH-impedanciometría esofágica de 24horas (HEMII-pH) sigue siendo considerada como el actual patrón oro para la confirmación diagnóstica del RFL13, aunque la gravedad de la patología determinada mediante HEMII-pH no siempre se correlaciona con la severidad de los síntomas ni con los hallazgos exploratorios en el paciente40,41.
En centros donde la HEMII-pH no está disponible, se considera que la pH-metría de doble canal esofágico puede ser una herramienta de ayuda al diagnóstico del paciente con sospecha de RFL. Esta recomendación coincide con la incluida en la guía de práctica clínica europea de otorrinolaringología, donde los expertos recomendaron la medición del pH orofaríngeo como una herramienta complementaria en casos en los que la HEMII-pH no esté disponible1. Según dicha guía, la presencia de más de 10 episodios de reflujo faríngeo con un pH ≤6,0 podría considerarse indicativa de la enfermedad. No obstante, la monitorización del pH orofaríngeo no ha sido reconocida como el estándar diagnóstico debido a diversas limitaciones, entre ellas el uso de un sensor único y la imposibilidad de identificar eventos esofágicos proximales previos a la detección del reflujo faríngeo1,40.
Dado que la medición del pH mediante HEMII-pH o pH orofaríngeo no está disponible en todos los centros médicos, muchos profesionales optan por un abordaje empírico basado en la respuesta al tratamiento con IBP42. Este enfoque suele ser efectivo y rentable para los pacientes que presentan RFL leve a moderado y sin síntomas de alarma13.
Otro método alternativo aceptado por los panelistas fue la detección de pepsina en saliva mediante la prueba de determinación de pepsina en saliva (PEP-test), una técnica rápida, sencilla y no invasiva. Sin embargo, su disponibilidad en centros de salud es aún limitada.
Aunque el PEP-test podría considerarse una herramienta auxiliar en el diagnóstico del RFL, presenta ciertas limitaciones significativas, como la alta variabilidad en la sensibilidad de las mediciones33,43,44. Además, los estudios han evidenciado inconsistencias en la correlación entre los niveles de pepsina salival, los hallazgos de la HEMII-pH y las manifestaciones clínicas. Estas discrepancias podrían atribuirse a la posible participación de otras enzimas gastroduodenales en la inflamación de la mucosa y en la generación de los síntomas33.
Cuestionarios validadosLos panelistas están de acuerdo en que los cuestionarios de resultados reportados por los pacientes (PROMs, por sus siglas en inglés) constituyen herramientas muy útiles para evaluar la gravedad, la frecuencia y el impacto de los síntomas sobre la calidad de vida en diversas patologías. Su uso permite optimizar tanto la valoración inicial como el seguimiento posterior al tratamiento.
En el contexto del RFL, el índice de síntomas de reflujo (RSI, por sus siglas en inglés) es el instrumento más utilizado. Este cuestionario autoadministrado de nueve ítems permite valorar subjetivamente la intensidad y la frecuencia de los síntomas en una escala de 0 a 5, estableciéndose una puntuación de 13 o más para sugerir la posible presencia de RFL en el paciente31.
Otro instrumento ampliamente utilizado es la puntuación de los síntomas de reflujo (RSS, por sus siglas en inglés), compuesto por 22 ítems diseñados para evaluar subjetivamente el impacto del RFL en la calidad de vida del paciente45. Su versión abreviada, el RSS-12, ha demostrado ser una alternativa eficaz y más ágil en su cumplimentación46. Aunque se ha señalado que el RSS-12 presenta mayor consistencia que el RSI47, su utilización en la práctica clínica otorrinolaringológica sigue siendo limitada. Este hecho refleja una discrepancia entre las recomendaciones de la literatura y la adopción de estos instrumentos en la práctica clínica real, lo que sugiere la necesidad de estrategias para fomentar su utilización.
Es importante destacar que, si bien los PROMs como el RSI y el RSS permiten documentar la presencia y la evolución de los síntomas, no poseen valor diagnóstico en sí mismos debido a la superposición de manifestaciones con otras patologías irritativas laringofaríngeas. En consecuencia, estos cuestionarios no tienen valor diagnóstico para el RFL, sino que cumplen la función de documentar la presencia y la evolución de síntomas laringofaríngeos antes y después del tratamiento. Por lo tanto, no pueden sustituir a las herramientas diagnósticas objetivas disponibles13.
Al igual que los síntomas, los hallazgos endoscópicos en pacientes con RFL presentan una baja especificidad, ya que signos inflamatorios similares pueden observarse en múltiples enfermedades del tracto aerodigestivo superior. Esta falta de especificidad señala la necesidad de complementar la evaluación con herramientas clínicas adicionales.
La puntuación de los hallazgos de reflujo (RFS, por sus siglas en inglés) es una de las escalas más utilizadas en la evaluación de los hallazgos laringoscópicos asociados al RFL. Esta escala permite graduar la presencia y la gravedad de ocho signos laringoscópicos característicos en pacientes con sospecha de RFL48. Sin embargo, la literatura describe una notable variabilidad intraobservador e interobservador en su aplicación, lo que afecta su reproducibilidad. Esta discrepancia entre la utilidad teórica del RFS y su aplicabilidad clínica real indica la importancia de estrategias para mejorar su fiabilidad, como la implantación del empleo de guías ilustradas con imágenes, una recomendación que ha sido planteada por el CC durante la discusión del actual consenso.
Tratamientos habituales y recomendacionesLas modificaciones higiénico-dietéticas representan la primera línea terapéutica en el manejo del RFL (nivel de acuerdo entre nuestros especialistas del 90,8%), y su importancia ha sido ampliamente respaldada por la literatura49-51.
La adherencia a una dieta específica contra el reflujo gastroesofágico es importante para optimizar el control sintomático y, a largo plazo, posibilitar la reducción progresiva o incluso la suspensión del tratamiento farmacológico. Además, la instauración de cambios en el estilo de vida contribuye a la disminución de la dependencia de fármacos1.
Entre las medidas higiénico-dietéticas, con mayor consenso entre los panelistas, para el tratamiento del RFL se incluyen las siguientes: evitar la ingesta de alimentos y bebidas como mínimo en las dos horas previas a la realización de ejercicio intenso o al momento de acostarse; reducir el consumo de grasas y evitar comidas copiosas, ya que pueden favorecer el reflujo; eliminar o minimizar el consumo de cafeína, alcohol y nicotina, agentes que pueden disminuir la presión del EEI; elevar la cabecera de la cama para reducir la probabilidad de episodios de reflujo nocturno; intentar controlar el estrés, dado su posible impacto en la exacerbación de los síntomas; tratar de adoptar la posición de decúbito lateral izquierdo al dormir, lo que puede contribuir a disminuir los episodios de reflujo, y evitar el uso de fajas, cinturones ajustados o ropa ceñida en la zona abdominal, ya que pueden incrementar la presión intraabdominal y favorecer el reflujo49-51.
Sin embargo, la adopción de estas modificaciones es variable entre los pacientes. Una proporción significativa de pacientes no sigue estas pautas, a menudo debido a barreras relacionadas con hábitos de vida arraigados o la falta de educación nutricional específica. Esta falta de adherencia es especialmente frecuente en aquellos pacientes sin síntomas típicos de ERGE, al no comprender que sus síntomas otorrinolaringológicos sean secundarios a reflujo. En estos casos se consensuó, con prácticamente un 94% de acuerdo, que podría ser recomendable prescribir, además, tratamiento farmacológico durante las fases iniciales del manejo (1-2meses).
En cuanto al tratamiento farmacológico, los encuestados destacan que los IBP son el pilar terapéutico del RFL52. También se consideró que en pacientes con RFL intenso puede ser adecuado incrementar al doble la dosis estándar del IBP. En estos casos, la administración de una dosis única doble de IBP en ayunas por la mañana puede ser efectiva; sin embargo, desde un punto de vista farmacocinético parece más recomendable dividir la dosis doble única en dos dosis estándar separadas en 12horas, una antes del desayuno y otra antes de la cena52,53.
Se han explorado estrategias de desescalada terapéutica, como la combinación de IBP con alginatos, que podría permitir una reducción de la dosis de IBP sin comprometer el control sintomático54. El RFL, independientemente de su carácter débilmente ácido o alcalino, puede ser tratado eficazmente con alginatos o con alginatos en combinación con antiácidos. Los alginatos forman una barrera protectora sobre el contenido gástrico, lo que disminuye significativamente los episodios de reflujo gastroesofágico y reduce el riesgo de afectación del tracto aerodigestivo superior55,56.
Adicionalmente, se aceptó con un nivel de acuerdo del 90,8% que los productos que contienen ácido hialurónico y agentes con efecto barrera específicos, como la queratina, presentan propiedades reparadoras y regenerativas para el epitelio dañado por el RFL. Además, desempeñan un papel protector frente al daño oxidativo y las enzimas proteolíticas, como la pepsina57-60.
Manejo clínico y seguimiento de los pacientes con RFLLos panelistas coincidieron en que el manejo del paciente con RFL requiere un enfoque multidisciplinar en el que colaboren estrechamente especialistas en otorrinolaringología y gastroenterología. Dado que el RFL es una manifestación de una patología digestiva con repercusiones en la esfera otorrinolaringológica, su diagnóstico y tratamiento no deben limitarse a una única especialidad19. Esta apreciación está en la línea con la literatura reciente que destaca la necesidad de un enfoque multidisciplinar en el manejo del RFL, con la colaboración estrecha entre otorrinolaringólogos y especialistas en aparato digestivo1,13.
Si bien los pacientes suelen acudir inicialmente al otorrinolaringólogo por síntomas como disfonía, carraspeo o sensación de cuerpo extraño faríngeo, es fundamental que el especialista en aparato digestivo evalúe la presencia de síntomas atípicos y manifestaciones extraesofágicas de la ERGE, siendo el RFL la más frecuente61. La identificación y la caracterización de estos síntomas permiten optimizar el abordaje terapéutico y mejorar los resultados clínicos.
Dado el curso clínico del RFL, que puede presentarse de manera aguda, crónica o recurrente, el tratamiento debe ser individualizado y sostenido en el tiempo. La terapia farmacológica, basada principalmente en IBP y medidas complementarias como modificaciones dietéticas y cambios en el estilo de vida, debe mantenerse de forma prolongada, continua o intermitente, según la evolución del paciente, hasta lograr un control sintomático adecuado y la resolución de las lesiones asociadas. Aunque esta declaración está en línea con la literatura que apoya el uso de IBP en combinación con modificaciones en el estilo de vida y cambios dietéticos49-51, hubo una falta de consenso entre los panelistas sobre la duración óptima del tratamiento con IBP, lo que sugiere la necesidad de estudios adicionales para establecer protocolos estandarizados basados en la evolución sintomática del paciente.
También se acordó que durante el seguimiento de un paciente con RFL el otorrinolaringólogo debe evaluar el cambio de hábitos y el manejo del estrés50, ajustar la medicación si hay mejoría62, seguir la evolución de los síntomas con cuestionarios RSI o RSS y realizar una endoscopia faringolaríngea para detectar cambios endoscópicos31,47. Por su parte, el especialista en aparato digestivo debe descartar síntomas de alarma como la disfagia o la pérdida de peso, comprobar la adherencia al tratamiento y monitorizar el control de síntomas. En casos refractarios al tratamiento, se recomienda una evaluación conjunta entre ambas especialidades.
No obstante, estas herramientas no son utilizadas de manera sistemática en la práctica clínica. Además, el seguimiento de la adherencia al tratamiento y la detección de síntomas de alarma, como la disfagia o la pérdida de peso, parecen no estar estandarizados, lo que podría influir negativamente en la detección temprana de complicaciones.
Estrategias para optimizar la detección y el abordaje clínicoA partir de los resultados obtenidos en el consenso, se identificaron diversas áreas de mejora que podrían optimizar la identificación, el diagnóstico y el manejo del RFL. Aunque la existencia de una definición clara representa un avance significativo, todavía persisten desafíos en cuanto a su detección en la práctica clínica, la uniformidad en los criterios diagnósticos y la formación de los profesionales de la salud.
- •
Una vez acordada una definición clara, sería de gran interés llevar a cabo estudios de prevalencia que permitan comprender con mayor precisión la magnitud del RFL en diferentes poblaciones. La recopilación de datos epidemiológicos fiables no solo facilitaría la identificación de grupos de riesgo, sino que también contribuirá al desarrollo de estrategias de intervención más efectivas.
- •
Dada la considerable variabilidad tanto intraobservador como interobservador de algunos de los cuestionarios actuales, como el RFS, sería conveniente desarrollar y validar una herramienta más sencilla y estandarizada. Cuestionarios más accesibles y con menor margen de subjetividad favorecerían una mejor identificación de los casos y una mayor reproducibilidad de los resultados, facilitando su aplicación tanto en el ámbito clínico como en estudios de investigación.
- •
Los médicos de atención primaria son el primer punto de contacto de muchos pacientes con el sistema de salud, por lo que es importante fortalecer sus conocimientos en este ámbito. La formación específica en la detección y el abordaje del RFL mejoraría el diagnóstico temprano y podría evitar derivaciones a especialistas en casos que no son necesarios, optimizando así los recursos del Sistema Nacional de Salud.
- •
Aunque se ha señalado que el RSS-12 presenta mayor consistencia que el RSI47, su uso en la práctica clínica otorrinolaringológica sigue siendo limitado. Sería altamente recomendable aumentar la difusión de este cuestionario entre los especialistas en otorrinolaringología, ya que desempeña un papel clave en la confirmación diagnóstica. Garantizar que los otorrinolaringólogos conozcan y cuenten con herramientas validadas y actualizadas podría permitir un diagnóstico más preciso y homogéneo, reduciendo la variabilidad en la interpretación de los resultados y favoreciendo un manejo clínico más adecuado.
Este estudio presenta diversas fortalezas que refuerzan la validez y la relevancia de los resultados. En primer lugar, destaca su enfoque multidisciplinar, integrando las perspectivas de otorrinolaringólogos y especialistas en aparato digestivo, lo cual resulta esencial, dado que el RFL se sitúa en la intersección de ambas especialidades. Esta visión complementaria permite un abordaje más completo y preciso de la patología.
Además, la amplia representatividad geográfica de los panelistas, reflejo de la realidad asistencial de las comunidades autónomas españolas, proporciona una visión nacional del manejo del RFL en España. Los participantes cuentan con una media de 17años de experiencia clínica, lo que asegura un alto nivel de conocimiento en el tema.
Finalmente, la rigurosa metodología Delphi utilizada aporta solidez a los resultados, con criterios de consenso claramente definidos (80% de acuerdo) y un proceso iterativo que permitió refinar las declaraciones hasta alcanzar un alto grado de validación (74,2% en la segunda ronda).
No obstante, el estudio también presenta ciertas limitaciones, como es el ligero desequilibrio en la proporción de especialistas participantes, con una mayor representación de otorrinolaringólogos (63,1%) en comparación con especialistas en aparato digestivo (36,9%). Este sesgo en la composición del panel podría haber influido en la orientación de algunas recomendaciones hacia la perspectiva otorrinolaringológica.
ConclusiónEl estudio realizado establece un consenso entre especialistas en otorrinolaringología y aparato digestivo de todo el territorio nacional español que describe y proporciona información relevante del diagnóstico, el manejo y el tratamiento del RFL en nuestro país, fomentando la investigación conjunta y la adopción de enfoques comunes basados en la evidencia de esta enfermedad.
La difusión de este consenso busca consolidar el conocimiento de expertos en la materia, sirviendo como una referencia rigurosa y actualizada para mejorar la práctica clínica y guiar futuros estudios que optimicen el abordaje de esta patología.
FinanciaciónLaboratorios CINFA S.A. ha sido el promotor y financiador de este proyecto, pero no ha participado ni ha influido en la opinión de los participantes en la elaboración de la encuesta, en el análisis estadístico, en la discusión de los resultados ni en la redacción del artículo, que han sido responsabilidad de CROSSDATA y del comité de expertos que firman como autores del artículo en nombre del grupo de trabajo ReFaL.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses.
AgradecimientosLos autores expresan su agradecimiento a los laboratorios CINFA S.A. por su incondicional apoyo para la realización de este proyecto, sin interferir en el contenido, el desarrollo y la redacción de este consenso.
Asimismo, agradecemos a CROSSDATA, una Contract Research Organization (CRO), cuya participación ha resultado esencial para el desarrollo integral de este trabajo. CROSSDATA ha estado implicada en todas las fases del estudio, aportando soporte metodológico y técnico, desde la concepción y el diseño del proyecto, pasando por la coordinación de la recogida y el análisis de los datos, hasta la ayuda para la interpretación crítica de los resultados y la elaboración del presente manuscrito.
A. López Jerez (H. Central de la defensa Gómez Ulla, Madrid); A. de Vicente Ortega (H. Antequera, Málaga); A. Elvira Machado Martin (H. Quirón Pozuelo, Madrid); A. Karina Papapietro Méndez (Torreblanca, Teknon, Hostafranc, Barcelona); A. Lemes Robayna (H.U. de Canarias, Santa Cruz de Tenerife); B. Mateos Serrano (H. Quirón Salud Sur y H.U. La Paz, Madrid); C. Teruel Sánchez-Vegazo (H.U. HM Sanchinarro, Madrid); C. Argüelles Martínez de la Vega (H.U. San Agustín, Asturias); C. García Bastida (H. Álvaro Cunqueiro, Pontevedra); C. de Zárraga Mata (H. de Manacor, Baleares); C. Romeu Figuerola (H.C. de Mora d’Ebre i H.C. d’Amposta, Tarragona); C. Herrero Fernandez (H.U. del Sureste, Arganda del Rey, Madrid); C. Vaduva (H.U. de Getafe, H.U. HM Puerta del Sur, Madrid); D. Carral Martínez (H. San Rafael, La Coruña); D. Castro Gutiérrez de agüeras (H.U. Virgen del Rocío, Sevilla); D. Anibal Olazarri (H. de Palamós, Girona); D. Hellín Meseguer (H.C.U. Virgen de la Arrixaca, Murcia); E. Garrido Gómez (H.U. Ramón y Cajal, Madrid); E. Mora Rivas (H.U. Ramón y Cajal, Madrid); E. Montiel Díez (H.U. de Getafe, Madrid); E. Úbeda Fernández (H.G.U. de Ciudad Real, Ciudad Real); E. Fuster Martín (H.R.U. de Málaga, Málaga); F. Estremera Arévalo (H.U. de Navarra, Navarra); F. López Álvarez (H.U.C. de Asturias - HUCA, Asturias); F. Jaume Monroig (H.C. d’Inca, Baleares); F. Garcia-Purriños (H.U. Mar Menor, Murcia); F. Valcárcel Martín (H.U. Cruces, Bizkaia); G. Cardenete Muñoz (H.G.U. de Ciudad Real, Ciudad Real); G. Celis Morata (Hospital CIMA, Barcelona); I. Clemente Agodino (H.U. Mútua de Terrassa, Barcelona); I. Grilo Bensusan (H.A.R. Écija, Sevilla); J. Remacha Sardà (H. Clínic Barcelona, Barcelona); J.X. Segarra Ortega (Complejo Asistencial Universitario de Salamanca, Salamanca); K. Aspuru Rubio (H. de Barbastro, Huesca); L. Pérez Delgado (H.U. Miguel Servet de Zaragoza, Zaragoza); L. Sanchis Artero (H. Sagunto, H. Casa Salud, Valencia); L.E. Cubillos del Toro (H.G. de Villalba, Madrid); M.T. Cuesta González (H.U. Dr. Peset, Valencia); M. Acuña García (H. Recoletas Campo Grande, Valladolid); M. Bracho González (H. de Antequera, Málaga); M.A. Álvarez de Toledo y Jeute (H.U. Virgen del Rocío, Sevilla); M.C. Trapero Domínguez (H. Quirón, Málaga); M.D. Arjona Muñoz (H. Quirón Salud Campo de Gibraltar, Cádiz); M.L. Callejo Goena (H.U. de Navarra, Navarra); M. Rey Marcos (C.H.U. de Ourense, Ourense); M. Cardier Suarez (C.U. Navarra, Navarra); M. Aparicio Cabezudo (H.C. San Carlos, Madrid); M.A. Landa Aranzabal (H.U. Donostia, Guipúzcoa); M. García Teno (H.U. de Puerto Real, Cádiz); N. Llópez Carratalá (H.U.P. la Fe y Grupo ORL Valencia, Valencia); O. Núñez Martínez (H.U. Sanitas La Moraleja, Madrid); P.L. Parente Arias (C.H.U. A Coruña, A Coruña); P. Corriols Noval (H. Valdecilla, Cantabria); P. Gil Simón (H. Rio Hortega, Valladolid); P. González Carro (H.G. Mancha Centro, Alcázar de San Juan, Ciudad Real); R.I. Baños Madrid (H. H.U. Puerta del Mar, Cádiz); R. López Diu (Centre Especialitats Mèdiques Gema, Barcelona); S. Blanco Rey (H.U. Infanta Elena, Madrid).