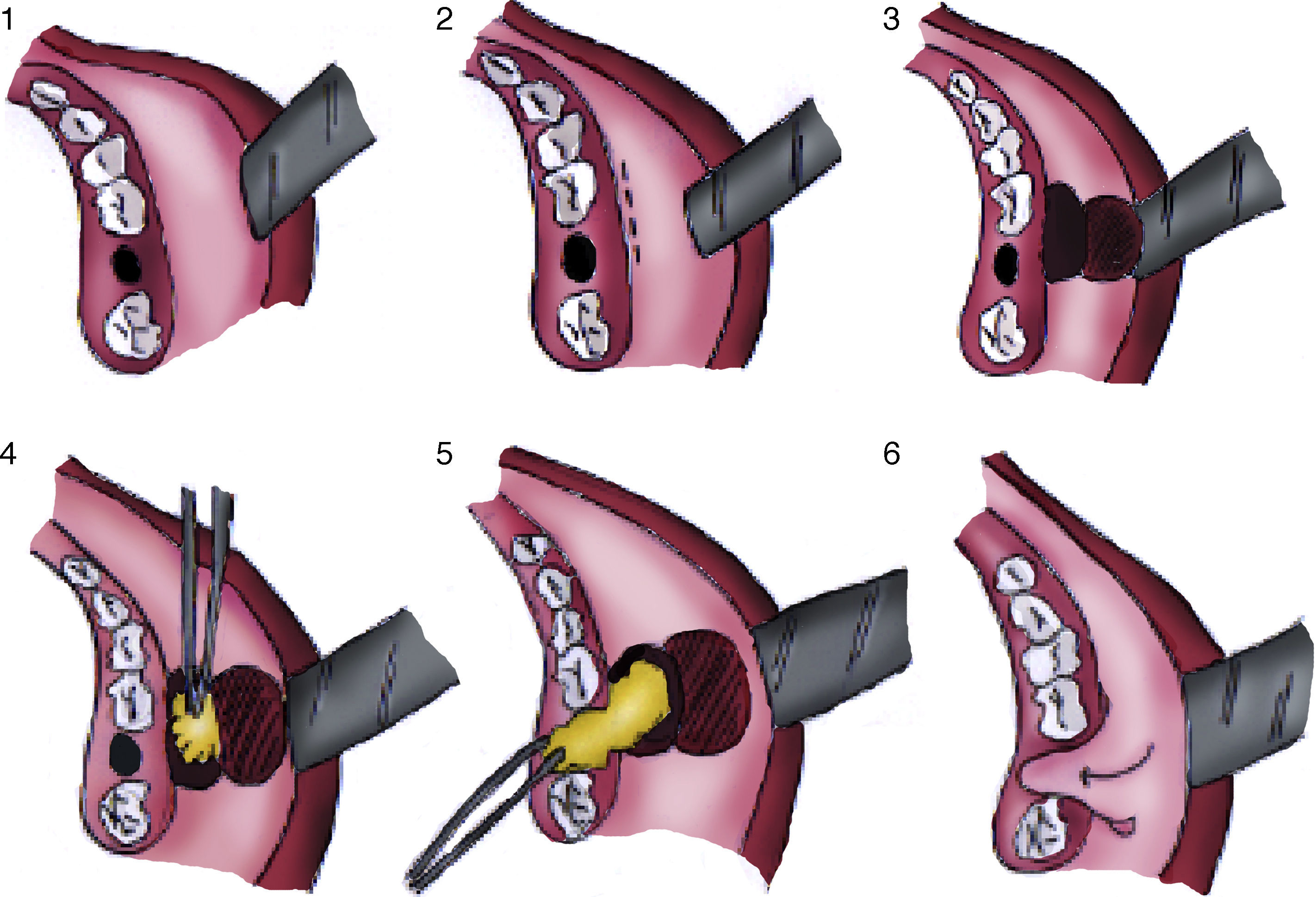
La sinusitis odontógena da cuenta del 10 a 12% de los casos de sinusitis maxilar y ocurre por una interrupción del mucoperiostio en respuesta a varias condiciones, siendo la más frecuente la extracción de una pieza dentaria superior. Su manejo consta de dos pilares; tratar la inflamación e infección sinusal y el manejo de la fístula oroantral que perpetúa la infección. Las comunicaciones menores de 5mm se pueden resolver espontáneamente, pero las mayores se deben cerrar por distintas técnicas de colgajos. El uso de la bolsa de Bichat para cerrar la fístula oroantral se documentó por primera vez en 1977. Es un colgajo pediculado que ha demostrado ser exitoso y tiene varias ventajas que lo hacen el método de elección de tratamiento de la fístula oroantral: su ubicación permite su fácil uso, mínima disección, tiene gran versatilidad, buena movilidad, gran aporte sanguíneo, baja tasa de complicaciones, escasa morbilidad del sitio donante, bajo riesgo de infección, rápida técnica quirúrgica, rápida epitelización, sin cicatriz visible, entre otras. Es por esto que promovemos el uso de esta técnica y la presentamos como la mejor opción en la actualidad para nuestros pacientes.
Odontogenic sinusitis accounts for 10-12% of maxillary sinusitis. It occurs due to an interruption of the mucoperiosteum in response to a series of conditions, most frequently the extraction of a superior tooth. Its treatment has two bases: treating the infection and managing the oroantral fistula that perpetuates the infection. Communications smaller than 5mm can resolve spontaneously; bigger ones must be closed by a flap. Bichat's fat pad flap was first used in 1977 to close an oroantral fistula. It is a pedicled flap that has been shown to be successful, with advantages that make it the best option in oroantral fistula treatment. Its location allows easy access, minimum dissection, great versatility, good mobility, good blood supply, low rate of complications, no morbidity in the donor site, low risk of infection, shortened surgical time and fast cover by epithelium, and it leaves no visible scar, amongst other benefits. That is why we encourage the use of this technique and choose it as the best option for management of our patients.