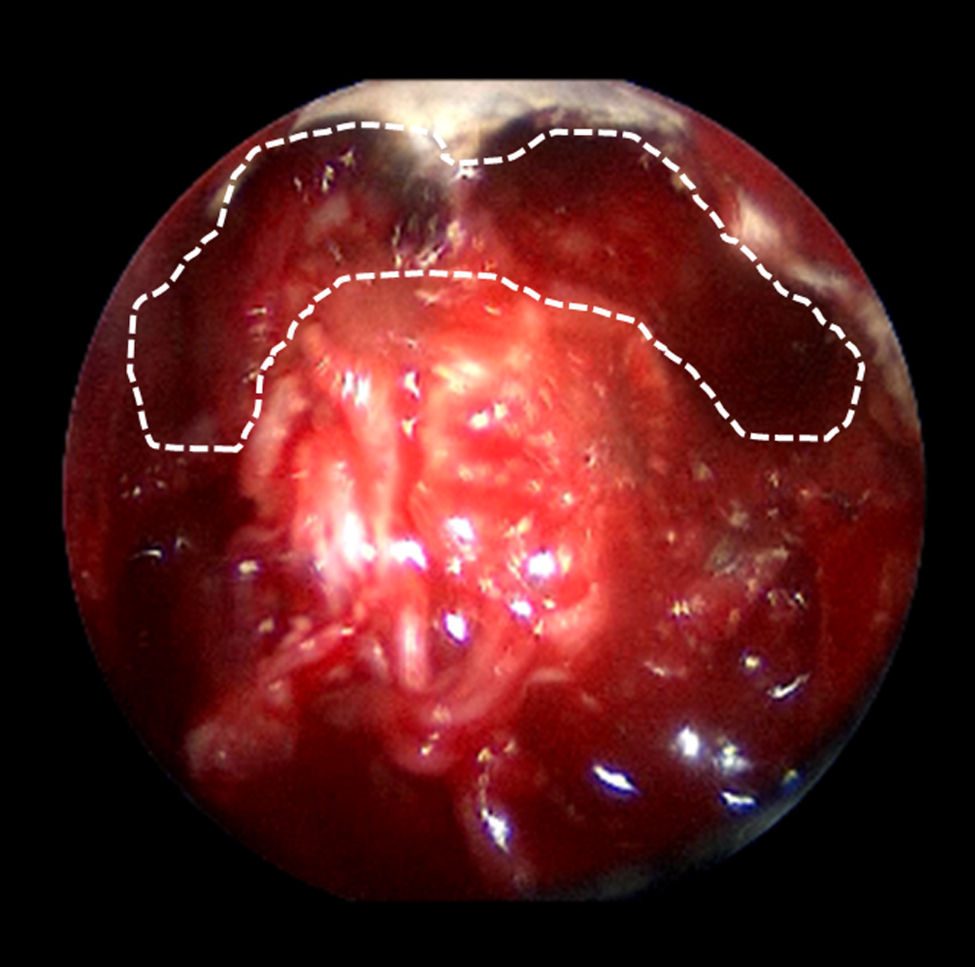
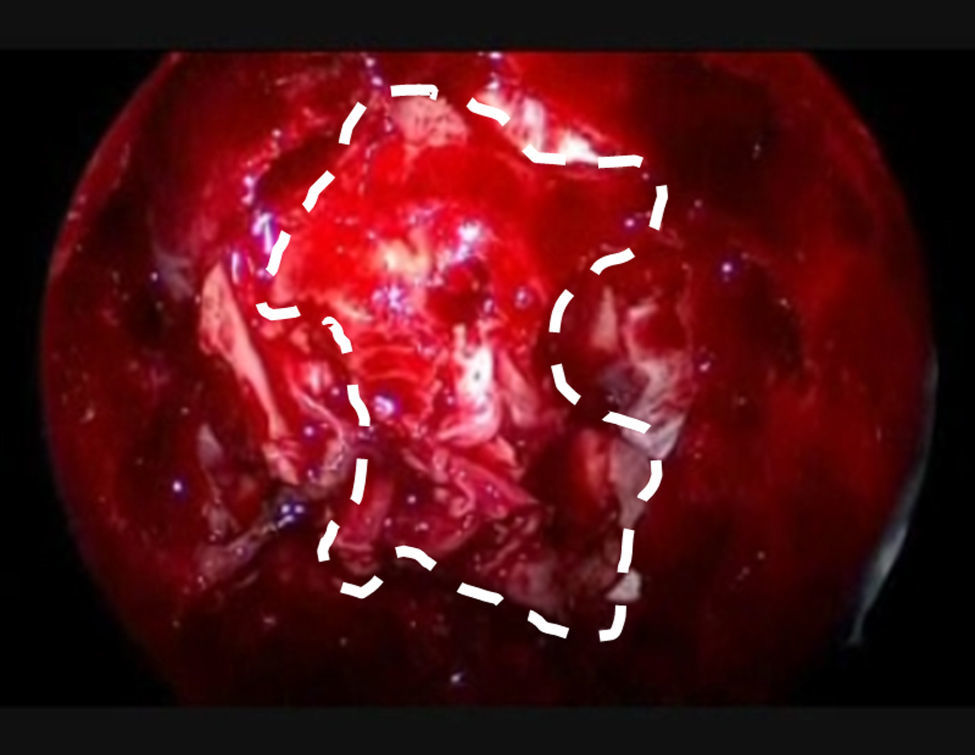
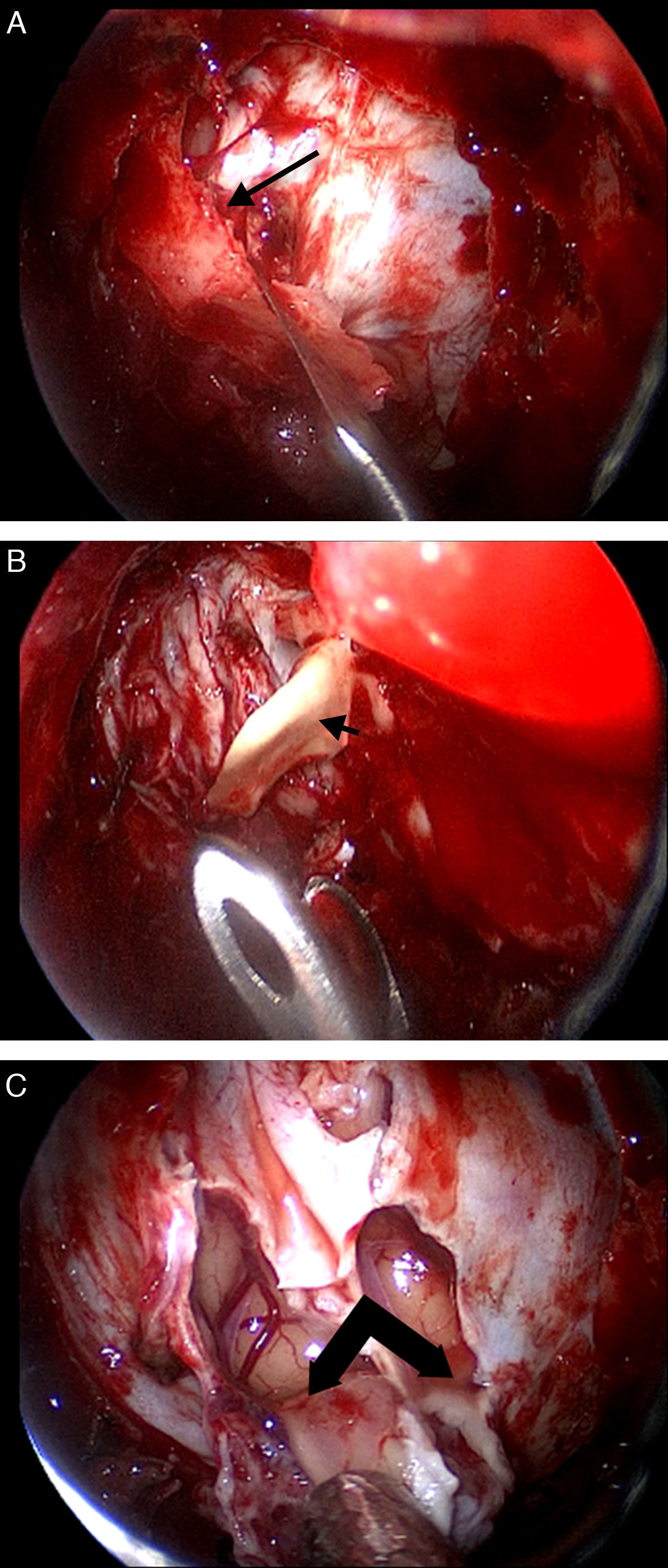
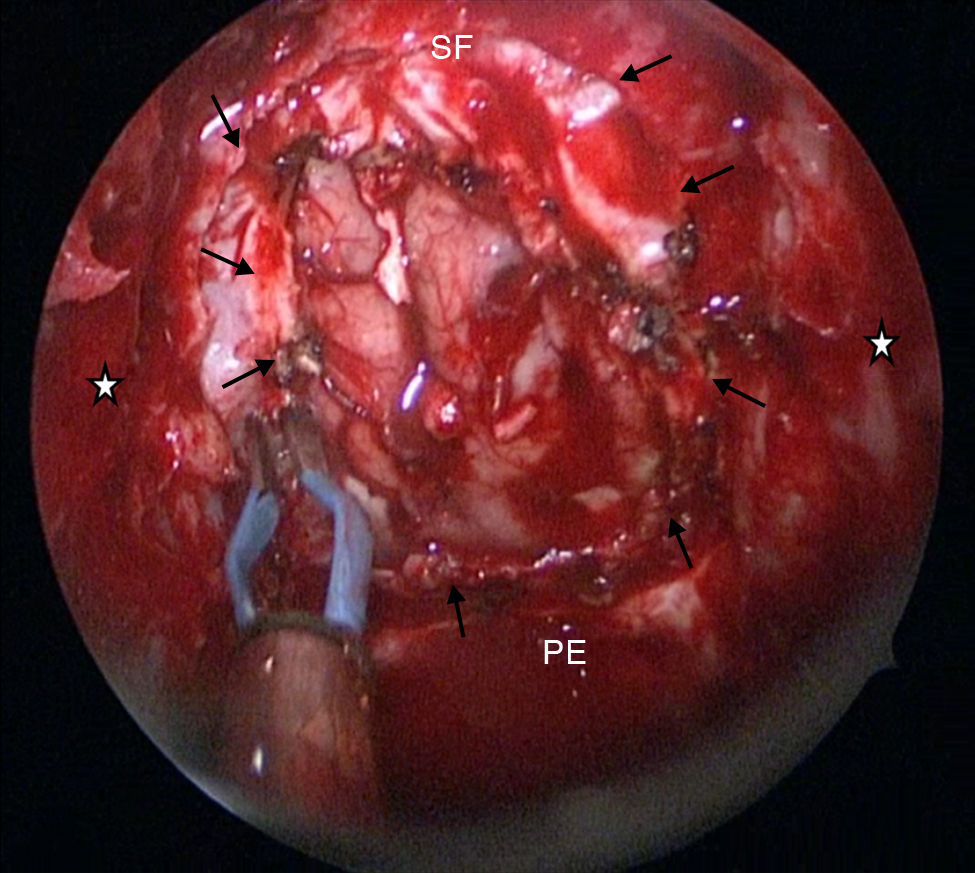
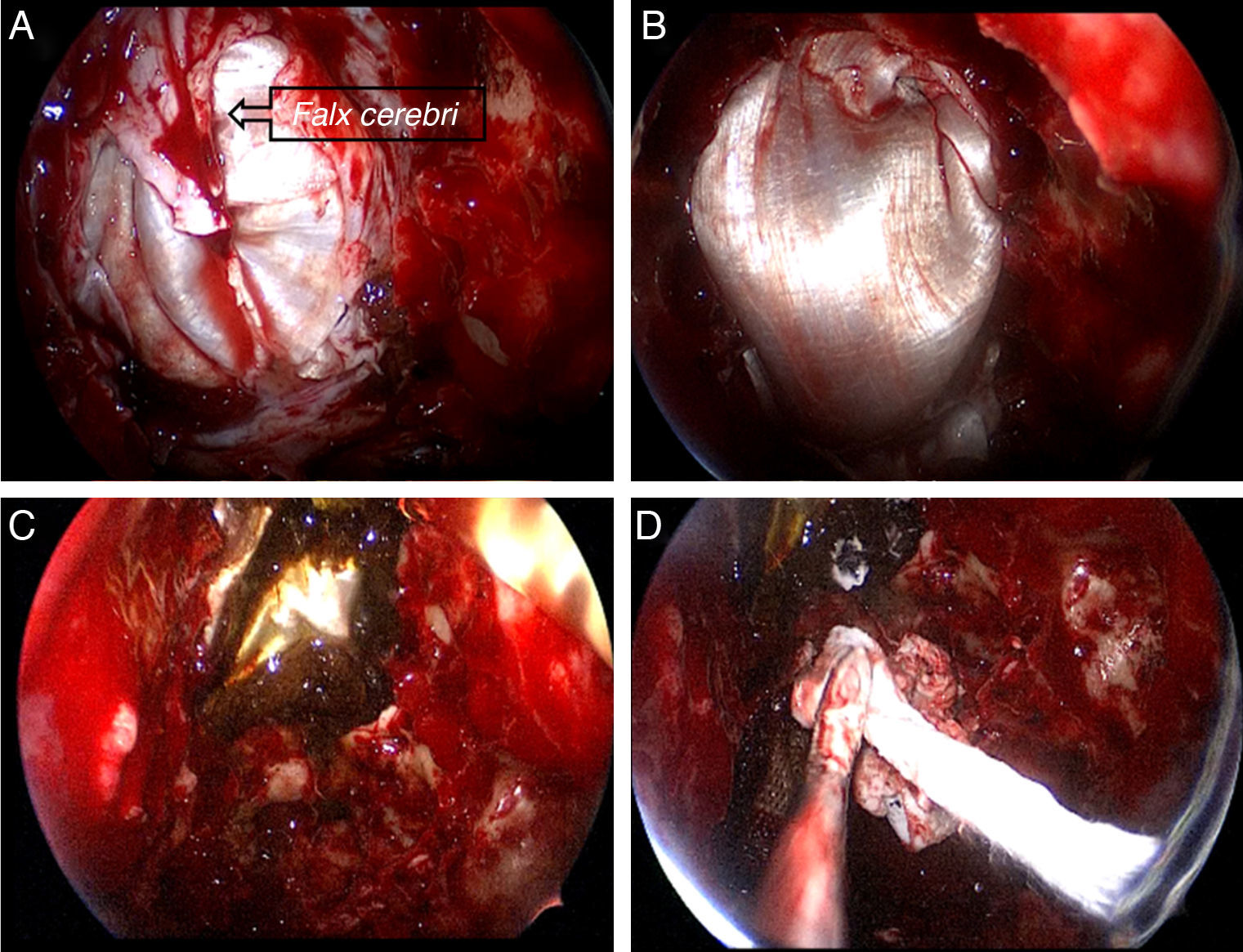
La resección craneofacial (RCF) anterior es un procedimiento bien establecido para el tratamiento de los tumores que afectan la base del cráneo anterior. Exponemos la técnica empleada en el tratamiento endoscópico de estos tumores.
Material y métodoSe realiza un análisis retrospectivo de los tumores tratados en nuestro servicio entre los años 2004 y 2011 mediante una RCF endoscópica.
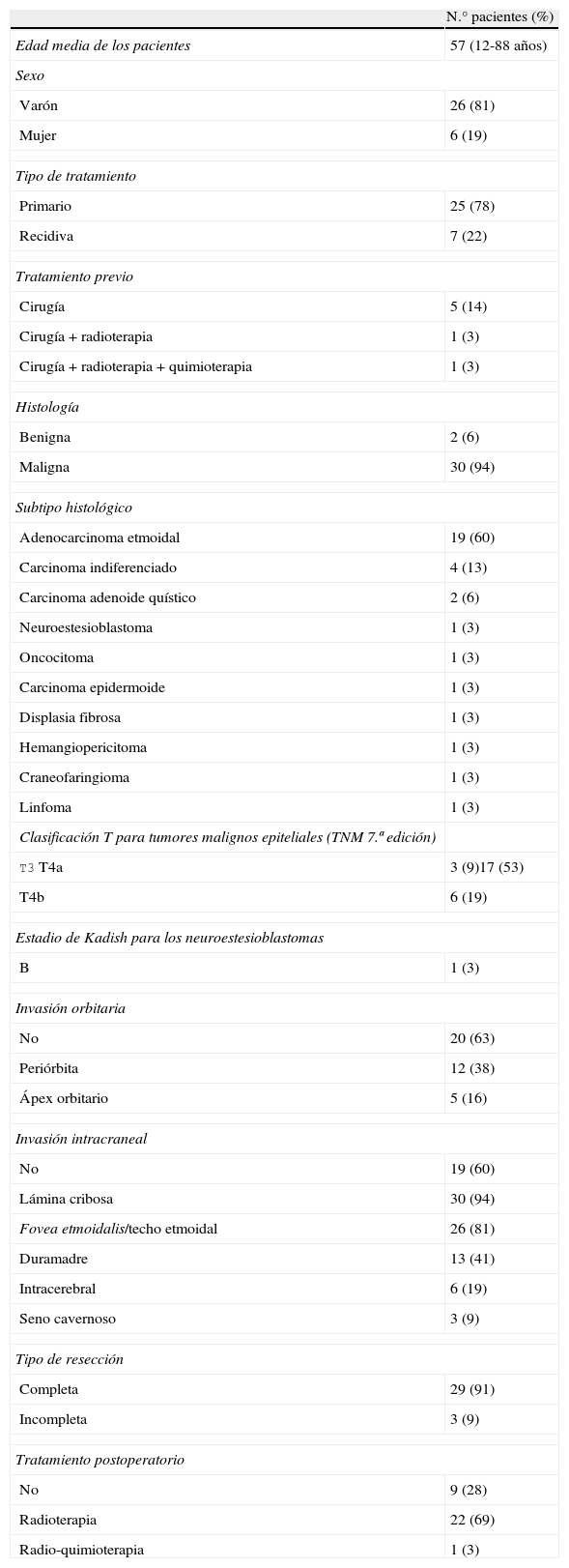
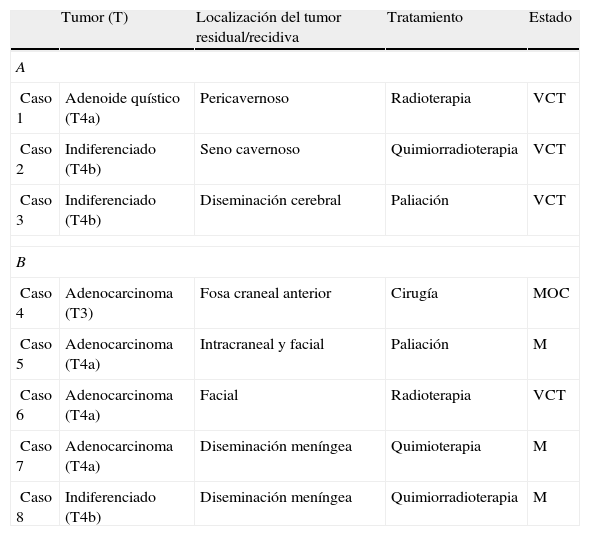
ResultadosFueron analizados 32 pacientes. El seguimiento medio fue de 28 meses (rango: 6-84 meses). Los tumores más frecuentes fueron los adenocarcinomas de etmoides (60%) seguido de los carcinomas indiferenciados (13%). El 9% de los tumores de origen epitelial pertenecían a la categoría T3, el 53% eran T4a y el 19% T4b. La tasa de complicaciones fue del 6% y la resección fue completa en el 91% de los pacientes. Durante el seguimiento de los pacientes, el 9% presentaron una recidiva a nivel local. La supervivencia media y la supervivencia libre de enfermedad fue del 70 y del 85% a los 5 años, respectivamente.
ConclusionesLos resultados obtenidos permiten afirmar que, en casos seleccionados, la RCF endoscópica es una alternativa válida a los tradicionales abordajes abiertos en términos oncológicos y funcionales.
Anterior craniofacial resection (CFR) is a standardised procedure for the treatment of tumours involving the anterior skull base. We present our experience in the endoscopic treatment of these tumours.
Material and methodA retrospective analysis was performed of patients treated by endoscopic anterior CFR in our Department from 2004 until 2011.
ResultsThirty-two patients were analysed. Mean follow-up was 28 months (range: 6-84 months). The most frequent pathological entity was adenocarcinoma (60%), followed by undifferentiated carcinoma (13%). According to TNM classification, malignant epithelial tumour staging was T3 in 9%, T4a in 53% and T4b in 19% of the malignant epithelial tumours. The complication rate was 6% and the resection was complete in 91% of cases. During follow-up, 9% of patients developed recurrence. The 5-year overall survival rate was 70% and the 5-year disease-free survival rate was 85%
ConclusionThese results seem to indicate that properly planned endoscopic CFR may be a valid alternative to traditional open approaches for the management of malignancies of the anterior skull base.