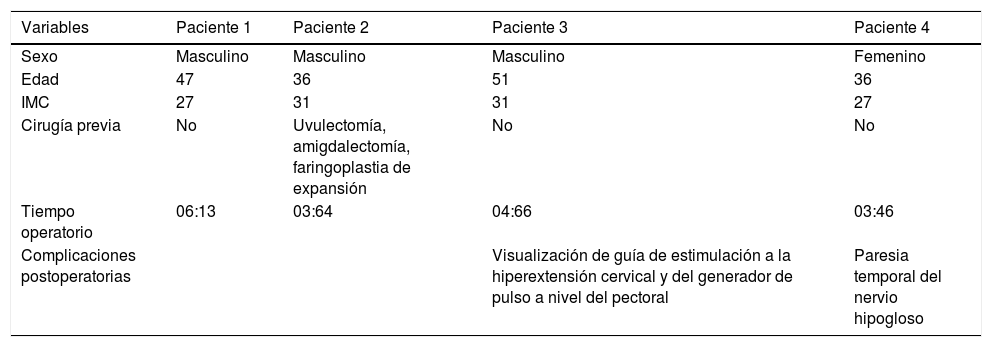
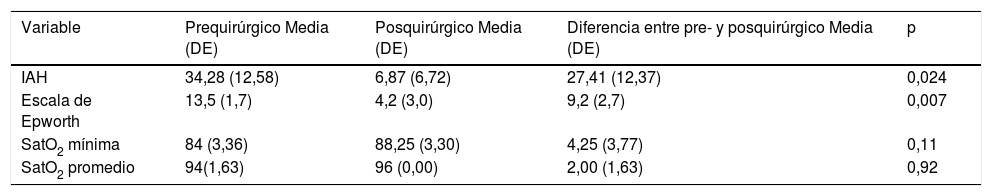
El objetivo de esta comunicación es presentar nuestros resultados preliminares en la cirugía de estimulación de la vía aérea mediante el implante de estimulador de nervio hipogloso para el síndrome de apnea obstructiva del sueño. Presentamos 4 casos en los que se valoraron los resultados de la cirugía empleando la escala de Epworth, el índice de apneas-hipopneas, SatO2 mínima, SatO2 promedio y la intensidad del ronquido. En los 4 casos se evidenció una disminución significativa de los valores de la escala de Epworth y el índice de apneas-hipopneas (p < 0,05). La saturación de oxígeno mínima y promedio tuvo mejores valores en el posquirúrgico; sin embargo, la diferencia no fue estadísticamente significativa. La severidad de los ronquidos medida de forma subjetiva pasó de «intensa» en todos los casos a «ausente». Los resultados preliminares obtenidos ponen en evidencia una mejora tanto objetiva como subjetiva tras la activación del implante.
The objective of this communication is to describe our preliminary results in upper airway stimulation surgery via hypoglossal nerve stimulation implantation for obstructive sleep apnoea. We describe 4 cases and the outcomes of the surgery were analysed using the Epworth scale, apnoea-hypopnoea index, minimal O2 Sat, average O2 Sat and snoring intensity. In all cases a significant reduction in Epworth scale values and apnoea-hypopnoea index were obtained (P<.05). The minimum and average oxygen saturation had better values after the surgery, however, there was no statistically significant difference. The snoring severity measured subjectively changed from «intense» to «absent» in all cases. The preliminary results obtained with the upper airway stimulation surgery via hypoglossal nerve stimulation showed objective and subjective improvement after the implant activation.