La prevalencia de los niveles de sedación profunda varía entre el 35 y el 68% en pacientes adultos con ventilación mecánica, que se asocian a múltiples complicaciones, al aumento en la estancia hospitalaria y del costo, por lo que es imperativo el uso racional y seguro de la sedación. Describimos cómo utilizar el monitor BIS® y sus diferentes parámetros clínicos para el uso adecuado de la sedación en cuidado crítico. A su vez, hacemos una revisión de la literatura y demostramos con los diferentes estudios sus ventajas: primero, como complemento de la escala de agitación-sedación de Richmond (RASS), la BIS puede identificar con fiabilidad la sedación profunda; segundo, se asocia con una disminución del uso de medicamentos y de los costos; tercero, se relaciona con una reducción de las complicaciones médicas, como la depresión respiratoria, la aspiración, el delirio y las estancias prolongadas en UCI derivadas de la sedación excesiva.
The prevalence of deep sedation levels varies between 35 and 68% in adult patients with mechanical ventilation, which is associated with multiple complications, increased hospital stay and increased costs, making the rational and safe use of sedation imperative. We describe how to use the BIS® monitor, its different parameters of clinical use for the appropriate use of sedation in critical care. In turn, we review the literature demonstrating with different studies its advantages: first, as a complement to the Richmond Agitation Sedation Scale (RASS), the BIS can reliably identify deep sedation; second, it is associated with a decrease in the use of medications and costs; third, it is related to a reduction of medical complications such as respiratory depression, aspiration, delirium and prolonged ICU stays derived from excessive sedation.
Los pacientes adultos críticamente enfermos con ventilación mecánica (VM) requieren agentes analgésicos y sedantes para aliviar la ansiedad, reducir el estrés, minimizar la incomodidad y el dolor del tubo endotraqueal, permitir intervenciones rutinarias en la unidad de cuidado intensivo (UCI), minimizar asincronías paciente-ventilador y prevenir daños relacionados con la agitación, mientras resolvemos el proceso patológico subyacente. Todas las guías internacionales basadas en la evidencia con respecto a la sedación para pacientes con VM en UCI son consistentes en sus recomendaciones. Las guías estadounidenses, coreanas, sudamericanas, ibéricas, alemanas y del Reino Unido recomiendan una sedación ligera en lugar de profunda, a menos que sea clínicamente necesario1-4.
Estudios controlados aleatorizados indican que la focalización en niveles de sedación ligera con prueba de despertar espontáneo reducen el uso de sedantes y acortan la duración de VM y de estancia en la UCI. Se entiende por sedación ligera la inducción de un estado libre de ansiedad, con el paciente tranquilo capaz de responder a órdenes5,6. Sin embargo, en la práctica clínica es difícil mantener con éxito un nivel ligero de sedación; la ansiedad del paciente, la disrupción de los ciclos de vigilia-sueño, el ruido en la UCI y las actividades derivadas de la atención clínica hacen que los niveles de sedación fluctúen mucho. Además, ciertas enfermedades ameritan el uso de niveles de sedación profunda1,7,8.
Un elemento importante para mantener una sedación óptima es la evaluación continua de su profundidad, principalmente con el uso de escalas subjetivas, tales como la escala de agitación-sedación de Richmond (RASS) (tabla 1). Aunque las escalas validadas proporcionan una evaluación estandarizada de los niveles de sedación, su naturaleza intermitente dificulta su capacidad para detectar una sedación profunda no deseada; adicionalmente, hay una importante variabilidad interobservador1.
Escala de agitación-sedación de Richmond (RASS)
| +4 Combativo: violento, riesgo para cuidadores |
| +3 Muy agitado: se quita dispositivos de monitorización y soportes |
| +2 Agitado: movimientos desordenados sin propósito, desacople con la ventilación mecánica |
| +1 Inquieto: ansioso |
| 0 Despierto: tranquilo y colaborador |
| -1 Somnoliento: Se despierta con contacto visual por más de 10 segundos |
| -2 Sedación ligera: Despierta brevemente con contacto visual a voces por menos de 10 segundos |
| -3 Sedación moderada: Movimiento o apertura ocular a voces, pero sin contacto visual |
| -4 Sedación profunda: no hay apertura ocular a la voz, solo movimiento ocular y apertura al estimulo físico |
| -5 No despierta. No responde a voces ni a estímulo físico |
Algunos datos derivados de estudios observacionales indican que la prevalencia de niveles de sedación profunda varía entre el 35 y el 68% en pacientes adultos con VM y, a su vez, estos niveles profundos de sedación se asocian a múltiples complicaciones y al aumento en la estancia hospitalaria y del costo, por lo que es imperativo el uso racional y seguro de la sedación9.
Por otra parte, el nivel apropiado de sedación basado en escalas clínicas es difícil de mantener en grados más altos de sedación (sedación profunda) en especial en pacientes con síndrome de dificultad respiratoria aguda, que obligan con frecuencia a usar relajantes musculares. Algunos informes de casos de pacientes químicamente paralizados pero despiertos describen el terror que experimentaron. Por lo tanto, las guías de prácticas clínicas recomiendan sedación profunda, amnesia y analgesia efectiva, antes del bloqueo neuromuscular7.
Estar despierto con bloqueo neuromuscular es una complicación devastadora y en gran medida prevenible, ya que acarrea grandes secuelas psicológicas a largo plazo. Esto es de vital importancia, ya que los estudios han demostrado que hasta el 70% de los pacientes que informan estar conscientes experimentan secuelas psicológicas duraderas, que incluían síntomas graves compatibles con trastorno de estrés postraumático. Por lo tanto, se han recomendado intensos esfuerzos para evitar que ocurra. Algunos estudios de cohortes y ensayos controlados aleatorizados en Estados Unidos recogen una incidencia en el quirófano del 0,1 al 0,2%10.
Con relación a esto, una reciente revisión sistemática y metaanálisis de la literatura de estudios que evalúan el despertar en urgencia y UCI en pacientes ventilados con sedación y relajación encontraron que la incidencia parece ser mucho más alta que la informada desde el quirófano. La estimación global de incidencia de despertar fue del 12,3% (IC del 95%: 2,8-26,0%). Se realizaron 2análisis de subgrupos primarios según la calidad de los estudios (buenos o malos); para los estudios de buena calidad hubo una incidencia estimada del 3,4% (IC del 95%: 0-10,2%): muy alta comparada con la del quirófano. También se realizó un metaanálisis de subgrupos estratificado por ubicación, que reveló una estimación de incidencia en la UCI del 10,7% (IC del 95%: 0-40,9%) y en el servicio de urgencias del 14,2% (IC del 95%: 0,4-39,3%). Estos resultados indican una necesidad urgente de estudiar más a fondo esta complicación grave y prevenible para mitigar su impacto en los supervivientes de enfermedades críticas11.
Monitoreo de la sedaciónSe sabe que el electroencefalograma (EEG) cambia sistemáticamente con la dosis del fármaco sedante o anestésico. Por este motivo se han empleado en la práctica clínica distintas formas de EEG procesados para hacer un seguimiento del grado de consciencia de pacientes con sedación y anestesia general. Estos sistemas procesan el EEG y proporcionan un valor índice y un conjunto de valores casi instantáneos que pueden utilizarse para el seguimiento del grado de consciencia. Las bandas típicas de una EEG de un adulto normal incluyen 4tipos: beta (β), alfa (α), theta (θ) y delta (δ).
Existen diferentes dispositivos de electroencefalografía procesada y monitores de profundidad de la anestesia. Los 3monitores comerciales más utilizados en anestesia son: el PSI (SedLine® Masimo Inc, Irvine, CA, EE. UU.); el BIS® (BIS VISTA®, Medtronic Inc., Minneápolis, MN, EE. UU.) y el Entropy®, monitor Datex Ohmeda S/5 con módulo Entropy™ (GE Healthcare, Chicago, IL, EE. UU.)12. El monitoreo con base en el índice bispectral (BIS), introducido en los años 1990 en anestesia, es el más utilizado en la práctica clínica, ha sido validado para el manejo de la sedación perioperatoria y ha mostrado resultados positivos en el monitoreo de la sedación en la UCI13.
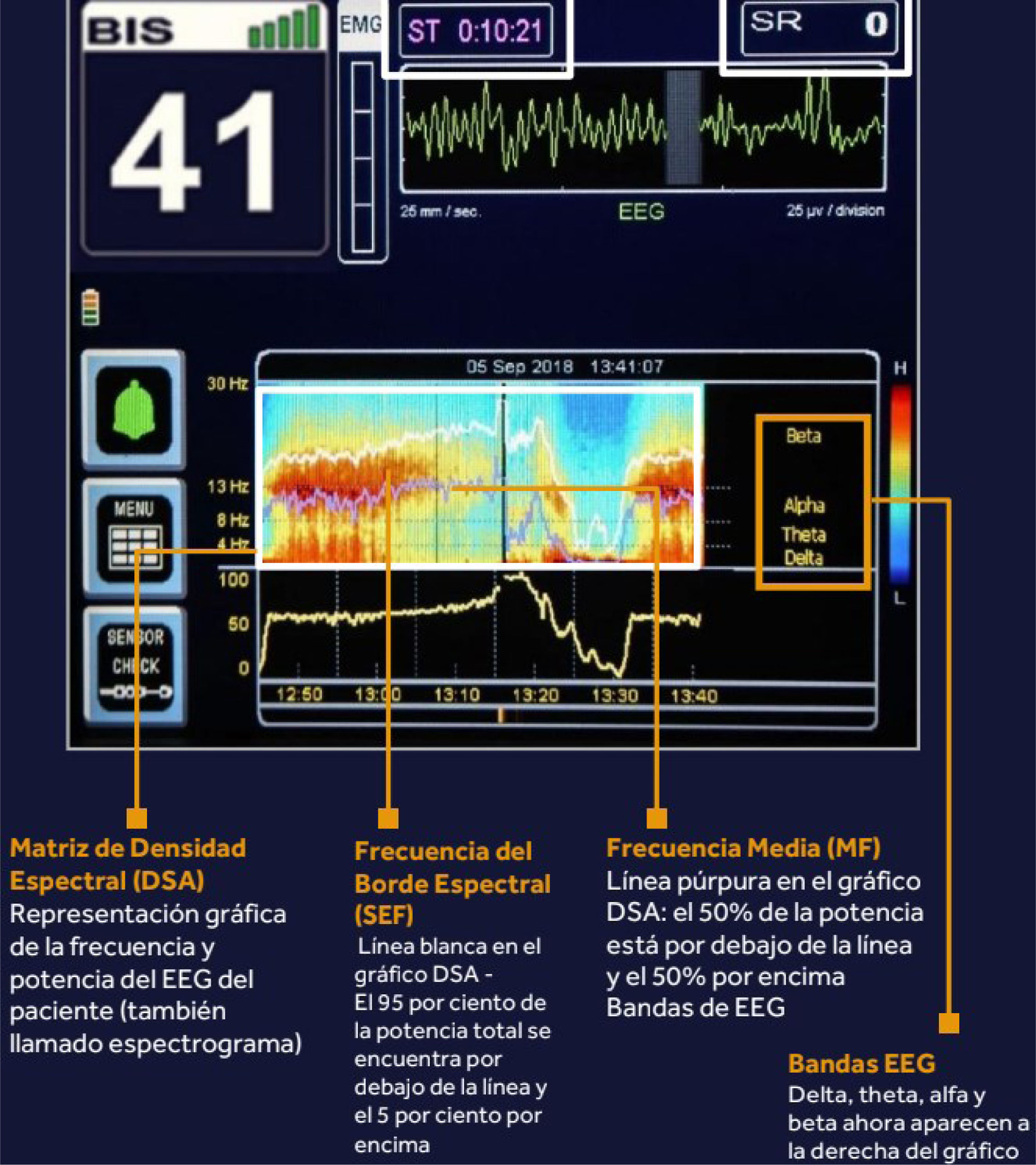
El índice de respuesta (IR) es una variable derivada de la electromiografía (EMG), propuesta para la monitorización de la sedación en la UCI. Para determinar el IR, se mide el EMG frontal con un sensor frontal, se obtiene la potencia del EMG de cada periodo de 0,5 segundos y, finalmente, el IR se obtiene con base en la serie temporal de potencia del EMG de los últimos 60 minutos14. Tanto el BIS como el IR proporcionan monitorización en tiempo real con una escala simple de 0 a 100, donde los valores bajos representan sedación profunda y los valores altos representan un aumento de la excitación. El monitor BIS® ofrece una puntuación de 0 a 100, en la que 0 representa la ausencia de función cerebral (corresponde a un estado profundo de coma o de inconsciencia que se refleja en un EEG isoeléctrico) y 100 el nivel de alerta completa del paciente. Los valores superiores a 90 reflejan una predominancia de ondas β de frecuencia entre 13 y 30Hz que indican vigilia. Con este índice se considera que un paciente está inconsciente si el valor del BIS está entre 40 y 60. El monitor muestra el EEG sin procesar, el espectrograma, el grado de actividad electromiografía y el índice de calidad de la señal15. Estas se verán diferentes según el nivel de anestesia del paciente o del nivel de sedación (fig. 1).
Valores de las ondas cerebrales en un adulto normal.
Tomado de Hajat et al.16.
Otros parámetros que nos muestra el monitor BIS® son:
- -
El patrón bursts-suppression. En el EEG consiste en ráfagas de actividad eléctrica (bursts) seguidas de periodos de supresión o silencio eléctrico de muy bajo voltaje. Es un estado extremo de depresión cortical, que puede encontrarse en anestesia profunda, hipoxia, coma inducido, hipotermia, o daño cerebral grave.
- -
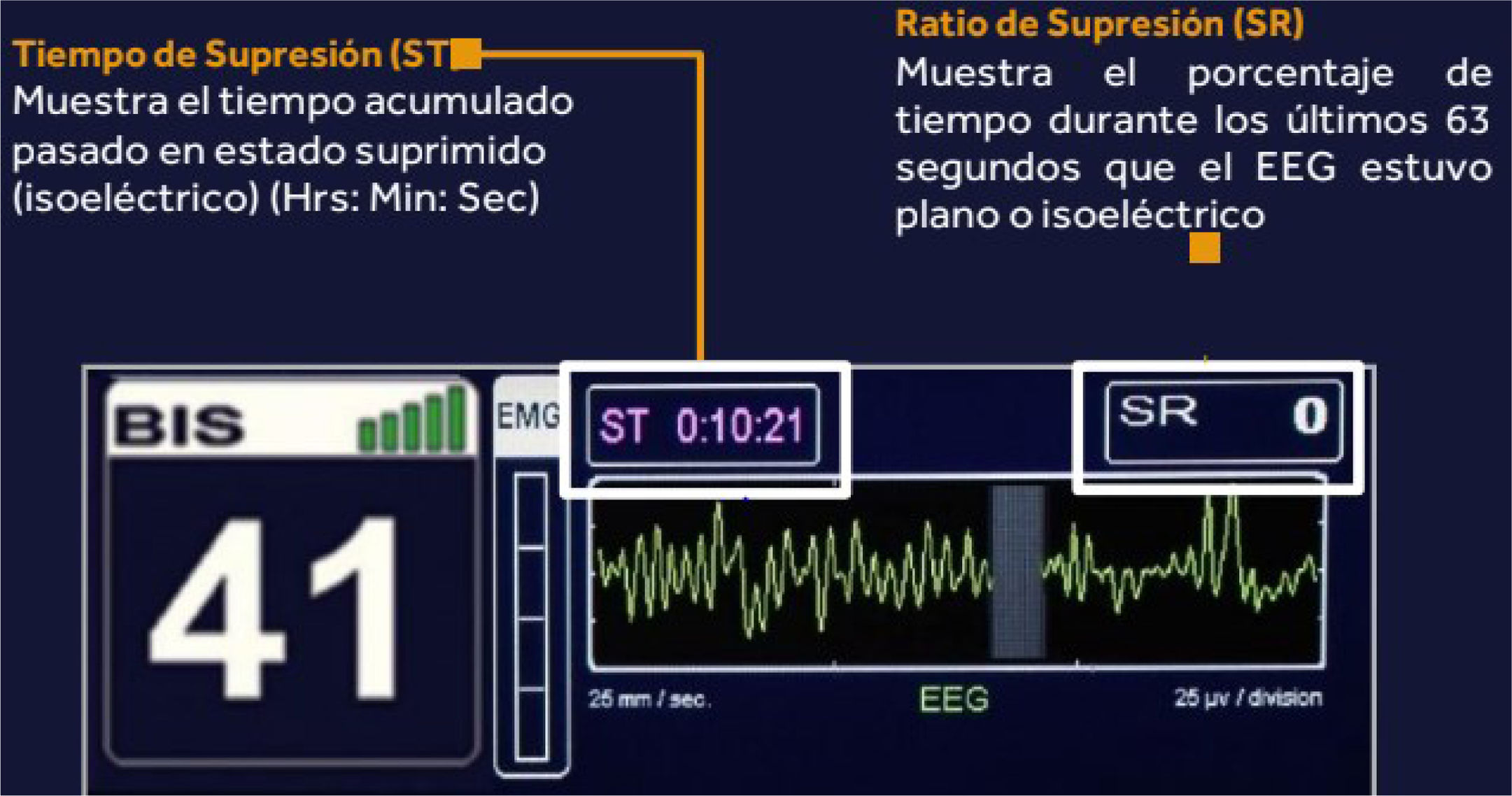
El ratio o tasa de supresión (SR). Es el porcentaje del tiempo (normalmente en una ventana de ∼60-63 segundos) en el que el EEG está suprimido (prácticamente plano o con voltaje muy bajo). Se expresa en porcentaje; por ejemplo, si el SR=20% significa que, en el último minuto aproximadamente, el cerebro ha estado 12-13 segundos en silencio eléctrico. En anestesia general, una tasa de supresión elevada (p. ej.,>10-15%) suele indicar que el paciente está excesivamente anestesiado y hay riesgo de efectos adversos, como hipotensión o retraso en la recuperación. En cuidados intensivos, también se usan para monitorizar estados de coma profundo. Otros ejemplos: si SR=0 → casi no hay supresiones. Si SR=100 → todo el tiempo está suprimido (ausencia casi completa de actividad eléctrica) (fig. 2).
- -
El tiempo de supresión (ST). En la práctica, este concepto se refiere a la duración de cada episodio de supresión continua (es decir, cuánto dura cada pausa eléctrica antes de reanudarse actividad). Conceptualmente es el componente temporal subyacente que produce el SR.
- -
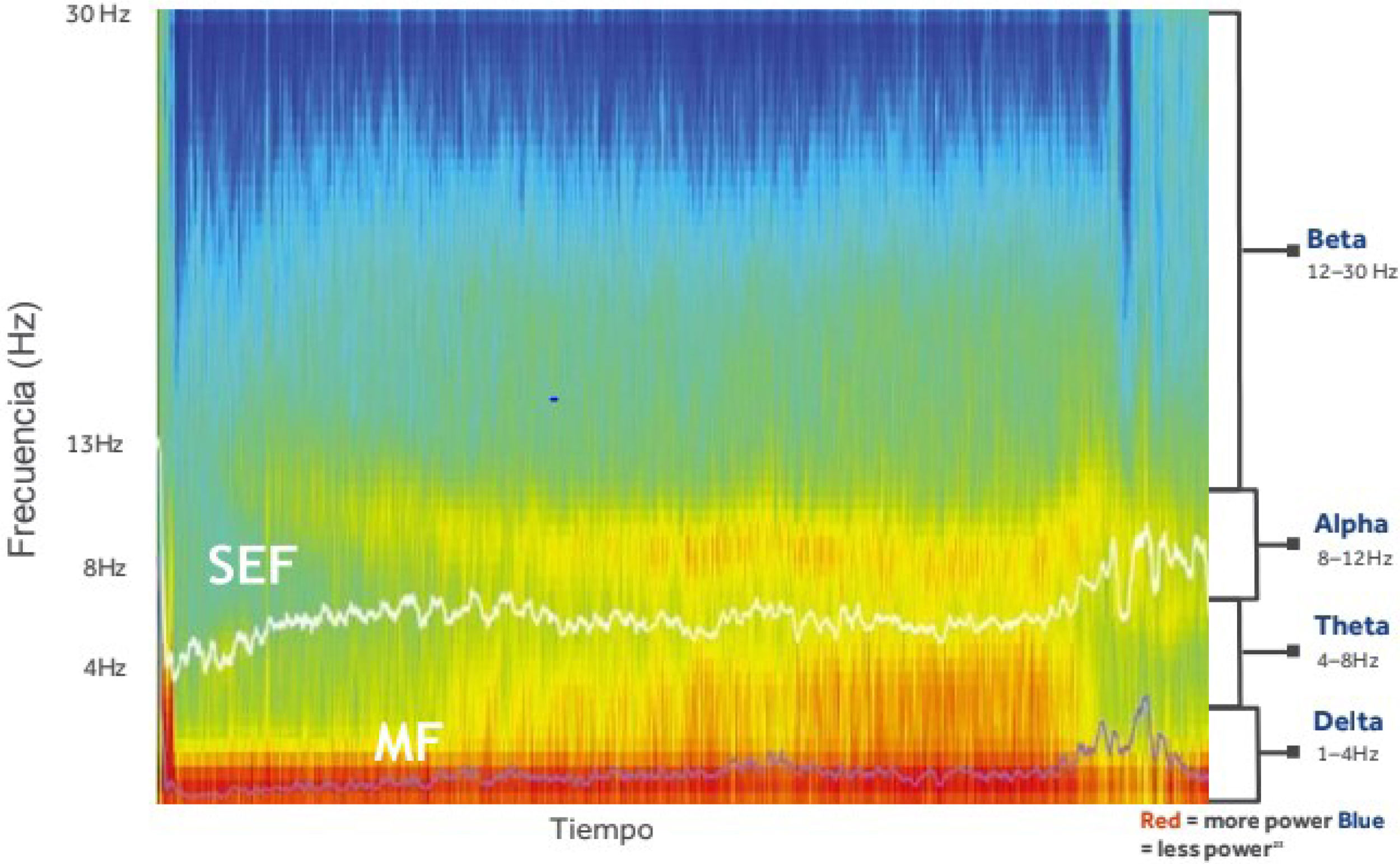
La matriz de densidad espectral (DEA). Es la representación gráfica de la frecuencia y potencia del EEG del paciente (también llamado espectrograma). Las ondas cerebrales se representan en color con una vista bidimensional. El color rojo indica el predominio de las ondas en el EEG. Por ejemplo, si esta predomina en los bordes inferiores (por debajo de 4Hz) significa que predominan las ondas δ en la matriz espectral (fig. 3). Se muestran también las bandas de EEG: δ, θ, α y β que aparecen a la derecha del gráfico DSA.
- -
La frecuencia del borde espectral (SEF 95). Es la línea blanca en el gráfico DSA. Corresponde al 95% de la potencia total de las ondas que se encuentran por debajo de la línea y al 5% que se encuentra por encima. Nos indica la distribución de la potencia espectral del fármaco en inducir hipnosis. Cuando este índice esta por debajo de 15 nos asegura una buena hipnosis (fig. 4). Por lo tanto, valores más bajos indican predominio de ritmos lentos (sedación/anestesia profunda) y valores más altos indican más actividad rápida (vigilia/estado leve).
- -
SEF 95 <10Hz. Es usado con frecuencia como umbral que indica sedación profunda o sobresedación en pacientes críticos. En un ensayo aleatorizado en pacientes con covid-19 grave los investigadores evitaron mantener SEF 95 <10Hz para reducir la sobresedación (y consideraron SR>2% como señal de supresión). El protocolo usó SEF 95 como marcador para disminuir la dosis de propofol cuando era demasiado bajo17.
- -
SEF 95 entre ∼8 y 13Hz. Es el rango usado como objetivo aproximado para estados anestésicos/hipnóticos «adecuados» (equivalente a anestesia general ligera-moderada en quirófano); por eso muchos grupos proponen ∼8-13Hz como referencia, aunque no es universal ni específico para UCI18.
- -
SEF 95 muy bajo: <5Hz. Se describe en pacientes extremadamente sedados o con EEG muy deprimido (estado similar a burst-suppression/actividad muy lenta). Estos valores indican depresión cortical marcada. Roustan et al. identificaron el SEF 95 como uno de los índices más importantes de monitorización en UCI19.
- -
La frecuencia media (MF). Es la línea púrpura en el gráfico DSA. El 50% de la potencia de las ondas está por debajo de esa línea y el 50% por encima (fig. 4).
Este manuscrito se desarrolló como una revisión de la literatura en forma narrativa debido a la naturaleza conceptual y evolutiva del tema abordado. Los monitores BIS® permiten medir el nivel sin estimular al paciente, mientras que las escalas de sedación subjetiva requieren evaluar la respuesta del paciente a estímulos de voz, físicos e incluso dolorosos. Esta estimulación cambia el estado preexistente del paciente.
EstudiosEn un estudio multicéntrico reciente de Wang et al. en pacientes intubados en VM, con sedación y sin relajación muscular, los autores monitorizaron continuamente la profundidad de la sedación con la plataforma BIS®; además, evaluaron de forma intermitente la sedación mediante el uso de la escala de RASS cada 4 horas. El objetivo principal fue evaluar la precisión diagnóstica del BIS® en la detección de sedación profunda en comparación con la escala RASS. En este estudio se observó una alta incidencia de sedación profunda (41%) en la que la monitorización continua con el BIS® puede detectar de forma confiable la sedación profunda en pacientes ventilados. Específicamente, una medición de BIS <50 al inicio del estudio y <80 tomada 15 minutos después de una estimulación tuvo una sensibilidad del 92% para detectar una puntuación RASS<-320.
En un ensayo clínico aleatorizado (ECA) realizado por Olson et al., llevado a cabo en pacientes adultos neurocríticos con VM, el objetivo era evaluar si la monitorización del nivel de sedación utilizando la escala BIS® adjunta a la evaluación clínica se asociaba a una reducción en la cantidad total de fármaco sedante utilizado en un periodo de 12horas. La monitorización de la sedación se hacía mediante la evaluación clínica con la escala de Ramsay (n=35) o la evaluación clínica más monitorización BIS® (n=32). El equipo de enfermeras ajustó la dosis de propofol a un Ramsay de 4 o a un Ramsay de 4 y a un BIS entre 60 y 70. Los pacientes en el grupo de BIS® recibieron significativamente menos propofol (93,5 frente a 157,8ml, respectivamente; p<0,015) y tuvieron tasas de infusión más bajas (14,6 frente a 27,9 mcg/kg por min; p=0,003). Los del grupo BIS® se despertaron mucho más rápido que los del grupo de Ramsay solo (1,24 vs. 7,5min; p<0,0001). Así que la monitorización de la sedación con el monitor BIS® nos da como resultado una marcada reducción en la dosis total de sedantes utilizados para lograr el mismo nivel de sedación clínica, lo que resultó en un tiempo más corto para despertarse sin ningún efecto adverso medible8.
Un estudio realizado por Stewart et al. en 30pacientes adultos postoperatorios en UCI con VM y sedación intravenosa, excluyendo a pacientes con trastornos neurológicos primarios, encontraron que el BIS y el IR predijeron los niveles de RASS con una probabilidad de predicción de 0,776 para BIS y de 0,763 para IR21.
Faritous et al. realizaron un estudio en 70 pacientes intervenidos de cirugía cardíaca (bypass coronario o cirugía valvular) con VM y sedados, a los que se les evaluó el dolor poco después de la operación mediante BIS, la herramienta de observación del dolor en cuidados críticos, y también se revisaron los signos vitales. Las evaluaciones del dolor se hicieron en 3momentos diferentes: 1) basal (inmediatamente antes de cualquier procedimiento doloroso, incluyendo la aspiración traqueal o el cambio de posición del paciente); 2) durante cualquier procedimiento doloroso y 3) 5minutos después del procedimiento (tiempo de recuperación). El grupo de investigación concluyó que la monitorización BIS puede utilizarse para la evaluación del dolor junto con la herramienta de observación del dolor en pacientes con VM y es mucho más sensible que la monitorización de los cambios hemodinámicos22.
Chalela et al. evaluaron la utilidad del BIS en 10 pacientes con encefalopatía hipercápnica secundaria a enfermedad pulmonar obstructiva crónica. Midieron el nivel de actividad cerebral mediante el BIS y diferentes escalas: escala de coma de Glasgow, escala de sedación de Ramsay (RSS) y la escala de RASS. Encontraron que el BIS fue útil para la detección temprana y para la monitorización automática de la intensidad de la encefalopatía hipercápnica en estos pacientes, lo que puede evitar problemas en su manejo23.
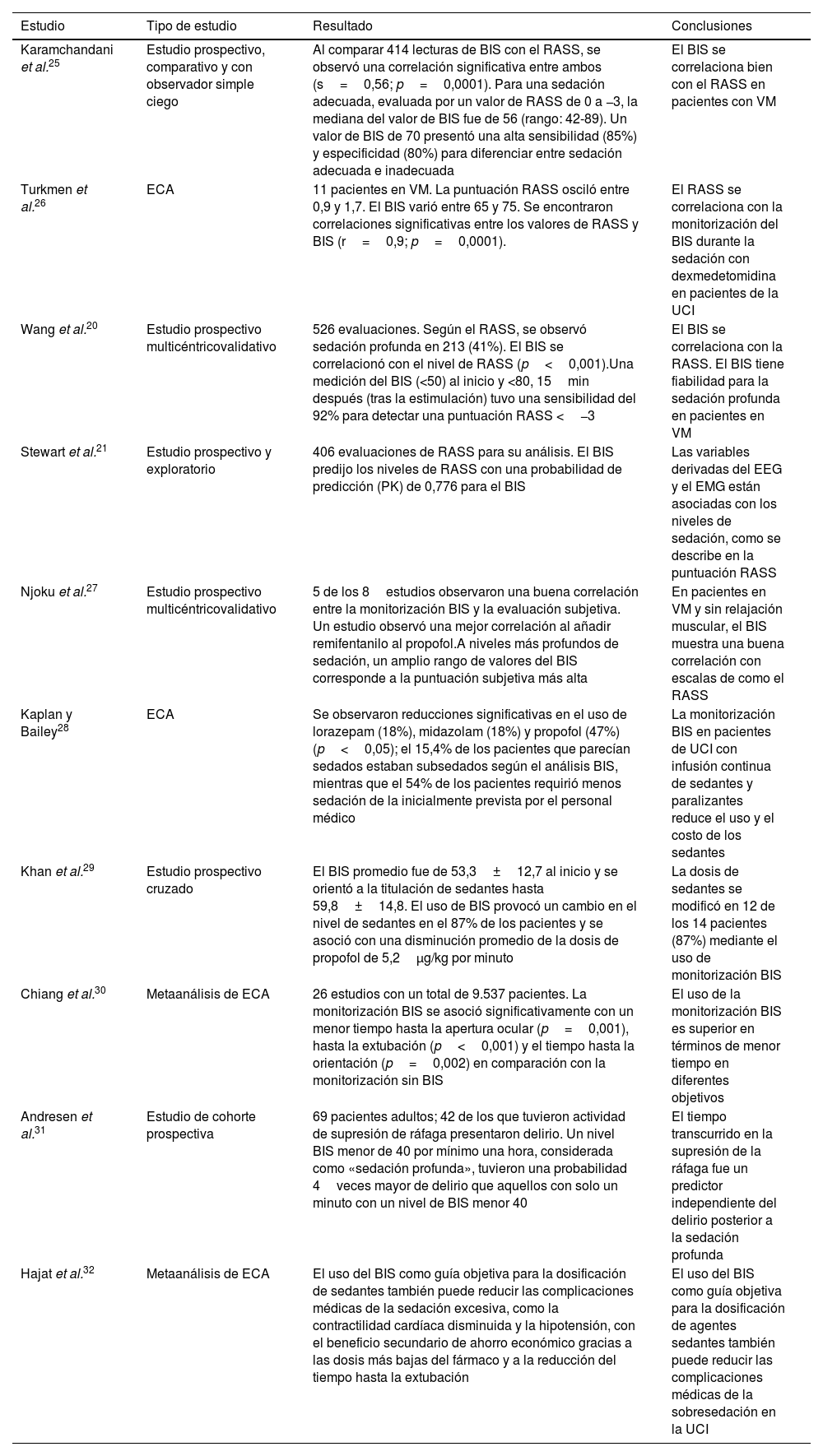
Manning et al. desarrollaron una revisión sitemática evaluando 3temas. En primer lugar, cuando se utiliza como complemento de la escala de RASS, la BIS puede identificar con fiabilidad la sedación profunda en pacientes intubados, sedados y en estado crítico. En segundo lugar, la investigación actual señala que integrar la monitorización con BIS en entornos de cuidados intensivos se asocia con una disminución del uso de medicamentos y de los costos. En tercer lugar, el uso de la monitorización con BIS se relaciona con una reducción de complicaciones médicas como la depresión respiratoria, la aspiración, el delirio y las estancias prolongadas en UCI derivadas de la sedación excesiva24. Los 10 estudios más relevantes que analizaron se presentan resumidos en la tabla 2, algunos ya discutidos.
Estudios que evalúan la monitorización con BIS en UCI
| Estudio | Tipo de estudio | Resultado | Conclusiones |
|---|---|---|---|
| Karamchandani et al.25 | Estudio prospectivo, comparativo y con observador simple ciego | Al comparar 414 lecturas de BIS con el RASS, se observó una correlación significativa entre ambos (s=0,56; p=0,0001). Para una sedación adecuada, evaluada por un valor de RASS de 0 a −3, la mediana del valor de BIS fue de 56 (rango: 42-89). Un valor de BIS de 70 presentó una alta sensibilidad (85%) y especificidad (80%) para diferenciar entre sedación adecuada e inadecuada | El BIS se correlaciona bien con el RASS en pacientes con VM |
| Turkmen et al.26 | ECA | 11 pacientes en VM. La puntuación RASS osciló entre 0,9 y 1,7. El BIS varió entre 65 y 75. Se encontraron correlaciones significativas entre los valores de RASS y BIS (r=0,9; p=0,0001). | El RASS se correlaciona con la monitorización del BIS durante la sedación con dexmedetomidina en pacientes de la UCI |
| Wang et al.20 | Estudio prospectivo multicéntricovalidativo | 526 evaluaciones. Según el RASS, se observó sedación profunda en 213 (41%). El BIS se correlacionó con el nivel de RASS (p<0,001).Una medición del BIS (<50) al inicio y <80, 15min después (tras la estimulación) tuvo una sensibilidad del 92% para detectar una puntuación RASS <−3 | El BIS se correlaciona con la RASS. El BIS tiene fiabilidad para la sedación profunda en pacientes en VM |
| Stewart et al.21 | Estudio prospectivo y exploratorio | 406 evaluaciones de RASS para su análisis. El BIS predijo los niveles de RASS con una probabilidad de predicción (PK) de 0,776 para el BIS | Las variables derivadas del EEG y el EMG están asociadas con los niveles de sedación, como se describe en la puntuación RASS |
| Njoku et al.27 | Estudio prospectivo multicéntricovalidativo | 5 de los 8estudios observaron una buena correlación entre la monitorización BIS y la evaluación subjetiva. Un estudio observó una mejor correlación al añadir remifentanilo al propofol.A niveles más profundos de sedación, un amplio rango de valores del BIS corresponde a la puntuación subjetiva más alta | En pacientes en VM y sin relajación muscular, el BIS muestra una buena correlación con escalas de como el RASS |
| Kaplan y Bailey28 | ECA | Se observaron reducciones significativas en el uso de lorazepam (18%), midazolam (18%) y propofol (47%) (p<0,05); el 15,4% de los pacientes que parecían sedados estaban subsedados según el análisis BIS, mientras que el 54% de los pacientes requirió menos sedación de la inicialmente prevista por el personal médico | La monitorización BIS en pacientes de UCI con infusión continua de sedantes y paralizantes reduce el uso y el costo de los sedantes |
| Khan et al.29 | Estudio prospectivo cruzado | El BIS promedio fue de 53,3±12,7 al inicio y se orientó a la titulación de sedantes hasta 59,8±14,8. El uso de BIS provocó un cambio en el nivel de sedantes en el 87% de los pacientes y se asoció con una disminución promedio de la dosis de propofol de 5,2μg/kg por minuto | La dosis de sedantes se modificó en 12 de los 14 pacientes (87%) mediante el uso de monitorización BIS |
| Chiang et al.30 | Metaanálisis de ECA | 26 estudios con un total de 9.537 pacientes. La monitorización BIS se asoció significativamente con un menor tiempo hasta la apertura ocular (p=0,001), hasta la extubación (p<0,001) y el tiempo hasta la orientación (p=0,002) en comparación con la monitorización sin BIS | El uso de la monitorización BIS es superior en términos de menor tiempo en diferentes objetivos |
| Andresen et al.31 | Estudio de cohorte prospectiva | 69 pacientes adultos; 42 de los que tuvieron actividad de supresión de ráfaga presentaron delirio. Un nivel BIS menor de 40 por mínimo una hora, considerada como «sedación profunda», tuvieron una probabilidad 4veces mayor de delirio que aquellos con solo un minuto con un nivel de BIS menor 40 | El tiempo transcurrido en la supresión de la ráfaga fue un predictor independiente del delirio posterior a la sedación profunda |
| Hajat et al.32 | Metaanálisis de ECA | El uso del BIS como guía objetiva para la dosificación de sedantes también puede reducir las complicaciones médicas de la sedación excesiva, como la contractilidad cardíaca disminuida y la hipotensión, con el beneficio secundario de ahorro económico gracias a las dosis más bajas del fármaco y a la reducción del tiempo hasta la extubación | El uso del BIS como guía objetiva para la dosificación de agentes sedantes también puede reducir las complicaciones médicas de la sobresedación en la UCI |
BIS: índice biespectral; ECA: ensayo controlado aleatorio; EEG: electroencefalograma; EMG: electromiograma; RASS: escala de agitación-sedación de Richmond; VM: ventilación mecánica.
Para finalizar, en el último metaanálisis de 20 estudios realizado por Jaworska et al., los autores concluyeron que la monitorización por EEG mostró una disminución de la duración de la estancia hospitalaria (días) (SMD −0,89; IC del 95%: −1,17 a −0,62; I2=13,4%), una reducción de la dosis total de sedante (expresada en equivalentes de propofol, mg) (SMD −1,29; IC del 95%: −2,27 a −0,31; I2=96,6%) y una reducción de la dosis total de opioides (expresada en equivalentes de morfina, mg) (SMD −0,40; IC del 95%: −0,76 a −0,04; I2=77,0%)33.
Limitaciones importantesLas siguiente son las probables dificultades con la monitorización BIS:
- -
Dependencia del monitor o del algoritmo: distintos dispositivos y algoritmos (BIS, SedLine, otros) calculan un SEF ligeramente distinto; no hay completa estandarización.
- -
Efecto de fármacos no GABAérgicos: agentes como quetamina, dexmedetomidina u opioides modulan el espectro EEG de manera atípica (p. ej., por mantener componentes rápidas) alterando la relación entre SEF y profundidad real. La quetamina también cambia el espectro de potencia del EEG al provocar un aumento de la actividad θ y alterar el espectro EEG de forma atípica.
- -
Artefactos (EMG) y bloqueo neuromuscular: la actividad muscular (EMG) eleva la potencia en altas frecuencias y aumenta el SEF, aun cuando el paciente esté profundo; por el contrario, los bloqueadores neuromusculares reducen el EMG y reducen los índices procesados.
- -
Variabilidad entre pacientes (edad, daño cerebral): ancianos o pacientes con lesión cerebral tienen un SEF más bajo a igual dosis; por eso es impreciso usar un umbral único.
Por lo anterior, se debe usar SEF 95 como parte de un enfoque multiparamétrico, no como único criterio. Se debe combinar: una escala clínica (RASS), el índice BIS, DSA, SEF 95 y la detección de supresión (SR/BSR).
Implicaciones clínicas y conclusionesEn el contexto del posparo cardíaco o la lesión cerebral, varios estudios han evaluado si un BIS y SR tempranos predicen resultados neurológicos desfavorables: en pacientes reanimados tras paro cardíaco, un SR promedio ≥ 3 a la hora 23 predijo un desenlace neurológico adverso con sensibilidad ∼74% y especificidad ∼92%. Un BIS promedio ≤ 25 a la hora 12 fue también predictor de mal pronóstico con alta especificidad (∼97%)34.
Los estudios de monitoreo BIS® en la UCI mencionados encuentran reducciones en el uso total de sedantes y tiempos de despertar más rápidos a pesar de una sedación clínica similar, con menos agitación y una estancia en UCI más corta24. En nuestro concepto la combinación de la evaluación observacional con escalas validadas y la monitoria neurofisiológica con monitoria BIS® para controlar de manera dinámica la sedación en adultos intubados en estado crítico parece ser la forma más adecuada para la titulación de sedantes durante la sedación profunda. Esta aproximación optimiza el manejo de la sedación porque el personal de enfermería y el personal médico reciben más información que la que proporciona cada herramienta de forma independiente. Esta evaluación es más integral y continua del estado del paciente y se asocia con una disminución en la incidencia de sobresedación o infrasedación. Además, la monitorización continua del BIS® reduce la carga de trabajo de los cuidadores en UCI y los costos.
En pacientes con VM, las recomendaciones actuales indican que el nivel de sedación se evalúe a intervalos de 2 a 4 h y que la dosis del sedante se ajuste de acuerdo con los resultados de estas evaluaciones. Sin embargo, en un gran porcentaje de los pacientes esto no se cumple por la alta carga laboral en nuestras UCI. Este enfoque ayudará a los médicos intensivistas a reducir los episodios no deseados, a evitar la sedación profunda prolongada, a reducir las complicaciones cardiovasculares asociadas a esta y las acumulaciones excesivas de estos agentes.
Las guías internacionales de práctica clínica para la prevención y el manejo del dolor, la agitación/sedación, el delirio, la inmovilidad y la disrupción del sueño (PADIS 2018) en pacientes adultos recomiendan la sedación profunda en los pacientes críticos que requieren relajación muscular, pero desafortunadamente los métodos subjetivos tradicionales, como con la escala de RASS, no son de utilidad en este escenario. Esta y otras guías recomiendan el monitoreo objetivo y continuo de la sedación con el monitor BIS®, especialmente para la titulación de sedantes durante los niveles de sedación profunda con o sin la relajación muscular, de forma complementaria a la clínica1,2,3.
En consecuencia, los monitores BIS® deberían utilizarse cada vez más en las UCI como una herramienta para guiar la sedación profunda. Se han propuesto como una herramienta adjunta a la escala del RASS en serie para evaluar y guiar la sedación en pacientes críticos adultos.
Consideraciones éticasLos autores declaramos lo siguiente:
- •
El trabajo no ha sido realizado bajo modelo de experimentación en animales.
- •
En el trabajo no han sido intervidos pacientes o sujetos humanos.
- •
El trabajo no es un ensayo clínico.
- •
Todos los datos mostrados en las figuras y tablas incluidas en el manuscrito se recogen en el apartado de resultados y conclusiones.
Los autores declaramos que no recibimos ninguna financiación para la elaboración del artículo.
Conflicto de interesesAseguramos que este manuscrito es trabajo original de los autores, no ha sido publicado previamente ni está siendo considerado para publicación en otro lugar. Todos los autores han estado activamente involucrados en el trabajo y asumen la responsabilidad pública por su contenido. Ninguno de los autores tiene conflicto de intereses con un laboratorio o tecnología médica para la elaboración del artículo.
Agradecemos a la Clínica Universitaria Bolivariana por el apoyo a la investigación y docencia.