La trombocitopenia afecta a alrededor del 25% de los pacientes de la UCI. Las causas principales son: sepsis, fármacos y microangiopatías trombóticas, incluyendo púrpura trombocitopénica trombótica y síndrome hemolítico urémico. El enfoque requiere una evaluación asertiva y un tratamiento oportuno. Se presenta el caso de una paciente adulta, con historia de linfoma no Hodgkin, quien consultó por un cuadro de lesiones cutáneas vesiculares y abdomen agudo. Fue admitida en cuidado intensivo luego de descubrir de manera incidental lesiones purpúricas hepáticas en la laparoscopia. Durante la estancia desarrolló trombocitopenia severa y disfunción hepática, a pesar del aparente control del foco séptico abdominal. Se contemplaron varias posibilidades de diagnóstico etiológico, incluyendo: fármacos, infección viral y microangiopatías trombóticas. Con ayuda de una juiciosa anamnesis y estudios paraclínicos de extensión, se pretendió avanzar en el diagnóstico etiológico; no obstante, se encontró un perfil atípico que no esclarecía del todo el mecanismo causal. La paciente persistió con trombocitopenia hasta llegar a niveles de riesgo; se inició manejo con aciclovir y se observó un ascenso del recuento plaquetario y una mejoría de la función hepática. La biopsia de piel confirmó varicela zóster, lo cual apuntó a un caso de microangiopatías trombóticas desencadenado por múltiples hits, como se describe en la literatura.
Thrombocytopenia affects about 25% of patients in the ICU. The main causes are: sepsis, drugs and thrombotic microangiopathies, including thrombotic thrombocytopenic purpura and haemolytic uraemic syndrome. The approach requires assertive evaluation and timely treatment. The case is presented on an adult patient, with a history of non-Hodgkin's lymphoma, who consulted due to a picture of vesicular skin lesions and acute abdomen. She was admitted to intensive care after incidentally discovering hepatic purpuric lesions in laparoscopy. During the stay, there was severe thrombocytopenia and hepatic dysfunction, despite the apparent control of the abdominal septic focus. Several possibilities of aetiological diagnosis were contemplated including: drugs, viral infection, and thrombotic microangiopathy. With the help of a judicious anamnesis and paraclinical studies of extension, the aim is to advance in the etiological diagnosis, however, an atypical profile was found that did not clarify the causal mechanism at all. The patient persisted with thrombocytopenia until reaching risk levels. The patient was managed with acyclovir, with an increase in platelet count and an improvement in liver function. Skin biopsy confirmed varicella zoster, which suggests a case of thrombotic microangiopathy triggered by multiple hits, as described in the literature.
La trombocitopenia afecta a alrededor del 25% de los pacientes de la UCI1. Las causas principales son: sepsis, fármacos y microangiopatías trombóticas (MAT), incluyendo la púrpura trombocitopénica trombótica (PTT) y el síndrome urémico hemolítico (SHU)2. El enfoque requiere una evaluación asertiva y un tratamiento oportuno. Se han descrito clásicamente perfiles característicos de cada una de estas etiologías para ayudar a realizar un diagnóstico preciso; aun así, en la práctica diaria estos perfiles no son específicos para cada entidad y no siempre se encuentran presentes, existen algoritmos diseñados para el estudio de la trombocitopenia1,3 y la literatura describe escalas como el PLASMIC score, que pretenden delimitar el estrecho límite entre estas enfermedades4. El paciente crítico, en contraste con otros pacientes, presenta un estado hemodinámico alterado que modifica casi por completo la fisiología de la economía, incluyendo la respuesta inmune, inflamatoria y el proceso de coagulación. No se han descrito estas herramientas clínicas para pacientes en estado crítico, lo cual limita aún más su diagnóstico1.
El abordaje del paciente con trombocitopenia demanda una evaluación acuciosa de la anamnesis, el estado de la coagulación y el patrón hematológico e infeccioso. La trombocitopenia que se acompaña de una elevación de los niveles de lactato deshidrogenasa, anemia y esquistocitosis refleja la formación de microtrombos y la destrucción de los glóbulos rojos. Estos hallazgos pueden corresponder a coagulación intravascular diseminada (CID) secundaria a sepsis o MAT inducidas, como describe la teoría de los «2 hits», donde múltiples situaciones coinciden en un paciente con predisposición y se convierten en gatillo de estas enfermedades5; la más frecuente de estas entidades es la CID, que se produce en hasta un 20% de los pacientes con sepsis en la UCI6. Otras causas son menos frecuentes: el SHU asociado a Escherichia coli tiene incidencias de hasta 30 casos por millón y la PTT de tan solo 10 casos por millón7. Las características clínicas de las MAT, las trombocitopenias asociadas a fármacos y la CID son muy similares; la PTT se describe como una péntada de fiebre, trombocitopenia, anemia hemolítica, disfunción renal y deterioro neurológico; esta péntada se presenta solo en la minoría de los casos; por otra parte, el SHU se caracteriza por la tríada: trombocitopenia, anemia hemolítica y disfunción renal8. Estas similitudes hacen que el diagnóstico preciso y el enfoque de la trombocitopenia en el paciente de la UCI sea complejo y retrasa el tratamiento. La recomendación basada en estudios y la opinión de expertos es iniciar el manejo lo antes posible, incluso antes del resultado de las pruebas confirmatorias y con alto grado de sospecha clínica, teniendo en cuenta los perfiles indistinguibles y atípicos de este tipo de enfermedades.
La varicela debida al virus de la varicela zóster es una enfermedad caracterizada por un exantema vesicular. La varicela generalmente produce una enfermedad leve a moderada, pero pueden surgir complicaciones graves como meningoencefalitis, meningitis y vasculitis que afectan a vasos pequeños o grandes, neumonía y hemorragias. Sin embargo, solo ha habido un informe previo de SHU después de una infección por varicela. Recientemente, un creciente cuerpo de evidencia apunta a que los virus también pueden jugar un papel importante como factores desencadenantes en la patogénesis de MAT9.
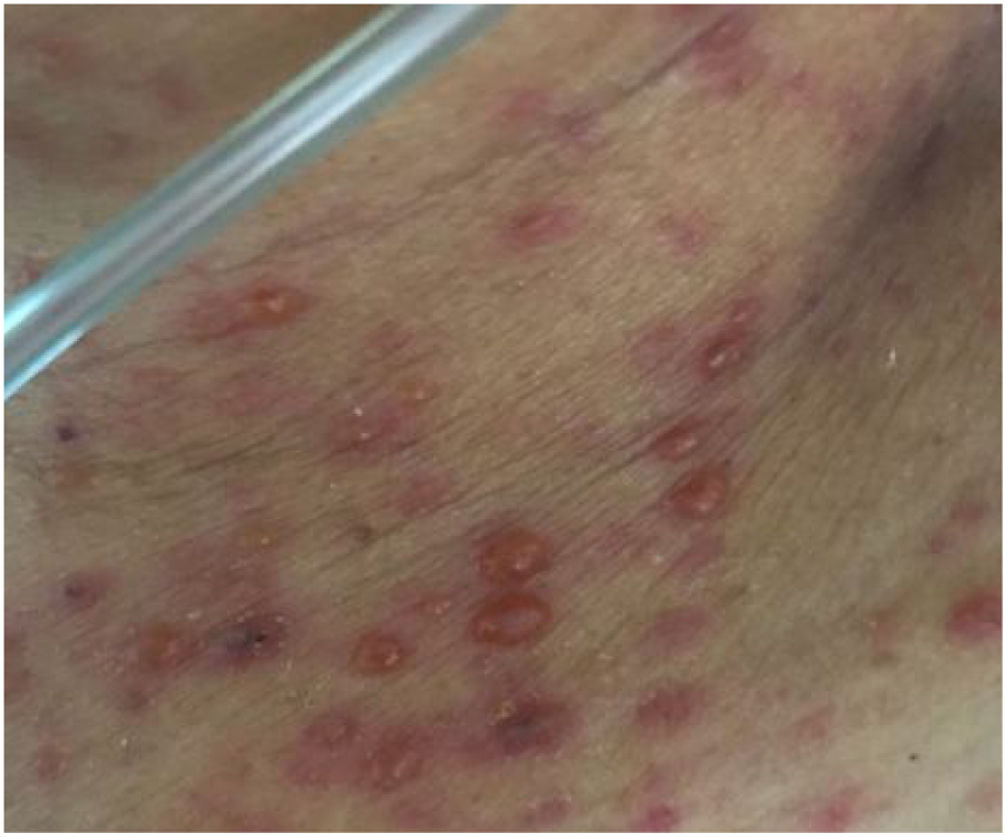
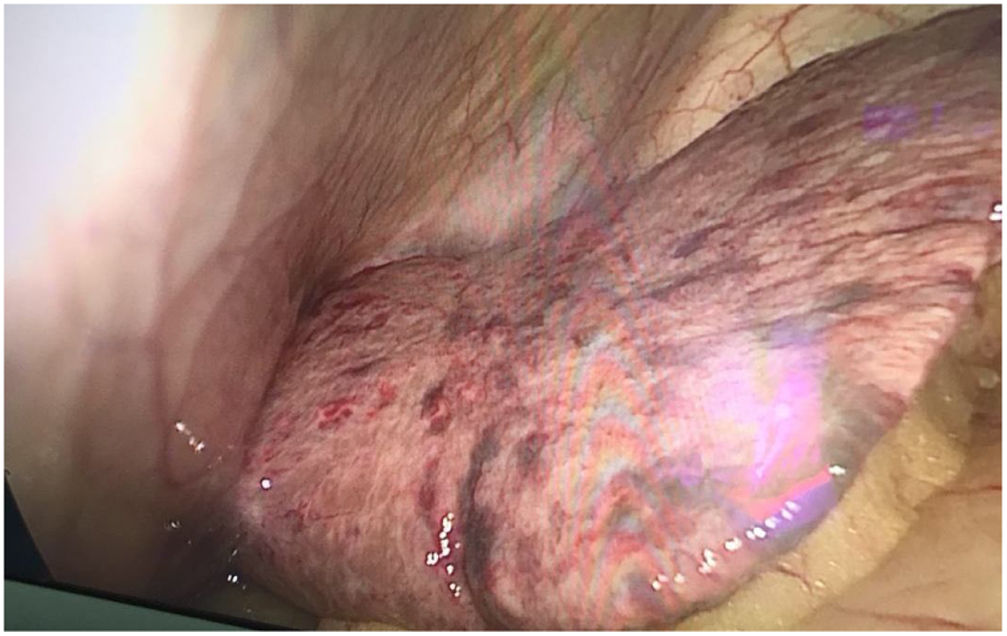
Descripción del casoUna paciente de 63 años con antecedente de linfoma no Hodgkin, quien recibió las 3 líneas de manejo, se presentó en el servicio de urgencias con un historial de 8 días de dolor en el hemiabdomen derecho asociado a fiebre y aparición de lesiones cutáneas, pustulosas, vesiculares y difusas de predominio en rostro, cuello y tórax, sin compromiso de palmas, plantas o mucosas. Los últimos 3 días antes de su admisión presentó alteración del estado de conciencia. Fue admitida con la sospecha de una apendicitis aguda, la cual no se logró confirmar dados los hallazgos no concluyentes en la tomografía. Al ingresar se descubrió que tenía hepatomegalia y disfunción hepática con colestasis; se indicó laparoscopia exploratoria bajo la presunción de apendicitis aguda con presencia de lesiones purpúricas en el hígado y el intestino (fig. 1). La paciente fue derivada a la UCI por presentar factores de riesgo para complicaciones posoperatorias; en la revisión por sistemas se encontró la presencia de diarrea y fiebre 2 días antes de la hospitalización. El examen físico demostró un abdomen blando, doloroso a la palpación en marco cólico derecho, mucosa oral con placa blanquecina única en el paladar duro, piel con lesiones pápulo/ampulosas de 2 a 3mm no confluyentes de contenido cetrino en el tronco y la cara (fig. 2), algunas con tinte violáceo, en menor cantidad en las extremidades, respetando las plantas y las palmas, ninguna linfadenopatía y ausencia de distermia.
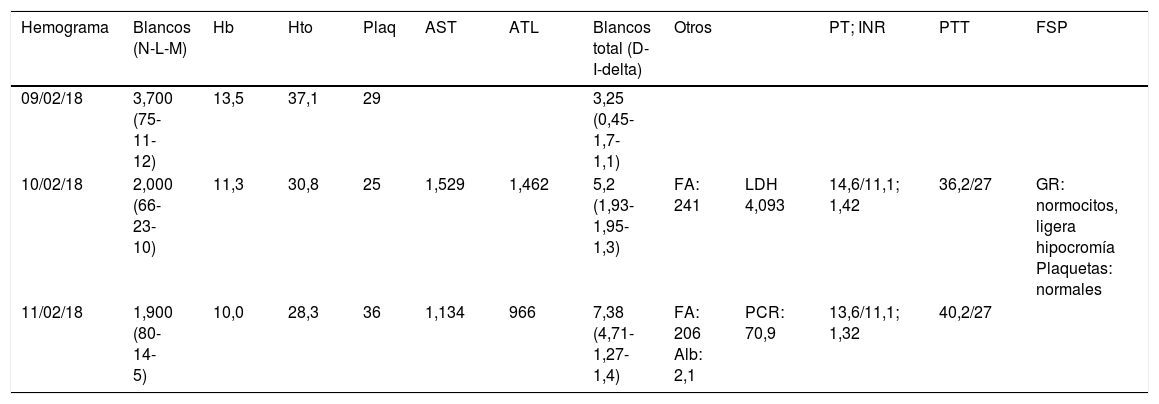
Los exámenes de laboratorio revelaron un compromiso de 2 líneas celulares (linfopenia y trombocitopenia) inicialmente. Pocos días después evolucionó con anemia y progresión del compromiso hepático con predominio de hipertransaminasemia y un patrón colestásico intrahepático (hiperbilirrubinemia directa sin elevación de fosfatasa alcalina), hallazgos hasta ese momento compatibles con un cuadro de sepsis abdominal con compromiso de órgano y sospecha de infección viral. Se inició la búsqueda de un nuevo foco séptico (coinfección), con foco hepático como primera posibilidad dados los antecedentes inmunológicos y el patrón paraclínico. Se ampliaron los estudios en la búsqueda de virus hepatotropos o bacterias multirresistentes. A pesar del tratamiento antibiótico y antiviral, no se observó una recuperación de las líneas celulares hasta llegar a niveles de severidad y riesgo; el estudio de la coagulación señaló un compromiso marcado y persistente del recuento plaquetario con un perfil poco claro para CID (fibrinógeno normal y productos de degradación de fibrinógeno en niveles bajos, con tiempo de protrombina normal), evidencia de esquistocitosis y lactato deshidrogenasa elevada, todo lo cual, en relación con las lesiones cutáneas, reflejaba un compromiso microangiopático. Días después la paciente progresó con compromiso cerebeloso microvascular, hallazgo que también estuvo en concordancia con el diagnóstico de MAT; no hubo compromiso renal, pero sí complemento consumido, y los niveles de ADAMST13 son mayores al 10%, considerándose una MAT atípica desencadenada por infección viral. Tras una semana de evolución se confirmó la infección por el virus de la varicela zóster con una biopsia de piel, y se completó el manejo antiviral y antibiótico, observándose una recuperación lenta y progresiva hacia la mejoría. Se trasladó a un pabellón de hospitalización para continuar el tratamiento. El comportamiento paraclínico se muestra en la tabla 1.
Evolución de los paraclínicos
| Hemograma | Blancos (N-L-M) | Hb | Hto | Plaq | AST | ATL | Blancos total (D-I-delta) | Otros | PT; INR | PTT | FSP | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 09/02/18 | 3,700 (75-11-12) | 13,5 | 37,1 | 29 | 3,25 (0,45-1,7-1,1) | |||||||
| 10/02/18 | 2,000 (66-23-10) | 11,3 | 30,8 | 25 | 1,529 | 1,462 | 5,2 (1,93-1,95-1,3) | FA: 241 | LDH 4,093 | 14,6/11,1; 1,42 | 36,2/27 | GR: normocitos, ligera hipocromía Plaquetas: normales |
| 11/02/18 | 1,900 (80-14-5) | 10,0 | 28,3 | 36 | 1,134 | 966 | 7,38 (4,71-1,27-1,4) | FA: 206 Alb: 2,1 | PCR: 70,9 | 13,6/11,1; 1,32 | 40,2/27 |
Alb: albúmina; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FA: fosfatasa alcalina; FSP: frotis de sangre periférica; GR: glóbulos rojos; Hb: hemoglobina; Hto: hematocrito; INR: razón internacional normalizada; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; Plaq: plaquetas; PT: tiempo de protrombina; PTT: púrpura trombocitopénica trombótica.
La trombocitopenia es un trastorno muy frecuente en la UCI. Se deben buscar muchas etiologías y los enfoques terapéuticos difieren según estas causas diferentes1. Uno de los diagnósticos diferenciales son las MAT, incluyendo la PTT y el SHU2, entidades que se caracterizan por el daño o la estimulación de las células endoteliales debido a innumerables daños ?infecciones, fármacos, etc.?, que conducen a la secreción de cadenas largas de multímetros del factor von Willebrand que permanecen anclados a la membrana celular. Estas cadenas multiméricas están fuertemente unidas a los componentes de glicoproteína Ibα de la glicoproteína plaquetaria. Los receptores de superficie Ibα-IX-V causan la adherencia de las plaquetas y la agregación posterior de plaquetas adicionales entre sí a través de receptores de glicoproteína IIb-IIIa activados. Esto produce trombos plaquetarios potencialmente oclusivos, que culminan en una aglutinación plaquetaria intravascular5.
La PTT se puede subdividir en 3 tipos: congénita o familiar, idiopática y no idiopática. Los síndromes PTT congénitos e idiopáticos son causados principalmente por la deficiencia de ADAMTS13, debido a mutaciones en el gen ADAMTS13 o autoanticuerpos que inhiben la actividad de ADAMTS13. La PTT secundaria no idiopática se asocia con afecciones como enfermedades autoinmunes y vasculitis (lupus eritematoso sistémico, esclerodermia), embarazo/posparto, cáncer, trasplante de células madre hematopoyéticas, medicamentos y otros agentes antineoplásicos (gemcitabina, mitomicina C, inhibidores de la calcineurina, quinina, cocaína, ticlopidina), clopidogrel e infecciones1,5.
Recientemente, un creciente cuerpo de evidencia demuestra que los virus también pueden jugar un papel importante como factores desencadenantes en la patogénesis de MAT9. La varicela debida al virus de la varicela zóster es una enfermedad caracterizada por el exantema vesicular. La varicela generalmente produce una enfermedad leve a moderada, pero pueden surgir complicaciones graves (meningoencefalitis, meningitis, vasculitis que afectan a vasos pequeños o grandes, neumonía y hemorragias); sin embargo, solo ha habido un informe previo de SHU después de una infección por varicela7.
El SHU puede clasificarse como asociado a diarrea (debido a una infección entérica con organismos productores de toxina Shiga) o no asociado a diarrea/atípico. Recientemente se ha demostrado que el SHU atípico es una enfermedad de desregulación del complemento, con un 50% de los casos que involucran genes reguladores del complemento2.
Otra posibilidad diagnóstica en el espectro de la trombocitopenia es el desarrollo de CID secundaria a un evento infeccioso; el factor distintivo más importante entre CID y MAT es el perfil de coagulación, que es anormal en la CID; a pesar de ser el más frecuente en el paciente crítico, en este caso no se encuentran alteraciones contundentes de la coagulación5.
En el presente caso, los resultados de los exámenes de infección evidenciaron el curso de la fase aguda de esta por virus hepatotropos y se consideró el diagnóstico de trombocitopenia por infección viral y foco séptico abdominal inicialmente (en consecuencia, la probabilidad de CID). Se tomaron paraclínicos que señalaron una coincidencia con los criterios diagnósticos, por lo que se continuó el manejo y se instauraron esfuerzos para descartar focos no controlados. La primera consideración diagnóstica fue la de una infección por varicela zóster, teniendo en cuenta la temporalidad y las características de las lesiones cutáneas y la asociación de disfunción hepática severa.
Luego de demostrar el diagnóstico histopatológico de infección por varicela se revisó la literatura, encontrando escasa información respecto a la relación de esta infección con MAT. En este caso se inició de manera temprana el manejo antiviral con aciclovir, antiviral selectivo que ha demostrado tener un mejor rendimiento si se recomienda iniciar en las primeras 24h de la aparición de las lesiones en la piel; en pacientes inmunocomprometidos puede iniciarse hasta dentro de las 72h siguientes, durante 7 días y mediante vía intravenosa para reducir la severidad del cuadro. Puede darse en pacientes inmunocomprometidos la recurrencia del cuadro desde 24h tras la suspensión del antiviral, con indicación de realizar un nuevo ciclo de terapia7,10.
Como se mencionó anteriormente, el estudio de la coagulación al cual se hizo seguimiento reveló un compromiso marcado y persistente del recuento plaquetario, que disminuyó la probabilidad de CID; el hallazgo de esquistocitosis y lactato deshidrogenasa elevada en relación con las lesiones cutáneas reflejó un compromiso microangiopático, características que pueden estar presentes en todas las entidades anteriormente discutidas. Días después la paciente progresó hacia un deterioro del SNC con evidencia de lesión microvascular cerebelosa, criterio que también está en concordancia con el diagnóstico de MAT, ante la persistencia de trombocitopenia severa y refractaria a pesar de los esfuerzos por detectar y corregir la causa. Se indagaron otras posibilidades incluidas en el contexto de MAT, se revisaron acuciosamente los criterios diagnósticos descritos en la literatura y se encontraron varias coincidencias como: fiebre, trombocitopenia, anemia hemolítica y deterioro neurológico; la ausencia de compromiso renal restó peso al diagnóstico de SHU, pero la hipocomplementemia permitió no descartarlo del todo. Los niveles de ADAMST13 mayores del 10% hicieron también menor la probabilidad de PTT; a este respecto vale la pena añadir que antes de la toma de este marcador la paciente recibió múltiples transfusiones de hemoderivados, lo cual disminuye la sensibilidad de la prueba de ADAMST131.
ConclusiónEste caso se consideró un evento autoinmune atípico desarrollado en una persona inmunocomprometida en cuyo historial médico se reportó tratamiento reciente con radioterapia, quimioterapia y quien además presentó como enfermedad de base una neoplasia probablemente en fase de reactivación. Este caso demuestra la vasta gama de posibilidades causales dentro del estudio de la trombocitopenia y hace pensar que esta paciente cursaba con una presentación atípica de MAT en el amplio espectro entre 2 extremos (PTT vs. SHU) y que tenía varios eventos disparadores de autoinmunidad: estrés dado por una condición crítica, susceptibilitad inmunológica y, en especial, la asociación poco estudiada con infección por el virus de la varicela zóster, como se describe en la teoría de los 2 o múltiples hits que desencadena un síndrome de trombocitopenia, un consumo aumentado de plaquetas y además una destrucción masiva de las mismas5.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al equipo médico, los residentes, el grupo del comité de ética de la institución y también de las universidades adscritas, quienes han hecho posible el cuidado integral de nuestros pacientes y la oportunidad de investigación.