Special Issue: Lecciones aprendidas del COVID-19
Más datosDeterminar los factores relacionados con la neumonía bacteriana en pacientes con COVID-19 en una unidad de cuidados intensivos de Barranquilla, Colombia.
DiseñoEstudio de casos y controles anidado, unicéntrico, realizado entre marzo y agosto del 2020.
PacientesPacientes mayores de 18 años, con una estancia hospitalaria mayor de 72h y soporte de ventilación mecánica invasiva, admitidos en la unidad de cuidados intensivos.
IntervencionesNinguna.
MedicionesSe agruparon variables clínicas para casos y controles. Se calcularon medias y desviación estándar en variables cuantitativas y proporciones en variables categóricas. Para evaluar las diferencias entre proporciones se usó la prueba exacta de Fisher y para las diferencias de medias se usó la prueba U de Mann-Whitney. Las variables con diferencia estadísticamente significativa se corrieron en un modelo explicativo basado en regresión logística binaria.
ResultadosLa frecuencia de neumonía bacteriana fue del 10,07%, encontrando un elevado consumo de terapia antibiótica empírica. Se encontró asociación estadística entre el tiempo de uso de dexametasona (OR 1,520; IC 95% 1,131-2,042) y el desarrollo de neumonía bacteriana. El resto de las variables no resultaron estadísticamente significativas tras ajustar el modelo con regresión logística.
ConclusiónSe encontraron tasas bajas de neumonía bacteriana, predominando la Klebsiella pneumoniae como la bacteria más frecuente. El uso excesivo de dexametasona en pacientes con COVID-19 en la unidad de cuidados intensivos podría aumentar el riesgo de neumonía bacteriana. Por este motivo, debe evaluarse con mayor profundidad para explicar causalidad y efecto.
To determine the factors related to bacterial pneumonia in patients with COVID-19 in an intensive care unit in Barranquilla, Colombia.
DesignNested, single-center case-control study, conducted between March and August 2020.
PatientsPatients over 18 years of age, a hospital stay greater than 72h, with invasive mechanical ventilation support admitted to the intensive care unit.
InterventionsNone.
MeasurementsClinical variables were grouped for both cases and controls. Means and standard deviation were calculated in quantitative variables and proportions in categorical variables. Fisher's exact test was used to evaluate the differences between proportions, and the Mann-Whitney U test was used for differences in means. Variables with statistically significant differences were run in an explanatory model based on binary logistic regression.
ResultsThe frequency of bacterial pneumonia was 10.07%, finding a high consumption of empirical antibiotic therapy. A statistical association was found between the time of dexamethasone use (OR 1.520; 95% CI 1.131-2.042) with the development of bacterial pneumonia. The rest of the variables were not statistically significant after adjusting the model with logistic regression.
ConclusionLow rates of bacterial pneumonia were found, with Klebsiella pneumoniae prevailing as the most frequent bacterium. Overuse of dexamethasone in intensive care unit COVID-19 patients could increase the risk of bacterial pneumonia. For this reason, it must be evaluated in greater depth to explain causality and effect.
SARS-CoV-2 es el nuevo coronavirus que origina la enfermedad COVID-19, la cual se ha convertido en la mayor pandemia en el nuevo milenio1. Según datos del Center for Systems Science and Engineering de la Johns Hopkins University, desde finales del 2019 hasta el 27 de junio del 2021 se infectaron 181.038.754 personas en el mundo, de las cuales murieron 3.921.9742. En Colombia, hasta esa fecha se registraron 104.678 defunciones, de las cuales 8.922 fueron reportadas en el departamento del Atlántico3.
Los pacientes con SARS-CoV-2 hospitalizados en la unidad de cuidados intensivos (UCI) tienen el riesgo de presentar neumonía bacteriana4,5. Esto se asocia a la corticoterapia mayor de 10mg/día6, enfermedades cardiometabólicas7,8, obesidad9, uso de ventilación mecánica invasiva (VMI) durante más de 48h10 y respuesta inmunoinflamatoria exacerbada11. Estas condiciones incrementan considerablemente la tasa de mortalidad en los pacientes críticamente enfermos10.
En nuestro estudio se evaluó la frecuencia de neumonía bacteriana en pacientes con COVID-19 y los factores relacionados en la UCI de adultos de la red hospitalaria pública de Barranquilla, Colombia.
Materiales y métodosSelección de pacientes y diseño del estudioSe realizó un estudio observacional tipo casos y controles anidado a una cohorte de pacientes ingresados en la UCI general de 29 camas en la ciudad de Barranquilla, en la costa norte de Colombia, entre los meses de marzo y agosto del 2020. Se consideraron casos todos los pacientes que resultaron con neumonía bacteriana después de haber estado más de 72h en la UCI. Se consideraron controles aquellos pacientes que después de estar más de 72h en la UCI no se infectaron. Para la selección de los controles se tuvo en cuenta que fueran iguales en cuanto a sexo y con una diferencia de edad de ±5 años con la población que conformaban los casos.
Toda la población de estudio, tanto los casos como los controles, eran pacientes con prueba de RT-PCR COVID-19 (positiva) con hospitalización en UCI mayor de 72h debido a neumonía comunitaria grave, definida a través de los criterios clínicos de ingreso de la Infectious Diseases Society of America y la American Thoracic Society y requerimiento de monitorización ventilatoria por alto riesgo de insuficiencia respiratoria aguda. Se definieron los pacientes con neumonía bacteriana por muestra de aspirado de secreción bronquial con aislamiento positivo del tracto respiratorio inferior para al menos un microorganismo bacteriano (mayor o igual a 104UFC/mL), durante la estancia y hospitalización. Se excluyeron los pacientes que tenían VMI mayor de 48h sin toma de muestra de aspirado de secreción bronquial y los pacientes con probabilidad de neumonía bacteriana asociada a VMI definida por criterios del Clinical Pulmonary Infection Score mayor de 6 puntos.
Para la prevención de la neumonía asociada a la VMI en toda la población de estudio se realizó de forma rutinaria el protocolo institucional, que consta de: 1) colocación de la cabecera del paciente a 30-45°; 2) aspiración de secreciones por sistema cerrado diario; 3) cambio rutinario del circuito del ventilador cada 72h; 4) mantenimiento de la presión del neumotaponador a 30cmH2O, y 5) lavado bucal con clorhexidina. En nuestra unidad existe un cumplimiento de la adherencia superior al 95% del paquete de prevención de neumonía asociada a la VMI. Además, en todos los pacientes se valoraba diariamente la necesidad de destete de VMI.
Las historias clínicas de los pacientes se revisaron retrospectivamente teniendo en cuenta las normativas nacionales e institucionales, y se recogieron en un instrumento de recolección de datos para su posterior ingreso en una base de datos de Microsoft Excel®, a la que solo tenían acceso los investigadores principales. Las variables de nuestro estudio incluyen variables sociodemográficas, comorbilidades clínicas, intervención terapéutica (antibioticoterapia empírica, corticoterapia), reporte hematológico y cultivos de secreción bronquial (perfil de susceptibilidad y resistencia).
Análisis estadísticoTanto para los casos como para los controles, se agruparon variables teniendo en cuenta las comorbilidades como: diabetes mellitus tipo 2, hipertensión arterial y sobrepeso. Además, se analizaron las variables relacionadas con el tiempo de hospitalización antes y después del ingreso en la UCI. Adicionalmente se evaluaron los tiempos de antibioticoterapia empírica y corticoterapia. Se calcularon medias y desviación estándar en las variables cuantitativas y proporciones en las variables categóricas. Para evaluar las diferencias entre proporciones se usó la prueba exacta de Fisher y para las diferencias de medias se usó la prueba U de Mann-Whitney. Las variables que presentaron diferencia estadísticamente significativa se corrieron en un modelo explicativo basado en una regresión logística binaria. Todos los datos fueron analizados usando el software estadístico IBM® SPSS® Statistics versión 25.
ResultadosEn la institución ingresaron 268 pacientes con COVID-19 en la UCI desde el 9 de mayo hasta el 7 de agosto del 2020, de los cuales 168 (62,7%) eran hombres y 100 (37,3%) mujeres. El promedio de edad de los hombres era de 59,6 años (DE 11,4) y el de las mujeres de 54,0 años (DE 15,6). El total de pacientes que luego de entrar a la UCI resultaron infectados con al menos un tipo de bacteria del tracto respiratorio inferior después de las 72h de su ingreso fue de 27. Por tanto, el porcentaje de neumonía bacteriana fue del 10,07% (27/268). Los controles se seleccionaron del resto de los pacientes. En total se escogieron 27 pacientes que conformaron el grupo de controles.
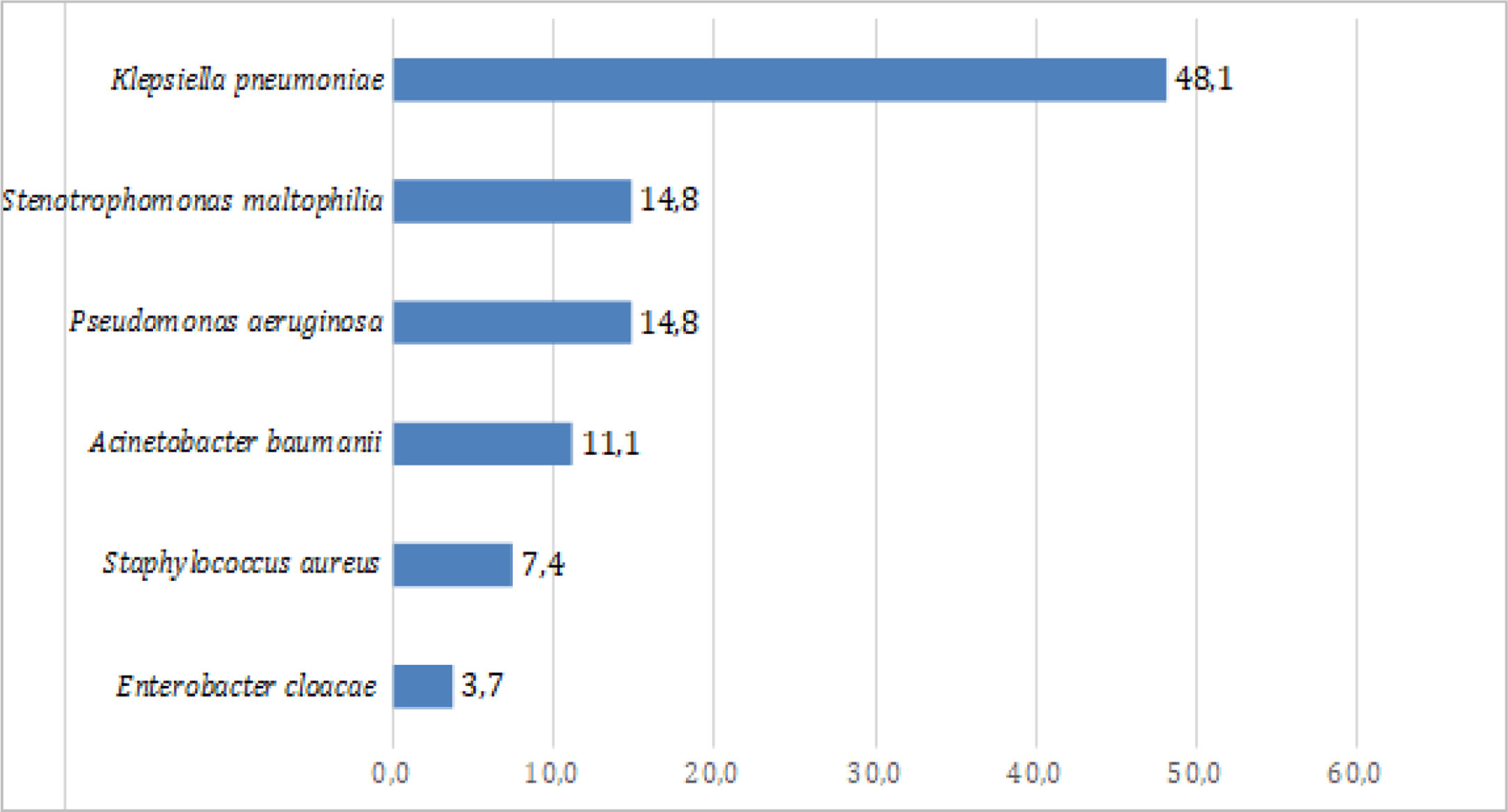
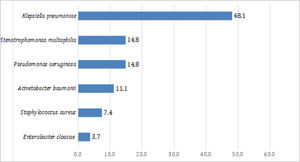
Bacterias aisladas de secreción bronquial en pacientes con COVID-19 después de 72h de hospitalización en UCIEn el 48,1% de los pacientes con neumonía bacteriana se aisló Klebsiella pneumoniae. Las otras 2 bacterias más frecuentes fueron Pseudomonas aeruginosa (14,8%) y Stenotrophomonas maltophilia (14,8%) (fig. 1). El porcentaje de bacterias resistentes fue bajo. De las 16 Klebsiella pneumoniae aisladas, 4 (25%) presentaban betalactamasas de espectro extendido.
Enfermedades de baseEl 14,8% (4/27) de los pacientes con neumonía bacteriana tenían diabetes mellitus tipo 2, el 40,7% (11/27) presentaban hipertensión arterial y el 18,5% (5/27) sobrepeso. Cuando se evaluó la diferencia entre los pacientes que tenían infección del tracto respiratorio inferior y los que no con alguna de las enfermedades anteriormente mencionadas, se encontró que no hubo diferencia estadísticamente significativa (p>0,05) (tabla 1).
Diferencia en la distribución de enfermedades de base presentadas en casos y controles
| Infección | |||||||
|---|---|---|---|---|---|---|---|
| Sí | (%) | No | (%) | Total | (%) | pa | |
| Diabetes mellitus tipo 2 | |||||||
| Sí | 4 | 14,8 | 8 | 29,6 | 12 | 22,2 | 0,3265 |
| No | 23 | 85,2 | 19 | 70,4 | 42 | 77,8 | |
| Hipertensión arterial | |||||||
| Sí | 11 | 40,7 | 12 | 44,4 | 23 | 42,6 | 1,000 |
| No | 16 | 59,3 | 15 | 55,6 | 31 | 57,4 | |
| Sobrepeso | |||||||
| Sí | 5 | 18,5 | 6 | 22,2 | 11 | 20,4 | 1,000 |
| No | 22 | 81,5 | 21 | 77,8 | 43 | 79,6 | |
El promedio del total de días hospitalizado (hospitalización+UCI) fue de 12,78 días (DE 7,06). El promedio de estancia en UCI solamente fue de 9,9 días (DE 6,7). Estos pacientes recibieron VMI en promedio 7,85 días (DE 6,07). Cuando se evaluó la diferencia entre los infectados con neumonía bacteriana y los no infectados no se encontraron diferencias estadísticamente significativas (p>0,05) (tabla 2).
Diferencia promedio de la estancia hospitalaria (hospitalización-UCI) y tiempo con soporte ventilatorio de casos y controles
| Casos | Controles | pa | |||
|---|---|---|---|---|---|
| Media | DE | Media | DE | ||
| Estancia hospitalaria (días previos UCI) | 3,17 | 4,50 | 2,67 | 4,84 | 0,6125 |
| Estancia hospitalaria UCI (días) | 11,17 | 7,76 | 9,14 | 5,98 | 0,1848 |
| Total días hospitalización(hospital+UCI) | 14,33 | 7,40 | 11,81 | 6,77 | 0,0939 |
| Tiempo con ventilación mecánica invasiva UCI (días) | 8,69 | 7,07 | 7,33 | 5,38 | 0,2944 |
DE: desviación estándar; UCI: Unidad de Cuidados Intensivos.
Con base en las recomendaciones de la Organización Mundial de la Salud para el manejo de la infección asociada a SARS-CoV-2 y el compromiso pulmonar se inició terapia antimicrobiana de forma empírica. El promedio de consumo de cada uno de los antibióticos suministrados a los pacientes se puede observar en la tabla 3. Al evaluar la diferencia en el consumo de antibióticos entre los que se infectaron con neumonía bacteriana y los que no, se encontró una diferencia estadísticamente significativa entre los que consumieron claritromicina. En cuanto al tiempo de consumo de claritromicina, el análisis de regresión logística encontró que los pacientes que tomaron claritromicina durante más de 7 días aumentan el riesgo de desarrollar infecciones bacterianas del tracto respiratorio inferior 1,567 veces comparados con aquellos que la consumieron durante menos tiempo (tabla 4).
Diferencia en el tiempo promedio de consumo de antibióticos empíricos y corticoterapia entre casos y controles
| Infección | |||||
|---|---|---|---|---|---|
| Tiempo consumo antibiótico empírico (días) | Casos | Controles | pa | ||
| Media | DE | Media | DE | ||
| Ampicilina-sulbactam | 2,1 | 3,6 | 1,2 | 3,1 | 0,1940 |
| Cefepima | 3,6 | 4,5 | 1,5 | 2,1 | 0,1760 |
| Ceftriaxona | 0,4 | 1,0 | 0,3 | 1,1 | 0,4410 |
| Meropenem | 1,3 | 3,9 | 0,4 | 1,2 | 0,3610 |
| Piperacilina-tazobactam | 0,7 | 2,4 | 0,5 | 1,2 | 0,5480 |
| Azitromicina | 0,0 | 0,0 | 0,6 | 3,1 | 0,3170 |
| Claritromicina | 7,4 | 3,8 | 3,0 | 2,5 | 0,0000 |
| Doxiciclina | 0,2 | 0,6 | 0,4 | 1,4 | 0,3750 |
| Vancomicina | 1,9 | 3,3 | 0,8 | 1,5 | 0,5150 |
| Tiempo de consumo corticoterapia | |||||
| Betametasona | 0,03 | 0,17 | 0,02 | 0,13 | 0,7484 |
| Dexametasona | 5,36 | 4,92 | 2,03 | 2,83 | 0,0001 |
| Hidrocortisona | 0,75 | 2,22 | 0,45 | 0,94 | 0,366 |
| Metilprednisolona | 0,42 | 1,11 | 0,59 | 1,69 | 0,5936 |
DE: desviación estándar.
Para controlar el proceso inflamatorio propio de la COVID-19 se suministró a los pacientes corticoterapia. En promedio, la dexametasona fue el corticosteroide con el promedio de días más largo: 3,31 (DE 4,085). El resto de corticosteroides no tenían más de un día en promedio. Al comparar entre casos y controles, se encontró una diferencia estadísticamente significativa entre el promedio de días que se les aplicó a los casos (infectados del tracto respiratorio inferior) y los controles (no infectados) (p=0,001) (tabla 3). Adicionalmente, en nuestro estudio se encontró que los pacientes que tomaron dexametasona durante más de 5 días aumentan el riesgo de desarrollar neumonía bacteriana 1,520 veces comparados con aquellos que la consumieron durante menos tiempo (tabla 4).
Perfil bioquímicoEn el perfil bioquímico se evaluó el perfil hematológico (eritrocitos, leucocitos, neutrófilos, linfocitos, hemoglobina y plaquetas) (tabla 5). Adicionalmente, se evaluaron los marcadores pronósticos como dímero D, ferritina y lactato deshidrogenasa (LDH) (tabla 5). En cuanto al perfil hemático identificado en toda la población en UCI, el promedio de eritrocitos fue de 4,3×106 cél/μl (DE 1,4), el promedio de leucocitos fue de 15,0×103 cél/μL (DE 6,59), el promedio del porcentaje de neutrófilo fue del 85% (DE 8,5), el promedio de linfocitos fue de 7,5×103 cél/μL (DE 6,2), el promedio de basófilos fue de 0,16×103 cél/μL. El promedio de plaquetas fue de 280.800 plaquetas/μL (DE 110,720). En los hombres, el promedio de hemoglobina fue de 12,2g/dl (DE 2,3), mientras que el de las mujeres fue de 11,8g/dL (DE 1,9). Cuando se evaluó si había diferencias entre los que presentaron neumonía bacteriana y los que no, se encontraron solo diferencias significativas en el valor de las plaquetas (p=0,02). En los otros parámetros los valores de p fueron>0,05. Respecto a los valores de dímero D y LDH, los valores promedio fueron 2.188,88ng/mL (DE 3.401,4) y 399,8UI/L (DE 312,2), respectivamente. El promedio de ferritina se distribuyó entre los hombres y las mujeres. La ferritina en hombres fue de 1.659,73ng/mL (DE 851,920) y en las mujeres fue de 909,38ng/mL (DE 942,6).
Diferencia de los valores promedio de parámetros hemáticos y marcadores pronósticos entre casos y controles
| Variables | Casos | Controles | pa | ||
|---|---|---|---|---|---|
| Media | DE | Media | DE | ||
| Parámetros hemáticos | |||||
| Eritrocitos (×106 cél/μL) | 4,6 | 2,1 | 4,2 | 0,6 | 0,1748 |
| Leucocitos (×103 cél/μL) | 16,3 | 7,9 | 14,3 | 5,6 | 0,1548 |
| Neutrófilos (%) | 85,7 | 6,7 | 86,0 | 9,5 | 0,8689 |
| Linfocitos (×103 cél/μL) | 7,5 | 5,0 | 7,6 | 6,9 | 0,9400 |
| Hemoglobina (g/dL) | 12,0 | 2,1 | 12,1 | 1,0 | 0,8177 |
| Plaquetas (×103 cél/μL) | 249,2 | 99,4 | 300,3 | 113,6 | 0,0280 |
| Marcadores pronósticos | |||||
| Dímero D (ng/mL) | 1.884,07 | 3.264,93 | 2.368,36 | 3.498,69 | 0,5052 |
| Ferritina (ng/mL) | 1.571,78 | 959,83 | 1.397,03 | 918,34 | 0,3804 |
| LDH (ng/mL) | 391,50 | 280,28 | 403,69 | 331,12 | 0,8547 |
DE: desviación estándar; LDH: lactato deshidrogenasa.
Las infecciones bacterianas del tracto respiratorio inferior son complicaciones frecuentes de las neumonías virales en pacientes críticamente enfermos, siendo poco estudiadas en Latinoamérica7,12,13. Estas infecciones asociadas a la COVID-19 han ejercido una presión sin precedentes en los sistemas de salud de la región, conduciendo a la necesidad de hospitalización en UCI14,15. Esto se podría asociar al uso excesivo de antibioticoterapia empírica, lo cual aumenta la probabilidad de muerte11,16,17. En este estudio se encontró que el 10,07% (n=27) de los cultivos de secreción bronquial del tracto respiratorio inferior resultaron positivos para al menos una bacteria gramnegativa. Este dato es inferior al evidenciado en un estudio de Goncalves Mendes Neto et al., quienes encontraron que el 19% de los aislamientos fueron positivos en pacientes críticos7, mientras que en España Garcia-Vidal et al. plantearon que el 7,4% de los pacientes con COVID-19 presentaba neumonía bacteriana en el epitelio respiratorio, incrementando el riesgo de desenlaces fatales18. En un metaanálisis liderado por Lansbury et al., concluyeron que aproximadamente el 7% de los pacientes con COVID-19 tenían neumonía bacteriana, lo que aumentó al 14% solo en pacientes en una UCI19.
En pacientes con COVID-19 las comorbilidades cardiometabólicas se han relacionado con mayores tasas de infección bacteriana en el epitelio respiratorio y con una mayor gravedad clínica7,8; en nuestro estudio no se evidenció dicha asociación. En fases tempranas de la COVID-19, en algunos estudios la proporción de linfocitos T CD4+ y linfocitos T CD8+ se mantiene en niveles normales en pacientes con comorbilidades cardiometabólicas, disminuyendo la asociación con neumonía bacteriana20. Sin embargo, en nuestro estudio no se evaluaron estos niveles de linfocitos T CD4+ y linfocitos T CD8+, por lo que se propone la necesidad de hacer un estudio donde se evalúe esta asociación. De igual forma, Crotty et al. no encontraron ninguna diferencia estadísticamente significativa entre los pacientes que presentaban alguna comorbilidad cardiometabólica y la presencia de coinfección bacteriana (p>0,05)21.
En cuanto a los parámetros hematológicos como leucocitos, neutrófilos, linfocitos y hemoglobina, no se relacionaron con la presencia de neumonía bacteriana (p>0,05). Buehler et al. encontraron que los niveles de plaquetas son similares en los pacientes con neumonía bacteriana y en no infectados, sin existir significación estadística en ambos grupos5. En nuestro estudio, aunque en el análisis bivariado se encontró una diferencia estadísticamente significativa en el conteo de plaquetas entre los pacientes que presentaban neumonía bacteriana y los que no la presentaban, en el análisis multivariado, al ajustar las variables, se evidenció que el número de plaquetas era estadísticamente similar tanto en los pacientes con neumonía bacteriana como en los que no presentaban infección.
La atención sanitaria ha tenido que responder y adaptarse rápidamente a los desafíos del uso de antimicrobianos en sospecha o curso de coinfección asociada a la COVID-1916,22. Según la Organización Mundial de la Salud, en situaciones de neumonía comunitaria grave se recomienda la aplicación de antimicrobianos intravenosos de amplio espectro dentro de la primera hora23,24. Estos incluyen el uso de macrólidos, cefalosporinas de cuarta generación (con factores de riesgo a Pseudomonas aeruginosa), tetraciclinas y quinolonas, teniendo en cuenta los factores del huésped y el perfil epidemiológico de resistencia local y hospitalaria22,25.
En pacientes con neumonía comunitaria grave por COVID-19 se recomienda el uso de esquemas de antibioticoterapia empírica como inhibidores betalactámicos/macrólidos y cefalosporinas/macrólidos23. Sin embargo, hay diversas posiciones sobre el uso de antibioticoterapia empírica. Por ejemplo, Du et al. determinaron que el uso de antibioticoterapia empírica de amplio espectro no modifica la evolución de la enfermedad en pacientes críticos dentro de su estudio26. Esto es similar a lo publicado por Goncalves Mendes Neto et al., donde la aplicación de antibioticoterapia empírica en pacientes críticamente enfermos presentaba peores resultados7. Por otra parte, Bardi et al. encontraron que la mayoría de los pacientes que recibieron un ciclo de cefalosporinas/macrólidos presentaron neumonía bacteriana nosocomial asociada a la COVID-19 (p<0,05)6. En nuestro estudio encontramos bajas tasas de resistencia bacteriana en los cultivos de secreción bronquial con al menos un aislamiento bacteriano, pero sí un alto consumo de antibioticoterapia empírica generalizado, parecido a lo encontrado por Nori et al.17. Esto se explica por la incertidumbre clínica, la dificultad para diferenciar la progresión y gravedad de la COVID-1914, lo cual genera un problema en la prescripción empírica en los centros de salud a nivel mundial7,14.
Los corticosteroides son agentes antiinflamatorios utilizados en el síndrome de dificultad respiratoria aguda, shock séptico refractario y en algunas comorbilidades respiratorias27,28. Actualmente, el uso de glucocorticoides ha demostrado tener resultados positivos en la modulación de las respuestas inflamatorias29, la reducción de la mortalidad a corto plazo30,31 y un menor tiempo de VMI en pacientes con COVID-1930,32,33. Sin embargo, existen datos opuestos donde no se reduce el tiempo de eliminación del virus, o la necesidad de VMI34–37. Por esta razón, hay controversia en el uso de corticosteroides en el manejo de la infección respiratoria aguda por SARS-CoV-238.
Teóricamente, la desregulación inmune secundaria a la infección por SARS-CoV-211,39 y el efecto inmunosupresor del uso de corticoides17 son considerados factores relacionados de neumonía bacteriana, pero no existe evidencia clara de esta relación. En nuestros datos encontramos que en el consumo de corticoterapia generalizada (metilprednisolona, hidrocortisona, betametasona) no se encontró significación estadística para la presencia de neumonía bacteriana. Por el contrario, los pacientes con neumonía bacteriana tenían tasas elevadas de consumo de dexametasona (p<0,05), similar a lo reportado por Goncalves Mendes Neto et al.7. Sin embargo, nuestro estudio es limitado en cuanto a responder a la asociación de causalidad-efecto entre la presencia de neumonía bacteriana y el uso de dexametasona. Los glucocorticoides predisponen a una disminución de citocinas proinflamatorias, factor nuclear kappa beta, aumentando el riesgo de colonización y neumonía bacteriana40. Además, aumenta la captación viral del SARS-CoV-2 por las células alveolares tipo 2, afectando la secreción del surfactante e inhibiendo el aclaramiento del líquido alveolar vectorial, lo que se relaciona con la presencia de neumonía bacteriana41.
Con respecto a los marcadores pronóstico (dímero D, ferritina, LDH), estos niveles son similares en los pacientes con neumonía bacteriana y los que no estaban infectados, no existiendo significación estadística (p>0,05). En contraste, Crotty et al. encontraron que los niveles elevados de LDH eran superiores cuando el paciente presenta coinfección bacteriana del tracto respiratorio inferior (1.210UI/l; p<0,05)21.
ConclusiónLa neumonía bacteriana en pacientes con COVID-19 coloca en alarma los sistemas de salud en las UCI. Durante la COVID-19 el cambio de flora bacteriana presionado por las intervenciones deliberadas de antimicrobianos augura un nuevo reto desde el enfoque del paciente con infección. En este estudio se encontraron tasas bajas de neumonía bacteriana; predomina la Klebsiella pneumoniae como la bacteria más frecuente. Se encontró un elevado consumo de terapia antibiótica empírica, por lo que se recomienda un mejor control, estandarización y creación de protocolos de uso según los patrones de resistencia de las instituciones clínicas. El uso excesivo de dexametasona en pacientes con COVID-19 en UCI podría aumentar el riesgo de neumonía bacteriana. Por este motivo, debe evaluarse con mayor profundidad a través de la realización de estudios clínicos que puedan explicar causalidad y efecto.