Algunas enfermedades neurológicas requieren ingreso en la unidad de cuidados intensivos (UCI) por su riesgo de complicaciones y necesidad de monitorización estricta. El Doppler transcraneal, herramienta no invasiva y accesible, permite evaluar la hemodinámia cerebral y guiar intervenciones, proporcionando información pronóstica valiosa. Este estudio evaluó su utilidad y su relación con el desenlace funcional según la escala de Rankin modificada (mRS) al egreso de la UCI y a los 28 días.
Material y métodosSe realizó un estudio prospectivo, descriptivo y observacional en los pacientes con enfermedades del sistema nervioso central. Se registraron mediciones de la arteria cerebral media mediante Doppler transcraneal al ingreso, a las 24 y 48h, y al egreso de la UCI, con seguimiento a 28 días mediante la escala de mRS.
ResultadosLa velocidad diastólica de la arteria cerebral media se asoció significativamente con el pronóstico funcional según la escala mRS al egreso de la UCI y a los 28 días. Asimismo, los puntajes de Glasgow, SOFA y APACHE II al ingreso se relacionaron de manera significativa con el desenlace a 28 días (p<0,001). La mRS al egreso y a los 28 días también se asoció significativamente con la mortalidad (p=0,001 y p<0,001, respectivamente).
ConclusionesLas bajas velocidades diastólicas y de presión de perfusión cerebral, así como los altos índices de pulsatilidad y presión intracraneana, se asociaron con mayor discapacidad funcional y mortalidad, reflejando la gravedad clínica. Además, los puntajes de Glasgow, SOFA y APACHE II al ingreso demostraron valor pronóstico al correlacionarse con el desenlace a 28 días.
Some neurological pathologies require admission to the intensive care unit (ICU) due to their risk of complications and the need for close monitoring. Transcranial Doppler (TCD), a non-invasive and accessible tool, allows for the evaluation of cerebral hemodynamics and can guide interventions, providing valuable prognostic information. This study assessed its utility and its relationship with functional outcomes according to the Rankin Scale (mRS) at ICU discharge and at 28 days.
Materials and methodsA prospective, descriptive, observational study was conducted in patients with central nervous system pathologies. Middle cerebral artery measurements were recorded using transcranial Doppler at admission, 24 and 48 hours, and at ICU discharge, with follow-up at 28 days using the mRS.
ResultsDiastolic velocity of the middle cerebral artery was significantly associated with functional prognosis according to the mRS at ICU discharge and at 28 days. Likewise, Glasgow, SOFA, and APACHE II scores at admission were significantly associated with 28-day outcomes (P<.001). The mRS at discharge and at 28 days showed a significant association with mortality (P=.001 and P<.001, respectively)
ConclusionsLow diastolic velocities and cerebral perfusion pressure, as well as high pulsatility indices and intracranial pressure were associated with greater functional disability and mortality, reflecting clinical severity o the patients. Additionally, Glasgow, SOFA, and APACHE II scores at admission demonstrated prognostic value, correlating with 28-day outcomes.
ConclusionsCerebral blood flow measurements at ICU discharge, particularly low velocities and high pulsatility indices, were associated with greater functional disability, which in turn was linked to increased mortality, reflecting clinical severity and the risk of adverse outcomes.
El ultrasonido Doppler transcraneal (DTC) es una herramienta no invasiva y accesible para la evaluación hemodinámica cerebral en los pacientes neurocríticos, útil tanto en la detección precoz de vasoespasmo como en la monitorización del flujo sanguíneo cerebral en condiciones como hemorragia subaracnoidea, traumatismo craneoencefálico o hipertensión intracraneal1.
En este contexto, la hipertensión intracraneal y el edema cerebral representan complicaciones frecuentes que comprometen la presión de perfusión cerebral (PPC) y favorecen isquemia, herniación y desenlaces desfavorables2–6. La autorregulación cerebral, mediada por la unidad neurovascular, puede alterarse en fases críticas, y parámetros como la presión intracraneal (PIC), la PPC, índice de pulsatilidad (IP), índice resistivo (IR) y la velocidad de flujo en arterias cerebrales principales, particularmente la arteria cerebral anterior (ACA), arteria cerebral media (ACM) y arteria cerebral posterior (ACP) son determinantes en el pronóstico neurológico3–6.
El cerebro, que representa aproximadamente el 2% del peso corporal, consume cerca del 50% de la glucosa total, lo que exige un aporte sanguíneo constante a través de las circulaciones carotídea y vertebrobasilar1. Entre ellas, la ACM y la ACP son especialmente vulnerables, ya que irrigan extensas regiones corticales y profundas, y su compromiso se ha relacionado con una mayor incidencia de eventos isquémicos1.
La barrera hematoencefálica y la unidad neurovascular mantienen la homeostasis cerebral a través de la interacción de células endoteliales, astrocitos, pericitos y elementos inmunes2. En este equilibrio, la PPC y la PIC son parámetros críticos: una PPC<50mmHg se asocia con isquemia grave, mientras que la PIC, normalmente entre 10-20mmHg, depende del balance entre la producción y reabsorción de líquido cefalorraquídeo (LCR) y de la presión venosa intracraneal3. La disminución progresiva del flujo sanguíneo cerebral conduce a un espectro de alteraciones que va desde cambios electroencefalográficos hasta la aparición de edema citotóxico y cese de la actividad neuronal4.
El edema cerebral constituye el principal mecanismo de daño celular y se clasifica en vasogénico, intersticial, citotóxico y neurotóxico; y con distribución focal o difuso. Sus causas incluyen traumatismo craneoencefálico, accidente cerebrovascular, hemorragia, infecciones, tumores e hidrocefalia. Su complicación mas relevante es la reducción de la PPC, que puede progresar a isquemia, herniación cerebral y, en consecuencia, muerte o discapacidad funcional5,6.
Dado que el volumen intracraneal es generalmente fijo, la PIC depende del flujo sanguíneo cerebral y del equilibrio de producción y reabsorción de LCR. Cuando se agotan los mecanismos compensatorios, la PIC puede alcanzar la presión crítica de cierre, colapsando el flujo sanguíneo cerebral6. En estas circunstancias, las arteriolas distales intentan dilatarse como mecanismo compensatorio; si este proceso fracasa, se produce un aumento de la presión arterial que incrementa el volumen sanguíneo cerebral y exacerba la hipoperfusión6.
La neuromonitorización puede ser invasiva, —como en el caso de la sonda intraparenquimatosa o el drenaje ventricular externo— o no invasiva, permitiendo evaluar parámetros clave como el flujo sanguíneo, la PIC y PPC y, además, la función cerebral mediante técnicas electrofisiológicas6,7. Entre las modalidades no invasivas, la pupilometría automatizada aporta una medición objetiva del tamaño y reactividad pupilar8, mientras que el DTC permite medir la velocidad de flujo en las arterias cerebrales basales a través de ventanas transtemporal, transorbital, occipital y submandibular. Esta técnica resulta especialmente útil para descartar hipertensión intracraneal en ausencia de monitorización invasiva7,9. Usando la velocidad del flujo sistólico (VS), la velocidad del flujo diastólico (VD) y la velocidad media (VM) del flujo del espectro de la ACM, se puede calcular el IP mediante la fórmula: IP=(VS-VD/VM), donde VM=([VS+2VD]/3). Con el IP se puede estimar la PIC usando la fórmula de Bellner10: PIC: (IP × 10,93) – 1,28. Al obtener la PIC podemos estimar la PPC a través de la diferencia entre la presión arterial media y la presión intracraneal (PAM-PIC)11.
Las hernias encefálicas representan un desplazamiento sostenido de tejido cerebral secundario al aumento de la PIC, pudiendo ser subfalciales o transtentoriales, con alto riesgo de compresión vascular y daño neuronal12.
El manejo inicial de la hipertensión intracraneal se basa en sedación y analgesia cuidadosamente monitorizadas para evitar hipotensión y mantener normovolemia, con el beneficio adicional de disminuir el riesgo de crisis convulsivas13. La osmoterapia con manitol o solución salina hipertónica contribuye a expandir el volumen plasmático, reducir la viscosidad sanguínea y disminuir el volumen cerebral; su dosificación se ajusta de acuerdo con la sintomatología y la meta de sodio sérico entre 145-155mEq/l8,14. Otras medidas incluyen el control estricto de PaCO2 y glucosa, el uso de barbitúricos en casos refractarios y, cuando es necesario, la intervención quirúrgica mediante evacuación de lesiones ocupantes de espacio, drenaje de LCR o craniectomía descompresiva11.
Para la evaluación funcional y pronóstica en los pacientes neurocríticos se emplean escalas como la de Ramsay, que valora el nivel de sedación, y la de Rankin modificada (mRS), que mide la recuperación funcional tras un daño neurológico (tabla 1)14,15. Diversos estudios y metaanálisis han demostrado que la autorregulación cerebral dinámica y los parámetros obtenidos mediante DTC se correlacionan con los desenlaces funcionales. En particular, se ha descrito que velocidades medias, especialmente en la ACM, con flujos inferiores a 35cm/s se asocian con un mayor riesgo de desenlace desfavorable16,17. Así mismo, Mosry et al., observaron que una velocidad diástolica de la ACM<20cm/s en los pacientes con TCE severo indica hipoperfusión, asociándose con mal pronóstico funcional y menor supervivencia18. Flujos diastólicos por debajo de este umbral también se relacionan con mayor mortalidad hospitalaria y peor recuperación a los 3, evaluada mediante la escala de desenlace de Glasgow (GOSE, por sus siglas en inglés: Glasgow Outcome Scale Extended). Hasta la fecha, existen pocos estudios que analicen la relación entre los hallazgos de DTC y la escala de mRS; además, los que se han realizado se han centrado en una enfermedad específica como traumatismo craneoencefálico y evento vascular isquémico. En este contexto, el objetivo de nuestro estudio fue evaluar las características del flujo cerebral registradas mediante DTC en los pacientes neurocríticos y su asociación con el desenlace funcional al egreso de la unidad de cuidados intensivos (UCI), medido mediante la escala de mRS a los 28 días.
Escala de Rankin modificada (mRS)18
| Puntaje | Descripción |
|---|---|
| 0 | Sin síntomas. |
| 1 | Sin discapacidad significativa a pesar de los síntomas; capaz de realizar todas las tareas y actividades habituales. |
| 2 | Discapacidad leve; incapaz de realizar todas las actividades anteriores, pero capaz de cuidar de sus propios asuntos sin ayuda. |
| 3 | Discapacidad moderada; requiere de algo de ayuda, pero puede caminar sin asistencia. |
| 4 | Discapicadad moderadamente grave; incapaz de caminar sin ayuda e incapaz de atender sus propias necesidades corporales sin ayuda. |
| 5 | Incapacidad grave; postrado en cama, incontinente, requiere atención y cuidados de enfermería constantes. |
| 6 | Muerte. |
Se realizó un estudio prospectivo, observacional durante un periodo de diez meses en un hospital de tercer nivel de la ciudad de México. El estudio fue aprobado por los comités de ética e investigación institucional (Hospital Juárez de México HJM 132/24-R); el consentimiento informado se obtuvo a través de los familiares de los pacientes. Se incluyeron pacientes adultos (18 a 80 años), con enfermedad del SNC y ventana transtemporal adecuada para realización de DTC. Se excluyeron únicamente quienes retiraron consentimiento informado o quienes fueron trasladados a otra institución antes del primer control. Los fallecidos fueron mantenidos en el análisis con intención de seguimiento.
Se realizaron mediciones de los flujos cerebrales mediante DTC por un médico especialista con formación en ecografía neurocrítica. Las evaluaciones se efectuaron al ingreso, a las 24, a las 48h y al egreso, determinando las velocidades de flujo cerebral en ambas ACM: VS, VD, VM, IP, IR, PIC y PPC. De manera simultánea, se registraron los parámetros clínicos, incluyendo la TAM al momento de cada medición. La PIC y la PPC se estimaron de forma no invasiva utilizando la fórmula de Bellner, basada en IP y PAM. Las mediciones se realizaron con equipo de ultrasonido Mindray TE7 ACE, software Smart VTI sonda phased array, promediando 3 espectros válidos por vaso (fig. 1). El tiempo de sedación se definió como los días con infusión continua de sedantes (propofol, midazolam o dexmedetomidina). La profundidad se evaluó con la escala de Ramsay por personal entrenado cada 4h. No se implementaron interrupciones diarias sistemáticas de la sedación La funcionalidad neurológica se evaluó al egreso de la UCI y a los 28 días mediante la escala de Rankin modificada (mRS) (tabla 1).
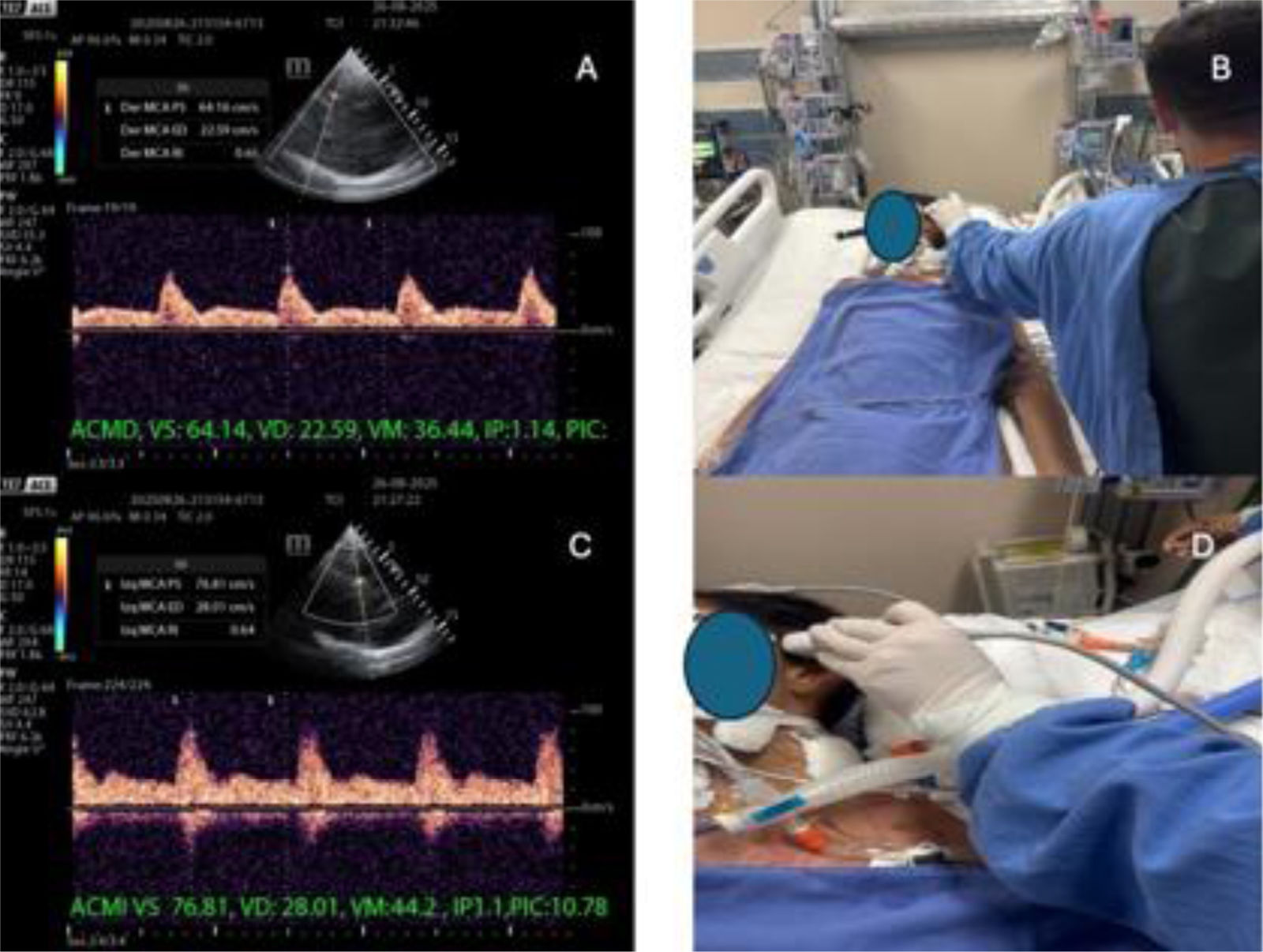
A y C) Doppler transcraneal (DTC) de la arteria cerebral media (ACM) derecha e izquierda a través de la ventana transtemporal, mostrando la velocidad sistólica (VS), velocidad diastólica (VD), velocidad media (VM), índice de pulsatilidad (IP) y la presión intracraneal estimada (PIC). B y D) Visualización de la ACM mediante DTC con ventana transtemporal.
Para el análisis estadístico se utilizó el software SPSS® IBM Statistics version 25. La distribución de las variables se evaluó mediante la prueba de normalidad de Kolmogorov-Smirnov. Las variables cuantitativas se expresaron como medias, desviación estándar y medianas; las cualitativas, en frecuencias y porcentajes. Las diferencias en las mediciones seriadas de flujo cerebral se analizaron con ANOVA de medidas repetidas con corrección de esfericidad. La asociación entre los parámetros de DTC y el desenlace funcional a través de mRS) se analizó mediante modelos de regresión logística binaria, categorizando el mRS en independencia o discapacidad leve (0-3) y dependencia severa o fallecimiento (4-6). Los modelos se ajustaron por sexo, etiología (TCE, EVC, tumor o infección), sedación, ventilación mecánica, osmoterapia y descenlace hospitalario. Los resultados se expresaron como razones de momios (OR) con intervalos de confianza del 95%. La supervivencia estratificada se analizó mediante curvas de Kaplan-Meier, considerando significativo un valor de p<0,05.
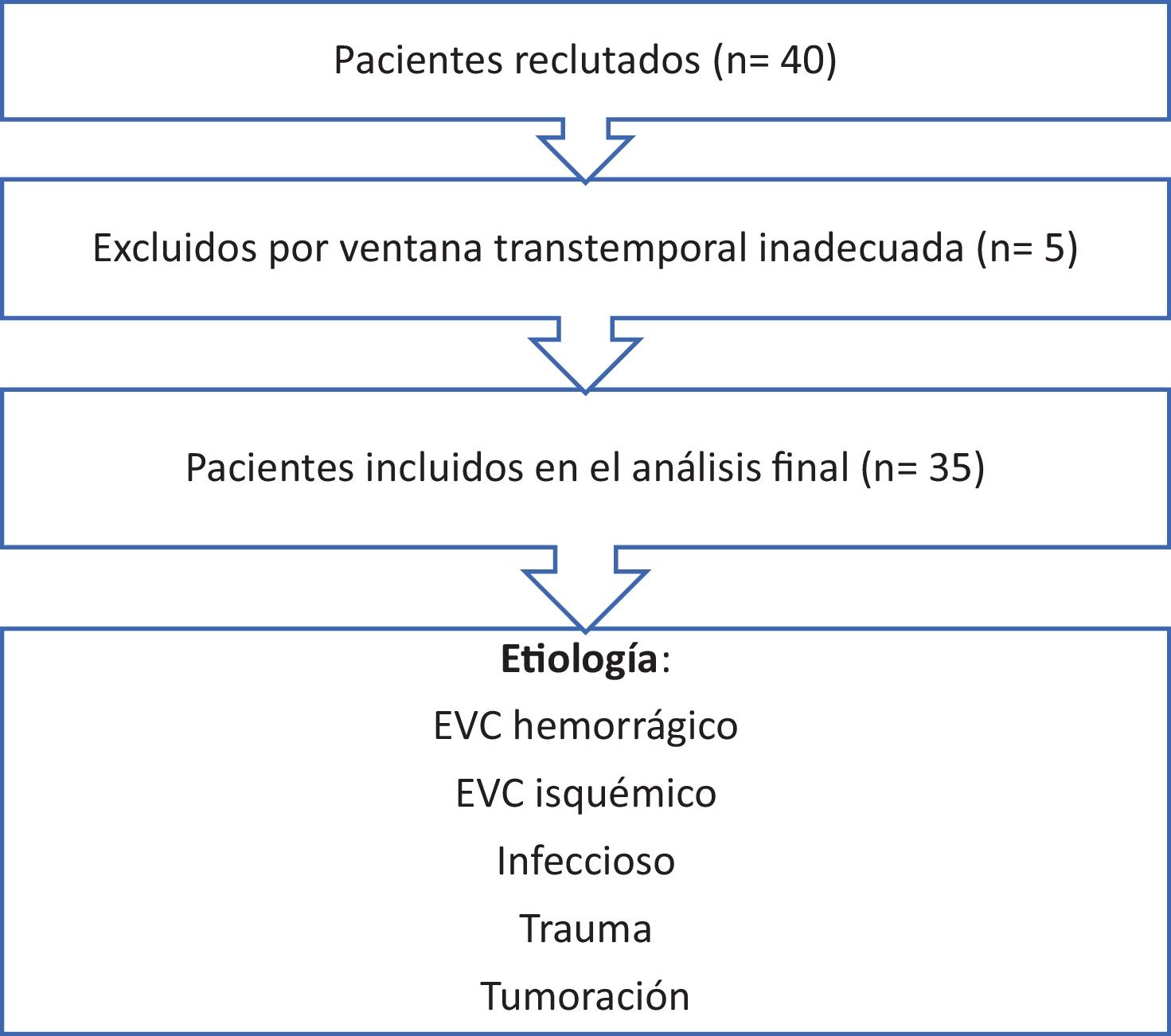
ResultadosDe los 40 pacientes reclutados, 35 (87,5%) presentaron ventana transtemporal adecuada y completaron el seguimiento a 28 días. En 5 casos (12,5%) no se obtuvo señal Doppler suficiente, por lo que fueron excluidos del análisis. El flujo de pacientes se detalla en la figura 2.
De la población estudiada (n=35), 19 (54,3%) fueron varones y 16 (45,7%) mujeres, observándose una mayor prevalencia de enfermedades neurocríticas de etiología médica en mujeres y causas traumáticas y vasculares en varones.
Las principales causas de ingreso a la UCI fueron: tumoraciones (20%, n=7), accidente cerebrovascular isquémico (20%, n=7), evento vascular hemorrágico (22,9%, n=8), traumatismo craneoencefálico (25,7%, n=9) y causas infecciosas (11,4%, n=4) (tabla 2). Las principales comorbilidades de nuestros pacientes fueron diabetes mellitus (22,9%, n=8), hipertensión arterial (31,4%, n=11) y síndrome de Down (2,8%, n=1).
Característica poblacionales de los pacientes ingresados al estudio
| Variable | n=35 |
|---|---|
| Género, n (%) | |
| Varón | 19 (54,3) |
| Mujer | 16 (45,7) |
| Tiempo de sedación en días, media (DE) | 4,42±4,0 |
| Etiología (%) | |
| EVC hemorrágico | 8 (22,9) |
| EVC Isquémico | 7 (20,0) |
| Infeccioso | 4 (11,4) |
| Trauma | 9 (25,7) |
| Tumoración | 7 (20,0) |
| Comorbilidades, n (%) | |
| Diabetes mellitus | 8 (22,9) |
| Hipertensión rterial | 11 (31,4) |
| Síndrome de Down | 1 (2,8) |
| Escala de mRS al egreso de la UCI, n (%) | |
| 0-3 puntos | 12 (34,3) |
| 4-6 puntos | 23 (65,7) |
| Escala de mRS a 28 días, n (%) | |
| 0-3 puntos | 16 (45,7) |
| 4-6 puntos | 19 (54,3) |
| Ventilación mecánica, n (%) | |
| Sí | 31 (88,6) |
| No | 4 (11,4) |
| Escala de coma de Glasgow a su ingreso, mediana (RIC)a | 8 (7,5-8,5) |
| Necesidad de cirugía | 19 (54,3) |
| Necesidad de reinterención quirúrgica | 3 (8,5) |
| SOFA, mediana (RIC)a | 9,5 (7-12,5) |
| APACHE II, mediana (RIC)a | 16,5 (11,2-23,2) |
| PAM mmHg, mediana (RIC) | 80 (75,5-85,5) |
| Terapia osmótica, n (%) | |
| Sí | 14 (40) |
| No | 21 (60) |
| Sodio inicial, mEq/l, mediana (RIC) | 139 (136,2-140) |
| Sodio final, mEq/l, mediana (RIC) | 153,5 (147,2-155) |
| pCO2, mmHg, mediana (RIC) | 38,1 (33,3-39-8) |
| Desenlace global, n (%) | |
| Vivo | 21 (60,0) |
| Fallecido | 14 (40,0) |
| Desenlace estratificado al egreso de la UCI adultos, n (%) | |
| mRS 0-3 puntos | |
| Vivo | 11 (31,4) |
| Fallecido | 1 (2,9) |
| mRS 4-6 puntos | |
| Vivo | 10 (28,5) |
| Fallecido | 13 (37,1) |
| Desenlace estratificado a 28 días, n (%) | |
| mRS 0-3 puntos | |
| Vivo | 16 (45,7) |
| Fallecido | 0 (0) |
| mRS 4-6 puntos | |
| Vivo | 5 (14,2) |
| Fallecido | 14 (40) |
APACHE: Acute Physiology And Chronic Health Evaluation II; DE: desviación estándar; EVC: evento vascular cerebral; mRS: escala de Rankin modificada; PAM: presión arterial media; RIC: rango intercuartílico; SOFA: Sequential Organ Failure Assessment; UCI: unidad de cuidados intensivos.
La mediana de la escala de coma de Glasgow al ingreso fue de 8 puntos (RIC: 7,5-8,5). Catorce pacientes requirieron terapia osmótica (40%), 19 (54,3%) pacientes fueron sometidos a procedimientos neuroquirúrgicos, y 3 (8,5%) de ellos requirieron reintervención durante su estancia en la UCI.
La mediana del puntaje SOFA fue de 9,5 (RIC: 7-12,5), y la del APACHE II de 16,5 (RIC: 11,2-23,2). El sodio sérico inicial presentó una mediana de 139mmol/l (RIC: 136,2-140), mientras que el sodio final, en los pacientes tratados con terapia osmótica, alcanzó una mediana de 153,5mmol/l (RIC: 147,2-155). La pCO2 inicial tuvo una mediana de 38,1mmHg (RIC: 33,3-39,8).
Mediante la prueba t de Student, se evidenció una asociación estadísticamente significativa entre los puntajes de Glasgow, SOFA y APACHE II con el desenlace a 28 días (vivo o fallecido, p<0,001).
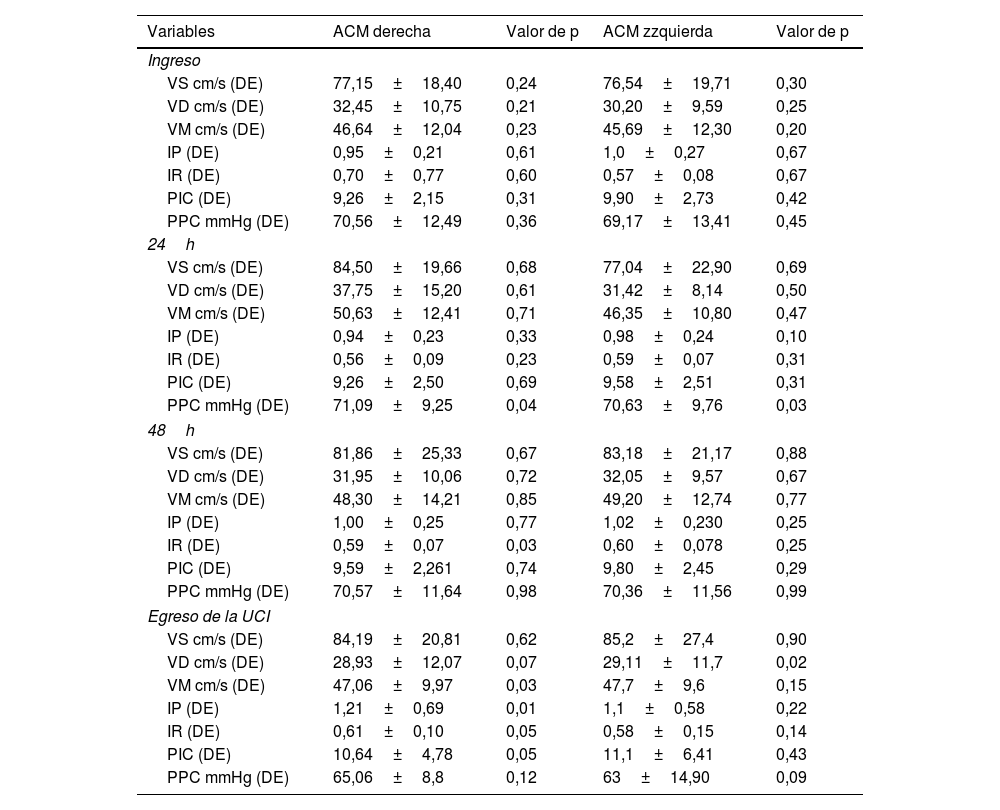
El análisis de los parámetros hemodinámicos de la ACM derecha e izquierda en los distintos momentos de evaluación (ingreso, 24h, 48h y egreso) se resume en la tabla 3.
Mediciones de las velocidades del flujo sanguíneo cerebral en diferentes momentos (ingreso, 24 y 48h, y egreso de la UCI). El valor de p se obtuvo mediante ANOVA de medidas repetidas con corrección de esfericidad
| Variables | ACM derecha | Valor de p | ACM zzquierda | Valor de p |
|---|---|---|---|---|
| Ingreso | ||||
| VS cm/s (DE) | 77,15±18,40 | 0,24 | 76,54±19,71 | 0,30 |
| VD cm/s (DE) | 32,45±10,75 | 0,21 | 30,20±9,59 | 0,25 |
| VM cm/s (DE) | 46,64±12,04 | 0,23 | 45,69±12,30 | 0,20 |
| IP (DE) | 0,95±0,21 | 0,61 | 1,0±0,27 | 0,67 |
| IR (DE) | 0,70±0,77 | 0,60 | 0,57±0,08 | 0,67 |
| PIC (DE) | 9,26±2,15 | 0,31 | 9,90±2,73 | 0,42 |
| PPC mmHg (DE) | 70,56±12,49 | 0,36 | 69,17±13,41 | 0,45 |
| 24h | ||||
| VS cm/s (DE) | 84,50±19,66 | 0,68 | 77,04±22,90 | 0,69 |
| VD cm/s (DE) | 37,75±15,20 | 0,61 | 31,42±8,14 | 0,50 |
| VM cm/s (DE) | 50,63±12,41 | 0,71 | 46,35±10,80 | 0,47 |
| IP (DE) | 0,94±0,23 | 0,33 | 0,98±0,24 | 0,10 |
| IR (DE) | 0,56±0,09 | 0,23 | 0,59±0,07 | 0,31 |
| PIC (DE) | 9,26±2,50 | 0,69 | 9,58±2,51 | 0,31 |
| PPC mmHg (DE) | 71,09±9,25 | 0,04 | 70,63±9,76 | 0,03 |
| 48h | ||||
| VS cm/s (DE) | 81,86±25,33 | 0,67 | 83,18±21,17 | 0,88 |
| VD cm/s (DE) | 31,95±10,06 | 0,72 | 32,05±9,57 | 0,67 |
| VM cm/s (DE) | 48,30±14,21 | 0,85 | 49,20±12,74 | 0,77 |
| IP (DE) | 1,00±0,25 | 0,77 | 1,02±0,230 | 0,25 |
| IR (DE) | 0,59±0,07 | 0,03 | 0,60±0,078 | 0,25 |
| PIC (DE) | 9,59±2,261 | 0,74 | 9,80±2,45 | 0,29 |
| PPC mmHg (DE) | 70,57±11,64 | 0,98 | 70,36±11,56 | 0,99 |
| Egreso de la UCI | ||||
| VS cm/s (DE) | 84,19±20,81 | 0,62 | 85,2±27,4 | 0,90 |
| VD cm/s (DE) | 28,93±12,07 | 0,07 | 29,11±11,7 | 0,02 |
| VM cm/s (DE) | 47,06±9,97 | 0,03 | 47,7±9,6 | 0,15 |
| IP (DE) | 1,21±0,69 | 0,01 | 1,1±0,58 | 0,22 |
| IR (DE) | 0,61±0,10 | 0,05 | 0,58±0,15 | 0,14 |
| PIC (DE) | 10,64±4,78 | 0,05 | 11,1±6,41 | 0,43 |
| PPC mmHg (DE) | 65,06±8,8 | 0,12 | 63±14,90 | 0,09 |
ACM: arteria cerebral media; DE: desviación estándar; IP: índice de pulsatilidad; IR: índice resistivo; PIC: presión intracraneal; PPC: presión de perfusión cerebral; VD: velocidad diastólica; VM: velocidad media; VS: velocidad sistólica; UCI: unidad de cuidados intensivos.
En la ACM derecha, a las 24h se observó una diferencia estadísticamente significativa en la PPC mediante ANOVA de medidas repetidas (p=0,04), hallazgo que también se evidenció en la ACM izquierda en el mismo tiempo (p=0,03). Al egreso, en la ACM derecha se identificaron diferencias significativas en la VD, el IP, el IR y PIC (p=0,07, 0,01, 0,05 y 0,05, respectivamente). En la ACM izquierda, al mismo tiempo, la única variable con significación fue la VD (p=0,02).
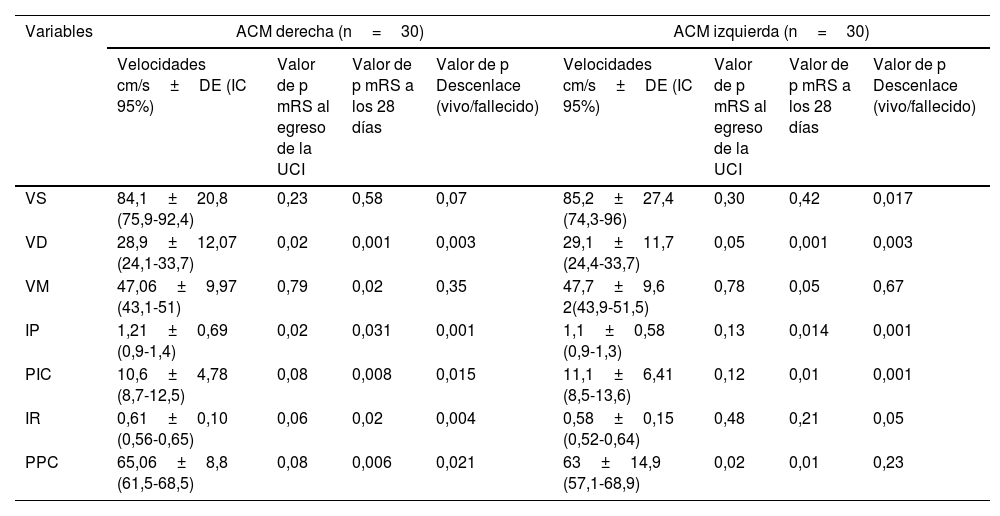
En cuanto a la relación con el pronóstico funcional, en la ACM izquierda se identificó una asociación entre la VD y la mRS tanto al egreso de la UCI (p=0,05) como a los 28 días (p=0,001). De forma similar, en la ACM derecha se encontró una correlación significativa entre la VD con el mRS tanto al egreso de la UCI como a los 28 días (p=0,02 y p=0,001, respectivamente). Asimismo, la PPC, tanto derecha como izquierda, mostró una asociación con la escala de mRS al egreso y a los 28 días (p=0,08, 0,006 para la PPC derecha; p=0,02 y 0,01 para la PPC izquierda) (tabla 4).
Correlación del flujo sanguíneo cerebral con el puntaje funcional en escala de Rankin modificado (mRS) al egreso, a los 28 días y con el descenlace hospitalario
| Variables | ACM derecha (n=30) | ACM izquierda (n=30) | ||||||
|---|---|---|---|---|---|---|---|---|
| Velocidades cm/s±DE (IC 95%) | Valor de p mRS al egreso de la UCI | Valor de p mRS a los 28 días | Valor de p Descenlace (vivo/fallecido) | Velocidades cm/s±DE (IC 95%) | Valor de p mRS al egreso de la UCI | Valor de p mRS a los 28 días | Valor de p Descenlace (vivo/fallecido) | |
| VS | 84,1±20,8 (75,9-92,4) | 0,23 | 0,58 | 0,07 | 85,2±27,4 (74,3-96) | 0,30 | 0,42 | 0,017 |
| VD | 28,9±12,07 (24,1-33,7) | 0,02 | 0,001 | 0,003 | 29,1±11,7 (24,4-33,7) | 0,05 | 0,001 | 0,003 |
| VM | 47,06±9,97 (43,1-51) | 0,79 | 0,02 | 0,35 | 47,7±9,6 2(43,9-51,5) | 0,78 | 0,05 | 0,67 |
| IP | 1,21±0,69 (0,9-1,4) | 0,02 | 0,031 | 0,001 | 1,1±0,58 (0,9-1,3) | 0,13 | 0,014 | 0,001 |
| PIC | 10,6±4,78 (8,7-12,5) | 0,08 | 0,008 | 0,015 | 11,1±6,41 (8,5-13,6) | 0,12 | 0,01 | 0,001 |
| IR | 0,61±0,10 (0,56-0,65) | 0,06 | 0,02 | 0,004 | 0,58±0,15 (0,52-0,64) | 0,48 | 0,21 | 0,05 |
| PPC | 65,06±8,8 (61,5-68,5) | 0,08 | 0,006 | 0,021 | 63±14,9 (57,1-68,9) | 0,02 | 0,01 | 0,23 |
Las comparaciones de los grupos se realizaron mediante prueba T de Student para muestras independientes.
ACM: arteria cerebral media; DE: desviación estándar; IC 95%: intervalo de confianza al 95%; IP: índice de pulsatilidad; IR: índice resistivo; PIC: presión intracraneal; PPC: presión de perfusión cerebral; UCI: unidad de cuidados intensivos; VD: velocidad diastólica; VM: velocidad media; VS: velocidad sistólica.
En relación con el desenlace clínico al egreso por mejoría de la UCI, el 28,5% de los pacientes presentó discapacidad severa por mRS, mientras que, al seguimiento a los 28 días, el 14,2% de los pacientes permanecieron vivos con discapacidad severa.
Por otro lado, se observó una relación significativa entre la duración de la sedación (4,4±4 días) y el pronóstico funcional al egreso (p=0,008). Sin embargo, al realizar un modelo de regresión logística binaria para identificar los factores asociados a un desenlace funcional desfavorable (mRS entre 4-6 a los 28 días), donde el modelo incluyó días de sedación, etiología, sexo, ventilación mecánica y terapia osmótica, ninguna variable alcanzó significación estadística (p<0,05). Los días de sedación y el sexo no se asociaron significativamente con el desenlace. La etiología vascular mostró una tendencia hacia una asociación con desenlace desfavorable (OR: 5,08; IC 95%: 0,81-31,84; p=0,083). El modelo clasificó correctamente el 65,7% de los casos, con mayor precisión para predecir desenlaces desfavorables (84,2%) que favorables (43,8%). No fue posible ajustar un modelo logístico binario para evaluar la relación entre el uso de ventilación mecánica y el desenlace funcional debido a una separación casi perfecta entre ambas variables, lo que impidió la convergencia del modelo. Este hallazgo sugiere una fuerte asociación entre la ventilación mecánica y un peor desenlace funcional en la cohorte estudiada.
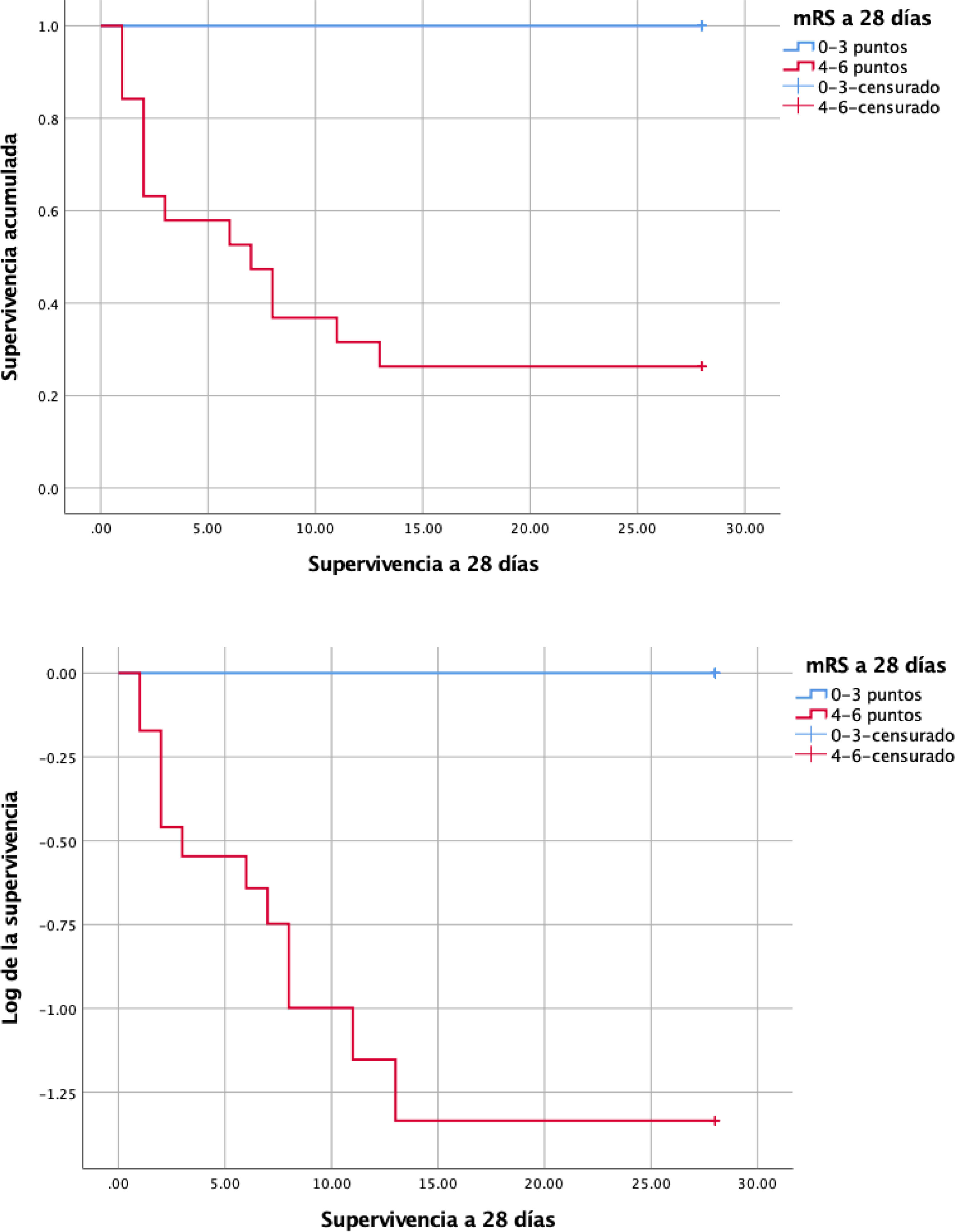
A los 28 días, la supervivencia global fue del 60% (n=21) (tabla 1). En el análisis de supervivencia, se observó una diferencia significativa según la escala de mRS. Los pacientes con mRS 4-6 (n=19) presentaron una probabilidad significativamente menor de supervivencia en comparación con aquellos con mRS 0-3 (n=16) (log-rank χ2=19,4; p<0,001). En el grupo con mRS 4-6, en el que fallecieron 14 pacientes, la mediana de supervivencia fue de 7 días (EE: 2,7), mientras que en el grupo con mRS 0-3 no se registraron muertes durante el seguimiento de 28 días (fig. 3).
Curva de supervivencia de Kaplan-Meier a 28 días estratificada según la escala de Rankin modificada (mRS); 0-3 puntos (independencia o discapacidad leve) y 4-6 puntos (dependencia severa o fallecimiento). Se observa una menor supervivencia en el grupo mRS 4-6 en comparación con el grupo 0-3 (log-rank χ2=19,4; p<0,001). La mediana de supervivencia en el grupo 4-6 fue de 7 días, mientras que en el grupo 0-3 no se observaron muertes durante el seguimiento.
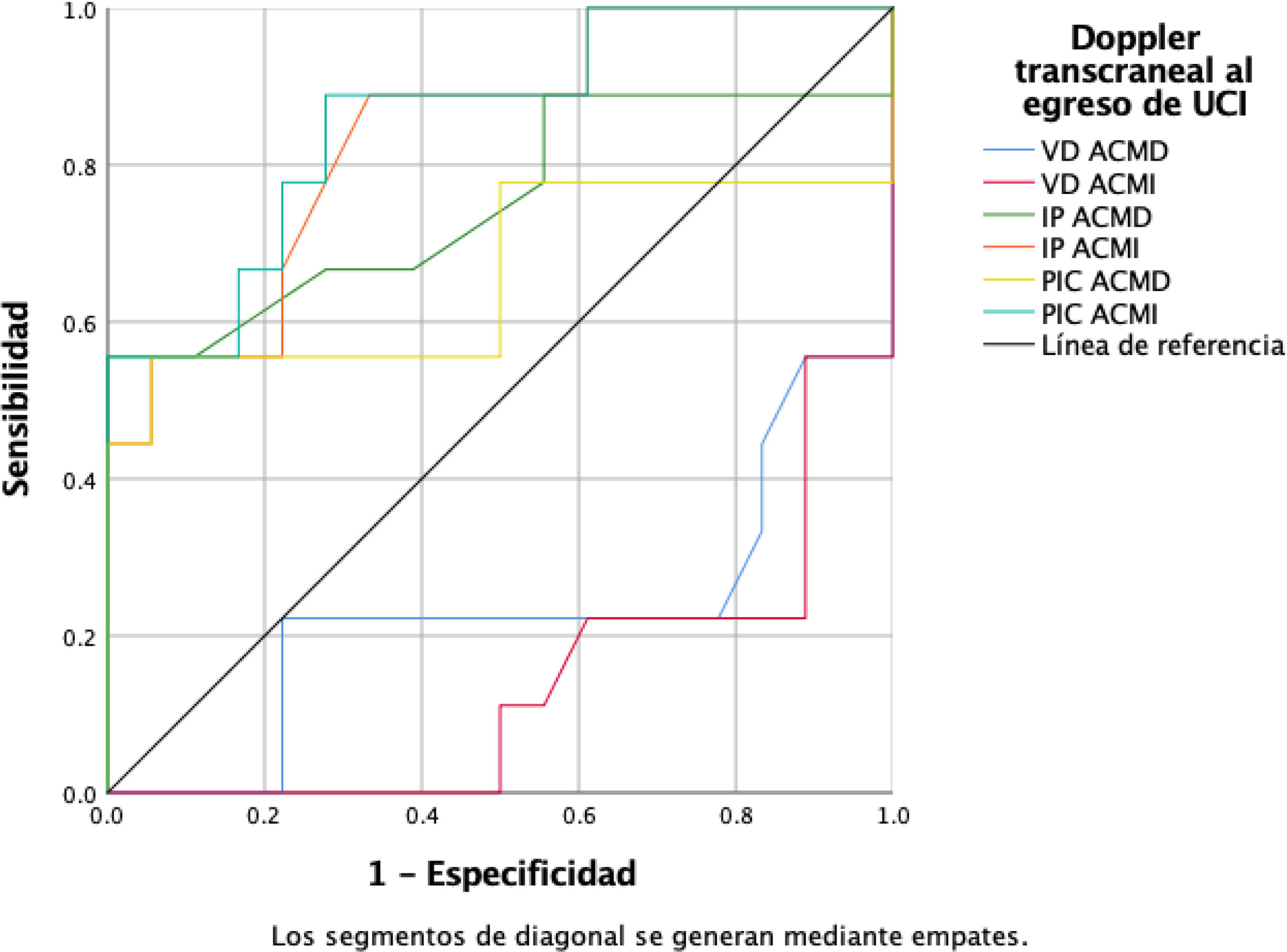
En el análisis ROC para predecir mortalidad a 28 días, la VD de la ACM al egreso mostró una baja capacidad discriminativa, con un área bajo la curva (AUC) de 0,228 para la ACM derecha y 0,139 para la izquierda. En contraste, el IP y PIC estimadas mostraron una capacidad predictiva superior, con AUC entre 0,54 y 0,66 durante la hospitalización, y un mejor desempeño al agreso, especialmente para el IP izquierdo (AUC: 0,84), la PIC izquierda (AUC: 0,858) y el IP derecho (AUC: 0,75). Estos resultados indican que un patrón de IP elevado y PIC no invasiva aumentada al egreso se asoció con mayor riesgo de mortalidad a 28 días (fig. 4).
Curvas ROC de parámetros Doppler transcraneal al egreso para predecir la mortalidad a 28 días. El índice de pulsatilidad (IP) y la presión intracraneal estimada (PIC) mostraron una adecuada capacidad discriminativa (AUC: 0,753-0,858), mientras que la velocidad diastólica (VD) media presentó bajo rendimiento (AUC: 0,139-0,228). La línea diagonal indica la referencia (AUC: 0,5). ACMD: arteria cerebral media derecha; ACMI: arteria cerebral media izquierda; AUC: área bajo la curva (Area Under the Curve); IP: índice de pulsatilidad; PIC; presión intracraneana; ROC: característica operativa del receptor (Receiver Operating Characteristic); VD: velocidad diastólica.
Se realizó prueba exacta de Fisher, y observamos que una velocidad diastólica media <20cm/s en la ACM al egreso se asoció con mayor mortalidad a 28 días, tanto en el lado derecho (p=0,01) como en el izquierdo (p=0,03). En contraste, no se encontró una asociación estadísticamente significativa entre una velocidad diastólica media <20cm/s y un desenlace funcional desfavorable mediante mRS al egreso de la UCI ni a los 28 días (ACM derecha: p=0,132; ACM izquierda: p=0,215).
Al realizar un análisis de regresión logística binaria para evaluar la asociación entre velocidad diastólica menor a 20cm/s de ambas arterias y desenlace hospitalario, considerando la variable etiologia por estratificación como factor de ajuste, el modelo presentó un R2 de Nagelkerke de 0,510 (p=0,015), mostrando un ajuste moderado, sin embargo no alcanzó significación estadística (p=0,253), lo que indica que la etiología no modificó significativamente la asociación observada entre velocidad diastólica y desenlace. En el modelo, la velocidad diastólica menor a 20cm/s nuevamente fue un predictor significativo del desenlace (p=0,002).
En conjunto, se observó que un mayor puntaje en la mRS se asoció con disminución de la velocidad diastólica y de la presión de perfusión cerebral, así como con incrementos en el índice de pulsatilidad y en la presión intracraneal. Se encontró una asociación significativa entre la puntuación de mRS al egreso de la UCI y la mortalidad (p=0,001), así como entre mRS a los 28 días y la mortalidad (p<0,001), indicando que una peor función neurológica se relaciona con mayor riesgo de muerte.
DiscusiónEn este estudio, que evaluó la utilidad del DTC como herramienta pronóstica en los pacientes neurocríticos, se encontró que los parámetros hemodinámicos cerebrales se correlacionaron con la evolución funcional evaluada mediante la escala mRS al egreso de la UCI y a los 28 días. Los hallazgos más relevantes se observaron al egreso de la UCI, donde VD y VM reducidas, junto con PPC bajas y valores elevados de IP y PIC estimada de forma no invasiva, se asociaron significativamente con un desenlace funcional desfavorable.
Estos resultados son consistentes con reportes previos, como los de Beishon et al. y Nida Fatima et al., quienes describieron que las alteraciones hemodinámicas cerebrales, incluyendo aumento del índice de pulsatilidad y disminución de la velocidad diastólica menor a 20cm/s se asocian con un mayor riesgo de desenlace desfavorable, se relacionan con peor evolución funcional y mayor riesgo de daño isquémico secundario15–17. Además, la disminución de la PPC observada en nuestro estudio se asocia con mayor discapacidad, reforzando su valor como marcador pronóstico temprano y su potencial utilidad para la estratificación de riesgo y toma de decisiones terapéuticas en los pacientes neurocríticos.
Este enfoque subraya la importancia de monitorizar de manera seriada los parámetros hemodinámicos cerebrales, dado que las mediciones tardías parecen reflejar con mayor precisión la evolución clínica y funcional, permitiendo identificar a los pacientes con mayor riesgo de desenlace adverso y ajustar estrategias de manejo neuroprotector.
La mayor proporción de ingresos correspondió a los pacientes con tumoraciones (20%) y eventos cerebrovasculares isquémicos (20%) o hemorrágicos (22,9%), reflejando la alta carga de enfermedades neurológicas estructurales y vasculares que requieren monitorización intensiva. Esta distribución es consistente con reportes previos en unidades neurocríticas y subraya la importancia de un seguimiento hemodinámico y funcional riguroso, así como la potencial utilidad de herramientas como el DTC para la predicción de desenlaces según la etiología.
No se observó una relación significativa entre la duración de la sedación y el pronóstico funcional al egreso. Sin embargo, la sedación puede considerarse una variable de exposición y al mismo tiempo, un marcador indirecto de gravedad neurológica, por lo que su efecto podría estar mediado por la severidad del cuadro clínico, mas que por la duración de la sedación en si.
En nuestro estudio, se observó también que los puntajes de Glasgow, SOFA y APACHE II al ingreso se asociaron de manera significativa con el desenlace a 28 días (p<0,001), lo que sugiere que un mayor grado de gravedad inicial se correlaciona con un riesgo más alto de mortalidad. Este hallazgo es consistente con estudios previos que muestran que las escalas de gravedad clínica y neurológica son predictores robustos de desenlace en pacientes críticos, reforzando la importancia de su evaluación temprana para la estratificación de riesgo y la planificación de intervenciones19.
Las mediciones hemodinámicas a través del DTC al egreso evidenciaron una mejora significativa en el rendimiento predictivo, especialmente del IP izquierdo (AUC: 0,84) y de la PIC no invasiva izquierda (AUC: 0,858), seguidas del IP derecho (AUC: 0,75) y PIC no invasiva derecha (0,66). Estos hallazgos sugieren que las alteraciones hemodinámicas cerebrales persistentes al egreso —caracterizadas por un incremento del IP y una elevación de la PIC estimada— podrían reflejar un estado de hipoperfusión y mayor resistencia cerebrovascular, asociados con un peor pronóstico vital. En contraste, los valores registrados al ingreso podrían estar más influenciados por factores agudos o reversibles del traumatismo inicial, lo que explicaría su menor capacidad discriminativa.
En este estudio, una velocidad diastólica <20cm/s en la ACM se asoció significativamente con un descenlace funcional desfavorable tanto al egreso de la UCI como a los 28 días, así como una mayor mortalidad a 28 días. Este hallazgo sugiere que dicho umbral podría reflejar un estado de hipoperfusión cerebral crítica, asociado con disminución de la reserva hemodinámica y peor pronóstico vital en los pacientes neurocrítico. Estos hallazgos son conherentes con reportes previos que describen que velocidades diastólicas reducidas se relacionan con alteración de la autorregulación cerebral y evolución neurológica desfavorable, reforzando el potencial del DTC como herramienta pronóstica complementaria en la monitorización de estos pacientes.
La mortalidad global fue del 40% con una mediana de supervivencia en el grupo mRS 4-6 de 7 días. Estos hallazgos coinciden con reportes previos en poblaciones similares, donde la mediana de supervivencia en los pacientes con alta gravedad neurológica y ventilación mecánica oscila entre 4 y 7 días, lo que refuerza la validez de nuestros datos y resalta la importancia de estrategias de monitorización y manejo intensivo temprano para mejorar los desenlaces funcionales y la supervivencia14,16,17.
Asimismo, nuestros resultados muestran una asociación significativa entre la funcionalidad neurológica y la mortalidad. Los pacientes con peor puntuación en la mRS al egreso de la UCI presentaron un mayor riesgo de muerte durante la estancia hospitalaria (p=0,001), relación que se mantuvo a los 28 días de seguimiento (p<0,001). Se observó una relación inversa entre la puntuación funcional y la supervicencia: los pacientes con mejor estado funcional (mRS: 0-3) mostraron una supervivencia del 100%, mientras que aquellos con discapacidad grave (mRS: 4-5) tuvieron menor probabilidad de supervivencia, y todos los pacientes con mRS 6 fallecieron antes de los 28 días.
Estos hallazgos reflejan una diferencia marcada en la supervivencia según el grado de discapacidad funcional, subrayando la importancia de implementa estrategias que favorezcan la recuperación neurológica temprana durante la estancia crítica y el seguimiento post-UCI. Nuestros resultados son consistentes con reportes previos que describen que la discapacidad neurológica grave se asocia con mayor mortalidad y menor probabilidad de recuperación funcional a corto y mediano plazo, reforzando el valor pronóstico de la evaluación funcional al egreso de la UCI16,17.
Entre las fortalezas de este estudio se encuentran su diseño prospectivo y la monitorización seriada mediante DTC, realizada por un médico especialista debidamente capacitado, lo que permitió evaluar de manera sistemática la evolución hemodinámica cerebral a lo largo de la estancia en la UCI y correlacionarla con desenlaces funcionales a 28 días. Además, la inclusión de pacientes con diferentes etiologías neurocríticas proporciona una visión amplia de la utilidad del DTC en distintos escenarios clínicos. Así mismo, se realizó un modelo de regresión logistica binaria ajustado por sexo, etiología, sedación y ventilación mecánica sin encontrarse asociaciones significativas con desenlaces funcionales desfavorables. Esto sugiere que dichas variables no actuaron como factores de confusión relevantes en la cohorte analizada. No obstante, el estudio presenta algunas limitaciones que deben considerarse al interpretar los resultados, como el tamaño reducido de la muestra y la unicentricidad del estudio, lo que puede limitar la generalización de los hallazgos. Asimismo, la exclusión de pacientes sin ventana transtemporal podría introducir sesgo de selección, y el seguimiento limitado a 28 días impide evaluar desenlaces a mas largo plazo.
A pesar de estas limitaciones, los hallazgos refuerzan la utilidad del DTC como herramienta de neuromonitorización en los pacientes neurocríticos, evidenciando su capacidad para identificar alteraciones hemodinámicas asociadas con mayor riesgo de discapacidad y mortalidad.
ConclusionesEl DTC es una herramienta útil y no invasiva para la monitorización hemodinámica cerebral en los pacientes neurocríticos, con un alto valor pronóstico respecto a la evolución funcional y la mortalidad. Se encontró que parámetros como la velocidad diastólica y presión de perfusión cerebral baja, el aumento del índice de pulsatilidad y de la presión intracraneal estimada, se asocian significativamente con desenlaces funcionales desfavorables y mayor mortalidad, especialmente cuando se miden al egreso de la UCI; mostrando una mayor relevancia pronóstica mediante la mRS, reflejando la gravedad clínica y el riesgo de desenlaces adversos.
Así mismo, los puntajes de Glasgow, SOFA y APACHE II al ingreso se asociaron significativamente con el desenlace a 28 días, indicando que un mayor grado de severidad inicial se relaciona con mayor mortalidad. De igual forma, la discapacidad funcional temprana, evaluada mediante la mRS al egreso de la UCI, se asoció con mayor riesgo de mortalidad durante la estancia como a los 28 días. La elevada mortalidad observada en este periodo refleja la complejidad clínica de la cohorte y la necesidad de mantener una vigilancia neurológica continua, tanto invasiva como no invasiva.
A pesar de limitaciones como el tamaño muestral y el seguimiento a corto plazo, los resultados refuerzan el potencial del DTC como herramienta complementaria en la estratificación de riesgo, toma de decisiones clínicas y seguimiento de pacientes neurocríticos en cuidados intensivos. Además, subrayan la necesidad de protocolos estandarizados de vigilancia neurológica en la UCI y hospitalización para optimizar los resultados clínicos.
Declaración de contribución de los autoresTodos los autores contribuyeron de forma equitativa para producir este artículo según la taxonomía CRediT.
FinanciaciónLos autores declaran que no recibieron apoyo financiero específico de agencias del sector público, privado o sin ánimo de lucro para la realización de esta investigación.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.