La disfunción diafragmática es un marcador de gravedad en pacientes bajo ventilación mecánica y se asocia con alta mortalidad. La fracción de engrosamiento diafragmático, una medición ultrasonográfica, se ha empleado como predictor en la retirada de la ventilación mecánica, aunque no se ha determinado su impacto en los resultados adversos, como la traqueostomía y la mortalidad.
ObjetivoEvaluar la asociación de la disminución de la fracción de engrosamiento diafragmático con resultados adversos en pacientes bajo ventilación mecánica invasiva.
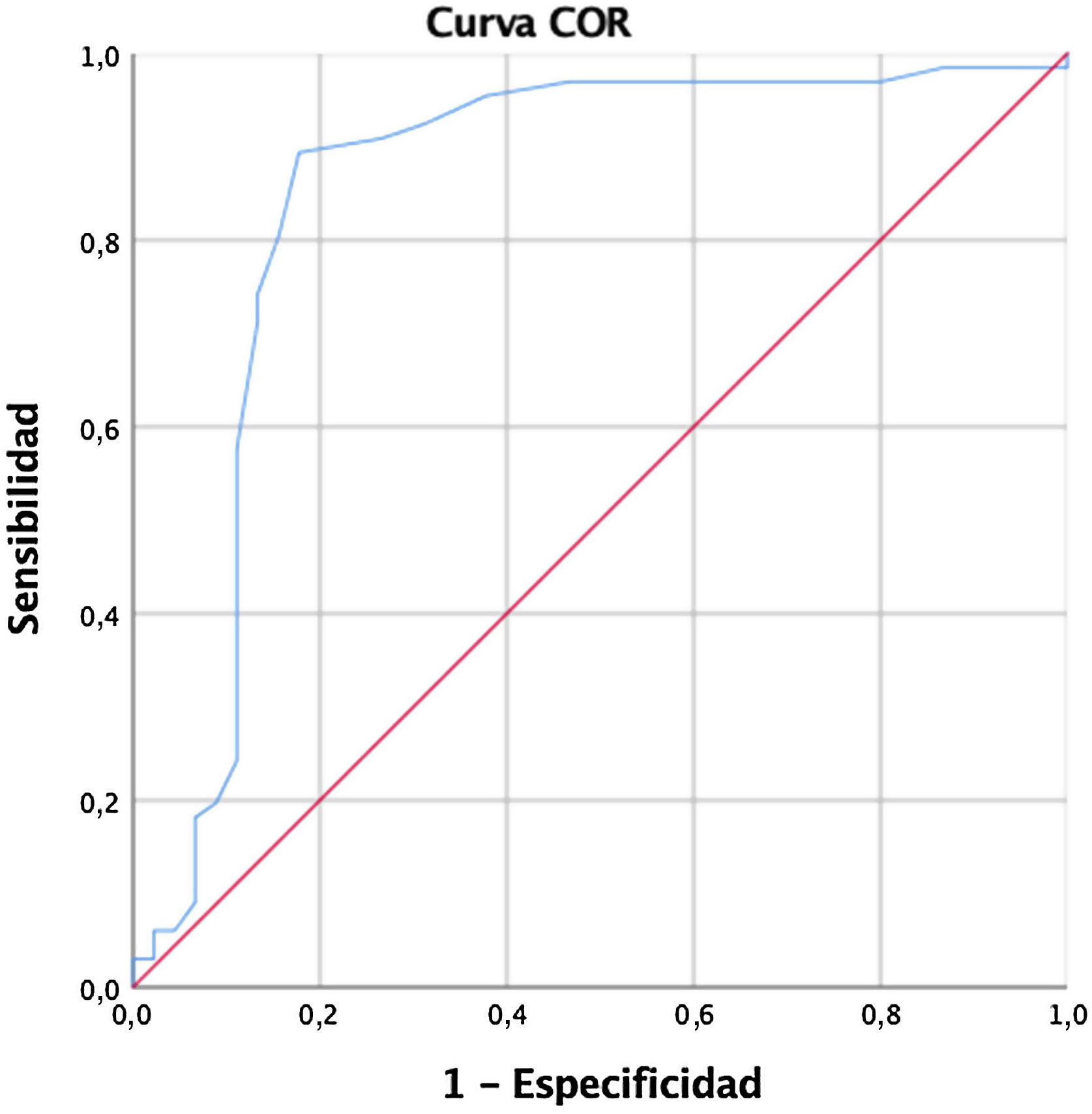
Material y métodosEstudio de cohortes prospectivo. Se midió la fracción de engrosamiento diafragmático al tercer día de inclusión y los sujetos del estudio se siguieron hasta 14 días. Se calculó una curva ROC en busca de un punto de corte óptimo para la sensibilidad y la especificidad. Se calculó el riesgo relativo para los resultados adversos con un intervalo de confianza del 95%.
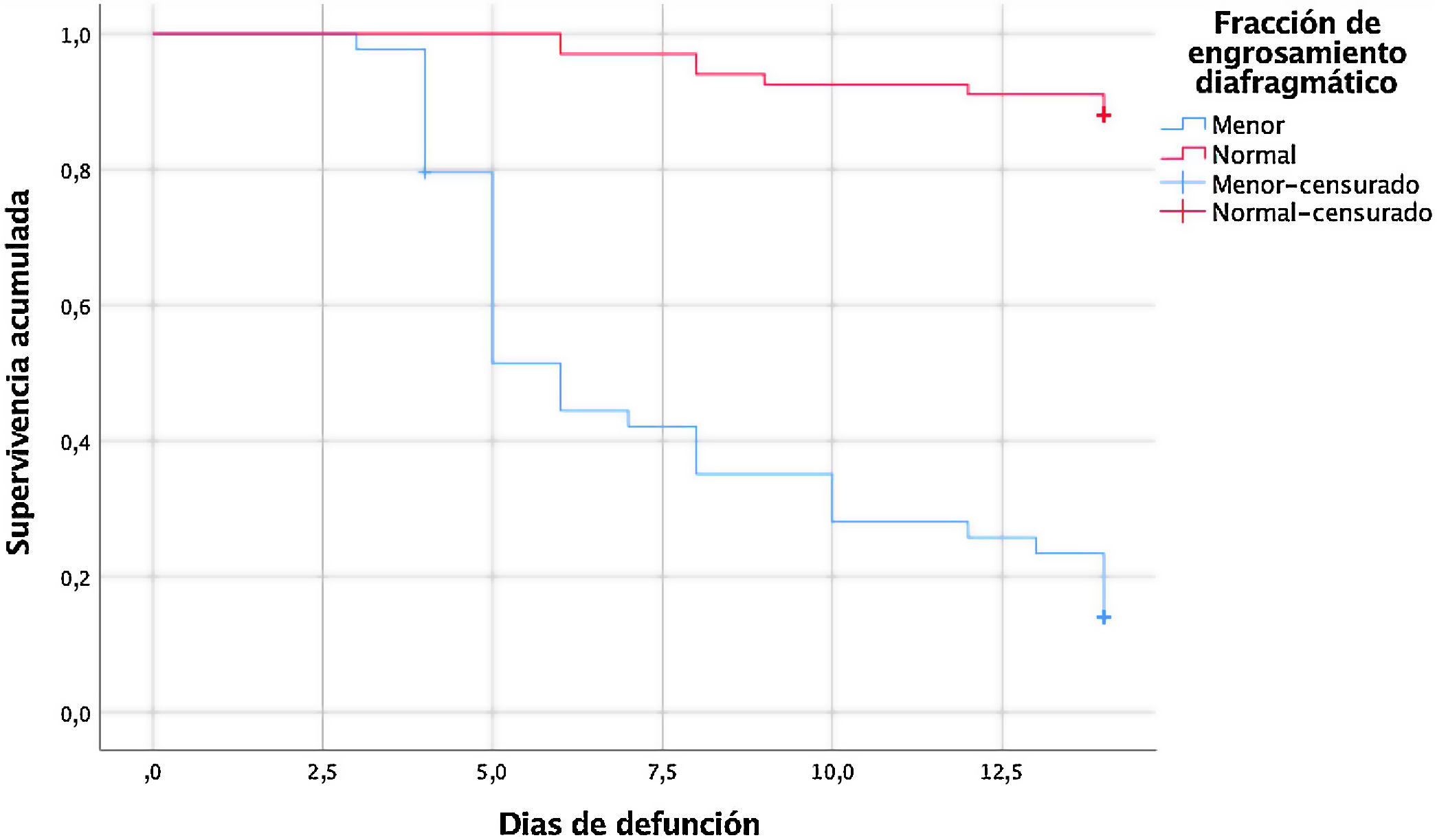
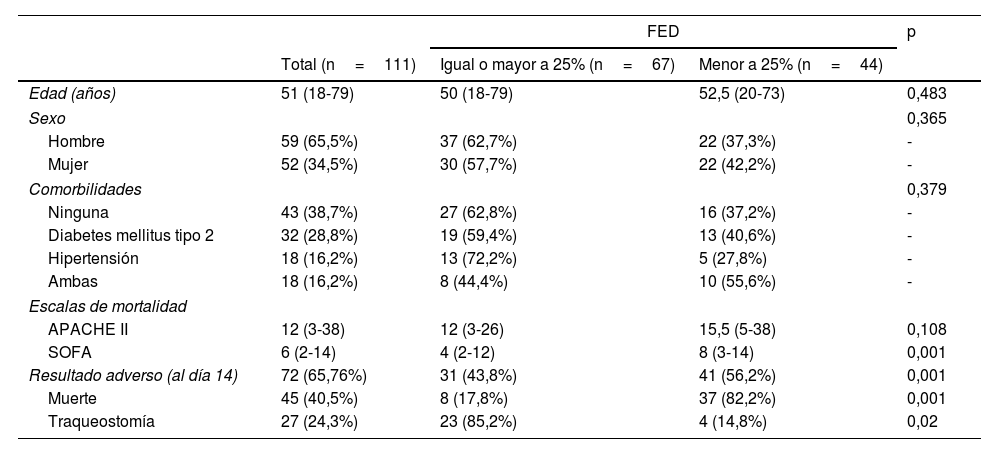
ResultadosSe analizaron 111 pacientes. Sesenta y siete (74,37%) tenían una fracción de engrosamiento diafragmático normal y 44 pacientes (25,63%) tenían una fracción de engrosamiento diafragmático baja. En el grupo de fracción de engrosamiento diafragmático baja se documentaron 37 muertes en el día 14 (82,2%) y hubo 4 casos con traqueostomía (14,8%). La incidencia de efectos adversos fue del 56,2% (riesgo relativo: 1,79; IC 95%: 1,3 a 2,45; p>0,001).
ConclusiónLa fracción de engrosamiento diafragmático es un parámetro novedoso para la monitorización y vigilancia clínica en pacientes con ventilación mecánica, así como un predictor prometedor de traqueostomía y mortalidad.
Diaphragmatic dysfunction is a severity marker for patients under mechanical ventilation and is associated with higher mortality rates. The diaphragmatic thickening fraction, an ultrasound measurement, has been employed as a mechanical ventilation weaning predictor; its impact on adverse outcomes, such as tracheostomy and mortality rates, are still undetermined.
ObjectiveTo evaluate the association of diaphragmatic thickening fraction decrease with adverse outcomes in patients under invasive mechanical ventilation.
Material and methodsProspective cohort study. The diaphragmatic thickening fraction was measured by ultrasound on the third day of enrollment, with a follow-up observation on day 14. A ROC curve was computed in search of an optimal cut-off point for sensitivity and specificity. Relative risk was calculated for adverse outcomes with 95% confidence interval.
ResultsOne hundred and eleven patients were analyzed. Sixty-seven patients (74.37%) had a normal diaphragmatic thickening fraction, and forty-four patients (25.63%) had a low diaphragmatic thickening fraction. In the low diaphragmatic thickening fraction group, 37 deaths were documented at day 14 (82.2%), and four cases sustained tracheostomy (14.8%); the incidence of adverse effects was 56.2% (relative risk, 1.79; 95% CI, 1.3–2.45; p>0.001).
ConclusionThe diaphragmatic thickening fraction is a novel parameter for clinical monitorization and surveillance for patients under mechanical ventilation, as well as a promising tracheostomy and mortality predictor.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí