Las bronquiectasias son dilataciones anormales e irreversibles de la pared de los bronquios con alteraciones del epitelio ciliar. Son el resultado de distintas enfermedades, entre ellas las discinesias ciliares primarias (DCP), trastornos genéticos asociados con la alteración de la estructura y función ciliar que provocan un déficit en la aclaración mucociliar. Se manifiestan por infecciones recurrentes de las vías aéreas desde la infancia e infertilidad. El 50% de las DCP corresponden al síndrome de Kartagener, caracterizado por sinusitis, situs inversus y bronquiectasias.
Se recomienda evaluar la etiología, las manifestaciones clínicas, la colonización y la infección bronquial, la función respiratoria y el daño estructural para determinar el pronóstico y el tratamiento más adecuado y mejorar la calidad de vida de estos pacientes.
Bronchiectasis is an abnormal and irreversible dilation of the bronchial wall. It is the result of different diseases, some of which include primary ciliary dyskinesia, a genetic disorder associated with abnormal ciliary structure and function resulting in changes in mucociliary transport. Common clinical signs and symptoms include recurrent upper and lower respiratory tract infections since childhood, and infertility. About 50% of cases are a Kartagener¿s syndrome, associated to situs inversus, chronic sinusitis and bronchiectasis.
It is recommended to evaluate the aetiology, clinical manifestations, bronchial colonization and infection, respiratory function and structural damage, in order to determine the prognosis and the best treatment to improve the quality of life of these patients.
Las bronquiectasias son dilataciones anormales, progresivas e irreversibles de los bronquios, con alteración del epitelio ciliar e inflamación crónica de la pared, resultado de diferentes enfermedades con puntos de manejo comunes. Se caracterizan por la susceptibilidad a infectarse y desarrollar una respuesta inflamatoria que favorece la progresión del daño pulmonar.
Dentro del espectro de etiologías están las alteraciones del sistema mucociliar, responsables del 5-10%, entre las que se incluyen las discinesias ciliares primarias (DCP).
El síndrome de Kartagener, enfermedad rara, de carácter genético, es una DCP con una serie de características clínicas como el caso que se expone.
Caso clínicoPaciente de 17 años diagnosticada desde la infancia de talasemia minor y dextrocardia, que acude al servicio de urgencias por tos y expectoración hemoptoica de sangre roja sin coágulos de 2 días de evolución y fiebre de 38°C. No ha presentado disnea ni dolor torácico pero sí expectoración verdosa. Refiere tos y expectoración blanquecina, sobre todo en los meses de invierno.
A la exploración física está consciente, orientada, normohidratada, normocoloreada, eupneica, con presión arterial 120/70 mmHg, saturación de O2 98%, frecuencia cardiaca de 70 ppm y temperatura de 37,5°C. En la auscultación pulmonar destacan crepitantes en hemitórax izquierdo, algunos roncus y sibilantes dispersos en ambos hemitórax; en la cardiaca, tonos desplazados a hemitórax derecho, rítmico a 70 lat./min sin soplos. La inspección de orofaringe y del abdomen no revela alteraciones. La palpación de senos paranasales no es dolorosa.
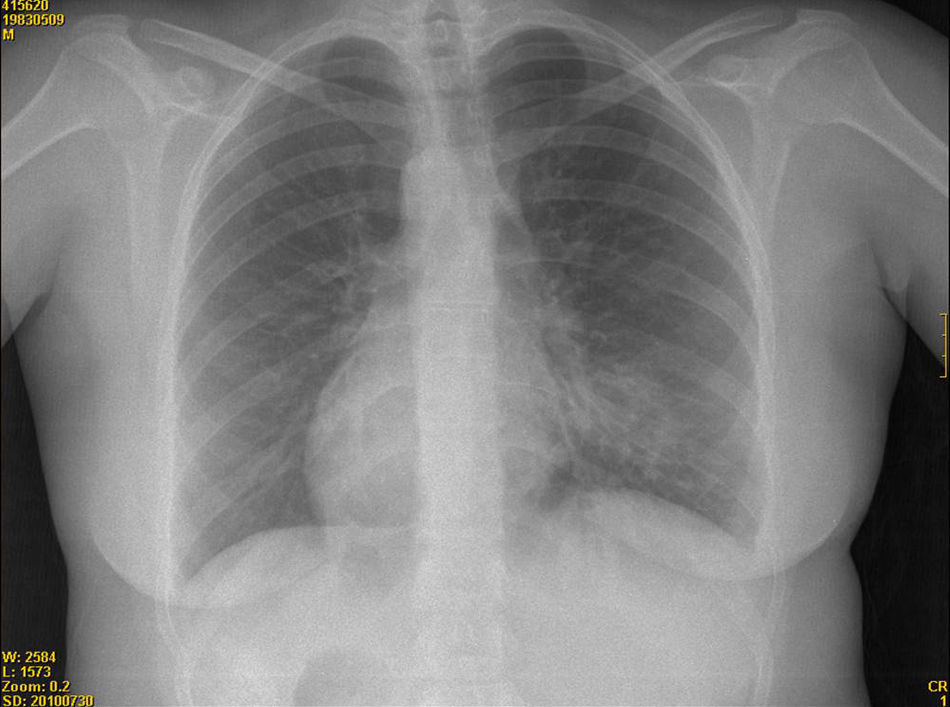
La radiografía de tórax muestra dextrocardia e imágenes compatibles con bronquiectasias en la base del hemitórax izquierdo (fig. 1). En la analítica solo destaca hematocrito 32%; hemoglobina 10; la bioquímica, coagulación y resto de hemograma dentro de la normalidad. El ECG detecta ritmo sinusal a 70 lat./min con desviación del eje eléctrico a la derecha.
Se ingresa a la paciente en el servicio de neumología para el control de las bronquiectasias sobreinfectadas y completar el estudio con más pruebas complementarias: el cultivo de esputo muestra flora habitual; radiografía de senos paranasales: seno frontal izquierdo hipoplásico, asimetría de senos maxilares con escasa aireación y engrosamiento de mucosa indicativo de sinusitis crónica; antígenos de Legionella y neumococo negativos; ecocardiograma: dextrocardia con situs inversus, resto de estructuras y flujos normales, sin hipertensión pulmonar ni alteraciones del pericardio; pruebas funcionales respiratorias: FVC 81%, FEV1 2,33 (73%), FEV1/FVC 79% (patrón normal); TC toracoabdominal: dextrocardia con situs inversus, bronquiectasias de pared engrosada y naturaleza quística en lóbulo medio e inferior del lado izquierdo (pulmón derecho) con tapones mucosos en algunas de ellas, derrame pleural izquierdo.
La sintomatología mejora con levofloxacino intravenoso, paracetamol y acetilcisteína, pudiendo ser dada de alta en 5 días. Con el diagnóstico de síndrome de Kartagener es citada en consultas externas de neumología previo cultivo de esputo y tras la realización de gammagrafía de aclaramiento mucociliar en medicina nuclear.
DiscusiónLas DCP son trastornos genéticos de carácter autosómico recesivo1 que afectan a ambos sexos sin preferencia de raza, aunque se han descrito casos de herencia ligada al cromosoma X. Se caracterizan por alteraciones estructurales y funcionales en los microtúbulos de los cilios produciéndose un mal barrido o aclaración mucociliar del epitelio respiratorio y de otras localizaciones.
El síndrome de Kartagener corresponde al 50% de las DCP, con una prevalencia de 1/20.000-40.0001. Fue descrito en 1904 por Siewert y en 1933 Kartagener la asocia a un cuadro clínico caracterizado por situs inversus total o parcial, bronquiectasias y sinusitis.
El situs inversus es la transposición de los órganos torácicos y/o abdominales, situándose en el lado opuesto ya en la etapa embrionaria. Puede ser total o parcial, y a veces solo hay dextrocardia.
Las rinosinusitis son frecuentes desde la infancia1, acentuándose en alguna época del año. Suele asociar agenesia de algún seno paranasal, el más frecuente del seno frontal. La obstrucción nasal crónica origina una serie de consecuencias en los niños: respiración bucal crónica, desviación del tabique, alteraciones de los cornetes nasales, paladar ojival y alteración de la posición dentaria.
Puede asociar otitis media secretora crónica, requiriendo drenajes transtimpánicos durante la infancia y provocar hipoacusia de transmisión en la edad adulta1.
Las bronquiectasias son consecuencia de infecciones bronquiales de repetición por mal aclaramiento mucociliar, que es el mecanismo de defensa del sistema respiratorio. Suelen aparecer en la segunda década de la vida. Durante la infancia aparece tos productiva crónica diaria que se incrementa durante el día y con el crecimiento, provocando el deterioro de la función pulmonar en la etapa adulta. Los gérmenes responsables de las infecciones son Staphylococcus aureus, Streptococcus neumoniae y Haemophilus influenzae. En casos de enfermedad avanzada puede intervenir Pseudomonas aeruginosa2,3.
Aproximadamente el 80% de los varones tienen espermatozoides vivos pero inmóviles, por lo que son infértiles. Además la ausencia de actividad ciliar en los conductos eferentes testiculares dificulta la salida de los mismos. En las mujeres la fertilidad está disminuida en un 50% y el riesgo de embarazo ectópico aumentado debido a la deficiente actividad de los cilios en las trompas de Falopio, que interfieren con el normal transporte del óvulo hacia el útero1.
El diagnóstico del síndrome de Kartagener se basa en la suma de las características clínicas descritas y en un protocolo extenso de pruebas complementarias.
Se consideran criterios de sospecha de bronquiectasias la tos y expectoración persistentes; infecciones respiratorias recurrentes y/o hemoptisis recidivantes en ausencia de hábito tabáquico.
Desde atención primaria se solicitará inicialmente una radiografía de tórax que mostrará las bronquiectasias, posibles complicaciones y la dextrocardia. Tiene escasa sensibilidad (88%), aporta poca información sobre la extensión2,4 y la normalidad no excluye su presencia.
Ante los hallazgos radiológicos indicativos junto a los criterios de sospecha deberemos derivar al paciente a neumología para completar el estudio, valorar la gravedad y realizar seguimiento. Las pruebas complementarias irán siempre orientadas según historia clínica, sospecha de causas secundarias y hallazgos en la TC. Según normativa de la Sociedad Española de Aparato Respiratorio (SEPAR)2 se recomienda el seguimiento en unidades especializadas compuestas por neumólogo, enfermera y rehabilitación respiratoria para una correcta educación sanitaria que ayudará al automanejo inicial y cumplimiento del tratamiento.
La prueba de elección para el diagnóstico definitivo es la TC1,2,5 (sensibilidad y especificidad mayor del 90%). Valora la extensión y morfología de las bronquiectasias, puede definir si hay situs inversus total o parcial y observar el daño estructural pulmonar.
En la radiografía de senos paranasales observaremos agenesia de senos, ausencia de neumatización y engrosamiento de la mucosa e incluso claros signos de sinusitis agudizada.
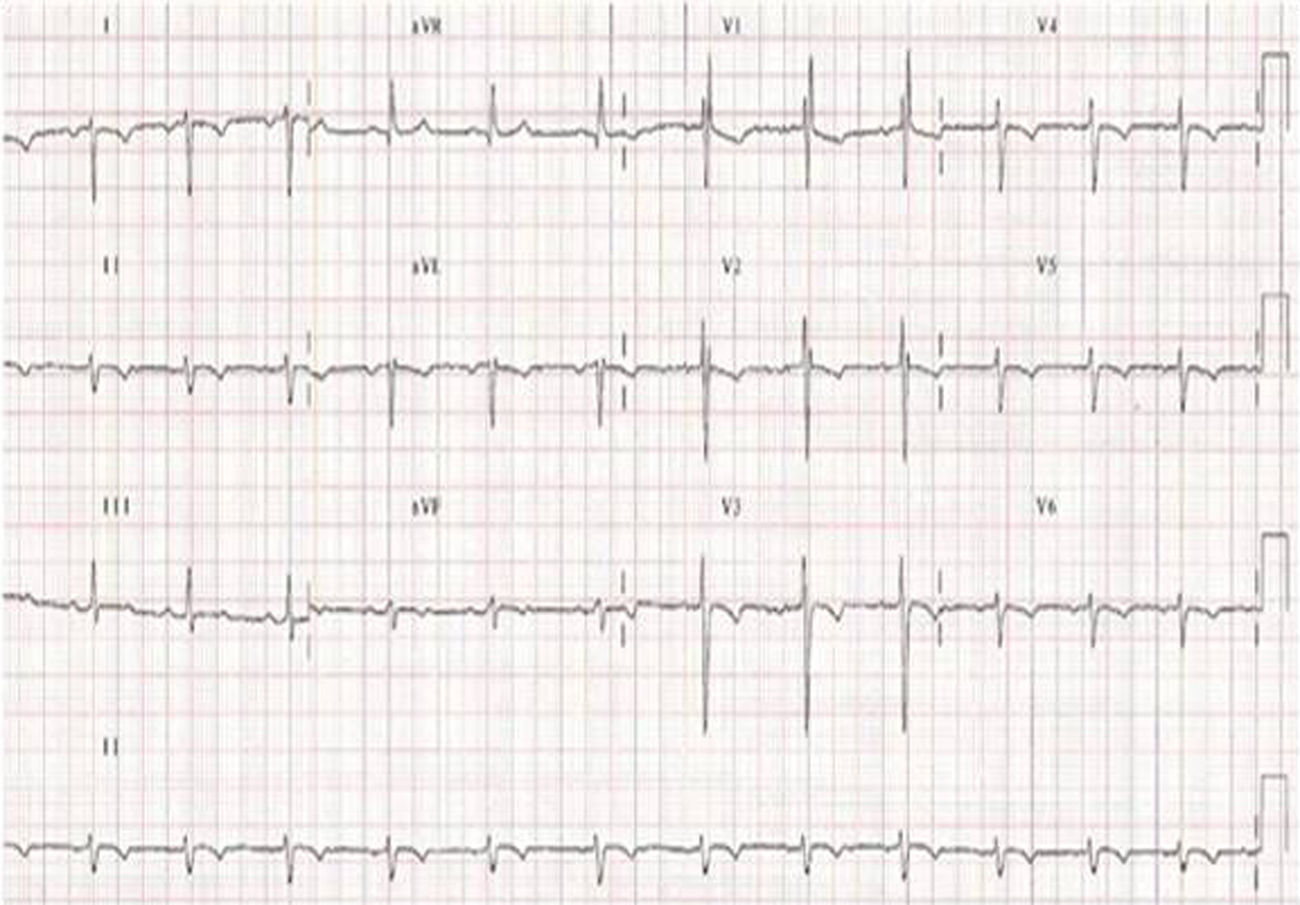
El ECG es importante para descartar las anomalías de conducción asociadas. Observaremos imagen especular: ritmo auricular ectópico (P negativa en I y positiva en avF) y un eje eléctrico desviado a la derecha (a 180°): QRS y T negativas en I, II, avL y avF3(fig. 2).
Imagen especular: ritmo auricular ectópico (P negativa en I y positiva en avF) y un eje eléctrico desviado a la derecha (a 180°): QRS y T negativas en I, II, avL y avF4.
Para el diagnóstico de la afectación de la función pulmonar se realizará espirometría, prueba broncodilatadora y saturación de oxihemoglobina2. En la espirometría podemos encontrar un patrón obstructivo desde leve a grave ya en la tercera década de la vida. A diferencia de la EPOC, los volúmenes pulmonares tienden a estar disminuidos6. La gasometría arterial y la prueba de esfuerzo deben valorarse dependiendo del grado de afectación.
El cultivo de esputo se utiliza para el diagnóstico de colonización e infección bronquial en fase estable y en las agudizaciones1,2.
Existen una serie de pruebas de cribado de DCP1,7: la determinación del óxido nítrico nasal exhalado (sensibilidad del 95% y especificidad del 90%) y la medida del aclaración mucociliar nasal mediante la prueba de la sacarina (poco específica) o por trazadores radioisótopos, más rentables y objetivos y que puede realizarse a cualquier edad (alta especificidad pero poca sensibilidad).
Para la confirmación de las DCP se pueden utilizar1,7: el estudio de la frecuencia y del patrón-forma de la batida ciliar mediante vídeo de alta resolución digital y alta velocidad y la microscopia electrónica de biopsia de mucosa nasal o bronquial para el estudio de la ultraestructura ciliar, apreciándose déficit parciales o ausencia total de dineína, proteína responsable de la estructura de los cilios. En un 10-20% de las DCP la microscopia electrónica es normal.
Se debe realizar monitorización periódica (cada 1-6 meses en dependencia de la morbilidad, gravedad y progresión) por su médico de familia o pediatra (en caso de niños) y especialistas correspondientes1,2 durante la fase estable. En cada visita de atención primaria se recogerán datos sobre color y volumen del esputo en fase estable; número y gravedad de agudizaciones; grado de disnea; síntomas y signos de hiperreactividad bronquial; frecuencia e intensidad de las hemoptisis; afectación sistémica (astenia, pérdida de peso, febrícula persistente); exploración cardiorrespiratoria.
El seguimiento por neumología incluye además estudio anual de la función pulmonar con espirometría y prueba broncodilatadora; analítica con marcadores de inflamación sistémicos y otros valores según etiología; parámetros nutricionales (índice de masa corporal, albúmina). En cada visita se registrará la saturación de oxígeno y el cultivo de esputo con antibiograma. La gasometría arterial y la prueba de esfuerzo se limita a situaciones avanzadas. La TC se repetirá cada 2 años en pacientes con alto riesgo de progresión y si aparecen nuevas lesiones en la radiografía de tórax.
El objetivo del tratamiento es mejorar la sintomatología y prevenir la progresión2.
Es fundamental una nutrición adecuada, sobre todo en estadios avanzados de daño pulmonar2,3.
Se potenciará la realización de ejercicio físico aeróbico moderado-intenso 3-4 veces por semana al menos 30 min para mejorar la tolerancia al esfuerzo y la calidad de vida2,3.
Con la fisioterapia respiratoria se aprenderán técnicas de aclaración mucociliar de vía aérea para los casos con hiperreactividad bronquial1,2,6.
Los broncodilatadores y corticoides inhalados, sobre todo antes de la fisioterapia, se ha demostrado que mejoran la movilidad ciliar y la aclaración de secreciones1,2. Los mucolíticos también facilitan la eliminación2,3 pero no hay una evidencia alta sobre su efectividad1.
No se ha demostrado la utilidad de los antibióticos en la fase estable, solo cuando existan cambios en las características del esputo o aparezca fiebre o disnea, excepto colonización crónica por Pseudomonas1–3,6.
Se recomienda la vacunación antigripal y antineumocócica por ser un grupo de alto riesgo1,2,6.
Las agudizaciones se tratarán con antibióticos preferiblemente según el resultado del esputo y el antibiograma2. En caso de Pseudomonas utilizaremos ciprofloxacino y como alternativa levofloxacino o ceftazidima más tobramicina; con amoxicilina-clavulánico se cubre la infección por Haemophilus y Neumococcus y para S. aureus la cloxacilina. Administraremos aerosolterapia y corticoides intravenosos para el broncoespasmo y mucolíticos para eliminar las secreciones5. Si presentan episodios de hemoptisis dentro de la agudización3, se suspenderán los fármacos inhalados y la fisioterapia las primeras 24-48h hasta la estabilización2.
Son criterios de ingreso hospitalario2: agudización moderada-severa, con fiebre, deterioro del estado cognitivo e inestabilidad hemodinámica, falta de respuesta al tratamiento ambulatorio, mal apoyo social, necesidad de tratamiento intravenoso, hemoptisis moderada-severa, insuficiencia respiratoria aguda que requiere oxigenoterapia o incluso ventilación mecánica no invasiva por hipercapnia asociada y cualquier otra complicación.
La cirugía se reserva para casos excepcionales, cuando son bronquiectasias muy focales con episodios de infección muy frecuente y no se controlan con tratamiento médico o hemoptisis masiva que entraña riesgo vital y no se controla con embolización2,3,5.
El trasplante pulmonar está indicado en pacientes jóvenes con insuficiencia respiratoria establecida, empeoramiento funcional progresivo y supervivencia escasa a corto plazo5,6.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.