Evaluar el rendimiento diagnóstico de un nuevo software de aprendizaje profundo para corrección de atenuación (SAPCA) en imágenes de perfusión miocárdica (IPM) utilizando una cámara cardiodedicada de cadmio-cinc-telurio (CZT) con correlación con angiografía coronaria (AC) para el diagnóstico de enfermedad arterial coronaria (EAC) en una población de alto riesgo.
MétodosEstudio retrospectivo de 300 pacientes (196 varones [65%], edad media de 68 años) desde septiembre de 2014 hasta octubre de 2019. Posteriormente realizaron una IPM, seguida de AC dentro de los 6 meses posteriores a la IPM. La probabilidad media pretest para EAC según los criterios de la Sociedad Europea de Cardiología fue del 37%. La IPM se realizó en una cámara CZT cardio dedicada (D-SPECT® Spectrum Dynamics) usando un protocolo de 2 días, de acuerdo con las guías de la Sociedad Europea de Medicina Nuclear (EANM). La IPM fue evaluada con y sin el SAPCA.
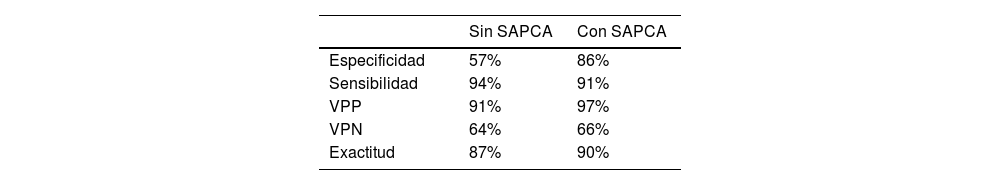
ResultadosLa precisión diagnóstica global de la IPM sin el SAPCA para identificar pacientes con cualquier EAC obstructiva en la AC fue del 87%, sensibilidad del 94%, especificidad del 57%, valor predictivo positivo del 91% y valor predictivo negativo del 64%. Utilizando el SAPCA, la precisión diagnóstica global fue del 90%, la sensibilidad del 91%, la especificidad del 86%, el valor predictivo positivo del 97% y el valor predictivo negativo del 66%.
ConclusiónEl uso del novel SAPCA mejora el rendimiento diagnóstico de la IPM usando la cámara CZT D-SPECT®, especialmente reduciendo el número de resultados falsos positivos al reducir los artefactos.
To evaluate the diagnostic performance of a novel deep learning attenuation correction software (SAPCA) for myocardial perfusion imaging (MPI) using a cadmium-zinc-telluride (CZT) cardio dedicated camera with invasive coronary angiography (ICA) correlation for the diagnosis of coronary artery disease (CAD) in a high-risk population.
MethodsRetrospective study of 300 patients (196 males [65%], mean age 68 years) from September 2014 to October 2019 undergoing MPI, followed by ICA and evaluated by means of quantitative angiography software, within six months after the MPI. The mean pre-test probability score for coronary disease according to the European Society of Cardiology criteria was 37% for the whole cohort. The MPI was performed in a dedicated CZT cardio camera (D-SPECT® Spectrum Dynamics) with a two-day protocol, according to the European Association of Nuclear Medicine guidelines. MPI was retrospectively evaluated with and without the SAPCA.
ResultsThe overall diagnostic accuracy of MPI without SAPCA to identify patients with any obstructive CAD at ICA was 87%, Sensitivity 94%, Specificity 57%, positive predictive value 91% and negative predictive value 64%. Using SAPCA the overall diagnostic accuracy was 90%, sensitivity 91%, specificity 86%, positive predictive value 97% and negative predictive value 66%.
ConclusionUse of the novel SAPCA enhances performance of the MPI using the CZT D-SPECT® camera and achieves improved results, especially avoiding artefacts and reducing the number of false positive results.
Las cámaras semiconductoras de cadmio-cinc-telururo (CZT) para imágenes de perfusión miocárdica (IPM) han demostrado una resolución de energía superior, una sensibilidad mejorada y tasas de especificidad diagnóstica en comparación con las cámaras de Anger tradicionales1 en la evaluación de la sospecha de enfermedad arterial coronaria (EAC). Sin embargo, una limitación reconocida de esta tecnología es el hecho de que estas cámaras son susceptibles a artefactos de varias fuentes, enmascarando potencialmente la EAC2,3. Además, se ha publicado que las cámaras CZT muestran una sensibilidad satisfactoria, pero una especificidad subóptima debido a la ausencia de corrección de atenuación1.
Se han realizado esfuerzos previamente para lograr mejores resultados en la IPM que utilizan la corrección de atenuación por medio de la tomografía computarizada (TC) de baja dosis4,5 para aumentar así el rendimiento diagnóstico del estudio. Por otro lado, las redes neuronales artificiales se han utilizado en cardiología nuclear desde la década de 19906, y se han utilizado con mayor frecuencia tanto para la investigación como para la práctica clínica en los últimos años7–9.
Recientemente se introdujo un nuevo software de aprendizaje profundo para la corrección de atenuación (SAPCA) aplicado para uso clínico en la IPM para la cámara CZT D-SPECT® (Spectrum Dynamics, Cesarea, Israel). El algoritmo SAPCA utilizado se basa en una red neuronal computacional (RNC) con una arquitectura U-Net.
Los autores han informado previamente el rendimiento de la cámara D-SPECT® comparando los resultados de la IPM con la angiografía coronaria (AC) invasiva como el estándar de oro para el diagnóstico8,10. Nuestro estudio anterior que utilizó aprendizaje profundo8 tuvo como objetivo estimar la predicción de los valores cuantitativos de AC directamente de la IPM, sin embargo, en el estudio actual investigamos si el nuevo SAPCA mejoraría el rendimiento de la IPM, basado en una cohorte clínica ampliada.
Según el conocimiento de los autores, todavía no hay ninguna literatura científica que evalúe el uso de este novedoso SAPCA para la cámara D-SPECT® hasta la fecha.
Material y métodosFueron revisados de forma retrospectiva, todos los sujetos adultos remitidos a nuestro centro para una IPM entre el 1 de septiembre de 2014 y el 14 de octubre de 2019 (n=3.634). Solo se consideraron para la inclusión en el estudio y posterior análisis a los pacientes que se sometieron a AC dentro de los 6 meses posteriores al estudio de una IPM. Se excluyeron los sujetos con bloqueo de rama izquierda, cardiopatía congénita y trasplante cardíaco. Debido al riesgo de broncoespasmo por regadenosón11, se pidió a todos los pacientes con asma conocida o enfermedad pulmonar obstructiva crónica que realizaran una prueba de espirometría pulmonar si se iba a realizar una prueba de esfuerzo farmacológico (PEF). Todos los pacientes con volumen espiratorio forzado en 1 segundo (FEV1)<1l, pacientes incapaces de pedalear una bicicleta o con una frecuencia cardíaca máxima baja durante la prueba de esfuerzo en bicicleta (PEB) previa fueron excluidos del estudio.
Esto resultó en la inclusión de 300 pacientes en los análisis finales. Ninguno de los pacientes tuvo eventos cardíacos o revascularización miocárdica en el período comprendido entre la IPM y el examen de AC. La indicación clínica para el estudio de IPM fue angina de esfuerzo y/o disnea.
Prueba de esfuerzoEl estrés se indujo a través de PEB, prueba de esfuerzo farmacológico (PEF) o utilizando una combinación de los 2 (PEC). La selección del tipo de prueba de esfuerzo se realizó a discreción de un consultor en medicina nuclear, dependiendo principalmente de la capacidad del paciente para pedalear una bicicleta y la frecuencia cardíaca máxima del paciente en la PEB anterior o durante la PEB el día de la prueba de IPM. De los 300 pacientes incluidos para la evaluación, 132 se sometieron a PEB, 132 PEF y 36 a PEC.
Para el grupo PEB, se realizó una prueba de esfuerzo de ejercicio máximo estandarizada en bicicleta (eBike® Basic, GE Medical Systems, GmbH, Freiburg, Alemania), con monitorización electrocardiográfica continua (Marquette CASE 8000, GE Medical Systems, Milwaukee, WI, EUA). La carga de trabajo se eligió individualmente, con el objetivo de un tiempo total de ejercicio de 8-12 minutos, y comenzó en 30-50 vatios (W), seguido de un aumento continuo de 15-20W/min hasta el agotamiento. Se inyectó [99mTc]Tc-tetrofosmina al paciente en el nivel más alto de carga de trabajo y ejercicio, el paciente continuó el ciclo durante 1-2min.
Para la PEF se administraron 400 microgramosμg (5ml) de regadenosón por vía intravenosa seguida de la inyección de [99mTc]Tc-tetrofosmina segundos después de la administración de regadenosón.
Para el protocolo combinado, se utilizó una PEB con 30-50W junto con la inyección de regadenosón después de 2min de pedaleo.
Imágenes de perfusión miocárdicaLa IPM se realizó de acuerdo con las directrices de la Sociedad Europea de Medicina Nuclear12.
Las imágenes se realizaron después de la prueba de esfuerzo utilizando una cámara CZT D-SPECT® (Spectrum Dynamics, Cesarea, Israel) con al menos 1 millón de recuentos de miocardio para cada sesión. Todos los pacientes realizaron la IPM de estrés en posición vertical y supina. En los casos de una IPM de esfuerzo normal, no se realizó ninguna IPM en reposo. Los pacientes recibieron 6MBq×kg de [99mTc]Tc-tetrofosmina para los estudios de esfuerzo y reposo en 2 días separados, con adquisiciones de SPECT iniciadas aproximadamente 30min después de la inyección del trazador. Ninguno de los pacientes tuvo eventos cardíacos entre los estudios de esfuerzo y reposo.
La IPM fue evaluada visualmente de forma rutinaria por 2 consultores de medicina nuclear (cada uno con al menos 10 años de experiencia en IPM) utilizando el modelo de 17 segmentos del ventrículo izquierdo y un sistema convencional de clasificación de 4 puntos: 0, captación normal; 1, equívoco; 2, moderado; y 3, reducción severa de la captación13–15. Solo se consideró que los segmentos con una puntuación de captación ≥2 en esfuerzo tuvieron una reducción definitiva de la captación. De estos: 1) los segmentos con defectos reversibles (defectos isquémicos) se definieron como aquellos con una disminución de ≥1 punto en la puntuación de captación en la adquisición del estudio de reposo, y 2) los otros segmentos se consideraron con un defecto fijo (segmentos de infarto de miocardio), excepto aquellos con una contractilidad definitivamente normal en la gated SPECT y para los cuales el diagnóstico final fue un artefacto de atenuación13,14. Se realizó una gated SPECT en imágenes de esfuerzo y reposo. Los segmentos con artefacto de atenuación fueron excluidos para la definición final del área de los defectos de esfuerzo. La evaluación se realizó utilizando QPS-QGS, versión 2012, Cedars-Sinai Medical Center y las bases de datos normales suministradas por el proveedor (Spectrum Dynamics). Todas las imágenes sin SAPCA se analizaron visualmente en posición vertical y supina y todas las imágenes que utilizaron SAPCA se analizaron utilizando solo la posición vertical. En la actualidad, el SAPCA suministrado por el proveedor (TruCorr, Spectrum Dynamics) aún no puede cuantificar el defecto total de perfusión (DTP) y, por lo tanto, esta evaluación no se incluyó en este estudio.
Software de corrección de atenuación de aprendizaje profundoEl propósito del SAPCA es generar un mapa de atenuación a partir de la adquisicón de la IPM reconstruida sin corrección de atenuación (NC). El mapa de atenuación se utiliza al reconstruir la adquisición de la IPM en una imagen de atenuación corregida (AC) utilizando el software de reconstrucción estándar. El algoritmo SAPCA utilizado con la D-SPECT® en este estudio se basa en una red neuronal computacional (RNC) con arquitectura U-Net y se describe en un informe técnico anterior16. La capacitación de la RNC y la validación externa por parte del proveedor consistieron en lo siguiente: las RNC fueron entrenadas utilizando, como entrada, cientos de miles de muestras de SPECT (basadas en 100 pacientes con estudios no corregidos, NC, reconstruidos de las exploraciones de esfuerzo y reposo) y, como salida de referencia, mapas de atenuación extraídos de las tomografías computarizadas correspondientes. Como validación, el SAPCA de AC reconstruyó las exploraciones de esfuerzo y reposo de 25 pacientes y se compararon con las imágenes correspondientes de TC de la AC.
Angiografía coronariaLa AC se realizó de forma rutinaria de acuerdo con las técnicas estándar. Las reducciones porcentuales del área lumínica debidas a placas ateromatosas intracoronarias se determinaron primero visualmente en marcos diastólicos finales y con la ayuda del software QCA (AC cuantitativa) (General Electric Advantage Workstation, aplicaciones de rayos X cardíacos, análisis de estenosis v1.6) para estenosis que un especialista en angiografía experimentado (con más de 10 años de experiencia en AC) determinó visualmente que estaban alrededor del umbral del 50%. Cuando correspondió, se obtuvieron dos mediciones separadas en vistas ortogonales del mismo segmento estenótico y se promediaron los valores para representar una medición aproximada del porcentaje (%) de estenosis del área lumínica del vaso. Cualquier estenosis ≥50% se consideró significativa y se consideró una prueba de AC positiva. Las oclusiones totales de los vasos coronarios se marcaron como estenosis del área de la luz del «100%». Cuando no se observó luz estenótica visible en la angiografía con un vaso marginalmente permeable (con un flujo distinto del normal), la estenosis también se consideró una oclusión total.
Análisis estadísticoLos análisis estadísticos, incluido el cálculo de sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y precisión, se realizaron utilizando el software estadístico MedCalc17 y se describen en porcentajes. Las variables continuas fueron reportadas como media±DE y las variables categóricas como porcentajes.
ResultadosDe los 300 pacientes evaluados, la mayoría eran varones 196 (65%) con una edad media de 68 años y un índice de masa corporal (IMC) medio de 28,7. La indicación clínica para el estudio de IPM fue angor de esfuerzo y/o disnea en 291 pacientes y una prueba de esfuerzo anormal en 9 pacientes. La estimación media de probabilidad previa a la prueba para EAC se calculó de acuerdo con la edad, el sexo, la angina y la disnea de acuerdo con las últimas pautas de la Sociedad Europea de Cardiología18, lo que resultó en un promedio de 37%. Cuarenta pacientes (13%) tenían EAC conocida. Las características basales se incluyen en la tabla 1.
Características basales de la población de estudio, incluidos los 300 sujetos. Todos los datos se presentan como media (desviación estándar) a menos que se indique lo contrario
| Varones, n (%) | 196 | 65 |
| Mujeres, n (%) | 104 | 35 |
| Edad, años | 67,7 | 10,2 |
| Peso, kg | 87,8 | 18,5 |
| Altura, m | 1,74 | 0,09 |
| IMC, kg/m2 | 27,8 | 5,1 |
| Diabetes mellitus, n (%) | 54 | 18 |
| Hipertensión, n (%) | 100 | 33 |
| Hiperlipidemia, n (%) | 51 | 17 |
| Consumo de tabaco, n (%) | 83 | 28 |
| Angina de pechoa, n (%) | 286 | 95 |
| Probabilidad previa a la prueba, % (DE) | 37 | 15 |
DE: desviación estándar; IMC: índice de masa corporal.
La exactitud diagnóstica general de la IPM sin SAPCA para identificar pacientes con EAC obstructiva en la AC con y sin el nuevo SAPCA se puede ver en la tabla 2.
Resultados de la evaluación sin SAPCA y utilizando SAPCA en toda la población
| Sin SAPCA | Con SAPCA | |
|---|---|---|
| Especificidad | 57% | 86% |
| Sensibilidad | 94% | 91% |
| VPP | 91% | 97% |
| VPN | 64% | 66% |
| Exactitud | 87% | 90% |
SAPCA: software de aprendizaje profundo para corrección de atenuación; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Hemos probado retrospectivamente un nuevo SAPCA para IPM en un entorno clínico de rutina, y nuestros resultados generales muestran un mejor desempeño de la población evaluada con SAPCA, principalmente debido a la reducción del número de resultados falsos positivos (FP) en la IPM (fig. 1), aumentando así la especificidad del 57 al 86%. Las tasas de especificidad informadas anteriormente para la IPM utilizando cámaras CZT han mostrado resultados bastante modestos que van del 54 al 76%1,10, lo que se debe principalmente al alto número de resultados FP obtenidos con este tipo de equipo. En nuestro estudio, de los 22 casos encontrados con resultados FP durante la evaluación sin SAPCA, solo 7 tuvieron resultados FP usando SAPCA, lo que puede traducirse clínicamente en evitar potencialmente los estudios de AC en 15 pacientes.
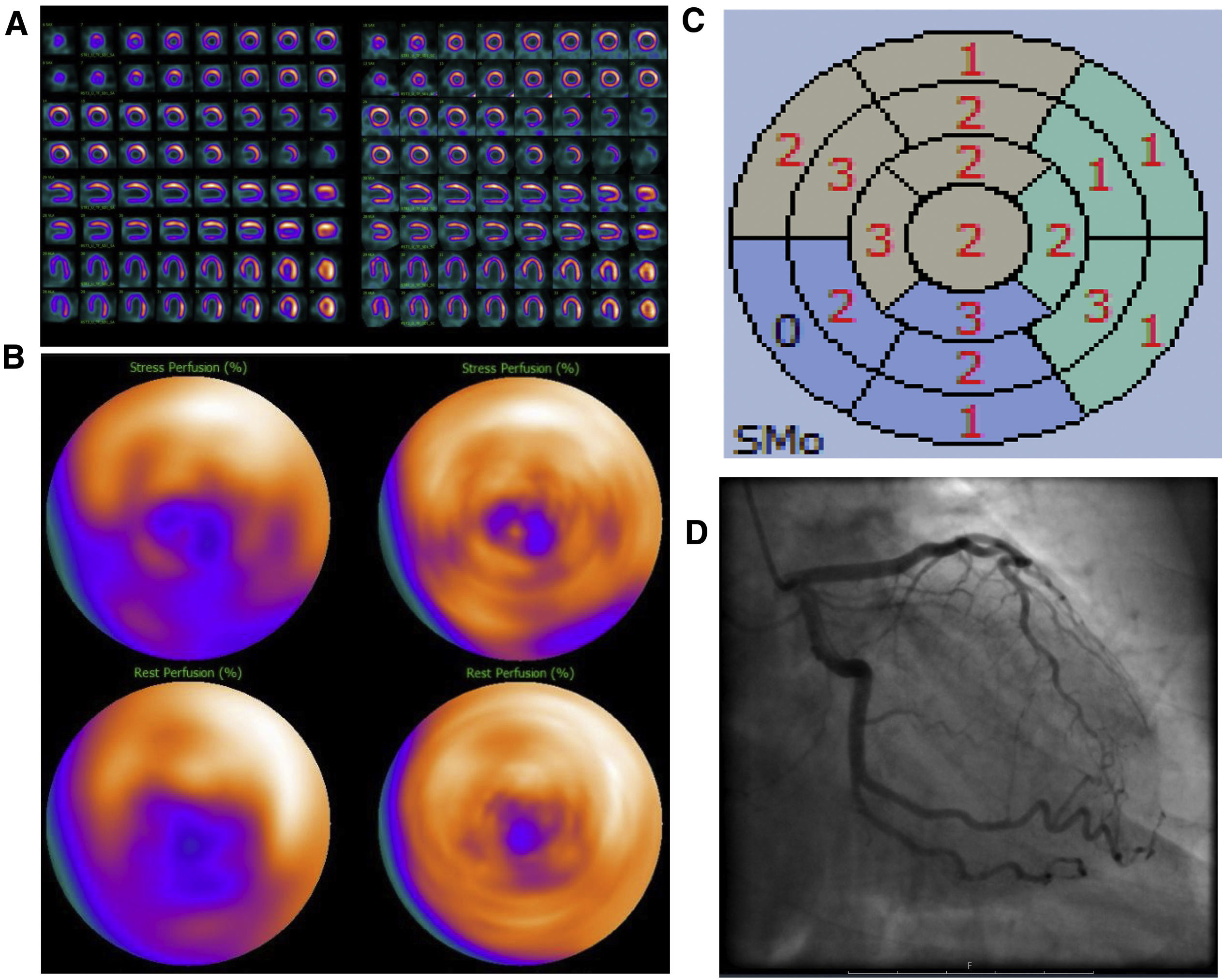
Mujer de 70 años, IMC 26, diabetes mellitus tipo II, fumadora, sin antecedentes cardiológicos previos. Diagnostico reciente de cáncer gástrico, se realiza una ecocardiografía como parte del estudio preoperatorio donde se observa una hipocinesis apical. Es remitida a IPM para descartar isquemia. Evaluación de la IPM sin SAPCA (imágenes en el lado izquierdo). IPM cortes de eje menor, de eje mayor vertical y eje mayor horizontal durante estrés en la fila superior y reposo en la fila inferior (A) y “ojo de buey” (B), mostrando un defecto de perfusión parcialmente reversible en la pared inferoseptal que afecta incluso el territorio apical. Mapa polar de imágenes gated durante el estrés mostrando contracción anormal moderada del ventrículo izquierdo (C). Ausencia obstrucción significativa de las arterias coronarias en la AC (D). IMP usando SAPCA (imágenes en el lado derecho) que muestran ausencia de defectos de perfusión significativos. La paciente pudo haber evitado la AC.
En consecuencia, la sensibilidad disminuyó del 94% sin SAPCA al 91% cuando se usa SAPCA, esto se debió a un mayor número de resultados falsos negativos (FN) cuando se usa SAPCA. Se encontraron 7 casos con resultados verdaderos positivos en la IPM confirmado con AC que convirtieron los resultados en FN cuando se evaluaron con SAPCA (fig. 2).
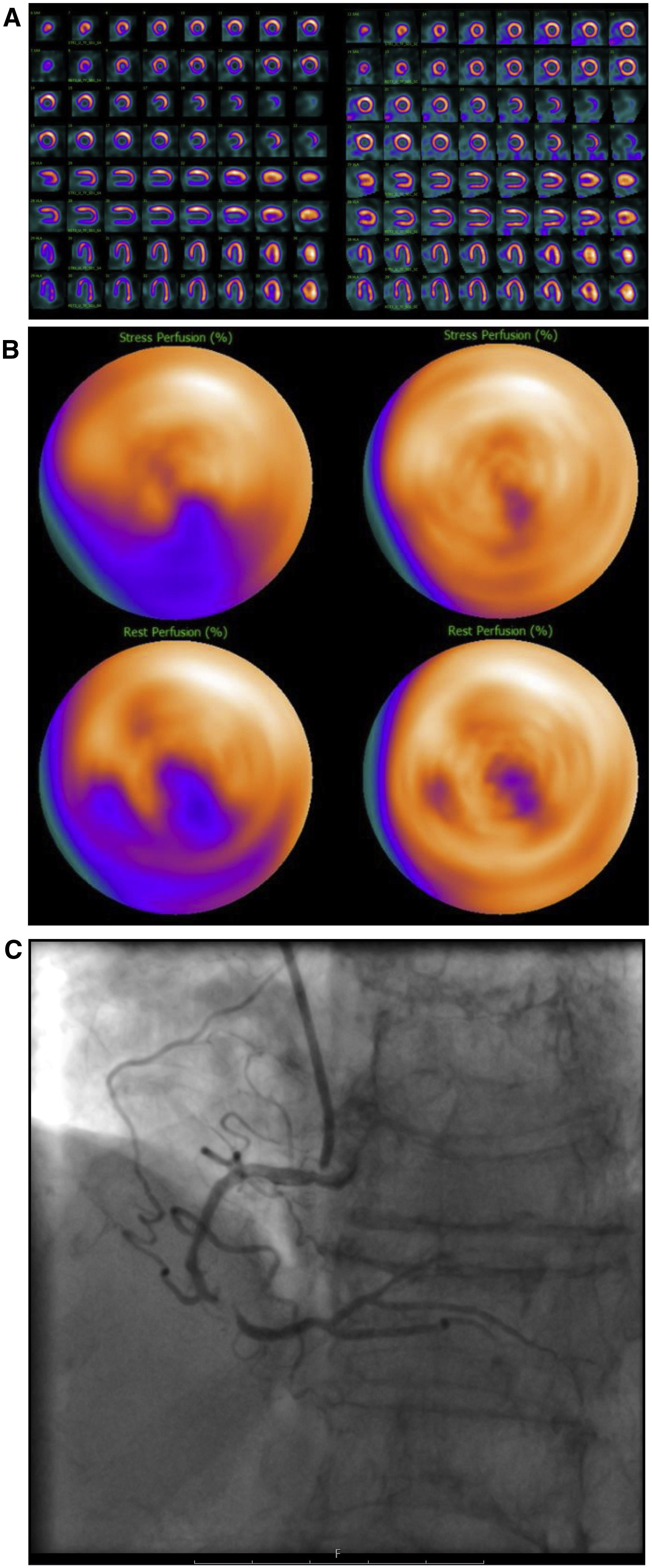
Mujer de 74 años, IMC 25, sin antecedentes cardiológicos previos. Presenta angina y electrocardiograma patológico. Es referida a una prueba de IPM para descartar isquemia. Evaluación de la IPM sin SAPCA (imágenes en el lado izquierdo). IPM cortes de eje menor, de eje mayor vertical y eje mayor horizontal durante estrés en la fila superior y reposo en la fila inferior (A) y “ojo de buey” (B), muestran un defecto de perfusión en la pared infero-septal, correspondiendo con el territorio de la arteria coronaria derecha, mostrando reversibilidad parcial en reposo. Obstrucción significativa de la arteria coronaria derecha comprobada con AC (C). IMP usando SAPCA (imágenes en el lado derecho) que muestran ausencia de defectos de perfusión significativos. Resultado falso negativo al usar SAPCA.
A pesar de que investigaciones previas que utilizan imágenes SPECT de posición supina corregida por atenuación por TC de baja dosis han mostrado resultados prometedores en la reducción de la frecuencia de los artefactos de atenuación en la IPM4 cuando se usan cámaras CZT, este abordaje requiere mucho tiempo y también radiación ionizante adicional. Aunque en dosis bajas, siempre es deseable omitir cualquier radiación evitable en el diagnóstico por la imagen que se adhiera a los principios de «tan bajo como sea razonablemente posible» (ALARA)19.
El uso de SAPCA para la IPM podría evitar el uso de la TC de baja dosis para corrección de atenuación, evitando el uso de radiación ionizante adicional a los pacientes, logrando resultados satisfactorios de sensibilidad, especificidad y precisión en la literatura científica disponible sobre el tema hasta la fecha20,21.
En un estudio reciente, Hagio et al.20 desarrollaron un nuevo SAPCA utilizando datos de IPM de una cámara estándar de Anger SPECT/TC con colimadores de baja energía y alta resolución (LEHR), utilizando un gran número de pacientes de los cuales casi el 50% tenía un índice de masa corporal (IMC)>30. El SAPCA desarrollado se probó con 351 pacientes que tenían correlación con la AC, la evaluación de la IPM se realizó con cuantificación del DTP, sus resultados muestran un menor rendimiento diagnóstico en comparación con los resultados del estudio actual, estando publicada una sensibilidad del 74,4-83,8%, una especificidad del 66,1-68,5% y una precisión del 70,3-71,5%.
Entre los diferentes tipos de artefactos que se han descrito en la literatura científica2 como la causa de los resultados de FP en la IPM cuando se usa la cámara D-SPECT®, se ha publicado que la obesidad3,10 es una de las causas más comunes de artefactos (fig. 3), algo que en varios casos puede llevar al paciente a una AC. El tipo de cámara y las características específicas del paciente, particularmente el gran número de pacientes con IMC alto, podrían explicar en parte los resultados obtenidos por Hagio et al. en comparación con los resultados obtenidos por nuestro grupo en este estudio. Sin embargo, se necesitan más estudios para confirmar estos hallazgos.
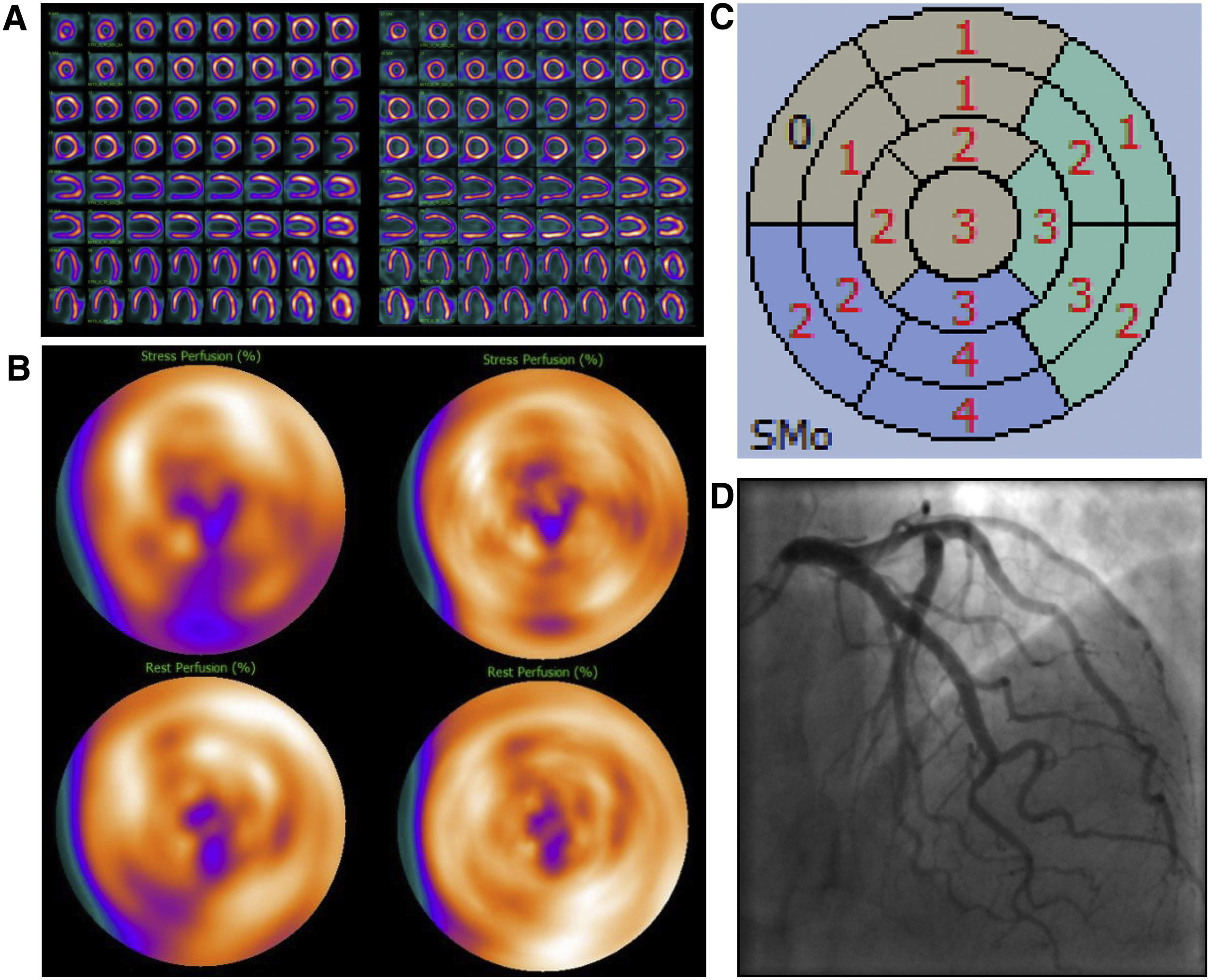
Varón de 69 años, IMC 31, antecedentes de fibrilación auricular. Presenta cambios patológicos en la onda ST-T en el electrocardiograma durante una prueba de esfuerzo. Referido a una prueba de IPM para descartar isquemia. Evaluación de la IPM sin SAPCA (imágenes en el lado izquierdo). IPM cortes de eje menor, de eje mayor vertical y eje mayor horizontal durante estrés en la fila superior y reposo en la fila inferior (A) y “ojo de buey” (B), mostrando un defecto de perfusión infero-apical con reversibilidad inferior durante el reposo. Mapa polar de imágenes gated durante el estrés mostrando contracción anormal moderada del ventrículo izquierdo (C). Ausencia obstrucción significativa de las arterias coronarias en la AC (D). IMP usando SAPCA (imágenes en el lado derecho) que muestran ausencia de defectos de perfusión significativos. El paciente pudo haber evitado la AC.
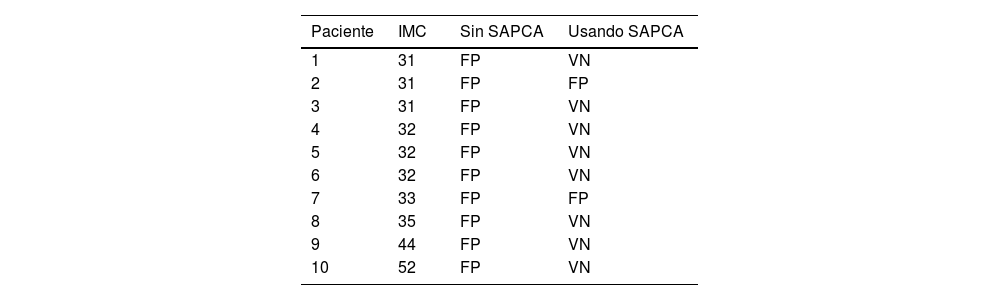
En nuestra población de estudio encontramos solo 28 pacientes (9%) con un IMC de 30 o más, el IMC medio para toda la población se puede ver en la tabla 1. De esos 28 pacientes, encontramos 10 casos con resultados FP durante la evaluación visual sin SAPCA reduciéndolo a 2 casos durante la evaluación utilizando el SAPCA (tabla 3).
Pacientes con un IMC>30 y resultados FP
| Paciente | IMC | Sin SAPCA | Usando SAPCA |
|---|---|---|---|
| 1 | 31 | FP | VN |
| 2 | 31 | FP | FP |
| 3 | 31 | FP | VN |
| 4 | 32 | FP | VN |
| 5 | 32 | FP | VN |
| 6 | 32 | FP | VN |
| 7 | 33 | FP | FP |
| 8 | 35 | FP | VN |
| 9 | 44 | FP | VN |
| 10 | 52 | FP | VN |
Evaluación sin SAPCA y utilizando SAPCA. La AC podría haberse evitado potencialmente en 8 de los 10 pacientes evaluados usando SAPCA.
AC: angiografía coronaria; FP: falso positivo; IMC: índice de masa corporal; SAPCA: software de aprendizaje profundo para corrección de atenuación; VN: verdadero negativo.
El novedoso SAPCA desarrollado por Hagio et al.20 ha sido probado recientemente en un ensayo multicéntrico más grande21, utilizando cámaras de Anger convencionales, demostrando mejores resultados al aplicar SAPCA a la IPM, observando un aumento sustancial en la especificidad y precisión de la prueba, algo que también se confirmó en nuestro estudio y se puede ver en la tabla 2.
En un artículo publicado recientemente por Shanbhag et al.22 el uso de SAPCA y cámaras de estado sólido con detectores CZT de un fabricante diferente en comparación con nuestro estudio, mostró mejores rendimientos de la IPM cuando se usa SAPCA. Estos resultados están en línea con los resultados de Hagio et al.20,21 y de nuestro grupo, lo que confirma una mejor precisión al usar estos métodos.
Una limitación del nuevo SAPCA utilizado en nuestro estudio fue la falta de disponibilidad para realizar la cuantificación del DTP y el aumento de casos FN, algo que podría desarrollarse y mejorarse potencialmente en futuras versiones del SAPCA. Sin embargo, el SAPCA muestra resultados prometedores en la eliminación de artefactos en la IPM, algo que puede disminuir el número de resultados FP y potencialmente aumentar la especificidad de la prueba, eliminando la necesidad de corrección de atenuación por TC y la radiación ionizante adicional para el paciente, asegurando el papel de la IPM como el guardián de la AC (fig. 4). Otra limitación de nuestro estudio es el bajo número de casos incluidos. La población de estudio es realmente pequeña en comparación con los estudios de Hagio et al.20,21 y Shanbhag et al.22, pero aceptable si se tiene en cuenta que se trataba de un estudio de un solo centro. Sin embargo, habría sido preferible un estudio más amplio. Se justifica una investigación prospectiva más amplia para confirmar nuestros hallazgos.
Varón de 50 años, IMC 29, antecedentes de hipertensión, hiperlipemia y angina típica. Referido a una prueba de IPM para descartar isquemia. Evaluación de la IPM sin SAPCA (imágenes en el lado izquierdo). IPM cortes de eje menor, de eje mayor vertical y eje mayor horizontal durante estrés en la fila superior y reposo en la fila inferior (A) y “ojo de buey” (B), mostrando un defecto de perfusión en la pared anterior, reversible en el estudio de reposo. Obstrucción significativa de la arteria coronaria descendente izquierda en la AC (C). IMP usando SAPCA (imágenes en el lado derecho) que muestran ausencia de defectos de perfusión significativos en la pared anterior, reversible en el estudio de reposo. Estudio verdadero positivo en la evaluación con y sin SAPCA, confirmado en la AC.
El SAPCA aumenta el rendimiento de la IPM utilizando la cámara CZT D-SPECT® logrando mejores resultados, especialmente en evitar artefactos y por lo tanto reduciendo el número de resultados FP, siguiendo los principios ALARA de la mejor manera posible, evitando la necesidad de utilizar radiación ionizante para la corrección de atenuación.
FinanciaciónLa subvención fue obtenida por Henry y Ella Margareta Stahls Stiftelse (Fundación Henry y Ella Margareta Stahl, proyecto RÖ-981845), Analytic Imaging Diagnostics Arena (subvención Vinnova 2017-02447), Departamento de Fisiología Clínica y Departamento de Radiología, Región Östergötland.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.