Etrasimod es una molécula pequeña, sintética, no biológica, de administración oral, que modula el receptor de la esfingosina-1-fosfato (S1PR, por sus siglas en inglés). Etrasimod fue autorizado por la Food and Drug Administration en 2023 y por la European Medicines Agency en 2024, constituyendo una nueva opción terapéutica para los pacientes a partir de 16 años con colitis ulcerosa activa de moderada a grave en la unión europea. Su eficacia y tolerabilidad han sido demostradas en varios ensayos clínicos, tanto como tratamiento de inducción como de mantenimiento, así como en estudios de extensión a largo plazo. En este artículo se revisan las características farmacodinámicas de etrasimod, sus principales diferencias con los fármacos biológicos y otras pequeñas moléculas (inhibidores de las janus quinasas), así como su eficacia clínica (incluyendo determinadas subpoblaciones como los pacientes con proctitis ulcerosa aislada) y el impacto sobre la calidad de vida de los pacientes.
Etrasimod is a synthetic, non-biological, orally administered small molecule sphingosine-1-phosphate receptor (S1PR) modulator. Etrasimod was approved by the Food and Drug Administration in 2023 and by the European Medicine Agency in 2024, constituting a new therapeutic option for the treatment of moderately to severely active ulcerative colitis in patients 16 years of age and older in the European Union. Its efficacy and tolerability have been demonstrated in several clinical trials both as induction and maintenance treatment, as well as in long-term extension studies. This article reviews the pharmacodynamic characteristics of etrasimod, its main differences with biological drugs and other small molecules (janus kinases inhibitors), as well as its clinical efficacy including certain subpopulations such as patients with isolated ulcerative proctitis, and the impact on their quality of life.
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal (EII) de naturaleza crónica e idiopática, caracterizada por la inflamación de la mucosa del colon. Esta inflamación puede extenderse de manera variable y cursa con episodios alternantes de brotes activos y periodos de remisión. Su desarrollo responde a una patogénesis multifactorial que involucra tanto factores genéticos como ambientales1,2. Existe una tendencia a que su prevalencia aumente, especialmente en los países desarrollados2–5. En España, se estima una prevalencia aproximada de 90 casos de CU por cada 100.000 habitantes6.
Las guías de práctica clínica actuales recomiendan el uso de aminosalicilatos como tratamiento de primera línea en los casos de CU de leve a moderada, y el uso de corticoides en los pacientes que no responden a estos7,8. Para los pacientes con CU de moderada a grave, el arsenal terapéutico ha aumentado con la aprobación de fármacos biológicos y moléculas pequeñas. Entre estas opciones se incluyen inhibidores del factor de necrosis tumoral (TNF; infliximab, adalimumab, golimumab), un inhibidor de integrina, (vedolizumab), inhibidores de la interleucina 23 (mirikizumab, risankizumab) o de las interleucinas 23 y 12 (ustekinumab), inhibidores de las janus quinasas (iJAK; tofacitinib, filgotinib, upadacitinib), y moduladores del receptor de esfingosina-1-fosfato (S1PR, por su abreviatura en inglés; ozanimod, etrasimod).
A pesar del impacto positivo de estas terapias en el tratamiento de la CU de moderada a grave durante los últimos 20 años9–13, aún se plantean desafíos importantes en el manejo de esta enfermedad. Un número significativo de pacientes continúa mostrando una respuesta insuficiente o inadecuada a los fármacos disponibles, lo que subraya la necesidad de explorar nuevas alternativas terapéuticas con mecanismos de acción innovadores14,15. Además, aunque los tratamientos actuales pudieran contribuir a reducir el riesgo de cirugía, las tasas de colectomía siguen siendo altas16–18, lo que refuerza la urgencia de nuevos tratamientos eficaces.
Etrasimod es una molécula pequeña de administración oral que actúa como un modulador selectivo de los receptores S1PR 1, 4 y 5. Los estudios que han evaluado su eficacia la han demostrado tanto en la inducción como en el mantenimiento de la remisión clínica en los pacientes con CU activa de moderada a grave19–22. Por ello, representa una nueva y prometedora alternativa terapéutica para los pacientes que no responden adecuadamente o pierden respuesta con el tiempo a los tratamientos convencionales o biológicos, o que no los toleran23.
El propósito de este artículo es ofrecer una revisión exhaustiva del conocimiento actual sobre el mecanismo de acción y la eficacia de etrasimod en el tratamiento de la CU, resaltando su papel como una alternativa terapéutica innovadora para abordar las necesidades no cubiertas de esta enfermedad.
Generalidades sobre etrasimodEn la etiopatogenia de la EII se desencadena una activación anómala tanto de la respuesta inmunitaria innata mediada por macrófagos y células natural killer, entre otras, como de la respuesta inmunitaria adaptativa mediada por los linfocitos T, entre otros24.
En las fases iniciales de la CU, los macrófagos activados se diferencian hacia células efectoras proinflamatorias y adquieren la capacidad de migrar a los ganglios linfáticos y presentar antígenos a los linfocitos, críticamente involucrados en el desarrollo de la EII25. Los linfocitos diferenciados migran desde los ganglios linfáticos hasta el torrente sanguíneo, y de ahí hacia la mucosa intestinal, induciendo la proliferación y activación de células inflamatorias26.
La esfingosina-1-fosfato es un fosfolípido derivado de la esfingosina por acción de las esfingosinas quinasas. Tiene un importante papel regulador en procesos inflamatorios, el crecimiento y supervivencia celular, la angiogénesis, el tono y permeabilidad vascular y la migración linfocitaria, entre otros. Su actividad está mediada por la unión a receptores transmembrana de la superficie celular expresados en diversas células inmunitarias y en diferentes localizaciones como el sistema nervioso central, el sistema cardiovascular, el sistema musculoesquelético, el bazo, los riñones y los pulmones27,28.
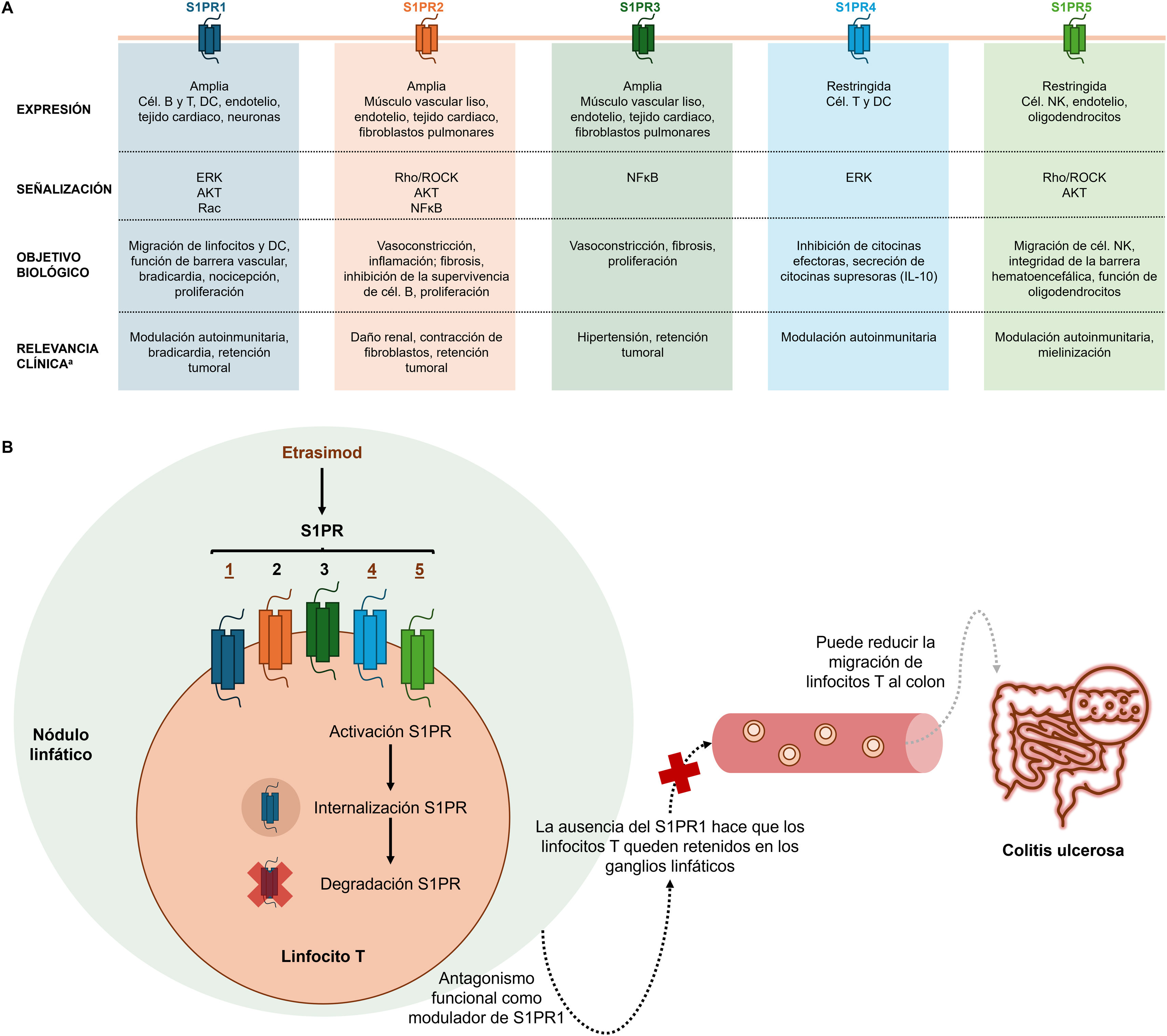
Se han identificado hasta 5 subunidades de S1PR, cuya distribución tisular es variable: los S1PR1-3 son ubicuos, mientras que el S1PR4 se localiza predominantemente en el tejido linfoide y el S1PR5 en el sistema nervioso central y el bazo29 (fig. 1A). La esfingosina-1-fosfato actúa sobre el sistema inmunitario regulando la migración de linfocitos (principalmente células B y T) desde los ganglios linfáticos hacia la sangre y la linfa, y finalmente hacia los tejidos. Dentro de los ganglios linfáticos, las células T CD4 y CD8 naïve son activadas ante la presencia de antígenos presentados por las células dendríticas. Estas células migran desde los ganglios linfáticos mediante un gradiente de esfingosina-1-fosfato, cuya concentración va aumentando hasta llegar al torrente sanguíneo27. El proceso de migración se modula mediante la interacción entre la esfingosina-1-fosfato con el S1PR, que se presenta en la superficie celular del linfocito. Se ha observado que la esfingosina-1-fosfato se encuentra sobreexpresada en modelos animales experimentales de colitis inducida y en los pacientes con CU activa30.
El papel de etrasimod en la colitis ulcerosa. A) Receptores de esfingosina 1-fosfato: localización, señalización, función y relevancia clínica. B) Papel antagónico funcional de etrasimod como modulador de los receptores de esfingosina-1-fosfato32,59–61. aEn función de una combinación de datos animales y humanos. Cél.: células; DC: cél. dendríticas; EIHR: mejoría endoscópica-remisión histológica; S1PR: receptor de esfingosina 1-fosfato (S1P, por sus siglas en inglés).
Etrasimod se une a los S1PR siendo un agonista completo del S1PR1 y un agonista parcial de los S1PR4-5, sin efectos detectables sobre los S1PR2-331. A la vez, actúa como un antagonista funcional del S1PR1 en los linfocitos al causar la internalización persistente del receptor en la célula y su degradación mediada por el proteasoma. La consecuente ausencia del S1PR1 provocada por estos efectos de etrasimod hace que los linfocitos queden retenidos en los ganglios linfáticos, observándose un descenso en su concentración en sangre periférica27. Por lo tanto, la acción terapéutica de etrasimod se asocia con la reducción en la migración de células T de los ganglios linfáticos a la sangre y a la mucosa cólica (fig. 1B). Cabe destacar que la reducción de linfocitos inducida por etrasimod tiene efectos diferenciales sobre las subpoblaciones linfocitarias, con una disminución más pronunciada en las células involucradas en la respuesta inmunitaria adaptativa32.
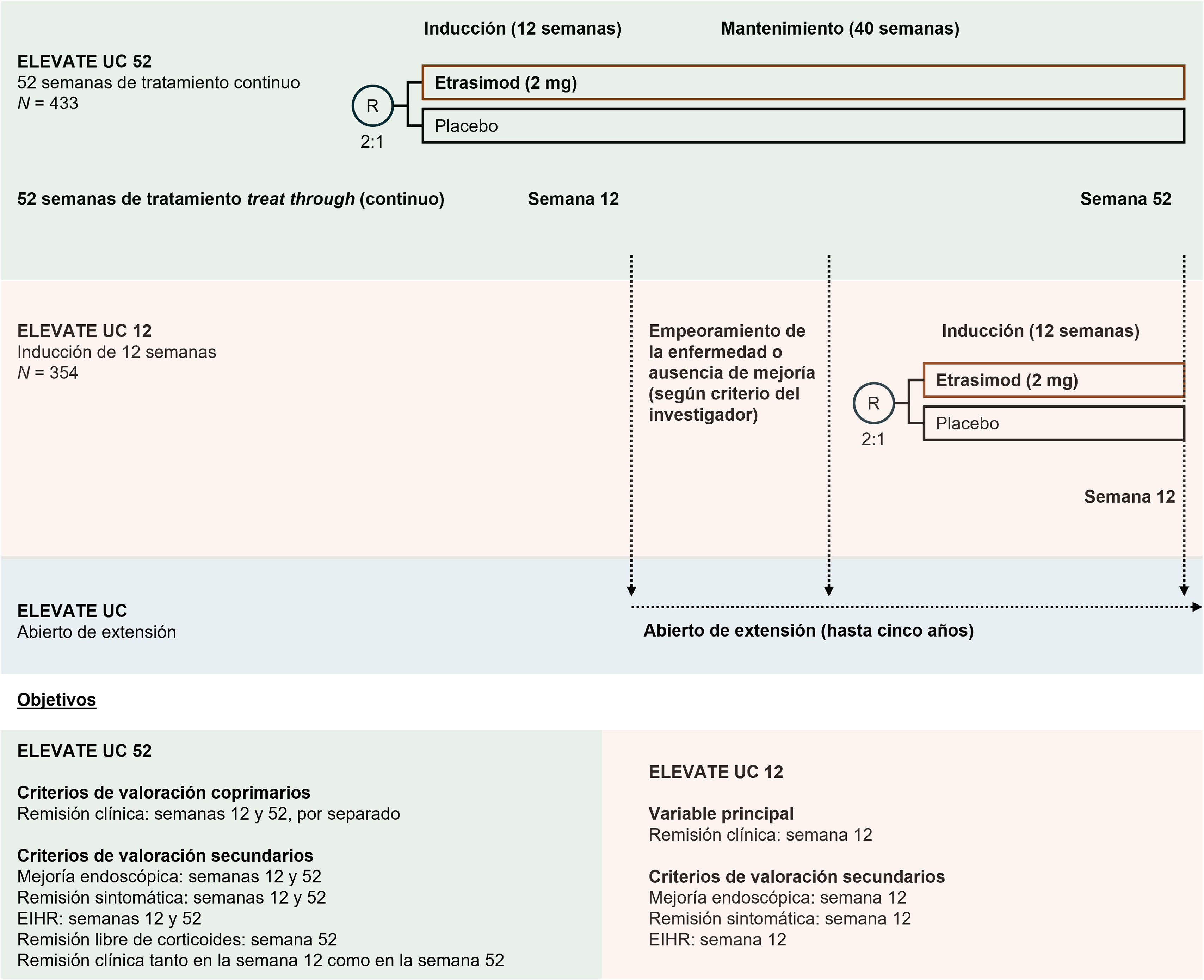
Desarrollo clínico de etrasimod en la colitis ulcerosaLa eficacia de etrasimod ha sido evaluada en un estudio clínico de fase 2 (OASIS)21 y en 2 estudios de fase 3 (ELEVATE UC)33, seguidos de sus respectivos estudios de extensión a largo plazo (OASIS OLE31 y ELEVATE UC OLE34) en los pacientes con CU de moderada a grave (tabla 1).
Desarrollo clínico de etrasimod en la colitis ulcerosa
| Estudio | Diseño | Criterios de inclusión | Duración | Tratamiento | Criterio de valoración primaria | Criterios de valoración secundarios |
|---|---|---|---|---|---|---|
| Estudio clínico de fase 2 (estudio OASIS)21 | Estudio multicéntrico, doble ciego, de grupos paralelos, controlado con placebo | 156 pacientes de entre 18 y 80 años con CU de moderada a grave (puntuación mMS de 4-9, subpuntuación endoscópica ≥2 y subpuntuación de sangrado rectal ≥1) y previamente intolerantes o fallo previo a terapias convencionales o biológicos | 12 semanas | 52 pacientes recibieron etrasimod 1mg/una vez al día, 50 pacientes etrasimod 2mg, y 54 pacientes placebo | Mejoría media del MMS desde el inicio del estudio hasta la semana 12 | Proporción de pacientes en la semana 12 que lograron mejoría endoscópica (definida como una subpuntuación endoscópica de ≤1), mejoría en los 2 componentes de la MMS (rango: 0-6, incluyendo sangrado rectal y los hallazgos endoscópicos), y mejoría en la MMS total (rango: 0-12, compuesto por el MMS más la evaluación global del médico) |
| Ensayo clínico de extensión a largo plazo (estudio OASIS OLE)31 | Los pacientes que completaron el estudio doble ciego fueron elegibles para ser incluidos en el estudio de extensión abierto | 52 semanas | 112 pacientes recibieron etrasimod 2mg/una vez día | Tolerabilidad y seguridad de etrasimod a largo plazo | Proporción de pacientes con respuesta clínica, remisión clínica o mejora endoscópica desde la semana 12 hasta la finalización del tratamiento | |
| Estudio de fase 3 de inducción (ELEVATE UC 12) (fig. 2)33 | Estudio clínico de fase 3, aleatorizado, multicéntrico, doble ciego, controlado con placebo | 354 pacientes de 16 a 80 años con CU activa de moderada a grave (confirmada por endoscopia: subpuntuación endoscópica ≥2 y subpuntuación de sangrado rectal ≥1 e histopatología con extensión de la enfermedad a ≥10cm del borde anal y una puntuación del mMS de 4-9) y una respuesta inadecuada, pérdida de respuesta, o intolerancia a al menos un tratamiento aprobado para la CU | 12 semanas | 238 recibieron etrasimod 2mg/una vez al día y 116 placebo | Porcentaje de pacientes que alcanzaron la remisión clínica en la semana 12 (definida como una subpuntuación en el número de deposiciones de 0 (o 1 con una disminución de ≥1 punto desde la visita basal), subpuntuación de sangrado rectal de 0 y subpuntuación endoscópica ≤1 (sin friabilidad) | Porcentaje de pacientes que lograron mejoría endoscópica, remisión sintomática y la mejoría endoscópica/remisión histológica a la semana 12 |
| Estudio de fase 3 de inducción y mantenimiento con un diseño de tratamiento continuo (treat-through) (ELEVATE UC 52) (fig. 2)33 | Estudio clínico de fase 3, aleatorizado, multicéntrico, doble ciego, controlado con placebo | 433 pacientes con CU de moderada a grave de 16 a 80 años que debían cumplir los mismos criterios de inclusión y exclusión que los del estudio ELEVATE UC 12 | 52 semanas | 289 recibieron etrasimod 2mg/una vez al día y 144 placebo | Porcentaje de pacientes que alcanzaron la remisión clínica en la semana 12 y en la semana 52 | Porcentaje de pacientes que lograron mejoría endoscópica, remisión sintomática, mejoría endoscópica/remisión histológica (EIHR, del inglés), respuesta clínica, remisión clínica sin corticosteroides y remisión clínica mantenida |
| Estudio de extensión (ELEVATE UC OLE)58 | Estudio de extensión de fase 3, multicéntrico, abierto, no controlado con pacientes con CU activa de moderada a grave que han recibido un tratamiento previo, doble ciego (etrasimod 2mg/una vez al día o placebo) durante su participación en uno de los estudios de fase 2 o de fase 3 | 5 años | Tolerabilidad y seguridad de etrasimod a largo plazo; número y gravedad de medidas de seguridad | Porcentaje de pacientes que alcanzaron remisión clínica, mejoría endoscópica y respuesta clínica, así como mejoría en la MMS total y parcial |
CU: colitis ulcerosa; MMS: modified Mayo score.
El estudio ELEVATE UC 52, que comprende un periodo de inducción de 12 semanas seguido de un periodo de mantenimiento de 40 semanas con un diseño treat-through (continuo), y el estudio ELEVATE UC 1233 (fig. 2) son ensayos clínicos de fase 3, aleatorizados, doble ciego, controlados con placebo. Estos estudios incluyeron respectivamente 433 y 354 pacientes de 16-80 años con CU activa, de moderada a grave, confirmada por endoscopia (lectura centralizada de la subpuntuación endoscópica ≥2 y subpuntuación de sangrado rectal ≥1) e histopatología con una extensión de la enfermedad a ≥10cm desde el margen anal y una puntuación del MMS (del inglés modified Mayo score) de 4-9. Además, los pacientes debían haber experimentado una respuesta inadecuada, pérdida de respuesta o intolerancia a al menos un tratamiento aprobado para la CU (aminosalicilatos orales, corticoides, tiopurinas, iJAK o biológicos como anti-TNF, anti-integrina o anti-IL12/23). En este estudio, los pacientes podían recibir terapias concomitantes para la CU, como dosis diarias estables de aminosalicilatos o corticoides orales. No se permitió el tratamiento concomitante con inmunomoduladores, terapias biológicas, aminosalicilatos vía rectal o corticoides rectales. En el ELEVATE UC 52, 289 pacientes recibieron 2mg de etrasimod una vez al día durante 52 semanas, y 144 pacientes recibieron placebo. A diferencia de los estudios con un diseño en el que los respondedores son aleatorizados nuevamente («realeatorización») tras el periodo de inducción, en este estudio de diseño treat-through (continuo) los pacientes asignados a cada brazo continuaron en el mismo durante el mantenimiento, sin ser realeatorizados. En el ELEVATE UC 12, 238 pacientes recibieron 2mg de etrasimod una vez al día durante 12 semanas, y 116 pacientes recibieron placebo33.
Desarrollo clínico de etrasimod en la colitis ulcerosa33.
El criterio de valoración principal fue el porcentaje de pacientes que alcanzaron la remisión clínica (es decir, una subpuntuación en la frecuencia de deposiciones de 0/1 con una disminución de ≥1 punto desde la visita basal; y una subpuntuación del sangrado rectal de 0 y endoscópica ≤1 [sin friabilidad]) en la semana 12 (ELEVATE UC 52 y 12) y en la semana 52 (ELEVATE UC 52) (tabla 2). Los criterios de valoración secundarios incluyeron, entre otros, el porcentaje de pacientes que lograron mejoría endoscópica, remisión sintomática y mejoría endoscópica-remisión histológica (EIHR, por sus siglas en inglés) a la semana 12 (ELEVATE UC 52 y ELEVATE UC 12), así como la remisión clínica sin corticoides y la remisión clínica mantenida (ELEVATE UC 52) (tabla 2). Cabe destacar que la remisión sintomática es una variable compuesta exigente y su empleo no es habitual en la evaluación de eficacia de las terapias avanzadas33.
Resultados de la eficacia y la tolerabilidad en los ensayos clínicos con etrasimod en los pacientes con colitis ulcerosa de moderada a grave
| Estudio | N.° de pacientes | Criterios | Eficacia a 12 semanas(n, %) | Eficacia a 52 semanas(n, %) | Efectos adversos (%) | ||||
|---|---|---|---|---|---|---|---|---|---|
| Tratamiento | Etrasimod2mg/una vez al día | Placebo | DTaIC 95% | Etrasimod2mg/una vez al día | Placebo | DTaIC 95% | |||
| n | 238 | 116 | 289 | 144 | |||||
| Estudio de fase 3 de inducción (ELEVATE UC 12) (fig. 2)33 | 354 | Primario | — | — | — | • Infecciones: 11,3% (n=27) vs. 12,1% (n=14),• Infecciones graves: 0 vs. 0%• Herpes zóster: 0 vs. 2% (n=2)• Bradicardia sinusal: 2 (n=4) vs. 0%• Bradicardia: <1% (n=1) vs. 0%• Bloqueo AV 1.er grado: <1% (n=1) vs. 0%• Bloqueo AV 2.o grado: 0 vs. 0%• Edema macular: <1% (n=1) vs. 1% (n=1) | |||
| Remisión clínicab | 55 (25) | 17 (15) | 10% (1%, 18%)j | — | — | — | |||
| Secundarios | — | — | — | ||||||
| Mejoría endoscópicac | 68 (31) | 21 (19) | 12% (3%, 21%)j | — | — | — | |||
| Normalización endoscópicad | 38 (17%) | 9 (8%) | 9,2% (2,3-16,2)l | ||||||
| Remisión sintomáticae | 104 (47) | 33 (30) | 17% (7%, 28%)j | — | — | — | |||
| Mejoría endoscópica-remisión histológicaf | 36 (16) | 10 (9) | 7% (1%, 14%)j | — | — | — | |||
| Respuesta clínicag | 138 (62) | 46 (41) | 21% (10%, 32%)k | — | — | — | |||
| n | 289 | 144 | |||||||
| Estudio de fase 3 de inducción y mantenimiento con un diseño de tratamiento continuo (treat-through) (ELEVATE UC 52) (fig. 2)33 | 433 | Primario | • Infecciones: 24,9% (n=72) vs. 22,2% (n=32)• Infecciones graves: 1% (n=3) vs. 3% (n=5)• Herpes zóster: 1% (n=2) vs. 0%• Bradicardia sinusal: 0 vs. 0%• Bradicardia: 1% (n=4) vs. 0%• Bloqueo AV 1.er grado: <1% (n=1) vs. 0%• Bloqueo AV 2.o grado: <1% (n=1) vs. 0%• Edema macular: <1% (n=1) vs. 0% | ||||||
| Remisión clínicab | 74 (27) | 10 (7) | 20% (13%, 27%)k | 88 (32) | 9 (7) | 25% (18%, 32%)k | |||
| Secundarios | |||||||||
| Mejoría endoscópicac | 96 (35) | 19 (14) | 21% (13%, 29%)k | 102 (37) | 14 (10) | 27% (19%, 34%)k | |||
| Normalización endoscópicad | 40 (15%) | 6 (4%) | 10,2% (4,7-15,7)m | 72 (26%) | 8 (6%) | 20,4% (13,8-27,0)ñ | |||
| Remisión sintomáticae | 126 (46) | 29 (22) | 25% (15%, 34%)k | 119 (43) | 25 (19) | 25% (16%, 34%)k | |||
| Mejoría endoscópica-remisión histológicaf | 58 (21) | 6 (4) | 17% (11%, 23%)k | 73 (27) | 11 (8) | 18% (11%, 25%)k | |||
| Respuesta clínicag | 171 (62) | 46 (34) | 28% (19%, 38%)k | 132 (48) | 31 (23) | 25% (16%, 34%)k | |||
| Remisión clínica sin corticosteroidesh | 88 (32) | 9 (7) | 25% (18%, 32%)k | ||||||
| Remisión clínica mantenidai | 49 (18) | 3 (2) | 16% (11%, 21%)k | ||||||
IC: intervalo de confianza.
La remisión clínica se definió como una subpuntuación de número de deposiciones de 0 (o 1 con una disminución de ≥1 punto desde la visita basal), una subpuntuación de de 0 y una subpuntuación endoscópica ≤1 (excluyendo la friabilidad).
La remisión sintomática se definió como una subpuntuación de número de deposiciones de 0 (o 1 con una disminución de ≥1 punto desde la visita basal) y una subpuntuación de sangrado rectal de 0.
La mejoría endoscópica-remisión histológica (EIHR) (también denominada «cicatrización de la mucosa») se definió como una subpuntuación endoscópica ≤1 (excluyendo friabilidad) con remisión histológica (puntuación del índice de Geboes<2,0, lo que indica que no hay neutrófilos en las criptas epiteliales o lámina propia, no hay aumento de eosinófilos y no hay destrucción de criptas, erosiones, ulceraciones o tejido de granulación).
La respuesta clínica se definió como una disminución de ≥2 puntos y ≥30% desde la visita basal en la puntuación Clínica de Mayo modificada, y una disminución de ≥1 punto desde la visita basal en la subpuntuación de sangrado rectal o una subpuntuación de sangrado rectal absoluta ≤1.
La remisión clínica sin corticosteroides se definió como la remisión clínica en la semana 52 sin recibir corticosteroides durante al menos 12 semanas antes de la semana 52.
Los pacientes incluidos presentaban características clínicas y demográficas basales similares en los 2 grupos de tratamiento. La duración media de la enfermedad fue de 7 años, el 33% tenían pancolitis, el 60% colitis izquierda y el 7% proctitis ulcerosa aislada; y la puntuación media del MMS fue de 735. El 30% de los pacientes en ELEVATE UC 52 y el 33% en ELEVATE UC 12 habían recibido previamente biológicos o iJAK y el 33% recibían corticoides al inicio de ambos estudios33.
Eficacia clínicaLos ensayos clínicos de fase 3 confirmaron la superioridad de etrasimod sobre placebo en el tratamiento de inducción a las 12 semanas y el mantenimiento de la remisión clínica hasta la semana 52 en los pacientes con CU de moderada a grave (tabla 2).
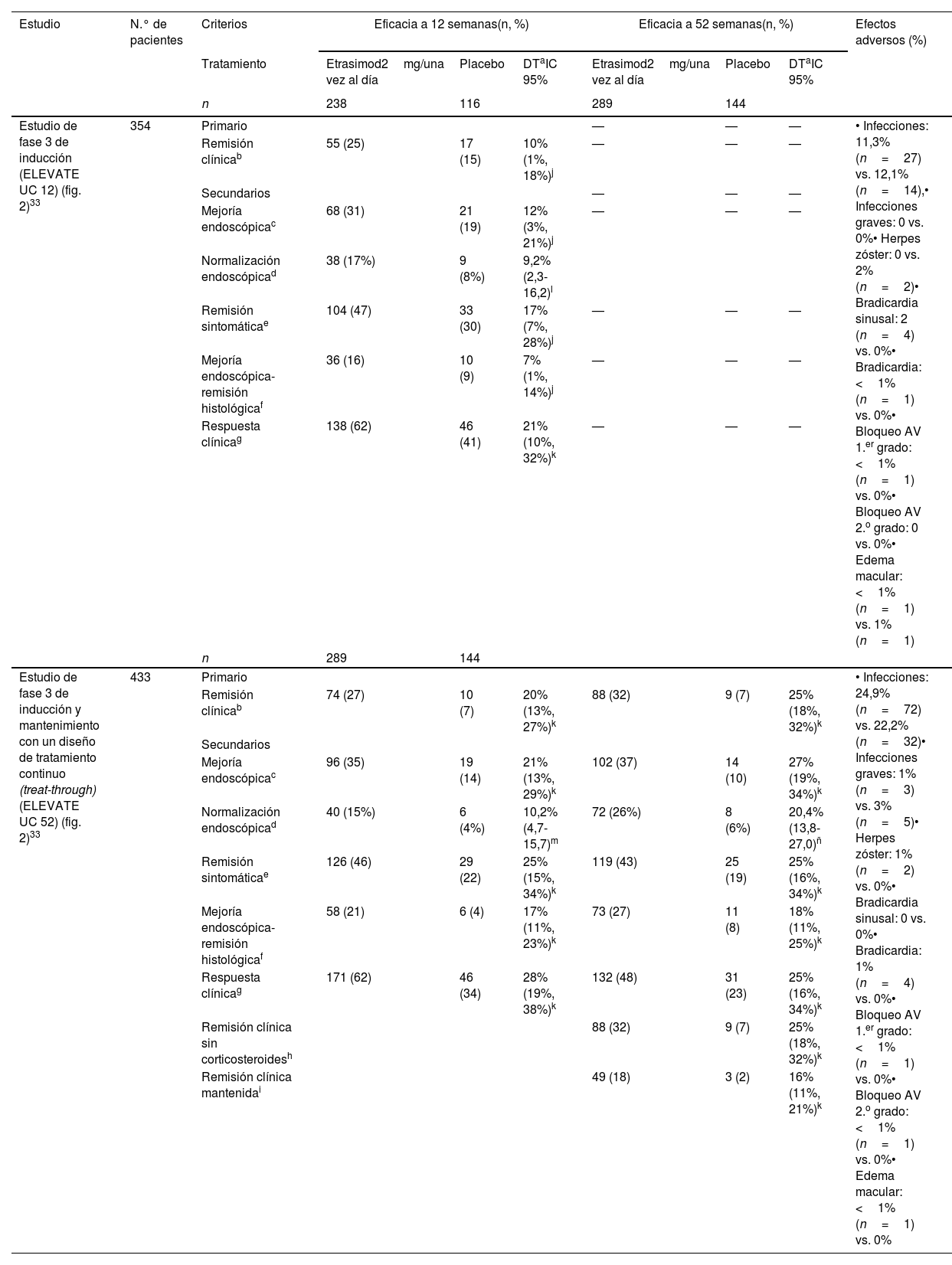
Eficacia del tratamiento de inducción a 12 semanasEn el estudio ELEVATE UC 52, una proporción significativamente mayor de pacientes en el grupo de etrasimod 2mg/una vez al día logró la remisión clínica en comparación con los pacientes en el grupo de placebo al finalizar el período de inducción de 12 semanas (27 vs. 7%; p<0,0001). También se observaron diferencias estadísticamente significativas con etrasimod frente a placebo en criterios como la mejoría endoscópica (35 vs. 14%), normalización endoscópica (15 vs. 4%), remisión sintomática (46 vs. 21%) y EIHR (21 vs. 4%)33 (tabla 2).
En el estudio ELEVATE UC 12, el 25% de los pacientes en el grupo de etrasimod alcanzaron la remisión clínica en comparación con el 15% de los pacientes en el grupo de placebo al final del período de inducción de 12 semanas (p=0,026). Además, se observó una mejoría estadísticamente significativa con etrasimod 2mg/una vez al día en comparación con placebo en los criterios de valoración secundarios, como la mejoría endoscópica (31 vs. 19%), normalización endoscópica (17 vs. 8%), remisión sintomática (47 vs. 30%) y EIHR (16 vs. 9%)33 (tabla 2).
Tiempo de inicio rápido de la respuesta a etrasimodEn ambos estudios se observó un alivio rápido de los síntomas36. Las diferencias entre los grupos de tratamiento fueron significativas desde el día 2 para la respuesta sintomática [disminución ≥30% respecto al valor basal en el RBS/SFS (del inglés rectal bleeding subscore/stool frequency subscore) y desde el día 11 para la remisión sintomática. El porcentaje de pacientes que lograron la remisión del sangrado rectal y la normalización de la frecuencia de deposiciones fue mayor en los pacientes que recibieron etrasimod en comparación con placebo, siendo estas diferencias estadísticamente significativas a partir del día 15 para el sangrado rectal y del día 3 para la frecuencia de deposiciones36.
Efecto de etrasimod sobre la disminución del recuento de linfocitosDe acuerdo con el mecanismo de acción de etrasimod, el recuento medio de linfocitos en la semana 2 en pacientes tratados con este fármaco disminuyeron una media del 50% con respecto a los valores basales, manteniéndose estables durante el seguimiento de los estudios ELEVATE UC 52 y ELEVATE UC 1233. Además, del total de los pacientes que recibieron etrasimod y completaron cualquiera de los estudios, pero no continuaron el tratamiento en el estudio de extensión abierto (n=31), el recuento absoluto de linfocitos volvió al rango normal en el 83% de los pacientes después de 52 semanas de tratamiento en estudio ELEVATE UC 52 y en el 77% de los pacientes después de 12 semanas de tratamiento en el estudio ELEVATE UC 12 a las 2 semanas tras haber suspendido el tratamiento33.
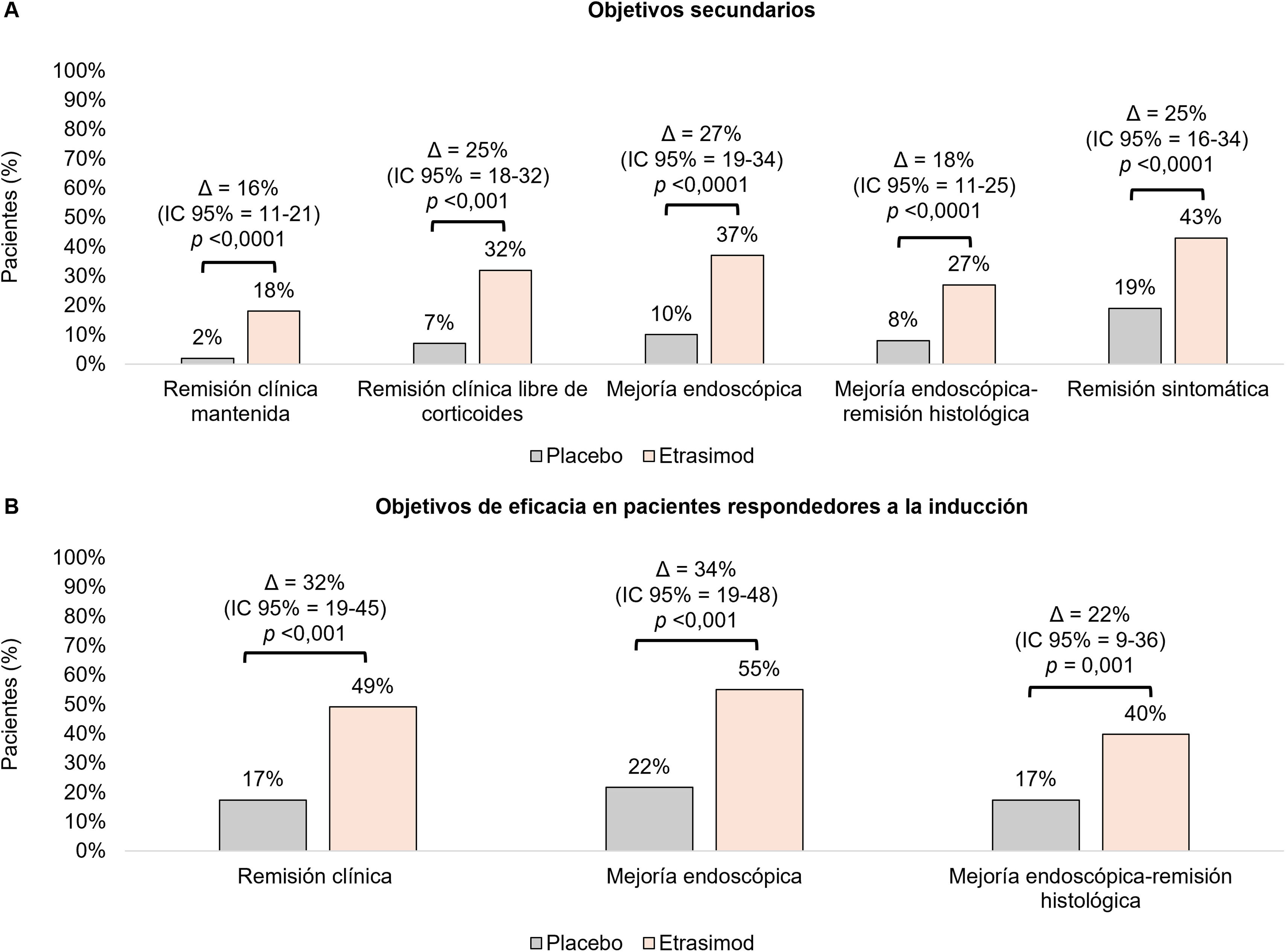
Eficacia del tratamiento de mantenimiento con etrasimod a las 52 semanasEn el estudio de mantenimiento (ELEVATE UC 52), una proporción significativamente mayor de pacientes en el grupo de etrasimod logró la remisión clínica en comparación con los pacientes del grupo de placebo al finalizar el período de 52 semanas de seguimiento (32 vs. 7%; p<0,0001). También se cumplieron los criterios de valoración secundarios clave de eficacia, mejoría endoscópica (37 vs. 10%), remisión clínica mantenida (18 vs. 2%), remisión sintomática (43 vs. 19%), EIHR (27 vs. 8%) y remisión libre de corticoides (32 vs. 7%)33 (tabla 2) (fig. 3A). Finalmente, cabe destacar que todos los pacientes que lograron la remisión clínica a la semana 52 permanecieron libres de corticoides durante 12 semanas.
A) Remisión clínica mantenida, remisión clínica libre de corticoides, mejoría endoscópica, mejoría endoscópica/remisión histológica y remisión sintomática a las 52 semanas en el estudio ELEVATE UC 52. B) Eficacia de etrasimod en la semana 52, en los pacientes que alcanzaron la respuesta clínica a las 12 semanas en el estudio ELEVATE UC 52 (pacientes respondedores)31,33. IC: intervalo de confianza.
En un análisis post hoc del estudio ELEVATE UC 52 se analizó la remisión clínica, la remisión libre de corticoides, la mejoría endoscópica, la EIHR y la remisión sintomática en la semana 52 en pacientes con un MMS basal de 5-9 independientemente de si alcanzaron o no los criterios de respuesta clínica en la semana 1222.
Entre los pacientes que respondieron al tratamiento de inducción en la semana 12, los tratados con etrasimod tuvieron una mayor tasa de remisión clínica a la semana 52 frente a placebo (49,1 vs. 17,4%; p<0,001), observándose resultados similares en todos los demás criterios de valoración de eficacia en la semana 52 (p<0,05) (fig. 3B). Estos resultados pueden ayudar a contextualizar la eficacia de etrasimod a 52 semanas con la de tratamientos que utilizaron diseños de realeatorización de pacientes respondedores.
Eficacia de etrasimod en función de los tratamientos previosEl ensayo ELEVATE UC 52 contó con la participación de pacientes previamente expuestos a biológicos o iJAK en un tercio de los casos. Un 22% habían recibido previamente fármacos anti-TNF; un 11% anti-integrina; un 7% iJAK y un y 2% anti-IL12/2333,37. En el ELEVATE UC 12, por otro lado, los pacientes previamente expuestos a estos fármacos representaron también un tercio38.
Los pacientes expuestos previamente a un biológico/iJAK presentaban en mayor medida pancolitis y un MMS de 7-9, y una duración más larga de la enfermedad, todo ello en comparación con aquellos que no habían recibido un tratamiento previo con dichos fármacos («pacientes bio/iJAK-naïve»)38. Los efectos del tratamiento con etrasimod se observaron de forma estadística- y clínicamente significativa en ambos grupos, en comparación con placebo, tanto en el periodo de inducción como en el mantenimiento, con un perfil de seguridad similar. En el ELEVATE UC 52, el 31% de los pacientes bio/iJAK-naïve y el 17% de los expuestos alcanzó la remisión clínica en la semana 12, en comparación con el 10 y el 2% de los pacientes tratados con placebo. A las 52 semanas, las tasas de remisión clínica fueron del 37% en el grupo bio/iJAK-naïve y del 21% entre los expuestos, frente al 7,5 y al 5% de aquellos tratados con placebo en cada grupo. En el ELEVATE UC 12, el 28% de los pacientes bio/iJAK-naïve tratados con etrasimod alcanzó la remisión clínica, en comparación con el 16% que la alcanzó en el grupo placebo. Entre los participantes del ELEVATE UC 12 previamente expuestos a biológicos/iJAK se observaron mejoras numéricas en todas las variables de eficacia, y resultados estadísticamente significativos en la respuesta clínica38.
Al comparar los efectos de etrasimod en pacientes expuestos a uno o a 2 o más biológicos/iJAK, se observaron, en la semana 12 y 52, mayores tasas de remisión clínica, respuesta clínica, mejoría endoscópica y remisión clínica sin corticoides en aquellos expuestos a un solo fármaco biológico/iJAK38. Estos resultados son consistentes con los observados cuando otras terapias avanzadas se han empleado en pacientes con CU previamente expuestos a más de un fármaco biológico39.
Eficacia de etrasimod en los pacientes con proctitis aisladaEl manejo de los pacientes con proctitis puede llegar a ser difícil. Habitualmente se les excluye de los ensayos clínicos de fase 3, a pesar de que la proctitis puede tener una notable influencia negativa en la calidad de vida40,41 y es muy frecuente que los pacientes con proctitis no controlada desarrollen formas más extensas de la enfermedad42
Los estudios ELEVATE UC 52 y 12 permitieron la inclusión de pacientes con proctitis aislada (con afectación rectal <10cm) siempre que cumplieran todos los demás criterios de inclusión y con un reclutamiento limitado al 15%. Se llevó a cabo un análisis de los 64 participantes (42 y 22, que recibieron etrasimod y placebo respectivamente) con proctitis aislada en la semana 12, procedentes de ambos estudios, y 36 participantes (27 y 9, que recibieron etrasimod y placebo, respectivamente) en la semana 52 procedentes del estudio ELEVATE UC 5219.
Una mayor proporción de pacientes con proctitis aislada tratados con etrasimod en comparación con placebo (p<0,05) lograron, en la semana 12, la remisión clínica (43 vs. 14%, respectivamente), mejoría endoscópica (52 vs. 23%), remisión sintomática (52 vs. 23%), EIHR (38 vs. 14%) y respuesta clínica (71 vs. 41%)43.
En la semana 52 en el estudio ELEVATE UC 52 se observó que un 44 y un 56% de los pacientes tratados con etrasimod alcanzó la remisión clínica y la remisión sintomática, respectivamente, frente al 11% que logró ambos tipos de remisión en el grupo placebo43.
Calidad de vida y resultados comunicados por los pacientes tratados con etrasimodLos pacientes tratados con etrasimod mostraron una mayor mejoría desde la visita basal en el Inflammatory Bowel Disease Questionnaire total y las puntuaciones de sus 4 dominios al final de la fase de inducción de 12 semanas y de la fase de mantenimiento de 52 semanas, en comparación con placebo. Estos hallazgos demuestran los beneficios de etrasimod en la calidad de vida relacionada con la salud específica de la enfermedad y respaldan los hallazgos clínicos del programa ELEVATE44.
Además, etrasimod mejoró los síntomas relacionados con la proctitis aislada, como el sangrado rectal en la semana 2 y la urgencia dentro de las 12 semanas de tratamiento, cuando se realizó la evaluación más temprana19.
Diferencias entre etrasimod y otras terapias avanzadasActualmente disponemos de 7 biológicos y 3 iJAK que han demostrado ser efectivos en el tratamiento de la CU de moderada a grave y que cuentan con la aprobación de la European Medicines Agency.
Los biológicos son anticuerpos monoclonales con una acción selectiva sobre su molécula diana. Debido a que son anticuerpos modificados, pueden inducir cierta inmunogenicidad (fundamentalmente los fármacos anti-TNF)5, lo que puede estar relacionado con su pérdida de respuesta y, por tanto, la necesidad de su uso concomitante con inmunosupresores (p. ej., tiopurinas), con el consiguiente aumento del riesgo de eventos adversos, o con intensificaciones en su posología13,18,45,46. Se estima que el 50% de los pacientes que reciben anti-TNF presentan una pérdida de respuesta con el tiempo47,48; la tasa de incidencia de pérdida de respuesta con vedolizumab en los pacientes con CU es del 18-39% a los 6-12 meses de seguimiento49, o del 40% por paciente/año de seguimiento50 y, finalmente, al menos un 35% de los pacientes tratados con ustekinumab requieren un aumento de dosis por pérdida de respuesta51.
Por otro lado, los iJAK no producen esta inmunogenicidad, aunque sí precisan con cierta frecuencia un incremento de la dosis durante el mantenimiento para mantener la eficacia10. Además, aunque los iJAK y los moduladores del S1PR como etrasimod son actualmente las únicas terapias avanzadas orales disponibles para la CU de moderada a grave, los iJAK tienen una serie de recomendaciones específicas para ser utilizados únicamente cuando no se disponga de las alternativas terapéuticas adecuadas en ciertos grupos de población52–54.
Etrasimod es una molécula pequeña (<1kDa) rápidamente absorbida después de su administración oral. No se han detectado diferencias clínicamente significativas en los pacientes tratados con etrasimod en función del sexo, la edad y el peso corporal, por lo que no hay ninguna indicación para ajustar la dosis en función del peso, solo una precaución respecto a su uso en los pacientes con un peso inferior a 40kg23. A diferencia de los biológicos, etrasimod tiene una vida media corta (t1/2: 30h), y su metabolización da lugar a la producción del compuesto original y a metabolitos menores no activos23,55.
El tratamiento con etrasimod se inicia con una dosis de 2mg una vez al día durante el periodo de inducción, sin necesidad de titulación, y se mantiene con la misma dosis a lo largo del periodo de mantenimiento33. La vía de administración oral, que comparte con los iJAK, constituye una ventaja para el paciente, especialmente en comparación con los biológicos que requieren su administración por vía intravenosa o subcutánea56. En comparación con los agentes que requieren una administración intravenosa, las moléculas pequeñas como etrasimod evitan la necesidad de visitas frecuentes al hospital, lo que ofrece una mayor comodidad y flexibilidad para el paciente. Además, su administración oral tiene un impacto económico positivo, al reducir los costes asociados con las visitas programadas y eliminar la necesidad de contar con personal especializado en infusiones.
Posicionamiento de etrasimod en la colitis ulcerosaEtrasimod es una nueva alternativa de terapia avanzada para el tratamiento de los pacientes a partir de los 16 años con CU activa de moderada a grave. Su administración oral y su posología de una vez al día podrían asociarse con un buen cumplimiento terapéutico por parte de los pacientes. Etrasimod actúa inhibiendo la salida de linfocitos de los ganglios linfáticos hacia la circulación sanguínea, un mecanismo de acción eficaz y novedoso para reducir la inflamación intestinal, como lo confirman los resultados clínicos obtenidos en los estudios ELEVATE32. En dichos estudios se ha observado que el 27% de los pacientes tratados con etrasimod alcanza la remisión clínica en la semana 12. Además, etrasimod ha demostrado ser más eficaz que el placebo en lograr la mejoría endoscópica y la EIHR, así como en alcanzar la remisión clínica sostenida y libre de esteroides, consolidando así su eficacia integral en diversos aspectos del manejo de la CU, al igual que otras terapias avanzadas. La eficacia clínica de etrasimod frente a placebo ha sido similar en los pacientes bio/iJAK-naïve y en aquellos expuestos a un tratamiento previo con biológicos o iJAK, tanto durante la fase de inducción como en la de mantenimiento, aunque como ocurre con otras terapias avanzadas, el beneficio terapéutico fue menos consistente en los pacientes previamente expuestos33. Por este motivo, etrasimod podría considerarse como una opción de primera línea en el tratamiento de la CU de moderada a grave.
Etrasimod ha demostrado una capacidad de respuesta rápida, evidenciándose diferencias significativas frente a placebo desde el día 2 para la respuesta sintomática, el día 3 para la disminución en la frecuencia de deposiciones, el día 11 para la remisión sintomática y el día 15 para la desaparición del sangrado rectal33,36.
Etrasimod es la primera terapia sistémica que incluyó en sus estudios de fase 3 a pacientes con CU de moderada a grave con proctitis aislada, mejorando la frecuencia de deposiciones y el sangrado rectal en la semana 219. Esto es relevante si tenemos en cuenta que, según datos del registro ENEIDA57, un 18% de los pacientes con CU presentan proctitis, y de ellos un 10% son refractarios al tratamiento con aminosalicilatos y corticoides, lo que requiere la administración de fármacos inmunosupresores (inmunomoduladores, biológicos o moléculas pequeñas)57.
A pesar de todo lo anterior, etrasimod no está libre de limitaciones, dada su reciente aprobación y la ausencia de datos publicados sobre sus efectos en CU en vida real, experiencia con la que sí cuentan otros fármacos. Los estudios en marcha y futuros sobre la eficacia y la seguridad de etrasimod en diferentes poblaciones de pacientes y con tiempos de seguimiento prolongados permitirán responder con evidencia científica a esta limitación.
ConclusionesLos resultados de los ensayos clínicos de fase 3 sobre etrasimod, los ELEVATE UC, han demostrado de forma concluyente su superioridad frente a placebo, tanto en la inducción como en el mantenimiento de la remisión clínica en los pacientes con CU activa de moderada a grave. Además, con ellos se han evidenciado beneficios significativos en aspectos tan relevantes como la mejoría endoscópica, la remisión sintomática, la EIHR y la remisión libre de corticoides. Estos hallazgos han resultado ser extensibles a distintas subpoblaciones de pacientes, y destacan particularmente en aquellas que plantean un desafío en la práctica clínica, como ocurre en los pacientes previamente expuestos a biológicos/iJAK o en aquellos con proctitis aislada (una condición que frecuentemente queda excluida de los ensayos clínicos y cuya carga sintomática afecta profundamente a la calidad de vida de los pacientes). Por otro lado, la administración oral de etrasimod supone una ventaja sobre otras terapias para la CU, lo que en última instancia podría favorecer la adherencia al tratamiento y reducir la necesidad de visitas programadas y el requerimiento de personal especializado en infusiones. Por último, la eficacia de etrasimod no se ve afectada por la inmunogenicidad, una limitación frecuente de los fármacos biológicos disponibles. Por todo lo anterior, etrasimod asocia una serie de características que lo diferencian de otras terapias avanzadas y que hacen que se perfile como una alternativa terapéutica innovadora y atractiva para el tratamiento de los pacientes con CU de moderada a grave.
Conflicto de interesesLos autores han recibido honorarios por su asesoramiento científico y contribución en la publicación. Javier P. Gisbert ha recibido honorarios por labores de asesoramiento científico y recibido soporte económico para investigación o actividades formativas por parte de MSD, Abbvie, Pfizer, Kern Pharma, Biogen, Mylan, Takeda, Janssen, Roche, Sandoz, Celgene/Bristol Myers, Gilead/Galapagos, Lilly, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Norgine y Vifor Pharma. María Chaparro ha recibido honorarios como ponente o asesor, o financiación para proyectos educativos y de investigación por parte de MSD, Abbvie, Hospira, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Biogen, Gilead y Lilly.
FinanciaciónEsta publicación fue financiada por Pfizer España.
El soporte de redacción médica a los autores durante la elaboración de este manuscrito, de acuerdo con las buenas prácticas de publicación, fue dado por Beatriz Albuixech-Crespo, PhD, y Javier Arranz-Nicolás, PhD (Medical Statistics Consulting, S. L., Valencia, España). Los autores quieren asimismo agradecer la participación de Mónica Valderrama por la recopilación inicial de toda la información disponible y de Michelle Segovia, John Woolcott y Ana Cábez, empleados de Pfizer España, en la revisión del documento.