La sensibilidad y especificidad de las técnicas de diagnóstico para la enfermedad de Chagas dependen en gran parte de los antígenos y las dianas utilizadas y de la respuesta inmunológica y las características de la infección de la población donde se aplica, de allí la necesidad de la evaluación de las técnicas de diagnóstico disponibles en un área determinada, por lo que el objetivo de este trabajo fue evaluar dos estuches comerciales para el diagnóstico inmunológico y molecular de la enfermedad de Chagas en zonas endémicas de Venezuela.
MétodosSe evaluaron los estuches: Chagas ELISA IgG+IgM® y Speed Oligo Chagas® (Vircell®, Granada, España). Se valoraron con 129 muestras (35 de pacientes en fase aguda, 33 en fase crónica, 31 de pacientes con otras enfermedades y 30 de individuos sanos). Se compararon los resultados con los obtenidos en las pruebas convencionales ELISA y PCR-ADN satélite de Trypanosoma cruzi.
ResultadosCon Chagas ELISA IgG+IgM® se obtuvo una sensibilidad de 94,1% y especificidad de 93,4%, con Speed Oligo Chagas® se obtuvo una sensibilidad de 92,6% y especificidad de 100%, valores similares a los obtenidos con ELISA y PCR-ADNsat convencionales.
ConclusiónLa sensibilidad y especificidad de los estuches comerciales evaluados los hacen adecuados para el diagnóstico de la enfermedad de Chagas en zonas endémicas de Venezuela.
The sensitivity and specificity of diagnostic techniques for Chagas disease depend largely on the antigens and targets used and on the immune response and characteristics of the infection of the population where it is applied, hence the need for evaluation of the diagnostic techniques available in a given area. So, the objective of this work was to evaluate two commercial kits for the immunological and molecular diagnosis of Chagas disease in endemic areas of Venezuela.
MethodsThe evaluated kits were: Chagas ELISA IgG+IgM® and Speed Oligo Chagas® (Vircell®, Granada, Spain). They were evaluated with 129 samples (35 from patients in the acute phase, 33 in the chronic phase, 31 from patients with other diseases, and 30 from healthy individuals). The results were compared with those obtained in the conventional ELISA and PCR-satellite DNA tests for Trypanosoma cruzi.
ResultsWith Chagas ELISA IgG+IgM® a sensitivity of 94.1% and specificity of 93.4% were obtained, with Speed Oligo Chagas® a sensitivity of 92.6% and specificity of 100% were achieved, values similar to those showed by conventional ELISA and satDNA-PCR.
ConclusionThe sensitivity and specificity of the commercial kits evaluated make them suitable for the diagnosis of Chagas disease in endemic areas of Venezuela.
La enfermedad de Chagas está causada por el hemoflagelado Trypanosoma cruzi (T. cruzi) y se transmite a mamíferos a través del contacto con heces infectadas de triatominos. La enfermedad presenta una fase aguda, con abundante parasitemia, seguida de una recuperación o del establecimiento de una fase crónica, con una parasitemia leve y una clínica que va desde asintomática hasta una enfermedad con síntomas cardiológicos, digestivos y neurológicos con riesgo de fallecimiento. Actualmente, entre 6 y 7 millones de personas tienen la enfermedad y 25 millones están en riesgo de infección1. En Venezuela en los últimos años se han descrito aumentos en la incidencia y prevalencia2–5, comunicaciones de casos agudos6, aumento de seropositivos en bancos de sangre7 y brotes de transmisión oral8–10.
El diagnóstico se realiza generalmente por métodos parasitológicos e inmunológicos. Las técnicas parasitológicas pueden tener baja sensibilidad cuando la carga parasitaria es baja. Aunque muchas de las técnicas que se están utilizando actualmente para el diagnóstico de la enfermedad de Chagas tienen buena especificidad, estas podrían presentar algunas reacciones cruzadas con otros parásitos relacionados, siendo muy importante su evaluación sobre todo en áreas coendémicas para enfermedad de Chagas/leishmaniasis. La técnica de reacción en cadena de la polimerasa (PCR) detecta secuencias específicas de ADN del parásito, siendo útil para el diagnóstico. Aunque también tiene algunas limitaciones, tiene ventajas, en casos agudos, transmisión congénita, inmunodeficiencias y en la evaluación del tratamiento11,12.
Existe consenso en recomendar dos técnicas, sugiriéndose una tercera prueba en caso de discrepancia13. En Venezuela, el diagnóstico se realiza comúnmente en centros públicos y privados utilizando principalmente pruebas comerciales y la verificación se realiza generalmente por Laboratorios de Referencia, dándose el caso de resultados discrepantes en pacientes diagnosticados en estos centros, con respecto a los de los Laboratorios de Referencia7.
Debido a esta problemática el propósito del trabajo fue evaluar dos estuches comerciales (ELISA y PCR, Vircell®, Granada, España), comparando la eficacia diagnóstica con el ELISA y PCR caseros de nuestro laboratorio (Laboratorio de Referencia para el diagnóstico de la enfermedad de Chagas en la zona Central de Venezuela).
MétodosSe evaluaron 129 muestras de sangre y suero: 35 de pacientes en fase aguda, 33 en fase crónica, 31 de pacientes con otras enfermedades (leishmaniasis visceral, n=11, leishmaniasis cutánea, n=10, malaria, n=5, y toxoplasmosis, n=5) y 30 de individuos sanos. Todas las muestras fueron cedidas por dos Laboratorios de Referencia para el diagnóstico de la enfermedad de Chagas de la zona Central de Venezuela y estaban confirmadas previamente mediante diagnóstico clínico, métodos parasitológicos (extendido de sangre coloreado, xenodiagnóstico y hemocultivo) e inmunodiagnóstico mediante ensayo inmunoenzimático (ELISA), hemaglutinación indirecta e inmunofluorescencia indirecta. El protocolo de trabajo fue aprobado por el Comité de Bioética del BIOMED-UC y todos los individuos habían firmado el consentimiento informado aceptando el uso de sus muestras para diagnóstico e investigación.
Se realizó un ELISA casero utilizando el antígeno de Maeckelt de T. cruzi, como ha sido descrito14 y el ELISA comercial de Chagas ELISA IgG+IgM® (Vircell®, Granada, España) siguiendo las instrucciones del fabricante15.
A partir de las muestras de sangre detalladas anteriormente, se efectuó la extracción de ADN, utilizando la resina Chelex® 100 (BioRad, Hercules CA, EE. UU.) como se ha descrito14. Posteriormente, se realizó la prueba de PCR para la detección de ADN satélite de T. cruzi16, empleando los cebadores: TcZ1 (directo) 5‘-CGAGCTCTTGCCCACACGGGTGCT-3‘y TcZ2 (reverso) 5‘-CCTCCAAGCAGCGGATAGTTCAGG-3‘. Las reacciones de amplificación y observación de los resultados por electroforesis en geles de agarosa se realizaron según los protocolos descritos14. Además, se realizó la prueba de PCR para la detección de ADN satélite de T. cruzi y el revelado del producto según el protocolo descrito por la casa comercial Speed Oligo Chagas® (Vircell®, Granada, España)15.
Se compararon los resultados obtenidos de las pruebas de ELISA y PCR, caseras y comerciales (Vircell®, Granada, España). Los resultados se ordenaron en tablas de contingencia y se calcularon los índices diagnósticos, sensibilidad y especificidad y la concordancia con el diagnóstico de referencia (gold standar o estándar de diagnóstico). El diagnóstico de referencia se estableció como un diagnóstico compuesto por varias pruebas (parasitológicas e inmunológicas) siguiendo los criterios de la OMS13 y OPS17,18. Se determinó el índice kappa calculado mediante el programa Stat Xact 8.0 para Windows para estimar la concordancia entre los resultados.
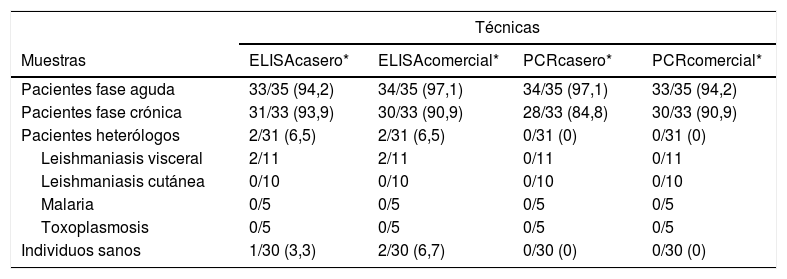
ResultadosLas muestras positivas de fase aguda dieron mejores resultados en todas las pruebas (inmunológicas y moleculares, tanto caseras como comerciales), que las muestras positivas de fase crónica. Solo se observaron 3 falsos positivos en el caso del ELISA casero (2 correspondieron a individuos con leishmaniasis visceral y uno correspondió a un individuo sano) y 4 en el ELISA comercial (2 correspondieron a los mismos individuos con leishmaniasis visceral y 2 correspondieron a individuos sanos, uno de ellos, el positivo al ELISA casero). En las técnicas moleculares (PCR), tanto la casera como la comercial, no se observaron falsos positivos (tabla 1 y tabla suplementaria 1 del Anexo Appendix B).
Detección de anticuerpos anti-Trypanosoma cruzi mediante ELISA casero y ELISA comercial y detección de ADN de T. cruzi mediante PCR casero y PCR comercial, en muestras de pacientes con enfermedad de Chagas en fase aguda y crónica, pacientes con otras enfermedades parasitarias (heterólogos) e individuos sanos
| Técnicas | ||||
|---|---|---|---|---|
| Muestras | ELISAcasero* | ELISAcomercial* | PCRcasero* | PCRcomercial* |
| Pacientes fase aguda | 33/35 (94,2) | 34/35 (97,1) | 34/35 (97,1) | 33/35 (94,2) |
| Pacientes fase crónica | 31/33 (93,9) | 30/33 (90,9) | 28/33 (84,8) | 30/33 (90,9) |
| Pacientes heterólogos | 2/31 (6,5) | 2/31 (6,5) | 0/31 (0) | 0/31 (0) |
| Leishmaniasis visceral | 2/11 | 2/11 | 0/11 | 0/11 |
| Leishmaniasis cutánea | 0/10 | 0/10 | 0/10 | 0/10 |
| Malaria | 0/5 | 0/5 | 0/5 | 0/5 |
| Toxoplasmosis | 0/5 | 0/5 | 0/5 | 0/5 |
| Individuos sanos | 1/30 (3,3) | 2/30 (6,7) | 0/30 (0) | 0/30 (0) |
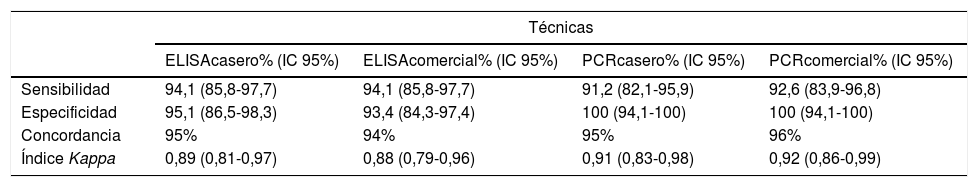
Por otro lado, en cuanto a los índices diagnósticos, los mejores valores de sensibilidad se obtuvieron en la técnica de ELISA, tanto casero como comercial (94,1%). Por el contrario, la especificidad fue mayor en la técnica de PCR, tanto la casera como la comercial (100%) (tabla 2). Se observó una concordancia elevada entre todas las pruebas evaluadas y el diagnóstico de referencia, siendo la mayor concordancia con la PCR comercial (96%) y la menor con el ELISA comercial (94%) por lo que se obtuvieron índices kappa de 0,92 y 0,88, respectivamente. Estos índices kappa señalan una concordancia casi perfecta (tabla 2).
Índices diagnósticos y concordancia de las pruebas de ELISA casero, ELISA comercial, PCR casero y PCR comercial para el diagnóstico de la enfermedad de Chagas
| Técnicas | ||||
|---|---|---|---|---|
| ELISAcasero% (IC 95%) | ELISAcomercial% (IC 95%) | PCRcasero% (IC 95%) | PCRcomercial% (IC 95%) | |
| Sensibilidad | 94,1 (85,8-97,7) | 94,1 (85,8-97,7) | 91,2 (82,1-95,9) | 92,6 (83,9-96,8) |
| Especificidad | 95,1 (86,5-98,3) | 93,4 (84,3-97,4) | 100 (94,1-100) | 100 (94,1-100) |
| Concordancia | 95% | 94% | 95% | 96% |
| Índice Kappa | 0,89 (0,81-0,97) | 0,88 (0,79-0,96) | 0,91 (0,83-0,98) | 0,92 (0,86-0,99) |
La enfermedad de Chagas en Venezuela (controlada en el pasado), se considera actualmente una de las muchas enfermedades reemergentes, en la situación de salud altamente deteriorada en el país4. En los últimos años se ha venido presentando un aumento de la incidencia y prevalencia (demostrado por los últimos estudios epidemiológicos2,3,5), la comunicación de casos agudos6, el aumento de seropositivos en bancos de sangre7 y numerosos brotes por transmisión oral8–10. La prevalencia real de la enfermedad de Chagas en el país es muy difícil de estimar por la irregularidad y múltiples problemas con el Programa Nacional de Control de la enfermedad de Chagas. Algunos estudios de ciertas zonas del país describen seroprevalencias entre 10-12%5. Es por ello que, en este contexto, donde existen diferencias entre los resultados de los diversos centros de diagnóstico y los de los laboratorios de referencia5,7, se hace necesaria evaluación y comparación de la capacidad diagnóstica de las distintas técnicas empleadas.
Debido a los posibles problemas de sensibilidad y especificidad de algunas pruebas en ciertos escenarios, la OMS/OPS recomiendan para la confirmación de los casos agudos el uso de pruebas parasitológicas/moleculares y en pacientes con sospecha de infección crónica el uso del «estándar de diagnóstico» (al menos dos pruebas de principios distintos y una tercera técnica ante casos de discrepancia). Además, se aconseja el uso de ELISA en los estudios poblacionales sobre la prevalencia de la enfermedad de Chagas, y usar ELISA (estuches altamente sensibles) para el tamizaje de la infección crónica por T. cruzi en los servicios de banco de sangre17,18.
En este trabajo se evaluaron dos estuches comerciales; Chagas ELISA IgG+IgM® (Vircell®, Granada, España) y Speed Oligo Chagas® (Vircell®, Granada, España) y se compararon con el ELISA y la PCR caseras que se realizan en el laboratorio. La principal diferencia entre las pruebas está en que el ELISA casero emplea el antígeno de Maeckelt de T. cruzi (extracto proteico total del parásito), mientras que el ELISA comercial contiene los antígenos recombinantes ampliamente valorados para diagnóstico; FRA, B13 y MACH (PEP2 TcD TcE y SAPA)15. Sin embargo, no hubo diferencia en la sensibilidad y la ligera diferencia en especificad no fue significativa. Por otro lado, en cuanto al diagnóstico molecular la diana de amplificación es la misma; ADN satélite de T. cruzi tanto para la PCR casera como la comercial, la diferencia está en el método de detección, que en la PCR casera es por electroforesis en geles de agarosa, teñidos con bromuro de etidio, mientras que, en la PCR comercial es por hibridación del producto de PCR en una tira reactiva, lo que quizás hizo a esta última ligeramente más sensible (aunque no significativamente) que la PCR casera. Por otro lado, la especificidad de ambas PCR fue la misma, lo cual era de esperar al tener la misma diana de amplificación.
Existen estudios publicados de valoración de estuches comerciales donde la mayoría de los estuches presentan sensibilidad por encima de 98% y muy pocos por debajo de ese valor. En cuanto a la especificidad, la mayoría presenta valores mayores al 96-97%, revelando los estuches con antígenos recombinantes mejores valores en cuanto a especificidad17–20. En el presente trabajo, entre los falsos positivos, 2 correspondieron a individuos con leishmaniasis visceral y 2 a individuos sanos (quienes quizás pudieron haber tenido alguna infección inaparente o debido a memoria inmunológica por infecciones pasadas y superadas, aunque no consta en sus historias clínicas). Aunque para la especificidad se toma en cuenta el total de muestras que deberían ser negativas, es necesario hacer estudios posteriores con mayor número de muestras de leishmaniasis en zonas coendémicas, ya que incluso se ha comunicado la presencia de coinfección en estas zonas21,22.
Es muy importante tener en cuenta el contexto epidemiológico en el cual se evalúan las técnicas de diagnóstico, ya que por ejemplo, en este trabajo se muestra que la serología detecta un mayor número de casos en fase aguda que en fase crónica, no siendo lo común en la mayoría de las situaciones epidemiológicas. Esto podría explicarse por la situación sanitaria actual de Venezuela, ya que muchos estudios muestran que las infecciones metaxénicas reemergentes, controladas en el pasado, han aumentado su incidencia y prevalencia2–6. Estos datos sugieren que en Venezuela la transmisión de T. cruzi es altamente activa, y por ello no se observa diferencia entre las dos fases.
Por otro lado, se ha descrito la persistencia del parásito en pacientes considerados en fase crónica y fallos en tratamiento, donde se observa persistencia parasitaria aún varios años después de tratados y de que los síntomas de fase aguda habían desaparecido23. El seguimiento de los brotes de enfermedad de Chagas por transmisión oral ha mostrado un 70% de persistencia de la infección, seis años después de tratamiento parasiticida9. Esto es compatible con lo reflejado en los resultados de PCR en fase crónica, donde el valor de sensibilidad es similar al de la fase aguda, lo cual no es común en la mayoría de los casos, donde la sensibilidad de la PCR para la amplificación de ADN satélite (una de las dianas más utilizadas a nivel mundial) está alrededor de 50% en fase crónica24. Por lo que, en esta situación, la definición de fase aguda y fase crónica se hace complicada. De allí la necesidad de evaluar las técnicas de diagnóstico en cada contexto particular.
La evaluación del estuche comercial de ELISA Vircell® solo se ha publicado en un trabajo de grado25 y en un estudio de la OMS para la validación de estándares biológicos internacionales26, obteniendo valores de sensibilidad y especificidad similares a los obtenidos en el presente trabajo. No existen publicaciones sobre el estuche Speed Oligo Chagas® (Vircell®, Granada, España).
Los índices diagnósticos de los estuches comerciales evaluados resultaron ser similares a los obtenidos por las pruebas caseras y son adecuados para el diagnóstico de la enfermedad de Chagas en zonas endémicas de Venezuela. En el caso de Speed Oligo Chagas® (Vircell®, Granada, España) se evita el uso de sustancias peligrosas como bromuro de etidio en la PCR convencional, la cual es utilizada en algunos centros de referencia de Venezuela.
FinanciaciónEste trabajo fue financiado por: Proyecto DIPISA-PG-2017-004, Universidad de Carabobo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.