Los fabricantes del test Platelia™ Aspergillus recomiendan repetir todas aquellas muestras positivas para la detección de galactomanano.
ObjetivosEvaluación de los resultados de la repetición del test Platelia™ Aspergillus en muestras inicialmente positivas y su correlación con estudios clínico-microbiológicos.
MétodosSe han estudiado 150 sueros positivos pertenecientes a 92 pacientes, de los cuales 31 (33,6%) tenían más de una muestra positiva. Nueve pacientes fueron diagnosticados de aspergilosis invasiva probable y dos de infección fúngica invasiva probada por Fusarium oxysporum y Scedosporium prolificans.
ResultadosSolamente 35 de los 150 sueros (23,3%) siguieron siendo positivos al repetir el ensayo. La media de la diferencia del índice OD entre las muestras inicialmente positivas y después negativas fue de 0,76. En 3 de los 9 pacientes diagnosticados de aspergilosis invasiva probable se obtuvo negativización de todas las muestras inicialmente positivas al repetir el ensayo.
ConclusionesNuestro estudio muestra una pobre reproducibilidad en los resultados positivos del test Platelia™ Aspergillus. Estos resultados apoyan la necesidad de evaluar una segunda muestra junto a la repetición simultánea de la primera que resultó positiva para reforzar el diagnóstico de infección fúngica invasiva.
The manufacturers of the Platelia™ Aspergillus test recommend retesting every sample with a positive result to galactomannan detection.
AimsTo evaluate the repeated results of the Platelia™ Aspergillus test on initially positive samples, and their association with clinical and microbiological studies.
MethodsA total of 150 positive sera belonging to 92 patients were studied. More than one positive sample was obtained from 31 (33.6%) patients. Nine patients were diagnosed with probable invasive aspergillosis and two with proven Fusarium oxysporum and Scedosporium prolificans invasive fungal infection, respectively.
ResultsOnly 35 out of 150 (23.3%) sera remained positive upon test repetition. The average OD-index difference between the initially positive and subsequently negative samples was 0.76. Sera from 3 patients out of 9 diagnosed with probable invasive aspergillosis yielded negative results after repetition.
ConclusionsOur study shows poor reproducibility of the positive samples for the Platelia™ Aspergillus test. These results reinforce the need to evaluate a second sample and to consider simultaneously repeating the first positive serum to enhance the diagnosis of invasive fungal infection.
En la actualidad, la detección de galactomanano (GM) se realiza con el test Platelia™ Aspergillus (TPA) (Bio-Rad, Marnes-la-Coquette, Francia). Los fabricantes de la prueba recomiendan repetir todas aquellas muestras positivas para la detección de GM.
Los objetivos de nuestro estudio fueron los siguientes: 1) evaluar los resultados de la repetición de muestras positivas obtenidas en nuestro centro durante el periodo comprendido entre enero de 2010 y diciembre de 2011, y 2) buscar la relación entre los resultados obtenidos y el diagnóstico de infección fúngica invasiva (IFI) basados en los criterios de la European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Disease Mycoses Study Group3 o la presencia de factores que puedan explicar posibles reacciones cruzadas o falsos positivos de la técnica.
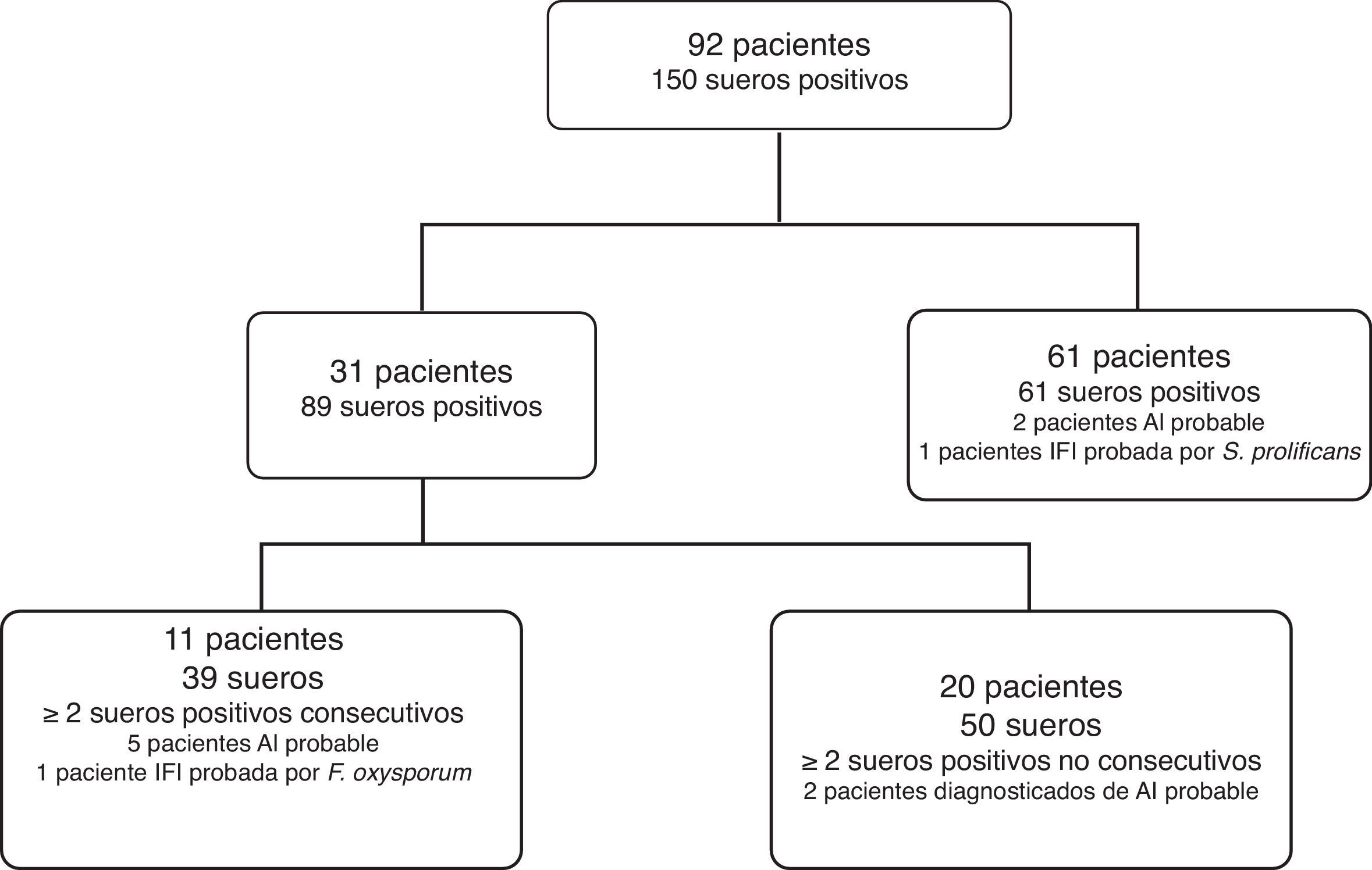
Durante el periodo de estudio se realizaron en nuestro servicio 4.273 determinaciones de GM. En 171 (4%) muestras se obtuvo un resultado de GM positivo (índice de densidad óptica [OD]≥0,5). Ciento cincuenta sueros fueron recuperados para el estudio, los cuales pertenecían a 92 pacientes, entre los que se incluían 82 enfermos oncohematológicos adultos, 6 pacientes oncohematológicos menores de 18 años, un paciente infectado por el VIH con una masa en el seno maxilar, una paciente candidata a trasplante pulmonar con imágenes nodulares y cavitadas en la TAC y cultivos positivos para Aspergillus fumigatus en muestras respiratorias, un paciente con lupus eritematoso sistémico con imágenes nodulares en la TAC y un paciente en el que no fue posible obtener los datos clínicos por pertenecer a otro centro. Treinta y un pacientes (33,6%) tenían más de una muestra positiva. Nueve pacientes fueron diagnosticados de aspergilosis invasiva (AI) probable y dos de IFI probada por Fusarium oxysporum y Scedosporium prolificans (fig. 1).
Tras la realización del test inicial, una alícuota procedente del tubo primario se conservó congelada a −80°C hasta su segundo procesamiento (entre una semana y 23 meses), realizado bajo las condiciones de rutina de nuestro laboratorio. Se revisaron las historias clínicas de los pacientes y se valoraron los siguientes factores como responsables potenciales de falsos positivos o de reacción cruzada en el momento de la extracción4,6,10,11: edad inferior a los 18 años, tratamiento con piperacilina/tazobactam o amoxicilina/ácido clavulánico, enfermedad injerto contra huésped, bacteriemia e infección por Penicillium spp., Alternaria spp., Paecilomyces spp., Fusarium spp., Histoplasma capsulatum, Geotrichum capitatum o Candida spp. Para la comparación del tiempo medio de congelación en función del resultado de la repetición y el tipo de factores y diagnóstico de IFI se utilizó la prueba U de Mann-Whitney de muestras independientes. Para la comparación de proporciones se utilizó el test de Chi2.
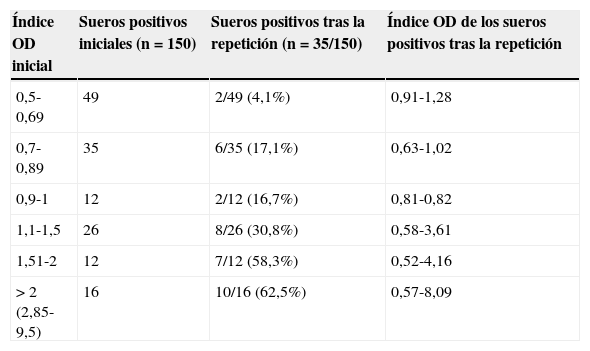
Los resultados del estudio tras la repetición del test se muestran en las tablas 1 y 2. Solamente 35 de 150 (23,3%) sueros siguieron siendo positivos, y en 14 de ellos el índice OD tras la repetición fue superior al inicial (rango 0,04-2,47). La media de la diferencia del índice OD entre las muestras inicialmente positivas y después negativas fue de 0,76 (rango 0,13-2,09). En 43 de los 92 pacientes (46,7%) con un total de 72 muestras inicialmente positivas no se encontró ninguno de los factores evaluados que pudieran ser responsables de un resultado positivo. En la repetición del test, 6 de esos 72 sueros (8,3%) permanecieron positivos. Respecto a los resultados obtenidos en las muestras de pacientes con factores relacionados con la positividad del test, de las 10 muestras inicialmente positivas de los pacientes menores de 18 años, todas excepto una resultaron negativas; la muestra positiva pertenecía a un paciente con bacteriemia por Staphylococcus epidermidis. Se constató tratamiento con piperacilina/tazobactam (compuesto genérico) en 14 pacientes con 16 muestras inicialmente positivas, y en las 16 muestras el resultado de la repetición del test fue negativo. Otros catorce pacientes con 20 muestras inicialmente positivas fueron diagnosticados de enfermedad injerto contra huésped, y solamente 2 de las muestras permanecieron positivas. El paciente infectado por el VIH fue diagnosticado de linfoma de Burkitt y el suero presentó un índice OD de 4,45, que fue confirmado como positivo en la repetición con un resultado de 4,79. Se encontró como posible factor de riesgo la inhalación y probable deglución de harina de cereales tras haber trabajado el día anterior, de forma ocasional, como cocinero en una pizzería. Los sueros extraídos posteriormente como control resultaron negativos. Un total de 7 pacientes presentaron bacteriemia el mismo día de la extracción del suero inicialmente positivo, 4 pacientes con S. epidermidis, 2 pacientes con Escherichia coli y un paciente con Staphylococcus haemolyticus. En 4 pacientes con bacteriemia, 2 por S. epidermidis, 1 por S. haemolyticus y 1 por E. coli, respectivamente, el resultado del test repetido fue negativo.
Valores iniciales del índice de densidad óptica del test de galactomanano en muestras positivas y valores posteriores tras la repetición del ensayo
| Índice OD inicial | Sueros positivos iniciales (n=150) | Sueros positivos tras la repetición (n=35/150) | Índice OD de los sueros positivos tras la repetición |
|---|---|---|---|
| 0,5-0,69 | 49 | 2/49 (4,1%) | 0,91-1,28 |
| 0,7-0,89 | 35 | 6/35 (17,1%) | 0,63-1,02 |
| 0,9-1 | 12 | 2/12 (16,7%) | 0,81-0,82 |
| 1,1-1,5 | 26 | 8/26 (30,8%) | 0,58-3,61 |
| 1,51-2 | 12 | 7/12 (58,3%) | 0,52-4,16 |
| >2 (2,85-9,5) | 16 | 10/16 (62,5%) | 0,57-8,09 |
Índice OD: rango del índice de densidad óptica.
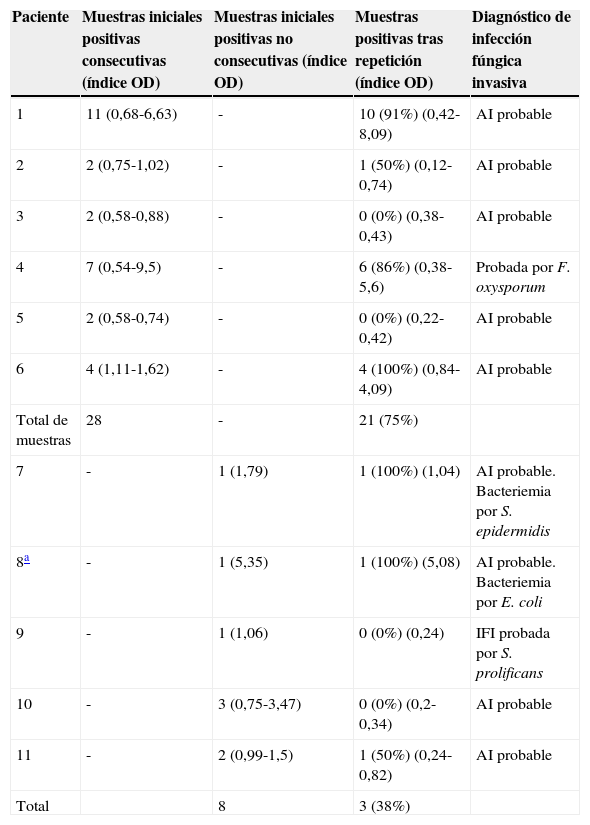
Resultados en pacientes con diagnóstico de infección fúngica invasiva
| Paciente | Muestras iniciales positivas consecutivas (índice OD) | Muestras iniciales positivas no consecutivas (índice OD) | Muestras positivas tras repetición (índice OD) | Diagnóstico de infección fúngica invasiva |
|---|---|---|---|---|
| 1 | 11 (0,68-6,63) | - | 10 (91%) (0,42-8,09) | AI probable |
| 2 | 2 (0,75-1,02) | - | 1 (50%) (0,12-0,74) | AI probable |
| 3 | 2 (0,58-0,88) | - | 0 (0%) (0,38-0,43) | AI probable |
| 4 | 7 (0,54-9,5) | - | 6 (86%) (0,38-5,6) | Probada por F. oxysporum |
| 5 | 2 (0,58-0,74) | - | 0 (0%) (0,22-0,42) | AI probable |
| 6 | 4 (1,11-1,62) | - | 4 (100%) (0,84-4,09) | AI probable |
| Total de muestras | 28 | - | 21 (75%) | |
| 7 | - | 1 (1,79) | 1 (100%) (1,04) | AI probable. Bacteriemia por S. epidermidis |
| 8a | - | 1 (5,35) | 1 (100%) (5,08) | AI probable. Bacteriemia por E. coli |
| 9 | - | 1 (1,06) | 0 (0%) (0,24) | IFI probada por S. prolificans |
| 10 | - | 3 (0,75-3,47) | 0 (0%) (0,2-0,34) | AI probable |
| 11 | - | 2 (0,99-1,5) | 1 (50%) (0,24-0,82) | AI probable |
| Total | 8 | 3 (38%) |
AI: aspergilosis invasiva; Índice OD: rango del índice de densidad óptica; IFI: infección fúngica invasiva.
En la tabla 2 se muestran los resultados en pacientes diagnosticados de IFI. Estos presentan la mayor proporción de muestras positivas tras la repetición del test si los comparamos con el resto de los pacientes no diagnosticados de IFI, siendo esta diferencia estadísticamente significativa (Chi2=49,722; p≤0,0001).
Al analizar estadísticamente el tiempo medio de congelación en función del resultado de la repetición y el tipo de factores y diagnóstico de IFI, se observó que el tiempo de congelación no influyó en los resultados (edad<18 años, p=1; enfermedad injerto contra huésped, p=1; bacteriemia, p=0,5; diagnóstico de IFI, p=1; pacientes sin factores de riesgo, p=0,274).
Pocos estudios han comprobado los resultados de la repetición del TPA cuando se obtiene un resultado positivo. En concreto, 4 estudios recientes al respecto indican entre un 40 y un 69% de negatividad tras la repetición del test en una muestra inicialmente positiva2,5,8,9. En nuestro estudio, de 150 sueros se ha obtenido un 76,7% de negatividad, lo que expresa una escasa reproducibilidad de la prueba en muestras positivas. Esta situación plantea un problema para la interpretación de los resultados en pacientes con sospecha de IFI, ya que en nuestro estudio se diagnosticaron casos de IFI probable en pacientes en los que todas o parte de sus muestras inicialmente positivas resultaron negativas al repetir el test. Desde que en 2007 Maertens et al.7 demostraran que el mayor rendimiento diagnóstico se obtenía con dos muestras consecutivas con índice OD≥0,5, esta pauta es la utilizada por la mayoría de los profesionales. No obstante, se recomienda que en el caso de obtener un índice OD≥0,7 en una primera muestra, se sospeche de AI sin esperar a la segunda muestra positiva1. Esta última recomendación plantearía la necesidad de repetir el test en muestras inicialmente positivas hasta tres veces en caso de disparidad de resultados tras la primera repetición.
La bacteriemia parece ser un factor de falsa positividad en 3 de nuestros 7 pacientes (2 S. epidermidis y 1 E. coli), ya que el resto de los sueros que fueron extraídos fuera del periodo de bacteriemia fueron negativos. La deglución de cereales y el posible paso de sus componentes a la sangre en pacientes con mucositis es un factor de riesgo descrito que podría explicar el alto valor positivo confirmado en el paciente con VIH de nuestro estudio, en quien no se encontró otro factor que explicara estos índices3; la negatividad fue obtenida en sueros posteriores una vez apartado de su lugar de trabajo. Los resultados de nuestro estudio parecen confirmar la reacción cruzada de GM con los antígenos de F. oxysporum11.
Al evaluar la relación entre el valor del índice OD inicial y la persistencia de positividad en la repetición del test, se observó una relación altamente significativa entre ambas variables (Chi2=33,941; p<0,0001), con un aumento del porcentaje de positividad a medida que aumenta el índice OD.
Una explicación a los resultados obtenidos podría ser la gran facilidad de producirse una contaminación selectiva de los pocillos. Como se ha detallado anteriormente, no influye el tiempo de congelación en el porcentaje de negatividad.
En resumen, nuestros resultados apoyan la necesidad de evaluar una segunda muestra tras un primer resultado positivo, tal y como está establecido en la práctica clínica1,7, y de considerar la repetición, de forma simultánea, de la primera muestra positiva. Un resultado positivo de ambas, obtenido bajo las mismas condiciones de procesamiento, reforzaría el diagnóstico de IFI teniendo en cuenta la valoración clínica del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la contribución de la Dra. Trinidad Dierssen Sotos (Universidad de Cantabria) en la realización del análisis estadístico del estudio.