Analizar del 2002 al 2013 los datos de la vigilancia de los serotipos y sensibilidad antimicrobiana de los aislamientos invasivos de Haemophilus influenzae (H. influenzae) en niños menores de 60 meses.
Materiales y métodosSe analizaron los datos demográficos, fuente y enfermedad asociada de los aislamientos invasivos de H. influenzae recibidos entre 2002 y 2013. Todos los aislamientos habían sido confirmados bacteriológicamente, tenían el dato del serotipo, el cual fue determinado por el método de aglutinación en lámina y PCR y los patrones de sensibilidad antimicrobiana por concentración inhibitoria mínima a ampicilina, SXT, cloranfenicol, cefuroxima y ceftriaxona. El análisis se realizó por periodos de 3 años.
ResultadosPor enfermedad invasiva el 50,5% eran de pacientes con meningitis, 23,5% de neumonías, 19,5% de sepsis y bacteriemia, 2,0% de otros y 4,5% sin dato. Por procedencia se recibieron de Bogotá y Antioquia 55 aislamientos de cada uno, de Risaralda 24, de Valle 15, de Santander 11 y 40 de 14 departamentos. El serotipo predominante fue el Hib (40,5%), seguido de HiNT (38,0%), Hia (17,5%), Hid (2,0%), Hif (1,5%) y Hie (0,5%). Del total de los aislamientos, 12,0% eran resistentes a ampicilina; 16,5% a SXT; 1,0% a cloranfenicol y 0,5% a ceftriaxona. Todos los aislamientos fueron sensibles a cefuroxima y a rifampicina.
ConclusionesLa vigilancia por el laboratorio es una vigilancia pasiva voluntaria pero, no obstante el número reducido de aislamientos, permite determinar que Hib continúa circulando en esta población y que hay otros serotipos de H. influenzae que causan enfermedad invasiva. Por tanto es necesario mantener y fortalecer la vigilancia de este patógeno.
To analyze 2002-2013 surveillance data on the serotypes and antimicrobial sensitivity of invasive Haemophilus influenzae (H. influenzae) isolates in children younger than 60 months.
Materials and methodsWe analyzed the demographic data, source and associated diseases of invasive HI isolates from cases recorded from 2002-2013. All isolates had been bacteriologically confirmed and had data on their serotype, which was determined by the slide agglutination method and polymerase chain reaction. The antimicrobial sensitivity patterns were determined by minimum inhibitory concentration of ampicillin, trimethoprim-sulfamethoxazole, chloramphenicol, cefuroxime and ceftriaxone. The analysis was conducted in 3-year periods.
ResultsAccording to invasive disease, 50.5% of patients had meningitis, 23.5% had pneumonia, 19.5% had sepsis and bacteremia, 2.0% had other diseases and 4.5% lacked data. By origin, 55 isolates each were received from Bogota and Antioquia, 24 were from Risaralda, 15 were from Valle, 11 were from Santander and 40 came from 14 departments. The predominant serotype was Hib (40.5%), followed by HiNT (38.0%), Hia (17.5%), Hid (2.0%), Hif (1.5%) and Hie (0.5%). Of the total isolates, 12.0% were resistant to ampicillin; 16.5% to trimethoprim-sulfamethoxazole, 1.0% to chloramphenicol and 0.5% to ceftriaxone. All isolates were sensitive to cefuroxime and rifampicin.
ConclusionsLaboratory surveillance is a voluntary passive surveillance; however, the low number of isolates helped determine that Hib continues to circulate in this population and that there are other H. influenzae serotypes that cause invasive disease. Therefore, surveillance of this pathogen needs to be maintained and reinforced.
Haemophilus influenzae (H. influenzae) se encuentra exclusivamente en el tracto respiratorio humano y forma parte de la flora normal1–3. Los aislamientos de H. influenzae encapsulados poseen un polisacárido serológicamente específico, que permite clasificarlos en 6 serotipos, denominados a, b, c, d, e y f (clasificación de Pittman) y que están correlacionados con la virulencia de la bacteria4,5.
H. influenzae serotipo b (Hib) causa enfermedad invasiva como meningitis, neumonía, sepsis, bacteriemia y enfermedad localizada como otitis, conjuntivitis o sinusitis, especialmente en los niños1–3. H. influenzae serotipo a (Hia) es reconocido como un importante patógeno emergente que puede ser considerado el segundo tipo clínicamente más virulento entre los 6 serotipos de Hi. Este serotipo afecta especialmente a los menores de 2 años y se ha demostrado la relación de algunos clones de Hia con enfermedades graves con alta tasa de letalidad6. Otros serotipos como el Hif y el Hie afectan principalmente a los adultos con alguna enfermedad predisponente y, en menor frecuencia, a la población pediátrica7,8.
Algunos aislamientos no poseen cápsula, por lo que no pueden serotipificarse y se los denomina H. influenzae no tipificables (HiNT)9. La implementación de técnicas moleculares que identifican el locus cap del polisacárido capsular ha permitido la diferenciación entre las cepas HiNT de aquellas que tienen un locus capsular parcial o completo10. HiNT es responsable del 20-30% de todos los episodios de otitis media aguda. En estudios realizados en niños con otitis, se encontró que el 50% estaban colonizados por HiNT, a diferencia de los niños sanos, en los que Streptococcus del grupo viridans fue la bacteria más frecuentemente recuperada10.
La vigilancia en Colombia de H. influenzae se inició en el año de 1994 dentro de los programas de la red nacional de laboratorios coordinada por el Grupo de Microbiología del INS y a partir de 1998 esta vigilancia se integró en el proyecto de Sistema de Redes de Vigilancia de los Agentes Bacterianos causantes de Neumonías y Meningitis (SIREVA II) de la Organización Panamericana de la Salud (OPS)11, el cual buscaba proporcionar información oportuna y confiable sobre la circulación de serotipos y sensibilidad antimicrobiana de agentes etiológicos causantes de meningitis bacteriana aguda (MBA) e infección respiratoria aguda (IRA).
El objetivo de este estudio fue analizar los datos de la vigilancia de los serotipos y sensibilidad antimicrobiana de los aislamientos invasivos de H. influenzae, del 2002 al 2013 en los niños menores de 60 meses.
Materiales y métodosSistema de vigilanciaLa vigilancia por laboratorio de la MBA e IRA es una vigilancia pasiva voluntaria que se realiza a través de la red nacional de laboratorios, conformada por las entidades de salud de la red pública y privada y los laboratorios de salud pública (LSP) de los 32 departamentos y distritos, los cuales envían los aislamientos invasivos al Grupo de Microbiología del INS, dentro del proyecto SIREVA/SIREVA II, apoyado por la OPS12.
AislamientosSe analizaron los datos demográficos, fuente y enfermedad asociada de los aislamientos invasivos de H. influenzae recibidos como parte del programa de MBA-IRA del 2002 al 2013, de niños menores de 60 meses13.
Estudios microbiológicosDespués de ser recuperados, los aislamientos habían sido confirmados previamente por el Grupo de Microbiología, por coloración de Gram, por la morfología típica de las colonias en agar chocolate, por requerimiento de factores V y X (Difco) y por producción de porfirinas (Difco)13.
La serotipificación de los aislamientos fue realizada por la técnica de aglutinación en lámina, con antisueros polivalentes y monovalentes (Difco) y la confirmación con la técnica de PCR utilizando los iniciadores VK I y II, que amplifican el gen que le confiere la capacidad de exportar la cápsula, iniciadores OMP II y III que amplifican el gen que codifica la proteína de membrana, exclusivamente de H. influenzae y los iniciadores específicos para cada tipo capsular10,13.
La producción de beta lactamasa fue determinada con el empleo de discos de cefinasa (BBL)13,14. La sensibilidad antimicrobiana se determinó a ampicilina, cloranfenicol, SXT, cefuroxima, ceftriaxona y rifampicina, por los métodos de difusión en disco (Kirby Bauer), en agar Haemophilus test medium (HTM) (Oxoid CM 898), suplementado con hematina y ácido delta-amino-levulínico (NAD) (Oxoid SR158E) y se determinó la concentración inhibitoria mínima (CIM) por el método de microdilución en caldo Mueller-Hinton ajustado con cationes (BBL 12 322) y suplementado con extracto de levadura (Difco 0127-01-7) NAD y hematina; se empleó como cepa de referencia H. influenzae ATCC 49247 y ATCC 49766. Las anteriores técnicas se realizaron e interpretaron de acuerdo con las recomendaciones del Instituto para Estándares del Laboratorio Clínico14.
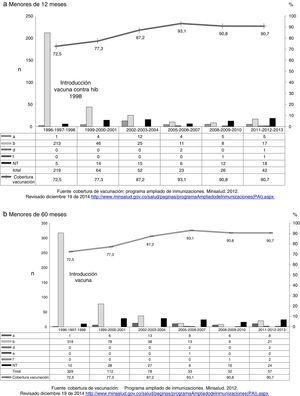
Se revisaron los datos de cobertura de vacunación de Hib, desde su introducción en 1998 hasta el año 2013 y se relacionaron con la frecuencia de aislamiento de Hib para los menores de 60 meses y menores de 12 meses en ese mismo periodo15.
Análisis estadísticoPara el análisis de los datos se agruparon los datos por períodos de 3 años y se clasificaron los aislamientos en los grupos de edad de los pacientes: niños menores o iguales a 2 meses, de 3 a 4 meses, de 5 a 6 meses, de 7 a 11 meses y de 12 a 59 meses; se determinó la frecuencia por procedencia, edad, sexo, tipo de muestra, diagnóstico, serotipo y patrones de sensibilidad antimicrobiana. La evolución de los serotipos se analizó en menores o iguales a 2 meses 3-4 meses y 5-6 meses.
El análisis de los datos se realizó con el programa EPI-Info versión 7. Para determinar las diferencias estadísticas de las prevalencias se utilizó el test de Fisher16.
ResultadosDatos demográficos y clínicosEntre 2002 y 2013 se recibieron 228 aislamientos invasivos de H. influenzae, 82 en el período 2002-2004, 38 del 2005 al 2007, 35 del 2008 al 2010 y 73 del 2011 al 2013, donde se observa un incremento significativo en el número de aislamientos recibidos en el último período comparado con los periodos de 2005-2007 y 2008-2010 (p < 0,05).
Del total de aislamientos recibidos, 200 fueron viables, con una recuperación durante el estudio, de 95,1% (2002-2004), 86,8% (2005-2007), 91,4% (2008-2010) y 78,1% (2011-2013). El 100% de los aislamientos recuperados fueron confirmados como H. influenzae.
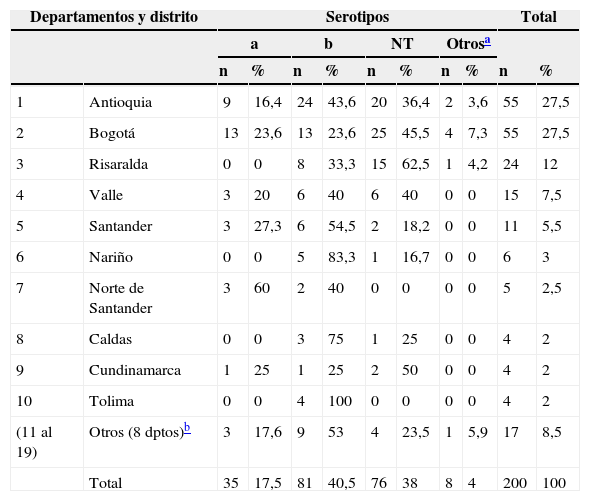
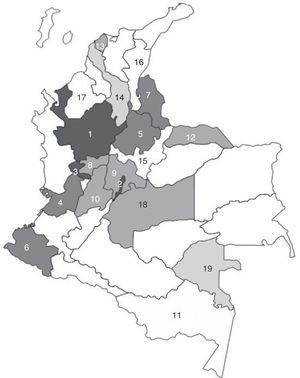
Los 200 aislamientos estudiados fueron remitidos principalmente por los LSP de Bogotá y Antioquia con 55 (27%) aislamientos cada uno, de Risaralda 24 (12%) y de Valle 15 (7,5%) (tabla 1 y fig. 1).
Distribución de los aislamientos de Haemophilus influenzae por procedencia y serotipo, Colombia, 2002-2013
| Departamentos y distrito | Serotipos | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| a | b | NT | Otrosa | ||||||||
| n | % | n | % | n | % | n | % | n | % | ||
| 1 | Antioquia | 9 | 16,4 | 24 | 43,6 | 20 | 36,4 | 2 | 3,6 | 55 | 27,5 |
| 2 | Bogotá | 13 | 23,6 | 13 | 23,6 | 25 | 45,5 | 4 | 7,3 | 55 | 27,5 |
| 3 | Risaralda | 0 | 0 | 8 | 33,3 | 15 | 62,5 | 1 | 4,2 | 24 | 12 |
| 4 | Valle | 3 | 20 | 6 | 40 | 6 | 40 | 0 | 0 | 15 | 7,5 |
| 5 | Santander | 3 | 27,3 | 6 | 54,5 | 2 | 18,2 | 0 | 0 | 11 | 5,5 |
| 6 | Nariño | 0 | 0 | 5 | 83,3 | 1 | 16,7 | 0 | 0 | 6 | 3 |
| 7 | Norte de Santander | 3 | 60 | 2 | 40 | 0 | 0 | 0 | 0 | 5 | 2,5 |
| 8 | Caldas | 0 | 0 | 3 | 75 | 1 | 25 | 0 | 0 | 4 | 2 |
| 9 | Cundinamarca | 1 | 25 | 1 | 25 | 2 | 50 | 0 | 0 | 4 | 2 |
| 10 | Tolima | 0 | 0 | 4 | 100 | 0 | 0 | 0 | 0 | 4 | 2 |
| (11 al 19) | Otros (8 dptos)b | 3 | 17,6 | 9 | 53 | 4 | 23,5 | 1 | 5,9 | 17 | 8,5 |
| Total | 35 | 17,5 | 81 | 40,5 | 76 | 38 | 8 | 4 | 200 | 100 | |
NT: no tipificable.
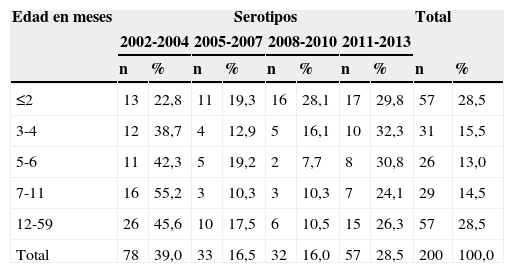
La distribución de los aislamientos recuperados por período y grupos de edad se encuentra en la tabla 2. El mayor número de aislamientos era de niños menores o iguales a 2 meses con 57 (28,5%) aislamientos. La distribución por sexo mostró que 120 (60,6%) eran niños, 78 (39,4%) eran niñas y 2 pacientes no tenían dato de sexo.
Distribución de los aislamientos de Haemophilus influenzae por grupos de edad y período estudiado, Colombia, 2002-2013
| Edad en meses | Serotipos | Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2002-2004 | 2005-2007 | 2008-2010 | 2011-2013 | |||||||
| n | % | n | % | n | % | n | % | n | % | |
| ≤2 | 13 | 22,8 | 11 | 19,3 | 16 | 28,1 | 17 | 29,8 | 57 | 28,5 |
| 3-4 | 12 | 38,7 | 4 | 12,9 | 5 | 16,1 | 10 | 32,3 | 31 | 15,5 |
| 5-6 | 11 | 42,3 | 5 | 19,2 | 2 | 7,7 | 8 | 30,8 | 26 | 13,0 |
| 7-11 | 16 | 55,2 | 3 | 10,3 | 3 | 10,3 | 7 | 24,1 | 29 | 14,5 |
| 12-59 | 26 | 45,6 | 10 | 17,5 | 6 | 10,5 | 15 | 26,3 | 57 | 28,5 |
| Total | 78 | 39,0 | 33 | 16,5 | 32 | 16,0 | 57 | 28,5 | 200 | 100,0 |
Se recuperaron 98 (49%) aislamientos de hemocultivos, 90 (45%) de líquido cefalorraquídeo, 7 (3,5%) de líquido cefalorraquídeo y hemocultivos y 5 (2,5%) de líquido pleural. Por enfermedad invasiva, 101 (50,5%) aislamientos eran de pacientes con meningitis, 47 (23,5%) de neumonías, 39 (19,5%) de sepsis y bacteriemia, 4 (2,0%) de otras enfermedades invasivas y 9 (4,5%) no tenían dato. La meningitis se presentó con mayor frecuencia en cada uno de los grupos de edad.
Datos microbiológicos y relación con los datos demográficosLa distribución por procedencia y serotipo se encuentra en la tabla 1 y figura 1, donde se observa que Hib fue menos frecuente en Bogotá (23,6%), comparado con Antioquia (43,6%) (p=0,02) y HiNT fue más frecuente en Risaralda (62,5%) que en Antioquia (36,4%) (p=0,03).
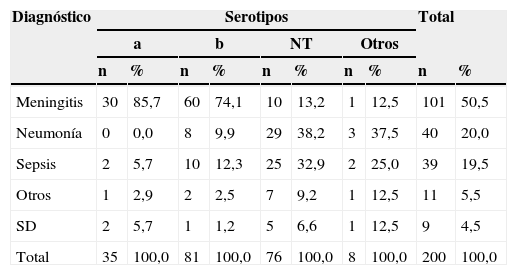
Con respecto a la distribución de los aislamientos de H. influenzae por serotipos y diagnóstico (tabla 3), se observó que el predominante fue Hib con 81 (40,5%) aislamientos, que se asoció principalmente con meningitis, seguido de HiNT con 76 (38,0%) que causaba especialmente neumonía y sepsis. La concordancia de la serotipificación con la prueba confirmatoria de PCR fue del 100%.
Distribución de los aislamientos de Haemophilus influenzae por diagnóstico y serotipo en <60 meses, Colombia, 2002-2013
| Diagnóstico | Serotipos | Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| a | b | NT | Otros | |||||||
| n | % | n | % | n | % | n | % | n | % | |
| Meningitis | 30 | 85,7 | 60 | 74,1 | 10 | 13,2 | 1 | 12,5 | 101 | 50,5 |
| Neumonía | 0 | 0,0 | 8 | 9,9 | 29 | 38,2 | 3 | 37,5 | 40 | 20,0 |
| Sepsis | 2 | 5,7 | 10 | 12,3 | 25 | 32,9 | 2 | 25,0 | 39 | 19,5 |
| Otros | 1 | 2,9 | 2 | 2,5 | 7 | 9,2 | 1 | 12,5 | 11 | 5,5 |
| SD | 2 | 5,7 | 1 | 1,2 | 5 | 6,6 | 1 | 12,5 | 9 | 4,5 |
| Total | 35 | 100,0 | 81 | 100,0 | 76 | 100,0 | 8 | 100,0 | 200 | 100,0 |
NT: no tipificable; SD: sin dato.
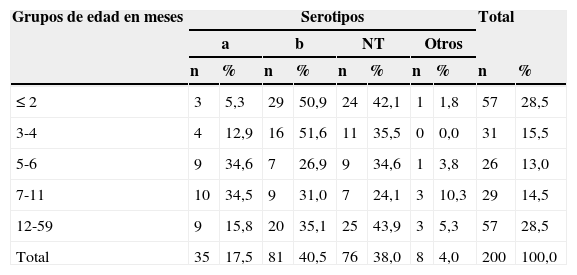
En los grupos de ≤2 meses y 3-4 meses, el serotipo predominante fue Hib con 29 (50,9%) y 16 (51,6%) respectivamente, a diferencia de los niños de 12 a 59 meses, grupo en el cual HiNT fue el más frecuente con 25 (43,9%) (tabla 4). Las diferencias no fueron significativas.
Distribución de los aislamientos de Haemophilus influenzae por serotipo y grupos de edad, Colombia, 2002-2013
| Grupos de edad en meses | Serotipos | Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| a | b | NT | Otros | |||||||
| n | % | n | % | n | % | n | % | n | % | |
| ≤ 2 | 3 | 5,3 | 29 | 50,9 | 24 | 42,1 | 1 | 1,8 | 57 | 28,5 |
| 3-4 | 4 | 12,9 | 16 | 51,6 | 11 | 35,5 | 0 | 0,0 | 31 | 15,5 |
| 5-6 | 9 | 34,6 | 7 | 26,9 | 9 | 34,6 | 1 | 3,8 | 26 | 13,0 |
| 7-11 | 10 | 34,5 | 9 | 31,0 | 7 | 24,1 | 3 | 10,3 | 29 | 14,5 |
| 12-59 | 9 | 15,8 | 20 | 35,1 | 25 | 43,9 | 3 | 5,3 | 57 | 28,5 |
| Total | 35 | 17,5 | 81 | 40,5 | 76 | 38,0 | 8 | 4,0 | 200 | 100,0 |
NT: no tipificable.
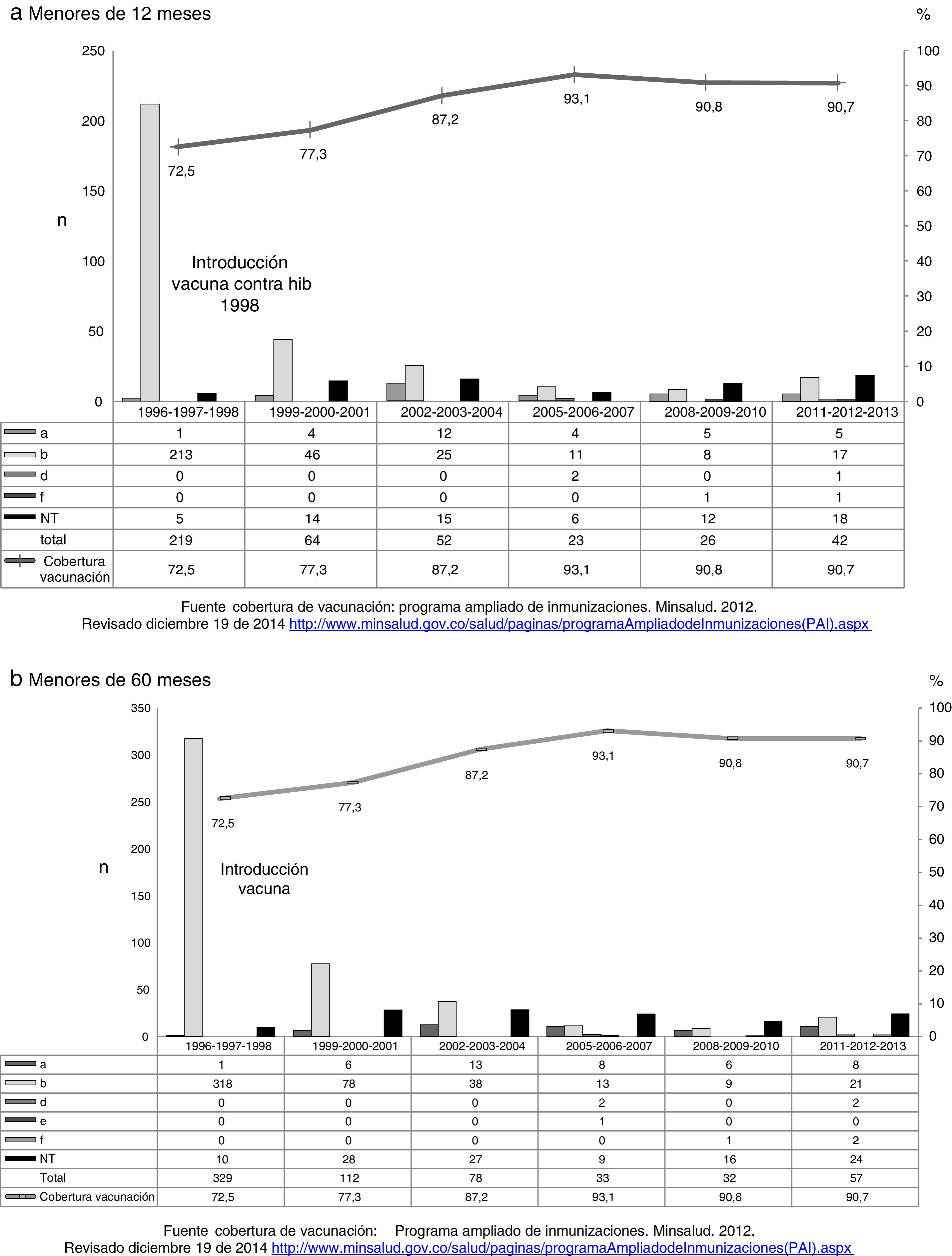
En la figura 2a y b se observa el número de aislamientos de H. influenzae, por serotipos y años de vigilancia en menores de 12 meses y menores de 60 meses y las coberturas de vacunación Hib para los mismos años y grupos de edad. En el período antes de la vacunación, los aislamientos de Hib en los menores de 12 meses representaban el 97,3%; después de la vacunación, con coberturas cerca del 91%, la distribución de los aislamientos de Hib en los períodos analizados, 2002-2004, 2005-2007, 2008-2010 y 2011-2013, fue de 48,1, 47,8, 32,0 y 40,1%, respectivamente; es importante resaltar que aunque para el último período no se incrementó significativamente la frecuencia, se observó un incremento en el número de aislamientos Hib. Los datos son similares para los menores de 60 meses.
De igual manera, antes de la vacunación, los aislamientos HiNT, en los menores de 12 meses, representaban el 2,2% y en los períodos posvacuna analizados representaron el 28,8, 26,1 48 y 42,9%, indicando un incremento significativo en los 2 últimos períodos (p < 0,001) y un incremento del 50% en número de aislamientos recibidos en el último período; en los menores de 60 meses la situación fue similar (fig. 2a y 2b).
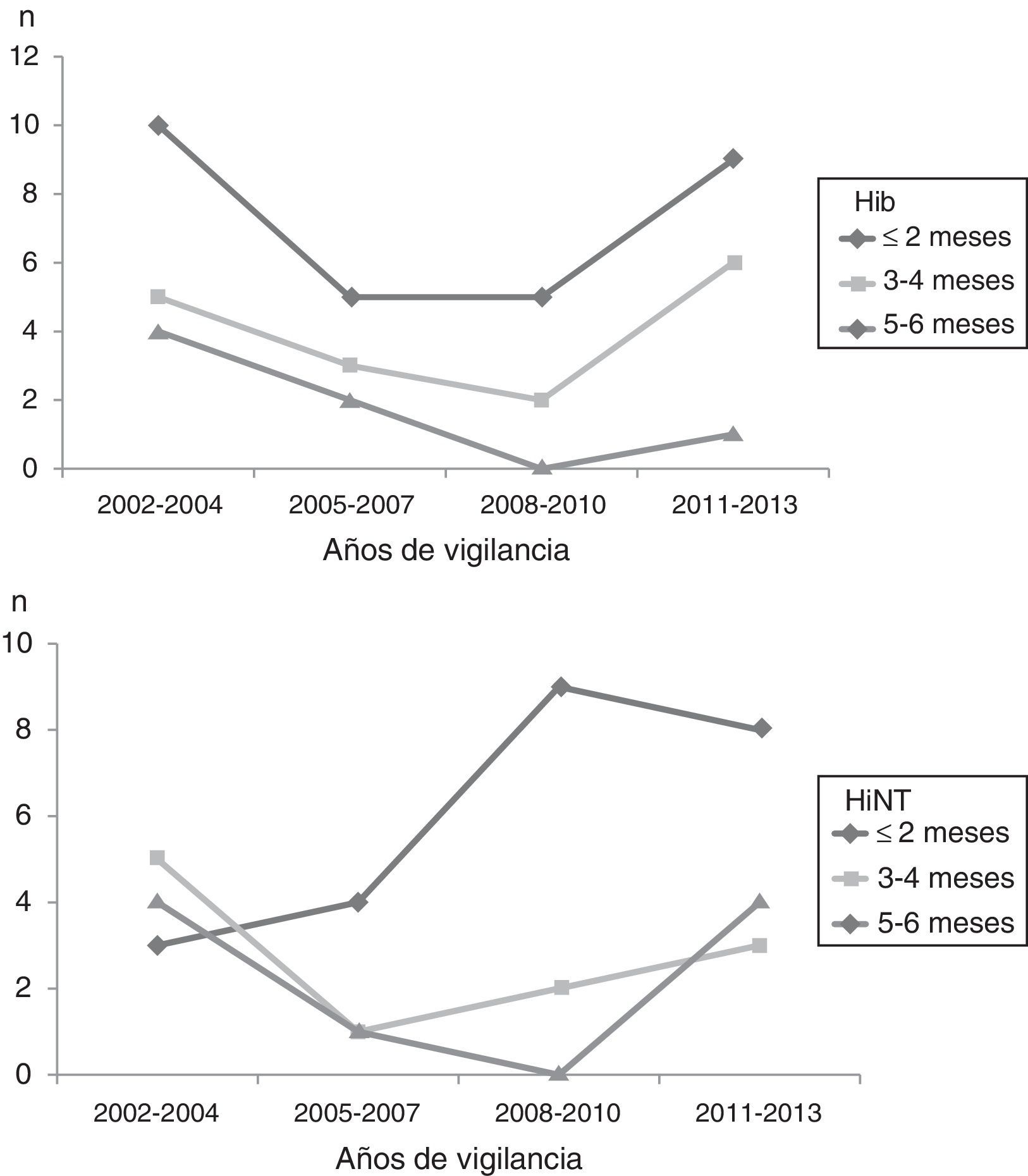
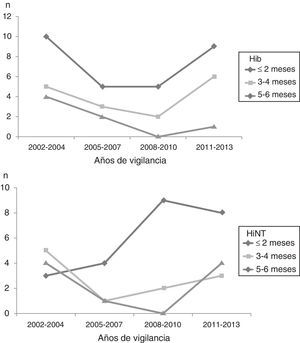
En la figura 3 se observa la evolución de Hib y HiNT por período de vigilancia y por los grupos de edad de los menores o iguales a 6 meses. El comportamiento es similar en todos los grupos.
Del total de los aislamientos estudiados, 24 (12,0%) fueron productores de beta lactamasa y resistentes a ampicilina; un aislamiento no productor de beta lactamasa presentó resistencia intermedia a la ampicilina; 33 (16,5%) aislamientos fueron resistentes a SXT, 2 (1,0%) a cloranfenicol y uno (0,5%) a ceftriaxona. Todos los aislamientos fueron sensibles a cefuroxima y a rifampicina. De los 33 aislamientos resistentes a SXT, 10 (30,3%) presentaron resistencia a ampicilina y fueron sensibles a los otros antimicrobianos.
De los 81 aislamientos Hib, 11 (13,4%) eran productores de beta lactamasa y 4 (4,9%) resistentes a SXT; un aislamiento beta lactamasa positivo fue resistente a SXT y cloranfenicol. De los aislamientos HiNT, 12/76 (15,8%) eran productores de beta lactamasa y 27 (35,5%) a SXT; 7 aislamientos presentaron resistencia a los 2 antimicrobianos. Hia fue sensible a todos los antibióticos estudiados.
1DiscusiónLa vigilancia realizada por el laboratorio a través de la Red Nacional de Laboratorios por el Grupo de Microbiología del INS no tiene una representación nacional y no tiene base poblacional, debido a que esta vigilancia es voluntaria y pasiva y no cuenta con el dato de vacunación de los pacientes; sin embargo esta vigilancia proporciona una información importante como es la determinación de los serotipos implicados en las infecciones invasivas causadas por H. influenzae, dato necesario en el momento en el que la cobertura de vacunación contra Hib, con datos del Ministerio de Salud, es cercana al 93%15.
En el último período analizado (2011-2013) se observó un incremento en el número de aislamientos, procedentes especialmente de Bogotá 19 (33,3%) y Risaralda 15 (26,3%) (datos no mostrados), pero es importante anotar que cerca del 50% eran de niños menores de 4 meses (tabla 2). Este incremento no correspondió a ninguna intervención del programa de vigilancia por el laboratorio, como tampoco se puede asumir que se deba a fallas en el sistema de vacunación debido a que en este sistema de vigilancia no se conoce ese dato. Pero puede deberse a la mejora en el diagnóstico y a la vigilancia de las meningitis y neumonías en algunas regiones del país.
En Colombia, con la introducción de la vacuna Hib en 1998 se observó una reducción de Hib del 40% en los casos de meningitis en menores de 12 meses; para el HiNT al comparar 1996-1998 con 1999-2002, se evidenció un incremento en la frecuencia relativa del 23% en ese mismo grupo de edad17,18; estos cambios son similares a los reportados en otros países de América Latina7,19 donde se apreció una disminución drástica, especialmente en la población pediátrica, lo que confirma el impacto de la vacuna Hib en la salud pública.
De acuerdo con el informe SIREVA II para Latinoamérica del 201219, se recuperaron 65 aislamientos Hib en menores de 12 meses, de los cuales 31 (47,7%) de los casos se presentaron en Argentina y al analizar los datos del 2009 al 2012 (SIREVA II), en el mismo grupo de edad, en Argentina, informaron 5 aislamientos en 2009 y 35 en el 2012, lo que indica un incremento importante, pero se desconoce el estado vacunal de estos niños. Esta información fue obtenida por la vigilancia por laboratorio19.
En los menores de 60 meses, HiNT fue tan importante como causante de enfermedad invasiva como Hib, el cual para el último período (2011-2013) representó el 42,1% y estuvo asociado en un 35% a sepsis o bacteriemia (datos no mostrados). Para Argentina, Brasil y Chile, HiNT representó durante el 2012 (SIREVA II), 38,6, 43,1 y 77,5% respectivamente, lo que indica la importancia de HiNT como patógeno en la región19.
En esta vigilancia, Hia fue el tercero en importancia con una frecuencia de 17,5%; no se observó incremento en los períodos estudiados y se asoció especialmente con la población de mayores de 6 meses. Para Latinoamérica, entre 2007 y 2012 la frecuencia fue más baja que la observada en Colombia (8,1 y 6,8%)19. También ha estado asociado a brotes en Alaska y en algunos zonas de Canadá ha representado cerca del 50% de los aislamientos estudiados, entre el 2000-20054,6,20.
La asociación del serotipo con el diagnóstico clínico de los pacientes, varía de un país a otro; en este estudio, Hib y Hia estuvieron asociados a meningitis (74,1; 85,7%) y HiNT a neumonía, sepsis o bacteriemia (71,1%), algo similar a lo encontrado en otros países latinoamericanos, como Argentina, Brasil y Chile, donde los aislamientos de HiNT estaban asociados a neumonía o sepsis y bacteriemia en el 94,9, 96,8 y 75%, respectivamente19, similar a lo encontrado en Israel21, pero diferente a Alemania, donde HiNT está más asociado a meningitis22.
La vigilancia por el laboratorio de los serotipos de H. influenzae es indispensable y además se debe mejorar la calidad de la información, de tal manera que permita conocer el estado de vacunación de los niños con enfermedad invasiva por Hib. Según Ladhani et al.23, más de la mitad de los niños con falla vacunal contra Hib presentan concentraciones de anticuerpos por debajo de los considerados para conferir protección a largo plazo, lo que indica que estos niños podrían estar en mayor riesgo de enfermedad invasiva por Hib y se beneficiarían de otra dosis de la vacuna Hib.
El 50,9% de los aislamientos Hib eran de menores o iguales a 2 meses y el restante era de niños mayores de 2 meses, lo que indica la circulación de este patógeno en la población infantil colombiana, a pesar de que según el estudio de García24 el porcentaje de portación de Hib en niños de 12 meses en Colombia fue muy bajo (0,1%).
Algunos estudios han demostrado la importancia de la vacunación materna en el último trimestre del embarazo, con Hib, para reducir el riesgo de enfermedad invasiva por este patógeno en los menores de 2 meses, debido a que los anticuerpos atraviesan la placenta y protegen al recién nacido, hasta que este recibe la primera dosis de vacuna25.
Este tipo de vigilancia, adicionalmente a que es una vigilancia voluntaria y pasiva, depende de los recursos tanto humanos como materiales, lo que conlleva cambios en el número de aislamientos estudiados, lo cual no permite determinar el número real de casos diagnosticados; sin embargo, es la única manera de medir indirectamente el impacto de la vacunación contra Hib que se realiza en el país con los cambios en la frecuencia de los aislamientos Hib y la aparición de otros serotipos como causantes de enfermedad invasiva en los niños.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los coordinadores de los LSP del país, que participan activamente en la vigilancia de Hi; a Olga Marina Sanabria por la participación en el procesamiento de las muestras; a Andrés Montilla por la colaboración en el análisis de significación de la información y a la doctora Elizabeth Castañeda por la revisión del manuscrito.