Describir las características clínicas, los esquemas de antibiótico empleados y el pronóstico en términos de mortalidad intrahospitalaria y efectos adversos en pacientes con bacteriemia por enterobacterias con prueba fenotípica para carbapenemasas positiva.
Material y métodosEstudio de corte trasversal en un hospital de tercer nivel (Medellín, Colombia), en pacientes con bacteriemia por enterobacterias resistentes a carbapenems (CRE) detectados entre enero del 2010 y diciembre del 2013. Se presentan las variables continuas con medianas y rangos intercuartiles (RIQ) y las categóricas con porcentajes.
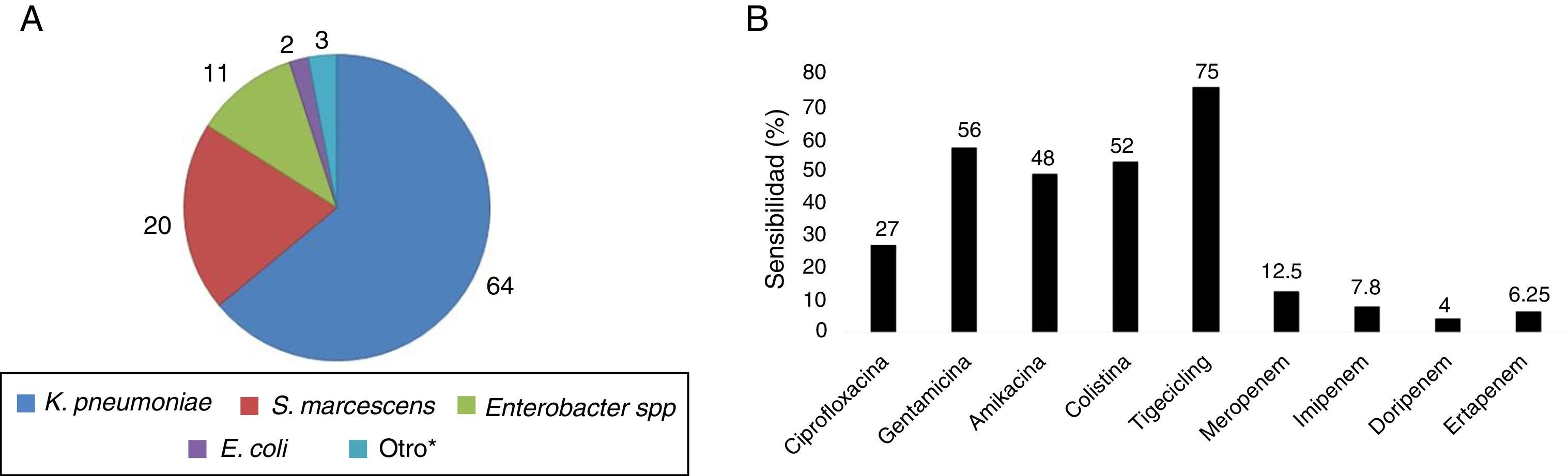
ResultadosSe incluyeron 64 casos con un promedio de edad de 62±14 años, 66% (n=42) hombres. El 60% (n=38) se encontraban en la UCI, y la mediana de APACHE-II fue de 17 (RIQ: 12-22), con alta comorbilidad (puntaje Charlson de 3; RIQ: 2-5). La mediana de estancia previa a la bacteriemia fue de 21días (RIQ: 13-39). El 64% correspondieron a Klebsiella pneumoniae, el 20% a Serratia marcescens y el 11% a Enterobacter spp. El 45% tenían tamización positiva previa a la bacteriemia. La mortalidad a los 28días fue del 51,6% (n=33) y ocurrió con una mediana de 5días luego de detectada la bacteriemia (RIQ: 2-17). El tratamiento definitivo fue combinado en el 76,6% de los casos, pero no hubo un esquema de combinación prevalente. Se reportaron efectos adversos en uno de cada 3 pacientes, y la mediana de estancia hospitalaria fue de 46días (RIQ: 26-76). La mortalidad a 28 días de pacientes tratados con carbapenems (n=27), colistina (n=27) o tigeciclina (n=18), solos o en cualquier combinación, fue del 40,7, del 55,2 y del 55,7%, respectivamente.
DiscusiónLos pacientes incluidos tenían altos índices de comorbilidad y exposición al ambiente nosocomial, como en estudios previamente publicados. La mortalidad a 28días fue comparable a la reportada en otros estudios. Se encontró menor mortalidad en pacientes tratados con terapias combinadas que incluían carbapenems, similar a lo reportado en un estudio clínico reciente en pacientes con bacteriemia por Klebsiella pneumoniae productora de carbapenemasas.
ConclusionesLa bacteriemia por CRE afecta pacientes muy enfermos y se acompaña de elevada mortalidad. Se detecta colonización en casi la mitad de los pacientes antes del desarrollo de infección. Hay heterogeneidad en el manejo antimicrobiano, pero la inclusión de carbapenems en el esquema de tratamiento combinado podría asociarse con menor mortalidad.
To describe the clinical features, antibiotic regimes and prognosis in terms of inpatient mortality and adverse effects in patients with Enterobacteriaceae bacteremia and a positive carbapenemase-detecting phenotypic test.
Materials and methodsA cross-sectional study was conducted at a tertiary hospital (Medellín, Colombia). Patients with bloodstream infections by carbapenems-resistant Enterobacteriaceae (CRE) diagnosed from January, 2010 to December, 2013 were included. Continuous variables are presented as medians and interquartile ranges (IQR), and categorical variables are presented as percentages.
ResultsSixty-four cases were included, with a mean age of 62±14; 66% were male (n=42). A total of 60% (n=38) were admitted to the ICU and the median APACHE-II score was 17 (IQR: 12-22), with high comorbidity (Charlson score=3, IQR: 2-5). The median hospital stay prior to the diagnosis of bacteremia was 21days (IQR: 13-39). Klebsiella pneumoniae was isolated in 64%, Serratia marcescens in 20% and Enterobacter spp. in 11% of the cases. Some 45% had a positive screening before the diagnosis of bacteremia. Mortality at 28 days was 51.6% (n=33) and occurred in a median of 5days (IQR: 2-17) after bloodstream infection was detected. Definitive treatment was a combination of antibiotics for 76.6%, but no combination scheme was prevalent. Adverse effects were observed in one of 3 patients and the median hospital stay was 46 days (IQR: 26-76). Mortality at 28days was 40.7% when patients were treated with a combination that included carbapenems agents (n=27), compared with 55.2% for colistin (n=27) and 55,7% for tigecycline (n=18).
DiscussionA high comorbidity index and nosocomial environment exposure were observed, as in previously published studies. The 28-day mortality was comparable to that reported in other studies. There was less mortality in patients treated with a combination that included a carbapenem agent, as was reported in a recent clinical study on patients with bacteremia Klebsiella pneumoniae carbapenemase.
ConclusionsCRE bacteremia is seen in very ill patients and is associated with high mortality. Bacterial colonization was detected in nearly half the patients prior to development of infection. The current antimicrobial therapy is heterogeneous, but the inclusion of a carbapenems agent in combination therapy may be associated with lower mortality.
Las enterobacterias resistentes a carbapenems (CRE) se caracterizan por generar un amplio espectro de infecciones, siendo la bacteriemia y la neumonía las más comunes1. Su prevalencia viene en aumento: en un reporte reciente, los Centros para el Control y Prevención de Enfermedades (CDC) notificaron que en Estados Unidos la proporción de CRE fue del 1,2% en el año 2001 y aumentó al 4,2% para el 20112. La mortalidad atribuible a este tipo de infecciones varía entre el 18 y el 60%, siendo más elevada en pacientes con bacteriemia3-5.
La emergencia de resistencia a carbapenems puede surgir como una combinación de mecanismos: modificaciones de la permeabilidad de la membrana externa, sistemas de expulsión activa con hiperproducción de β-lactamasas tipo AmpC o BLEE o producción de β-lactamasas específicas que hidrolizan carbapenems (carbapenemasas)6,7. Estas últimas son una verdadera amenaza a la salud pública, pues conllevan una alta mortalidad y limitadas opciones de tratamiento efectivo para pacientes con infecciones graves por BGN multirresistentes8,9. Esto ha motivado la necesidad de combinar antibióticos con diferentes mecanismos de acción y de resistencia10.
Los estudios iniciales se enfocaron en la epidemiologia, en los métodos de detección por laboratorio y en la caracterización molecular de las carbapenemasas11. Últimamente se han publicado varios reportes evaluando el tratamiento de infecciones por gérmenes productores de carbapenemasas12-14, pero aún no está claro cuál es el esquema antimicrobiano óptimo. Por lo tanto, es necesario conocer los resultados en nuestro medio para describir las características de esta población y las combinaciones terapéuticas más comúnmente empleadas.
Materiales y métodosPacientes y diseño del estudioEstudio de corte transversal que incluyó pacientes mayores de 18años con un episodio de bacteriemia por enterobacterias con prueba fenotípica positiva para carbapenemasas. Se realizó en un hospital universitario de alto nivel de complejidad en Medellín (Colombia), entre enero del 2010 y diciembre del 2013. Se excluyeron los pacientes que fueron remitidos a otra institución y en quienes se desconociera su desenlace final. Este estudio fue aprobado por el comité de ética de la institución participante.
Variables y método de recolecciónSe revisaron retrospectivamente las historias clínicas electrónicas de pacientes detectados desde la base de datos de seguimiento desde el área de vigilancia, prevención y control de infecciones de la Institución y se diligenció un formato para evaluar las siguientes variables: demográficas, comorbilidades, tratamiento inmunosupresor, procedimiento quirúrgico durante la hospitalización, necesidad de ingreso a UCI, necesidad de ventilación mecánica, uso de catéter vesical, uso de catéter vascular central, uso previo de antimicrobianos en los últimos 30 días, hospitalizaciones previas, procedimientos invasivos, tipos de tratamiento, efectos secundarios y resultados clínicos (tiempo de estancia hospitalaria y mortalidad). Se incluyeron todos los episodios de bacteriemia. Se consideró como tratamiento antibiótico empírico apropiado aquel en el que se empleó al menos un agente activo in vitro (sensible) distinto a tigeciclina y aminoglucósidos.
Para evaluar la gravedad de la enfermedad en el momento de su presentación se utilizaron 2 sistemas: el puntaje de bacteriemia de Pitt y el Acute Physiologic and Chronic Health Evaluation II (APACHE-II). El primero tiene la capacidad de predecir mortalidad causada por bacteriemias por gérmenes gramnegativos y grampositivos15. El APACHE-II evalúa 12 variables fisiológicas en las primeras 24h de estancia en UCI y el puntaje final varía entre 0 y 71; la puntuación más alta se correlaciona con mayor riesgo de mortalidad16. El índice de comorbilidades de Charlson es un puntaje que evalúa la asociación entre las comorbilidades de pacientes hospitalizados con mortalidad y se interpreta según el puntaje final. Así: 0=12%, 1-2=26%, 3-4=52% y ≥5=85%17.
Identificación bacteriana y pruebas de sensibilidadLa identificación de los aislamientos bacterianos y las pruebas de sensibilidad fueron realizadas por personal calificado del laboratorio de la institución participante de acuerdo con los protocolos estandarizados para el diagnóstico de enterobacterias, utilizando el sistema Vitek® (bioMérieux Clinical Diagnostics).
La confirmación de producción de carbapenemasas fue realizada mediante el test de Hodge modificado según las recomendaciones del Clinical and Laboratory Standards (CLSI). Esta técnica se empleó ante el hallazgo en el antibiograma de resistencia o susceptibilidad intermedia al menos a un carbapenem y resistencia a una o más cefalosporinas de tercera generación y según criterios del CLSI del 201418. La técnica realizada cumplió con las recomendaciones del Manual de procedimientos para la determinación de susceptibilidad antibiótica en patógenos de importancia epidemiológica, emitido por el INS en agosto de 201219.
Análisis estadísticoSe analizaron variables continuas con medianas y rangos intercuartiles (RIQ) y categóricas con porcentajes, utilizando el programa estadístico SPSS® versión 21 (SPSS Inc., Chicago, Illinois, EE.UU.).
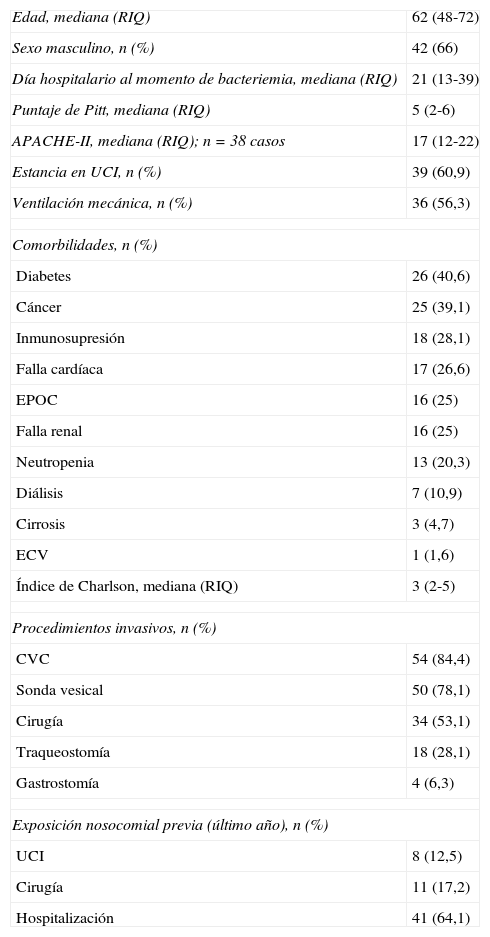
ResultadosDurante el periodo de estudio se incluyeron 64 casos de bacteriemia por enterobacterias con prueba fenotípica para carbapenemasas positivo en 62 pacientes. La edad promedio fue de 62±14años, y el 66% (n=42) fueron hombres. La tabla 1 muestra las características clínicas de la población. La mediana de días de hospitalización al momento de la detección de la bacteriemia fue de 21días. El 60% (n=38) de los pacientes se encontraban en la UCI en el momento de la bacteriemia y estaban severamente enfermos, como se puede observar por los altos valores en la escala de Pitt y APACHE-II. El índice de Charlson fue alto (mediana de 3), siendo la diabetes, el cáncer, la falla renal y la EPOC las comorbilidades más frecuentes, con el 40,6% (n=26), el 39,1% (n=25), el 25% (n=16) y el 25% (n=16), respectivamente. El 84% (n=54) de los pacientes tenían un catéter central en el momento de la bacteriemia, y el 53% (n=34) habían sido intervenidos quirúrgicamente durante la hospitalización índice. La mayoría de los pacientes estuvieron hospitalizados el año previo al desarrollo de la bacteriemia (64%; n=41), y el 100% recibieron al menos un antibiótico en los 3meses previos a la detección de la bacteriemia.
Características clínicas de la población de estudio
| Edad, mediana (RIQ) | 62 (48-72) |
| Sexo masculino, n (%) | 42 (66) |
| Día hospitalario al momento de bacteriemia, mediana (RIQ) | 21 (13-39) |
| Puntaje de Pitt, mediana (RIQ) | 5 (2-6) |
| APACHE-II, mediana (RIQ); n=38 casos | 17 (12-22) |
| Estancia en UCI, n (%) | 39 (60,9) |
| Ventilación mecánica, n (%) | 36 (56,3) |
| Comorbilidades, n (%) | |
| Diabetes | 26 (40,6) |
| Cáncer | 25 (39,1) |
| Inmunosupresión | 18 (28,1) |
| Falla cardíaca | 17 (26,6) |
| EPOC | 16 (25) |
| Falla renal | 16 (25) |
| Neutropenia | 13 (20,3) |
| Diálisis | 7 (10,9) |
| Cirrosis | 3 (4,7) |
| ECV | 1 (1,6) |
| Índice de Charlson, mediana (RIQ) | 3 (2-5) |
| Procedimientos invasivos, n (%) | |
| CVC | 54 (84,4) |
| Sonda vesical | 50 (78,1) |
| Cirugía | 34 (53,1) |
| Traqueostomía | 18 (28,1) |
| Gastrostomía | 4 (6,3) |
| Exposición nosocomial previa (último año), n (%) | |
| UCI | 8 (12,5) |
| Cirugía | 11 (17,2) |
| Hospitalización | 41 (64,1) |
CVC: catéter venoso central; ECV: enfermedad cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; RIQ: rango intercuartil; UCI: unidad de cuidados intensivos.
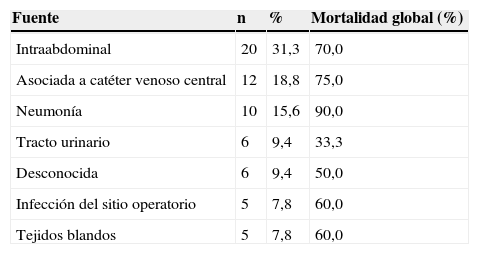
En la tabla 2 se muestran las diferentes fuentes de la infección con su respectiva mortalidad. La fuente más frecuente fue intraabdominal, seguido de bacteriemia asociada a catéter venoso central y neumonía; en 6 casos (9,4%) no se logró identificar la fuente.
Fuente de bacteriemia y su respectiva mortalidad
| Fuente | n | % | Mortalidad global (%) |
|---|---|---|---|
| Intraabdominal | 20 | 31,3 | 70,0 |
| Asociada a catéter venoso central | 12 | 18,8 | 75,0 |
| Neumonía | 10 | 15,6 | 90,0 |
| Tracto urinario | 6 | 9,4 | 33,3 |
| Desconocida | 6 | 9,4 | 50,0 |
| Infección del sitio operatorio | 5 | 7,8 | 60,0 |
| Tejidos blandos | 5 | 7,8 | 60,0 |
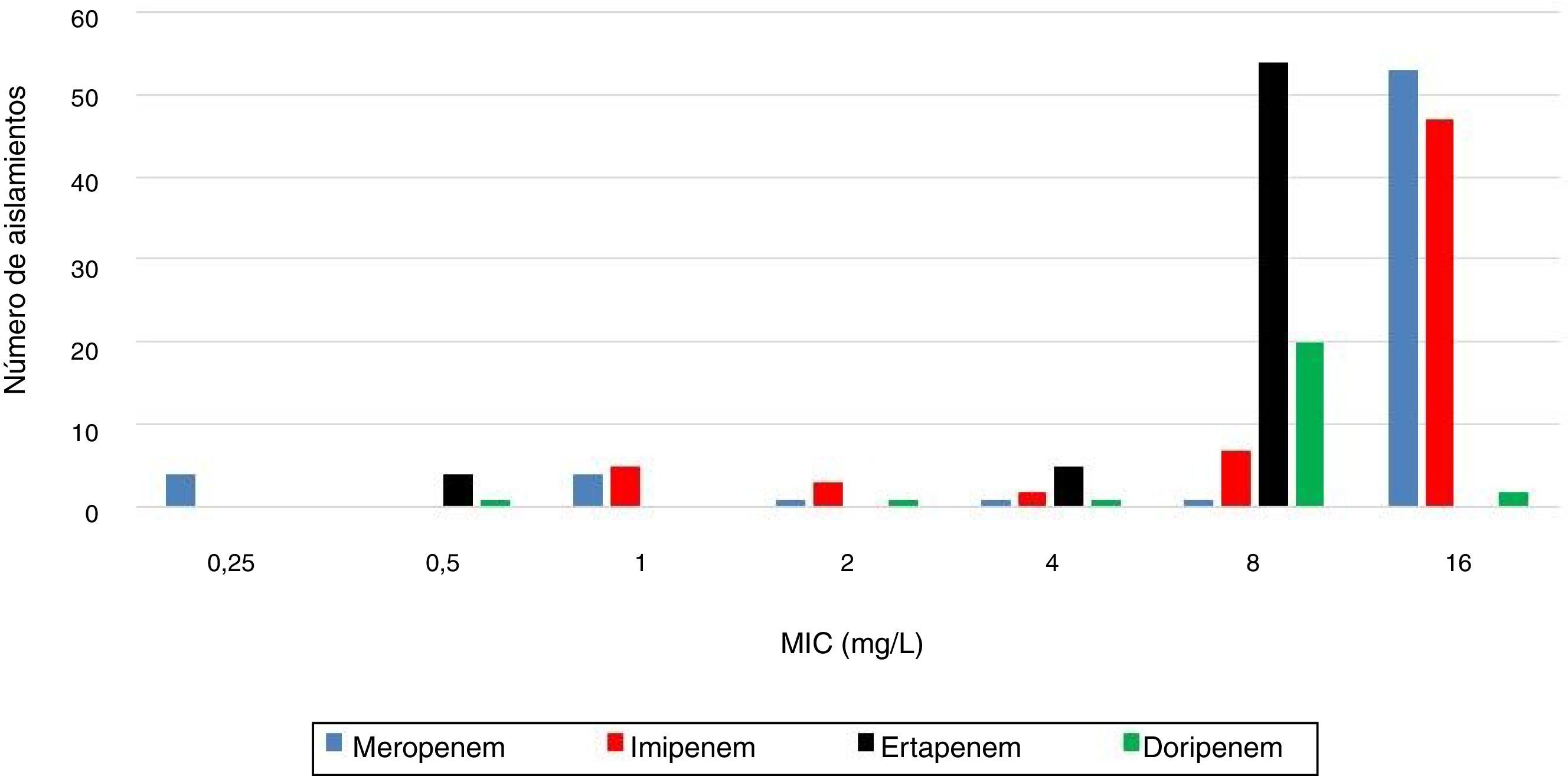
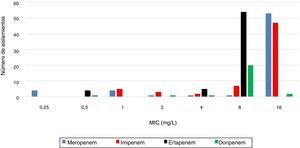
La figura 1a muestra los microorganismos causantes de la bacteriemia, y el perfil de sensibilidad es mostrado en la figura 1b, con el 70% de los aislamientos considerados multirresistentes (MDR). La concentración inhibitoria mínima (MIC) a los carbapenems fue muy alta, con una mediana de 16mg/l (RIQ: 16-16) para meropenem e imipenem, y de 8mg/l (RIQ: 8-8) para ertapenem y doripenem (fig. 2). De los 64 casos, 29 (45%) tenían una prueba de tamización positiva previamente al desarrollo de la bacteriemia.
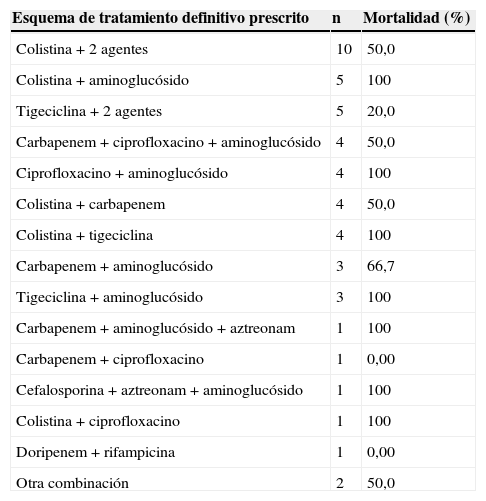
El 68% (n=44) de los pacientes recibieron un tratamiento empírico con monoterapia, de los cuales en solo 5 casos (7,8%) se consideró apropiado. El tratamiento definitivo más frecuente fue una combinación (76,6%, n=49), seguido de monoterapia (17,2%, n=11); 4 pacientes (6,3%) no recibieron tratamiento definitivo por encontrarse en intención paliativa. La mediana de duración del tratamiento definitivo fue 12días (RIQ: 3-14), y solo el 44% (n=28) lograron terminar el tratamiento prescrito, siendo la muerte la principal causa de suspensión (83,3%). Los esquemas de tratamiento combinado utilizados se muestran en la tabla 3.
Diferentes esquemas de tratamiento prescritos
| Esquema de tratamiento definitivo prescrito | n | Mortalidad (%) |
|---|---|---|
| Colistina+2 agentes | 10 | 50,0 |
| Colistina+aminoglucósido | 5 | 100 |
| Tigeciclina+2 agentes | 5 | 20,0 |
| Carbapenem+ciprofloxacino+aminoglucósido | 4 | 50,0 |
| Ciprofloxacino+aminoglucósido | 4 | 100 |
| Colistina+carbapenem | 4 | 50,0 |
| Colistina+tigeciclina | 4 | 100 |
| Carbapenem+aminoglucósido | 3 | 66,7 |
| Tigeciclina+aminoglucósido | 3 | 100 |
| Carbapenem+aminoglucósido+aztreonam | 1 | 100 |
| Carbapenem+ciprofloxacino | 1 | 0,00 |
| Cefalosporina+aztreonam+aminoglucósido | 1 | 100 |
| Colistina+ciprofloxacino | 1 | 100 |
| Doripenem+rifampicina | 1 | 0,00 |
| Otra combinación | 2 | 50,0 |
La mortalidad a los 14 días fue del 39% (n=27), a los 28 días fue del 51,6% (n=33) y el 67,2% de los casos (n=43) murieron durante la hospitalización índice. La mediana desde la bacteriemia hasta la muerte fue de 5días (RIQ: 2-17), y se consideró la infección como causa de muerte en 37 de los 43 casos (86%). Se documentó depuración de la bacteriemia en 35 casos, con una mediana de 6días (RIQ: 3-10) para obtener hemocultivos negativos, presentándose recaída en 6 (9,4%) y bacteriemia distinta en 4 casos (6,3%). Se reportaron efectos adversos del tratamiento en uno de cada 3 pacientes, siendo la nefrotoxicidad el más frecuente, con 17 casos, seguido de complicaciones del sistema nervioso central, con 2 casos, y hepatitis o mielotoxicidad, con un caso cada uno. La estancia hospitalaria fue de 46días (RIQ: 26-76).
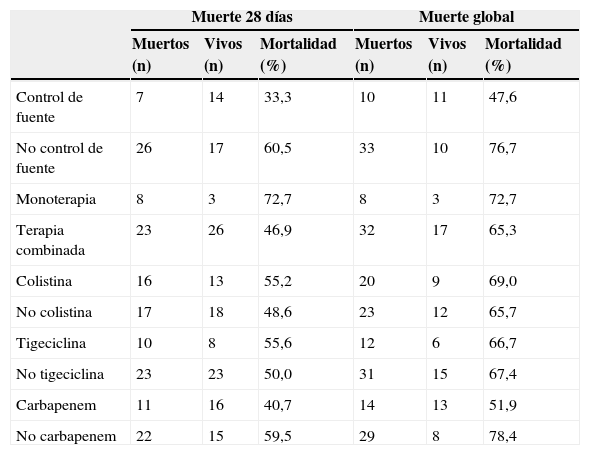
La mortalidad a 28días de los pacientes tratados con carbapenems (n=27), colistina (n=27) o tigeciclina (n=18), solos o en cualquier combinación, fue del 40,7, del 55,2 y del 55,7%, respectivamente. Igualmente, la mortalidad en los pacientes con control de la fuente de infección (n=21) fue del 33%, comparada con el 60% en aquellos sin control (n=43). Los pacientes tratados con monoterapia (n=11) tuvieron una mortalidad del 73%, comparada con el 47% en los que recibieron tratamiento con alguna combinación (n=49) (tabla 4).
Diferentes tipos de tratamiento definitivo de pacientes con bacteriemia y su relación con mortalidad global y a 28 días
| Muerte 28 días | Muerte global | |||||
|---|---|---|---|---|---|---|
| Muertos (n) | Vivos (n) | Mortalidad (%) | Muertos (n) | Vivos (n) | Mortalidad (%) | |
| Control de fuente | 7 | 14 | 33,3 | 10 | 11 | 47,6 |
| No control de fuente | 26 | 17 | 60,5 | 33 | 10 | 76,7 |
| Monoterapia | 8 | 3 | 72,7 | 8 | 3 | 72,7 |
| Terapia combinada | 23 | 26 | 46,9 | 32 | 17 | 65,3 |
| Colistina | 16 | 13 | 55,2 | 20 | 9 | 69,0 |
| No colistina | 17 | 18 | 48,6 | 23 | 12 | 65,7 |
| Tigeciclina | 10 | 8 | 55,6 | 12 | 6 | 66,7 |
| No tigeciclina | 23 | 23 | 50,0 | 31 | 15 | 67,4 |
| Carbapenem | 11 | 16 | 40,7 | 14 | 13 | 51,9 |
| No carbapenem | 22 | 15 | 59,5 | 29 | 8 | 78,4 |
El presente estudio describe los resultados de pacientes con bacteriemia por CRE en una institución de alta complejidad en nuestro medio. Los pacientes incluidos tenían factores que se han asociado a infección nosocomial por CRE en otros estudios publicados. Esto es, larga estancia hospitalaria, estar severamente enfermos, estancia en UCI (60%), uso de ventilación mecánica (56%), adquisición de infección intrahospitalaria y haber estado expuestos a procedimientos invasivos así como a tratamientos antibióticos previos (principalmente fluoroquinolonas, cefalosporinas de amplio espectro y carbapenémicos)4,20-22. Esto resalta que una enfermedad subyacente severa, asociada con la presión de selección antibiótica y exposición al ambiente nosocomial, son factores de riesgo para infección con organismos multirresistentes.
La mortalidad a 28días en nuestra cohorte fue del 51,6% (n=33), similar a la reportada en otros estudios. Ben David et al.20 reportaron una mortalidad del 48% en bacteriemias por gérmenes productores de carbapenemasas vs 22% con BLEE, y del 17% con cepas sensibles. En el estudio de Zarkotou et al.13 la mortalidad global fue del 52%, y Tumbarello et al.12 describen una mortalidad a 30días del 41,6%. En general, la mortalidad en bacteriemia es mayor que la de otro tipo de infecciones (72% vs 22%)23. En nuestro medio, Cuervo et al.24 evaluaron infecciones por K.pneumoniae productora de carbapenemasas en 45 pacientes con cáncer. Solo el 17,7% (n=8) tuvieron bacteriemia, y únicamente 2 pacientes sobrevivieron, arrojando una tasa de mortalidad estimada de 75%. Al igual que lo encontrado en nuestro trabajo, se identificaron factores de riesgo como tiempos de estancia hospitalaria prolongados (entre 11 y 60 días) y exposición a algún antibiótico en el último mes.
Se conocen factores asociados con mayor mortalidad no relacionados con el tratamiento, que incluyen altos valores en las escalas de morbilidad, como el índice de comorbilidades de Charlson, la escala de bacteriemia de Pitt y la escala APACHE-II, así como la edad23,25. Los pacientes incluidos en nuestro estudio tenían altos valores en todas estas escalas, con edad avanzada (62±14años), índice de comorbilidades de Charlson con mediana de 3 (RIQ: 2-5), puntaje de Pitt de 5 (RIQ: 2-6) y APACHE-II de 17 (RIQ: 12-22). Esto refleja que se trata de un grupo de pacientes gravemente enfermos y con altas probabilidades de morir, aun cuando recibieran un tratamiento apropiado.
En cuanto al tratamiento, solo el 7,8% de los pacientes recibieron un tratamiento empírico apropiado. Similar a lo reportado por otros autores12,13,21,26, el tratamiento definitivo con una combinación de antibióticos se asoció a menor mortalidad a los 28días, comparado con la monoterapia (47 vs 73%). Un estudio clínico reciente reportó menor mortalidad en pacientes con bacteriemia por K.pneumoniae productora de carbapenemasas tratados con terapias combinadas específicamente cuando se incluían carbapenems21. En nuestro estudio se presentó menor mortalidad a 28días en pacientes que recibieron carbapenems (40,7%), comparado con los que se trataron con esquemas que no incluían carbapenems (59,5%). Estudios in vitro apuntan a que las combinaciones podrían ser efectivas incluso si las bacterias son resistentes a uno o más antibióticos individuales27. Es así como se ha evaluado el uso de carbapenems como parte del esquema de tratamiento definitivo, con dosis altas e infusiones extendidas cuando las CRE tienen una MIC menor o igual a 4mg/l23,28.
Todos estos datos sugieren que se debería incluir carbapenems en los esquemas de combinación para el tratamiento de bacteriemias por CRE, mientras se conoce un tratamiento óptimo. Identificar el mejor régimen para estas infecciones requerirá estudios en modelos animales de infección para explorar diferentes combinaciones y/o estudios clínicos multicéntricos y con asignación aleatoria con poder estadístico para evaluar desenlaces clínicos. Esta es un área importante de estudio en el futuro. Otro factor relacionado significativamente con la sobrevida es el control del foco de infección29. En nuestro estudio, el control de fuente se realizó en el 33% de los pacientes, con una mortalidad del 33% versus el 60,5% en el grupo en que no se realizó esta intervención.
El 45% de nuestros pacientes estaban colonizados antes de la bacteriemia, con una tasa de colonización similar a la reportada en otro estudio13. Esta alta tasa resalta el valor de la vigilancia activa, que, más allá del beneficio en el control de infecciones, es crucial para la elección del tratamiento empírico en pacientes sépticos13. A pesar de conocerse la colonización, solo el 7,8% recibieron tratamiento empírico apropiado.
Nuestro estudio tiene varias limitaciones. La naturaleza retrospectiva lo hace susceptible a potenciales sesgos conocidos de estudios con tal diseño. Adicionalmente, el seguimiento limitado al tiempo de estancia hospitalaria, con el análisis solo de la mortalidad intrahospitalaria, podría subestimar la mortalidad, e impide evaluar los reingresos, comunes en esta clase de pacientes severamente enfermos con porcentajes de readmisiones de hasta el 72% entre los 90 días post-egreso1,30,31. Además está la falta de análisis molecular para comprobar e identificar la clase de carbapenemasas, pues solo se identificaron fenotípicamente.
ConclusiónLa bacteriemia por CRE se presenta en pacientes severamente enfermos y se acompaña de elevada mortalidad. Hay gran heterogeneidad en el manejo antimicrobiano utilizado en nuestro medio, pero la inclusión de carbapenems en el esquema de tratamiento combinado podría asociarse con menor mortalidad. Se detecta colonización en casi la mitad de los pacientes antes del desarrollo de infección, resaltando la importancia de la vigilancia activa.
FinanciaciónEl presente estudio no tuvo fuentes de financiación externas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesAida Oliveros Navarro, en su nombre y en representación de todos los autores del presente trabajo, declara que no existe ningún conflicto de intereses relacionado con el artículo.