Las infecciones asociadas a la asistencia sanitaria suponen una parte sustancial de los efectos adversos que los pacientes sufren durante la atención médica. Las bacteremias asociadas a catéter vascular central (CVC) suponen una causa importante de estas infecciones. Los objetivos fueron determinar la tasa de incidencia de bacteremia asociada a CVC en unidades de cuidados intensivos y la identificación de los principales factores de riesgo involucrados en el desarrollo de bacteremia asociada a CVC.
Sujetos y métodosEl estudio se llevó a cabo en 2 hospitales de Galicia (España) y se realizó un estudio de cohorte o incidencia y posteriormente, anidado en este, un subestudio de casos y controles. Se incluyeron a pacientes atendidos en unidades de cuidados intensivos de 2 hospitales (hospital A y hospital B) durante un período de 2 meses, de los años 2009, 2010 y 2011. Se calcularon las tasas de incidencia y los factores de riesgo asociados al desarrollo de bacteremia asociada a CVC.
ResultadosLas tasas de incidencia encontradas fueron 3,21; 2,91 y 5,76 bacteremias por 1.000 días en riesgo para el hospital A para los años 2009, 2010 y 2011 respectivamente. Estas tasas fueron de 2,10; 0 y 4,74 bacteremias por 1.000 días en riesgo para el hospital B para los mismos años. Se identificaron como factores de riesgo, el estado de coma (OR=3,72; IC95% 1,06-13,02) y el número de catéteres (OR=1,90; IC95% 1,21-2,97).
ConclusionesSe observan tasas superiores al estándar recomendado en la mayoría de los períodos de estudio. Se debe prestar especial atención a los pacientes en coma y con varios catéteres, al presentar estos un riesgo mayor de desarrollo de bacteremias asociadas a CVC.
Healthcare-associated infections lead to a high proportion of the adverse effects that patients experience during medical care. Among them, central-line associated bloodstream infections (CLABSIs) represent a significant proportion (14-52%).
ObjectiveTo calculate the incidence rates of CLABSI and to identify the risk factors for infection at intensive care units at 2 hospitals (hospital A and hospital B).
DesignThis study was conducted at two Galician hospitals (Spain) and was designed as an observational study that included patients attended in intensive care units from 2009 to 2011. We calculated incidence rates and risks related with intrinsic or extrinsic factors.
ResultsThe incidence rates found at hospital A were 3.21, 2.91 and 5.76 bloodstream infections per 1,000 days at risk in 2009, 2010 and 2011, respectively, and at hospital B 2.10, 0 and 4.74 bloodstream infections per 1,000 days at risk in those same years. The risk factors identified in the multivariate analysis were coma (OR=3.72; 95% CI 1.06–13.02) and the number of catheters (OR=1.90; 95% CI 1.21–2.97).
ConclusionThe observed incidence rates are higher than the recommended standards. Intensive care unit staff should focus special attention on to patients with coma and with a high numbers of catheters.
Las infecciones asociadas a la asistencia sanitaria (IAAS) suponen una parte sustancial de los efectos adversos que los pacientes sufren durante la atención médica1–3. Dentro de las IAAS, las bacteremias ocupan el cuarto lugar en frecuencia, representando las bacteremias asociadas a catéter vascular central (CVC) una causa frecuente (14-52%) de estas infecciones4,5.
En España, en 2011, la prevalencia de bacteremia asociada a CVC fue del 1,8% de forma global, ascendiendo hasta un 2,9% en las unidades de cuidados intensivos4. Se estima que se desarrollan entre 5.000 y 8.000 bacteremias asociadas a CVC anualmente, dando lugar a 1.250-2.000 muertes (25%), de las cuales 400-600 (9%) están directamente relacionadas con bacteremia asociada a CVC.
Existen diferentes estimaciones del gasto atribuible al desarrollo de IAAS; así, se estima que en EE. UU. este gasto se sitúa entre 28.000 y 33.000 millones de dólares anualmente6. En cuanto al gasto atribuible al desarrollo de una bacteremia, aunque es variable según los países, se estima que aproximadamente oscila entre 5.000 y 36.000 dólares7–10. En España, según datos del protocolo del proyecto Bacteriemia Zero11, cada bacteremia supone un gasto de aproximadamente 6.000 euros, con un aumento de la estancia hospitalaria en torno a los 20 días.
Para hacer frente al problema de las infecciones hospitalarias, se han llevado a cabo históricamente programas de seguimiento y control. En EE. UU. en la década de 1970 los Centers for Disease Control and Prevention (CDC) implantaron el proyecto Study on the Efficacy of Nosocomial Infection Control (SENIC), con el que se demostró que con programas de vigilancia y control se consigue un descenso del 32% de las IAAS12–14. Posteriormente, se desarrolló en este país el proyecto National Nosocomial Infection Surveillance (NISS)15,16, actualmente denominado National Healthcare Safety Network (NHSN)17, sistema voluntario y confidencial sobre el que se realizan informes mensuales de más de 300 hospitales y cuyos datos contribuyen a detectar cambios en patrones de incidencia, resistencia a antibióticos, focos, pronóstico y factores de riesgo para la infección.
En el año 1998 se funda en Argentina la Comunidad Internacional de Control de Infecciones Nosocomiales (International Nosocomial Infection Control Consortium [INICC]), considerada la primera red de vigilancia multinacional. Se trata de un sistema voluntario con participación de hospitales de varios lugares del mundo y que presenta entre sus objetivos la creación de una red global y dinámica de vigilancia de IAAS, la promoción de prácticas de control de IAAS basadas en la evidencia y la mejora de las herramientas de vigilancia en los hospitales. Actualmente está vigente en 300 ciudades de 62 países y permite la recopilación de datos, análisis de costes y la generación de informes18.
En Europa, aunque existían programas paralelos, fue desde octubre de 1994 a diciembre de 1995 cuando se centralizó la información en el proyecto europeo Hospitals in Europe Link for Infection Control through Surveillance (HELICS)19,20. En 2005, HELICS se adhirió al proyecto Improving Patient Safety in Europe (IPSE), constituyendo la red de redes de vigilancia de las IAAS, en la que se estandarizaron métodos de vigilancia y análisis de estas infecciones. Posteriormente, en 2009 esta red se integró en el European-CDC, con el objetivo de facilitar el desarrollo y ejecución de acciones conjuntas en el ámbito de vigilancia de las IAAS.
En España, se han desarrollado principalmente 2 sistemas de vigilancia: el Estudio de Prevalencia de la Infección Nosocomial en España (EPINE) y el Estudio Nacional de Vigilancia de la Infección Nosocomial en Servicios de Medicina Intensiva (ENVIN-UCI).
El proyecto EPINE se realiza anualmente desde 1990 y fue el primer sistema de vigilancia desarrollado en nuestro país21. En el año 2012 España entró a formar parte de European Point Prevalence Surveillance (EPPS), con la elaboración del Estudio de Prevalencia de las Infecciones Nosocomiales en Europa y su desarrollo en España (EPINE-EPPS), liderado por el European-CDC.
El programa ENVIN-UCI recoge desde 1994 datos de las principales IAAS asociadas a dispositivos en las unidades de cuidados intensivos (UCI), estas infecciones se asocian a mayor morbimortalidad en pacientes críticos y entre ellas se encuentran las bacteremias asociadas a CVC22,23.
En Galicia, en el año 2000, se implantó el Sistema de Vigilancia de la Infección Nosocomial (SVIN), incluido en el Plan de Minimización de Riesgos Microbiológicos en el medio hospitalario de Galicia (PLAMIRMIHGA). El objetivo general de este sistema de vigilancia es disminuir los niveles de IAAS y reducir, por tanto, la morbimortalidad y los costes derivados de la misma. Además de la vigilancia general del hospital, se establece selectivamente la observación de determinadas áreas o servicios, procedimientos o localizaciones de infección. En cuanto a la infección en UCI se estableció el estudio de todos los pacientes con CVC ingresados en estas unidades durante más de 24h, al constituir el cateterismo de vías centrales, un factor de riesgo de IAAS de notable intensidad24.
La identificación de factores de riesgo asociados con bacteremia es esencial para establecer programas de intervención con el objetivo de disminuir o mantener en límites adecuados las tasas de bacteremia asociada a CVC.
Los objetivos de este estudio fueron: a. determinar la tasa de incidencia de bacteremia asociada a CVC en UCI de 2 hospitales (hospital A y hospital B) durante un período de 2 meses consecutivos de los años 2009, 2010 y 2011 y su comparación con el estándar recomendado; y b. la identificación de los principales factores de riesgo involucrados en el desarrollo de bacteremia asociada a CVC.
Sujetos y métodosEl estudio se llevó a cabo en UCI de 2 hospitales de Santiago de Compostela, Galicia (España). Ambos centros forman parte de un complejo hospitalario que en conjunto cuenta con 1.570 camas y da cobertura a una población de referencia de aproximadamente 453.000 habitantes.
Se realizó un estudio de cohorte o incidencia. Posteriormente y anidado en él, se llevó a cabo un subestudio de casos y controles. Se utilizó en el hospital A información recopilada durante los períodos comprendidos entre 20 de abril y 19 de junio de 2009, 21 de abril y 20 de junio de 2010, y 1 de marzo y 30 de abril de 2011. En el hospital B los períodos de estudio fueron de 14 de octubre a 7 de diciembre de 2009, de 13 de septiembre a 12 de noviembre de 2010, y de 2 de mayo a 15 de junio de 2011.
Se incluyeron todos los pacientes mayores de 18 años que habían sido ingresados en las UCI de ambos hospitales participantes en el estudio durante los períodos de estudio, cuyo ingreso fue superior a 24h y que fueron portadores de al menos un CVC en algún momento del ingreso.
Se excluyeron los pacientes que padeciesen, en el momento del inicio del estudio, una bacteremia asociada a CVC, al tratarse de casos prevalentes.
La recopilación de datos se llevó a cabo diariamente y siguiendo las recomendaciones establecidas en el PLAMIRMIHGA24. El seguimiento de cada paciente finalizó cumplidos los 60 días de estudio, o en el momento del alta de la UCI. Transcurrido este período se determinó el estado del paciente en cuanto a la presencia o ausencia de bacteremia asociada a CVC.
Se consideró bacteremia asociada a CVC todo caso que cumpliese alguno de los criterios establecidos en el PLAMIRMIHGA24 y los casos de pacientes con diagnóstico específico de la misma por parte del médico responsable.
Se realizó un análisis descriptivo de los datos, y posteriormente se determinó la tasa de incidencia de bacteremia asociada a CVC, considerándose esta como el número de bacteremias asociadas a CVC por cada 1.000 días en riesgo.
Para la comparación de las variables cualitativas se usó el test Ji-Cuadrado o el test exacto de Fisher (en caso de frecuencia esperada menor de 5). Para la comparación de las variables cuantitativas se utilizó la U de Mann-Whitney. Se comprobó la normalidad de la distribución por el test de Kolmogorov-Smirnov.
Para la evaluación de los factores de riesgo de bacteremia nosocomial en los pacientes portadores de CVC, se realizaron los análisis de regresión logística univariante y multivariante.
En todos los análisis se consideró un nivel de significación del 95% y se utilizó el programa SPSS 15.0 para Windows y el software libre R (http://www.r-project.org/) - library mgcv.
Se ha cumplido con las exigencias de la Ley Orgánica de Protección de Datos (15/1999) y el RD 994/99, tanto en la gestión de los datos recogidos como en el manejo de las historias clínicas.
ResultadosEn total, formaron parte del estudio 682 pacientes, 573 pertenecían al hospital A y 109 al hospital B.
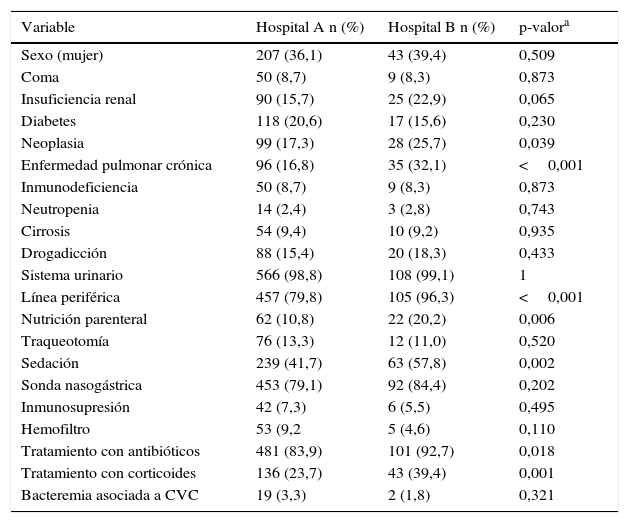
En el hospital A, 207 (36,1%) pacientes eran mujeres (tabla 1). La media de edad fue de 62,47±16,48 años. La mediana del número de catéteres de los que fue portador cada paciente fue de 2 con un rango de [1-5] CVC. En total 336 pacientes (58,6%) fueron portadores de más de un CVC, 29 (8,6%) de los cuales poseían más de 4. En cuanto a los días en riesgo, la mediana fue de 5 [1-96] días (tabla 2). Con respecto a la situación basal de los pacientes, las enfermedades más frecuentes fueron diabetes y neoplasia, en 118 (20,6%) y 99 (17,3%) pacientes respectivamente. Los factores asociados a desarrollo de bacteremia más frecuentes fueron el empleo de sonda urinaria en 566 pacientes (98,8%), el uso de línea periférica en 457 pacientes (79,8%) y el empleo de sonda nasogástrica en 453 (79,1%).
Características de los pacientes (variables categóricas)
| Variable | Hospital A n (%) | Hospital B n (%) | p-valora |
|---|---|---|---|
| Sexo (mujer) | 207 (36,1) | 43 (39,4) | 0,509 |
| Coma | 50 (8,7) | 9 (8,3) | 0,873 |
| Insuficiencia renal | 90 (15,7) | 25 (22,9) | 0,065 |
| Diabetes | 118 (20,6) | 17 (15,6) | 0,230 |
| Neoplasia | 99 (17,3) | 28 (25,7) | 0,039 |
| Enfermedad pulmonar crónica | 96 (16,8) | 35 (32,1) | <0,001 |
| Inmunodeficiencia | 50 (8,7) | 9 (8,3) | 0,873 |
| Neutropenia | 14 (2,4) | 3 (2,8) | 0,743 |
| Cirrosis | 54 (9,4) | 10 (9,2) | 0,935 |
| Drogadicción | 88 (15,4) | 20 (18,3) | 0,433 |
| Sistema urinario | 566 (98,8) | 108 (99,1) | 1 |
| Línea periférica | 457 (79,8) | 105 (96,3) | <0,001 |
| Nutrición parenteral | 62 (10,8) | 22 (20,2) | 0,006 |
| Traqueotomía | 76 (13,3) | 12 (11,0) | 0,520 |
| Sedación | 239 (41,7) | 63 (57,8) | 0,002 |
| Sonda nasogástrica | 453 (79,1) | 92 (84,4) | 0,202 |
| Inmunosupresión | 42 (7,3) | 6 (5,5) | 0,495 |
| Hemofiltro | 53 (9,2 | 5 (4,6) | 0,110 |
| Tratamiento con antibióticos | 481 (83,9) | 101 (92,7) | 0,018 |
| Tratamiento con corticoides | 136 (23,7) | 43 (39,4) | 0,001 |
| Bacteremia asociada a CVC | 19 (3,3) | 2 (1,8) | 0,321 |
Descripción de las características que presentaron los pacientes de ambos hospitales con respecto al total de pacientes estudiados en cada uno de los hospitales. Diferencias entre el hospital A y el hospital B.
Características de los pacientes (variables continuas)
| Hospital A (n=573) | Hospital B (n=109) | |||
|---|---|---|---|---|
| Variable | Media (DE) | Mediana [mín-máx] | Media (DE) | Mediana [mín-máx] |
| Edad* | 62,47 (16,48) | 66 [18-91] | 65,49 (17,11) | 67 [21-94] |
| N.o catéteres** | 1,84 (0,89) | 2 [1-5] | 1,09 (0,35) | 1 [1-3] |
| Días en riesgo*** | 8,68 (9,99) | 5 [1-96] | 8,78 (8,32) | 7 [1-48] |
Diferencias entre el hospital A y el hospital B en cuanto a la edad, número de catéteres y días en riesgo: Prueba U de Mann-Whitney.
En cuanto al hospital B, 43 pacientes (39,4%) eran mujeres. La media de edad fue de 65,46 (±17,10) años. La mediana del número de catéteres de los que fue portador cada paciente fue de un catéter, con un rango [1-3]. Tan solo 8 pacientes (7,3%) fueron portadores de más de un CVC. La mediana de los días en riesgo fue de 7 días [1-48]. La enfermedad de base más frecuente fue la pulmonar crónica en 35 de ellos (32,1%) y la neoplasia en 28 (25,7%). Entre los factores asociados a desarrollo de bacteremia más frecuentes se encuentran el empleo de sonda urinaria en 108 (99,1%), el uso de línea periférica en 105 (96,3%) y la sonda nasogástrica en 92 pacientes (84,4%).
Las tasas de incidencia de bacteremia asociada a CVC en el hospital A en los años 2009, 2010 y 2011 fueron respectivamente de 3,21; 2,91 y 5,76 bacteremias por cada 1.000 días en riesgo. Para el hospital B estas tasas, para los mismos años, fueron de 2,10; 0 y 4,74 bacteremias por cada 1.000 días en riesgo. En todos los casos, a excepción del segundo período de estudio del hospital B, estas tasas superaron el estándar de calidad establecido en PLAMIRMIHGA (menos de 2 episodios por 1.000 días de catéter vascular).
De los 19 casos de bacteremia asociada a CVC en el hospital A, los microorganismos más frecuentemente encontrados en los cultivos fueron Staphylococcus epidermidis, Acinetobacter baumanii, otros Staphylococcus y Candida albicans. En el hospital B, en los 2 casos de bacteremia los microorganismos implicados fueron Chrysebacterium spp. y otros Staphylococcus.
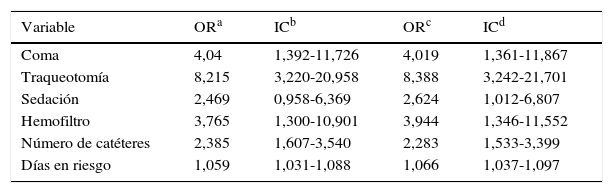
En cuanto a los factores de riesgo de bacteremia asociada a CVC estudiados en los pacientes del hospital A y ajustados por sexo y edad, solo se encontró relación estadísticamente significativa con el estado de coma (OR=4,02; IC95% 1,36-11,87), ser portador de una traqueotomía (OR=8,39; IC95% 3,24-21,70), el estado de sedación (OR=2,62; IC95% 1,01-6,81) y ser portador de hemofiltro (OR=3,94; IC95% 1,35-11,55). También se encontró relación directa entre el número de catéteres (OR=2,28; IC95% 1,53-3,40) y los días en riesgo (OR=1,07; IC95% 1,04-1,10) (tabla 3).
Riesgo de bacteremia asociada a CVC en función de las variables de estudio. Análisis de regresión logística univariante y ajustado por sexo y edad
| Variable | ORa | ICb | ORc | ICd |
|---|---|---|---|---|
| Coma | 4,04 | 1,392-11,726 | 4,019 | 1,361-11,867 |
| Traqueotomía | 8,215 | 3,220-20,958 | 8,388 | 3,242-21,701 |
| Sedación | 2,469 | 0,958-6,369 | 2,624 | 1,012-6,807 |
| Hemofiltro | 3,765 | 1,300-10,901 | 3,944 | 1,346-11,552 |
| Número de catéteres | 2,385 | 1,607-3,540 | 2,283 | 1,533-3,399 |
| Días en riesgo | 1,059 | 1,031-1,088 | 1,066 | 1,037-1,097 |
Análisis de regresión logística univariante y ajustado por sexo y edad, de los pacientes del hospital A.
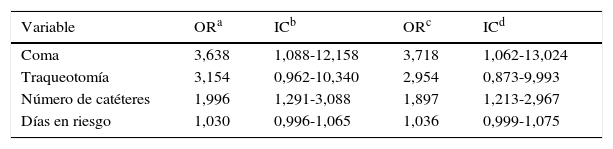
Posteriormente, en el modelo final de regresión logística multivariante (tabla 4), únicamente se encontró relación estadísticamente significativa con el estado de coma (OR=3,72; IC95% 1,06-13,02) y con el número de catéteres (OR=1,90; IC95% 1,21-2,97).
Riesgo de bacteremia asociada a CVC en función de las variables de estudio. Análisis multivariante y ajustado por sexo y edad
| Variable | ORa | ICb | ORc | ICd |
|---|---|---|---|---|
| Coma | 3,638 | 1,088-12,158 | 3,718 | 1,062-13,024 |
| Traqueotomía | 3,154 | 0,962-10,340 | 2,954 | 0,873-9,993 |
| Número de catéteres | 1,996 | 1,291-3,088 | 1,897 | 1,213-2,967 |
| Días en riesgo | 1,030 | 0,996-1,065 | 1,036 | 0,999-1,075 |
Análisis de regresión logística multivariante y ajustado por sexo y edad, de los pacientes del hospital A.
Tanto las bacteremias asociadas a CVC como los diversos tipos de IAAS suponen actualmente un problema para los hospitales, especialmente para las UCI25, por lo que existen programas destinados a su vigilancia y control. Este estudio se fundamenta en los criterios diagnósticos (basados en los de los CDC) y metodología establecidos en el PLAMIRMIHGA por tratarse del sistema de referencia utilizado por los centros de la Red del Servicio Galego de Saúde. Sin embargo existen otros sistemas de vigilancia, que deben ser destacados, como por ejemplo el ENVIN (sistema que utilizan las UCI de España). No obstante, aunque uno de los objetivos básicos de estos sistemas es vigilar las tasas de bacteremia asociada a CVC en las unidades de críticos, existen diferencias entre ambos.
Las discrepancias más destacables son que en el ENVIN el período de estudio es mayor (3 meses al año) y en cambio el período de seguimiento para cada paciente es menor (30 días). También existen diferencias en los estándares de calidad (siendo en el PLAMIRMIHGA de menos de 2 episodios por 1.000 días de catéter vascular y en ENVIN el estándar de calidad se considera menos de 4 episodios por cada 1.000 días de catéter) y en los criterios de inclusión y exclusión de los pacientes (el ENVIN no recoge los pacientes ingresados durante el período de estudio con fecha de ingreso previa al inicio del mismo)24,26.
El empleo de diferentes sistemas de vigilancia (tanto entre hospitales como entre unidades dentro del mismo hospital) con diferencias entre ellos para la obtención de las tasas de IAAS, puede dar lugar a que estas no sean siempre comparables, obligando en ocasiones a realizar la vigilancia de las IAAS empleando varios sistemas para obtener tasas comparables. De este modo, se pone de manifiesto la importancia de utilizar criterios uniformes y estandarizados en el estudio de las infecciones hospitalarias, consiguiendo no solo garantizar la comparabilidad de tasas entre centros o unidades sino que también se obtendría un mayor rendimiento y eficiencia.
A pesar de las discrepancias entre los sistemas de vigilancia, todo buen control de las IAAS necesita sistemas de evaluación que permitan corroborar cifras adecuadas o detectar incrementos en las tasas y los factores de riesgo asociados a este aumento, para posteriormente averiguar el origen del problema y poder corregirlo.
El control de las tasas de bacteremia asociada a CVC y la identificación de factores de riesgo de la misma son esenciales para reducir la morbimortalidad hospitalaria, así como para disminuir los costes derivados3.
De acuerdo con los resultados de este estudio, las tasas de incidencia obtenidas en ambos hospitales fueron superiores al estándar de calidad, a excepción del segundo período de estudio del hospital B. Este hecho pone de manifiesto la necesidad de mantener el sistema de vigilancia de las infecciones, así como la puesta en marcha de intervenciones que ayuden al descenso de las mismas.
Las diferencias entre las características de los pacientes atendidos en ambos centros (tabla 1) podrían ayudar a explicar, en parte, el distinto número de casos de bacteremia en los mismos. Se debe tener en cuenta que, en la actualidad, el hospital B atiende en general a pacientes con enfermedad crónica de base y/o ancianos. Estos pacientes suelen ingresar durante largas temporadas, para recibir terapias que les otorguen la mejor calidad de vida posible, de ahí el menor número de catéteres que se usa en estos pacientes y el mayor número de días en riesgo.
En cuanto a los microorganismos hallados en los casos de bacteremia, no difieren de lo establecido en la literatura2,3,27; así, el microorganismo hallado con más frecuencia en nuestro estudio fue el Staphylococcus epidermidis. También se aislaron otros microorganismos, como Acinetobacter baumanii, otros Staphylococcus, Enterobacter y Candida albicans. Estos datos están en consonancia con el hecho conocido de que el patrón de los microorganimos implicados en las bacteremias asociadas a CVC no ha sufrido grandes modificaciones en las últimas 2 décadas.
Respecto a los análisis de regresión logística tanto univariante como multivariante, solamente se pudieron realizar con los datos del hospital A, puesto que en el hospital B se dieron solo 2 casos de bacteremia asociada a CVC en el total de los períodos de estudio, lo que también relativiza los valores de las tasas obtenidas.
Los factores de riesgo de bacteremia que se han obtenido tanto en el análisis de regresión logística univariante como en los ajustados por sexo y edad (tabla 3), son concordantes con lo establecido en la literatura28-33, a excepción de la diabetes, factor documentado de riesgo para el desarrollo de infección.
Se ha descrito en la literatura, como uno de los factores de riesgo más importantes, el tiempo de permanencia del catéter (tiempo en riesgo). Se ha demostrado que la probabilidad de contaminación del catéter puede alcanzar un 25% a partir del décimo día, e incluso llegar al 55% a los 20 días31. En este estudio, de forma similar, se obtuvo que la probabilidad aumenta de forma exponencial en los primeros 20 días, llegando a incrementarse las tasas en un 70% en el vigésimo día. Este hecho debe hacer reflexionar sobre la permanencia innecesaria de catéteres en los pacientes a lo largo del ingreso6 con el fin de prevenir una mayor incidencia de infecciones.
Aunque el estudio de factores de riesgo, tanto de bacteremia asociada a CVC como de otras IAAS, es fundamental, el esfuerzo no debe limitarse solo a la detección de los mismos, sino que debe centrarse en la puesta en marcha de medidas que permitan evitar las infecciones, y crear un ambiente de seguridad11.
En esta línea se encuentra el estudio de Anguera et al.34, en el que se observó que la implantación de una nueva estrategia en el mantenimiento de los CVC es una medida eficaz para la reducción de la incidencia de bacteremia asociada a CVC (reduciéndose de 8,17 a 4,29 bacteremias asociadas a CVC por cada 1.000 días en riesgo).
Dentro de los proyectos a gran escala, se puede resaltar, entre otros, el Michigan Keystone Projects, llevado a cabo en Michigan por el Dr. Peter Pronovost de la Universidad Johns Hopkins, así como el Pittsburg Regional Healthcare Initiative o la estrategia llevada a cabo por INICC para el control de bacteremias asociadas a catéter central en UCI. Estos proyectos y estrategias han demostrado reducciones situadas, aproximadamente, entre el 50 y el 70% en bacteremias relacionadas con catéter vascular en las UCI al aumentar la adherencia a las recomendaciones de buena práctica para la inserción de CVC35–39.
Basada en la experiencia llevada a cabo por el Dr. Pronovost, surge en España el proyecto Bacteriemia Zero, el cual tiene como objetivo principal reducir la media estatal de la tasa de bacteremia relacionada con catéter a menos de 4 episodios de bacteremia por 1.000 días de CVC. Secundariamente se pretende crear una red de UCI que aplique prácticas seguras de efectividad demostrada y promover una cultura de seguridad en las UCI del Sistema Nacional de Salud11.
El progreso en la reducción de las tasas de bacteremia asociada a CVC pone de manifiesto que son evitables y ayuda a establecer un marco de prevención que se puede aplicar a otras infecciones hospitalarias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflictos de intereses