LOS SUEÑOS: TERRITORIO DEL DESEO
L.E. Martín-Peñasco de Merlo
Madrid.
¿Todavía es necesario preguntarnos dónde habita, en qué tierra hunde sus raíces y hacia donde camina? Quizá fuera mejor preguntarnos qué o quiénes desencadenan su sacudida, qué rostro es capaz de hacerle salir de su ensimismamiento. De este modo, nos situaríamos frente a su objeto. El deseo, siempre inquieto, siempre buscando, siempre anhelado, muriendo y renaciendo; hiriéndonos en lo más profundo de nosotros mismos al mostrarnos tan menesterosos y necesitados, enfrentados ante nuestro propio vacío. Siempre interrogándonos, siempre perplejos, siempre asombrados. ¿Acaso no nos hemos preguntado lo suficiente? Y, sin embargo, parece todo tan sencillo. Sencillo porque la respuesta está en nosotros, vive con nosotros: en los sueños de nuestros cuerpos. Sueños de cuerpo sexuado, nuestra libertad, nuestra posibilidad de elegirnos y de elegir el modo de vivirnos como corporeidad, como carne sexuada, sin que quepa la posibilidad de la renuncia. Sueños de cuerpo humano, cuerpo del deseo. ¿Cuántos siglos ciegos ante esta realidad? Cuerpo cercado por el tiempo, capaz de regalarnos instantes profundos de gozo y horas secas de hastío; territorio del dolor y del placer. En el horizonte sueños de muerte; mas la muerte que espera mientras que estamos vivos, mientras que deseamos. Sueños de cuerpos llenos de promesas, de posibilidades y de enigmas; espacio gozoso donde las caricias atenúan la soledad de la carne. Carne visible y deseable para el otro, carne visible y deseable para mí, que oculta y, al mismo tiempo, es signo de lo invisible; significante que guarda celosamente, para ser desvelado en la ofrenda y descubrimiento del encuentro, su significado y su sentido; puertas entreabiertas del deseo. Y así, no de otra manera, nos conocen nuestros sueños, conocemos nuestra condición y nuestros límites, y nuestro deseo se desvela en los sueños.
SUEÑO Y FUNCION SEXUAL
P. La Calle
Clínica Galena. Madrid.
La nutrición, el sueño y la función sexual son funciones fisiológicas con numerosos elementos en común, entre otros, su regulación por el sistema nervioso central y la presentación de las disfunciones referidas a estas tres áreas que comparten un espacio en las clasificaciones de trastornos del comportamiento. Las correlaciones también se extienden al campo de las disciplinas que se ocupan de estos trastornos, así la sexología médica y la medicina del sueño tienen numerosos puntos en común. Durante el sueño, en la Fase REM, y dentro de los fenómenos paradójicos del sueño, la reacción eréctil supone una reacción fisiológica que sirve de modelo para el estudio de la función sexual y su fisiopatología, así como para la valoración y diagnóstico fundamentalmente de la disfunción eréctil. Se revisa la fisiología de la erección como fenómeno paradójico y sus aplicaciones en el campo de la sexología".
CONCEPTOS ACTUALES DE DIAGNÓSTICO DEL SINDROME DE PIERNAS INQUIETAS
R. Egatz Wozniak
Servicio de Neurología. Fundación Jiménez Díaz. Madrid.
Debido a la naturaleza subjetiva de los hallazgos clínicos del Síndrome de Piernas Inquietas (SPI), el diagnóstico se basa principalmente en la historia clínica del paciente. En 2003 el Grupo Internacional de Estudio para el SPI modificó los criterios diagnósticos principales, fijados previamente en 1995. Actualmente el diagnóstico se basa en cuatro criterios clínicos principales: 1) Necesidad de mover las extremidades (habitualmente las inferiores), asociada o no a parestesias y/o disestesias; 2) aparición o empeoramiento de los síntomas en reposo o en períodos de inactividad; 3) alivio parcial o total con el movimiento; 4) la clínica aparece o empeora en las últimas horas de la tarde o por la noche. Existen criterios que apoyan el diagnóstico: historia familiar, respuesta positiva a tratamiento dopaminérgico y presencia de movimientos periódicos de las piernas (PLM) en el sueño o la vigilia. Deben considerarse hallazgos asociados al SPI, como: curso clínico (crónico y progresivo), trastornos de sueño (morbilidad principal) y la evaluación médica general (normal en formas idiopáticas/familiares).
El SPI puede ser idiopático, o secundario. Se han documentado aproximadamente 20 asociaciones de tipo médico, siendo las más frecuentes: embarazo, síndrome de apnea/hipopnea, insuficiencia renal, anemia/ferropenia, neuropatías, alteraciones de la médula espinal, y Parkinson.
En el diagnóstico diferencial del SPI se consideran tres grupos principales: síndromes motores (acatisia, calambres nocturnos, etc.), síndromes sensitivos (polineuropatía, enfermedad vascular, etc.) y alteraciones probablemente secundarias al SPI (insomnio, trastornos afectivos).
La polisomnografía y el test de inmovilización sugerida son métodos cada vez más utilizados, y de una alta sensibilidad y especificidad para determinar posibles alteraciones sensitivo-motoras del SPI (movimientos periódicos de las piernas).
EPIDEMIOLOGIA Y CALIDAD DE VIDA EN EL SINDROME DE PIERNAS INQUIETAS
M. Merino Andreu
Servicio de Neurofisiología Clínica. Hospital Universitario La Paz. Madrid.
El Síndrome de Piernas Inquietas (SPI) es un trastorno crónico caracterizado por la necesidad irrefrenable de mover las piernas provocada por una sensación desagradable no dolorosa en las extremidades, agravada por el reposo y que aparece fundamentalmente por la noche, provocando dificultad para conciliar el sueño y una fragmentación del mismo. Aunque el SPI es habitualmente infradiagnosticado, se estima que afecta a un 4-10% de la población general en grados variables de severidad. Esta prevalencia es mayor en mujeres y se incrementa con la edad. En algunos casos se describen niños con SPI, los cuales acuden al médico por "dolores de crecimiento", y encontrándose con frecuencia algunos familiares afectos de SPI. Aunque no existen datos concluyentes respecto a la influencia racial en el SPI, algunos estudios revelan una baja prevalencia en la población oriental. La deficiencia de hierro constituye un factor crítico en la patogenia de este síndrome pero también el embarazo, la neuropatía periférica (IRC, DM, CMT), la enfermedad de Parkinson, el tabaquismo o el consumo de alcohol están asociados a una mayor prevalencia del mismo. En general, la enfermedad no reduce la supervivencia de los pacientes aunque provoca un empeoramiento de la calidad de vida y consecuencias en las actividades normales de la vida diaria derivadas del trastorno de sueño (insomnio nocturno) tales como ánimo deprimido, fatiga y, en algunos casos, agitación psicomotriz. El impacto global negativo de los síntomas, referido por dos tercios de los pacientes con SPI, es extremadamente llamativo en la mitad de ellos.
SINDROME DE PIERNAS INQUIETAS: ¿QUÉ SABEMOS SOBRE SU CAUSA?
C. Serrano González
Servicio de Neurología. Hospital General. Guadalajara.
La fisiopatología del Síndrome de Piernas Inquietas (SPI) es compleja y no del todo bien comprendida. La respuesta mayoritaria al tratamiento dopaminérgico y el empeoramiento con fármacos antagonistas de los receptores de dopamina, avalan la hipótesis dopaminérgica, aunque ésta no explica por completo algunas formas de SPI secundarias. Las evidencias bioquímicas, de neuroimágen y anatomopatológicas señalan al déficit de hierro en el SNC como el origen primigenio en la mayoría de los pacientes. Se presume que este déficit de hierro ocasiona alteraciones dopaminérgicas que resultan en la aparición de los síntomas sensitivos positivos y en los movimientos periódicos de piernas en el SPI, aunque los estudios funcionales mediante SPECT y PET encaminados a demostrar estas alteraciones, no obtienen resultados concluyentes; no obstante parece que, aunque no de forma exclusiva, la disfunción fundamental puede localizarse a nivel postsináptico en el receptor D2 de la dopamina en especial en el grupo neuronal A11. La participación de una disfunción de otros receptores no dopaminérgicos, cono los receptores de opioides, de NMDA y noradrenérgicos puede jugar también un papel menor, aunque en ocasiones primordial, en su fisiopatología. Las estructuras anatómicas centrales y circuitos neuronales que pueden verse involucradas en la génesis del SPI, son múltiples y se sitúan a nivel subcortical, fundamentalmente en el tálamo, núcleo rojo, cerebelo, bulbo y en los grupos neuronales responsables de reflejo flexor a nivel medular; la participación de la corteza motora parece, en cambio, poco probable. La participación de estos circuitos y estructuras neuronales explica igualmente la ritmicidad circadiana, la aparición de los síntomas durante el reposo y la mejoría con el movimiento característicos de éste Síndrome.
HACIA UN TRATAMIENTO BASADO EN LA EVIDENCIA
D. García-Borreguero Díaz-Varela
Servicio de Neurología. Fundación Jiménez Díaz. Madrid.
El tratamiento del Síndrome de Piernas Inquietas (SPI) se ha basado fundamentalmente en los fármacos dopaminérgicos desde la descripción por parte de Akpinar de la eficacia terapéutica de la L-DOPA a comienzos de los años 80. Desde entonces se han realizado más de 17 estudios sobre la L-DOPA, de los cuales 11 han sido realizados con diseño controlado. En términos generales, la L-DOPA, a dosis entre 100 y 200 mg/día y combinada con carbiDOPA o con benserazida, ha mostrado una buena eficacia y tolerancia a corto plazo en este cuadro. Sin embargo, la descripción a finales de los años 90 de la existencia de fenómenos de "potenciación", con incremento de la severidad de los síntomas cuando la L-DOPA era utilizado a medio plazo, ha contribuido al surgimiento de un mayor interés por la utilización de fármacos agonistas dopaminérgicos. Entro los derivados ergolínicos, los fármacos mejor estudiados son pergolida y cabergolina. Más recientemente se han realizado estudios multicéntricos con derivados no-ergolínicos, tales como ropinirol, pramipexol, y recientemente rotigotina. La tolerancia a este tipo de sustancias es mayor, con una menor incidencia de nauseas e hipotensión, y el riesgo de complicaciones serias a largo plazo (p.ej., valvuloatías) es menor.
Con la excepción de la gabapentina, otras sustancias no dopaminérgicas (anticonvulsivantes, opiáceos, benzodiacepinas) están peor estudiadas. No está claro cuál es el lugar de la gabapentina en el tratamiento del SPI, aunque se ha sugerido que pudiera ser un fármaco de primera elección en los casos de SPI secundario a neuropatía periférica, o en aquellos casos de SPI en los que el dolor es el síntoma principal.
En conjunto, los estudios realizados indican que el SPI es un cuadro con un buen índice de respuesta al tratamiento. Durante la presentación, se mostrarán algoritmos de tratamiento propuestos recientemente.
TRATAMIENTO DEL SINDROME DE APNEAS E HIPOPNEAS DURANTE EL SUEÑO (SAHS)
J.F. Masa Jiménez
Jefe del Servicio de Neumología. Hospital San Pedro de Alcántara. Cáceres.
El tratamiento del Síndrome de Apneas e Hipopneas durante el Sueño (SAHS) no ha cambiado sustancialmente en la última década aunque sin duda conocemos mejor el efecto del tratamiento, el perfil del paciente tratable y como debemos aplicarlo.
¿CON QUÉ TRATAR?
El tratamiento de primera línea sigue siendo la CPAP disponiendo además de otros tratamientos como medidas generales (reducción de peso, dormir en decúbito lateral), prótesis de avance mandibular (PAM), cirugía de la vía aérea superior y tratamiento farmacológico.
Eficacia de la CPAP
Diferentes estudios aleatorizados y controlados han mostrado que la CPAP mejora los síntomas clínicos (principalmente la somnolencia diurna excesiva), la calidad de vida1,2 disminuye la presión arterial nocturna y diurna3,4) y la frecuencia de accidentes de tráfico5-7. Sin embargo, un estudio multicéntrico español no pudo demostrar mejoría en somnolencia diurna, calidad de vida ni en la presión arterial en pacientes con SAHS (IAH > 30) que presentaban síntomas clínicos escasos8. En consecuencia este estudio aclaró que la CPAP debía usarse solamente en pacientes sintomáticos con relativa independencia del IAH. Esta asunción ha estado vigente hasta hace escasamente semanas ya que de nuevo otro estudio español (observacional) ha demostrado, en más de 1.600 sujetos estudiados, que los pacientes con apneas de sueño graves (IAH > 30) no tratados (en general por no aceptación del tratamiento) tienen más eventos cardiovasculares y más mortalidad que la población sana9. El efecto anterior no ocurrió en los pacientes con apneas de sueño grave que fueron tratados con CPAP. Este estudio implicaría que el tratamiento con CPAP debe también intentarse en pacientes con IAH>30 poco sintomáticos. No obstante para aumentar el nivel de evidencia se necesita que estudios controlados y aleatorizados futuros demuestren mayor frecuencia de eventos cardiovasculares en los no tratados.
Algunos estudios no controlados han observado mejoría de la sensibilidad a la insulina en pacientes con SAHS tratados con CPAP10. Otros estudios igualmente no controlados han mostrado disminución de la presión arterial en mujeres embarazadas con SAHS y pre-eclampsia11. Estas eventuales indicaciones de CPAP (síndrome metabólico y pre-eclampsia) quedan sujetas al resultado de futuros estudios.
Eficacia de la pérdida de peso
Existen muy pocos estudios controlados (y con muestras pequeñas) tanto en la pérdida de peso secundaria a dieta como en la secundaria a cirugía bariátrica. Vistos en conjunto se puede resumir que la pérdida de peso en general conduce a mejoría de los síntomas y del IAH, siendo más importante con la cirugía bariátrica12. Sin embargo, no existe una clara relación entre la pérdida de peso y la disminución del IAH, el 50% de los que perdieron peso con dieta, recuperaron el mismo peso entre 5 y 11 años después y el 40% de los que se consideraron curados después de cirugía bariátrica, vuelven a tener apneas 7 años más tarde, con poco o ninguna ganancia de peso.
Por tanto parece que la pérdida de peso podría producir mejoría durante cortos periodos de tiempo y queda por dilucidar en estudios futuros qué ocurriría en pacientes con SAHS leves/moderados donde quizás la pérdida de peso necesaria no sea drástica y consecuentemente sería más fácil de alcanzar y mantener.
Eficacia de la posición corporal
En pacientes con "efecto posicional" (reducción al menos a la mitad del IAH al adoptar el decúbito lateral), el cambio de posición mejora el IAH y los síntomas clínicos, pero con menor eficacia que la CPAP13. Así mismo, elevar la postura para dormir mejora ligeramente el IAH pero claramente menos que la CPAP14.
Eficacia de los fármacos
Diferentes estudios han evaluado la eficacia de fármacos como protriptilina, progesterona, serotoninérgicos, azetazolamida, teofilina y fisogtismina para el tratamiento del SAHS. Aunque algunos han mostrado algún beneficio, como conclusión general, no existe suficiente evidencia para que se pueda recomendar su uso.
Eficacia de las prótesis de avance mandibular (PAM)
Diferentes estudios aleatorizados y controlados en grupos paralelos y cruzados frente a CPAP, han mostrado mejoría de los síntomas clínicos y del IAH aunque la CPAP fue siempre más eficaz en el IAH y en general también más efectiva en los síntomas clínicos15. En la mayoría de estudios el cumplimiento fue mejor en las PAM que en la CPAP16.
Los factores que pueden predecir mejores resultados son: pacientes jóvenes, no obesos, efecto posicional, bajo IAH y sobre todo que se consiga protusión de la mandíbula. Además existen factores dentales y cráneo faciales que pueden predecir el éxito. Un estudio ha mostrado que 34 de 100 pacientes tenían contraindicaciones al uso de las PAM y 16% presentaban problemas en la articulación temporo-mandibular17.
Por otra parte, en varios estudios se ha observado que algunos pacientes empeoran aumentando el IAH. Recientemente se ha publicado un estudio con una PAM con la que el avance mandibular se dirige remotamente y puede realizarse durante la polisomnografía. De esta forma se hace una "titulación" similar a la CPAP, precisando el avance óptimo. A la vez puede determinarse si se obtiene o no mejoría y el IAH residual18.
En definitiva las PAM pueden ser un tratamiento de segunda línea en pacientes seleccionados.
Eficacia de la cirugía de la vía aérea superior
La cirugía nasal (turbinectomía y corrección del septo) se considera como tratamiento coadyuvante en general en pacientes que no pueden usar CPAP por obstrucción nasal.
La cirugía de partes blandas faríngeas (adenoamigdalectomía, uvulopalatofaringoplastia y linguoplastia) tiene hoy un papel poco relevante en el tratamiento del SAHS en base principalmente a los malos resultados a largo plazo de la uvulopalatofaringoplastia que ha sido la más estudiada.
La cirugía de avance mandibular (osteotomía mandibular con avance del geniogloso y suspensión hioidea y osteotomía maxilo-mandibular), han obtenido buenos resultados en escasos estudios realizados y en cualquier caso lo agresivo de la cirugía limita la aceptación de eventuales casos.
En resumen el papel actual de la cirugía de partes blandas y mandibular está principalmente relegado a anormalidades faringeas (gran hipertrofia amigdalar) o mandibular (retro-micrognatias importantes).
¿A QUIÉN TRATAR?
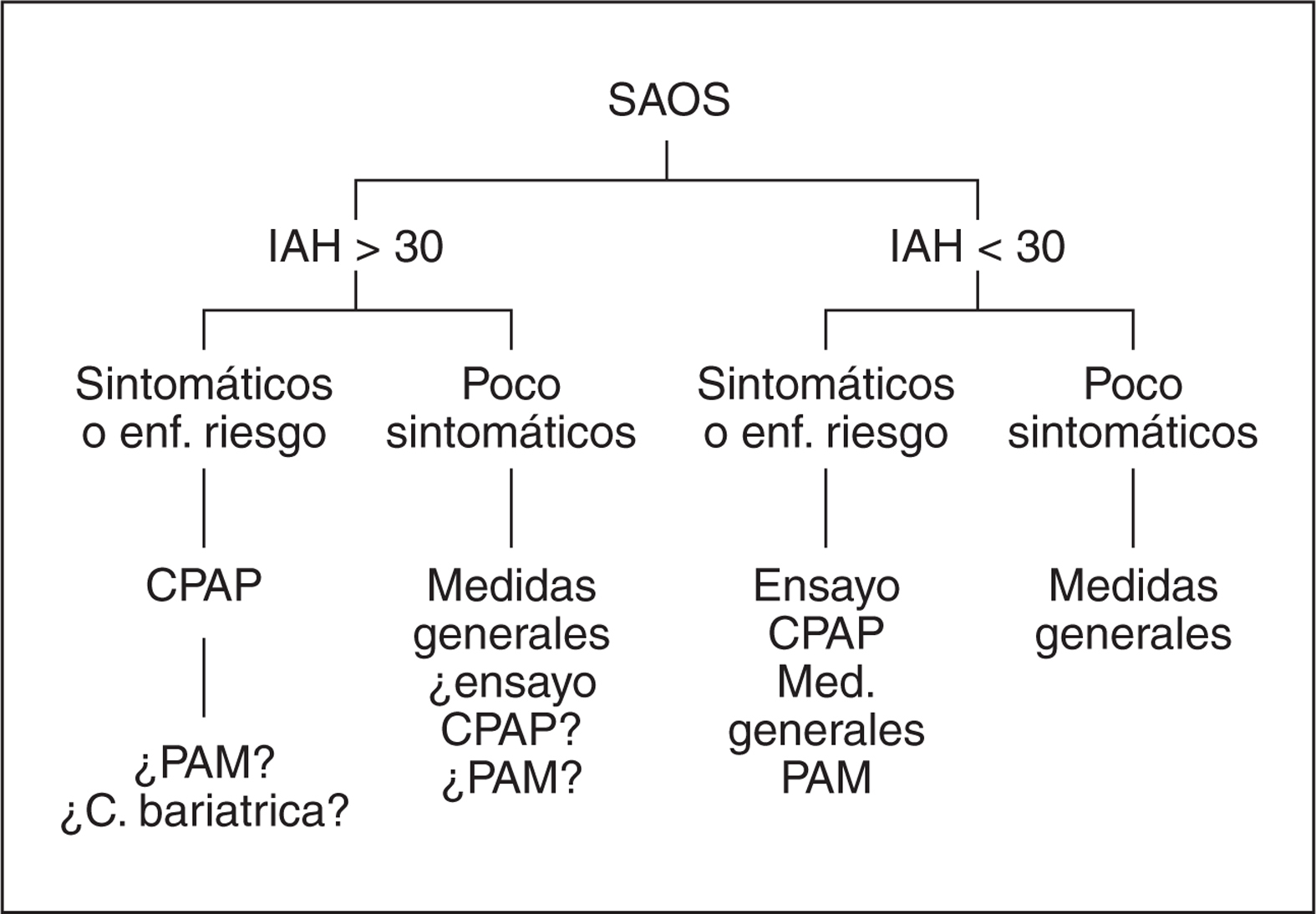
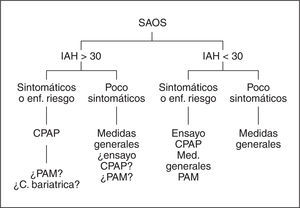
La indicación de iniciar tratamiento y también de qué tipo de tratamiento se empleará se basa en la relevancia de síntomas clínicos, existencia de enfermedades cardiovasculares, profesiones de riesgo y del IAH (figura 1). Pacientes con IAH > 30 con síntomas clínicos relevantes y/o enfermedades de riesgo y/o profesión de riesgo deberían ser tratados con CPAP. Si la CPAP no es tolerada o el cumplimiento es bajo, después de evaluar cuidadosamente (e intentar solución) las posibles causas, podría considerarse un ensayo con PAM o cirugía bariátrica en caso de obesidad mórbida.
Figura 1.
En pacientes con IAH > 30 poco sintomáticos sin enfermedades o profesión de riesgo, las medidas generales sería la primera elección. No obstante en pacientes seleccionados se podría considerar la posibilidad de ensayar CPAP o PAM debido al riesgo cardiovascular. En pacientes con IAH < 30 con síntomas relevantes y/o enfermedades y/o profesiones de riesgo, el tratamiento con medidas generales y/o ensayo con CPAP serían los tratamientos de elección. En caso de fracaso, la segunda línea de tratamiento sería PAM. En pacientes con IAH < 30 poco sintomáticos sin enfermedades o profesiones de riesgo, el tratamiento de elección sería medidas generales.
¿COMO TRATAR CON CPAP?
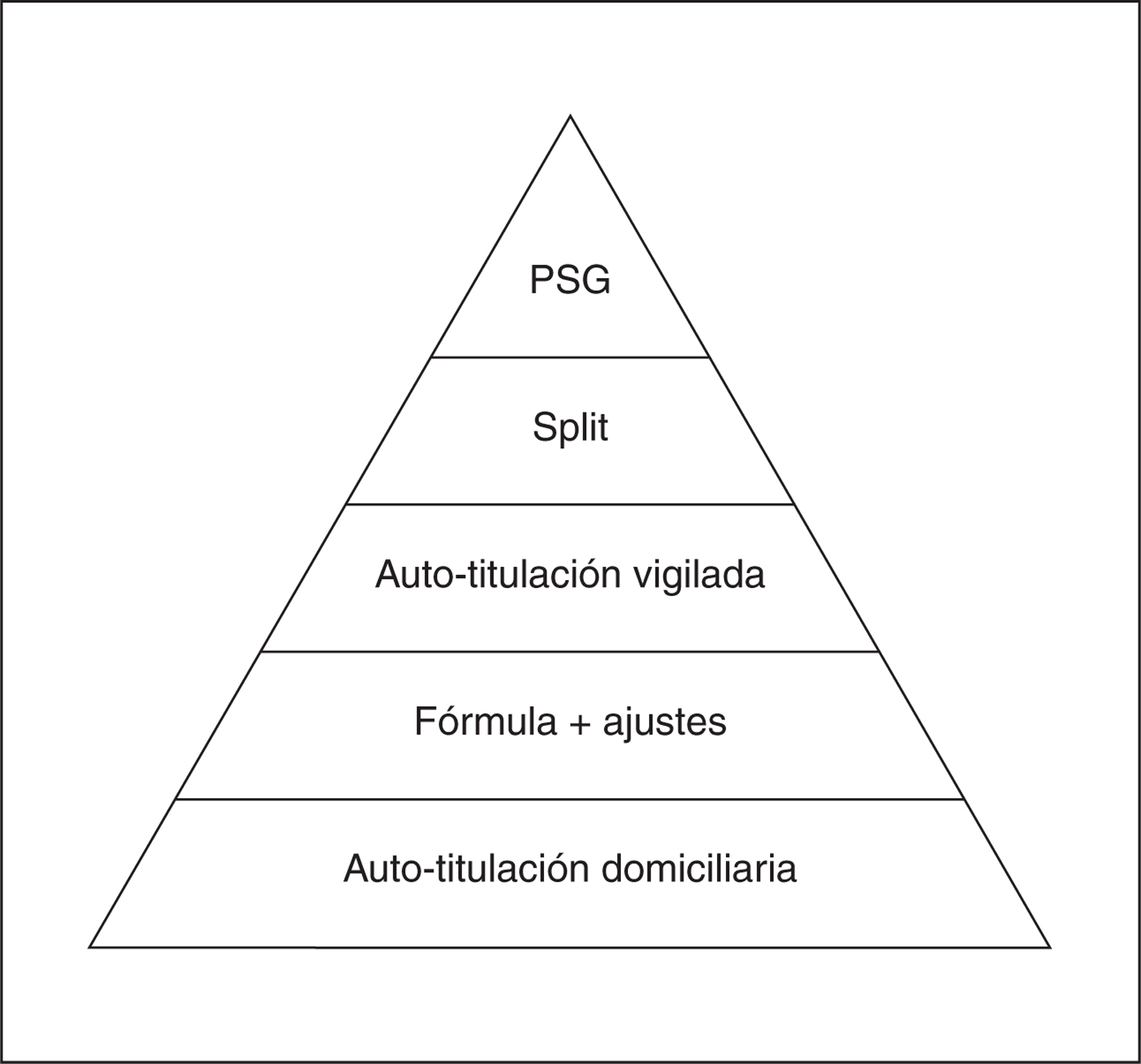
La presión efectiva para el tratamiento del SAHS varía de persona a persona, por lo que una titulación es necesaria de forma individual. En la tabla 1 se enumeran diferentes formas de titulación que han sido valoradas en otros tantos estudios.
La realizada mediante polisomnografía convencional o autoCPAP vigilada en el laboratorio de sueño están suficientemente probadas. La realizada mediante poligrafía respiratoria no tiene suficiente evidencia en la literatura.
Titulación mediante fórmula
Varios estudios han valorado la eficacia reduciendo el IAH con CPAP titulada mediante fórmulas19-22. Estas fórmulas tienen en cuenta el IMC, el perímetro del cuello y el IAH.
Dos estudios controlados y aleatorizados han valorado la eficacia y efectividad de la CPAP titulada mediante fórmula19,20 y posteriores ajustes domiciliarios en función de la presencia de ronquido o apneas observadas. El resultado es similar a la CPAP titulada mediante polisomnografía aunque en el estudio de mayor muestra20 el grupo de tratamiento con CPAP titulada mediante fórmula tenía mayor frecuencia de apneas e hipopneas residuales.
Titulación mediante autoCPAP en el domicilio
Dos estudios aleatorizados y controlados han evaluado la eficacia de la CPAP titulada mediante autoCPAP en el domicilio con respecto a la CPAP titulada convencionalmente20,23. Uno de ellos no estudió la eficacia de la CPAP mediante polisomnografía al final del seguimiento23 aunque no hubo diferencia en los síntomas y adherencia al tratamiento. En el otro20 la eficacia y efectividad de la CPAP titulada automáticamente fue similar a la realizada polisomnográficamente.
La conclusión de estas dos formas de titulación (mediante fórmula y autoCPAP) es que ambas son similarmente efectivas con respecto a la polisomnográfica, aunque quizás el comportamiento fue algo mejor con autoCPAP.
"Split night"
Diferentes estudios han demostrado que se puede utilizar una parte del estudio polisomnográfico para diagnóstico y otra parte para titulación. Sin embargo, en ocasiones en la primera parte no se alcanza en diagnóstico o en la segunda la presión efectiva. Dos estudios han demostrado que cuanto mayor es el IAH del paciente es más fácil obtener el diagnóstico utilizando menos tiempo y en consecuencia se puede alcanzar la presión efectiva con mayor frecuencia al disponer de más tiempo para esta segunda parte24,25. Por tanto para la polisomnografía "split night" es más conveniente seleccionar los pacientes más graves clínicamente ya que es más probable que tengan mayor IAH.
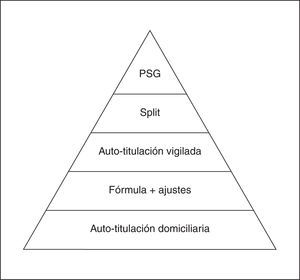
Resumen titulación
En la figura 2 pueden observarse las opciones de titulación en base a lo más recomendable. La titulación con autoCPAP en el domicilio debe ser la norma, siendo la titulación mediante fórmula con ajustes domiciliarios una alternativa. Otras opciones son la autoCPAP vigilada, split night y polisomnografía. El split night va quedando fuera del circuito de asistencia ya que la tendencia es hacer poligrafía respiratoria a los pacientes más sintomáticos en lugar de polisomnografía. La polisomnografía convencional de titulación puede quedar reservada para un 10-15% de los pacientes (pacientes con apneas centrales, con importantes desaturaciones durante el sueño, uvulopalatofaringoplastia previa y grave obstrucción nasal).
Figura 2.
AUTOCPAP COMO TRATAMIENTO
Muchos estudios han valorado la eficacia de la autoCPAP como tratamiento domiciliario y como alternativa a la CPAP a presión fija. La mayoría de ellos encuentran similar beneficio clínico, efectos secundarios, adherencia y cumplimiento que la CPAP fija. La eficacia en el IAH es también similar o con ligera tendencia a favor de la autoCPAP26. El problema radica en que estos equipos son más caros que la CPAP fija, pero seguramente serán el tratamiento del futuro, ahorrando la titulación.
BIBLIOGRAFÍA
1.Jenkinson C, Davies RJO, Mullins R, Stradling JR. Comparison of therapeutic and subtherapeutic nasal continuous positive airway pressure for obstructive sleep apnoea: a randomized prospective parallel trial. Lancet. 1999;353:2100-5.
2.Ballester E, Badia JR, Hernandez L, Carrasco E, de Pablo J, Fornas C, Rodriguez-Roisin R, Montserrat JM. Evidence of the effectiveness of continuous positive airway pressure in the treatment of sleep apnea/hypopnea syndrome. Am J Respir Crit Care Med. 1999;159:495-501.
3.Becker HF, Jerrentrup A, Ploch T, Grote L, Penzel T, Sullivan CE, et al. Effect of nasal continuous positive airway pressure treatment on blood pressure in patients with obstructive sleep apnea. Circulation. 2003;107:68-73.
4.Pepperell JCT, et al. Ambulatory blood pressure after therapeutic and subtherapeutic nasal continuous positive airway pressure for obstructive sleep apnoea: a randomised parallel trial. Lancet. 2002;359:204-10.
5.George CF. Reduction in motor vehicle collisions following treatment of sleep apnoea with nasal CPAP. Thorax. 2001;56:508:12.
6.Sassani A, Findley LJ, Kryger M, Goldlust E, George C, Davidson TM. Reducing motor-vehicle collisions, costs, and fatalities by treating obstructive sleep apnea syndrome. Sleep. 2004;27:453-8.
7.Findley L, Smith C, Hooper J, Dineen M, Surta PM. Treatment with nasal CPAP decreases automobile accidents inpatients with sleep apnea. Am J Respir Crit Care Med. 2000;161:857-9.
8.Barbe F, Mayoralas LR, Duran J, Masa JF, Maimo A, Montserrat JM, Monasterio C, Bosch M, Ladaria A, Rubio M, Rubio R, Medinas M, Hernandez L, Vidal S, Douglas NJ, Agusti AG. Treatment with continuous positive airway pressure is not effective in patients with sleep apnea but no daytime sleepiness. a randomized, controlled trial. Ann Intern Med. 2001;134:1015-23.
9.Marin JM, Carrizo SJ, Vivente E, Agusti A. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet. 2005;365:1046-53.
10.Harsch IA, Schahin SP, Radespiel-Troger M, Weintz O, Jahreiss H, Fuchs FS, Wiest GH, Hahn EG, Lohmann T, Konturek PC, Ficker JH. Continuous positive airway pressure treatment rapidly improves insulin sensitivity in patients with obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 2004;169(2):139-40.
11.Edwards N, Blyton DM, Kirjavainen T, Kesby GJ, Sullivan CE. Nasal continuous positive airway pressure reduces sleep-induced blood pressure increments in preeclampsia. Am J Respir Crit Care Med. 2000;162:2358.
12.Magalang UJ, Jeffery Mador M. Behavioral and pharmacologic therapy of obstructive sleep apnea. Clin Chest Med. 2003;24:343-53.
13.Jokic R, Klimaszewski A, Crossley M, Sridhar G, Fitzpatrick MF. Positional treatment vs continuous positive airway pressure in patients with positional obstructive sleep apnea syndrome. Chest. 1999;115:771-81.
14.Skinner MA, Kingshott RN, Jones DR, Homan SD, Taylor DR. Elevated posture for the management of obstructive sleep apnea. Sleep Breath. 2004;8:193-200.
15.Lim J, Lasserson TJ, Fleetham J, Wright J. Oral appliances for obstructive sleep apnoea. Cochrane Database Syst Rev 2004;4:CD004435.
16.Barnes M, McEvoy RD, Banks S, Tarquinio N, Murray CG, Vowles N, Pieerce RJ. Efficacy of positive airway pressure and oral appliance in mild to moderate obstructive sleep apnea. Am J Respir Crit Care Med. 2004;170:656-64.
17.Petit FX, Pepin JL, Bettega G, Sadek H, Raphael B, Levy P. Mandibular advancement devices: rate of contraindications in 100 consecutive obstructive sleep apnea patients. Am J Respir Crit Care Med. 2002;166:274-8.
18.Tsai WH, Vazquez JC, Oshima T, Dort L, Roycroft B, Lowe AA, Hajduk E, Remmers JE. Am J Respir Crit Care Med. 2004;170:366-70.
19.Fitzpatrick MF, Alloway CED, Wakeford TM, Maclean AW, Munt PW, Day AG. Can patients with obstructive sleep apnea titrate their own continuous positive airway pressure? Am J Respir Crit Care Med. 2003;167:716-22.
20.Masa JF, Jiménez A, Durán J, Capote F, Monasterio C, Mayos M, Terán J, Hernández L, Barbé F, Maimó A, Rubio M, Montserrat JM. Alternative methods of titrating continuous positive airway pressure. Am J Respir Crit Care Med. 2004;170:1218-24.
21.Kushida CA, Efron B, Guilleminault C. A predictive morphometric model for the obstructive sleep apnea syndrome. Ann Intern Med. 1997;127:581-7.
22.Oliver Z, Hoffstein V. Predicting effective continuous positive pressure. Chest. 2000;117:1061-4.
23.Stradling JR, Barbour C, Pitson DJ, Davies RJ. Automatic nasal continuous positive airway pressure titration in the laboratory: patient outcomes. Thorax. 1997;52:72-5.
24.Masa JF, Sojo MA, Sanchez De Cos J, Disdier C, Hernández M, Martín MJ, López S. Diagnóstico y tratamiento del síndrome de apneas de sueño en una sola noche. Arch Bronconeumol. 1995;31(Supl 1):13.
25.Yamashiro Y, Kryger MH. CPAP titration for sleep apnea using a split-night protocol. Chest. 1995;107:62-6.
26.Ayas NT, Patel SR, Malhotra A, Schulzer M, Jung D, Fleetham J, White DP. Auto-titrating versus standard continuous positive airway pressure for the treatment of obstructive sleep apnea: results of a meta-analysis. Sleep. 2004;27:249-53.
RONCOPATIA CON O SIN SINDROME DE APNEA OBSTRUCTIVA DEL SUEÑO: AVANCES EN EL TRATAMIENTO QUIRURGICO DESDE EL PUNTO DE VISTA ORL
H. Galera Ruiz
Profesor Asociado ORL. Universidad de Sevilla. Tutor de Residentes ORL. Hospital Universitario Virgen Macarena. Sevilla.
El conocimiento, diagnóstico y tratamiento de los trastornos respiratorios que se producen durante el sueño han experimentado un gran desarrollo en los últimos años. Hoy en día su interés ha sobrepasado el estricto ámbito de la ciencia y de los colectivos médicos para llegar incluso a sensibilizar a gran parte de la población, por el impacto que se produce sobre la calidad de vida y los riesgos asociados que conlleva.
La apnea es la interrupción de la respiración durante más de 10 segundos y la hipopnea es una significativa reducción de la amplitud del flujo respiratorio. Todos los seres humanos presentan apneas-hipopneas durante el sueño, y hasta cinco episodios en una hora se considera normal y sin consecuencias para la salud. En los casos graves, se llegan a documentar índices que superan los 30 episodios a la hora y espectaculares duraciones del evento apneico que llegan a superar los 40 segundos.
El síndrome de Apnea Obstructiva durante el sueño (SAOS) es el más frecuente de los trastornos respiratorios nocturnos, llegando a afectar al 4% de los varones y al 2% de las mujeres entre los 30 y 60 años y presentando un claro incremento con la edad. Se estima que entre uno y dos millones de españoles se encuentran afectados en un mayor o menor grado y que la mayoría todavía no están diagnosticados porque tradicionalmente los pacientes acababan por acostumbrarse, y no buscaban asistencia médica por falta de información. Parece ser que esta tendencia ha ido cambiando durante los últimos años con la implantación en los grandes hospitales del estudio sistemático y multidisciplinar de esta patología por parte de Neumólogos, Neurólogos, Neurofisiólogos, Otorrinolaringólogos, Psicólogos, etc. Se trata de una enfermedad desencadenada por las paradas respiratorias o apneas repetidas producidas por la obstrucción de la vía aérea superior (VAS) y que se asocian a despertares inconscientes transitorios. Este déficit de sueño reparador y de oxigenación mantenido conlleva la aparición de diferentes procesos cardiovasculares, enfermedad pulmonar obstructiva crónica e incluso en los casos más severos muerte súbita. También afecta al descanso, provoca sensación de sueño diurna, y a la concentración y rendimiento en el trabajo. De especial importancia es este padecimiento en determinadas profesiones, como conductores, obreros de la construcción, etc., en las que el riesgo de sufrir un accidente no solo pone en peligro las vidas de los pacientes sino las de otras personas también.
Por otro lado, el ronquido es el fenómeno acústico provocado por las vibraciones de los tejidos de la faringe y fosas nasales al paso del aire durante el sueño. El ronquido y la apnea tienen muchos nexos en común y es precisamente la existencia de un ronquido severo con paradas respiratorias, generalmente observadas por el acompañante nocturno, la causa más frecuente de consulta médica.
El tratamiento quirúrgico del ronquido es distinto tanto desde el punto de vista de la técnica quirúrgica como de los resultados, cuando se trata de una roncopatía simple o de un SAOS, por lo que el estudio preoperatorio completo con polisomnografía, rinofibrolaringoscopía y TAC, es crucial para la correcta aproximación diagnóstica, indicación quirúrgica y mejor pronóstico. A continuación se describen aquellas técnicas quirúrgicas que se practican con mayor frecuencia en la actualidad para el tratamiento de este problema y se explican los adelantos tecnológicos que han contribuido a desarrollar una cirugía menos invasiva y más eficaz.
TRATAMIENTO QUIRÚRGICO
Aunque se trata de una cirugía relativamente reciente, actualmente es ya una práctica médica bastante experimentada y universalmente difundida. En primer lugar hay que decir que por regla general en las roncopatías leves, el ronquido está producido por el paladar blando y la úvula y el tratamiento estriba en la reducción de volumen a nivel del velo del paladar y de los cornetes nasales, mientras que en el SAOS la obstrucción con frecuencia es multinivel afectando a otras zonas anatómicas de la VAS y que pueden ser tributarias de corrección quirúrgica o no, como sucede en el colapso circunferencial de las paredes laterales de la faringe. Determinada el área de obstrucción, la cirugía puede requerir de actuaciones asiladas sobre una zona determinada, fosas nasales, rinofaringe, orofaringe o hipofaringe, esqueleto facial, o bien de forma escalonada sobre todas o alguna de ellas, ya que la obstrucción puede ser única o múltiple, y en ocasiones incluso difícil o imposible de detectar con exactitud, lo que compromete la eficacia de esta cirugía.
INDICACIONES
El tratamiento indicado en el SAOS severo consiste en la utilización de aparatos de respiración asistida con presiones positivas (CPAP) y la cirugía programada para corregir las distintas obstrucciones anatómicas que estén presentes El plantear la cirugía como última alternativa, una vez que se han agotado los tratamientos con medidas generales e instrumentales, no es correcto en todos los casos. Es más correcto considerar cada caso de manera individual con una evaluación lo más exacta posible de la evidente relación entre SAOS y estrechamiento de las VAS, pues es esta relación la que ha de temporizar cuando la indicación quirúrgica se precisa con o sin tratamientos previos. La decisión se ha de tomar y planificar de forma detallada y haciendo una valoración individual del candidato.
Cuando se plantea tratamiento quirúrgico sin evidenciarse previamente anomalías estructurales o anatómicas de la VAS, éste es controvertido, pues los resultados no son fáciles de predecir y su utilidad a medio y largo plazo no está clara. Por ello que en estos casos la cirugía se practica sólo cuando el cuadro de SAOS es severo y tras el fracaso de otras modalidades de tratamiento menos invasivo como el CPAP; en estos caso la cirugía tiene por objetivo aumentar el espacio de las VAS y corregir la desproporción anatómica.
RESULTADOS
En pacientes bien seleccionados se alcanzan tasas de curación del 90 al 95%, y los mejores resultados se obtienen en los pacientes menos obesos y con índices de apnea-hipopnea menores de 50.
El paciente debe de conocer de antemano todas las posibilidades reales que existen de éxito con este tipo de cirugía, es decir; en muchos casos tras la cirugía puede desaparecer la sintomatología o que puede persistir ruidos respiratorios nocturnos aunque menos molestos, o también que disminuyan los ronquidos pero que no desaparezcan las apneas y sus consecuencias.
En realidad el único tratamiento que puede garantizar la curación del SAOS en el 100% de los casos es la traqueotomía ya que sortea completamente la obstrucción de la VAS por lo que cualquier otro tratamiento quirúrgico ha de ser aceptado con muchas posibilidades de éxito pero nunca del 100%.
TÉCNICAS QUIRÚRGICAS
Para corregir la obstrucción nocturna de las VAS existen dos tipos de técnicas:
1. Técnica de derivación de la zona obstructiva: traqueotomía.
2. Corrección de la obstrucción.
Cirugía nasal.
Cirugía de la orofarínge.
Cirugía que actua sobre la hipofarínge.
Otros tratamientos quirúrgicos.
TRAQUEOTOMÍA
La traqueotomía fue descrita en 1969 por Khulo como una técnica quirúrgica efectiva en el tratamiento del SAOS, aunque en la actualidad la indicación se ha visto reducida como tratamiento de primera línea. Consigue la derivación de la zona obstructiva y la efectividad es del 100%, desapareciendo la sintomatología del SAOS de forma inmediata.
Se reserva para SAOS severos o asociados a síndromes congénitos: Down, Hurler, acondroplasia, obesidad mórbida, etc., o en casos severos que no responden a otros tipos de tratamientos.
Las complicaciones, molestias y consecuencias psicosociales que acarrea la traqueotomía son de sobra conocidas por el ORL y puede ocurrir que algunos de estos pacientes no valoren la mejoría experimentada en su calidad de vida, primando las objeciones a esta modalidad de tratamiento.
CIRUGÍA NASAL
Cualquier tipo de obstrucción nasal puede contribuir al desarrollo de una roncopatía. Con la eliminación de dicha obstrucción se suele conseguir una mejoría pero no la curación completa. Cuanto más responsable sea la obstrucción nasal del cuadro de roncopatía, mayor será la mejoría posquirúrgica y así ocurre que los mejores resultados se obtiene en SAOS moderados con estudio cefalométrico normal. En otros casos, si bien se consigue un pobre resultado en cuanto a la corrección del SAOS, si que se consigue un notable beneficio al mejorar la tolerancia al CPAP y por consiguiente la adherencia al tratamiento. El CPAP con terminal nasal eficiente requiere que el paciente disponga de una buena permeabilidad nasal, pues para el correcto funcionamiento precisan de menores presiones que con la mascarilla facial.
Los tratamientos quirúrgicos de la obstrucción nasal han mejorado cualitativamente en los últimos años con el desarrollo y la introducción en la ORL de nuevas tecnologías (Cirugía endoscópica nasosinusal, radiofrecuencia, etc.) que permiten resultados aceptables con escasa morbilidad y acción inflamatoria sobre los tejidos nasales. Entre las distintas técnicas más novedosas se encuentran la reducción de los cornetes inferiores mediante aplicación de radiofrecuencia. Esta técnica en los pacientes se puede practicar con anestesia local y sin precisarse ingreso hospitalario. Además en nuestro hospital ha supuesto una disminución de la indicación de la corrección de las desviaciones del tabique nasal o septoplastia (técnica más agresiva y que precisa anestesia general). Cuando es necesaria la corrección quirúrgica del tabique nasal porque la desviación es importante realizamos una técnica menos invasiva que la tradicional de Cottle, la septoplastia endoscópica. Prácticamente todos los casos se abordan por una única fosa nasal respetándose la integridad de la mucosa del otro lado. En desviaciones puntuales se puede someter al paciente a la anestesia local y en las mayores a la general. Se deja taponamiento en un solo lado de la nariz y se causa mínimo daño sobre los tejidos. Por ultimo a los pacientes que presentan con obstrucción nasal secundaria a poliposis nasosinusal se les practica la Cirugía endoscopica nasosinusal con un porcentaje de éxitos que supera el 80%. Por tanto se puede concluir que, hoy por hoy disponemos de técnicas quirúrgicas efectivas y poco invasivas para corregir todo el espectro lesional que acompaña a la obstrucción nasal en los casos de ronquido y SAOS:
Rinopatía vasomotora (hipertrofia de cornetes inferiores) * reducción mediante radiofrecuencia.
Desviación del tabique nasal → septoplastia endoscópica.
Poliposis nasosinusal → cirugía endoscópica nasosinusal funcional.
¿Qué es la radiofrecuencia (RF)? La RF consiste en la administración de energía al interior de un tejido mediante un flujo de corriente alterna de alta frecuencia a 460 KHz. Esto da lugar a una agitación iónica que calienta el tejido, y cuando la temperatura se eleva por encima de los 47º C, se produce la coagulación de las proteínas y necrosis tisular.
En el tratamiento de las roncopatías la RF se administra mediante electrodos de aguja, fabricados a medida para el tejido a tratar. La administración de la energía se controla mediante un algoritmo computarizado a unos parámetros preestablecidos: potencia, límites de temperatura (80-90º), resistencia, tiempo de tratamiento y energía total administrada en julios. Las lesiones producidas en un tejido blando mediante la RF, van a producir una reabsorción del mismo reduciendo su volumen, además el área tratada tiende a la contracción, dejando los tejidos más tensos y reduciendo su vibración. Se trata de un procedimiento técnicamente simple y mínimamente invasivo, que conlleva menos dolor que los métodos quirúrgicos tradicionales y que se puede realizar de forma ambulatoria con una tasa de complicaciones baja y un resultado terapéutico generalmente bueno.
La técnica se realiza en general con anestesia loca en consulta externa y su duración es breve, solo las técnicas de base de lengua pueden exigir en algunos pacientes la anestesia general. La cirugía reductiva del tamaño de los cornetes inferiores para mejorar la permeabilidad nasal se puede realizar con RF, bien sea para tratamiento del bloqueo nasal sólo, o asociado a una roncopatía. Es un procedimiento técnicamente simple y mínimamente invasor, que se puede realizar ambulatoriamente, proporcionando una mejoría de la obstrucción nasal con mínimos efectos secundarios y sin alteraciones de las propiedades ciliares y mucosas. Se aplica en toda la longitud del cornete inferior dependiendo de la localización y magnitud de la hipertrofia. Esta técnica también puede tener interés para mejorar la tolerancia del CPAP en pacientes con obstrucción nasal.
CIRUGÍA DE LA OROFARÍNGE
La orofaringe es el territorio anatómico responsable del SAOS en el mayor número de casos. Para corregir la obstrucción a nivel de la cavidad faríngea se pueden realizar dos tipos de actuaciones quirúrgicas, las que actúan sobre el continente intentando agrandar la cavidad orofaríngea (faringoplastias) y las que actúan sobre el contenido de la cavidad para reducirlo (amigdalectomias y palatoplastias).
Amigdalectomías
En los niños las causa más frecuente de SAOS es la hipertrofia adenoamigdalar y por tanto el tratamiento de elección la adenoamigdalectomía. En determinados casos con presencia de malformaciones craneofaciales, parálisis cerebral o hipotonía muscular el tratamiento es mucho más complejo, y se precisa un abordaje multidisciplinar (Cirugía Maxilofacial o Plástica).
Por otro lado en el adulto se valora no solo la hipertrofia sino también la posición y el sostén, ya que en ocasiones, a pesar de no ser hipertróficas, tienden a caer en dirección posterior hacia la línea media produciendo obstrucción. Cuando se plantea esta técnica como tratamiento único del SAOS es aconsejable extirpar la úvula en su raíz para evitar una posterior elongación de la misma que pueda dar problemas de ronquido. Existen distintas técnicas quirúrgicas, todas ellas aceptadas APRA el tratamiento de este problema y que van desde la disección clásica, elcetrocauterio, láser y la RF, esta última pretende reducir el volumen del tejido amigdalino.
La RF aplicada a la base de la lengua, solo se emplea en pacientes en los que la retropulsión y colapso de la base de la lengua sea responsable del cuadro de roncopatía. Se puede realizar sola o asociada alguna de las técnicas descritas de cirugía mandibular. Dependiendo de la gravedad del cuadro a tratar se puede realizar de forma ambulatoria o de forma hospitalaria para poder controlar y monitorizar al paciente durante 24-48 horas. En los casos graves y cuando se prevé una colaboración escasa por parte del paciente, se puede optar por la anestesia general.
El electrodo se coloca bajo la musculatura superficial de la lengua. Se administra uno o dos puntos centrales y dos laterales de unos 750 J, pudiendo administrarse hasta una dosis total de 3000 J. Por regla general el postoperatorio precisa de una analgesia más intensa que la necesaria para las otras técnicas de RF.
Las posibles complicaciones descritas con esta técnica son, gran edema postoperatorio y riesgo obstructivo de la VAS, por lo que la energía administrad nunca debe de exceder los 1500 J cuando se practica con anestesia local, disfagia, que puede ser importante hasta haber riesgo de deshidratación, dolor postoperatorio intenso con la formación de úlceras superficiales en la mucosa, infecciones graves como la celulitis o el absceso hasta en le 1% de los casos, y por último la lesión nervio hipogloso. Para evitarlo el cirujano ha de administrar los puntos de tratamiento a una distancia de la línea media de la lengua que no supere los 2 cm. Las limitaciones de esta técnica vienen impuestas por la escasa experiencia que existe a largo plazo sobre la misma, si bien parece ofrecer unos resultados prometedores.
Palatoplastias
Las técnicas que a continuación se exponen tratan de solucionar la estrechez a nivel palatofaríngeo actuando sobre el paladar. La mayor dificultad de estas técnicas es la determinación del límite de resección superior palatino para conservar la función esfinteriana velofaríngea y evitar así reflujo y alteraciones foniátricas iatrogénicas.
Una obesidad mayor del 125% del peso ideal, o la presencia de alteraciones hipofaringeas cefalométricas, disminuyen considerablemente las posibilidades de éxito de esta cirugía.
Fue Ikematsu en 1964 el primero en proponer una técnica quirúrgica útil, la palatofaringoplastia con uvulectomía parcial, como tratamiento de la roncopatía simple. Como el nombre indica, se trata de la resección de aquellos elementos vibrátiles del paladar blando (úvula, mucosa y submucosa) pero respetando la musculatura para volver a suturar el remanente de mucosa sobre ella. Esta técnica prácticamente no plantea complicaciones y obtiene una tasa de mejoría del 80%.
A partir de aquí van a surgir numerosas evoluciones de la técnica, y quizás la más importante es la descrita por Fujita (Uvulopalatofaringoplastia o UPPP) en 1981 que es la que ha alcanzado mayor difusión mundial. Introduce la extirpación siempre de las amígdalas palatinas independientemente del tamaño, para después pinzar el músculo palatofaríngeo a nivel del tercio medio y así lateralizarlo lo más posible al suturarlo al músculo palatogloso.
En 1987, Dickinson introduce el concepto de "dimple point" o punto en el que cuando se apoya el dedo índice sobre el paladar blando denota que el paladar llega a contactar con la pared faríngea posterior. Para evitar complicaciones y secuelas se aconseja resecar el velo siempre por debajo de este nivel.
A partir de aquí surgen numerosas modificaciones técnicas a los procedimientos descritos por Ikematsu y Fujita, pero quizás las más aceptadas o realizadas son las propuestas por Fairbanks en 1987, que consiguen mejorar la movilidad del pilar posterior y evitar la retracción cicatricial del paladar blando.
En 1990, Kamami en Francia aplica por primera vez el láser de CO2 a la cirugía del ronquido y describe sutécnica, la uvulopalatoplastia asistida por láser (LAUP). El autor comunica un 85% de éxito en la roncopatía simple y en el SAOS leve. En 1992 se introduce en los Estados Unidos, siendo popularizada por Coleman y Krespi y aprobada en ese país para el tratamiento del ronquido simple por la "Food and Drug Administration" (FDA). El Láser actúa en realidad como bisturí electro-óptico que permite cortar, coagular y vaporizar selectivamente los tejidos. La utilización es fácil, permite controlar la profundidad del corte y en la mayoría de los casos no se produce sangrado lo que hace que el procedimiento sea más rápido. Se puede realizar con anestesia local, estando el paciente sentado frente al cirujano, teniendo en cuenta las consideraciones de seguridad en cirugía Láser. Para la intervención se utiliza una pieza de mano con tope para proteger a la faringe de la dispersión del rayo y con potencia entre 15 y 20 vatios se va tallando un nuevo paladar y uvula de manera escalonada. Las ventajas más importantes del LAUP son la posibilidad de realizar el procedimiento con anestesia local y el menor sangrado.
Por último hay que mencionar el más reciente avance tecnológico introducido en cirugía palatina, las técnicas de RF o somnoplastia, descrita por primera vez por Mandini en EEUU (1997) y aprobadas por la FDA recientemente. La técnica consiste en la reducción tisular volumétrica del paladar blando mediante este tipo de energía, pudiendo también realizarse de forma ambulatoria y con anestesia local. Dependiendo del tamaño del paladar se selecciona tres o cuatro puntos de tratamiento, dos laterales y uno o dos mediales. Se encuentra indicado en la roncopatía simple y en SAOS leve, como paso previo a otra cirugía palatina o en casos de intolerancia al CPAP. De igual forma, dada la sencillez del procedimiento y la escasa morbilidad que produce también se puede utilizar tras el fracaso de otras técnicas quirúrgicas. En paciente con úvula larga o muy gruesa se puede asociar al tratamiento una uvulectomía. Las mayores ventajas que ofrece respecto al LAUP son que produce menor dolor postoperatorio y es más sencilla de practicar.
CIRUGÍA QUE ACTÚA SOBRE LA HIPOFARINGE
Este tipo de cirugía está indicado para corregir la estrechez del espacio aéreo posterior de la vía aérea producida por una posición posterior de la base de la lengua, especialmente en pacientes con retroposición mandibular. Constituye una combinación de reconstrucción esquelética y de tejidos blandos por lo que tiene dos vertientes: cirugía sobre los maxilares y cirugía sobre la base de la lengua, bien de forma aislada o bien combinada. La valoración diagnostica de la estrechez aérea a este nivel ha de ser objetivada mediante la cefalometría realiza con radiografía simple o con resonancia nuclear magnética. Con frecuencia se asocia una retrognatia clínica evidente.
Dada la dificultad que encierra esta cirugía se aconseja comenzar por aquellas técnicas más sencillas y que actúan sobre la base la lengua. Cuando estas técnicas fracasan se recurre a la cirugía de los maxilares o a la glosectomía de la base de la lengua con láser.
Avance del tubérculo geni: genioplastia
Esta técnica es descrita por Riley y Powel en 1984, y consiste en el desplazamiento anterior de los músculos genioglosos y de las inserciones en la parte inferior de la cara interna de la mandíbula. Con esta cirugía se suele conseguir un desplazamiento anterior de la lengua entre 8-18 mm, no se gana ningún espacio adicional para la lengua pero ésta queda en tensión lo que aumenta el espacio posterior de la vía aérea. Esta técnica ha sido prácticamente abandonada pues sus resultados son pobres, además produce una protusión antiestética del mentón y un debilitamiento de la mandíbula que puede dar origen a una fractura. La técnica es relativamente sencilla de realizar y ha sufrido algunas modificaciones con objeto de conseguir mayor avance de la base lingual y evitar el riesgo de fractura mandibular manteniendo una estética aceptable.
Osteotomía mandibular inferior con miotomía y suspensión del hioides
Esta es la técnica más utilizada en la actualidad y fue descrita por Powell y Riley y modificada por Tieley en 1984. La cirugía consiste en el adelantamiento de la base de la lengua a expensas del hioides que se sujeta a la mandíbula con fascia lata.
Avance bimaxilar
Esta técnica se encuentra indicada cuando la base de la lengua constituye un punto de obstrucción debido a una retroposición mandibular. El avance maxilar conlleva un avance mandibular y en consecuencia también de la lengua.
Esta cirugía puede exigir un tratamiento ortodóncico previo con el fin de orientar los dientes de tal forma que se produzca una oclusión dental estable posquirúrgica, así como para eliminar las compensaciones dentales que limitarían la cantidad del avance que se quiere realizar
La técnica consiste en la realización de osteotomías tipo LeFort I de avance en maxilar superior, en combinación con osteotomía sagital de ramas ascendentes para avance mandibular. Si se cree conveniente también se le puede añadir la osteotomía mandibular inferior con miotomía y suspensión hioidea.
Entre todos los tratamientos quirúrgicos disponibles en la actualidad este es el más fiable para aumentar el calibre de la VAS.
Las indicaciones para esta intervención son: deficiencia mandibular grave, obesidad mórbida, SAOS grave con una IAH mayor de 50 y desaturaciones por debajo de 70%, y pacientes en los que han fallado otras modalidades de tratamiento.
Glosectomía de la línea media
La glosectomia de la línea media con Láser fue descrita por Fujita y Woodson en 1991. Estos autores contemplaron que se podía ampliar el espacio hipofaringeo reduciendo el tamaño de la base de la lengua mediante incisiones de la línea media y extirpando los excesos de tejido sin alterar la función. Se realiza una traqueotomía profiláctica para evitar aquellas complicaciones más severa, como la hemorragia y obstrucción de la VAS. Si es necesario pueden vaporizarse igualmente las amígdalas linguales hipertróficas, los pliegues epiglóticos y la epiglotis parcialmente, si es colapsable.
BIBLIOGRAFÍA
Benedetti JA, Hoard M, Gampper TJ. Obstructive sleep apnea: Part II. Surgical approaches to sleep apnea. J Long Term Eff Med Implants. 2004;14:177-84.
Coleman J. Apnea durante el Sueño, Parte I. Clínicas Otorrinolaringoloógicas de Norteamérica. 6/1998.
Coleman J. Apnea durante el Sueño, Parte II. Clínicas Otorrinolaringoloógicas de Norteamérica. 2/1999.
Chabolle F, Lachiver X. Tratamiento quirúrgico de la roncopatía con o sín síndrome de apnea del sueño. Enciclopedia Médico Quirúrgica, Elsevier SAS, París (2000) E-46-340.
Galera Ruiz H, Ortiz Bish F, Beltran Lara E, Muñoz Borge F. El tratamiento médico e instrumental de los trastornos respiratorios del sueño en Pediatría. En: Trastornos respiratorios del sueño en Pediatría. Roncopatía crónica infantil, de Francisco Delgado Moreno. Jarpyo Editores, S.A., Madrid 2003. Pag. 153-157.
Rosen CL. Obstructive sleep apnea syndrome in children: controversies in diagnosis and treatment. Pediatr Clin North Am. 2004;51:153-67.
Sher AE. Upper airway surgery for obstructive sleep apnea. Sleep Med Rev. 2002;6:195-212.
Verse T, Pirsig W. New developments in the therapy of obstructive sleep apnea. Eur Arch Otorhinolaryngol. 2001;258:31-7.
EFICACIA Y BENEFICIOS DEL DISPOSITIVO CIRENA (CINTA RESPIRATORIA NASAL): RONQUIDO ORAL, APNEAS DEL SUEÑO Y OTRAS CONSECUENCIAS DE LA RESPIRACION BUCAL
J. Pérez Rull, C. Miron Lopez y E. Hadjean
Servicio Otorrinolaringología y Cirugía Maxilofacial. Hospital de Madrid. Hospital de Lariboisiére. París.
Mediante un dispositivo (CIRENA) utilizado durante el sueño, con el fin de evitar la respiración oral, evaluamos los resultados subjetivos y objetivos. Se induce la respiración fisiológica nasal en 600 pacientes roncadores asociados a apneas obstructivas y diversos problemas de vías aerodigestivas.
CONTEXTO Y OBJETIVO
La importancia de respirar por la nariz, la primera y la más elemental de las reglas de higiene para la salud, es un concepto vital prácticamente ignorado y no tenido en cuenta en el modo de vivir de la sociedad actual.
Este estudio, además de confirmar las ventajas de la respiración nasal sobre la bucal; presenta un dispositivo que evita la respiración bucal durante el sueño, y que suprime o reduce sus consecuencias patológicas ronquido oral, Apneas del sueño y afecciones inflamatorio-infecciosas de vías aerodigestivas (rinitis, faringitis, alergias, etc.).
MÉTODOS
Seleccionamos pacientes cuyo motivo de consulta es el ronquido y/o problemas inflamatorio-infecciosos, en particular de la esfera ORL.
La respiración bucal, presente en todos los pacientes seleccionados se diagnostica mediante un simple examen clínico. Un 80% de los sujetos presentan simplemente disfunciones labiales y no verdaderas obstrucciones nasales.
La respiración oral es confirmada mediante 120 registros polisomnograficos nocturnos. Este examen demuestra la constante asociación de la respiración oral a las apneas del sueño en 90 sujetos. Igualmente es frecuente la asociación a SAOS y enfermedades idiopáticos como Hipertensión arterial, cardiopatías, diabetes, ictus, etc.
RESULTADOS
Al respirar por la nariz y suprimir la respiración oral durante el sueño con el dispositivo existe mejoría subjetiva y/u objetiva en más el 100% de los pacientes que pueden respirar por la nariz y mantener la boca cerrada.
Además de mejorar la calidad del sueño( refieren dormir mejor, descansar más, menos despertares nocturnos, y más sensación de descanso) los pacientes refieren no roncar o roncar menos así como supresión de síntomas como la sensación de ahogo nocturno, boca seca, carraspera, obstrucción nasal, tos nocturna, acufenos, vértigo nocturno, cefalea matinal, rechineo dentario o bruxismo, mal aliento matinal.
Los resultados subjetivos son confirmados con métodos objetivos en 15 pacientes, mediante registros polisomnográficos nocturnos realizados, primero respirando el paciente espontáneamente y posteriormente, respirando por la nariz, con el dispositivo (CIRENA).
MEDICAMENTOS DE PLANTAS MEDICINALES EN EL ABORDAJE DEL INSOMNIO EN ATENCION PRIMARIA
J.L. López Larramendi
COF. Madrid.
Las plantas medicinales se han venido utilizando desde la más remota antigüedad como tranquilizantes para controlar el nerviosismo y como elementos terapéuticos eficaces para combatir del insomnio. Es a partir de los años 80, época en la que comienza a desarrollar la Comisión E Alemana una serie de monografías técnicas sobre plantas medicinales cuando podemos empezar a hablar de un "manejo científico" de las mismas, situándonos en la actualidad en una demostrable "Evidencia Científica" de sus acciones farmacológicas según se constata en numerosas publicaciones y documentos europeos consensuados, entre los que destacan:
Comité Europeo de Medicamentos de Plantas Medicinales (2004)
Monografías Europeas ESCOP
Farmacopea Europea
Farmacopea Española
Base Datos Cochrane
Para que un determinada producto de planta medicinal se pueda manejar con una suficiente garantía por parte del prescriptor (y, así mismo, consumir con garantía por parte del enfermo), debe reunir las características propias de cualquier medicamento: calidad-seguridad-eficacia.
En la actualidad se encuentra en fase de desarrollo la Directiva Comunitaria 2004/24/CE por la cual se establece un registro simplificado, en cuanto a la documentación requerida de seguridad y eficacia, para aquellos medicamentos de plantas medicinales que tengan un uso de larga tradición (15 años) en los países comunitarios. El fin último de esta nueva directiva, en vigor a partir de octubre-2005, es la armonización de criterio y libre circulación entre los 25 países de la CE de ciertas especies vegetales que cumplan unos determinados requisitos.
Así, y desde la actual perspectiva farmacológica, numerosas especies vegetales que se han utilizado tradicionalmente en occidente como hipnóticos, han desaparecido del moderno arsenal de la fitoterapia debido a su estrecho margen terapéutico y potencial toxicidad, como es el caso de las populares Solanáceas: Beleño, Estramonio, Belladona ó Mandrágora, y por supuesto los derivados de la Adormidera (opio,..), aunque se sigan utilizando sus principios activos aislados ó modificados químicamente junto con otras moléculas de síntesis en ciertos medicamentos. Otras especies europeas, sin embargo, se han confirmado como muy eficaces en el trastorno del sueño, como es el caso de la Valeriana ó el Lúpulo. Un tercer grupo necesita aún más ensayos clínicos con este enfoque terapéutico: Tila, Espino blanco, Lavanda, Melisa.
Por otro lado, han aparecido especies foráneas de otras latitudes que, por sus buenas cualidades farmacológicas se han asentado en la CE como muy eficaces en el tratamiento del insomnio y en la sintomatología derivada del nerviosismo y la ansiedad, como es el caso de la Pasiflora ó Amapola de California.
Podemos decir, por tanto, que actualmente el facultativo sanitario dispone de un número importante de Plantas Medicinales con demostrada Evidencia Científica y óptima farmacología para el abordaje del insomnio y la sintomatología derivada de la ansiedad en Atención Primaria.
MEDICINA PEDIATRICA DEL SUEÑO
G. Pin
Hospital Quirón. Valencia.
INTRODUCCIÓN
El sueño es la actividad a la que más tiempo dedica el cerebro del niño durante las primeas etapas del desarrollo. Durante los dos primeros años de vida el niño pasa durmiendo 9.500 horas (13 meses) en contraste con las 8.000 horas que dedica a todas las actividades de vigilia, entre los 2 y los 5 años de vida pasa el mismo tiempo durmiendo que en vigilia y llegada la adolescencia dedica el 40% de su tiempo al sueño1.
Los problemas con el sueño implican a 1 de cada 3 niños de manera que la demanda asistencial por problemas relacionados con el sueño está sufriendo un crecimiento exponencial. Revisando la literatura disponible se puede concluir que entre el 13 y el 27% de los padres de niños de 4 a 12 años de edad refieren la presencia de dificultades con el sueño que incluyen:
Resistencia a acostarse.
Ansiedad en el momento de acostarse.
Inicio de sueño retrasado.
Colecho de respuesta a la actitud del niño.
Ronquido.
Enuresis.
Despertares nocturnos.
Pesadillas / terrores del sueño.
Sonambulismo.
Despertar matinal precoz.
Excesiva somnolencia diurna.
Hemos escogido aspectos de la patología del sueño pediátrica en los que el desarrollo madurativo del organismo infantil condiciona una presentación clínica así como unas secuelas y necesidades terapéuticas diferenciadas del adulto. Al mismo tiempo, se trata de alteraciones del sueño con gran implicación en la vigilia del niño y por tanto en su calidad de vida.
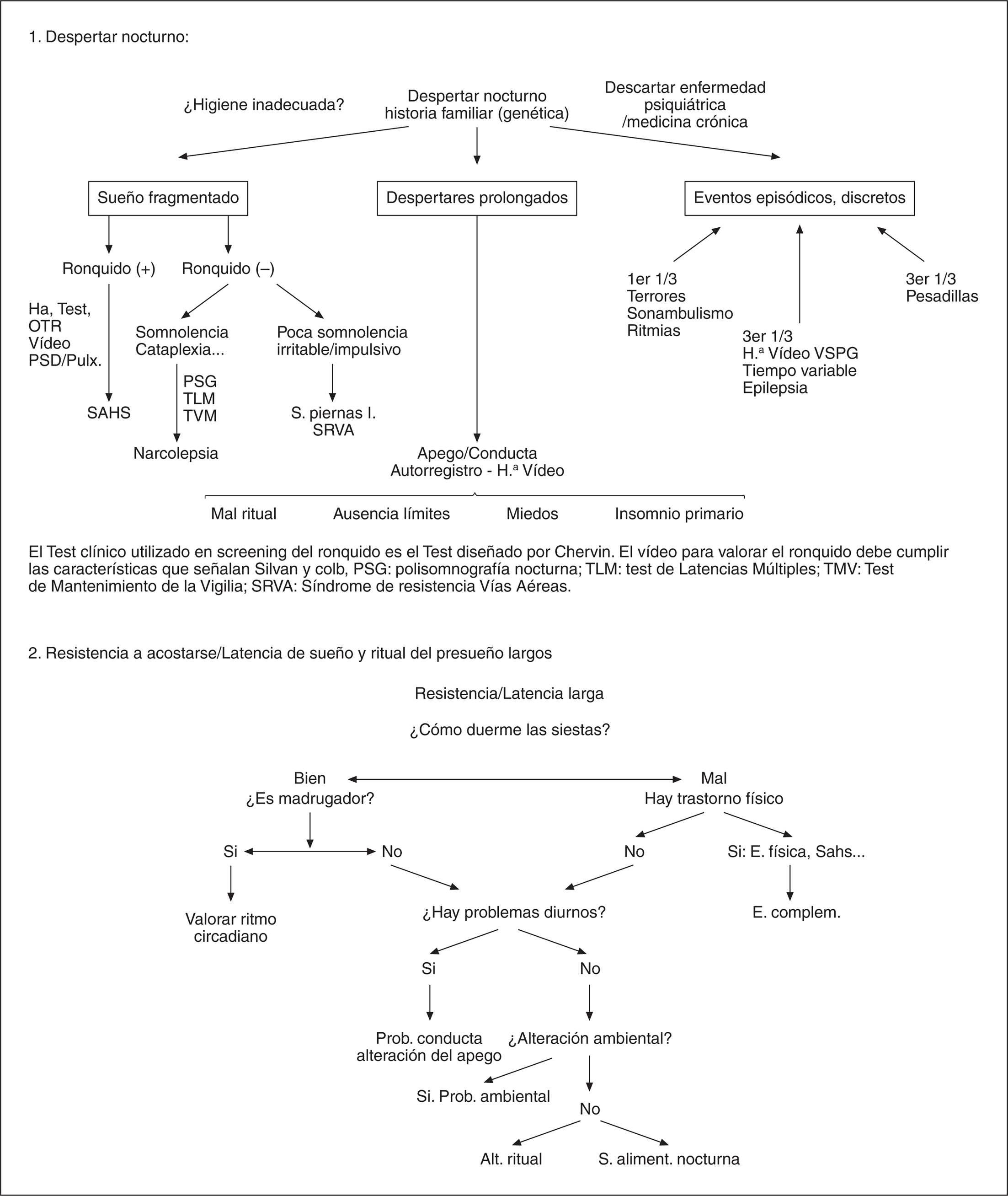
Para finalizar y con el objetivo de optimizar los recursos sanitarios, proponemos esquemas de diagnóstico diferencial que faciliten el uso racional de estos recursos.
BIBLIOGRAFÍA
1.Jodi A. Mindell, Judith A. Owens. A Clinical Guide to Pediatric Sleep. Diagnosis and Management of Sleep Problems. Lippincott Williams & Wilkins. Philadelphia.2003
CRISIS NOCTURNAS Y PARASOMNIAS EN LA INFANCIA DIAGNOSTICO DIFERENCIAL
R. Peraita-Adrados
Unidad Neurofisiológica de Sueño y Epilepsia. Hospital General Universitario Gregorio Marañón. Madrid.
Las parasomnias consisten en fenómenos episódicos que perturban el sueño nocturno. No son trastornos del sueño ni de la vigilia, per se, sino eventos inducidos o exacerbados por el sueño. Estos trastornos representan episodios de activación del Sistema Nervioso Central que implican al soma a través de las vías motoras y/o al sistema nervioso vegetativo, o a las funciones psíquicas. La prevalencia de las parasomnias es mayor en edad pediátrica, lo que sugiere que los factores madurativos y del desarrollo, adquieren una gran importancia en la etiología de estos trastornos. Las parasomnias en edad pediátrica son motivo de consulta muy frecuente en las unidades de sueño.
La historia clínica debe apoyarse en un interrogatorio minucioso del niño, de sus padres o familiares, y de la persona que comparte habitación con el paciente. El diagnóstico se basa en la historia clínica y en la historia de sueño; en la exploración general, neurológica y neuropsicológica; y en el registro vídeo-polisomnográfico (VPSG). La anamnesis debe completarse con la obtención del árbol genealógico, debido al carácter hereditario de estos procesos y con el fin de estudiar sus características fenotípicas, genéticas y moleculares.
El registro vídeo-EEG-PSG es el gold-standard para el estudio de diferentes tipos de crisis nocturnas y de algunas parasomnias, fundamentalmente los trastornos del arousal (terrores nocturno, sonambulismo y despertar confusional). Los requisitos indispensables consisten en un equipo vídeo-EEG digital sincronizado, un técnico cualificado y un neurofisiólogo clínico con acreditación en la interpretación de EEG y polisomnografía infantil.
El montaje EEG debe ser extenso (13 canales mínimo sistema 10-20) y el resto de la poligrafía comprende: EOG, ECG, EMGs submentoniano y del músculo Tibial anterior, flujo aéreo naso-bucal, esfuerzo respiratorio torácico y abdominal, y Sa O2.
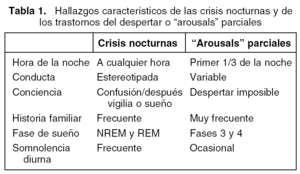
El diagnóstico clínico se documenta con un estudio VPSG en algunos casos, bien para caracterizar la parasomnia o bien, cuando se duda entre una parasomnia (normalmente un terror nocturno o un terror-sonambulismo) y una crisis epiléptica nocturna (tabla 1). El diagnóstico diferencial se basa en: 1) la existencia de crisis durante la vigilia y de anomalías paroxísticas intercríticas en el EEG, en caso de epilepsia; 2) la semiología crítica debido a que en la crisis epiléptica, además de las manifestaciones de terror y angustia, suele haber manifestaciones motoras, clonismos faciales, automatismos masticatorios, deglutorios, etc.; y por último, 3) la respuesta al tratamiento anticomicial con desaparición de las manifestaciones críticas que confirmará rotundamente la naturaleza de los episodios de difícil caracterización.
Si las crisis epilépticas son exclusivamente nocturnas, el diagnóstico diferencial con las parasomnias es obligatorio en ciertos casos de enuresis secundaria, terrores nocturnos, pesadillas, sonambulismo, movimientos rítmicos, bruxismo, etc. La Epilepsia Nocturna Frontal Autosómica Dominante (ENFAD) descrita en los últimos años plantea muchas veces enormes dificultades diagnósticas con algunas parasomnias y movimientos, incluso normales, durante el sueño. Los ataques consisten en crisis motoras de breve duración que no interrumpen el sueño y aparecen agrupadas. Los registros EEGs intercríticos son anodinos y durante las crisis suele aparecer una actividad delta rítmica en áreas anteriores. Los registros vídeo-EEG-PSG tienen la clave diagnóstica en estas epilepsias nocturnas1-3.
Otro problema diagnóstico lo constituye el hecho de que ciertas descargas epilépticas que se originan en estructuras profundas del lóbulo frontal no suelen observarse en los registros EEG convencionales. En estos casos es imprescindible utilizar electrodos especiales: nasofaringeos o supraorbitarios cuando el origen de la descarga epiléptica procede de la región frontorbitaria.
El EEG durante los trastornos del arousal muestra una combinación de frecuencias alfa, theta y delta, sin un patrón típico de vigilia. Recientemente se ha publicado que en ningún episodio sonambúlico hay una evidencia de un despertar completo aunque clínicamente el comportamiento sea muy complejo (sentarse en la cama, levantarse, etc.). El comportamiento del niño se caracteriza por una ausencia de respuesta a los estímulos y diferentes niveles de activación autonómica. El registro VPSG demuestra en muchos casos el factor desencadenante de la parasomnia: apnea obstructiva, reflujo gastro-esofágico, arritmia cardíaca, mioclonía hípnica, movimientos periódicos de las extremidades, etc.
Las crisis epilépticas y también las parasomnias provocan una perturbación del sueño incrementando su fragmentación, el número de cambios de fase, de arousals, y una disminución de la eficiencia y de la continuidad del mismo. La privación crónica de sueño resultante, provoca una somnolencia diurna excesiva y trastornos cognitivos y conductuales. Además, la privación de sueño disminuye el umbral convulsivo en pacientes epilépticos.
Las parasomnias ocasionales no precisan de ningún tratamiento farmacológico. El tratamiento se reserva para aquellos casos en los que exista un comportamiento que conlleve riesgo de lesiones para el niño o los que le rodean. Normalmente se utilizan las benzodiacepinas, principalmente el clonazepam, y los antidepresivos tricíclicos o los inhibidores de la recaptación de la serotonina. Las benzodiacepinas se deben administrar con precaución en las parasomnias y otros trastornos de sueño ya que influyen en la estructura del mismo.
El tratamiento de las causas subyacentes como las apneas obstructivas, el aumento de la resistencia de la vía aérea superior, el síndrome de piernas inquietas con movimientos periódicos de las extremidades elimina en la mayor parte de los casos el sonambulismo en niños. La psicoterapia y las técnicas de relajación se recomiendan en casos individualizados.
CONCLUSIONES
De todo lo anterior se deduce que las parasomnias tienen una prevalencia elevada en la infancia y, debido a que muchas epilepsias y síndromes epilépticos debutan en edad pediátrica, el diagnóstico diferencial se planteará en un número no despreciable de casos. La cuestión se complica todavía más si pensamos que algunos niños epilépticos pueden presentar, además de sus crisis comiciales, parasomnias. En todos los casos es necesaria una evaluación clínica minuciosa y una metodología de estudio adecuada.
La obtención del registro VPSG en el laboratorio de sueño es fundamental para el diagnóstico diferencial y, por consiguiente, para la administración de la terapia adecuada en cada caso.
BIBLIOGRAFÍA
1.Scheffer IE, Bhatia K Lopes-Cendes I, et al. Autosomal dominant frontal epilepsy misdiagnosed as sleep disorder. Lancet. 1994;343:515.
2.Oldani A, Zucconi M, Ferini-Strambi, et al. Autosomal dominant nocturnal frontal epilepsy: Electroclinical picture. Epilepsia. 1996;37:964-76.
3.Peraita-Adrados R, Piñeiro P, Diaz-Otero, et al. Autosomal dominant nocturnal frontal lobe epilepsy: a five generation spanish family with 14 affected members. J Sleep Res. 1998;7(suppl 2):S206.
ALTERACIONES RESPIRATORIAS DURANTE EL SUEÑO Y SINDROME DE PIERNAS INQUIETAS EN EL NIÑO CON SINDROME DE DÉFICIT DE ATENCION LIKE: ¿CAUSA O EFECTO?
E. Estivill
Clínica del Sueño Estivill. USP Instituto Universitario Dexeus, Barcelona.
SÍNDROME DE APNEA OBSTRUCTIVA DEL SUEÑO EN EL NIÑO
(Resumen del artículo publicado por Estivill y cols, en Anales de Pediatria)
INTRODUCCIÓN
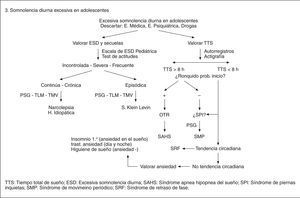
El Síndrome de Apnea Obstructiva del Sueño (SAOS) es un trastorno respiratorio relacionado con el sueño (síndrome de apneas-hipoapneas del sueño). Su frecuencia no es excepcional en la primera infancia y se incrementa en edades posteriores, pudiendo afirmar que es una patología frecuente en niños y, si no se trata, puede producir severas complicaciones1,2. Las principales complicaciones son: retraso en el crecimiento, problemas de comportamiento y dificultades en el aprendizaje, además de las repercusiones cardiocirculatorias y pulmonares. Si se trata precozmente, el SAOS y sus complicaciones suelen desaparecer en la mayoría de los niños1. Aunque recientemente han sido publicados excelentes artículos para dar a conocer el SAOS infantil entre los pediatras y otros especialistas en nuestro país3-5, parece aún existir comparativamente un nivel de infradiagnóstico inaceptable. El presente artículo es una revisión de la evidencia existente con relación al SAOS en los niños y tiene como objetivo el subrayar el importante papel de los pediatras en la detección precoz del SAOS infantil a partir de los niños que roncan, etapa fundamental para llegar al diagnóstico definitivo.
A falta de un consenso general sobre el mejor método para el diagnóstico y el tratamiento del SAOS infantil, la American Academy of Pediatrics ha provisto de una guía clínica para la detección precoz del SAOS en los niños2.
El SAOS consiste en la obstrucción completa (apnea obstructiva) y/o parcial (hipopnea) recurrente de las vías respiratorias durante el sueño6, con persistencia de la actividad de los músculos respiratorios y diafragmáticos, un reducido o ausente flujo naso-bucal, hipercapnia y desaturación oxihemoglobínica7.
Existen numerosos aspectos diferenciales entre el SAOS de los adultos y el SAOS observado en los niños. Clínicamente, los síntomas que caracterizan este síndrome en los niños son los ronquidos habituales, el sueño fraccionado y los problemas neurocomportamentales diurnos. A diferencia de los adultos con apneas del sueño, la somnolencia diurna no es frecuente en los niños con SAOS, aunque sí puede estar presente. En términos del diagnóstico, todavía no existe una definición aceptada universalmente para el SAOS infantil y no es posible utilizar los mismos criterios diagnósticos que en los adultos, al existir diferencias notables en cuanto a las formas de manifestación del SAOS en los niños.
En primer lugar, los niños pueden presentar un patrón de obstrucción parcial de las vías aéreas más frecuentemente asociado a hipercapnia (hipoventilación obstructiva), que a episodios de apnea como los adultos8. En segundo lugar, los criterios diagnósticos estándares para un adulto9 requieren de la presencia de somnolencia diurna y de más de 5 apneas por hora de sueño; además, las apneas deben tener una duración mínima de 10 segundos. Estos criterios no son válidos para los niños con SAOS, primero, porque no suelen tener somnolencia diurna clara y segundo, porque apneas de duración menor a 10 segundos pueden asociarse a desaturaciones de oxígeno importantes; asimismo, los niños pueden presentar sólo episodios de hipoventilación10. Finalmente, en los niños con SAOS a menudo no se
observan arousals corticales (mini-despertares o despertares eléctricos) al final de las apneas, especialmente en los niños más pequeños, aunque sí son muy frecuentes los arousals autonómicos y los movimientos11. La ausencia de arousals corticales podría explicar por qué la excesiva somnolencia diurna del SAOS del adulto es muy poco frecuente en el SAOS infantil12.
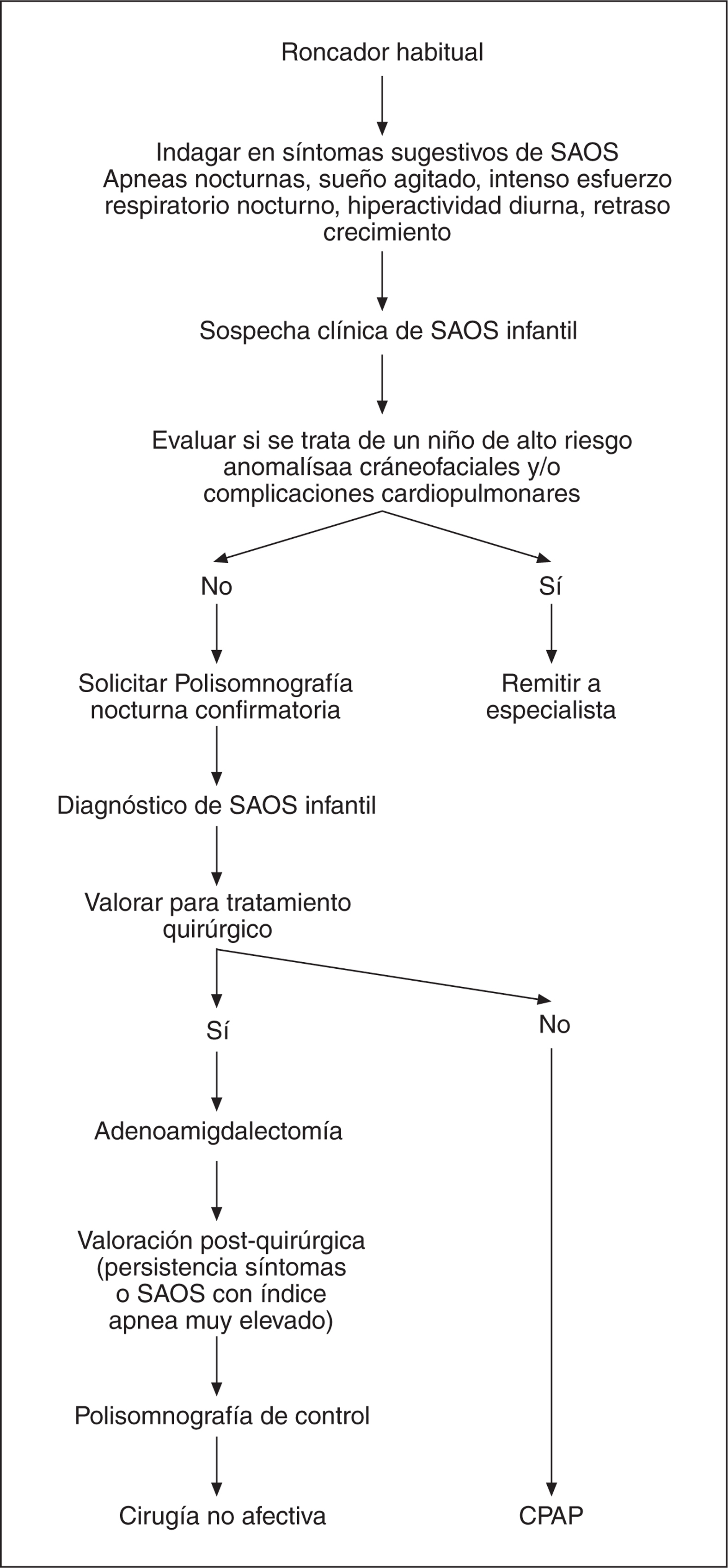
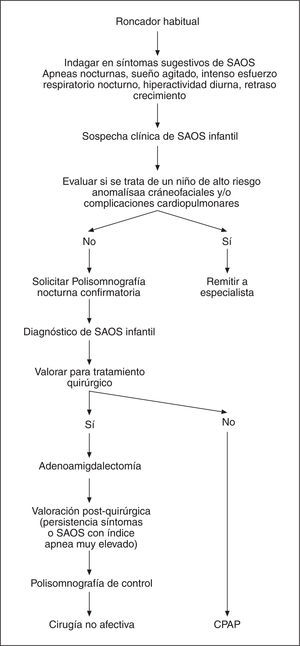
En la figura 1 se ha elaborado un algoritmo que resume los aspectos más importantes para el manejo diagnóstico y terapéutico del SAOS en la infancia.
Figura 1. Algoritmo para el manejo del SAOS infantil.
EPIDEMIOLOGÍA
El SAOS está presente en niños de todas las edades, desde los neonatos a la edad adolescente. Se estima que la incidencia del síndrome de apnea obstructiva del sueño en edad pediátrica gira alrededor del 1 al 3%, afectando preferentemente a los niños de edad comprendida entre los 2 y los 5 años13, periodo en el cual el tejido linfático está hipertrófico. Aunque no se conoce bien la historia natural ni el pronóstico a largo plazo del SAOS infantil, un estudio llevado a cabo en una población de adolescentes de edades comprendidas entre los 12 y 16 años, mostró que la frecuencia de los síntomas asociados a alteraciones respiratorias durante el sueño era similar a la referida en los niños14. Asimismo, los niños con ronquido primario no tienden a progresar a SAOS con el tiempo15.
A diferencia de lo que observamos en los adultos, no existen diferencias relevantes en cuanto al sexo. Finalmente, debe destacarse que resulta difícil conocer la prevalencia real del SAOS infantil ya que la mayor parte de los estudios publicados fueron llevados a cabo con criterios polisomnográficos heterogéneos1.
ETIOLOGÍA Y FACTORES DE RIESGO
La causa más frecuente del SAOS en el niño es la hipertrofia adenoamigdalar, aunque se ha comprobado que la gravedad del SAOS no tiene correlación con la dimensión de las amígdalas o de las adenoides. Se ha sugerido que la hipertrofia adenoamigdalar probablemente no actuaría como única causa de las alteraciones respiratorias observadas durante el sueño, sino que precipitaría el SAOS en aquellos niños con previas alteraciones funcionales de las vías aéreas16.
Al contrario de lo que sucede en los niños17, en muchos casos de SAOS en adultos no es posible identificar la zona específica de obstrucción dentro de la faringe. Como causa del SAOS en los adultos, se ha señalado la necesidad de una alteración del tono y de la distensibilidad muscular, una descoordinación neurológica y diversas alteraciones en el calibre de la vía aérea superior16.
Normalmente los niños tienen las vías aéreas inferiores relativamente estrechas pero mantienen su permeabilidad durante el sueño, gracias al aumento de tono neuromotor del impulso ventilatorio central. Podría pensarse que el SAOS infantil se manifiesta en aquellos niños con un deficiente mecanismo compensatorio de aumento de tono neuromotor de las vías aéreas inferiores16. Otras causas importantes de SAOS en la infancia son las anomalías cráneofaciales18, como la micrognatia, la retrognatia, el paladar duro elevado, el paladar ojival, el paladar blando alargado; y diversos síndromes, como el de Pierre-Robin, el de Crouzon, el de Teacher-Collins, el de Apert y el síndrome de Down. Todos estos cuadros pueden presentar un espacio faríngeo muy reducido. Algunas enfermedades neuromusculares también pueden ser causa de SAOS infantil: la malformación de Arnold-Chiari tipo I y II, la distrofia miotónica, las miopatías y otras enfermedades musculares.
MANIFESTACIONES CLÍNICAS
El síntoma más frecuente de SAOS en los niños es el ronquido nocturno. La incidencia del ronquido nocturno en los niños se ha estimado que oscila entre el 7 y el 9%19. Sin embargo, el ronquido no siempre está asociado a síntomas diurnos significativos ni tampoco a alteraciones polisomnográficas (hipoxemia, hipercapnia o fragmentación del sueño) que puedan indicar la presencia de apneas. Este ronquido sin otras manifestaciones ha sido definido como ronquido primario. En el ronquido primario, el índice de apnea-hipopnea por hora de sueño (IAH) es inferior a 1, no se producen desaturaciones de oxígeno significativas, ni tampoco presentan hipercapnia20.
Sólo un subgrupo de niños roncadores habituales presenta además un SAOS. Los síntomas nocturnos observables en estos niños son el ronquido continuo, un aumento del esfuerzo respiratorio con respiración paradójica, sueño agitado no reparador (restless sleep), hipersudoración nocturna, apneas observadas por parte de los padres, posturas anormales de la cabeza con el fin de mantener permeable las vías aéreas (hiperextensión de la cabeza) enuresis nocturna y parasomnias, como terrores nocturnos, pesadillas o sonambulismo. En los casos graves de SAOS, los síntomas diurnos más frecuentes son la respiración oral diurna, las dificultades de atención (déficit de atención e hiperactividad), los problemas de comportamiento y de rendimiento escolar, la irritabilidad, la agresividad y la somnolencia excesiva diurnas, la cefalea matinal, la infecciones recurrentes de las vías aéreas superiores, la boca seca al despertarse, los síntomas asociados a la hipertrofia adenoamigdalar y el retraso en el crecimiento.
COMPLICACIONES
El SAOS infantil sin tratamiento puede producir severas consecuencias. Los primeros estudios llevados a cabo indicaban como complicaciones principales el retraso en el crecimiento, el cor pulmonale y el retraso mental8. Estas graves secuelas hoy parecen menos comunes, probablemente gracias al diagnóstico precoz y al tratamiento. Sin embargo, en niños con SAOS pueden encontrarse diversos grados asintomáticos de hipertensión pulmonar22 y de hipertensión sistémica23. En los niños diagnosticados de SAOS, se ha demostrado que las complicaciones cardiocirculatorias (hipertensión pulmonar, cor pulmonale, disfunción ventricular derecha) pueden revertir después de la adenoamigdalectomía o de otras intervenciones quirúrgicas24.
Numerosos estudios han demostrado que el sueño fragmentado y la hipoxemia pueden ser causa de modificaciones neurocognitivas posteriores en edad adulta. Por lo tanto, la fragmentación del dueño y la hipoxemia asociada al SAOS deberían comprometer también al rendimiento cognitivo y neuropsicológico en los niños y en los adultos. En tanto que los niños atraviesan un periodo de rápido aprendizaje y desarrollo, sería lógico pensar que, en los niños con SAOS, el impacto de su mal dormir y de la respiración anormal podría ser más grave10. En un reciente trabajo de revisión de la literatura1, se han encontrado diversas publicaciones que evalúan la asociación entre problemas de comportamiento, especialmente hiperactividad o alteración por déficit de atención e hiperactividad (ADHD), con los problemas respiratorios durante el sueño. En un estudio sobre 988 niños portugueses, se ha indicado que los roncadores habituales tenían una puntuación dos veces alterada en el Children Behavioral Questionnaire, respecto a los no roncadores25.
Otra complicación muy frecuente observada en el SAOS infantil es el retraso en el crecimiento. Este retraso en el crecimiento se ha atribuido al incremento en el gasto energético por el esfuerzo respiratorio durante el sueño y a la reducción en la secreción de la hormona del crecimiento. Marcus et al26 hicieron un estudio polisomnográfico sobre un grupo de niños, antes y después la adenoamigdalectomía, demostrando que el gasto energético disminuía y el peso aumentaba después la intervención quirúrgica. En un reciente estudio, Nieminen et al27 demostraron que los factores de crecimiento IGF-I y IGFBP-3 aumentaban significativamente en los niños operados.
DIAGNÓSTICO
El diagnóstico de SAOS infantil suele realizarse mediante la historia clínica, el examen físico, el registro de vídeo o audio, la pulsioximetría/capnografía nocturna y el estudio polisomnográfico. El estudio polisomnográfico es en la actualidad el gold standar' para confirmar el diagnóstico y evaluar la gravedad del SAOS. Dada que la polisomnografía es una técnica costosa y aún no fácilmente disponible en todos los centros, algunos autores2 consideran que una buena aproximación al diagnóstico inicial del SAOS infantil podría realizarse mediante la clínica, un vídeo doméstico y la poligrafía cardiorrespiratoria. Sin embargo, la poligrafía cardiorrespiratoria (que analiza las variables cardiorrespiratorias y no las neurofisiológicas) aún no ha sido validada en niños de manera apropiada4.
Historia clínica y examen físico
Es muy improbable que los niños puedan presentar SAOS sin ronquido. Por lo tanto, debería ser de rutina el investigar este síntoma1. Así mismo, es importante preguntar a los padres si han observado apneas o paradas respiratorias durante el sueño de sus hijos, sueño agitado, enuresis, cianosis, excesiva somnolencia diurna, problemas comportamentales o dificultades en el aprendizaje28. Normalmente el examen físico es normal, aunque pueden hallarse anormalidades no específicas como hipertrofia adenoamigdalar, respiración bucal, obstrucción nasal o facies adenoidea. También podrían estar presentes algunas de las complicaciones del SAOS. Pero la historia clínica y el examen físico por sí solos no conducen a un diagnostico de certeza. En 1984, Brouillette et al realizaron un estudio para evaluar la eficacia diagnóstica de un cuestionario clínico a partir del cual se determinaba una puntuación de SAOS (OSAS score)29. Según esta puntuación de SAOS, si el valor era > 3,5 entonces era predictivo de diagnóstico de SAOS en la polisomnografía y si la puntuación de SAOS era < -1 se excluía la presencia de SAOS. Desafortunadamente, las tres cuartas partes de los sujetos tenían una puntuación de SAOS indeterminada y, por lo tanto, esta puntuación de SAOS por sí sola tiene escasa utilidad con fines diagnósticos.
Polisomnografía nocturna (PSG)
La polisomnografía nocturna (PSG) es la única técnica diagnóstica que evalúa cuantitativamente las alteraciones ventilatorias y estructurales del sueño que aparecen asociadas a los trastornos respiratorios que se manifiestan mientras el individuo duerme. Actualmente, la PSG es el gold standard para hacer el diagnóstico de SAOS, haciendo posible el diagnóstico diferencial del ronquido primario1. Asimismo, la PSG permite determinar el riesgo de las complicaciones posintervención29 en los casos quirúrgicos de SAOS. Durante la PSG se registran las diversas señales electrofisiológicas, como son el electroencefalograma (C3, C4, O1, O2 ó C3 y O2), electrocardiograma, electrooculograma y el electromiograma; los movimientos de la pared torácica y del abdomen; el flujo aéreo naso-bucal; la oxigenación (con la pulsioximetría o mediante la monitorización de la presión transcutánea de oxígeno) y las medidas de retención de CO2 (con termistores oronasales y/o sensores de CO2 nasales). Al mismo tiempo, puede realizarse una monitorización audiovisual del sueño, aunque no debe considerarse como una técnica diagnostica sustitutiva de la PSG29.
En el niño, una apnea obstructiva se define como la ausencia de flujo respiratorio naso-bucal en presencia de esfuerzo respiratorio continuo, que se acompaña de una reducción de la saturación de oxigeno del 4% y que presenta una duración mayor a 2 ciclos respiratorios. Una hipopnea obstructiva se define como una reducción de al menos el 50% de la amplitud del flujo naso-bucal en presencia de esfuerzo respiratorio, de duración mayor a 2 ciclos respiratorios y con reducción de la saturación de oxigeno del 4%20. En los niños, puede diagnosticarse un SAOS cuando el índice de apnea (IA) o el índice de apnea/hipopnea (IAH) son patológicos. El índice de apnea (IA) es patológico cuando supera 1 evento por hora de sueño (IA > 1/h); el índice de apnea/hipopnea (IAH) es patológico cuando supera los 5 eventos por hora de sueño (IAH > 5/h). La ATS acepta como criterios de SAOS en niños, un IAH superior a 3. Asimismo, en 1995 fueron propuestos unos criterios de gravedad del SAOS en los niños que recogía tanto síntomas como parámetros polisomnográficos. Posteriormente se ha comprobado que la gravedad del SAOS en los niños tiene implicaciones terapéuticas y pronósticas1.
TRATAMIENTO
Amigdalectomía y adenoidectomía
La adenoamigdalectomía es el tratamiento más común y más eficaz en los niños con SAOS. La sola adenoidectomía puede no ser suficiente para la resolución completa de los síntomas30. Después de la intervención quirúrgica, se solucionan las alteraciones polisomnográficas entre el 75% y los 100% de los casos30, y desaparecen los síntomas. La respuesta es también muy efectiva en los niños obesos. Las posibles complicaciones de la adenoamigdalectomía son las producidas por la anestesia, la hemorragia y dolor local. Así mismo, en el postoperatorio de los niños con un SAOS grave, se ha descrito la aparición de complicaciones respiratorias, como un empeoramiento del SAOS y edema pulmonar, que deben ser tenidas en cuenta por los anestesistas5.
Después de la intervención, debería realizarse una PSG de control a los niños que siguen roncando y a aquellos que tenían previamente un IAH elevado.
Presión aérea positiva continua
La terapia con CPAP (continuous positive airway pressure) es una alternativa váilda a la cirugía, en aquellos niños con tejido amigdalar mínimo o/y persistencia de SAOS después la adenoamigdalectomía. Las indicaciones más comunes para la utilización del CPAP en los niños son la obesidad, las anomalías cráneofaciales y el síndrome de Down. El CPAP también puede ser útil en el período peri-intervención para reducir el edema de los tejidos blandos. Por otro lado, se ha recomendado prestar especial atención al cumplimiento del CPAP en los niños con esta terapia31.
CONCLUSIONES
El síndrome de apnea obstructiva del sueño en la infancia es una importante alteración respiratoria que afecta entre el 1 y el 3% de los niños.
Las principales complicaciones y secuelas del síndrome de apnea obstructiva del sueño en la infancia pueden incluir desde la inhibición del crecimiento a las complicaciones cardiopulmonares (hipertensión pulmonar, cor pulmonale, disfunción ventricular derecha), pasando por un aumento del riesgo de padecer hiperactividad y significativas dificultades de aprendizaje.
Las consecuencias clínicas del SAOS infantil pueden ser tan severas, que ante un SAOS significativo no está justificada una actitud expectante.
Los pediatras deberían investigar sobre el ronquido y las posibles dificultades respiratorias de los niños.
El ronquido nocturno es el síntoma más frecuente. Otros síntomas asociados son las apneas nocturnas manifestadas por los padres, la hipersudoración nocturna, el sueño agitado o no reparador, las posturas anormales en hiperextensión de la cabeza, la enuresis nocturna y las parasomnias.
A diferencia de los adultos, la somnolencia diurna excesiva es excepcional en los niños con SAOS.
Ante la sospecha clínica de SAOS en un niño, debe solicitarse una polisomnografía nocturna para confirmar el diagnóstico y evaluar la severidad del cuadro.
Si el niño presenta un SAOS con complicaciones adicionales o de alto riesgo, deberá ser referido a un especialista.
El tratamiento de elección en la mayoría de los niños con SAOS simple es la adenoamigdalectomía, alcanzando la curación entre el 75 y el 100% de los casos, incluyendo la remisión de los síntomas.
El CPAP es el tratamiento alternativo cuando la adenoamigdalectomía deba retrasarse, esté contraindicada o no resulte efectiva.
Los pediatras tienen un papel esencial en la detección precoz del síndrome de Apnea obstructiva del sueño infantil, y por lo tanto, en la prevención de sus complicaciones y secuelas.
BIBLIOGRAFÍA
1.Schechter MS, and the Section of Pediatric Pulmonology, Subcommittee on Obstructive Sleep Apnea Syndrome. Technical report: diagnosis and management of childhood obstructive apnea syndrome. Pediatrics. 2002;109:4
2.Durán J, Rubio R. Síndrome de apneas-hipopneas durante el sueño en el niño. Anales Españoles de Pediatria. 2001;54;4-6.
3.Vila Asensi JR, De Miguel JM. Síndrome de apnea obstructiva en la infancia. An Esp Pediatr. 2001;54:58-64.
4.Gonzalez Pérez-Yarza E, Durán J, Sánchez-Armengol A, Alonso ML, De Miguel J, Municio JA. SAHS en niños y adolescentes. Clínica, diagnóstico y tratamiento. Arch Bronconeumol. 2002;38(Supl 3):34-9.
5.American Academy of Pediatrics. Clinical practice guideline: diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2002;109:704-12.
6.American Thoracic Society. Standards and indications for cardiopulmonary sleep study in children. Am J Respir Crit Care Med. 1996;153:866-78.
7.Bruni O. Principi di medicina del sonno nel bambino. Mediserve, 2000.
8.Bruillette RT, Fernbach SK, Hunt CE. Obstructive sleep apnea in infants and children. J Pediatr. 1982;100:31-40.
9.ICDS-International classification of sleep disorder. Diagnostic and coding manual. Diagnostic Classification Steering Committee. Rochester Minnesota: American Sleep Disorder Association, 1990.
10.Rosen CL. Obstructive sleep apnea syndrome (OSAS) in children: diagnostic challenges. Sleep. 1996;19(10 suppl):s274-7.
11.McNamara F, Issa FG, Sullivan CE. Arousal pattern following central and obstructive breathing abnormalities in infants and children. J Appl Physiol. 1996;81:2651-7.
12.Marcus CL. Obstructive sleep apnea syndrome: differences between children and adults. Sleep. 2000;23 suppl 4:S140-1.
13.Gislason T, Benediktsdottir B. Snoring, apneic episodes, and nocturnal hipoxemia among children 6 months to 6 years old. An epidemiological study of lower limit of prevalence. Chest. 1995;107:9636-96.
14.Sánchez-Armengol A., Fuentes-Pradera MA, Capote-Gil F, García-Díaz E, Cano-Gómez S, Carmona-Bernal C, et al. Sleep-related breathing disorder in adolescents aged 12 to 16 years. Clinical and polygrafic findings. Chest. 2001;119:1393-400.
15.Marcus CL, Hamer A, Loughlin GM. Natural history of primary snoring in children. Pediatr Pulmonol. 1998;26:6-11.
16.Marcus CL.Pathophysiology of childhood obstructive sleep apnea: current concepts. Respir Physiol. 2000;119(2-3):143-54.
17.Estivill E, Esteller E. El paciente roncador. Formación médica Continuada en Atención Primaria 8;7:439-46.
18.Chervin RD, Guilleminault C. Obstructive sleep apnea and related disorders. Neurol Clin. 1996;14:583-609.
19.Ali NJ, Pitson D, Stradling JR. Prevalence of snoring, sleep disturbance and sleep related breathing disorders and their relation to daytime sleepiness in 4-5 years old children. Am Rev Respir Dis. 1991;143:A381.
20.Carroll JL, McColley SA, Marcus CL, Curtis S, Loughlin GM. Inability of Clinical history to distinguish primary snoring from obstructive sleep apnea syndrome in children. Chest. 1995;108:610-18.
21.Carroll JL, Loughlin MG. Obstructive sleep apnea syndrome in infants and children: diagnosis and management. In: Ferber R, Kryger M: Principles and practice of sleep medicine in the child. WB Saunders, Philadelphia 1995, pp. 163-91.
22.Tal A, Leiberman A, Margulis G, Sofer S. Ventricular dysfunction in children with obstructive sleep apnea: radionuclide assessment. Pediatr Pulmonol. 1988;4:139-43.
23.Marcus CL, Greene MG, Carroll JL. Blood pressure in children with obstructive sleep apnea. Am J Resp Crit Care Med. 1998;157:1098-103.
24.Ross RD, Daniels SR, Loggie JM, Meyer RA, Ballard ET. Sleep apnea associated hypertension and reversible left ventricular hypertrophy. J Pediatr. 1987;111:253-5.
25.Ferreira AM, Clemente V, Gozal D, Gomes A, Pisarra C, Cesar H, et al. Snoring in Portuguese primary school children. Pediatrics. 2000;106:E64.
26.American Thoracic Society. Cardiorespiratory sleep studies in children. Establishment of normative data and polysomnographic predictors of morbidity. Am J Respir Crit Care Med. 1999;160:1381-7.
27.Marcus CL, Carroll JL, Koerner CB, Hamer A, Lutz J, Loughlin GM. Determinants of growth in children with the obstructive sleep apnea syndrome. J Pediatr. 1994;125:556-62.
28.Nieminen P, Löppönen T, Tolonen U, Lanning P, Knip M, Löppönen H. Growth and biochemical markers of growth in children with snoring and obstructive sleep apnea. Pediatrics. 2002;109:4.
29.Brouillette RT, Hanson D, David R, Klemka L, Szatkowski A, Fernbach S, et al. A diagnostic approach to suspected obstructive sleep apnea in children. J Pediatr. 1984;105:10-4.
30.Zucconi M, Strambi LF, Pestalozza G, Tessitore E, Smirne S. Habitual snoring and obstructive sleep apnea syndrome in children: effects of early tonsil surgery. Int J Pediatr Otorhinolaryngol. 1993;26:235-43.
31.Esteller E, Estivill, E. El ronquido y el Síndrome de Apnea Obstructiva en los niños. Vigilia-Sueño. 2000;12(Supl.):29-35.
SINDROME DE PIERNAS INQUIETAS
(Resumen extraído del artículo de Pin y Estivill, publicado en Vigilia-Sueño)
El Síndrome de Piernas Inquietas ha sido descrito casi de manera anecdótica en niños1. Sin embargo, en una encuesta realizada a 138 adultos un 20% de los mismos informaron que sus síntomas empezaron antes de los 10 años de edad pero fueron atribuidos a "dolores de crecimiento", Síndrome Déficit de Atención o problemas psicológicos2 de manera que el Síndrome de Piernas Inquietas a menudo es ignorado por los padres o considerado como un hecho normal.
Picchietti y colbs3 realizaron la primera serie clínica que describe con detalle la presencia del S. De Piernas Inquietas (SPI) en niños y adolescentes sin otra entidad clínica asociada.
En dicho artículo llama poderosamente la atención, que en sólo 25 de los 129 casos estudiados, los padres eran conscientes de las alteraciones del sueño que sufrían sus hijos; e incluso después de recibir instrucciones concretas sobre este síndrome, hasta en 39 pacientes con el síndrome demostrado por PLSG los padres no notaron ninguna alteración del sueño. Walters y colaboradores encontraron por medio de un cuestionario en adultos que el 18% de los síntomas habían comenzado antes de los 10 años de edad y el 25% entre los 10 y los 20 años4.
Estos datos, unidos al hecho de que la mayoría de los padres no son conscientes de la relación entre los síntomas diurnos de sus hijos y el SPI (incluso después de ser encuestados directamente en su búsqueda), cuestionan la validez de las encuestas no dirigidas para su diagnóstico clínico de sospecha y podrían explicar su escasa incidencia en la clínica pediátrica y su confusión con espasmos, alteraciones del REM, dolores de crecimiento o fenómenos normales
El diagnostico del SPI es eminentemente clínico pero en su artículo Picchietti y colbs identifican el SPI por su asociación con los movimientos periódicos de las extremidades. Utilizan un EMG del tibial anterior que muestre una secuencia de cuatro o más movimientos de las piernas, (mioclonus) cada uno de 0,5 a 5 seg. de duración separados al menos por 5 seg. pero no por más de 90 seg.
La intensidad del síndrome la clasifican en:
Medio: índice de 525.
Moderado: índice de 2550.
Severo: índice mayor de 50 o un índice de arousal inducido por el Síndrome de Piernas Inquietas de más de 25.
Según este criterio clínico muchos de los niños de entre 3 y 12 años de edad que, con una incidencia de entre un 1530% refieren dolores idiopáticos de extremidades (mal llamados dolores de crecimiento) caracterizados por inquietud motora nocturna asociada, en algunas ocasiones, a dolor de corta duración y despertares nocturnos, en realidad estarían refiriendo la clínica del S. de Piernas Inquietas ante pediatras desconocedores de este cuadro.
Desde el punto de vista neurofisiológico los hallazgos EEG en el Síndrome de Piernas Inquietas en la Infancia son:
Latencia: La latencia de sueño es normal o algo acortada mientras que la latencia de sueño REM es normal.
Arquitectura: La progresión de los estadios es normal, pero hay una significativa fragmentación y disrupción de la arquitectura como resultado de los arousal y despertares secundarios a los movimientos periódicos de las extremidades.
EMG: Episodios de contracturas repetitivas de 0,5 a 5 seg. (media 1,52,5 seg.) en una o las dos piernas. El intervalo típico entre movimientos es de 2040 seg. Los movimientos con intervalos menores de 5 seg. o mayores de 90 seg. no se cuentan.
EEG: Normal, a menudo se asocian complejos K a los movimientos de las piernas.
Respiración: Normal.
Comentario: Los movimientos periódicos están ausentes durante el sueño REM. Comienzan en el estadio I, alcanzan el máximo en el estadio 2, y tienden a disminuir en el sueño de ondas lentas. Se observa un discreto incremento de la FC y de la TA. Esta situación puede afectar también a los brazos.
Billard y colaboradores han observado un gran número de arousal electroencefálicos anteriores a los movimientos periódicos de los miembros, lo cual sugiere que no son simplemente consecuencia de los movimientos periódicos; al contrario, estos resultados indican que los movimientos periódicos son la manifestación de un desorden del arousal subyacente
Se ha sugerido una herencia autosómica dominante debido al alto porcentaje de antecedentes familiares, de manera que el SPI moderado en la infancia puede ser un precedente del SPI del adulto. El 32% de los padres biológicos de los niños con Síndrome de Piernas Inquietas tienen síntomas de SPI.
Los movimientos periódicos de las extremidades siempre acompañan al SPI pero también pueden presentarse de forma aislada, generalmente benigna o asociados a otros cuadros entre los que podemos citar:
Anemia por déficit de Fe: Se observa una mejoría del sueño si los niveles de ferritina son superiores a 50 mcg/l.
Leucemia infantil.
Aparición tras la administración de irradiación craneal y metotrexato intratecal.
Fibromialgia juvenil: Un 38% de los niños con fibromialgia presentan un índice de más de 5 movimientos/ hora
S. de Williams: En una serie de 7 niños con S. de Williams los siete presentaban SPI. La interrupción de la arquitectura del sueño podría explicar algunos de los problemas de conducta descritos en los niños con S. de Williams
S. de Gilles de la Tourette.
S. de Déficit de Atención con Hiperactividad: Parece existir una comorbilidad entre el SDAH y el S. de Piernas Inquietas en la infancia. Aunque los padres generalmente tienen impresiones falsamente positivas y falsamente negativas de la incidencia de este síndrome en sus hijos, la prevalencia de los movimientos periódicos de los miembros durante el sueño es mayor en los niños con S de Déficit de Atención con Hiperactividad (SDAH) que en los controles. Los niños con SDAH de edades comprendidas entre los 2 y los 15 años presentan en un 26% de los casos más de 5 movimientos de piernas por hora con interrupciones del sueño, mientras que, por el contrario, los niños de la misma edad comparables presentan el S. de Piernas Inquietas sólo en un 5% de los casos. Aquellos niños con S. de Déficit de Atención con un índice de movimientos periódicos de los miembros mayor de 5 por hora suelen presentar una historia clínica de problemas de inicio de sueño y/o de mantenimiento del sueño.
Muchos de los movimientos periódicos en los niños con S. de Déficit de Atención se asocian a arousal.
Esta asociación entre S. de Déficit de Atención con Hiperactividad y el S. de Piernas Inquietas se podría explicar por herencia genética, déficit de dopaminérgicos o por ambas mientras que la medicación estimulante que se usa para tratar el SDAH no parece jugar un papel en la génesis del S. De Piernas Inquietas.
La alteración del sueño que se asocia al S. De Piernas Inquietas junto con la intranquilidad motora durante la vigilia presente en los niños con SDAH, podría contribuir a incrementar la falta de atención y la hiperactividad de los niños con el S. de Déficit de Atención con Hiperactividad si bien hay autores que opinan que, en algunos casos, las alteraciones del sueño podrían ser más la causa que los efectos de la hiperactividad Quizás por ello Walters y colbs concluyen su investigación afirmando que la mejoría observada en los niños con S. de Hiperactividad y Déficit de Atención tras el tratamiento con agentes dopaminérgicos se debería tanto a una disminución de las alteraciones e interrupciones del sueño como a la presencia tanto en el S. de Déficit de Atención como en el S. De Piernas Inquietas de un déficit común de dopaminérgicos
Desde el punto de vista clínico, en la historia clínica de los niños con el S. De Piernas Inquietas sin otra asociación destaca3:
Problemas escolares.
Problemas para el inicio del sueño (latencias mayores de 20 minutos).
Problemas para el mantenimiento del sueño (más de dos despertares por noche).
Historia familiar positiva para el S. de Piernas Inquietas.
Estos niños duermen menos tiempo que sus coetáneos (0,9 h menos que lo ideal para su edad) lo que parece indicar que no compensan la pérdida de calidad de sueño con un incremento de la cantidad del mismo.
En resumen, este Síndrome debería ser sospechado en la clínica de asistencia primaria pediátrica ante la presencia o agudización de:
Latencia del sueño que se alarga (mayor de 15 min.)
Que se acompaña de lucha para acostarse.
Y coincide con un aumento de los despertares nocturnos.
Y además se aprecian signos de inquietud motora o exceso de actividad motora nocturna. La PLSG, que no es imprescindible para el diagnostico, puede confirmar la presencia de movimientos periódicos durante el sueño.
Cualquier recomendación sobre su tratamiento y la eficacia del mismo en niños y adolescentes debe esperar más datos provenientes de la investigación aunque en casos severos podemos intentar el uso de los nuevos agonistas dopaminérgicos como el Ropinirol o Mirapexin a dosis de 0,25 mg el primero y medio comprimido el segundo, tomados 2 horas antes de acostarse. Sus escasos efectos secundarios los puede hacer adecuados para tratar esta patología en niños y adolescentes.
BIBLIOGRAFÍA
1.Arens R, Wright B, Elliott J, Zhao H, Wang P, Niamey T, Kaplan P. Periodic limb movement in sleep in children with Williams syndrome. J.Pediatr. 1998;133:670-4.
2.Walters AS, Hickey K, Maltzman J et al. A questionnaire study of 138 patients with restless legs syndrome: the "night-walkers" survey. Neurology. 1996;46:92-5.
3.Picchietti DL, Walters AS. Moderate to severe Periodic Limb Movement Disorder in Childhood and Adolescence. Sleep. 1999;22:297-300.
4.Walters AS, Hickey K, Maltzman J, et al. A questionnare study of 138 patients with restless legs syndrome. The "night-walkers" survey. Neurol. 1996;46 92-5.
DEL LABORATORIO DEL SUEÑO A LA PRACTICA CLINICA: ESQUEMAS DIAGNOSTICOS EN MEDICINA DEL SUEÑO PEDIATRICA
G. Pin Arboledas, M. Cubel Alarcón y M. Morell Salort
Unidad Valenciana del Sueño. Hospital Quirón Valencia.
OBJETIVO
Presentar esquemas diagnósticos que ayuden a la comprensión de la patogenia del insomnio infantil y a realizar un diagnóstico diferencial de las principales alteraciones del sueño en la edad pediátrica desde la consulta de la Unidad del Sueño. El objetivo final es facilitar la planificación de las exploraciones complementarias, de forma que se puedan optimizar los recursos sanitarios utilizados.
INTRODUCCIÓN
El dormir toda la noche es un ítem del desarrollo psicomotor gobernado principalmente por factores madurativos, constitucionales y genéticos sobre los que el ambiente ejerce un papel modulador. Heath et al encontraron que las influencias genéticas explican al menos el 33% de las variables de la calidad de sueño y de las alteraciones del mismo y entre el 20-40% de las variaciones en los patrones de sueño. De manera que el sueño es un claro ejemplo de evento biopsicosocial: Los estímulos apropiados o inapropiados para iniciar y mantener el sueño a lo largo de la noche suelen establecerse hacia los 3-4 meses de edad, de manera que esta edad es un determinante importante para el inicio de los problemas del sueño. Cada vez tenemos más evidencias que sugieren que la organización del sueño infantil se produce más rápidamente en condiciones de una estimulación coordinada y escasa y en un ambiente de estímulo medido, coordinado y rítmico que ocasiona unos estados mejor definidos de sueño y vigilia, mayor cantidad de sueño tranquilo y menor inquietud y llanto. De manera que los cuidadores del niño influyen profundamente en el desarrollo de la organización del sueño alterándolo si lo sobreestimulan.
FRECUENCIA
La frecuencia de las alteraciones del sueño en la edad pediátrica es alta convirtiéndose el sueño, en muchas ocasiones, en un problema social. En un estudio realizado por nosotros en familias con niños hasta los 6 años los resultados mostraron:
1) Una alta incidencia de interrupciones del sueño durante el primer semestre de la vida (53,3%).
2) A partir del tercer año de vida se producía un importante descenso de los despertares nocturnos. A pesar de ello, a los 6 años un 18,6% de los niños interrumpían el sueño familiar al menos 3 veces por semana.
3) Elevado porcentaje de niños de 6 años que no habían aprendido a dormirse por sí mismos (12,1%).
De la misma manera en la investigación llevada a cabo por nuestro grupo entre 730 adolescentes de 13-14 años los hallazgos fueron:
1) Latencia de sueño de 40 minutos en 11,9% de la muestra.
2) Incidencia de despertares nocturnos: un 16,5% indica tener 6 despertares por semana.
3) Parasomnias: Soliloquia (46,4%), sensación de sacudida de los miembros al dormirse (34,1%) sonambulismo activo (7,8%).
4) Predominio de las parasomnias en el sexo femenino salvo la sensación de sacudida de los miembros.
Revisando la literatura disponible se puede concluir que entre el 13 y el 27% de los padres de niños de 4 a 12 años de edad refieren la presencia de dificultades con el sueño que incluyen:
Resistencia a acostarse.
Ansiedad en el momento de acostarse.
Inicio de sueño retrasado.
Colecho de respuesta a la actitud del niño.
Ronquido.
Enuresis.
Despertares nocturnos.
Pesadillas / terrores del sueño.
Sonambulismo.
Despertar matinal precoz.
Excesiva somnolencia diurna.
Estos problemas suelen ser estables a lo largo de la infancia de manera que, un niño con dificultades del sueño a los 8 meses probablemente continuará mostrando dificultades con el sueño a los 3 años de edad y aquellos con problemas a los 2 años continuarán teniendo dificultades con el sueño a los 12 años de edad.
Así pues, la valoración, estudio y tratamiento de los problemas del sueño en la infancia está justificada por su alta prevalencia, su estabilidad y consecuencias en el desarrollo del niño. Su eficiencia en el aprovechamiento de los recursos sanitarios ha sido demostrada.
ESQUEMAS DIAGNÓSTICOS-TERAPÉUTICOS EN PEDIATRÍA DEL SUEÑO
El mejor tratamiento de las dificultades comportamentales con el sueño en la edad pediátrica continua siendo la prevención. Para que ésta sea eficaz, es necesario conocer el modo en el que se gestan las dificultades de inicio y mantenimiento del sueño en la infancia, valorando los factores de riesgo de insomnio en la infancia tales como:
Factores predisponentes: edad y antecedentes familiares.
Factores contribuyentes: factores afectivos, temperamento, tipo de apego.
Factores coadyuvantes: Enf. Médicas, SAHS....
Factores precipitantes: Alteraciones de la dinámica familiar, fatiga, factores externos.
Factores condicionantes: Aquellos que una vez instituido el insomnio, ayudan a hacerlo crónico (ansiedad, depresión, irritabilidad-fatiga, etc.)
Para ello proponemos el siguiente esquema evolutivo:
En el desarrollo de los problemas con el inicio y mantenimiento del sueño en la infancia podemos distinguir dos períodos de tiempo definidos. Lo que acontece durante los primeros 4 meses de vida y los que sucede pasado este período de tiempo:
a) Durante los primeros 4 meses de vida se dan dos circunstancias:
Predominio de los factores biológicos sobre los conductuales, jugando un importante papel el temperamento del lactante, la inestabilidad de los sistemas nerviosos central y autónomo así como el control congénito inestable de la respiración que ocasiona un trabajo pulmonar inestable.
Ausencia del desarrollo del apego.
En estas primeras etapas del desarrollo, un 29% de lactantes presentan situaciones que favorecen el estado de hipervigilia (temperamento difícil, más de 11 tomas al final de la primera semana de vida, cólico del lactante, actitud asfixiante de los cuidadores,etc.). Estas situaciones, unidas a la inestabilidad e inmadurez de los sistemas nerviosos central y autónomo en su control congénito de la respiración y del sueño generan un incremento del trabajo respiratorio e inestabilidad de la continuidad del sueño. Consecuencia de ello, es la aparición de unos patrones de sueño congénitos inestables.
Estos patrones originan déficit de sueño familiar con el desarrollo del binomio fatiga-ansiedad justo en el inicio del establecimiento de la relación de apego gestándose, como consecuencia, una relación de apego del tipo insegura-dependiente/insegura-resistente que altera la dinámica familiar. La consecuencia lógica de ello es la aparición de unos hábitos de sueño familiares disfuncionales bien por hábitos irregulares o por la ausencia de límites.
b) Trascurridos los primeros 4-6 meses de vida entran en juego otros factores que pueden condicionar la evolución de estos hábitos disfuncionales, alterando el aprendizaje del hábito de sueño y provocando la aparición de refuerzos positivos (atención, cuidados extras...) ante situaciones disfuncionales.
La presencia de un SAHS, S. de movimientos periódicos o cualquier otra situación médica, neurológica y/o psiquiátrica patológica retroalimenta los problemas con el sueño incrementando el binomio fatiga-ansiedad en el niño y sus cuidadores. Como consecuencia de ello la secreción de neurotransmisores (adrenalina, dopamina fundamentalmente) se ve alterada favoreciendo la aparición de síntomas de síndrome de déficit de atención like, alteraciones conductuales... que incrementan las alteraciones de inicio y mantenimiento del sueño.
Se favorece de esa manera el empeoramiento del hábito de sueño, al aparecer refuerzos positivos a la conducta disfuncional del bebé como parte de la trampa conductual a la que su conducta induce a los padres, cerrando de esa manera el círculo que incrementa el estado de hiperalerta-irritabilidad.
Esta secuencia relacionando los 5 factores implicados queda resumida en la figura 1.
Figura 1.
Figura 2. Algoritmos diagnósticos. (Continuación)
Figura 2. Algoritmos diagnósticos.
EVALUACIÓN CLÍNICA DE LAS ALTERACIONES DEL SUEÑO EN LA INFANCIA
De la misma manera que otras alteraciones médicas o psiquiátricas, la clave del diagnóstico clínico es el diagnóstico diferencial. Este diagnóstico diferencial entre una alteración del sueño y cualquier otra entidad médica y/o psiquiátrica que se presenta de manera similar es importante desde el inicio del enfoque clínico (terror nocturno versus cuadro epiléptico, retraso de fase por miedos versus ansiedad, etc.). La comorbilidad también puede darse bien con la coexistencia de varias alteraciones del sueño en un mismo niño, bien con la coexistencia de alteraciones del sueño y alteraciones médicas y/o psiquiátricas. Ejemplos de esta comorbilidad son:
Síndrome Apnea-Hipopnea del Sueño y Enuresis.
Síndrome Apnea-Hipopnea del Sueño y parasomnias del arousal.
Deprivación crónica de sueño y parasomnias del arousal.
Insomnio e higiene de sueño inadecuada.
Resistencia a acostarse y despertares nocturnos.
Síndrome de Piernas Inquietas y Movimiento Periódico de los Miembros.
BIBLIOGRAFÍA
1.Heath AC, Kendler KS, Eaves L, Martín NG. Evidence for genetic influences on sleep disturbance and sleep patterns in twins. Sleep. 1990;13:318-35.
2.Pin G, Lluch A, Borja F. El pediatra ante los trastornos del sueño. An Esp Pediatr. 1999;50:247-52.
3.Blader JC, Koplewitz HS, Abikoff H, Foley C. Sleep problems of elementary school children: a community survey. Arch Pediatr Adolesc Med. 1997;115:473-80.
4.Paavonene EJ, Aronen ET, Moilanen I, Piha J, Räsänen E, Tamminen T et al. Sleep problems of school-aged children: a complementary view. Acta Paediatrics. 2000;89:223-8.
5.Smedje H, Broman JE, Hetta J. Parents reports of disturbed sleep in 5-7 yeras old Swedish children. Acta Paediatr. 1999;88:858-65.
6.Stein MA, Mendelson J, Obermeyer WH, Amromin J, Benca R. Sleep and behavior problems in school-aged children. Pediatrics. 2001;107:e60.
7.American Academy of Pediatrics: "Sleep Problems." In: Guidelines for Health Supervision II. Elk Grove Village,IL,American Academy of Pediatrics,1988.
8.Sheldon S. Evaluating Sleep in Infants and Children. De Lippincott-Raven 1996.
9.Blader JC, Koplewicz HS, Abikoff H, Foley C. Sleep problems of elementary school children. Arch Pediatr Adolesc Med. 1997;151:473-80.
10.Mosko S, Richard C, McKenna J, Drumond S. Infant sleep architecture during bedsharing and possible implications for SIDS. Sleep. 1996;19:677-84.
11.Chervin RD, Hedger K, Dillon JE, Pituch KJ. Pediatric Sleep Questionnaire (PSQ): validity and reliability of scales for sleep-disordered breathing, snoring, sleepiness, and behavioural problems. Sleep Medicine 2000;1:21-32.
12.Sivan Y, Kornecki A, Schonfeld T. Screening obstructive sleep apnea síndrome by home videotape recording in children. Eur Respir J. 1996;9:2127-31.
13.Stores G. Practitioner review: assessment and treatment of sleep disorders in children and adolescents. J Child Psychol Psychiatry. 1996;37:907-25.
14.Ali NJ, Pitson DJ, Stradling JR. Snoring, sleep disturbance, and behaviour in 4-5 years old. Arch Dis Child. 1993;68:360-6.
15.Meijer AM, Habekothe RT, Van Den Wittenboer G.L. Mental health, parental rules and sleep in pre-adolescents. J Sleep Res. 2001;10:297-302.
16.M. Nikolopoulou, I St James-Roberts. Preventing sleeping problems in infants who are at risk of developing them. Arch Dis Child. 2003;88:108-11.
17.Mindell J, Owens J. Symptom-Based Algorithms. En: A clinical guide to pediatric sleep. Diagnosis and management of sleep problems. Ed: Mindell J, Owens J. Lippincott Williams & Wilkins 2003.
CATAPLEJIA: MECANISMOS CAUSALES Y TRATAMIENTO. FOCUS EN GHB
M.J. Barbanoja,b, S. Closa, S. Giméneza y S. Romeroa,c
aCentre d'Investigació de Medicaments, Institut de Recerca; Servei de Farmacología Clínica, Hospital de la Santa Creu i Santa Pau, Barcelona.
bDepartament de Farmacologia i Terapèutica, Universitat Autònoma de Barcelona.
cCentre de Recerca en Enginyeria Biomèdica, Departament ESAII, Universitat Politècnica de Catalunya.
RESUMEN
En esta revisión se destaca la bioquímica y farmacología del GHB y sus efectos tras administración exógena, con especial énfasis en el sueño y en la narcolepsia. Hasta el momento es el primero y único compuesto aprobado por la FDA para el tratamiento específico de la cataplejia. GHB es un derivado del GABA y parece que actúa como un neurotransmisor inhibitorio en el SNC. A pesar de modular la actividad de diversos sistemas de neurotransmisión se enfatiza su efecto sobre las neuronas dopaminérgicas, siendo sus acciones, tanto fisiológicas como farmacológicas, mediadas a través de receptores cerebrales específicos para el GHB. Además, algunos de sus efectos parecen mediados a través de su interacción con el receptor GABAB. Clínicamente ha mostrado su actividad como hipnótico induciendo un patrón de sueño fisiológico. Además, se ha evidenciado su eficacia y seguridad en la reducción de la cataplejia, somnolencia diurna y alucinaciones hipnagógicas presentes en los enfermos con narcolepsia. Sin embargo, datos experimentales constatan que contrariamente a lo que sucede tras su administración nocturna, cuando se administra durante el día incrementa la cataplejia, estando todavía por dilucidar el mecanismo responsable de sus efectos beneficiosos sobre la pérdida brusca de tono muscular observado en la narcolepsia.
INTRODUCCIÓN
El ácido gamma-hidroxi-butírico (GHB) es un ácido graso de cadena corta, presente en la naturaleza, particularmente en tejidos de mamíferos. Fue inicialmente aislado e investigado en los años 60 con el objetivo de desarrollar un análogo del ácido gamma-amino-butírico (GABA) que pudiera cruzar con facilidad la barrera hematoencefálica (figura 1). El GHB tiene una historia de uso en medicina de más de 30 años, especialmente en Europa, habiendo estado disponible también en EEUU como producto de libre dispensación, específicamente como suplemento alimentario. Al inicio de los años 90 los culturistas empezaron a usar GHB y su pro-fármaco la gamma-butirolactona (GBL) ante los efectos de GHB como liberador de hormona del crecimiento (GH). Al final de los años 90 el GHB se convirtió en un compuesto popular consumido en fiestas ("club drug") y ganó notoriedad como una importante droga de abuso y como droga que facilitaba la agresión sexual ("date-rape drug"). En la calle, algunos de los nombres que recibe son: "G", "éctasis líquido", "graves daños corporales", "chico de Georgia", "líquido X", "jabón", "situación fácil", "agua salada", "cazo" o "nitro" (Smith, Larive y Romanelli, 2002).
Figura 1. Estructura química de los neurotransmisores: ácido gamma-aminobutírico (GABA), ácido gamma-hidroxibutírico (GHB) y su precursores estructuralmente relacionados: 1,4-butanediol (BD) y gamma-butirolactona (GBL).
La FDA proscribió la venta libre de GHB en 1990 y el 13 de marzo de 2000 lo clasificó como compuesto perteneciente al grupo I (agente con alto potencial de abuso sin uso médico reconocido en los EEUU). En paralelo GHB ha está siendo desarrollado, bajo el nombre comercial de Xyrem®, como un nuevo tratamiento para la narcolepsia dentro del Programa de Fármacos Huérfanos de la FDA, habiendo sido autorizada su comercialización en julio de 2002, clasificándose específicamente Xyrem en el grupo III (prohibición de vender, distribuir o dar el compuesto a quien no le ha sido prescrito, así como su uso paro otros propósitos distintos a los anteriores) (Fuller y Hornfeldt, 2003). En esta presentación se revisará la neurobioquímica del GHB endógeno y el efecto de la administración exógena de GHB, con especial énfasis en sus efectos sobre el sueño y en particular en la narcolepsia.
GHB COMO NEUROTRANSMISOR
Una serie de hallazgos sugieren que GHB tiene un papel como neurotransmisor o neuromodulador. El GHB se distribuye de forma heterogénea en el SNC identificándose los mayores niveles en hipocampo, ganglios basales, hipotálamo y sustancia nigra, con sistemas para la síntesis, recaptación vesicular y almacenamiento en terminales sinápticas (Maitre, 1997).
El GHB en el cerebro se cree que procede del metabolismo del GABA, quien primero es desaminado a semialdehido succínico (SSA) por el GABAaminotransferasa. La mayoría del SSA producido se convierte en ácido succínico y se incorpora en el ciclo de Krebs. Sin embargo, una pequeño porcentaje, menos del 2%, es transformado por un enzima citosol específico (SSA reductasa) en GHB. Sin embargo, se han descrito vías alternativas que pueden contribuir de forma significativa a la producción de GHB, especialmente en la periferia, donde los niveles de GHB son particularmente elevados en relación a los muy bajos o ausentes niveles de GABA. Se ha evidenciado que 1,4-butanediol (BD) y gamma-butirolactona (GBL) constituyen precursores naturales del GHB, encontrándose ambos presentes en el cerebro de rata a concentraciones 1/10 en relación a las de GHB.
Se ha demostrado que GHB es liberado a través de un mecanismo mediado por Ca++ tras despolarización neuronal. Tras su liberación sináptica GHB se une de forma reversible a receptores GHB específicos, acoplados a proteínas G. A pesar de las altas concentraciones de GHB en la periferia, parece que solo hay receptores de GHB en el SNC. Ni el GABA ni el GBL han mostrado afinidad apreciable por los receptores GHB. Mientras que el GABA no presenta afinidad por los receptores GHB, GHB puede unirse a los receptores GABAB, pero con una afinidad suficientemente baja para que esta actividad sea totalmente irrelevante a concentraciones endógenas. Sin embargo, se ha sugerido que algunas de las acciones del GHB administrado exógenamente pueden estar parcialmente relacionadas con una débil actividad agonista GABAB. De hecho, algunos de los efectos del GHB pueden antagonizarse por antagonistas GABAB y reproducirse por el agonista GABAB baclofen.
Tras la liberación, la actividad del GHB finaliza ante su recaptación activa de la hendidura sináptica. Esta recaptación se efectúa mediante un mecanismo de alta afinidad dependiente de energía y Na+ específico para el GHB y sus análogos. Una vez en el interior de la célula el encima citosólico GHB deshidrogenasa cataliza la conversión de GHB a SSA el cual es metabolizado primariamente a succinato, así como a GABA.
El metabolismo de GHB acontece con rapidez resultando en una vida media de 30-50 minutos en el cuerpo con un aclaramiento en el SNC todavía más rápido. Un punto importante a tener en cuenta en relación con el tiempo de vida media de GHB consiste en que el compuesto no presenta una cinética lineal de eliminación ante la saturación de la vía de eliminación (Scharf y cols., 1998). Ante ello, la vida media es dosis-dependiente, de forma similar a lo que ocurre con el alcohol y el ácido salicílico, pudiéndose esperar una importante prolongación en casos de sobredosis.
También el GHB se encuentra en elevadas concentraciones en algunos tejidos periféricos. Se cree que podría desempeñar un papel en disminuir el consumo de energía, protección tisular ante la anoxia y protección tisular ante las demandas metabólicas excesivas ya que los niveles plasmáticos de GHB aumentan en circunstancias estresantes. Por lo tanto, se le ha calificado como un agente protector endógeno cuando las provisiones energéticas tisulares son bajas (Mamelak, 1989).
EFECTOS SOBRE OTROS SISTEMAS DE NEUROTRANSMISIÓN
Tanto la liberación endógena como la administración exógena de GHB actuando pre- y post-sinpáticamente disminuye los niveles de actividad de SNC. La activación del receptor GHB conlleva la modulación de la actividad de otros sistemas de neurotransmisión (Nicholson y Balster, 2001).
En relación con la neurotransmisión dopaminérgica, se describe un efecto bifásico. Una primera fase real y una segunda fase en la que la dosis y el tiempo parecen influir en el tipo de respuesta, no quedando claro si representa una respuesta válida o un artefacto asociado con el procedimiento experimental. La repuesta primaria ante la exposición a GHB y sus análogos consiste en una atenuación de la neurotransmisión dopaminérgica. Se produce una inhibición del disparo de las neuronas dopaminérgicas en la sustancia nigra y las regiones mesolímbicas, resultando en un incremento de los niveles cerebrales de dopamina. Tras el decremento inicial en la liberación de dopamina se ha descrito una segunda fase en la que hay un incremento de tal liberación en el estriado y estructuras cortico-límbicas.
En relación a la neurotransmisión opioide se describe que GHB estimula un incremento en la liberación de varios opioides endógenos en diferentes regiones cerebrales. Se ha propuesto que sería a través de la modulación de la actividad de interneuronas opioides que el disparo de las neuronas dopaminérgicas sería inhibido. Así se explicarían los efectos de los antagonistas opioides (naloxona y naltrexona) revirtiendo el efecto sobre los niveles de dopamina, a pesar de no tener el GHB afinidad por los receptores opioides, ni la naloxona afinidad por los receptores GHB. Sin embargo, no todos los resultados en relación al antagonismo de la naloxona sobre los cambios dopaminérgicos causados por el GHB son totalmente consistentes.
En relación a la neurotransmisión serotoninérgica y colinérgica, si bien también se han descrito cambios en la frecuencia de disparo de las respectivas neuronas, la consistencia de las observaciones y posibles mecanismos implicados están lejos de estar claramente identificados.
Se han descrito distintas posibilidades en la interacción del GHB con la neurotransmisión GABAérgica. Como ya se ha comentado previamente, concentraciones de GHB que excedan las fisiológicas en 2-3 órdenes de magnitud son capaces de producir alteraciones funcionales mediadas por el receptor GABAB. También GHB puede actuar como precursor metabólico del GABA. Además, se han descrito interacciones funcionales entre los receptores GHB y GABAB, así por ejemplo, la inhibición que GHB induce en la liberación de GABA a nivel del tálamo. También se ha descrito la posible participación de los receptores GABAA. La administración exógena de GHB eleva, de forma dosis-dependiente, la concentración de progesterona en el cerebro, parece ser por un mecanismo mediado por el receptor GABAB. Esta elevación adquiere relevancia al ser la allopregnanolona, metabolito de la progesterona, un modulador alostérico positivo del receptor GABAA.
ADMINISTRACIÓN DE GHB EXÓGENO
Los efectos del GHB son dosis dependientes. En humanos, dosis bajas (10 mg Kg1) producen amnesia anterógrada de corto plazo y es posible el abuso del compuesto. Dosis entre 20 y 30 mg Kg1 ocasionan somnolencia y sueño, mientras que dosis de 50 mg Kg1 conllevan anestesia general sin analgesia. Dosis superiores a 50mg Kg1 pueden producir coma, depresión cardiocirculatoria, convulsiones y muerte (Ting Wong, Gibson y Snead Ill, 2004). Algunos de los usos médicos del GHB incluyen epilepsia (como modelo farmacológico en animales de las crisis de asuencia), depresión, síndrome de abstinencia alcohólico, anestesia y en los trastornos del sueño.
GHB Y EL SUEÑO
Consistente con las acciones sedantes de GHB el compuesto se ha utilizado como agente inductor de sueño en insomnes y otros pacientes con trastornos de sueño. Hay también reportes ocasionales de su utilización como ayuda al sueño para mejorar los post-efectos observados con metanfentamina o NDMA (Galloway y cols., 1977). Dosis orales de 30-50 mg/kg producen sueño, que es prontamente revertido por estímulos externos y virtualmente indistinguible del sueño normal. Los patrones de EEG, conducta y evaluaciones subjetivas sugieren que el sueño inducido por GHB reproduce al sueño fisiológico, incrementando el sueño de ondas lentas (estadios 3 y 4) y el sueño REM (Laborit, 1964; Yamada y cols., 1967; Vickers, 1969; Mamelak y cols. 1977). Estas características son distintas de las ocasionadas por los hipnóticos clásicos convencionales, como las benzodiacepinas, que disminuyen el sueño de ondas lentas y el sueño REM.
En los años 70 se propuso la utilización de GHB como tratamiento sintomático de pacientes narcolépticos. Aunque esta utilización terapéutica podría parecer a priori contraintuitiva, la habilidad de GHB de inducir un sueño fisiológico durante la noche estaría en la base de su utilización para mejorar la sintomatología en la narcolepsia (Mamelak, 1989). La etiología y patofisiología de la narcolepsia todavía tienen que ser plenamente dilucidadas (Siegel, 1999); sin embargo es conocido que estos pacientes experimentan alteraciones del sueño a lo largo de la noche resultando en patrones de sueño anormales, de tal manera que durante el día, y ante los patrones de sueño no reparadores, los pacientes presentarían la somnolencia extrema, cataplejia, parálisis de sueño y alucinaciones hipnagógicas (Overeem y cols, 2001). El GHB tomado por la noche consolidaría el sueño restableciendo un patrón normalizado, disminuyendo la presión REM durante el día, de tal manera que la incidencia de síntomas durante la vigilia disminuiría (Mamelak, 1989; Lapierre y cols., 1990). Evaluado el GHB como tratamiento de la narcolepsia en diversos ensayos clínicos se ha evidenciado su seguridad y efectividad en la reducción de la cataplejia, somnolencia diurna y alucinaciones hipnagógicas (Broughton y Mamelak, 1979; Scahrf y cols., 1985; Mamelak y cols., 1986; Bédard y cols. 1989; Scrima y cols. 1990; Lammers y cols., 1993). El desarrollo clínico de Xyrem® para el tratamiento de la cataplejia en la narcolepsia se inició formalmente en 1994, estableciéndose la eficacia y seguridad de oxibato sódico (nombre genérico oficial que ahora recibe el GHB) en 2 ensayos clínicos aleatorizados, doble-ciego y controlados con placebo (US Xyrem Multicenter Study Group, 2002, 2003a), aportándose datos adicionales de seguridad en un tercer ensayo clínico a largo plazo y abierto (US Xyrem Multicenter Study Group, 2003b).
Es interesante resaltar que GHB promueve la cataplejia cuando se administra durante el día, y sin embargo disminuye la presentación de cataplejia cuando es administrada en la noche (Mamelak y Sowden, 1983). La explicación ofrecida consiste en plantear que al administrar GHB en la noche, los pacientes duermen y no son conscientes de ninguna parálisis nocturna; la prolongada activación nocturna del sistema inhibitorio motor por GHB iría seguida de una elevación por rebote del umbral de inhibición el día siguiente.
GHB Y CATAPLEJIA
Hay un acuerdo general que las estructuras neuronales responsables de los principales eventos tónicos y fásicos durante el sueño REM se localizan en el tronco cerebral, siendo facilitados tanto por una estimulación colinérgica como por una inhibición serotoninérgica y/o noradrenérgica. Sin embargo, hasta el momento no se han descrito cambios importantes en estos sistemas de neurotransmisión tras la administración de GHB. De hecho, estudios "in vitro" demuestran una práctica ausencia de lugares de fijación al GHB de alta afinidad a nivel del tronco encefálico (Hechler y cols., 1987). Por otro lado, hay creciente evidencia de que estructuras más rostrales, posiblemente localizadas en el hipotálamo, ejercerían cierto papel en el control de los mecanismos asociados al sueño REM, habiéndose descrito esta estructura como un lugar donde la unión de GHB es importante. Además, merece comentario el hecho de que entre las estructuras con una mayor densidad de lugares de fijación para el GHB se encuentran varias regiones del sistema límbico, específicamente el campo CA-1 del cuerno de Ammon (Hechler y cols., 1987). Esta región podría desempeñar cierto papel en la fisopatología de la cataplejia, un síntoma que se desencadena ante emociones específicas y es controlado por GHB (Broughton y Mamelak, 1980).
Se ha especulado que ante la inervación dopaminérgica del hipotálamo y el efecto que GHB ocasiona sobre la neurotransmisión dopaminérgica, las neuronas dopaminérgicas podrían estar implicadas en el efecto del GHB sobre la cataplejia. El papel exacto de las neuronas dopaminérgicas en el sueño todavía no está claramente dilucidado. Diversas observaciones sugieren que la dopamina tiene un efecto inhibitorio del sueño REM. Los agonistas dopaminérgicos reducen o incluso eliminan el sueño REM en humanos (Cianchetti, 1985) y previenen el efecto rebote que normalmente acontece en gatos deprivados de sueño REM (Stenberg y Porkka-Heiskanen, 1987). Además, también se ha evidenciado que la administración endovenosa de L-DOPA durante el sueño NREM retrasa el inicio del sueño REM (Guillin y cols., 1973).
CONCLUSIÓN
Hasta la fecha, la narcolepsia es habitualmente tratada con estimulantes (anfetamina, metilfenidato, pemolina o modafinil) para reducir la excesiva somnolencia diurna, y antidepresivos (imipramina, venlafaxina, fluoxetina) para controlar la cataplejia y los síntomas relacionados con el sueño REM. Como alternativa, los resultados obtenidos en ensayos clínicos con GHB sugieren que, a pesar de no tener un claro conocimiento de los mecanismos por los que ejerce los efectos, su administración comportaría cierta normalización del patrón de sueño en la narcolepsia, pudiendo ser suficiente para el control de la cataplejia, pero todavía requiriéndose estimulantes, aunque a dosis bajas, para un satisfactorio control de la excesiva somnolencia diurna. Limitaciones en su uso se centrarían en su corta duración de acción, que condiciona la necesidad de administrar una segunda dosis en la noche, y en su perfil de seguridad, especialmente a largo plazo, ante el eventual desarrollo de dependencia física y potencial de abuso.
BIBLIOGRAFÍA
Bédard MA, Montplaisir J, Godbout R, Lapierre O. Nocturnal *-hydroxybutyrate: effect on periodis leg movements and sleep organization of narcoleptic patients. Clin Neuropharmacol. 1989;12:29-36.
Broughton R, Mamelak M. The treatment of narcolepsy-cataplexy with nocturnal *-hydroxybutyrate. Can J Neurol Sci. 1979;6:1-6.
Broughton R, Mamelak M. Effects of nocturnal gamm-hydroxybutyrate on sleep/waking patterns in narcolepsy-cataplexy. Can J Neurol Sci. 1980;7:23-31.
Cianchetti C. Dopamine agonists and sleep in man. In Wauquier A, Gaillard JM, Monti JM, Radulouaki M, eds. Sleep: neurotransmitters and neuromodulators. New York: Raven Press, 1985. 121-134.
Fuller DE, Hornfeldt CS. From club drug to orphan drug: sodium oxybate (Xyrem) for the treatment of cataplexy. Pharmacotherapy 2003;23:1205-9.
Gillin JC, Post RM, Wyatt RJ, Goodwin FK, Snyder F, Bunney WE. REM inhibitory effect of L-dopa infusion during human sleep. EEG Clin Neurophysiol. 1973;35:181-6.
Golloway GP, Frederick SL, Staggers FE Jr, Gonzales M, Stalcup SA, Smith DE (1977). Gamma-hydroxybutyrate: an emerging drug of abuse that causes physical dependence. Addiction;92:89-96.
Hechler V, Wessmann D, March E, Pujol JF, Maitre M. Regional distribution of high-affinity Y-[3H]hydroxybutyrate binding sites as determined by radioautography. J Neurochem Int. 1987;4:523-9.
Laborit H. Sodium 4-hydroxybutyrate. Int J Neuropharmacol. 1964;3:433-52.
Lammers GJ, Arends J, Declerck AC, Ferrari MD, Schouwink G, Troost J. *-hydroxybutyrate and narcolepsy: a double-blind placebo-controlled study. Sleep. 1993;16:216-20.
Lapierre O, Montplaisir J, Lamarre M, Bedard MA. The effect of gamma-hydroxybutyrate on nocturnal and diurnal sleep of normal subjects: further considerations on REM sleep-triggereing mechanism. Sleep. 1990;13:24-30.
Maitre M. The γ-hydroxybutyrate signalling system in brain: organization and functional impliations. Prog Neurobiol. 1997;51:337-61.
Mamelak M. Gammahydroxybutyrate: an endogenous regulator of energy metabolism. Neurosci Biobehav Rev. 1989;13:187-98.
Mamelak M, Sowden K. The effect of gammahydroxybutyrate on the H-reflex: pilot study. Neurology 1983;33:1497-1500.
Memelak M, Escriu JM, Stokan O. The effects of gammahydroxybutyrate on sleep. Biol Psych 1977;12:273-88.
Mamelak M, Scharf MB, Woods M. Treatment of narcolepsy with gammahydroxybutyrate: a review of clinical and sleep laboratory findings. Sleep. 1986;9:285-9.
Nicholson KL, Balster RL. GHB: a new and novel drug of abuse. Drug Alchol Depend. 2001;63:1-22.
Overeem S, Mignot E, vanDijk JG, Lammers GJ. Narcolepsy: clinical features, new pathological insights, and future perspectives. J Clin Neurophysiol. 2001;18:78-105.
Scharf MB, Brown D, Woods M, Brown L, Hirschowitz J. The effects and effectiveness of (-hydroxybutyrate in patients with narcolepsy. J Clin Psychiatry. 1985;46:222-5.
Scharf MB, Lai AA, Branigan B, Stover R, Berkowitz. Pharmacokinetics of gammahydroxybutyrate (GHB) in narcoleptic patients. Sleep. 1998;21:507-14.
Scrima L, Hartman PG, Johnson FH, Thomas EE, Hiller FC. The effects of *-hydroxybutyrate on the sleep of narcolepsy patients: a double-blind study. Sleep. 1990;13:479-90.
Siegel JM. Narcolepsy: a key role for hypocretins (orexins). Cell. 1999;98:437-51.
Smith KM, Larive Ll, Romanelli F. Club drugs: methylenedioxymethamphetamine, flunitrazepam, ketamine hydrochloride, and gamma-hydroxy-butyrate. Am J Health Syst Pharm. 2002;59:1067-76.
Stenberg D, Porkka-Heiskanen T. Dopaminergic inhibition of paradoxical sleep in cats. Sleep Res. 1987;16:149.
Ting Wong CG, Gibson KM, Snead Ill OC. From the street to the brain: neurobiology of the recreational drug *-hydroxybutyric acid. Trends Pharmacol Sci. 2004;25:29-34.
US Xyrem Multicenter Study Group. A randomized, double-blind, placebo-controlled multicenter trial comparing the effects of three doses of orally administered sodium oxybate with placebo for the treatment of narcolepsy. Sleep. 2002;25:42-9.
US Xyrem Multicenter Study Group. The abrupt cessation of therapeutically administered sodium oxybate (GHB) does not cause withdrawal symptoms. J Clin Toxicol. 2003a;41:131-5.
US Xyrem Multicenter Study Group. A 12-month, open-label, multi-center extension trial of orally administered sodium oxybate for the treatment of narcolepsy. Sleep. 2003b;26:31-5.
Vickers MD. Gammahydroxybutyric Acid. Int Anesth Clin. 1969;7:75-89.
Yamada Y, Yamamoto J, Fujiki A, Hishikawa Y, Kaneo Z. Effect of butyrolactone and gamma hydroxybutyrate on the EEG and sleep cycle in man. Electroenceph Clin Neurophysiol. 1967;22:558-62.
TRATAMIENTO DE LOS TRASTORNOS DEL SUEÑO EN PSIQUIATRIA
F. Cañellas
Unidad de Psiquiatría. Hospital Universitario Son Dureta. Palma de Mallorca.
INTRODUCCIÓN
El insomnio, las hipersomnias, los trastornos del ciclo vigilia-sueño, las parasomnias, pueden ser secundarios a otras patologías, muchas de las cuales, fundamentalmente del insomnio, serán patologías psiquiátricas.
En todos los casos la valoración de estos trastornos comportará estudiar si ha habido alguna variación reciente en los hábitos del patrón de sueño-vigilia del paciente, de su conducta, trabajo o ritmo estacional. Una historia clínica cuidadosa, de los trastornos mentales, médicos, consumos de sustancias incluyendo fármacos, será esencial para orientar el diagnóstico y el correcto tratamiento.
INSOMNIO RELACIONADO CON TRASTORNOS PSIQUIÁTRICOS
El insomnio es la alteración del sueño más frecuente. También es una de las quejas más frecuentes en la práctica clínica diaria, tanto en la de medicina general como en la de psiquiatría. El insomnio esta presente en la mayoría de trastornos psiquiátricos, formando parte incluso de los criterios diagnósticos de algunas entidades nosológicas (trastornos afectivos, ansiosos).
En el insomnio asociado a trastornos psicóticos estará indicada la utilización de neurolépticos de mayor potencia sedante, o una mayor dosis vespertina del neuroléptico. No suele ser necesaria la asociación de fármacos exclusivamente hipnóticos, pero si fuera preciso se evitará la posible suma de efectos sedantes entre psicofármacos, y el riesgo de alterar el ritmo circadiano vigilia-sueño.
Cuando el insomnio aparece en el contexto de un trastorno de ansiedad, dado que el tratamiento básico serán las benzodiazepinas, probablemente de vida media larga, la terapéutica correcta será la pauta fraccionada de dichos fármacos, incidiendo en una mayor dosis próxima a la hora deseada de iniciar el sueño. Ocasionalmente en estos trastornos, el paciente necesitará combinación puntual intermitente de fármacos específicamente hipnóticos.
En los trastornos afectivos, como probablemente el efecto antidepresivo del fármaco no será objetivado hasta las 2-4 semanas, será útil al inicio del tratamiento la combinación, durante un periodo no superior a las 2-3 semanas, del antidepresivo con un hipnótico preferentemente benzodiazepínico o utilizar un antidepresivo sedativo.
Recomendaciones generales para el empleo de hipnóticos
La mayor dificultad terapéutica en el tratamiento de los trastornos del sueño secundarios a patología psiquiátrica la plantea el tratamiento del insomnio crónico. El clínico debe elegir entre deferentes opciones, cada una de las cuales presenta problemas.
1. Los hipnóticos son el tratamiento más frecuentemente indicado. Son fármacos seguros que disminuyen la latencia del sueño, aumentan el tiempo total de sueño, disminuyen el número de despertares nocturnos y mejoran la calidad subjetiva del mismo. El grado de eficacia terapéutica es dosis dependiente, y no existen diferencias entre ellos al comparar dosis equipotentes. Sin embargo, presentan diferentes problemas:
La significación clínica de su acción sobre la arquitectura del sueño no todavía bien establecida.
El tema de perdida de eficacia (tolerancia) en tratamientos prolongados sigue siendo debatido. Cuando se comparan todos estos fármacos no parece existir una disminución del efecto terapéutico en un periodo de 4-5 semanas, y tampoco difieren entre ellos en este aspecto.
Las agencias evaluadoras (FDA, Agencia Europea del Medicamento, etc.) no han aprobado su indicación para tratamientos crónicos (más de 5 semanas de duración) Recientemente han aparecido algunos trabajos que sugieren la eficacia a largo plazo del tratamiento del insomnio con los nuevos compuestos de forma intermitente (máximo 4 noches por semana)
El mayor riesgo de la utilización crónica d estos fármacos es el efecto rebote, que está relacionado con la dosis utilizada y la vida media del fármaco, siendo menos frecuente entre los hipnóticos de vida media larga. Para evitar este fenómeno se recomienda la reducción progresiva de dosis.
Existe un riesgo de abuso-dependencia, debido a ello es preciso valorar, antes de iniciar el tratamiento, las características potencialmente adictivas del paciente. Están contraindicados en pacientes con antecedentes de abuso de substancias.
Su uso también se contraindica en pacientes con síndrome de apnea de sueño y no se recomienda su utilización en ancianos por el riesgo de deterioro cognitivo
2. Es cada vez mas frecuente utilizar antidepresivos sedativos en el tratamiento del insomnio crónico. Por una parte está demostrado que el riesgo de desarrollar una depresión es mayor en los pacientes con insomnio crónico. Por otra se ha visto que en los pacientes depresivos con insomnio, los antidepresivos sedativos mejoran el sueño desde la primera noche. A ello también ha contribuido la aparición de nuevos antidepresivos con un mejor perfil de efectos secundarios que los antidepresivos tricíclicos (trazodone, mianserina, mirtazapina) Estos compuestos deben darse en toma única nocturna. Sin embargo, existen todavía pocos estudios sobre la eficacia, tolerancia, y seguridad del uso crónico de los antidepresivos en pacientes con insomnio primario, lo que plantea un problema de indicación. Este seria el tratamiento de elección y en los insomnes con síndrome de apneas del sueño o con riesgo de abuso de substancias. En algunos casos la utilización de antidepresivos puede agravar el insomnio. Este problema se ilustrará con un caso clínico.
3. Debe considerarse siempre el tratamiento no farmacológico del insomnio, que incluye medidas de higiene de sueño (evitar estimulantes, ejercicio moderado, regularidad de horarios, etc.) y la psicoterapia. Numerosos estudios controlados demuestran la eficacia de la psicoterapia cognitivo-conductual en el tratamiento del insomnio. El principal problema es la accesibilidad del paciente a esta terapia y el tiempo que consume, una alternativa a considerar seria la psicoterapia de grupo que también ha demostrado su eficacia.
HIPERSOMNIAS RELACIONADAS CON TRASTORNOS PSIQUIÁTRICOS
Son poco frecuentes pero debemos pensar en ellas cuando se descartan otras etiologías. Para ilustrar este apartado se presentará un caso clínico.
PARASOMNIAS
La mayoría de parasomnias no requieren tratamiento específico. Aunque tienden a preocupar al entorno familiar, pueden ser aliviados con una correcta explicación tranquilizadora al paciente y a la familia y recomendando los principios generales de unas rutinas del ir a dormir regulares y adecuadas. Un apoyo psicoterapéutico que facilite la mejor comprensión de la situación tanto al paciente como a la familia, junto con la administración de una BZD de vida media larga puede ser útil.
Una parasomnia especial es el Trastorno de conducta durante el sueño REM. Se caracteriza por la pérdida intermitente de la atonía muscular típica de la actividad REM. y la aparición de actividad motora desordenada relacionada con el contenido del ensueño. El trastorno suele comenzar a partir de la cuarta década. Durante el episodio el individuo puede realizar movimientos de defensa con auto y heteroagresividad.
PARÁLISIS DEL SUEÑO
Es una angustiosa sensación de imposibilidad de moverse o de hablar que experimentan algunos individuos especialmente en las fases de inicio o final del sueño. Carece de relevancia patológica y no requiere otro tratamiento que la explicación cuidadosa al paciente de su intrascendencia. Debe descartarse que el síntoma no forme parte de tétrada narcoléptica. Generalmente aparece en sujetos predispuestos, casi siempre facilitado por estados de ansiedad.
TERRORES NOCTURNOS
Suele aparecer en niños después de los 18 meses de edad y se presenta en el 3% de los niños. Si el cuadro es muy severo puede ser necesario tratar.
En la ultima década, la investigación en la regulación del ciclo sueño-vigilia ha conducido al descubrimiento de polimorfismos genéticos y de mecanismos moleculares y celulares, situados mayoritariamente en el hipotálamo, que se encuentran implicados en determinados trastornos del sueño. Es muy probable que en los próximos años estos descubrimientos conduzcan al desarrollo de nuevas moléculas que permitan modular el sueño y la vigilia y poder responder de forma etiológica en el tratamiento de estos trastornos.
TRABAJO EN HORARIOS DESPLAZADOS, RECOMENDACIONES Y ESTRATEGIAS PARA FACILITAR LA ADAPTACION DE LOS RITMOS BIOLOGICOS
M.A. Quera-Salvaay M. Montori Lasillab
aHôpital Raymond Poincaré APHP. Université Paris Ouest. France
bHospital Clínico Universitario Lozano-Blesa. Zaragoza.
Varios ritmos biológicos, como el ritmo vigilia-sueño, el rendimiento intelectual, la temperatura corporal, la secreción de melatonina y de cortisol, y la mayoría de las variables bioquímicas, fisiológicas y del comportamiento, fluctúan de manera regular cada 24 horas, es decir, con una periodicidad circadiana del latín circa, alrededor y dies, un día. Los ritmos circadianos están gobernados por un reloj biológico localizado en los núcleos supraquiasmáticos hipotalámicos. El ritmo espontáneo del reloj interno es superior a las 24 horas, lo que obliga a nuestro organismo a un reajuste cotidiano de nuestros ritmos para evitar un deslizamiento progresivo del sueño en el curso de la jornada. Los sincronizadores, es decir las señales temporales del entorno que informan periódicamente al organismo sobre el transcurrir del tiempo, son de capital importancia. Dos tipos de sincronizadores predominan en el hombre: el sincronizador social y el sincronizador ecológico. El primero está ligado al conjunto de los ritmos de la vida social y profesional y el segundo está sujeto, por ejemplo, a las variaciones cíclicas de luz-oscuridad, temperatura, campos magnéticos, etc. La sociedad industrializada ha modificado considerablemente nuestra percepción de estas variaciones y, en particular, el papel de los ciclos luz-oscuridad ha sido poco valorado durante demasiado tiempo.
Hoy el veinte por ciento de la población activa de los países industrializados se enfrentan a los problemas derivados del trabajo que se realiza en horarios desplazados y los individuos están no solamente sometidos a cambios brutales en el horario de la actividad, sino que además deben funcionar contra el tiempo en relación a sus sincronizadores. El reloj biológico recibe informaciones contradictorias. Los ciclos vigilia-sueño del individuo no están en sintonía con las variaciones periódicas del medio, tales como la luz-oscuridad. En la mayor parte de casos, la actividad profesional en horarios irregulares constituye más una opción personal que una mayor capacidad de los individuos para acostumbrarse a las perturbaciones de sus ritmos biológicos. Tales situaciones profesionales precisan de una adaptación de los ritmos biológicos de los individuos para mejorar su calidad de vida y para disminuir el riesgo de accidentes.
En el curso de la reunión se expondrán las recomendaciones y las estrategias que disminuyen los riesgos asociados a este tipo de actividad profesional.
ESTADO DE SALUD EN NUESTRO MEDIO DE LOS TRABAJADORES A TURNOS COMPARADO CON UN GRUPO CONTROL CON HORARIO REGULAR DE TRABAJO
M.P. Cuartero y P. Carvajal
Unidad de Sueño del Hospital MAZ de Zaragoza.
INTRODUCCIÓN
El trabajo a turnos está cada vez más presente en nuestra sociedad. En los últimos años, dentro de la tendencia general a vivir en una sociedad que está activa 24 horas al día y 7 días a la semana, está aumentando alrededor de un 3% al año en el Primer Mundo, registrándose cifras del 16% en Inglaterra, del 20% en EEUU, y del 30% en Canadá1. Estos datos demuestran que un importante número de personas se ven obligadas a ir en contra de los ritmos circadianos naturales, que junto con otros factores como el sueño y la vida socio-familiar del individuo se ven alterados, de forma que se afecta el rendimiento del trabajador, su seguridad y sus relaciones laborales y sociales pudiendo desencadenar una serie de patologías.
Está descrito que estos desajustes puedan ocasionar el llamado Síndrome de Desadaptación al Trabajo a Turnos (SDTT) Agudo o Crónico, dependiendo del tiempo de evolución del trastorno y de las alteraciones que se produzcan en el individuo.
Una de las primeras alteraciones que se producen es en al esfera del sueño ya que el ritmo natural del individuo está desincronizado y el sueño diurno que realizan suele ser de peor calidad y menor duración, con un número frecuente de despertares debido a los condicionantes externos. Esto dificulta la recuperación de la fatiga física que se acumula, ocasionando un aumento de errores y accidentes en el trabajo y convirtiéndose en una persona irritable y de mal humor, lo cual puede acarrear problemas para sí mismo y para su entorno2. El segundo factor importante para el bienestar de esos trabajadores es la restricción de la vida familiar y el tiempo dedicado a las actividades de ocio, ya que sus horarios van muchas veces en contra de las costumbres "diarias" de la sociedad. Esto puede dar lugar a un aislamiento social del trabajador y es uno de los factores que más quejas suscita entre ellos, siendo responsable de la mala adaptación al sistema y pudiendo ocasionar problemas psicológicos a largo plazo.
Con el tiempo pueden desencadenarse problemas médicos más serios3, en forma de enfermedades del sueño, cuando se mantiene en el tiempo una disminución de la calidad/cantidad del mismo, del estado de ánimo, digestivas, como gastritis crónica o úlcera péptica favorecidas sobre todo por los horarios irregulares en las comidas y a la ingesta de un mayor número de alimentos fríos y precocinados y cardiocirculatorias, ya que acumulan un mayor número de factores de riesgo cardiovascular, creciendo el riesgo de IAM en esta población4 hasta un 40% más que para los trabajadores diurnos.
Se han hecho múltiples estudios en estos trabajadores y en diferentes sectores laborales, pero en nuestro medio no se ha llevado a cabo, hasta la fecha, ningún estudio que englobe a toda la población laboral y que permita describir si existen o no estos trastornos debido al horario irregular de trabajo. Sería interesante conocer cuál es la prevalencia de cada uno de ellos para permitirnos elaborar unas adecuadas guías de información, vigilancia y seguimiento médico de los trabajadores expuestos a este tipo de organización laboral.
OBJETIVO
Valorar las posibles diferencias en el estado de salud entre una población con un horario de trabajo a turnos y otra con un horario regular de trabajo.
MATERIAL Y MÉTODOS
El diagnóstico del SDTT es clínico, por lo que para su estudio están indicadas diferentes escalas de salud que incluyan preguntas para el despistaje de problemas de sueño, fatiga crónica, salud física y psíquica, alteraciones socio-familiares, tipo de personalidad, ritmo circadiano y estrategias para la adaptación a este tipo de horario. Diversos estudios5 han puesto de relevancia el Standard Shiftwork Index (SSI) como una herramienta de trabajo adecuada para el estudio de las posibles alteraciones que puede acarrear el trabajo a turnos. En nuestro estudio hemos utilizado la versión reducida del SSI traducida y adaptada al español.
Para delimitar la población a estudio se ha llevado a cabo un muestreo de la población laboral aragonesa a partir de un listado en el que constaban todas las empresas registradas en nuestra comunidad. De ellas, se ha prescindido de los sectores laborales que según los últimos datos del instituto aragonés de estadística presentaban un% de trabajadores a turnos menor del 4%, y de aquellas que tuviesen 3 o menos de 3 trabajadores en plantilla. Entre las empresas restantes, y conociendo el número de trabajadores, se llevó a cabo un muestreo sistemático de toda la población laboral entre la que se distribuyó el cuestionario para que fuese rellenado de forma anónima. Los cuestionarios fueron distribuidos por correo, realizando un recordatorio telefónico a las empresas para disminuir la tasa de no respuesta.
RESULTADOS
Se compararon los resultados en el estado de salud entre los dos grupos a turnos y no turnos.
Respecto a las características personales en los dos grupos de trabajadores no se han detectado diferencias significativas en cuanto a la edad, el estado a civil o el número de personas que dependen del trabajador (cargos). Sí destaca que la población de trabajadores a turnos es mayoritariamente masculina (64,6% de hombres frente al 35,4% de mujeres).
En cuanto a las horas de trabajo se ha observado que los trabajadores a turnos trabajan una hora más tanto en contrato como en la realidad. Respecto al ritmo de trabajo no se detectan diferencias significativas entre los dos grupos, aunque parece que está ligeramente más controlado entre los trabajadores sin turnos.
En el tipo de personalidad (matutina/vespertina) tampoco se han hallado diferencias significativas entre los dos grupos, destacando que un mayor porcentaje de trabajadores a turnos manifiestan una tendencia matutina (sus mejores momentos del día serían por la mañana temprano) 29% respecto a un 26% en los no turnos, aunque no es el momento preferido para ninguno de los dos grupos.
Dentro de la esfera del sueño sí se encuentran marcadas diferencias significativas entre los dos grupos, con mayor prevalencia tanto de síntomas de insomnio como de somnolencia en los trabajadores a turnos en ambos sexos, y necesitando en media más horas de sueño semanales los trabajadores a turnos que los sin turnos.
En cuanto a la fatiga crónica no se encuentran diferencias significativas entre los dos grupos, aunque existe un porcentaje mayor de trabajadores con turnos que manifiestan este tipo de queja.
Teniendo en cuenta el tipo de personalidad o los rasgos neuróticos de la misma, tampoco se encuentran diferencias significativas entre el grupo de turnos/sin turnos, pero si se realiza el análisis entre los dos sexos se ve que las mujeres en general presentan más alteraciones y éstas aumentan cuando trabajan a turnos.
En el estado de salud física sí existen diferencias significativas entre los dos grupos, presentando un peor estado de salud los trabajadores a turnos, y sin que se haya visto influencia de la edad o de los años en activo para un peor estado de salud.
Al desglosar las diferentes alteraciones, se observa que las mayores diferencias se encuentran en los trastornos digestivos y del aparato músculo-esquelético para ambos sexos. Dentro de los trastornos cardiovasculares solo si analizamos los dos sexos por separado se encuentran diferencias, siendo significativas entre el sexo femenino y sin diferencias en el masculino.
Por último, respecto al estado de salud mental, orientado a detectar trastornos psiquiátricos menores en la población, solo se observan diferencias significativas entre el grupo de trabajadores sin turnos y aquellos que siguen un trabajo a turnos que incluya trabajo nocturno. En este caso, al analizar ambos sexos por separado vuelven a encontrarse claras diferencias significativas entre las mujeres que trabajan a turnos y no turnos.
CONCLUSIONES
En nuestro estudio ha quedado demostrado una vez más el trabajo a turnos como un factor de riesgo para la salud y el bienestar de los trabajadores, teniendo en cuenta que en el caso del sexo femenino estos trastornos se acentúan aún más, probablemente debido a la sobrecarga social y familiar que soportan la mayoría de las mujeres de nuestro medio.
Los trastornos más acentuados se dan en la esfera gastrointestinal, en la músculo esquelética y en la esfera del sueño, siendo factores que requerirán un mayor estudio, puesto que se debe informar y educar a estos trabajadores para que logren mejorar las costumbres tanto en hábitos de sueño como alimentarios que podrían reducir en gran medida este tipo de patologías.
En nuestro estudio destaca una baja prevalencia de los trastornos psicológicos y de adaptación al sistema, ya que según la literatura es uno de los que mayores quejas suscita, pero al realizar una comparación con la población con un horario regular de trabajo no se observa un peor estado de salud psíquica. Habría que valorar que costumbres dentro de nuestra sociedad facilitan una mayor integración de estos trabajadores.
Con estos datos debemos hacer hincapié, sobre todo, en la necesidad de la puesta en marcha de guías de actuación, de un adecuado seguimiento médico y de una mayor información que permita afrontar este tipo de trabajo, y así detectar y solucionar precozmente los síntomas y signos de intolerancia al mismo.
BIBLIOGRAFIA
1.Eipstein R, Tzischinsky O, Herer P, Lavie P. Methodological aspects of shift work research-comprehensiveness and limitation: Actigraphic and PAT studies. Shiftwork International Newsletter. 2003;Volume 20, number 2.
2.Wedderburn A. Shiftwork and Health. BEST, published by the European Foundation for the Improvement of Living and Working Conditions. Luxembourg 2000.
3.Rajaratnam SM, Arendt J. Health in 24-h society. Lancet. 2001;358:999-1005.
4.Costa G. Working and health conditions of Italian air traffic controllers. Int J Occup Saf Ergon. 2000;6:365-82.
5.Smith C, Gibby R, Zickar M, Crossley C, Robie C, Folkard S, Tucker P, Barton J. Measurement properties of the Shiftwork Survey and Standard Shiftwor Index. J. Human Ergol. 2001;30:191-6.
6.Monk TH, Welsh DK. The role of chronobiology in sleep disorders medicine. Sleep Med Rev. 2003;7:455-73.
7.Costa G. Working and health conditions of Italian air traffic controllers. Int J Occup Saf Ergon. 2000;6:365-82.