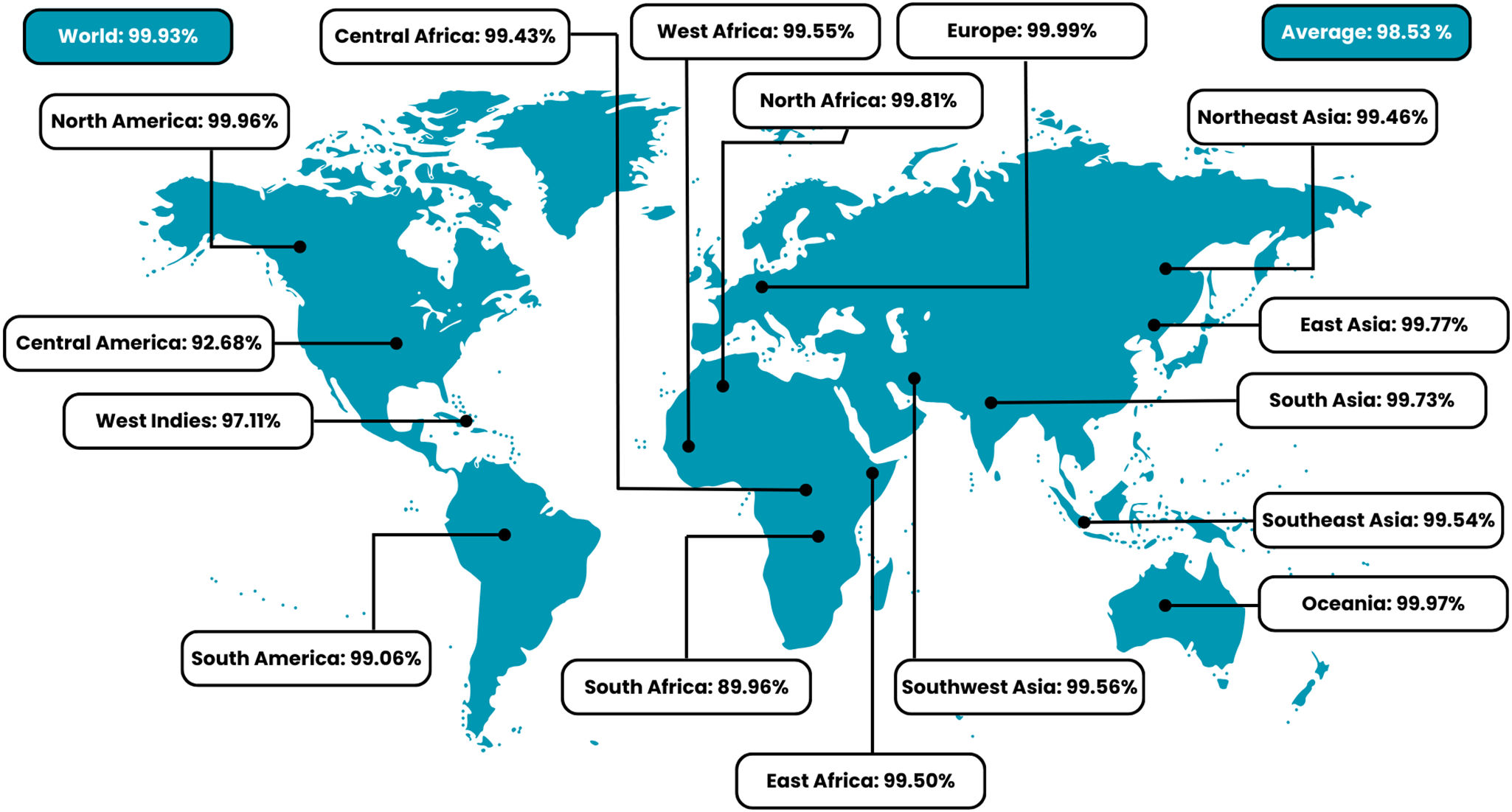
Monkeypox (MPX) disease is a re-emerging zoonotic disease caused by the monkeypox virus (MPXV), which poses an escalating danger to world health and has shown pandemic potential, as indicated by the 2022 epidemic. Notwithstanding the growing illness burden, no vaccinations or targeted therapies are sanctioned. The present work used a structure-based immunoinformatics approach to develop a multi-epitope subunit vaccine targeting MPXV.
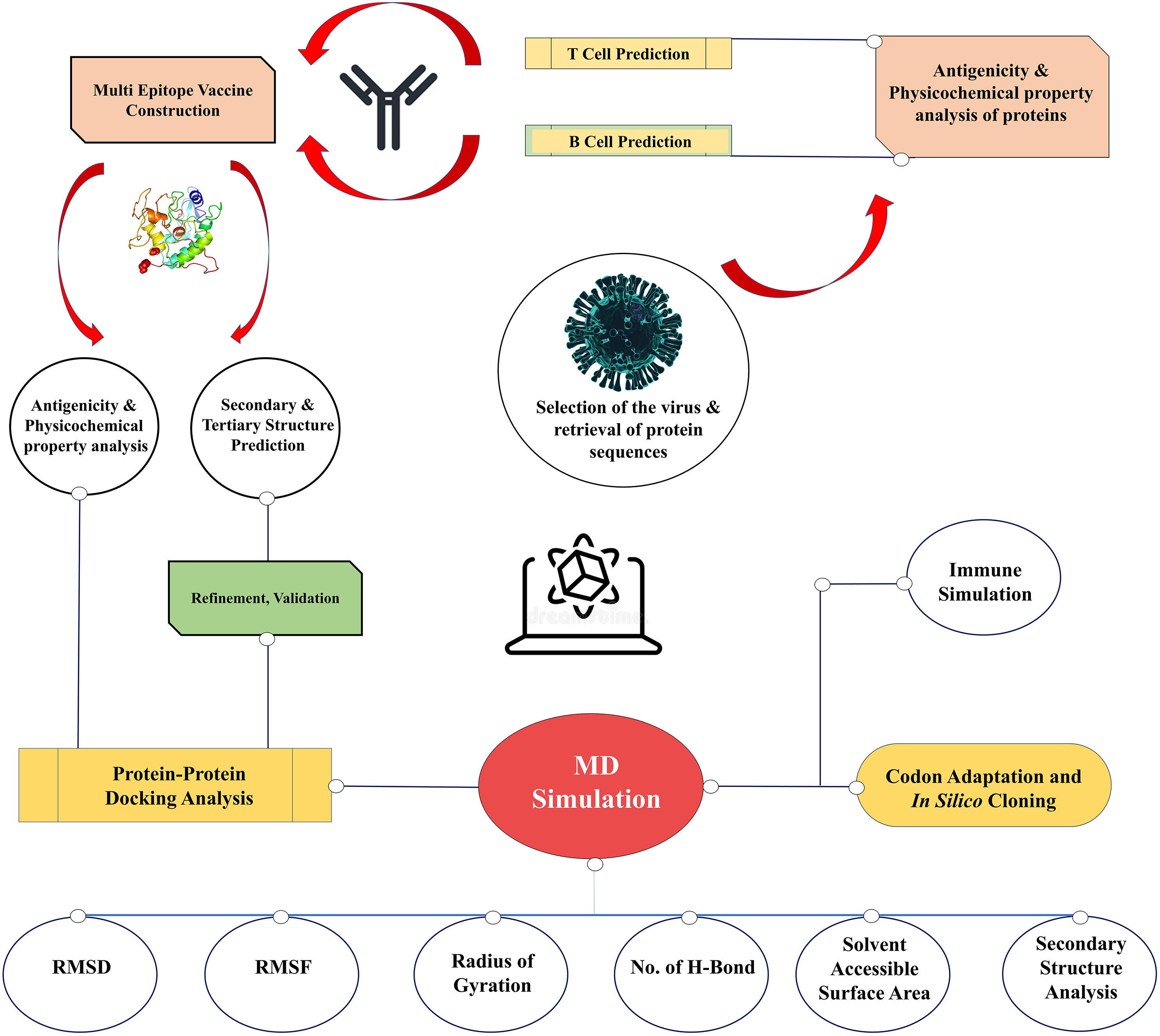
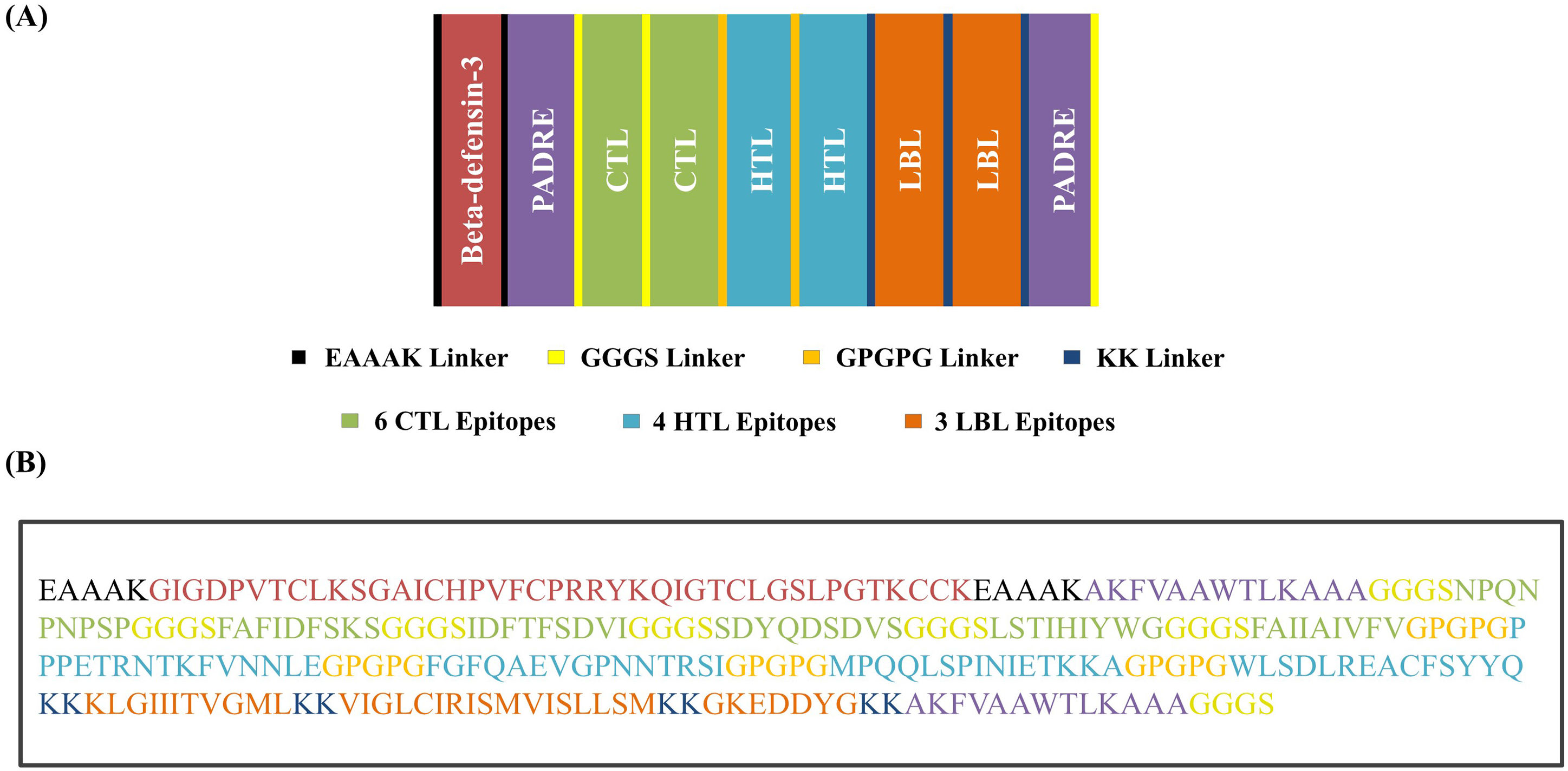
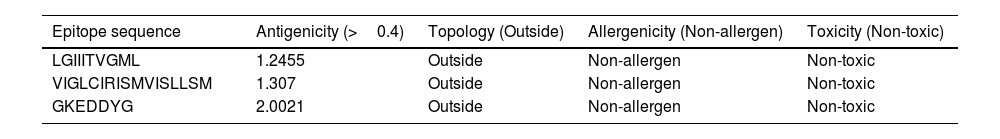
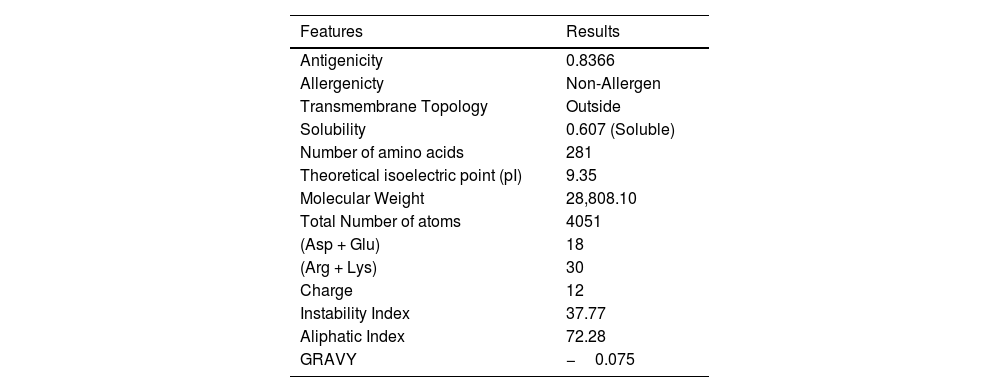
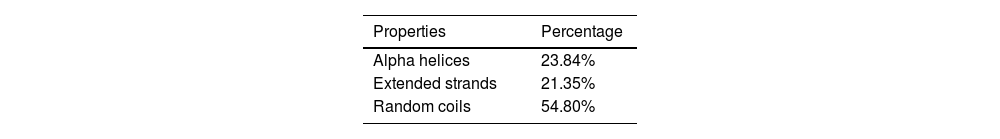
MethodsAmong the five identified viral proteins (A14L, A15L, A30L, A35R, and E8L), E8L, A14L, and A30L were potentially targeted for the vaccination due to their critical functions in viral particle attachment to host cells, viral envelope production, and morphogenesis. The comprehensive vaccine construction consists of six cytotoxic T lymphocytes (CTLs), four helper T lymphocytes (HTLs), and three B-cell epitopes interconnected by GGGS, GPGPG, and KK linkers to ensure epitope flexibility and preserve structural conformation and incorporating the β-defensin-3 and the PADRE sequence were used as adjuvants to enhance immunogenicity, resulting high antigenic, no allergenic, and no toxic.
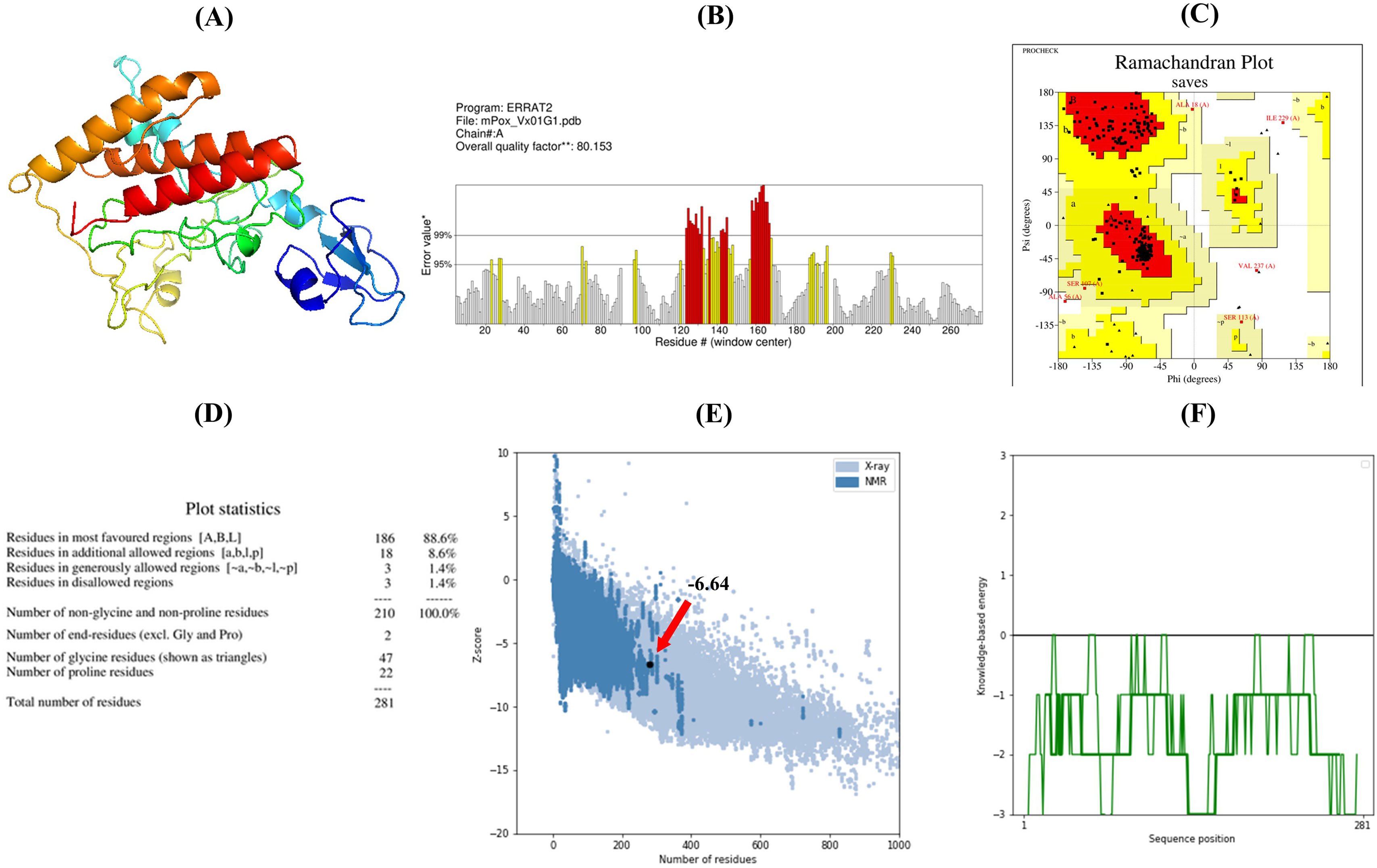
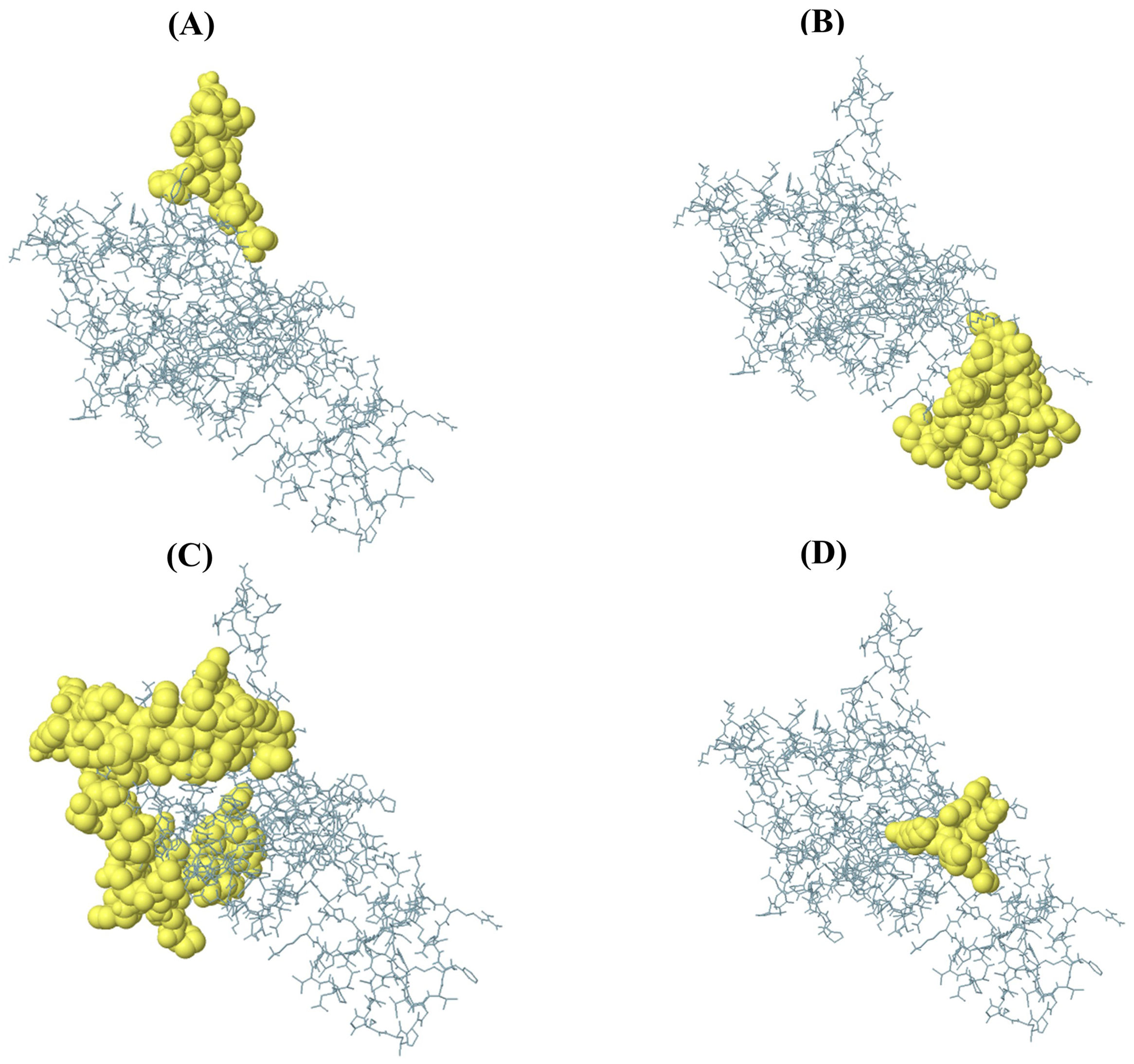
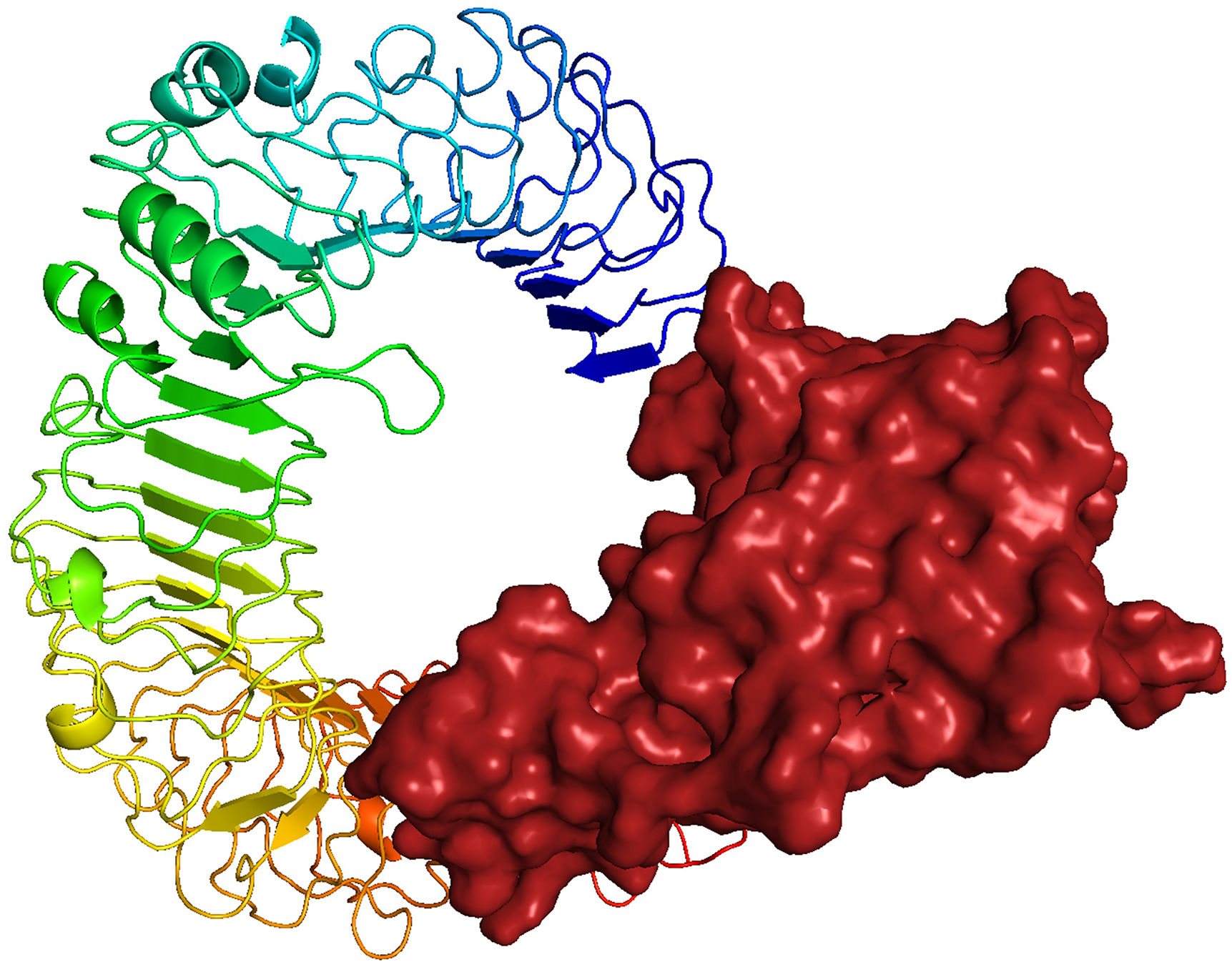
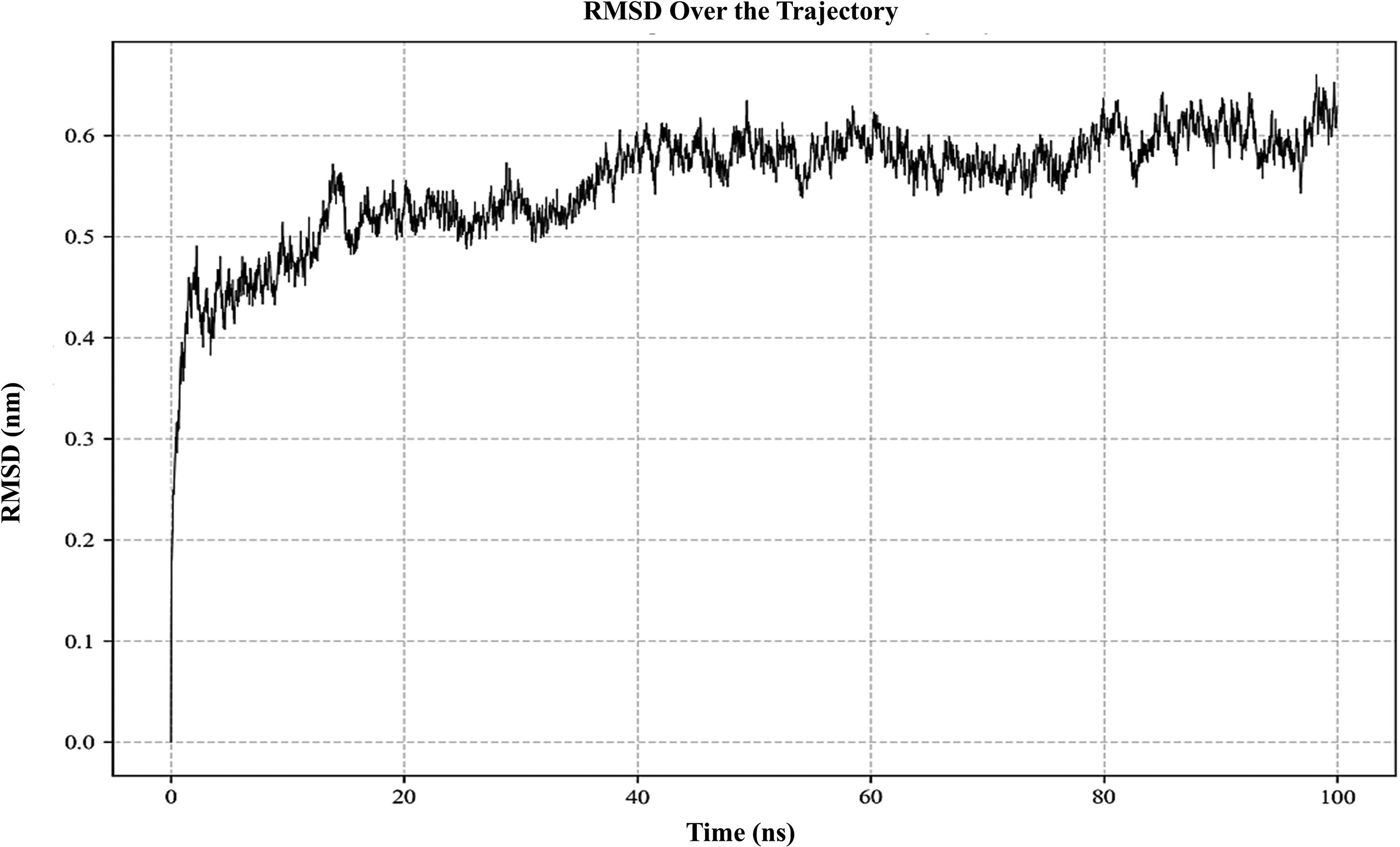
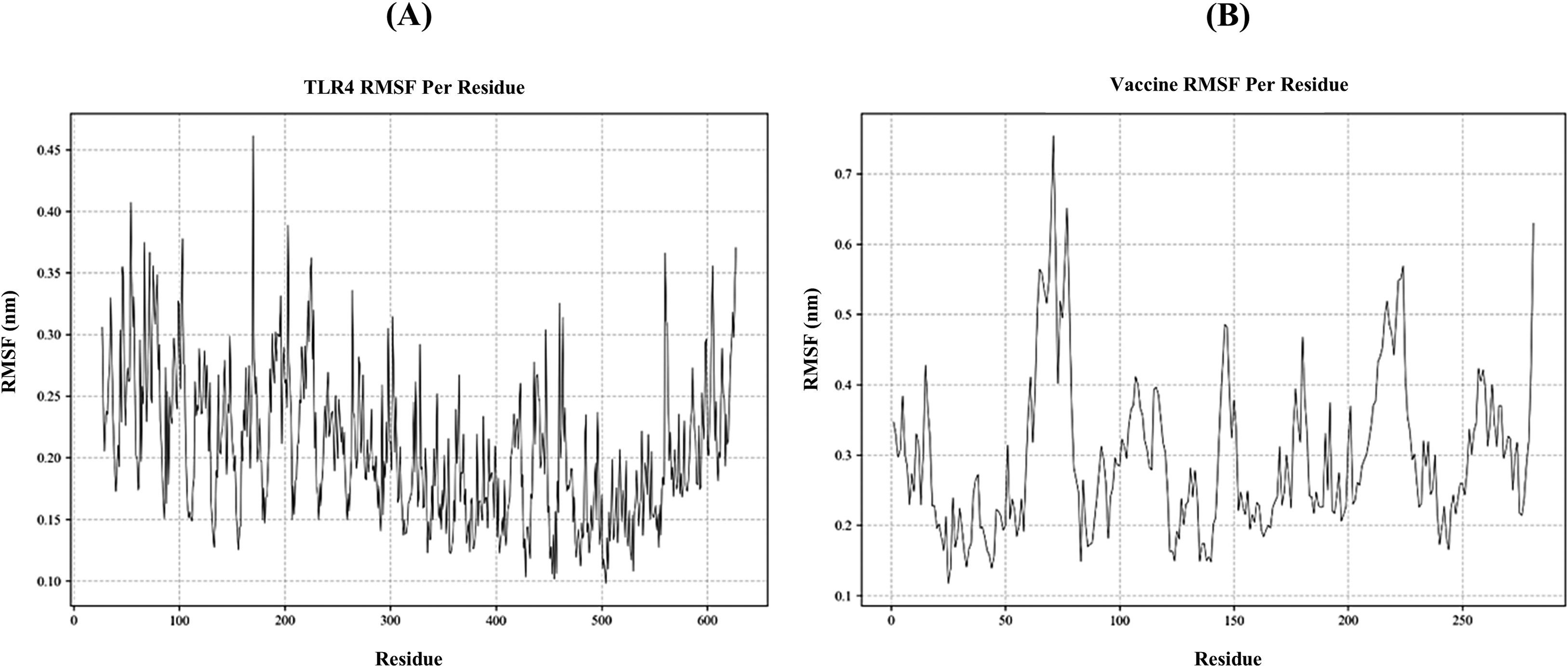
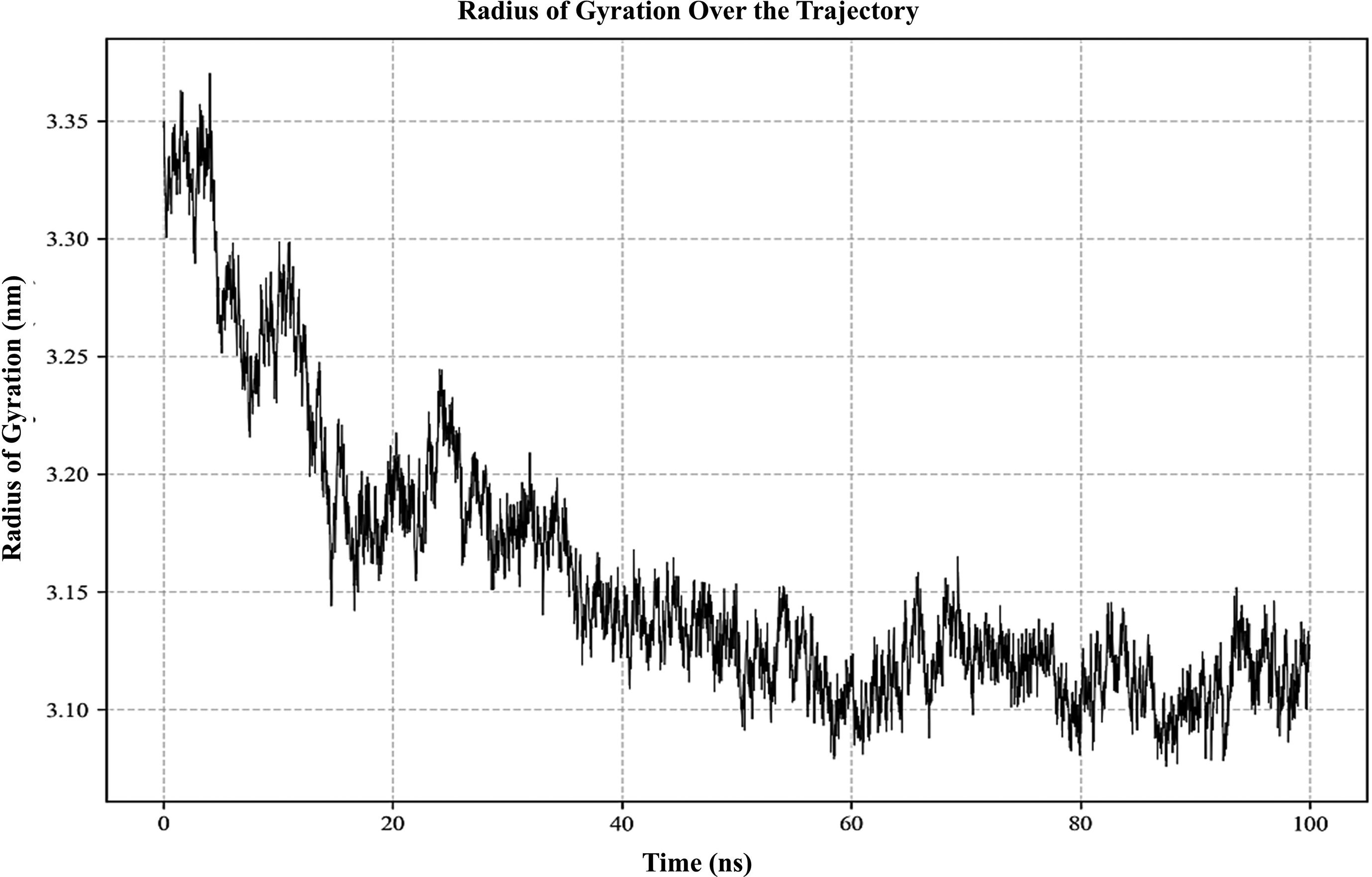
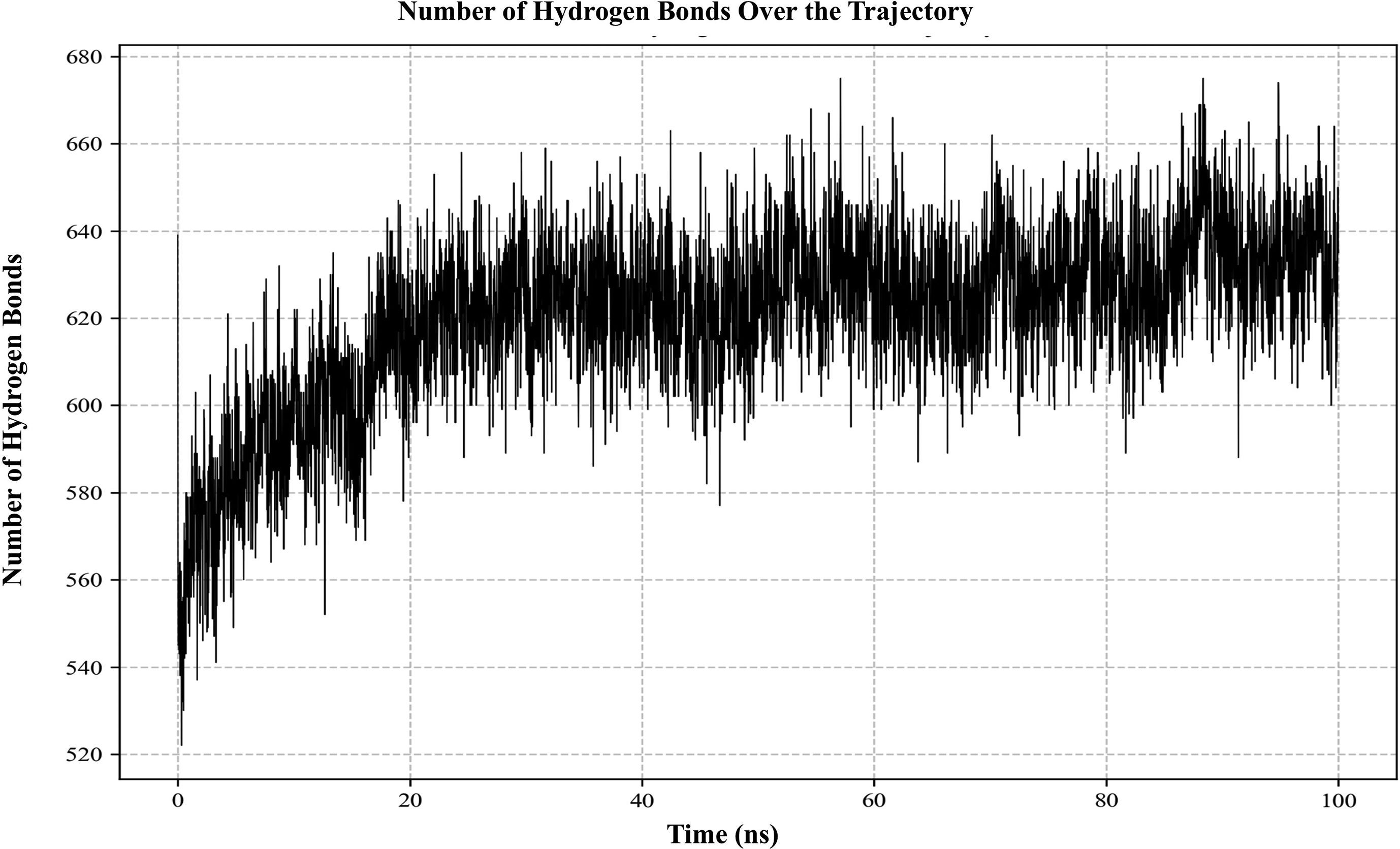
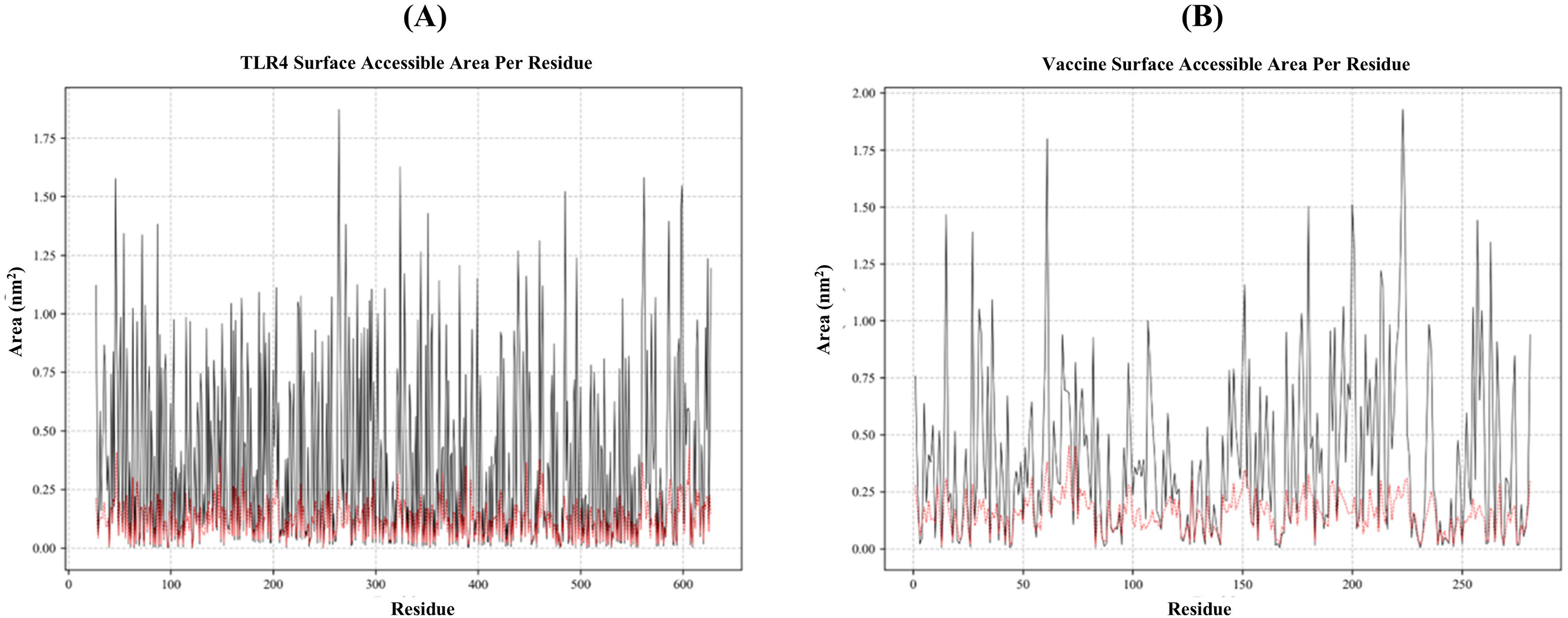
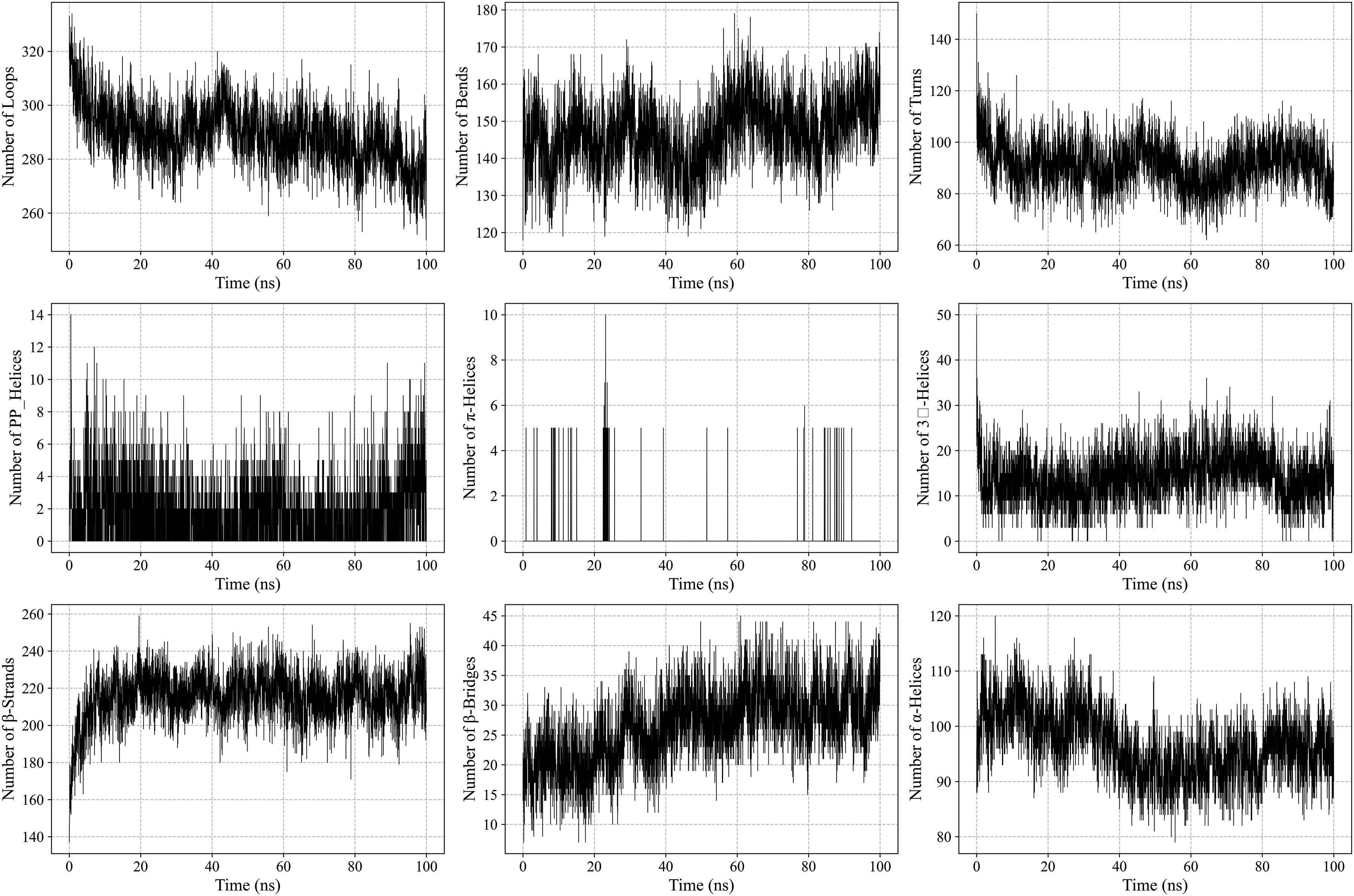
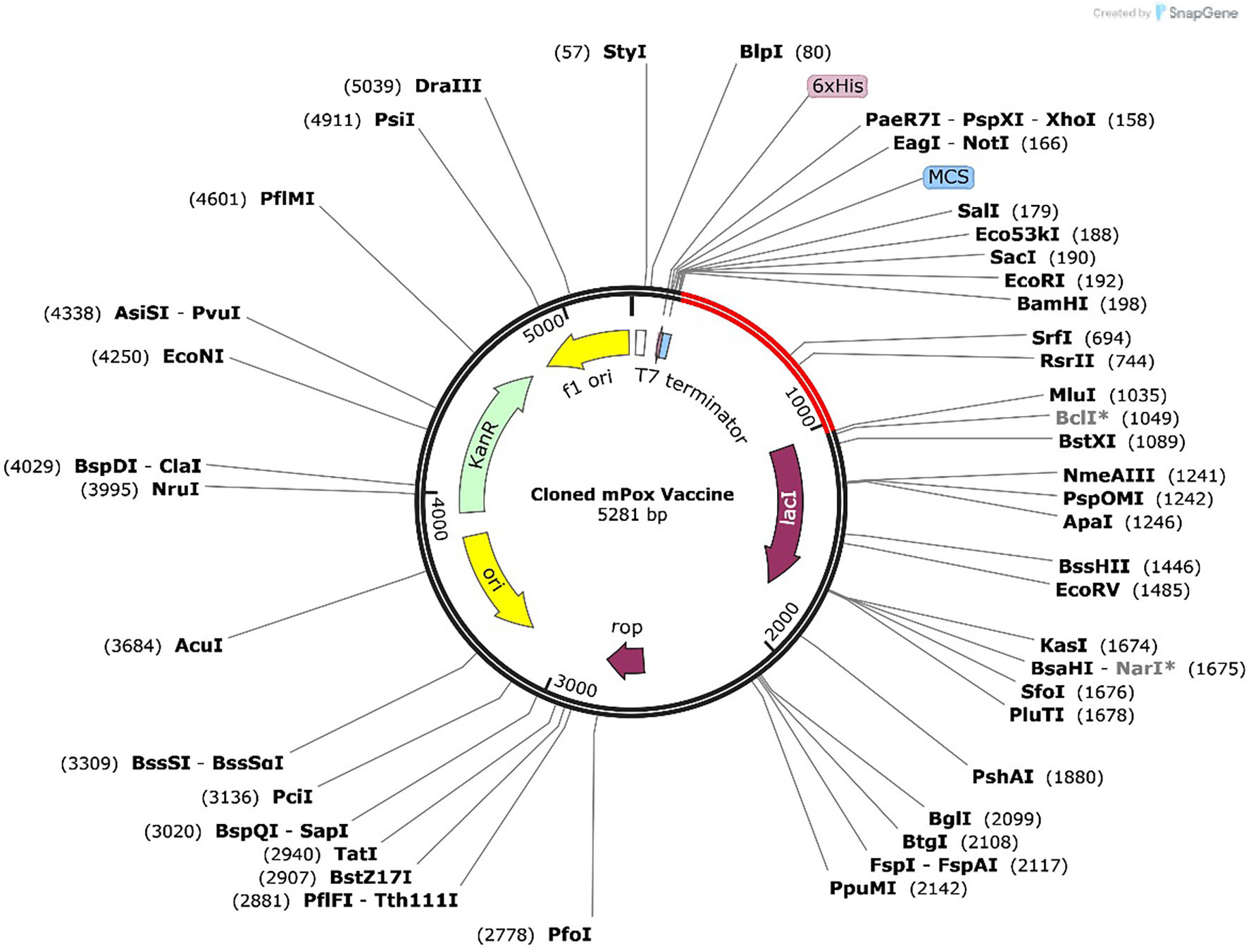
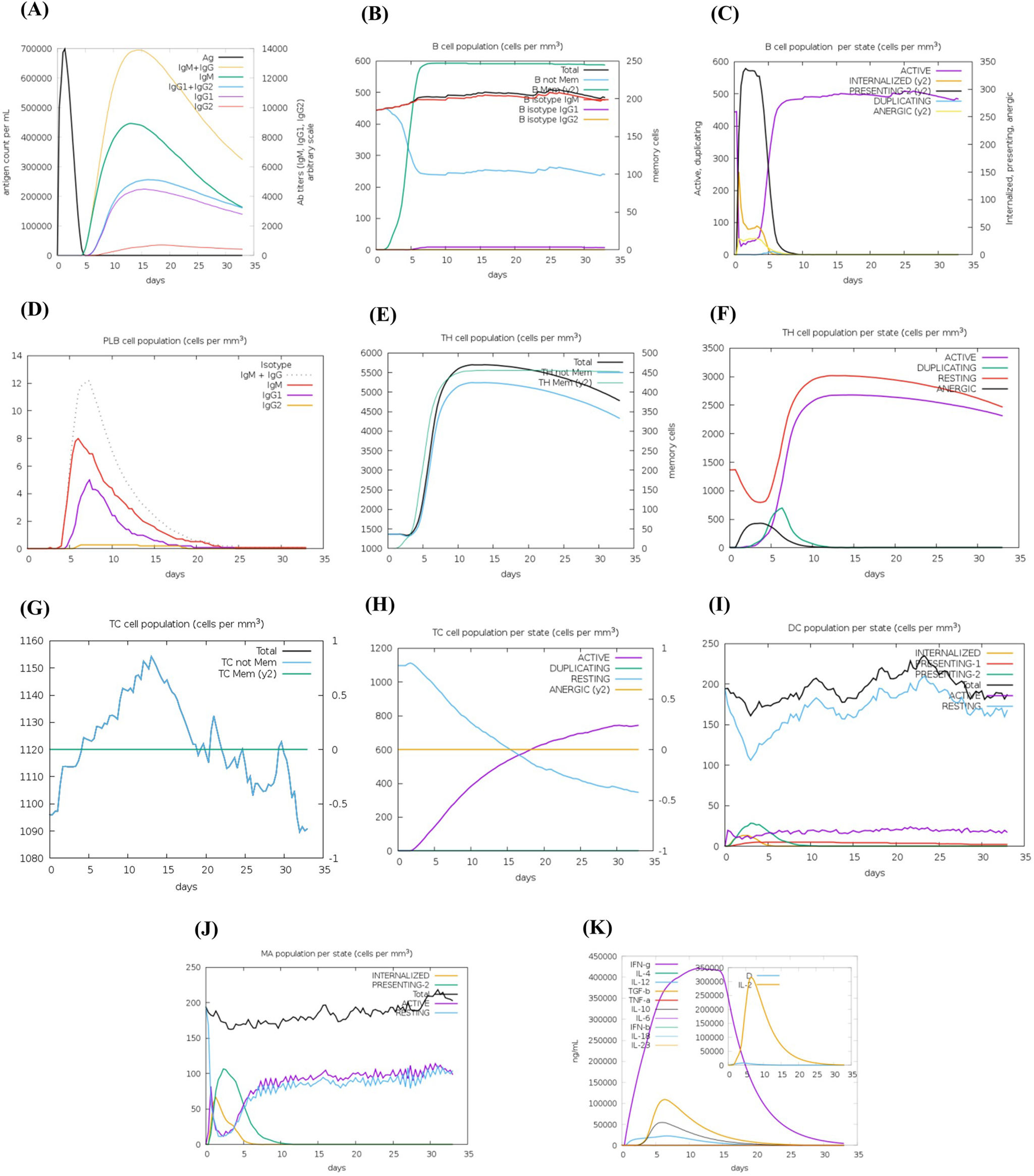
ResultsThe molecular docking demonstrated higher interaction with the TLR4 receptor (−877.1 kcal/mol), and molecular dynamics simulations validated the stability of the vaccine–receptor complex. Consolidating immunological models forecasted robust immune activation, characterized by elevated cytokine levels and enhanced memory cell responses. Additionally, codon optimization and in silico cloning confirmed the possibility for practical expression in Escherichia coli.
ConclusionThe findings demonstrate a strong immunogenic potential of the vaccine design against MPXV, necessitating further in vitro and in vivo validation studies.
La enfermedad del virus de la viruela del mono (MPX) es una enfermedad zoonótica reemergente causada por el virus de la viruela del mono (MPXV), que plantea un peligro creciente a la salud mundial, y ha mostrado un potencial pandémico, según lo indicado por la pandemia de 2022. Pese a la creciente carga de la enfermedad, no se han sancionado vacunaciones ni terapias dirigidas. El presente trabajo utilizó un enfoque inmunoinformático basado en estructura para desarrollar una vacuna de subunidad multiepitópica dirigida a MPXV.
MétodosEntre las cinco proteínas virales identificadas (A14L, A15L, A30L, A35R y E8L), E8L, A14L y A30L fueron dianas potenciales para la vacunación debido a sus funciones críticas en cuanto a fijación de partículas virales a las células huésped, producción de envoltura viral y morfogénesis. La amplia construcción de la vacuna se compone de seis linfocitos T citotóxicos (CTL), cuatro linfocitos T helper (HTL) y tres epítopos de células B interconectados por los enlazadores GGGS, GPGPG y KK para garantizar la flexibilidad epitópica y preservar la conformación estructural, utilizándose β-defensina-3 y la secuencia PADRE como adyuvantes para mejorar la inmunogenicidad, con resultado altamente antigénico, no alergénico y no tóxico.
ResultadosEl acoplamiento molecular demostró una mayor interacción con el receptor TLR4 (−877,1 kcal/mol), validando las simulaciones de dinámica molecular la estabilidad del complejo vacuna–receptor. La consolidación de los modelos inmunológicos previó la activación inmunológica robusta, caracterizada por niveles elevados de citocinas y una mejora de las respuestas de las células de memoria. Además, la optimización del codón y la clonación in silico confirmaron la posibilidad de expresión práctica en Escherichia coli.
ConclusiónLos hallazgos demuestran un potencial inmunogénico fuerte del diseño de la vacuna contra MPXV, que necesita estudios adicionales de validación in vitro e in vivo.