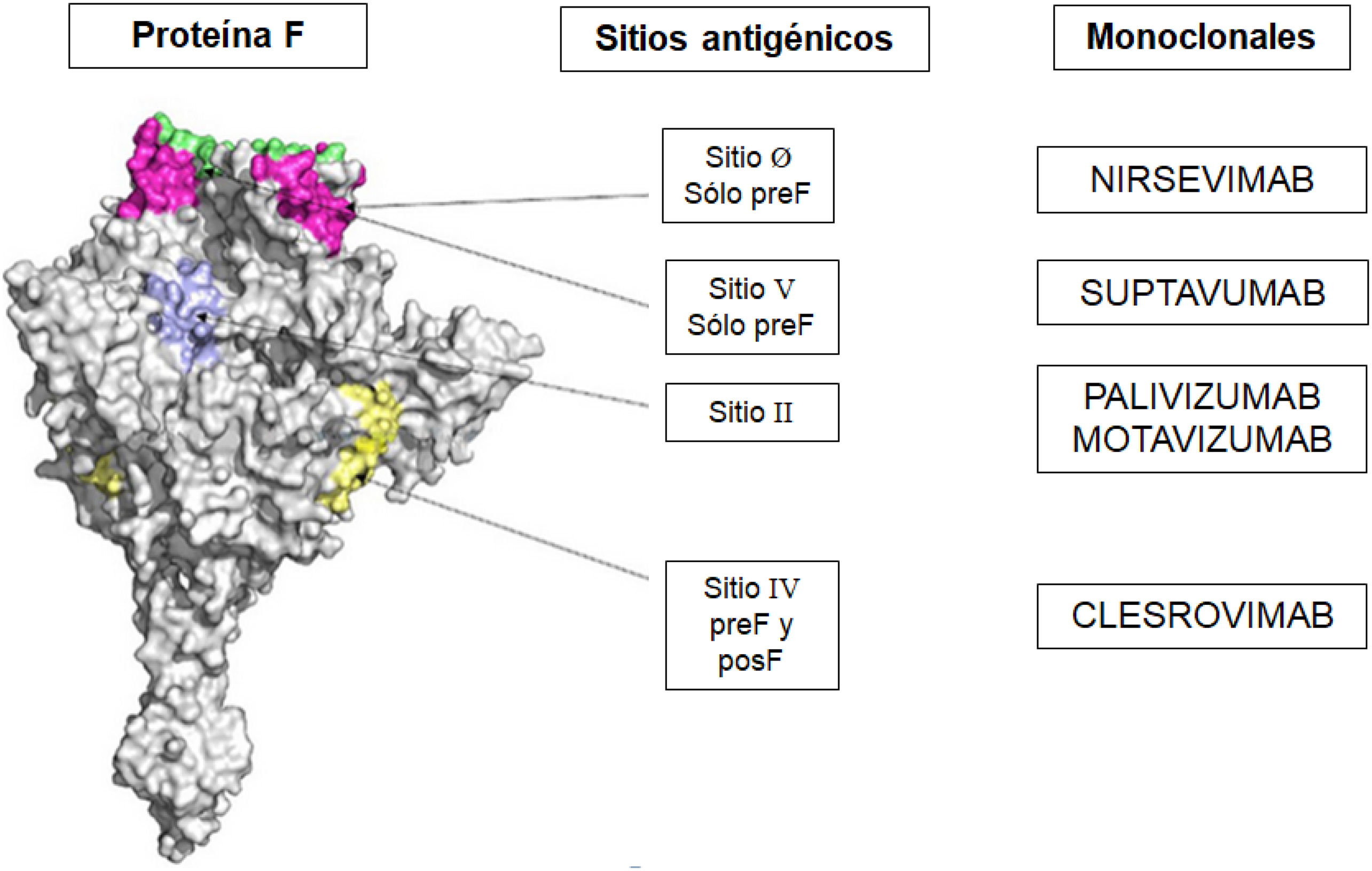
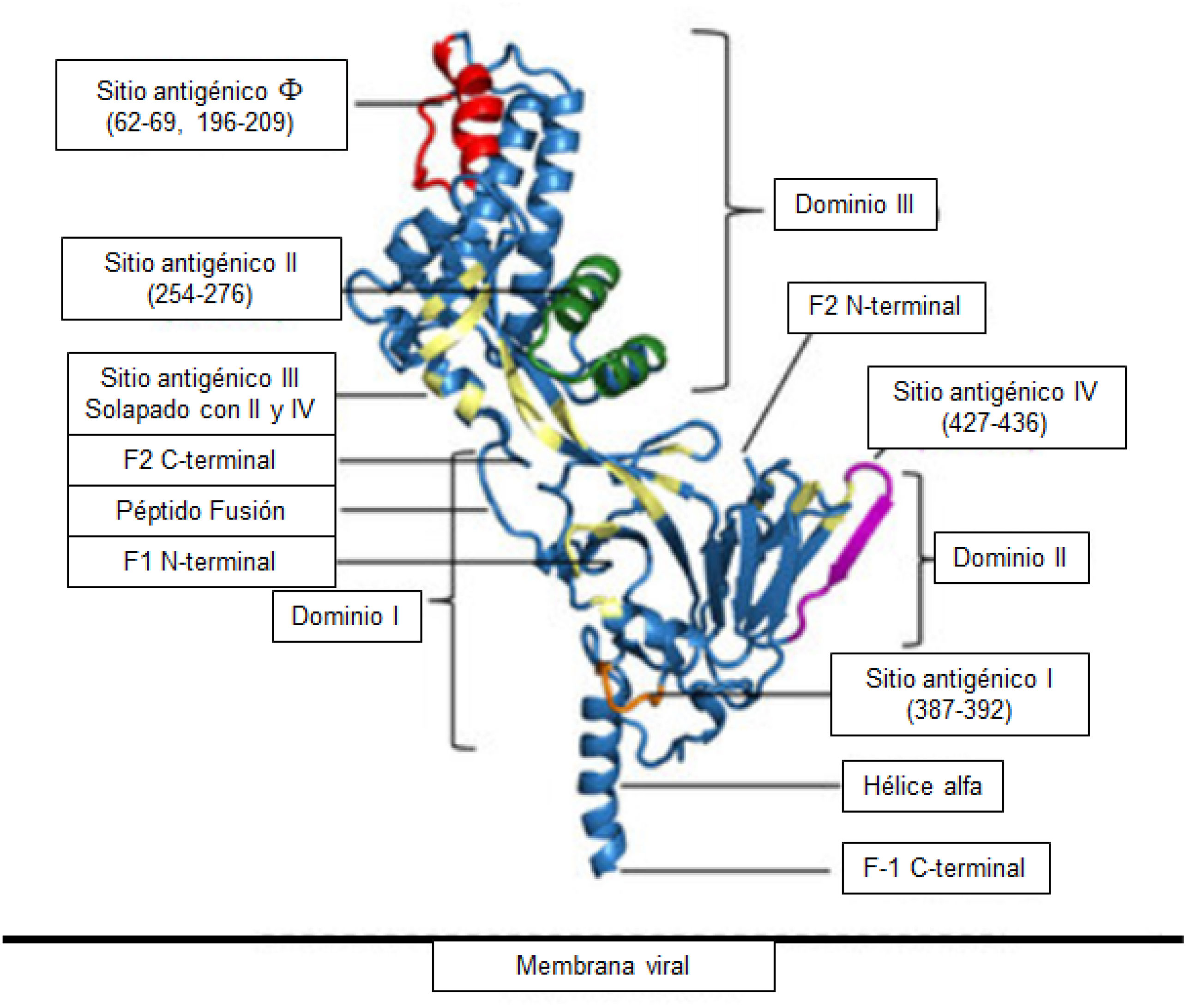
En 2023 se comercializó en España el anticuerpo monoclonal nirsevimab, dirigido específicamente frente al «sitio cero (Ø)» de la conformación de prefusión (preF) de la proteína F del virus respiratorio sincitial (VRS). La eficacia demostrada de este anticuerpo monoclonal impulsó la investigación de nuevas dianas antigénicas en dicha proteína del VRS. Clesrovimab (RB1) es un anticuerpo monoclonal humano tipo IgG kappa dirigido contra el sitio IV del VRS, expuesto tanto en la forma preF como en la posF. Su detección en secreciones nasales ha mostrado capacidad neutralizante frente al VRS, correlacionada con la concentración nasal, que representa entre el 1,4 y 3,3% de la concentración sérica. A los 5 meses de la inmunización, clesrovimab mostró una reducción en la incidencia y la gravedad de los síntomas del tracto respiratorio inferior asociados al VRS del 88%, en la hospitalización por VRS del 84,2% y en la hospitalización grave del 90,9%, tras una dosis de 100 mg. En junio de 2025, la FDA aprobó el anticuerpo monoclonal Enflonsia™ (clesrovimab-cfor, Merck & Co.), producido por la recombinación genética en células de ovario de hámster chino, para la prevención de las infecciones del tracto respiratorio inferior causadas por el VRS en lactantes nacidos durante o expuestos a su primera temporada de circulación de VRS (menores de 8 meses). De acuerdo con los diferentes ensayos clínicos disponibles, se trata de un anticuerpo monoclonal de vida media prolongada, diseñado para proporcionar una protección específica, directa, rápida y duradera (al menos 5 meses) con una única dosis de 105 mg administrada por vía intramuscular, independientemente del peso del lactante.
In 2023, the monoclonal antibody nirsevimab, specifically targeting the “site zero (Ø)” of the pre-fusion (preF) form of the RSV F protein, was introduced in Spain. The proven efficacy of this monoclonal antibody has led further researcher into novel antigenic targets on the RSV F protein. Clesrovimab (RB1) is a human IgG kappa monoclonal antibody directed against site IV of RSV, which is exposed in both the preF and postF conformations. The presence of clesrovimab in nasal secretions has shown RSV-neutralizing activity, which correlates with its nasal concentration that represents between 1.4% and 3.3% of serum concentration. Five months after immunization, clesrovimab has shown a reduction of the incidence and severity of RSV-associated lower respiratory tract symptoms by 88%, the incidence of RSV-related hospitalization by 84.2%, and the incidence of severe hospitalization by 90.9% following a single 100 mg dose. In June 2025, the FDA approved the monoclonal antibody Enflonsia™ (clesrovimab-cfor; Merck & Co.), produced by genetic recombination in Chinese hamster ovary cells, for the prevention of lower respiratory tract infections caused by RSV in infants born during or entering their first RSV season (aged <8 months). Based on various clinical trials, Enflonsia™ is considered a long-lived monoclonal antibody, designed to provide specific, direct, rapid, and long-lasting protection (at least 5 months) with a single intramuscular 105 mg dose, regardless of the infant's weight.