Las presentes guías fueron seleccionadas y adaptadas de acuerdo a los parámetros del New Zealand Guidelines Group (NZGG) para guías basadas en la evidencia. Inicialmente se realizó una búsqueda de guías de diferentes sociedades científicas, las cuales fueron evaluadas por el instrumento AGREE de acuerdo a su alcance y aplicabilidad. Se realizó una nueva búsqueda de literatura académica, se llevó a cabo una revisión sistemática de acuerdo con los artículos de información preferente para revisiones sistemáticas y metaanálisis (PRISMA); para la identificación de artículos se utilizaron las bases de datos Cochrane de revisiones sistemáticas, la biblioteca Cochrane de ensayos clínicos controlados, Medline y Embase; las estrategias de búsqueda se centraron en los últimos 3 años.
Las recomendaciones de las guías han sido calificadas de acuerdo a los niveles de evidencia del centro de medicina basado en la evidencia de Oxford (tablas 1 y 2).
Grado de comprobación científica
| Grado | Tipo de datos científicos |
|---|---|
| 1a | Datos científicos procedentes de metaanálisis de ensayos aleatorizados |
| 1b | Datos científicos procedentes de al menos un ensayo aleatorizado |
| 2a | Datos científicos procedentes de un estudio controlado bien diseñado sin aleatorización |
| 2b | Datos científicos procedentes de al menos un estudio cuasiexperimental bien diseñado de otro tipo |
| 3 | Datos científicos procedentes de un estudios no experimentales bien diseñados, como estudios comparativos, estudios de correlación y casos clínicos |
| 4 | Datos científicos procedentes de informes u opiniones de comités de expertos o de la experiencia clínica de autoridades en la materia |
Grado de recomendación
| Grado | Naturaleza de las recomendaciones |
|---|---|
| A | Basada en estudios clínicos de buena calidad y coherencia en los que se abordan las recomendaciones concretas y que incluyen al menos un ensayo aleatorizado |
| B | Basada en estudios clínicos bien realizados, pero sin ensayos clínicos aleatorizados |
| C | Emitida a pesar de la ausencia de estudios clínicos de buena calidad directamente aplicables |
El carcinoma de células renales (CR) es la lesión sólida más frecuente en el riñón y representa aproximadamente el 90% de todos los tumores renales malignos. Engloba diferentes tipos de CR con características histopatológicas y genéticas específicas1. Hay un predominio 1,5:1 de los varones sobre las mujeres, y la incidencia máxima tiene lugar entre los 60 y 70años de edad. Entre los factores etiológicos figuran factores relacionados con los hábitos de vida como tabaquismo, obesidad e hipertensión arterial. El hecho de tener un pariente de primer grado con cáncer de riñón también se asocia a un mayor riesgo de CR. La profilaxis más eficaz consiste en evitar el tabaquismo y la obesidad2-7.
Debido a la mayor detección de tumores mediante técnicas de imagen, como ecografía y tomografía computarizada (TAC), ha aumentado el número de CR diagnosticados de manera fortuita. Estos tumores son, con más frecuencia, de menor tamaño8-10.
ConclusiónSe han identificado varios factores de riesgo verificados, tales como tabaquismo, obesidad e hipertensión arterial. El tabaquismo es un factor de riesgo confirmado de CR (grado de comprobación científica: 2a).
Diagnóstico y estadificaciónSíntomasMuchas masas renales son asintomáticas y no palpables hasta las últimas fases de la enfermedad. En la actualidad, más del 50% de los CR se detectan de manera fortuita al emplear pruebas de imagen para investigar diversos complejos sintomáticos inespecíficos11,12 (grado de comprobación científica: 2b). La tríada clásica de dolor en la fosa renal, hematuria macroscópica y masa abdominal palpable es poco frecuente en la actualidad (6-10%)13,14 (grado de comprobación científica: 3).
Se identifican síndromes para neoplásicos en el 30% de los pacientes con CR sintomáticos (tabla 3) (grado de comprobación científica: 4). Algunos pacientes sintomáticos comienzan con síntomas de afectación metastásica, como dolor óseo o tos persistente15 (grado de comprobación científica: 2b).
La exploración física solo tiene una utilidad limitada en el diagnóstico del CR. Sin embargo, los hallazgos siguientes deberían desencadenar la práctica de exploraciones radiológicas:
- •
Masa abdominal palpable.
- •
Adenopatía cervical palpable.
- •
Varicocele que no se reduce.
- •
Edema bilateral en las extremidades inferiores.
Los evaluados con más frecuencia son creatinina sérica, filtración glomerular (FG), hemoglobina, velocidad de sedimentación globular, fosfatasa alcalina, LDH y calcemia corregida16,17 (grado de comprobación científica: 4).
Estudios radiológicosLa mayoría de los tumores renales se diagnostican mediante ecografía abdominal o TAC realizada por diversas razones (grado de comprobación científica: 4). Las pruebas de imagen pueden emplearse para clasificar las masas renales en sólidas o quísticas.
Presencia de realce con el contrasteEn cuanto a las masas renales sólidas, el criterio más importante para diferenciar las lesiones malignas es la presencia de realce con el contraste10 (grado de comprobación científica: 3). La estrategia tradicional para detectar y caracterizar masas renales consiste en utilizar ecografía, TAC o resonancia nuclear magnética (RNM). En algunos casos, como enfermedad renal crónica, contraindicación de uso de medios de contraste yodados y sospecha de trastornos vasculares periféricos como infarto y necrosis cortical, la ecografía con contraste podría resultar útil18-20.
TAC o RNMLa TAC o la RNM se utilizan para definir una masa renal. Han de obtenerse imágenes antes y después de la administración de un medio de contraste intravenoso para demostrar la presencia de realce. En la TAC, el realce de las masas renales se determina comparando los valores de unidades Hounsfield (UH) obtenidos antes y después de la administración del contraste. Una variación en 20UH o más es un dato sólido de realce21 (grado de comprobación científica: 3). A fin de optimizar el diagnóstico diferencial y la detección, la evaluación debe incluir imágenes de la fase nefrográfica, ya que esta fase permite una representación óptima de masas renales que normalmente no se realzan en la misma medida que el parénquima renal.
La TAC abdominal permite diagnosticar CR y aporta información sobre:
- •
Función y morfología del riñón contralateral (grado de comprobación científica: 3).
- •
Extensión del tumor primario con diseminación extrarrenal.
- •
Afectación venosa.
- •
Adenopatías locorregionales.
- •
Estado de las glándulas suprarrenales y el hígado (grado de comprobación científica: 3).
La angiografía por TC con contraste abdominal es una herramienta útil en casos seleccionados para obtener información detallada sobre el riego sanguíneo renal, de importancia para planeación quirúrgica como pinzamiento segmentario en nefrectomía parcial22,23. En casos de alergia al medio de contraste, la angiografía por RNM puede estar indicada, pero es menos sensible y menos precisa que la angiografía por TC para la detección de vasos supernumerarios24.
En caso de que los resultados por TC sean indeterminados, la RNM puede arrojar información adicional, tal como:
Realce de componentes nodulares en masas quísticas complejas25.
Información sobre enfermedad localmente avanzada26-28.
Información sobre el compromiso venoso y la extensión de trombos tumorales en la vena cava inferior, cuando estos están poco definidos en TC26-29 (grado de comprobación científica: 3).
La RNM se indica en los pacientes con alergia al contraste intravenoso y en el embarazo en insuficiencia renal27,30 (grado de comprobación científica: 3).
Otras pruebas complementariasLa arteriografía renal y la flebografía de la vena cava inferior solo tienen una utilidad limitada en el estudio diagnóstico de pacientes seleccionados con CR (grado de comprobación científica: 3). En los pacientes con cualquier signo de disfunción renal ha de contemplarse la práctica de un renograma isotópico y una evaluación de la función renal total para optimizar la decisión relativa al tratamiento31,32 (grado de comprobación científica: 2a).
Pruebas complementarias en el cáncer renal metastásicoLa TAC de tórax es la prueba complementaria más exacta con fines de estadificación torácica33-37 (grado de comprobación científica: 3). No obstante, como mínimo, ha de efectuarse una radiografía de tórax habitual, como alternativa menos exacta a la TAC de tórax, para evaluar la presencia de metástasis (grado de comprobación científica: 3). Hay consenso en que la mayor parte de las metástasis óseas y cerebrales son sintomáticas en el momento del diagnóstico, por lo que normalmente no está indicado efectuar una gammagrafía ósea o TAC cerebral sistemática38. Sin embargo, en caso de estar indicados por síntomas y signos clínicos o analíticos, pueden utilizarse otros procedimientos diagnósticos, tales como gammagrafía ósea, TAC o RNM38-41 (grado de comprobación científica: 3).
Clasificación de Bosniak de las masas renales quísticasEn cuanto a la evaluación de masas renales quísticas, la clasificación de Bosniak cataloga los quistes renales en 5 categorías en función del aspecto en la TAC en un intento de predecir el riesgo de malignidad42,43 (grado de comprobación científica: 3). El sistema de Bosniak también ofrece recomendaciones de tratamiento para cada categoría (tabla 4).
Clasificación de Bosniak
| Categoría de Bosniak | Características | Actitud |
|---|---|---|
| I | Quiste benigno simple con una pared muy fina o delgada que no contiene tabiques, calcificación ni componentes sólidos. Tiene densidad de agua y no se realza con el material contraste | Benigno |
| II | Quiste benigno que puede contener algunos tabiques muy finos o delgados. Puede haber calcificación fina en la pared o los tabiques. Lesiones <3cm con una atenuación alta de manera uniforme, de bordes bien definidos y que no se realizan con el contraste | |
| III | Estos quistes pueden contener más tabiques muy finos o delgados. Puede observarse un realce mínimo de un tabique muy fino o delgado o de la pared con el contraste. Puede haber un engrosamiento mínimo de los tabiques o de la pared. El quiste puede contener calcificación, que puede ser nodular y gruesa, pero no hay realce con el contraste. No hay elementos de tejidos blandos que realcen con el contraste. En esta categoría también se incluyen las lesiones renales ≥3cm. Totalmente intrarrenales, que no se realzan con el contraste y de atenuación elevada. Estas lesiones presentan, en general, bordes bien definidos | Seguimiento. Una pequeña proporción son malignos |
| IV | Estas lesiones son masas quísticas indeterminadas que presentan paredes o tabiques irregulares engrosados en los que puede observarse realce con el contraste | Cirugía o seguimiento. Malignos en >50% de las lesiones |
| V | Estas lesiones son lesiones quísticas claramente malignas que contienen componentes de tejidos blandos que se realzan con el contraste |
En el CR, el diagnostico histológico se establece tras la extirpación quirúrgica de los tumores renales por nefrectomía radical o nefrectomía parcial. El sistema de clasificación de Fuhrman del grado nuclear (grado 1, 2, 3 y 4) en el CR ha sido la clasificación aceptada de forma más general y es un factor pronóstico independiente e importante del CR (grado de comprobación científica: 3).
Según la Organización Mundial de la Salud (OMS), hay al menos 3 subtipos histológicos principales de CR44:
- •
De células claras (CRc, 80-90%).
- •
Papilar (CRp, 10-15%).
- •
De células cromófobas (CRcr, 4-5%) (grado de comprobación científica: 3).
Estos tipos de CR pueden diferenciarse mediante los cambios histológicos y de genética molecular (grado de comprobación científica: 3) (tabla 5). El CRp puede subdividirse en 2 subtipos distintos (tipos 1 y 2), con una evolución clínica adversa45,46 (grado de comprobación científica: 3).
Subtipos histológicos principales del carcinoma renal
| Subtipo histológico | Porcentaje de CR | Descripción histológica | Cambio de genética molecular asociados |
|---|---|---|---|
| • De células claras (CRc) | 80-90% | La mayor parte del CRc consta principalmente de células que contienen un citoplasma claro, aunque en algunos células predomina un citoplasma eosinófilo. El patrón de crecimiento puede ser tubular sólido y quístico | Identificados por la deleción específica del cromosoma 3p y la mutación en el gen VHL. Otros cambios son la duplicación de la banda cromosómica 5q22 y la deleción del cromosoma 6q, 8p, 9p y 14q |
| • Papilar (CRp) | 10-15% | La mayor parte de los CRp contienen células pequeñas con un citoplasma escaso, pero también con características basófilas, eosinófilas o de tinción pálida. Predomina un patrón de crecimiento papilar, aunque puede haber disposiciones papilares tubulares y sólidas. Las zonas necróticas son frecuentes. El CRp puede dividirse en 2 subtipos distintos: el tipo 1, con células pequeñas y citoplasma pálido, y el tipo 2, con células grandes y citoplasma eosinófilo, este último con un peor pronóstico | Las alteraciones genéticas más constantes son las trisomías de los cromosomas 3q, 7, 8, 12, 16, 17 y la pérdida del cromosoma Y |
| • De células 4-5% cromófobas (CRcr) | 45% | Las células del CRcr tienen un citoplasma granular pálido o eosinófilo. El crecimiento se produce generalmente en láminas sólidas | La característica genética es una combinación de pérdida de los cromosomas 1, 2, 6, 10, 13 y 17 |
La proporción de tumores renales pequeños y fortuitos ha aumentado significativamente en la mayoría de los países, aunque un número elevado de pacientes con CR sigue consultando por síntomas clínicos, tales como masa palpable, hematuria y síntomas para neoplásicos y metastásicos (grado de comprobación científica: 3). Una estadificación exacta del CR mediante TAC o RNM de tórax y abdomen es obligatoria (grado de comprobación científica: 3). La TAC de tórax es el método más sensible para la estadificación torácica. La gammagrafía ósea o la TAC cerebral sistemáticas carecen de utilidad en el estudio clínico habitual de los pacientes asintomáticos (tabla 6).
Recomendaciones
| GR | NE | |
|---|---|---|
| TAC abdominal simple y contrastada y RNM son recomendadas para pacientes con CR y se consideran equivalentes para diagnóstico y estadificación | B | 3 |
| TAC abdominal simple y contrastada y RNM son las modalidades imagenológicas apropiadas para caracterización la estadificación de tumores renales previo a cirugía | C | 3 |
| TAC de tórax: se recomienda para estadificación pulmonar y del mediastino | C | 3 |
| Gammagrafía ósea: no se recomienda de rutina | C | 3 |
| Biopsia de masa renal: se recomienda previo a terapia ablativa y terapia sistémica cuando no existe patología previa | C | 3 |
| Biopsia percutánea: se recomienda en pacientes candidatos a vigilancia activa | C | 3 |
| Biopsia renal percutánea: debe obtenerse mediante técnica coaxial | C | 3 |
En general, el sistema TNM de clasificación en estadios se recomienda para uso clínico y científico47 (tabla 7).
Clasificación TNM año 200947
| T Tumor primario |
| TX Tumor primario no puede ser establecido T0 Sin evidencia de tumor primario |
| T1 Tumor ≤7cm limitado al riñón |
| T1a Tumor ≤4cm limitado al riñón |
| T1b Tumor >4cm limitado al riñón |
| T2 Tumor >7cm limitado al riñón |
| T2a Tumor >7cm pero ≤10cm |
| T2b Tumor >10cm limitado al riñón |
| T3 Tumor que se extiende hacia los vasos mayores o invade directamente la glándula adrenal o tejidos perinéfricos pero no más allá de fascia de Gerota |
| T3a Tumor que se extiende a la vena renal a segmentarias o invade senos renales o perirrenales pero no va más allá de la fascia de Gerota |
| T3b Tumor que se extiende hasta la vena cava por debajo del diafragma |
| T3c Tumor que se extiende hasta la vena cava por encima del diafragma o invade la pared de la vena cava |
| T4 Tumor que invade más allá de la fascia de Gerota (incluye extensión hacia la glándula adrenal ipsilateral) |
| N Nodos linfáticos regionales |
| Nx No puede ser establecido |
| N0 Sin metástasis a nodos linfáticos regionales |
| N1 Metástasis a nodo linfático regional único |
| N2 Metástasis en más de un nodo linfático regional |
| M Metástasis a distancia |
| M0 Sin metástasis a distancia |
| M1 Con metástasis a distancia |
| Estadio | |||
|---|---|---|---|
| Estadio I | T1 | N0 | M0 |
| Estadio II | T2 | N0 | M0 |
| Estadio III | T3 | N0 | M0 |
| T1,T2,T3 | N1 | M0 | |
| Estadio IV | T4 | Cualquier N | M0 |
| Cualquier T | N2 | M0 | |
| Cualquier T | Cualquier N | M1 |
Los factores que influyen en el pronóstico pueden clasificarse en anatómicos, histológicos, clínicos y moleculares.
Factores anatómicosLos factores anatómicos comprenden: tamaño del tumor, invasión venosa, invasión de la cápsula renal, afectación suprarrenal y metástasis ganglionares y a distancia. Estos factores se agrupan habitualmente en el sistema de estadificación TNM de uso universal.
Factores histológicosLos factores histológicos comprenden: grado de Fuhrman, subtipo de CR, características sarcomatoides, invasión microvascular, necrosis tumoral e invasión del sistema colector. El grado nuclear de Fuhrman es el sistema de graduación histológica más aceptado en el CR48 (grado de comprobación científica: 3).
Según la clasificación de la OMS, existen 3 subtipos histológicos principales de CR: convencional (de células claras) (80-90%), papilar (10-15%) y de células cromófobas (4-5%). En un análisis unifactorial se constató una tendencia a un mejor pronóstico de los pacientes con CR de células cromófobas con respecto al papilar, y de este respecto al convencional (de células claras) CR. Sin embargo, la información pronóstica proporcionada por el subtipo de CR desaparece cuando se estratifica en función del estadio tumoral49,50 (grado de comprobación científica: 3).
Entre los CR papilares se han identificado 2 subgrupos con evoluciones diferentes: el tipoi son tumores de grado bajo con citoplasma cromófilo y un pronóstico favorable. El tipoii son tumores en su mayor parte de alto grado con citoplasma eosinófilo y una tendencia importante a presentar metástasis51 (grado de comprobación científica: 3).
La clasificación en tipos del CR se ha confirmado a escala molecular mediante análisis citogenéticos y genéticos52-55 (grado de comprobación científica: 2b).
Factores clínicosLos factores clínicos comprenden: estado funcional del paciente, síntomas localizados, caquexia, anemia y recuento de plaquetas56-58 (grado de comprobación científica: 3).
Factores molecularesEntre los numerosos marcadores moleculares en investigación figuran: anhidrasa carbónicaIX (CaIX), factor de crecimiento del endotelio vascular (VEGF), factor inducible por la hipoxia (HIF), Ki67 (proliferación), p53, PTEN (homólogo de la fosfatasa y tensina) (ciclo celular), cadherinaE y CD44 (adherencia celular) (grado de comprobación científica: 3). Hasta la fecha no se ha demostrado que ninguno de estos marcadores mejore la exactitud predictiva de los sistemas pronósticos actuales, por lo que no se recomienda su uso en la práctica habitual59-62.
Por último, aunque parece que la determinación de perfiles de expresión génica es un método prometedor, hasta ahora no ha ayudado a identificar nuevos factores pronósticos relevantes.
Sistemas y nomogramas pronósticosSe han desarrollado y validado externamente sistemas y nomogramas pronósticos postoperatorios que combinan factores pronósticos independientes63-69. Es posible que estos sistemas sean más exactos que el estadio TNM o el grado de Fuhrman aislado para predecir la supervivencia (grado de comprobación científica: 3). Una ventaja importante de los nomogramas es su capacidad para medir la exactitud predictiva (EP), lo que permite evaluar objetivamente todos los parámetros predictivos nuevos. Antes de ser adoptado, cada variable o sistema pronóstico nuevo tiene que demostrar que su EP es superior a la de sistemas histopronósticos postoperatorios convencionales. Recientemente se han diseñado nuevos nomogramas preoperatorios con EP excelentes.
ConclusiónEn los pacientes con CR debe identificarse el estadio TNM, el grado nuclear según Fuhrman y el subtipo de CR (OMS, 2004), ya que aportan información pronóstica importante (grado de comprobación científica: 2). Los sistemas pronósticos deberían utilizarse actualmente en un contexto metastásico, y continúan en investigación en la enfermedad localizada (grado de comprobación científica:) (tabla 8).
Recomendaciones GR
| GR | NE | |
|---|---|---|
| Se recomienda el uso de sistema de clasificación TNM | B | 2 |
| Se recomienda el uso de sistemas de graduación y de clasificación de los subtipos de CR según la OMS | B | 2 |
| Sistemas pronósticos:; deben usarse en enfermedad metastásica | B | 2 |
| En enfermedad localizada, el uso de sistemas pronósticos integrados o nomogramas no se recomienda de forma rutinaria, a menos que estos sistemas puedan ofrecer justificación para la inclusión de pacientes en ensayos clínicos | C | 3 |
| Marcadores pronósticos moleculares: no se recomiendan para uso clínico de rutina | C | 3 |
Estudios morfológicos detallados, con uso de técnicas inmunohistoquímicas y moleculares contemporáneas, han dado lugar a la clasificación actual de las neoplasias epiteliales renales, tal como se describe en la monografía de la OMS de 2004. Los tipos habituales de CR de células claras (CRc), papilar (CRp) y de células cromófobas (CRcr) constituyen aproximadamente el 85-90% de los tumores renales malignos. El 10-15% de tumores renales restantes comprenden diversos carcinomas esporádicos y familiares infrecuentes, algunos de ellos recientemente descritos, y un grupo de carcinomas no clasificados70.
Carcinoma canalicular de Bellini (carcinoma de conductos colectores)El carcinoma de conductos colectores es un tipo muy raro de CR que se manifiesta a menudo en un estadio avanzado de la enfermedad. Hasta el 40% de los pacientes presentan diseminación metastásica en el momento de presentación inicial, y la mayoría fallecen en los primeros 1-3años después del diagnóstico principal. Hasta la fecha, la serie más extensa de casos (n=81) en que se ha investigado la evolución indicó la existencia de metástasis ganglionares regionales en el 44% de los pacientes en el momento del diagnóstico y de metástasis a distancia en el 32%. La supervivencia fue del 48% a los 5años y del 14% a los 10años. La respuesta a terapias dirigidas es pobre71,72.
Carcinoma renal sarcomatoideEl CR sarcomatoide representa una transformación de alto grado de diferentes tipos de CR, sin que se trate de una entidad histológica distinta. Los cambios sarcomatoideos en el CR conllevan un peor pronóstico y una pobre respuesta a la terapia sistémica73,74.
Carcinoma renal no clasificadoEl CR no clasificado es una categoría diagnóstica que alude al CR que no puede asignarse a ninguna otra categoría70.
Carcinoma renal quístico multilocular (CRc multilocular)No existen criterios histopatológicos estrictos para este subtipo70. En la clasificación de la OMS de 2004 el CRc multilocular es una entidad independiente, aunque se trata básicamente de un CRc bien diferenciado. Este subtipo llega a representar el 3,5% de los tumores renales tratados quirúrgicamente. Hasta la fecha no se han descrito metástasis de este tumor. Según la clasificación de Bosniak, que se basa en criterios de imagen, el CRc multilocular se manifiesta como una lesión quística tipoii o iii de Bosniak. Sin embargo, este tipo de lesión de Bosniak también puede deberse a un tumor epitelial y estromal mixto del riñón (TEEMR), un nefroma quístico o un quiste multilocular, todos ellos lesiones benignas. En muchos casos, una biopsia preoperatoria y un análisis intraoperatorio de cortes congelados no dan lugar a un diagnóstico correcto. Afortunadamente, todos estos tumores se tratan con la misma estrategia quirúrgica. Por este motivo, en caso de ser técnicamente posible, una nefrectomía parcial es la técnica de elección cuando se observa una masa renal multiquística compleja de densidad aumentada75,76 (grado de comprobación científica: 3) (grado de recomendación: B).
Adenoma papilarLos adenomas papilares son tumores con una estructura papilar o tubular, de grado nuclear bajo y de 5mm de diámetro o menos. Dado que son muy pequeños, solo se identifican de manera fortuita en una pieza de nefrectomía70.
Carcinoma medular renalEl carcinoma medular renal es una neoplasia maligna devastadora que afecta principalmente a varones jóvenes con rasgo drepanocítico. También es muy raro, de modo que supone en torno al 2% de todos los tumores renales primarios en personas jóvenes entre 10 y 20años de edad. En el 95% de los casos se observa enfermedad metastásica en el momento de presentación.
Carcinoma por translocaciónLos carcinomas por translocación renales son tumores infrecuentes que suelen aparecer en niños y adultos jóvenes. En la mayor parte de los carcinomas por translocación (alrededor del 90%) interviene el factor de transcripción E3 (TFE3) localizado en Xp11.2, y parece que siguen una evolución relativamente inactiva, a pesar de encontrarse a menudo en un estadio avanzado en el momento de presentación77.
Carcinoma mucinoso y tubular de células fusiformesEste tumor guarda relación con el asa de Henle. La mayoría de los carcinomas mucinosos y tubulares de células fusiformes se comportan como tumores de bajo grado70,78.
Carcinoma asociado a nefropatía terminalLos cambios degenerativos quísticos, nefropatía quística adquirida (NQA) y una mayor incidencia de CR son características típicas de la nefropatía terminal (NT). La incidencia de NQA ronda el 50% en los pacientes sometidos a diálisis, pero también depende de la duración de la diálisis, el sexo (3 veces más frecuente en los varones) y los criterios diagnósticos del método de evaluación. Se identifican CR de riñones terminales naturales en aproximadamente el 4% de los pacientes. El riesgo durante toda la vida de padecer un CR es, como mínimo, 10 veces mayor que el de la población general. En comparación con los CR esporádicos, los CR asociados a NT y NQA se caracterizan por ser multicéntricos y bilaterales, por aparecer en pacientes más jóvenes (principalmente varones) y por un comportamiento menos agresivo. En los pacientes trasplantados, sin embargo, suele ser bastante agresivo, probablemente como resultado de la inmunosupresión. Aunque el espectro histológico de tumores en la NQA es similar al observado en el CR esporádico, la forma predominante es el CRp, presente en el 41-71% de los CR asociados a NQA, frente al 10% en el CR esporádico. El resto de tumores son en su mayor parte CRc. Tickoo et al. han descrito recientemente 2 nuevos tumores renales asociados a NT: CR asociado a poliquistosis adquirida y CRp de células claras. Hasta ahora, estas entidades no han sido aceptadas de forma general. El potencial maligno de los CR en la NT sigue siendo motivo de debate en comparación con los CR esporádicos. Los pacientes con NT deben someterse a una evaluación ecográfica anual de los riñones79-83.
Tumores metanéfricosLos tumores metanéfricos se dividen en adenoma metanéfrico, adenofibroma y tumores del estroma metanéfrico. Se trata de tumores benignos muy raros, y su extirpación quirúrgica resulta suficiente70.
Tumores epiteliales y estromales renalesLos tumores epiteliales y estromales renales (TEER) representan un nuevo concepto que combina 2 tumores mesenquimatosos y epiteliales mixtos benignos: nefroma quístico y tumores epiteliales y estromales mixtos. Los estudios de imagen revelan que la mayoría de las lesiones quísticas de TEER corresponden al tipoiii de Bosniak y, con menor frecuencia, al tipoii o iv. Aunque se ha descrito un comportamiento agresivo en muy pocos casos, ambas neoplasias suelen considerarse benignas y su extirpación quirúrgica resulta curativa.
OncocitomaLos oncocitomas renales son tumores benignos que representan cerca del 3-7% de todos los tumores renales. Las características de imagen aisladas son poco fiables para diferenciar entre oncocitoma y CR. El diagnóstico histopatológico sigue siendo el método de referencia. Aunque tan solo una biopsia percutánea puede dar lugar a un diagnóstico preoperatorio, presenta una especificidad baja para oncocitoma porque también se identifican células oncocitósicas en el CRc, la variante de células granulares de CR y la variante eosinófila de CRp (tipo 2). En determinados casos de oncocitomas confirmados histológicamente puede contemplarse una actitud expectante; las alternativas de manejo incluyen nefrectomía parcial y terapias mínimamente invasivas70,84,85 (grado de comprobación científica: 3) (grado de recomendación: C).
Tumores renales hereditariosPueden identificarse tumores renales hereditarios como parte de las siguientes entidades: sindromáticas como Von Hippel-Lindau, CRp hereditario, síndrome de Birt-Hogg-Dube, leiomiomatosis hereditaria, esclerosis tuberosa y translocación constitucional del cromosoma 370.
Tumores mesenquimatosos T2Los tumores mesenquimatosos incluyen diferentes tipos de sarcomas y son relativamente raros, excepto el angiomiolipoma.
Angiomiolipoma T3El angiomiolipoma (AML) es un tumor mesenquimatoso benigno constituido por una proporción variable de tejido adiposo, células musculares lisas fusiformes y epitelioides y vasos sanguíneos de pared gruesa anómalos. Puede aparecer de forma esporádica, lo cual es 4 veces más probable en las mujeres. También surge en la esclerosis tuberosa, en cuyo caso es múltiple, bilateral, de mayor tamaño y con probabilidad de causar hemorragias espontáneas. Representa en torno al 1% de los tumores extirpados quirúrgicamente. La ecografía, la TAC y la RNM confirman a menudo el diagnóstico debido a la presencia de tejido adiposo. La biopsia rara vez resulta útil. De forma preoperatoria, puede ser difícil diferenciar entre tumores formados principalmente por células musculares lisas y tumores epiteliales. El AML epitelioide es una variante potencialmente maligna de AML.
Las principales complicaciones del AML renal son la hemorragia retroperitoneal y la hemorragia en el sistema colector urinario, que puede ser potencialmente- mortal. La tendencia hemorrágica tiene que ver con el componente angiógeno del tumor, que incluye vasos sanguíneos irregulares y aneurismáticos. Los principales factores de riesgo de hemorragia son el tamaño del tumor, el grado del componente angiógeno del tumor y la presencia de esclerosis tuberosa70-86.
Las indicaciones primarias de intervención comprenden síntomas tales como dolor, hemorragia o sospecha de neoplasia maligna. Una intervención profiláctica es justificable en caso de:
- •
Tumores grandes (el umbral recomendado de intervención es ≥4cm de ancho)86,89.
- •
Mujeres en edad fértil.
- •
Pacientes en los que el seguimiento o el acceso a asistencia de urgencias no es adecuado (grado de comprobación científica: 3) (grado de recomendación: C).
La mayoría de los casos de AML pueden tratarse mediante técnicas conservadoras de nefrectomía parcial, aunque algunos casos de AML precisan una nefrectomía radical (grado de comprobación científica: 3). De entre las intervenciones quirúrgicas habituales, puede emplearse embolización arterial selectiva (EAS) y ablación por radiofrecuencia (ARF). Aunque la EAS resulta eficaz para controlar la hemorragia en el contexto agudo, tiene una utilidad limitada en el tratamiento a largo plazo del AML86-89.
Nuevas entidades histológicasRecientemente se han descrito nuevas entidades histológicas, para las que por ahora existen muy pocos datos clínicos. Entre ellas figuran:
- •
Tumor/carcinoma folicular seudotiroideo del riñón.
- •
CR asociado a neuroblastoma.
- •
Tumor angiomioadenomatoso renal.
- •
Carcinoma tubuloquístico.
- •
CRp de células claras.
- •
CRp oncocítico.
- •
Carcinoma renal folicular.
- •
CR leiomiomatoso.
Existen diversos tumores renales, de los que en torno al 15% son benignos. Todas las lesiones renales deben examinarse (por ejemplo, estudios de imagen, biopsia, etc.) y juzgarse en relación con la probabilidad de comportamiento maligno.
Tratamiento del carcinoma renal localizadoNefrectomía parcialCon base en los resultados oncológicos y de calidad de vida disponibles, la evidencia actual sugiere que el CR localizado se maneja mejor con nefrectomía parcial (NP) y no con nefrectomía radical (NR), con independencia del abordaje quirúrgico. Estudios que comparan la nefrectomía parcial abierta con la nefrectomía radical abierta demuestran que la tasa estimada de supervivencia cáncer-específica (SCE) a los 5años fue comparable90-93. Por primera vez, este hallazgo ha sido confirmado recientemente por estudios prospectivos, comparando la nefrectomía radical con la nefrectomía parcial en el tumor renal T1-2 N0M0 solitario <5cm con la función del riñón contralateral normal. Después de 9,3años de seguimiento, 198 pacientes (72,5%) estaban vivos después de la nefrectomía radical y 173 (64,4%) después de NP. El SCE fue de 98,5 vs. 97%, respectivamente. La recidiva local se produjo en un paciente en el grupo de NR y en 6 en el grupo NP94.
Una serie de estudios comparó NR vs. NP (abierta o laparoscópica) para CR <4cm95-99. Los resultados mostraron que la nefrectomía radical se asoció con mayor mortalidad por cualquier causa después de ajustar por las características del paciente. En los estudios de análisis de los CR de 4-7cm no se muestran las diferencias de SCE entre la nefrectomía parcial y la nefrectomía radical.
Adicionalmente, cuando la nefrectomía parcial laparoscópica se comparó con la nefrectomía radical laparoscópica en CR >4cm, no hubo diferencia en la supervivencia global (SG), la SCE y las tasas de supervivencia libre de recidiva (SLR). Además, análisis retrospectivos en pacientes de edad avanzada reportaron una SCE del 98% para la nefrectomía parcial vs. del 95% para la nefrectomía radical.
Otros estudios han comparado diversos aspectos de la calidad de vida y la seguridad de nefrectomía abierta parcial y radical abierta. Los resultados no mostraron diferencias en la duración de la estancia hospitalaria, las tasas de hemorragia y/o la transfusión sanguínea91,100.
Un estudio encontró que el tiempo operatorio promedio fue mayor para el grupo de NP abierta, pero otras investigaciones no encontraron tal diferencia. Tres estudios informaron consistentemente peor función renal después de la nefrectomía radical en comparación con NP93.
Una revisión de base de datos que compara NP con NR laparoscópica en los CR de 4-7cm encontró un incremento más bajo de los niveles de creatinina después de la NP101. Otro estudio que comparó la NR laparoscópica vs. NP laparoscópica encontró que la tasa de filtración glomerular (TFG) estimada disminuyó menos en el grupo de NP, mientras que el grupo de nefrectomía radical tenía una proporción significativamente mayor de pacientes con un aumento de 2 etapas en la ERC102.
Dos estudios informaron la calidad de vida después de la cirugía para el CR. Los pacientes que se sometieron a nefrectomía parcial reportaron mejores resultados en muchos aspectos de la calidad de vida103. Los que se sometieron a nefrectomía radical informaron un mayor grado de temor asociado a vivir con un solo riñón. Independientemente de la intervención, los pacientes con CCR <4cm y un riñón contralateral normal mostraron los puntajes más altos de calidad de vida después del tratamiento, tras comparar sus puntajes prediagnóstico. Los pacientes que tenían mayores tasas de complicaciones tenían puntuaciones de calidad de vida más bajos.
No hay estudios comparativos prospectivos que informen sobre los resultados oncológicos para terapias mínimamente invasivas en comparación con la nefrectomía radical. Un ensayo informó sobre la ablación por radiofrecuencia vs. nefrectomía radical o parcial para CR T1a, encontrando SCE del 100% para cada una de las 3 modalidades de tratamiento104.
De acuerdo a las características de los pacientes y del tumor, la evidencia actual sugiere resultados oncológicos satisfactorios para CR manejados con NP. La NP es tan buena como la nefrectomía radical abierta y debería ser la opción preferida cuando sea técnicamente posible.
Sin embargo, en algunos pacientes con CR localizado, la NP no es adecuada debido a:
- •
Tumor localmente avanzado.
- •
La resección parcial no es técnicamente viable porque el tumor se encuentra en una ubicación desfavorable.
- •
Deterioro importante de la salud general del paciente.
En estas situaciones, el tratamiento curativo sigue siendo la nefrectomía radical. La resección completa del tumor primario, por cirugía abierta o laparoscópica, ofrece una posibilidad razonable de curar la enfermedad.
SuprarrenalectomíaEstudios prospectivos compararon los resultados de la nefrectomía radical o parcial con o sin adrenalectomía ipsilateral. El análisis multivariado mostró que la ubicación del polo superior no era predictiva de compromiso suprarrenal, aunque el tamaño del tumoral sí lo fue. No hubo diferencias en la supervivencia global (SG) a los 5 o 10años, con o sin la adrenalectomía. La suprarrenalectomía se justificaba en criterios basados en hallazgos radiográficos o intraoperatorios. Solo 48 de 2.065 pacientes fueron sometidos a adrenalectomía ipsilateral concurrente, de los cuales 42 presentaban lesiones benignas105.
LinfadenectomíaEl papel de la linfadenectomía resulta controversial. La evaluación clínica de los ganglios linfáticos se basa en los hallazgos de la TC o RNM o en la evaluación intraoperatoria por palpación directa. Solo menos del 20% de ganglios clínicamente positivos se confirmaron metastásicos en el momento de la patología.
La RNM no permite la detección de pequeñas metástasis en ganglios de tamaño normal, y la linfadenectomía extendida sigue siendo la única modalidad para evaluar correctamente el compromiso nodal106,107.
En presencia de ganglios clínicamente positivos (cN+), la linfadenectomía parece estar siempre justificada. Sin embargo, la extensión de la misma sigue siendo un motivo de controversia. Series retrospectivas apoyan la hipótesis de que la linfadenectomía puede ser útil en pacientes de alto riesgo106 (tamaño tumoral mayor a 10cm, T3-T4, Fuhrman de alto grado y presencia de características sarcomatoides). Sin embargo, en el estudio aleatorizado EORTC solo el 4% de los pacientes tenían ganglios linfáticos positivos en la patología final, lo que sugiere que la linfadenectomía representa sobretratamiento en la mayoría de los casos106.
Estudios clínicos de más baja calidad sugieren que la linfadenectomía debería incluir los ganglios periféricos al hilio renal ipsilateral, la región interaortocava desde cercanías al diafragma hasta la iliaca común106-109.
EmbolizaciónLa práctica de una embolización tumoral antes de la nefrectomía carece de beneficios. En los pacientes que no son candidatos a la cirugía, o que presentan una enfermedad inoperable, la embolización puede controlar síntomas tales como hematuria macroscópica o dolor en el flanco. La embolización antes de la resección de metástasis óseas o vertebrales hipervasculares puede reducir la hemorragia intraoperatoria. En determinados pacientes con metástasis óseas o paravertebrales dolorosas la embolización contribuye a aliviar los síntomas110-114.
Técnicas quirúrgicas en nefrectomía radical y parcialTécnicas en nefrectomía radicalLos estudios muestran resultados oncológicos similares para la nefrectomía radical laparoscópica vs. técnica abierta. Sin embargo, se ha documentado disminución en la estancia hospitalaria y en los requerimientos analgésicos con técnica laparoscópica. No se ha encontrado diferencia en el número de complicaciones, pero el tiempo quirúrgico es significativamente menor en los pacientes manejados con nefrectomía radical abierta115-118.
En cuanto a los abordajes retroperitoneal o transperitoneal, los resultados oncológicos son similares y no se ha encontrado diferencia significativa cuando se evalúan índices de calidad de vida119.
La nefrectomía mano-asistida vs. nefrectomía radical laparoscópica convencional fueron comparadas en un estudio controlado aleatorizado y en revisiones de bases de datos, encontrando que la supervivencia global, cáncer-específica y la supervivencia libre de recurrencia son equivalentes a 5años entre las 2 técnicas. Sin embargo, el tiempo quirúrgico fue significativamente menor en los casos de cirugía mano-asistida y la estancia hospitalaria fue menor para los casos con técnica laparoscópica convencional119.
La nefrectomía radical laparoscópica asistida por robot vs. nefrectomía radical laparoscópica convencional fueron comparadas en una pequeña cohorte prospectiva. No se documentaron recurrencias locales, metástasis a distancia o en los puertos de abordaje; sin embargo, la muestra fue pequeña y el seguimiento menor a un año120.
Técnicas en nefrectomía parcial T4Estudios que comparan la nefrectomía parcial laparoscópica y la nefrectomía parcial abierta no encuentran diferencia en la supervivencia global y libre de progresión entre las 2 técnicas en centros con experiencia. No se ha encontrado diferencia significativa en términos de mortalidad postoperatoria o episodios de tromboembolismo pulmonar; sin embargo, el tiempo quirúrgico es significativamente más prolongado en el abordaje laparoscópico120-123.
Los tiempos de isquemia caliente son más cortos para la vía abierta, e incluso algunos estudios han demostrado una mayor disminución en la TFG en el grupo de nefrectomía parcial laparoscópica. Por otro lado, otros estudios comparativos no han identificado el abordaje quirúrgico como factor predictor independiente para el desarrollo de enfermedad renal crónica postoperatoria120-123.
Abordajes retroperitoneales o transperitoneales en nefrectomía parcial laparoscópica son equivalentes en resultados postoperatorios124.
En cuanto a nefrectomía parcial asistida por robot vs. nefrectomía parcial laparoscópica, ningún estudio las compara directamente los resultados oncológicos. Sin embargo, comparaciones prospectivas en tumores renales moderados a complejos muestran disminución significativa en las pérdidas sanguíneas y en el tiempo de isquemia en la nefrectomía parcial asistida por robot125-127.
Conclusiones T3La nefrectomía radical laparoscópica se acompaña de una menor morbilidad que la cirugía abierta.
Las tasas de control tumoral parecen equivalentes entre cirugía radical abierta o laparoscópica para tumores T1-T2a.
La nefrectomía parcial puede ser realizada abierta, laparoscópica pura o asistida por robot, teniendo en cuenta la experticia y la habilidad del cirujano (tabla 9).
Recomendaciones GR
| GR | NE | |
|---|---|---|
| La cirugía se recomienda para lograr curación en CR localizado | B | 1B |
| Se recomienda uso de cirugía conservadora en pacientes con tumores T1A | A | 1B |
| Debe preferirse cirugía conservadora sobre nefrectomía radical en pacientes con tumores T1B, siempre que sea técnicamente posible | B | 3 |
| Adrenalectomía ipsilateral: no se recomienda cuando no hay evidencia clínica de invasión de la glándula suprarrenal | B | 3 |
| Disección de los ganglios linfáticos: no se recomienda en tumor localizado sin evidencia clínica de invasión nodal | A | 1B |
| En los pacientes con ganglios linfáticos comprometidos clínicamente, la linfadenectomía puede ser realizada a propósito de estadificación o control local | C | 3 |
| Nefrectomía radical laparoscópica: se recomienda para pacientes con tumores T2 y masas renales no susceptibles de manejo con nefrectomía parcial | B | 3 |
| Nefrectomía radical laparoscópica: no debe realizarse en pacientes con tumores T1 en quienes se indica nefrectomía parcial | A | 1B |
Los pacientes ancianos y con comorbilidad importante con detección incidental de masas renales pequeñas tienen un riesgo relativo bajo de mortalidad específica por CR y una mortalidad significativa por otras causas. La vigilancia se define como la monitorización del tumor por imágenes abdominales seriadas (ecografía, TAC o RNM), reservando la intervención para los tumores que muestran progresión clínica durante el seguimiento128-130.
El crecimiento de los tumores renales es bajo, y en la mayoría de los casos la enfermedad metastásica se informó en un número limitado de pacientes (1-2%)131. En general, los resultados oncológicos a mediano y corto plazo indican que, en pacientes seleccionados por edad y/o comorbilidad avanzada, la vigilancia es una estrategia apropiada para el control inicial de masas renales pequeñas, seguida del tratamiento quirúrgico en los casos de progresión. Algunos estudios que evaluaron la calidad de vida encontraron que los dominios de depresión y ansiedad no se vieron afectados de forma negativa durante los periodos de vigilancia132-137.
Terapias ablativasEntre las alternativas propuestas al tratamiento quirúrgico del CR figuran técnicas percutáneas y mínimamente invasivas guiadas por imagen; por ejemplo, ablación por radiofrecuencia (ARF) percutánea, crioablación, ablación con microondas, ablación con láser y ablación con ultrasonidos centrados de alta intensidad (HIFU) (grado de comprobación científica: 2b).
Las posibles ventajas de estas y otras técnicas comprenden una menor morbilidad, el tratamiento ambulatorio y la capacidad de tratar a candidatos quirúrgicos de alto riesgo (grado de comprobación científica: 2b).
Ablación por radiofrecuencia y crioablaciónLa crioablación se puede realizar utilizando una vía percutánea o por vía laparoscópica, sin encontrar diferencia significativa en las tasas de complicaciones138. Otra comparación similar de la técnica no informó diferencias significativas en la supervivencia global, cáncer-específica y libre de recaída. Adicionalmente, los estudios han encontrado una diferencia no significativa en el cambio de la TFG estimada, con una disminución promedio de 3,7ml/min en 172 pacientes manejados por vía laparoscópica vs. 6,6ml/min en 123 pacientes manejados con abordaje percutáneo. El único hallazgo significativo fue un promedio más corto de duración de la estancia hospitalaria con la técnica percutánea (2,1días) frente a la técnica laparoscópica (3,5días) (p<0,01)138-140.
No hay estudios que comparen las estrategias de vigilancia con los procedimientos de ablación. Los datos sobre la crioablación laparoscópica versus nefrectomía parcial laparoscópica obtenidos a partir de una revisión de base de datos reportaron 3 muertes de 78 pacientes tratados, en comparación con ninguno de los pacientes tratados con NP laparoscópica. Otros estudios que comparan crioablación no informan acerca de la recurrencia con cada uno de los métodos terapéuticos, aunque el seguimiento es menor (12 meses). Cabe señalar que los estudios también incluyen tumores benignos, y los datos deben ser tratados con precaución.
En revisiones de bases de datos no se encontraron diferencias en los resultados perioperatorios, los tiempos de recuperación, las tasas de complicación postoperatoria o los niveles de creatinina sérica entre crioablación laparoscópica y la nefrectomía parcial laparoscópica. La pérdida de sangre fue menor y el tiempo quirúrgico fue más rápido en el grupo de crioablación. Comparaciones entre crioablación laparoscópica y NP abierta no informan recurrencias o metástasis locales en ninguno de los grupos. La duración de la estancia hospitalaria era más corta y la pérdida media de sangre fue significativamente menor en el grupo de crioablación laparoscópica, pero hubo diferencia en el número de pacientes que requieren transfusiones de sangre o en la duración de la cirugía. Sin embargo, estos estudios solo contaban con 20 pacientes en cada brazo, y el tiempo de seguimiento fue corto141,142.
Estudios que comparan la nefrectomía parcial laparoscópica (48 pacientes) con crioablación laparoscópica (30 pacientes) no encontraron diferencia en la supervivencia global, pero las diferencias significativas en la supervivencia cáncer-específica se observaron a los 3,5 y 7años. La supervivencia cáncer-específica fue del 100% en todo momento para el grupo de nefrectomía parcial laparoscópica, en comparación con el 93, el 88 y el 82% para el grupo de crioablación laparoscópica (p=0,027). Otros resultados oncológicos significativos a favor de la nefrectomía parcial laparoscópica incluido supervivencia libre de enfermedad, la recidiva local y metástasis143-145.
La ablación por radiofrecuencia se puede realizar por vía laparoscópica o por vía percutánea. Los estudios han comparado pacientes con tumores T1a con radiofrecuencia por vía laparoscópica o percutánea. Las complicaciones ocurrieron en hasta el 29% de los pacientes, pero eran en su mayoría de baja relevancia146-148. Las tasas de complicaciones fueron similares en los pacientes tratados por vía laparoscópica o percutánea. Un estudio con un número limitado de pacientes (n=47) encontró una mayor tasa de ablación incompleta en los pacientes tratados por vía percutánea. Sin embargo, no hubo diferencias en cuanto a la recurrencia o SCE.
La calidad de la evidencia con respecto a la radiofrecuencia para el tratamiento de CR localizado es baja. La mayoría de las publicaciones son estudios de cohorte retrospectivos con escaso número de pacientes y seguimiento limitado. Con un seguimiento medio de 6,3años, no hubo diferencia en la SG y la SCE.
Un equipo de Japón revisó de forma retrospectiva 105 pacientes tratados con radiofrecuencia percutánea (n=51) o nefrectomía radical (n=54). La media del tamaño del tumor eran 2,4cm en el grupo de radiofrecuencia y 2,8cm en el grupo de nefrectomía. La SCE fue del 100% en ambos grupos. Sin embargo, los pacientes tratados con cirugía eran más jóvenes (57,6 vs. 70años)149,150.
Un estudio monocéntrico de Francia comparó 34 pacientes manejados con radiofrecuencia y 16 manejados con NP abierta, encontrando una mayor tasa de complicaciones y transfusiones en el grupo de nefrectomía parcial, aunque los tumores eran mayores en los pacientes llevados a NP; las tasas de progresión fueron las mismas (0%) para ambos grupos149,150.
En los pacientes con tumores pequeños o comorbilidad importante que no son candidatos a la cirugía debe contemplarse la práctica de una técnica de ablación (por ejemplo, crioterapia o ablación por radiofrecuencia), y como norma ha de realizarse una biopsia previa al tratamiento. Otras técnicas percutáneas y mínimamente invasivas guiadas por imagen, como la ablación con microondas, la ablación con láser y la ablación con ultrasonidos centrados de alta intensidad, siguen siendo de carácter experimental.
Recomendaciones GR (tabla 10)Tratamiento adyuvanteLos indicios actuales de que la terapia antitumoral adyuvante podría mejorar la supervivencia libre de progresión en subgrupos seleccionados de pacientes sometidos a una nefrectomía por CRT3 han de confirmarse en relación con su repercusión en la supervivencia global (grado de comprobación científica: 1b). Algunos estudios en desarrollo en faseiii evalúan terapias adyuvantes con sunitinib, sorafenib, pazopanib, axitinib y everolimus, en espera de los resultados de estos estudios; hasta el momento no hay evidencia para el uso de terapia adyuvante con inhibidores de VEGF-R o mTOR151-154.
Recomendaciones GR
| GR | NE | |
|---|---|---|
| Debido a la baja calidad de datos disponibles no es posible realizar recomendaciones sobre ablación por radiofrecuencia y crioablación | C | 3 |
| En pacientes ancianos y/o con comorbilidad y masa renal pequeña y expectativa de vida limitada pueden ofrecerse la vigilancia activa, radiofrecuencia o crioablación | C | 3 |
Salvo en ensayos clínicos controlados, no hay indicaciones del tratamiento adyuvante después de la cirugía (grado de recomendación: A).
Tratamiento quirúrgico del carcinoma renal metastásico (nefrectomía por tumor)La nefrectomía por tumor solo es curativa cuando pueden extirparse todos los focos tu-morales durante la intervención. En la mayoría de los pacientes con enfermedad metastásica, la nefrectomía por tumor es paliativa y resultan necesarios otros tratamientos sistémicos. En un metaanálisis de 2 estudios aleatorizados, en los que se comparó la nefrectomía combinada con inmunoterapia con la inmunoterapia aislada, se constató una mayor supervivencia a largo plazo en los pacientes sometidos a una nefrectomía por tumor155. En la actualidad se encuentran pendientes los resultados de estudios aleatorizados faseiii que informen acerca de la nefrectomía citorreductora en combinación con terapia dirigida, como sunitinib y sorafenib, entre otros.
La nefrectomía en pacientes con metástasis está indicada en los que son adecuados para la cirugía y tienen un buen estado funcional.
ConclusionesLa nefrectomía por tumor en combinación con interferón-alfa (IFN-alfa) mejora la supervivencia de los pacientes con CR metastásico (CRm) y buen estado funcional (grado de comprobación científica: 1b).
La nefrectomía citorreductora con resección simultánea de metástasis únicas u oligometástasis podría mejorar la supervivencia y retrasar la terapia sistémica (tabla 11).
Tratamiento sistémico del carcinoma renal metastásicoQuimioterapiaDado que los CR se desarrollan a partir de los túbulos proximales, presentan grados elevados de expresión de la proteína de multirresistencia farmacológica, la glucoproteínaP, por lo que son resistentes a la mayoría de las quimioterapias156.
ConclusiónLa quimioterapia en monoterapia no se considera eficaz en los pacientes con CRm.
InmunoterapiaInterferón alfa en monoterapia y combinado con bevacizumabEl IFN-alfa deparó una tasa de respuesta del 6-15%, junto con una disminución del 25% del riesgo de progresión tumoral y un efecto beneficioso modesto sobre la supervivencia de 3-5meses en comparación con un equivalente de placebo16,157. Sin embargo, otros estudios, que incluyen pacientes con enfermedad de riesgo intermedio, no confirmaron estos resultados158.
El efecto positivo del IFN-alfa es especialmente importante en los pacientes con CRm con una histología de células claras, con criterios de riesgo favorable de Motzer y exclusivamente con metástasis pulmonares157 (tabla 12).
Criterios del MSKCC (Motzer) para predecir la supervivencia de los pacientes con CR avanzado16
| Factores de riesgo | Punto de corte utilizado |
|---|---|
| Estado funcional de Karnofsky | < 8 |
| Tiempo entre el diagnóstico y el tratamiento con IFN-alfa | < 12 |
| Hemoglobina | < límite inferior del intervalo de referencia del laboratorio |
| Lactato deshidrogenasa | > 1,5 veces el límite superior del intervalo del laboratorio |
| Calcemia corregida | > 10,0 mg/dl (2,4 mmol/l) |
En un estudio aleatorizado prospectivo, el IFN-alfa fue equivalente en cuanto a eficacia a la combinación de IFN-alfa +IL2 +5FU159. La eficacia moderada de la inmunoterapia fue confirmada en un metaanálisis de Cochrane que incluye 42 estudios160.
Una combinación de bevacizumab +IFN-alfa ha deparado recientemente mayores tasas de respuesta y supervivencia sin progresión en el tratamiento de primera línea en comparación con la monoterapia con IFN-alfa161. Todos los estudios aleatorizados recientes en que se han comparado medicamentos antiangiógenos en un contexto de primera línea con la monoterapia con IFN-alfa han demostrado la superioridad de sunitinib, bevacizumab +IFN-alfa o temsirolimus161-164.
La monoterapia con IFN-alfa ya no se recomien-da como tratamiento de primera línea del CR (grado de comprobacióncientífica: 1b).
Interleucina-2La interleucina-2 (IL-2) se ha utilizado para tratar el CRm desde 1985, con tasas de respuesta variables, entre el 7 y el 27%. El régimen óptimo de IL-2 no está claro, pero se han logrado respuestas completas a largo plazo (>10años) con bolos de IL-2 en dosis altas. La toxicidad de IL-2 es mucho mayor que la del IFN-alfa.
Tan solo el CR de células claras responde a la inmunoterapia. El uso de IL-2 no se ha validado en estudios aleatorizados y controlados en comparación con el mejor tratamiento sintomático165-167.
ConclusionesEl IFN-alfa como monoterapia es inferior a terapias dirigidas en CRm.
La IL-2 como monoterapia podría tener utilidad en pacientes seleccionados (buen estado general, tipo células claras, solo con metástasis pulmonares).
La combinación de bevacizumab e IFN-alfa es más efectiva que IFN-alfa en monoterapia en tumores de riesgo bajo e intermedio sin tratamientos previos.
Medicamentos inhibidores de la angiogénesisLos avances recientes en la biología molecular han conducido al desarrollo de varios medicamentos novedosos para el tratamiento del CRm.
En el CR de células claras esporádico, la acumulación de factor inducido por la hipoxia (FIH) debida a una inactivación del gen VHL (von Hippel Landau) provoca una hiperexpresión de VEGF y factor de crecimiento derivado de las plaquetas (PDGF) que estimulan la neoangiogénesis. Este proceso contribuye considerablemente al desarrollo y a la progresión del CR168-170. En la actualidad, varios medicamentos dirigidos han sido aprobados en Estados Unidos y en Europa para el tratamiento del CRm:
- •
Sorafenib (Nexavar®).
- •
Sunitinib (Sutent®).
- •
Bevacizumab (Avastin®) en combinación con IFN-alfa.
- •
Pazopanib (Votrient®).
- •
Temsirolimus (Torisel®).
- •
Everolimus (Afinitor®).
- •
Axitinib (Inlyta®).
En los estudios faseiii que incluyen los agentes aprobados, los pacientes fueron estratificados de acuerdo al modelo MSKCC (Criterios de Motzer). Dado que los criterios de Motzer se desarrollaron durante la era de las citoquinas, un consorcio de base de datos internacional ha establecido y validado un modelo de riesgo que puede llevar a un pronóstico más preciso para los pacientes tratados en la era de la terapia dirigida. Este modelo es conocido como el modelo Database Consortium Model (DCM), e incluye neutrofilia y trombocitosis a la lista de factores de riesgo MSKCC, mientras que LDH ha sido eliminado como factor pronóstico171.
El DCM ha sido validado y comparado con los modelos de riesgo de la Cleveland Clinic Foundation (CCF), el modelo francés, y el modelo International Kidney Cancer Working Group (IKCWG), mostrando un nivel de concordancia óptimo que no difiere de los otros modelos y permite predecir el pronóstico basado en factores clínicos172,173.
Inhibidores de tirosina cinasaSorafenibSorafenib es un inhibidor de varias cinasas por vía oral con actividad frente a Raf 1 serina/treonina cinasa, B-Raf, receptor tipo2 del factor de crecimiento del endotelio vascular (VEGFR-2), receptor del factor de crecimiento derivado de las plaquetas (PDGFR), tirosina cinasa afín a FMS3 (FLT-3) y c-KIT.
En un ensayo en faseiii se comparó sorafenib con placebo después del fracaso de una inmunoterapia sistémica previa o en pacientes que no eran aptos para recibir inmunoterapia. En dicho ensayo se comunicó una mejora de la supervivencia sin progresión de 3meses a favor de sorafenib174. La media de supervivencia libre de progresión fue de 5,5meses en el grupo de sorafenib y de 2,8meses en el grupo placebo (HR: 0,44; IC95%: 0,35-0,55; p<0,01)175.
SunitinibSunitinib es un inhibidor de la oxindol tirosina cinasa (TC). Inhibe selectivamente PDGFR, VEGFR, c-KIT y FLT-3 y tiene actividad antineoplásica y antiangiogénica. En ensayos en faseii con sunitinib en monoterapia de segunda línea en pacientes con CRm se constató una respuesta parcial en el 34-40% de ellos y una enfermedad estable >3meses en el 27-29%176.
En un ensayo en faseiii reciente de tratamiento en monoterapia de primera línea en el que se comparó sunitinib con IFN-alfa, sunitinib logró una mayor supervivencia sin progresión que el IFN-alfa (11 frente a 5meses, p<0,000001). Los resultados indicaron que la monoterapia con IFN-alfa fue inferior a sunitinib en los pacientes de riesgo bajo e intermedio con CRm. La supervivencia global fue de 26,4 y 21,8meses en los grupos de sunitinib e IFN-alfa, respectivamente (p=0,05). En los pacientes que pasaron de IFN-alfa a sunitinib (n=25) la mediana de la supervivencia fue de 26,4 en comparación con 20,0 meses con sunitinib e IFN-alfa, respectivamente (p=0,03). En los pacientes que no recibieron tratamiento después del estudio, la mediana de la supervivencia global fue de 28,1meses en el grupo de sunitinib en comparación con 14,1meses en el de IFN-alfa (p=0,003)177.
PazopanibPazopanib es un inhibidor de la angiogénesis por vía oral dirigido contra VEGFR, PDGFR y c-KIT.
En un ensayo aleatorizado prospectivo de pazopanib comparado con placebo en pacientes con CRm no tratados previamente y pacientes tratados con citocinas se constató una mejora significativa de la supervivencia sin progresión y la respuesta del tumor (9,2 frente a 4,2 meses)178.
Estudios aleatorizados faseiii de no inferioridad compararon pazopanib con sunitinib (COMPARZ), indicando que pazopanib es otra opción de primera línea. Demostró que pazopanib no se asocia con una peor supervivencia global o libre de progresión al compararse con sunitinib. Los 2 medicamentos tienen perfil de toxicidad diferente; sin embargo, índices de calidad de vida tienen mejores resultados con pazopanib179.
AxitinibEs un inhibidor oral selectivo de segunda generación de VEGFR-1, -2, de vida media corta.
Axitinib se evaluó por primera vez como un tratamiento de segunda línea. En el ensayo aleatorizado de faseiii de axitinib vs. sorafenib (AXIS) en pacientes con tratamiento de citoquinas o terapias dirigidas previas fallidas muestra una mejora del 40% en la mediana de la supervivencia libre de progresión de 5meses a 7meses en los pacientes asignados al azar para recibir axitinib180.
Sorafenib fue elegido como parámetro de comparación porque en el momento del ensayo no se contaba con un estándar de tratamiento de segunda línea tras el fracaso de un VEGF. Con 723 pacientes, la mediana de la supervivencia libre de progresión fue de 6,7meses para los pacientes en el grupo de axitinib vs. 4,7meses para aquellos en el grupo de sorafenib (HR: 0,67; IC95%: 0,54-0,81).
En el ensayo AXIS, axitinib mostró toxicidad con diarrea en el 11%, hipertensión arterial en el 16% y fatiga en el 11%. Las náuseas se registraron en el 32%, los vómitos en el 24% y la astenia en el 21%. El análisis final de OS no mostró diferencias significativas entre axitinib y sorafenib en el tratamiento de segunda línea181,182.
Axitinib se ha investigado en 2 estudios de primera línea publicados. La primera fue una-faseii de un estudio doble ciego aleatorizado y controlado que investigó la eficacia y la seguridad de axitinib en pacientes no tratados previamente. La mediana de la supervivencia libre de progresión en los subgrupos de pacientes era de 14,5meses en el grupo de axitinib (IC95%: 9,2-24,5) y 15,7meses (IC95%: 8,3-19,4) en el grupo de titulación placebo, y 16,6 meses (IC95%: 11,2-22,5) en los no aleatorizados. Esto apoya la hipótesis de que el aumento de la dosis se asocia con una mayor tasa de respuesta183.
Anticuerpos monoclonalesBevacizumab en monoterapia y bevacizumab +interferón-alfaBevacizumab es un anticuerpo monoclonal humanizado que se une a isoformas del VEGF-A. Bevacizumab, 10mg/kg cada 2semanas, en pacientes resistentes a la inmunoterapia aumentó la respuesta global (10%) y la supervivencia sin progresión en comparación con placebo. En un reciente ensayo en faseiii doble ciego (n=649) en el CRm se comparó bevacizumab +IFN-alfa con la monoterapia con IFN-alfa. La mediana de la respuesta global fue del 31% en el grupo de bevacizumab +IFN-alfa y del 13% en el tratado exclusivamente con IFN-alfa (p<0,0001). La mediana de la supervivencia sin progresión aumentó significativamente de 5,4meses con IFN-alfa a 10,2meses con bevacizumab +IFN-alfa (p<0,0001), pero solo en los pacientes de riesgo bajo e intermedio.
No se observó ningún efecto beneficioso en los pacientes de alto riesgo184.
Inhibidores de mTOR (objetivo de la rapamicina en mamíferos)TemsirolimusTemsirolimus es un inhibidor específico de mTOR (objetivo de la rapamicina en mamíferos). Se aleatorizó a pacientes con CRm de alto riesgo a recibir tratamiento de primera línea con temsirolimus o IFN-alfa en monoterapia o en combinación. En el grupo de temsirolimus, la supervivencia global fue de 10,9meses, frente a 7,3meses en el de IFN-alfa (p<0,0069). Sin embargo, la supervivencia global en el grupo de temsirolimus +IFN-alfa no mejoró significativamente185.
EverolimusEverolimus es un inhibidor de mTOR por vía oral. En un estudio en faseiii reciente se comparó everolimus más el mejor tratamiento sintomático (MTS) con placebo más el MTS en pacientes en que había fracasado un tratamiento previo con anti-VEGF-R. La mediana de la supervivencia sin progresión fue de 4meses con everolimus y de 1,9meses con placebo (p<0,001).
En el estudio RECORD-1, 124 pacientes recibieron sunitinib como único tratamiento previo, con una supervivencia libre de progresión de 4 meses (IC95%: 3,7-5,5meses). Este estudio incluye, además, pacientes con falla terapéutica a multiples líneas de terapia dirigida, soportando su uso como tercera o cuarta línea186.
Estrategias terapéuticas y recomendaciones (terapia secuencial)Para pacientes con CRm tipo células claras que no han recibido tratamiento, sunitinib y bevacizumab más IFN-alfa son opciones de tratamiento de primera línea cuando existe riesgo bajo o intermedio. El estudio COMPARZ demostró que pazopanib y sunitinib tienen una eficacia similar con diferentes perfiles de toxicidad; por lo tanto, pazopanib se considera otra opción de primera línea para este tipo de pacientes.
Axitinib y tivozanib no están aprobados para el tratamiento del CRm sin tratamiento previo.
Después de la progresión con terapia anti-VEGF de primera línea, el estudio RECORD-1 estableció sunitinib seguido de everolimus secuencial como una de las opciones de tratamiento para los pacientes con CRm. El estudio AXIS es el único ensayo aleatorizado faseiii que compara inhibidores de TC, tras el fracaso de una TC anterior. La comparación de los datos de los estudios RECORD-1 y AXIS no se recomienda debido a diferencias en las poblaciones de los pacientes.
Hasta el momento no se pueden hacer recomendaciones claras sobre la mejor secuencia en terapia dirigida, más allá de la recomendación de que la terapia VEGF dirigida debe ser utilizada en pacientes de riesgo bajo o intermedio.
En cuanto a la terapia ideal posterior a progresión después del uso de inhibidores de la MTOR, los datos son limitados, y según la opinión de expertos debería realizarse un cambio a terapia anti-VEGF. Sunitinib en este escenario parece tener utilidad y, por lo tanto, es una opción atractiva para el tratamiento.
En pacientes con progresión después del tratamiento con citoquinas, sorafenib, axitinib o pazopanib logran una mediana de supervivencia libre de progresión de 5,5, 12,1 y 7,4meses, respectivamente.
En cuanto a la combinación de agentes dirigidos, actualmente no hay combinaciones que puedan recomendarse, debido a que estudios faseii y faseiii demuestran un aumento en la toxicidad y ningún beneficio en términos de supervivencia global y libre de progresión (tabla 13).
Recomendaciones
| GR | NE | |
|---|---|---|
| En pacientes con CR metastásico, la quimioterapia como monoterapia no se considera efectiva | B | 1B |
| Monoterapia con IFN-alfa o IL-2: no debe recomendarse de forma rutinaria como primera línea en el tratamiento del CR metastásico | A | 1B |
| Terapia sistémica para CRm: debe estar basada en agentes dirigidos | A | 1B |
| Sunitinib y pazopanib: se recomiendan como primera línea de tratamiento para CRm | A | 1B |
| Bevacizumab más IFN-alfa: se recomiendan como primera línea de tratamiento para CRm en riesgo intermedio y favorable | A | 1B |
| Temsirolimus: se recomienda como primera línea de tratamiento en pacientes de alto riesgo | A | 1B |
| Axitinib: se recomienda como segunda línea de tratamiento en CRm | A | 1B |
| Everolimus: se recomienda para CR que fallaron al tratamiento con VEGF | A | 1B |
| Pazopanib y sorafenib son alternativas al axitinib y se recomiendan como segunda línea de tratamiento luego de falla a tratamiento con citoquinas | B | 3 |
| Terapia secuencial con agentes dirigidos se recomienda | A | 1B |
La vigilancia después del tratamiento de un CR permite al urólogo controlar e identificar:
- •
Complicaciones postoperatorias.
- •
Función renal.
- •
Recidiva local tras la nefrectomía parcial o el tratamiento de ablación.
- •
Recidiva en el riñón contralateral.
- •
Aparición de metástasis.
El método y el momento de realización de las exploraciones se han abordado en numerosas publicaciones. No existe consenso sobre la vigilancia después del tratamiento del CR y, de hecho, no hay pruebas de que un diagnóstico precoz de la recidiva frente a otro más tardío mejore la supervivencia. Sin embargo, el seguimiento es importante para aumentar los conocimientos sobre el CR y debe realizarlo el urólogo, quien debe registrar el tiempo transcurrido hasta la recidiva o la aparición de metástasis.
Las complicaciones postoperatorias y la función renal se evalúan fácilmente mediante la anamnesis, la exploración física y la medición de la creatinina sérica y la FG. El control a largo plazo repetido de la FG está indicado cuando hay insuficiencia renal antes de la cirugía o un deterioro postoperatorio.
La función renal y la supervivencia sin cáncer se pueden optimizar practicando una nefrectomía parcial, siempre que sea posible, en caso de tumores T1 y T2187 (grado de comprobación científica: 3). La recidiva en el lecho tumoral es rara (2,9%), pero su diagnóstico precoz resulta útil porque el tratamiento más eficaz es la cirugía citorreductora. La recidiva en el riñón contralateral también es poco frecuente (1,2%) y se relaciona con bordes positivos, multifocalidad y grado (grado de comprobación científica: 3)188.
El motivo de la vigilancia es identificar precozmente las recidivas locales o metástasis. Esto es especialmente importante con los tratamientos de ablación, como la crioterapia y la ablación por radiofrecuencia.
La vigilancia radiológica intensiva no resulta necesaria en todos los pacientes. Por ejemplo, la evolución tras la cirugía de tumores de bajo grado T1a casi siempre es excelente. Por tanto, resulta razonable estratificar el seguimiento, teniendo en cuenta el riesgo de aparición de recidivas o metástasis.
Aunque no existen datos aleatorizados, se han realizado estudios extensos en los que se han evaluado factores pronósticos con un seguimiento prolongado de los que es posible extraer ciertas conclusiones (grado de comprobación científica: 4)189-191.
- •
La sensibilidad de la radiografía de tórax para detección de metástasis pequeñas es baja, y la ecografía tiene limitaciones. La vigilancia no debe estar basada en esta modalidad de imágenes. En pacientes con tumores de bajo riesgo, los intervalos de vigilancia pueden ser adaptados de acuerdo al beneficio y las dosis de radiación; la RNM puede ser utilizada para disminuir las dosis de radiación.
- •
Cuando el riesgo de recidiva es intermedio o alto, un TC de tórax y abdomen es la prueba de elección, aunque ha de tenerse en cuenta la morbilidad importante de la dosis de radiación con las TAC repetidas.
- •
La vigilancia debe incluir evaluación clínica de la función renal y factores de riesgo cardiovascular.
- •
PET y PET-TC no son el patrón de oro en la vigilancia del CR, dado que cuentan con baja sensibilidad y especificidad.
Existe cierta polémica acerca de la duración óptima del seguimiento. Algunos autores sostienen que el seguimiento mediante pruebas de imagen no es rentable después de 5años; sin embargo, las metástasis tardías tienen más probabilidades de ser aisladas y justifican un tratamiento más intensivo con intención curativa.
Además, los pacientes con tumores que aparecen en el riñón contralateral pueden ser tratados mediante nefrectomía parcial si se detectan cuando son pequeños. Además, en caso de tumores <4cm no hay diferencias entre la nefrectomía parcial o radical en la recidiva durante el seguimiento (grado de comprobación científica: 3)192.
Es necesario un algoritmo de vigilancia para controlar a los pacientes después del tratamiento del CR, en el que no solo se tenga en cuenta el perfil de riesgo del paciente, sino también la eficacia del tratamiento administrado. Diferentes autores han diseñado sistemas de puntuación y nomogramas para cuantificar la probabilidad del desarrollo de recurrencias tumorales, metástasis y muerte; sin embargo, muchos de ellos no incluyen terapias ablativas (tabla 14).
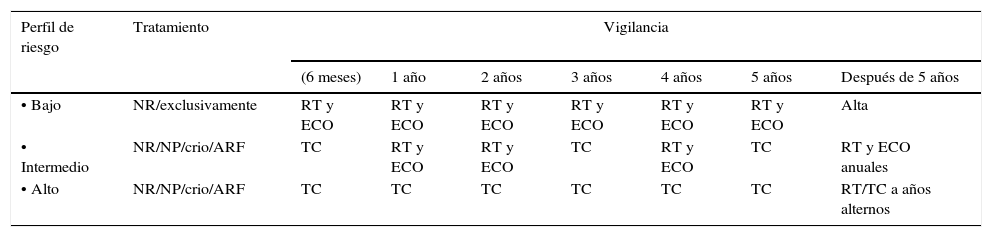
Algoritmo propuesto de vigilancia tras el tratamiento del CR de acuerdo con el perfil de riesgo del paciente y la eficacia del tratamiento
| Perfil de riesgo | Tratamiento | Vigilancia | ||||||
|---|---|---|---|---|---|---|---|---|
| (6 meses) | 1 año | 2 años | 3 años | 4 años | 5 años | Después de 5 años | ||
| • Bajo | NR/exclusivamente | RT y ECO | RT y ECO | RT y ECO | RT y ECO | RT y ECO | RT y ECO | Alta |
| • Intermedio | NR/NP/crio/ARF | TC | RT y ECO | RT y ECO | TC | RT y ECO | TC | RT y ECO anuales |
| • Alto | NR/NP/crio/ARF | TC | TC | TC | TC | TC | TC | RT/TC a años alternos |
La vigilancia después del tratamiento del CR ha de basarse en los factores de riesgo del paciente y el tipo de tratamiento administrado. El objetivo de la vigilancia es detectar recidivas locales o metástasis mientras el paciente sigue siendo curable desde el punto de vista quirúrgico (tabla 15).
Recomendaciones
| GR | NE | |
|---|---|---|
| El seguimiento posterior al tratamiento debe basarse en los factores de riesgo de cada paciente y en el tipo de tratamiento realizado | C | 4 |
| Para enfermedad de bajo riesgo, TAC/RNM no deben usarse frecuentemente | C | 4 |
| Para en enfermedad de riesgo intermedio, TAC/RNM deben realizarse con intervalos regulares de acuerdo a los nomogramas de riesgo | C | 4 |
| En pacientes de alto riesgo, el seguimiento incluye de forma rutinaria TAC/RNM | C | 4 |
| Debido al riesgo de recurrencia intrarrenal en tumores >7cm tratados con NP o en caso de margen positivo, la vigilancia debe incrementarse en estos pacientes | C | 4 |
Adaptación de las guías de manejo en carcinoma de células renales, European Association of Urology, 2014.