Objetivo. Aumento biológico y estabilización de defectos óseos masivos con aloinjertos estructurales de mitades de fémur procedentes de donante.
Indicaciones. Defectos óseos masivos con aflojamiento de vástago endoprotésico de cadera aséptico, fractura femoral periprotésica o pseudoartrosis; en caso necesario, también ante una situación de infección curada.
Contraindicaciones. Infección local o sistémica.
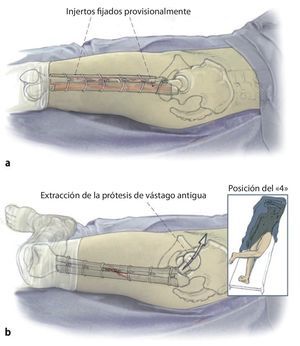
Técnica quirúrgica. Los dos aloinjertos estructurales preparados se fijan provisionalmente en la zona epiperiostal anterolateral y anteromedial del fémur mediante cerclajes de alambre teniendo cuidado de no lesionar la línea áspera vascularizada. Con el fémur así estabilizado se puede colocar la pierna en posición de «4» para poder preparar el espacio medular para la cirugía endoprotésica de revisión. Para finalizar, se insiere la prótesis de revisión no cementada apretando gradualmente los cerclajes. Con esta técnica del «cracking» se estabiliza el vástago endoprotésico y los injertos tienen una función de reposición, de aumento y de soporte.
Tratamiento postoperatorio. Carga parcial, a ser posible durante doce semanas postoperatorias. Durante el intraoperatorio y al cabo de diez días, así como a las seis y doce semanas postoperatorias, toma de radiografías en dos planos; después, cada uno-dos años.
Resultados. En cuatro estudios diferentes se estabilizaron un total de 123 pacientes desde diciembre de 1991 hasta junio de 2011 por defectos óseos femorales periprotésicos extensos y/o fractura periprotésica, refractura o pseudoartrosis mediante injertos estructurales. En un periodo de seguimiento medio de 3,8 años (intervalo: 0,3-11 años) se registró una puntuación de 80,8 puntos (intervalo: 44-100) en la escala de cadera de Harris, una refractura, 103 casos con vástago endoprotésico estable, 20 casos con vástago fibroso estable, 9 casos de mínima reabsorción del injerto y 122 integraciones radiológicas del aloinjerto estructural según la clasificación de Emerson et al. (Clin Orthop Relat Res. 1992;285:35-44).
Redacción
D.C. Wirtz, Bonn
Ilustraciones
R. Himmelhan, Heidelberg
Introducción
Los defectos extensos de la metáfisis del fémur suponen un desafío especial para el cirujano ortopédico. La clasificación de los defectos óseos en la zona proximal del fémur según Paprosky ha dado buenos resultados para la planificación de este tipo de cirugía de revisión. Paprosky diferencia los defectos metafisarios de la siguiente manera20:
— Tipo I: metáfisis y diáfisis intactas, con escasa pérdida de sustancia del calcar.
— Tipo II: metáfisis no intacta con grandes pérdidas de sustancia en la zona anterior y posterior y diáfisis intacta.
— Tipo IIIa: mínimo 4 cm de diáfisis intacta hacia distal.
— Tipo IIIb: menos de 4 cm de diáfisis intacta hacia distal.
— Tipo IV: metáfisis y diáfisis femoral completa muy ensanchadas, vástago extralargo.
La clasificación de Paprosky apunta en primer lugar a la posibilidad de un anclaje distal del vástago de revisión en la diáfisis. De la planificación de la cirugía de revisión con presencia de defecto óseo metafisario extenso resulta la siguiente lista de chequeo:
— Una radiografía ambigua puede sugerir una falsa posibilidad de anclaje endoprotésico diafisario distal seguro.
— El enclavamiento de un vástago de revisión con tornillos en la zona distal puede resultar técnicamente imposible por la baja calidad del hueso cortical diafisario.
— El trocánter mayor con los músculos glúteos mínimos, importantes por su función, puede sufrir dehiscencia a lo largo de un tramo largo debido a las osteólisis típicas en la unión del tubérculo innominado con la diáfisis después de la implantación de la prótesis de revisión, por lo que la integración ya no es posible.
— Ante la presencia de fracturas periprotésicas y pseudoartrosis adicionales, sobre todo tras un tratamiento fallido de fracturas periprotésicas, existe un riesgo muy alto de inestabilidad persistente por falta de sustancia ósea.
— Si la prótesis de rodilla es con vástago, existe un mayor riesgo de fractura en la zona femoral interprotésica, a menudo con compromiso óseo.
— Especialmente en las intervenciones con pacientes jóvenes el objetivo ha de ser conseguir el aumento del alojamiento de anclaje óseo con el fin de evitar un posible fracaso de la prótesis en el futuro.
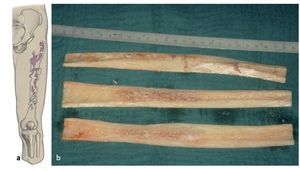
Los autores del presente trabajo utilizan desde hace más de veinte años aloinjertos estructurales corticales en las revisiones endoprotésicas de cadera con defectos metafisarios extensos. Estas mitades corticales en forma de láminas de fémur de donante humano se utilizan como aumento y soporte en las cirugías de revisión.
Principio y objetivo de la intervención
El defecto óseo en el fémur se estabiliza durante la cirugía de revisión mediante grandes mitades corticales estructurales de fémur y el alojamiento óseo se aumenta a medio y largo plazo. Los injertos se transforman en función de los estadios histológicos y radiológicos según Emerson et al.11 en huesos trabeculares vascularizados orientados en función de la transmisión de fuerzas.
Ventajas
— Reconstrucción biológica duradera con mejora de la situación ósea en el caso de un nuevo aflojamiento endoprotésico, transformación del injerto en hueso vascularizado probado histológica y radiológicamente con remodelación trabecular.
— Función de soporte para la fijación del vástago endoprotésico.
— Se evitan los inconvenientes de un recambio de fémur proximal o total.
— Procedimiento estándar con alto grado de repetitividad.
— Posibilidad de preservación de los músculos glúteos mínimos con su inserción y, por lo tanto, mejora funcional.
— Tasas de complicación reducidas.
— Mejores resultados a medio y a largo plazo.
— La intervención es especialmente adecuada para pacientes con requerimientos todavía más altos.
Desventajas
— Se requiere que el cirujano posea una experiencia quirúrgica amplia y regular en este tipo de intervenciones.
— Es necesario tener a disposición un banco de tejido óseo en caso de una cirugía no programada (es posible almacenar el injerto en un contenedor con hielo seco sin banco de tejido óseo durante 24 h).
— A pesar de la complejidad técnica, la tasa de éxito y la importancia económica de este tipo de cirugía, la clasificación de los GRDs (Grupos Relacionados por el Diagnóstico) es todavía bastante baja
— Duración de la intervención algo prolongada, con el consiguiente aumento del riesgo de infección teórico (no demostrado en la práctica).
Indicaciones
— Aflojamiento del vástago endoprotésico de la cadera con defecto óseo del tipo IIIa, IIIb o IV según Paprosky.
— Fractura periprotésica o pseudoartrosis con defecto óseo considerable incluso ante alojamiento fijo del vástago endoprotésico de la cadera.
— Fracturas interprotésicas en prótesis de cadera y de rodilla (sobre todo en pacientes relativamente jóvenes).
Como procedimiento alternativo al tratamiento de reconstrucción ósea que presentamos en este trabajo, se pueden nombrar únicamente las endoprótesis de recambio femoral proximal o total de la cirugía tumoral. Las ventajas del procedimiento con injertos estructurales que presentamos son:
— Mejores resultados a medio y largo plazo.
— Mejores posibilidades de retirada por el procedimiento de reconstrucción ósea y consiguientemente el «upgrading» en la clasificación de Paprosky y una mejor situación de partida en una nueva cirugía de revisión eventualmente necesaria.
Contraindicaciones
— Infecciones no curadas.
— Incompatibilidad Rh entre donante y receptor en edad fecunda.
— En pacientes de edad más avanzada con diagnósticos secundarios relevantes se debería realizar una estimación del riesgo-beneficio.
Información para el paciente
— Complicaciones generales de las cirugías endoprotésicas de revisión.
— Complicaciones especiales:
¿ Edema del muslo
¿ Hemorragia postoperatoria de vasos perforantes
¿ Limitación de la movilidad de la rodilla por presencia de adherencias en el cuádriceps
¿ Fractura del injerto y/o del fémur
¿ Aflojamiento de la osteosíntesis con injerto estructural, ruptura del material de osteosíntesis
¿ Reabsorción del injerto
Preparación de la intervención
— Radiografías: radiografía general de la cadera en profundidad, radiografía en proyección de Lauenstein con vástago largo, muslo con rodilla en dos planos.
— Planificación preoperatoria con el programa de planificación correspondiente en la radiografía.
— Selección de tamaños preoperatoria del hueso donante en base a las radiografías del injerto.
— Descartar una infección mediante exploración clínica y de laboratorio, así como mediante artroscopia de la articulación de la cadera con exploración microbiológica e histológica.
— Posibilidad de autodonación de sangre, dispositivo Cell-Saver intraoperatorio de rutina.
Instrumental
— Instrumental estándar para cirugías de revisión de cadera con implantes.
— Sierra oscilante.
— Fresa de altas revoluciones (por ejemplo, Hilan, Midas Rex).
— Alambre para cerclaje de 2,0.
— Bandeja de tornillos para fragmentos grandes.
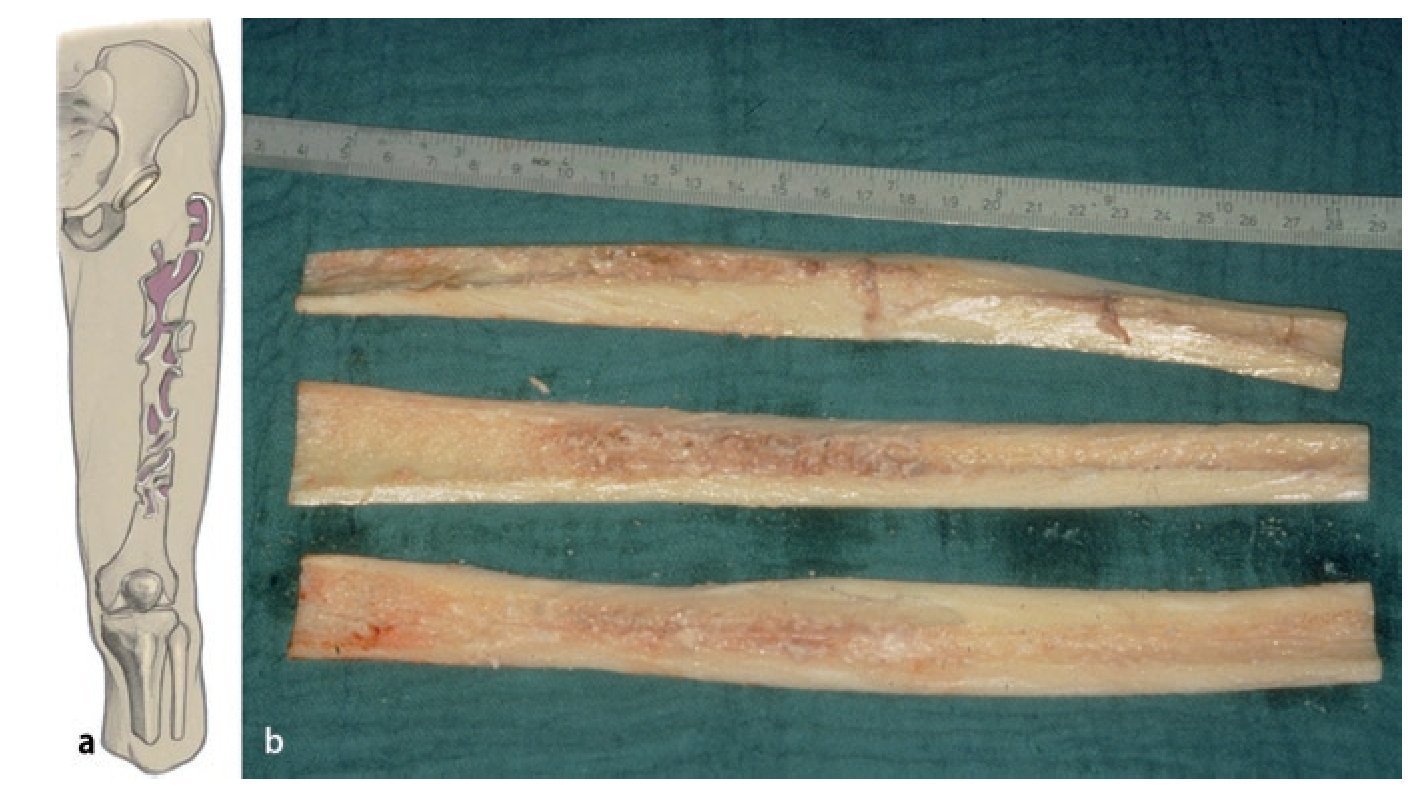
— Aloinjerto ipsilateral recién congelado (fémur distal o proximal diafisario-metafisario completo) según las directrices actuales para la gestión de un banco de tejido óseo10.
— Mesa de trabajo para la preparación del aloinjerto.
Anestesia y posición del paciente
— Anestesia bajo intubación.
— Paciente en posición de decúbito supino o lateral, mesa quirúrgica estándar con fluoroscopia.
Técnicas quirúrgicas
(Figs. 1-8)
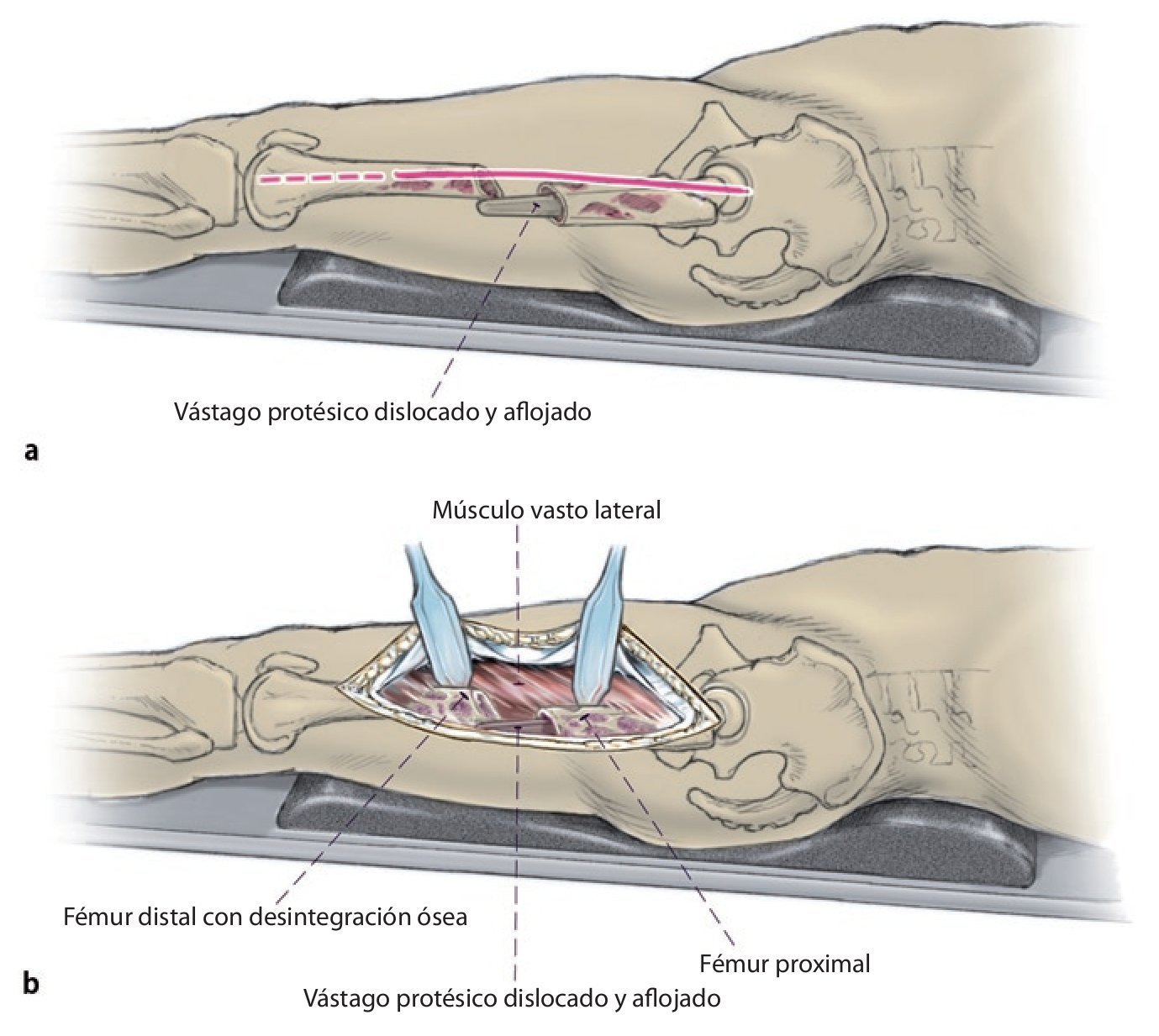
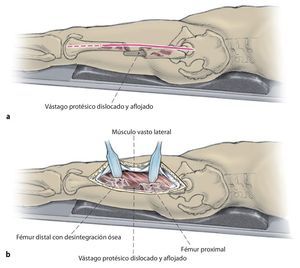
Fig. 1 Prolongación del abordaje anterolateral o inferior en la zona lateral del fémur hacia distal. Despegamiento en forma de L del músculo vasto lateral en el septo intermuscular y proximal junto al tubérculo innominado para la exposición del fémur teniendo especial cuidado de proteger el periostio, extracción del vástago endoprotésico; en caso necesario, extracción del cemento por la diáfisis defectuosa/fracturada del fémur.
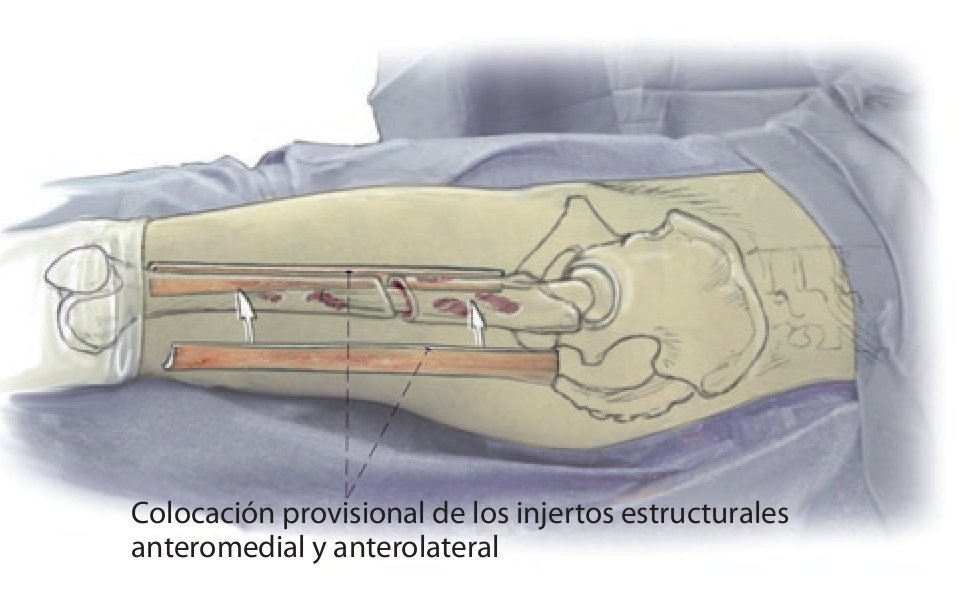
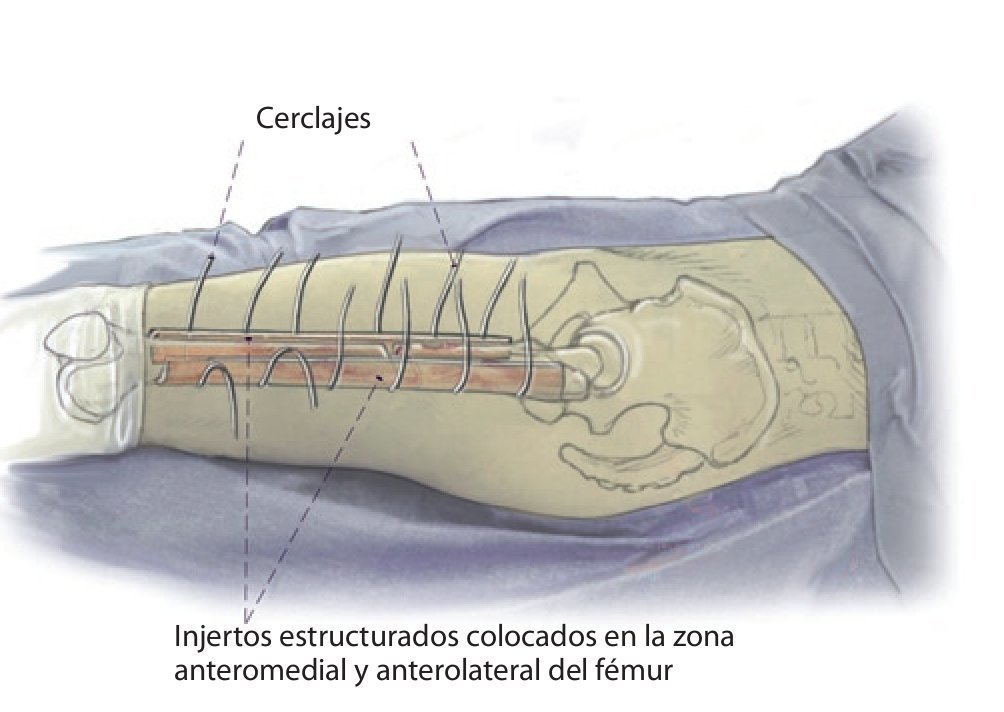
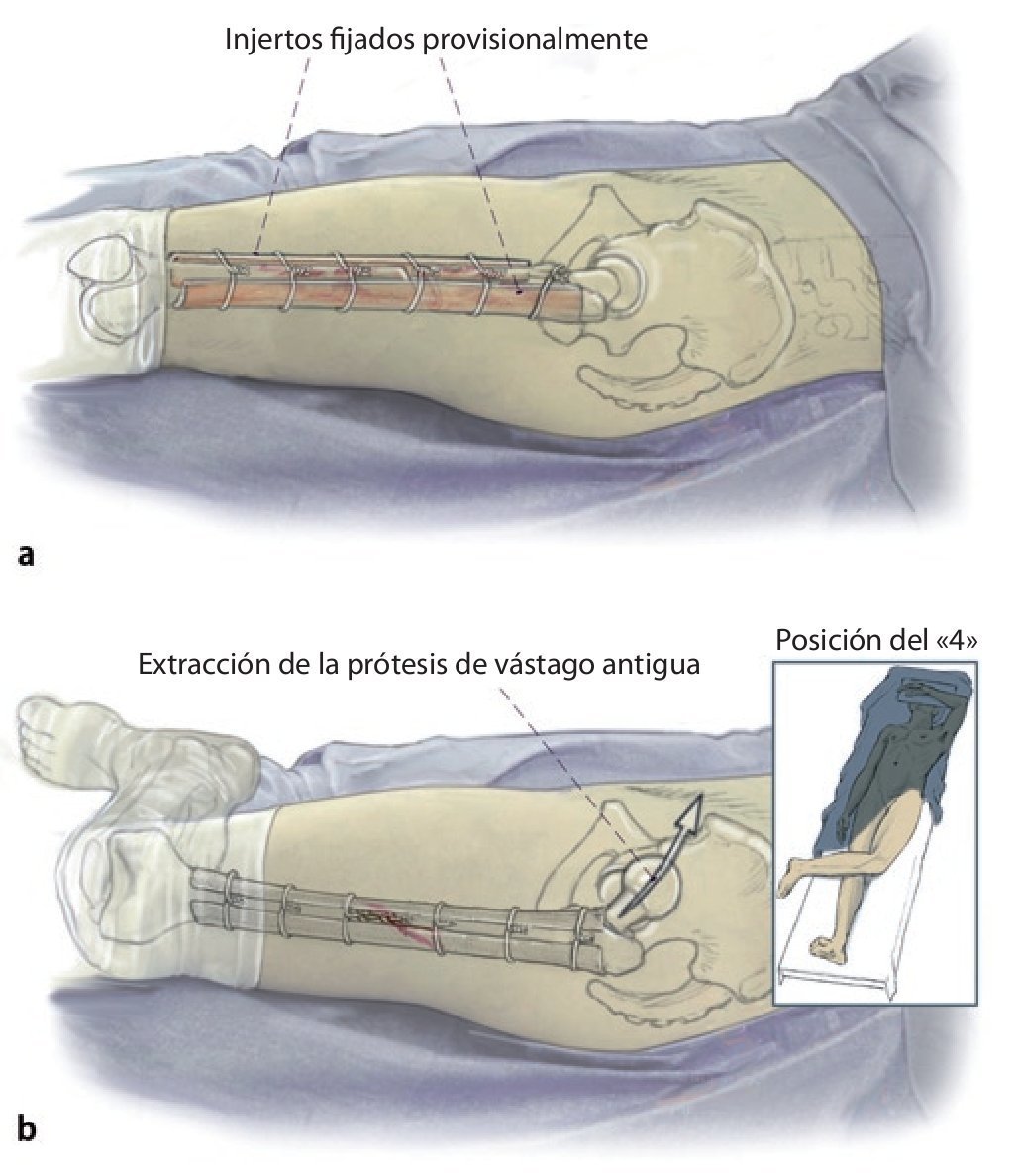
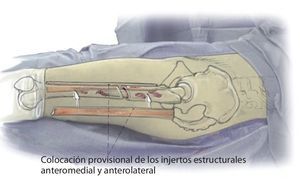
Fig. 2 Reposición en fracturas bajo inmovilización intramedular con el vástago endoprotésico reimplantado. Sección longitudinal sagital centrada del aloinjerto femoral separado con la sierra oscilante, por regla general, en dos mitades longitudinales. Modelación del injerto estructural con la fresa de alta revolución y colocación provisional de ambos injertos. Después de una nueva extracción del injerto estructural del lugar, colocación de los alambres para cerclaje de 2,0 a una distancia de 4 cm aproximadamente. Introducción de los injertos estructurales anteromedial y antero-lateral, apretar los cerclajes en función de la situación. Con la «fresa con punta de lápiz» se realizan previamente pequeñas ranuras en los injertos para el alojamiento de los cerclajes. Durante la preparación del fémur se deberá prestar especial atención de no desnudar el fémur dorsal para no comprometer los vasos que fluyen en la línea áspera.
Fig. 3 Una vez realizada la fijación provisional del injerto, el fémur se encuentra suficientemente estabilizado para que el cirujano pueda trabajar en la cavidad medular femoral tras la extracción del anterior vástago endoprotésico con la pierna en posición del «4» para preparar la prótesis de vástago original.
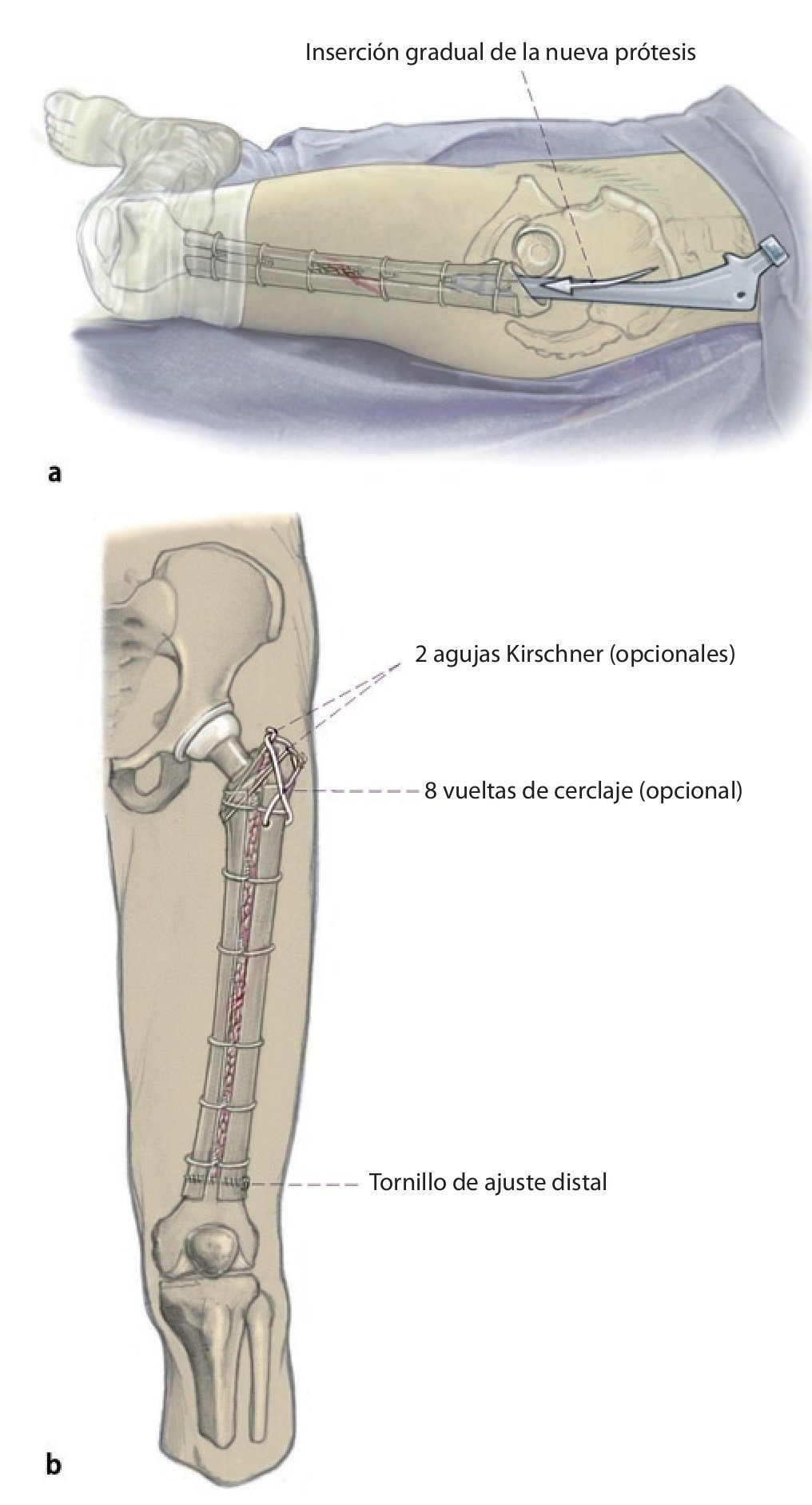
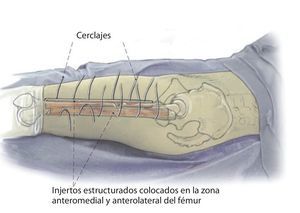
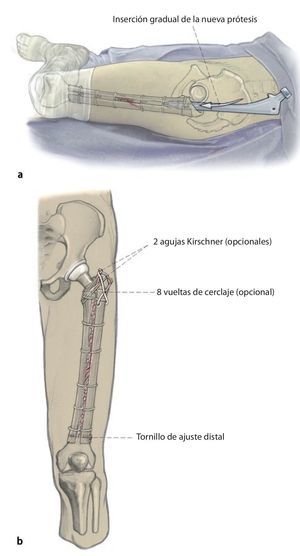
Fig. 4 A continuación, inserción gradual de la nueva endoprótesis apretando progresivamente los cerclajes (técnica de cracking controlada). La estabilidad definitiva de la prótesis de revisión en una situación de fémur inestable se puede conseguir por la función de soporte del injerto estructural apretando los cerclajes.
Fig. 5 Cuando los injertos estructurales tienen que cubrir defectos metafisarios hacia distal o proximal, se insertará adicionalmente un tornillo de ajuste. Finalmente, los injertos estructurales se envuelven en el músculo del cuádriceps, la fascia del músculo se adaptará al septo intermuscular. Antes del cierre de la herida se realizará una fluoroscopia en ambos planos. Puede realizarse una cirugía de esponjosa homóloga o autóloga en la zona de la fractura, de la pseudoartrosis o alrededor del injerto. Además del drenaje Redon de 14 en la zona de la articulación, se insertará un segundo drenaje Redon de 14 debajo del músculo vasto lateral.
Fig. 6a) Dibujo esquemático del defecto de tipo IIIb según Paprosky. b) Aloinjerto estructural preparado en el intraoperatorio.
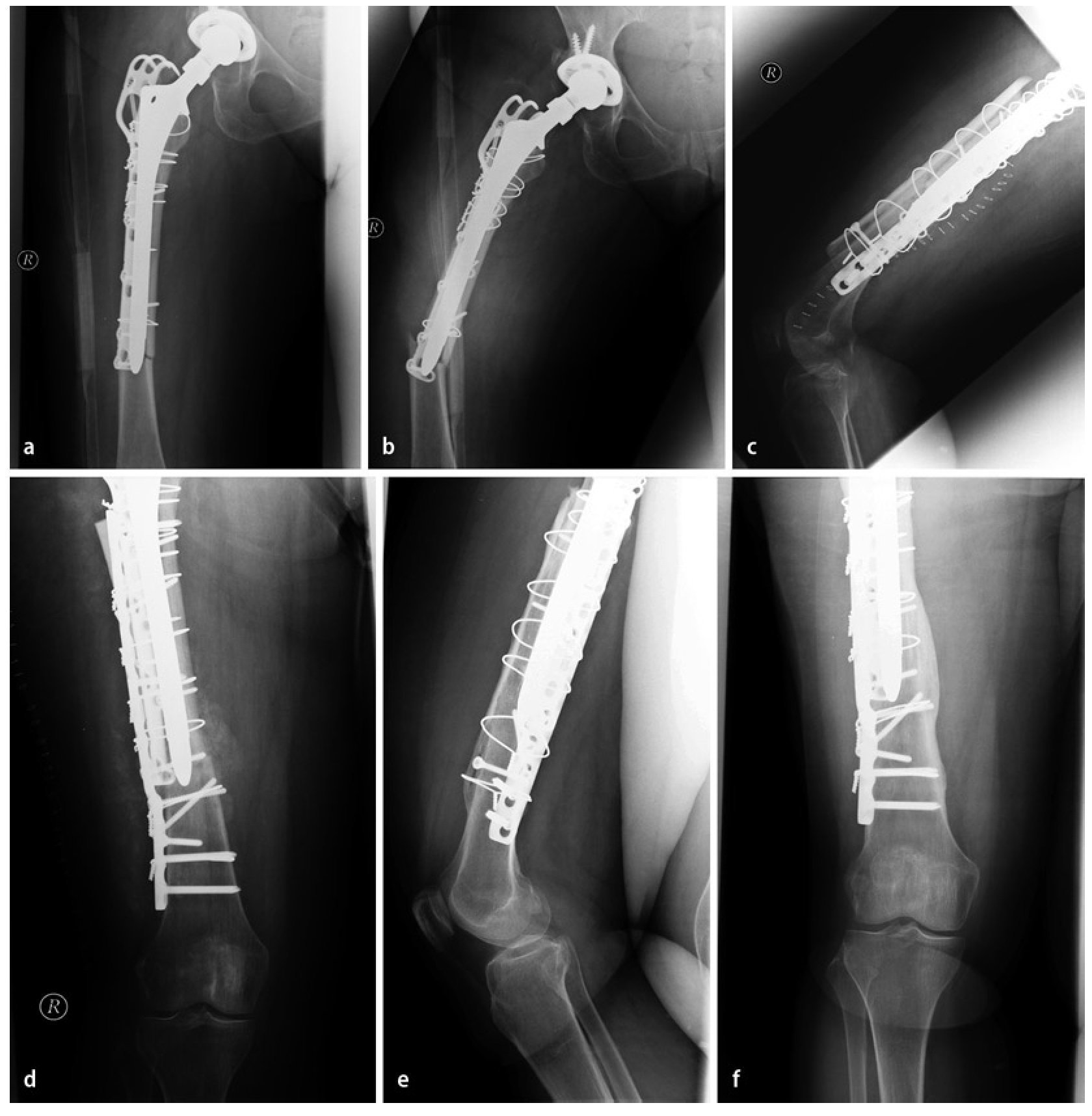
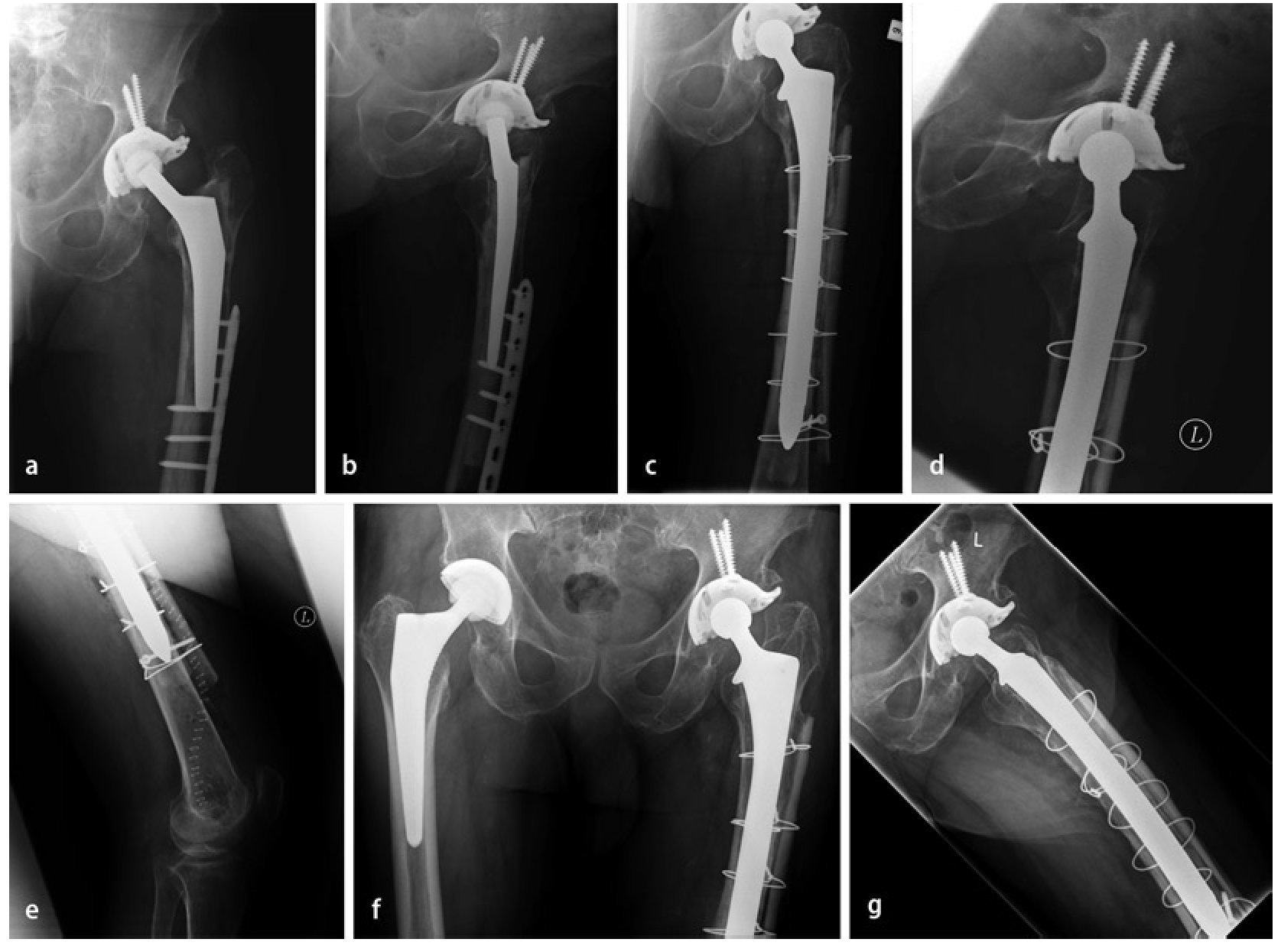
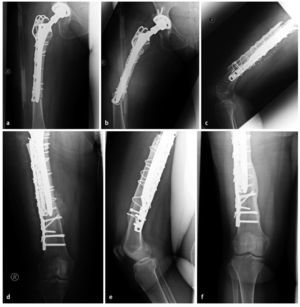
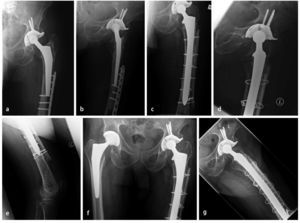
Fig. 7 Caso número 1: a, b) Paciente de sexo femenino de 54 años con una fractura transversal periprotésica de diáfisis femoral en el lado derecho, en la punta de la prótesis de cadera de revisión fija no cementada que rellena el espacio medular. c, d) Primer día postoperatorio después de reposición abierta y osteosíntesis con placa lateral de ángulo fijo en el muslo (sobrepuesta a la placa con gancho ya introducida), así como injerto estructural anteromedial y fijación mediante cerclajes. e, f) A los 42 meses postoperatorios, injerto estructural en el estadio del «complete bridging»11 con formación de esponjosa y centraje trabecular hacia la transmisión de fuerzas.
Fig. 7 Caso número 2: a, b) Paciente de sexo masculino de 84 años con aflojamiento de vástago aséptico en el contexto de una PTC cementada y osteosíntesis de placas de una fractura de fémur periprotésica y defecto femoral óseo del tipo III según Paprosky. c-e) Primer día postoperatorio después de la extracción de placas y recambio de vástago, así como inserción de un injerto estructural (anteromedial y anterolateral) con fijación mediante cerclajes. f, g) A los 15 meses postoperatorios, injerto estructural en el estadio del «complete bridging»11.
Tratamiento postoperatorio
— El paciente se levanta el primer día postoperatorio.
— Férula de movilización de rodilla a partir del primer día postoperatorio.
— Extracción de los drenajes el segundo día postoperatorio.
— Carga parcial mediante dos muletas con 15 kg aproximadamente durante 6-12 semanas postoperatorias.
— Control radiológico a los 10 días, así como a las 6 y 12 semanas postoperatorias; después, cada 1-2 años.
Errores, riesgos y complicaciones
— Rotura del injerto estructural: utilización de injertos estructurales de peroné homólogos o autólogos, ausencia de combinación de un solo injerto estructural con un segundo injerto estructural o una placa de osteosíntesis; problema técnico: fresado demasiado profundo de la ranura para los cerclajes.
— Reabsorción parcial o raramente completa de los injertos estructurales, sobre todo cuando no existe función de soporte y ante un injerto estructural de tamaño pequeño para el aumento de un defecto óseo pequeño.
— Aflojamiento de vástago endoprotésico: falta de estabilidad primaria.
— «Implosión» del fémur cuando los cerclajes se aprietan demasiado en el momento de introducir el vástago.
— Arrancamiento del trocánter mayor: con el fin de evitarlo, el trocánter mayor se puede estabilizar y fijar lateralmente con el injerto estructural y con tornillos, cerclajes y agujas Kirschner ante estrechamiento típico o defecto óseo entre tubérculo innominado y diáfisis femoral; injerto de esponjosa en la zona del defecto.
— Mayor riesgo de infección teórico por una duración de la intervención algo más prolongada.
— La transmisión directa de patógenos es altamente improbable, puesto que todos los donantes son sometidos con anterioridad a un análisis. En cuanto al riesgo residual, es responsable el «periodo ventana» entre infección y seroconversión del donante.
— Desde el punto de vista inmunológico, se deberá tener en cuenta únicamente la incompatibilidad Rh entre donante y receptor en caso de que el paciente esté en edad fértil. Hasta la fecha no se han descrito otras complicaciones inmunológicas. Por lo demás, el injerto óseo no posee inmunogenicidad como, por ejemplo, los injertos orgánicos.
Resultados
La estabilidad del vástago protésico se evaluó en el postoperatorio en base a los criterios radiológicos según Eng y Massin12. Esta valoración clasifica la integridad biológica del vástago protésico en el hueso en tres categorías. Las señales de una integración ósea segura son la alineación trabecular de la esponjosa sobre el vástago protésico, así como la atrofia ósea visible mediante radiografía en el fémur proximal como resultado del cambio de la transmisión de fuerzas ante un vástago estable y la ausencia de una línea radiolucente visible.
Un vástago protésico fibroso estable presenta una línea radiolucente no superior a un milímetro en la unión prótesishueso sin osteolitos visibles y sin migración de la prótesis y con ausencia de dolor por parte del portador. Una osteólisis periprotésica extensa o la migración del vástago se evalúan como una señal de inestabilidad.
Emerson clasificó el comportamiento del injerto estructural visible en las radiologías a lo largo del tiempo en base a las observaciones realizadas y combinadas con estudios histológicos11 y elaboró una secuencia de integración de injertos típica. Los resultados radiológicos en el transcurso del tiempo estaban en correlación con los estadios de integración de los injertos estructurales verificados histológicamente. De este modo, se puede realizar una clasificación de los injertos estructurales en sus diferentes estadios de integración en base a las imágenes radiológicas. La integración del injerto estructural empieza con un redondeo visible del contorno y una pérdida de densidad tras siete meses aproximadamente y es denominada «round of». Treintaiuna semanas después ya se observa que el injerto se dobla, situación denominada «scalloping». Después de ocho meses, se observa en la radiografía la formación de un puente parcial hacia la cortical del propio cuerpo, denominada «partial bridging». La formación de un puente parcial desemboca en un puenteo completo entre el injerto estructural y la cortical al cabo de una media de 12,5 meses y es denominada «complete bridging». Para finalizar, Emerson constató en el 22% de los casos que el injerto estructural había desaparecido completamente de la imagen radiológica después de una media de 26,8 meses. La reabsorción completa se corresponde con el estadio de la «cancelación».
En un primer estudio de revisión sobre aloinjertos estructurales llevado a cabo en diecinueve pacientes con fracturas periprotésicas con pérdida ósea extensiva se registró una escala de cadera de Harris media de 76,4 puntos (intervalo: 57,5-92,0)6 con un periodo de seguimiento posterior medio de 3,7 años (intervalo: 2,0-7,5 años). Solo había tenido lugar una refractura, que se trató mediante dos injertos estructurales adicionales. Finalmente, a todos los pacientes se les curó la fractura. Además, se produjo una lesión discal –que retrocedió completamente al cabo de un año–, una trombosis venosa profunda de piernas y una infección urinaria. Las imágenes radiológicas de los injertos estructurales mostraron un aumento masivo del hueso periprotésico y la integración con el crecimiento visible del puente y una formación de estructura trabecular según la transmisión de fuerzas correspondiente a las clasificaciones en el tiempo de los estudios histológicos de las radiografías y de los estudios radiológicos11 (ocho casos con más del 90% de integración, cinco casos con un «bone bridging» extendido y seis casos con un «bone briding» parcial de más del 50%).
En otro seguimiento posterior4 realizado con trece pacientes con el punto de partida de una «fractura femoral periprotésica fallida», se observó una integración completa sin necesidad de realizar ningún tratamiento adicional en todas las refracturas y pseudoartrosis. Después de un periodo de seguimiento medio de tres años (intervalo: 1,2-7 años), la escala de cadera de Harris media fue de 78 puntos (65-92). Se produjeron tres complicaciones mayores: una inserción no progresiva del vástago de revisión (estable desde el punto de vista fibroso, por el resto se observó una integración ósea), un hematoma profundo y una lesión parcial del nervio isquiático. Todos los injertos estructurales mostraron en las radiografías el comportamiento de integración acorde con el tiempo transcurrido y un aumento del hueso periprotésico (cuatro casos con más del 90% de integración, cuatro casos con «bone bridging» extenso y cinco casos con «bone bridging» parcial de más del 50%). No se observó ningún caso de reabsorción.
Realizamos una tercera serie5 ante defectos óseos metafisarios excesivos en la artroplastia total de cadera de revisión en veinte pacientes con injertos estructurales de soporte. En todos los pacientes se utilizaron injertos estructurales para poder fijar la endoprótesis de revisión de vástago largo en la diáfisis a modo de soporte en la zona distal, fijación posible únicamente mediante los injertos. La escala de Harris media en un periodo de seguimiento medio de 4,7 años fue de 75 puntos (intervalo: 47,5-92 puntos). En las imágenes radiológicas se pudo observar la integración ósea de diecisiete vástagos; tres vástagos presentaron solo un crecimiento fibroso tras la inserción inicial no progresiva del vástago de revisión. Como complicaciones aparecieron una lesión del peroneo, que posteriormente retrocedió completamente; una trombosis venosa profunda manifiesta; una úlcera gastrointestinal, y una neumonía. Únicamente dos pacientes registraron una reabsorción ligera de los injertos estructurales. Por lo demás, la integración se desarrolló dentro del tiempo previsto: doce pacientes con una integración de más del 90%, tres con un «bone bridging» extenso y cinco con un «bone bridging» parcial de más del 50%.
En el año 2008 examinamos a 71 pacientes sometidos a una implantación con injerto estructural con pérdida ósea periprotésica metafisaria de origen diverso (38 pacientes con fractura periprotésica y 33 pacientes con aflojamiento de vástago protésico7). El seguimiento se llevó a cabo durante 3,7 años (intervalo: 0,3-11 años). El valor medio postoperatorio en la escala de Harris fue de 84,1 puntos (intervalo: 44-100 puntos). La tasa de complicaciones postoperatorias generales fue del 12,6% (una luxación anterior, dos infecciones de herida superficiales, un hematoma profundo, una trombosis venosa profunda con embolia pulmonar, un SDRA debido a una transfusión masiva y una infección tardía después de dos años). Con respecto al conjunto del colectivo de pacientes, en el 70/71 de los casos los injertos estructurales se integraron completamente. En un caso se produjo una rotura del injerto. De ello resulta una tasa de integración de los injertos estructurales del 98,5%. 32 pacientes alcanzaron el estadio del «complete bridging», 16 pacientes el «partial bridging», en 15 pacientes se observó una tasa de integración dentro del tiempo indicado del injerto y en 7 casos se observó una reabsorción completa del injerto en la radiografía. El resultado fue una tasa de reabsorción del 9,9%. Todos los pacientes presentaron postoperatoriamente una integración estable del vástago protésico, 55 vástagos se habían integrado en el hueso y 16 eran fibrosamente estables sin presentar síntomas clínicos.
También en otros seguimientos clínicos realizados a medio y largo plazo se pudo identificar una aplicación eficaz y exitosa del injerto estructural para defectos óseos en la cirugía endoprotésica de revisión del vástago femoral1,3,8,9,13-15,17,19.
En otros seguimientos posteriores2,16,18 se obtuvieron incluso resultados satisfactorios en la aplicación de injertos estructurales después de una infección periprotésica curada y de defectos óseos masivos. Ni en la literatura1-7,9 ni según nuestra experiencia personal a lo largo de 22 años existe un solo dato que sugiera que el uso de injertos estructurales a modo de secuestro pueda provocar el aumento de las tasas de infección en las intervenciones de revisión.
Cumplimiento con las directrices éticas
Conflicto de intereses. G. Orfanos, Y. Ding, C.P. Bode, B. Barden y J.G. Fitzek indican que no existe ningún conflicto de intereses.
Este artículo no contiene pruebas en personas o animales
Correspondencia
Dr. G. Orfanos
Chirurgische Klinik I, Klinik für Unfall- und Orthopädische Chirurgie, Krankenhaus Düren gem. GmbH
Roonstr. 30, 52351 Düren (Alemania)
georgios.orfanos@krankenhaus-dueren.de