INTRODUCCIÓN
El síndrome de hipersensibilidad a fármacos (SHF) es el término más comúnmente empleado para describir un tipo de reacción grave medicamentosa, caracterizado por la tríada consistente en fiebre, afectación cutánea y afectación multiorgánica. Algunos autores extienden este concepto añadiendo la linfadenopatía y la eosinofilia al cuadro1-4. Desde las descripciones iniciales hace 70 años, esta reacción medicamentosa ha recibido diversas denominaciones, lo que ha contribuido a crear confusión en torno a la misma. Entre los diversos sinónimos que ha recibido figuran los de reacción de hipersensibilidad a fenitoína, síndrome similar a la mononucleosis infecciosa, síndrome similar a Kawasaki, hipersensibilidad a agentes anticonvulsionantes aromáticos, síndrome de hipersensibilidad a anticonvulsionantes, erupción por fármacos con eosinofilia y síntomas sistémicos (DRESS), síndrome de hipersensibilidad retardada multiorgánica inducida por fármacos (DIDMOHS), etc. En la actualidad los criterios que definen el SHF englobarían a todas estas entidades, incluidos los síndromes de hipersensibilidad a anticonvulsionantes y de DRESS, que siguen siendo muy utilizados.
Los fármacos principalmente implicados en esta rara pero potencialmente grave reacción son los antiepilépticos. Sin embargo, cada día se suman nuevos medicamentos capaces de inducir el SHF. La variable presentación clínica de las lesiones cutáneas, orgánicas, analíticas o histológicas del SHF, no siempre comunes a todos los pacientes, ha supuesto una seria dificultad para que este término se acepte de manera unánime. Además pueden existir casos diagnosticados de otras patologías, como son el síndrome de Stevens-Johnson (SS) o la necrólisis epidérmica tóxica (NET), que en ocasiones también cumplen criterios de SHF4,5. El síndrome puede simular otras patologías, como infecciones, neoplasias, enfermedades del colágeno o vasculitis, entre otros.
La incidencia del SHF es difícil de establecer, y únicamente en estudios de pacientes tratados con anticomiciales aromáticos se estima que 1 entre 1.000 a 10.000 puede padecer este síndrome. Además, entre estos fármacos existe una elevada reactividad cruzada que alcanza el 75%, hecho que condiciona el tratamiento de estos pacientes.
EPIDEMIOLOGÍA
Los datos epidemiológicos estiman que el 10-20% de los pacientes hospitalizados y el 7% de la población general pueden padecer una reacción medicamentosa6. Las reacciones de hipersensibilidad representan un tercio de todas las reacciones medicamentosas. Algunos trabajos en pacientes tratados con anticonvulsionantes refieren que 1 de cada 1.000 a 10.000 pueden padecer un SHF7,8. Datos más recientes establecen la incidencia en 1 de cada 3.000 en este grupo de pacientes9. Sin embargo, la verdadera incidencia del SHF no se ha establecido y probablemente sea mayor de lo referido en la literatura, pero la falta de consenso en el diagnóstico y la variable presentación clínica dificultan el establecimiento de cifras más concretas10. El riesgo de desarrollar un SHF es semejante en varones y en mujeres, y tampoco existen diferencias entre adultos y niños7,11,12.
La causa más frecuente de SHF son los antiepilépticos aromáticos, entre los que existe una reactividad cruzada que alcanza el 75%. Los datos mejor conocidos sobre la incidencia de SHF están establecidos en este grupo de pacientes. En el caso de la fenitoína y de la carbamazepina se estima que de 2,3 a 4,5 por 10.000 y de 1 a 4,1 por 10.000, respectivamente, pueden desarrollar un SHF7. La administración de lamotrigina también se ha asociado con el SHF. Según Shear y Splieberg13, la posibilidad de que la lamotrigina produzca una reacción medicamentosa grave es del 19%, frente al 9% de la fenitoína, la carbamazepina o el fenobarbital. El impacto económico del SHF puede ser elevado, y en un estudio canadiense el coste del proceso se cifraba entre 1.149 y 21.293 dólares canadienses14.
Distintos medicamentos, tanto la sulfona con un anillo aromático como los antiepilépticos, pueden provocar SHF. En un reciente artículo se describen 26 pacientes, de los cuales 24 padecían alguna forma de lepra, tratados con este fármaco, que desarrollaron SHF15. En estos pacientes la proporción era superior en varones que en mujeres (2,2:1), y la edad de aparición era semejante a la descrita con anticomiciales. En la actualidad existen otros medicamentos emergentes, como el abacavir y la nevirapina, capaces de inducir casos de hipersensibilidad graves. Estos fármacos están desplazando a los anticonvulsionantes clásicos en cuanto al porcentaje de pacientes afectados de SHF. Peyriére et al16, en un estudio sobre 216 casos recogidos durante 15 años en Francia, vieron que 90 estaban inducidos por abacavir y nevirapina, frente a 38 provocados por antiepilépticos clásicos.
Otros factores como el antígeno plaquetario humano (HLA), la raza o la radioterapia han sido valorados como predisponentes para padecer un SHF. El HLA-B*5701 está claramente relacionado con el abacavir17. La raza no parece tan determinante, aunque algunos autores consideran que es más predisponente en negros, posiblemente debido a una mayor incidencia de epilepsia18,19. La radioterapia se ha asociado con reacciones de hipersensibilidad grave, predominantemente en las zonas radiadas20, pero su incidencia es escasa para sacar conclusiones.
ETIOPATOGENIA
El SHF, como su propia definición indica, está inducido por diversos fármacos. Éstos tendrían capacidad para producir una acumulación de metabolitos reactivos, que se comportarían como haptenos e inducirían una respuesta inmune13,21-23. Sin embargo, la exposición al medicamento no sería suficiente, y además debería existir una susceptibilidad individual añadida24.
Fármacos implicados
En la actualidad la lista de medicamentos capaces de provocar el SHF es cada vez mayor. Los primeros casos se describieron con los antiepilépticos aromáticos, y de hecho en numerosas revisiones y artículos se denomina síndrome de hipersensibilidad a anticonvulsionantes. La difenilhidantoína, el fenobarbital y la carbamazepina son los anticomiciales clásicos que con más frecuencia se han asociado a SHF junto con las sulfonamidas25-30. La reactividad cruzada entre estos fármacos es muy elevada, y no es infrecuente la sensibilización simultánea o consecutiva de alguno de ellos31,32. Otros antiepilépticos aromáticos más recientes, como la lamotrigina, también se han incriminado en el SHF33-35. Existen otros medicamentos con anillo aromático que pueden desencadenar un SHF, y son los derivados de las sulfamidas (diaminodifenil-sulfona [dapsona], sulfasalazina, sulfametoxazol) y el alopurinol15,36-39. Este último provoca reacciones cutáneas en el 2% de los pacientes que lo toman, pero sólo 1 de 260 pacientes en tratamiento con alopurinol desarrolló un SHF40. En este grupo la mortalidad es muy elevada; Arellano y Sacristan41, en una revisión de 101 casos, describen una mortalidad del 26,7% como consecuencia, principalmente, de las lesiones cutáneas y sepsis.
A estos medicamentos, que podemos considerar clásicos en el desencadenamiento del SHF, habría que añadir una larga lista. Dentro de ésta, hay algunos fármacos en los que la asociación parece meramente fortuita, mientras que en otros tiene un valor estadístico superior a la pura coincidencia. En el primer grupo se encuentran medicamentos como la amoxicilina-ácido clavulánico42, la fenilbutazona43, la isoniazida, el enalapril, la mequitazina, la hidroclorotiazida44, la azatioprina45, la terbinafina46, el diltiazem47, el sorbinil48, el metimazol49, el tinidazol50, el copridrogel51,52, la clomipramina53, la ziprasidona54, el paracetamol55, la mexiletina56 y la vancomicina57. En el segundo grupo se encuentran la minociclina y los antirretrovirales. La minociclina es un antibiótico ampliamente utilizado hace 10 años en el tratamiento del acné, y diversas publicaciones lo implican en el desencadenamiento de numerosos efectos adversos, entre ellos el SHF44,58-61. En el grupo de los antirretrovirales, el SHF se ha descrito con diversos fármacos: abacavir, nevirapina y zalcitabina62. Sin embargo, el abacavir es el principal de todos ellos, y se estima que hasta el 18% de los pacientes pueden padecer algún tipo de reacción adversa, y que < 5% desarrollan un cuadro de hipersensibilidad grave63. Recientemente, Phillips et al64 han demostrado la relación entre el HLA-B*5701 y la positividad de las pruebas de contacto al abacavir.
Patogenia
En el desencadenamiento del SHF se han valorado diversos mecanismos etiopatogénicos que explicarían parcialmente la aparición del cuadro. Estos mecanismos pivotan sobre 3 aspectos fundamentalmente: metabolitos tóxicos, mecanismos inmunológicos y virus.
Metabolitos tóxicos
Algunos medicamentos asociados con SHF son metabolizados por detoxificación a productos intermedios con capacidad tóxica (óxidos arene), o bien pueden ligarse de manera covalente a macromoléculas que actúan como neoantígenos con capacidad de respuesta inmunológica10,22,23. En circunstancias normales la epóxido hidroxilasa microsomal es capaz de detoxificar estos fármacos, pero un déficit de esta enzima o una disminución de la capacidad de metabolización de la misma conducirían a la acumulación de metabolitos tóxicos13,65. Algunos autores proponen que este mecanismo tendría un carácter fenotípico semejante al que muestran 2 grupos de población diferentes, que se comportan como acetiladores rápidos y lentos23. Por tanto, es muy posible que el medicamento por sí solo no sea suficiente para desencadenar el SHF y debería existir una predisposición genética acompañante23,24,66. En el caso de los anticonvulsionantes aromáticos, el citocromo P450 (CYP 450) metaboliza el anillo aromático y produce óxidos arene que son detoxificados por la epóxido hidroxilasa. Leeder et al67 han identificado anticuerpos contra el CYP450 3A1 en ratas y en un paciente. Los metabolitos tóxicos se ligarían de manera covalente con el CYP450 y provocarían directamente la muerte celular o apoptosis, o bien formarían neoantígenos y, secundariamente, da-rían lugar a la consiguiente respuesta inmunoló-gica. Otra vía metabólica menor la constituye el glutatión22.
En otros medicamentos la vía metabólica también podría explicar la aparición de SHF. En el caso de la primidona se metaboliza a fenobarbital, y la oxcarbazepina es estructuralmente semejante a la carbamazepina, lo que explicaría un comportamiento semejante al descrito anteriormente. El SHF por lamotrigina también podría tener una causa metabólica, con formación de metabolitos 2-N óxidos y 2-N metilados de su principio activo11. El alopurinol mediante oxidación se metaboliza a oxipurinol, que sería el responsable del SHF38,41,68; su mecanismo no es bien conocido, a pesar de que se han barajado diversas hipótesis inmunológicas, genéticas y metabólicas.
Mecanismos inmunológicos
Diversos mecanismos inmunológicos se han implicado en el desencadenamiento del SHF, pero son poco conocidos23. La hipersensibilidad retardada parece la más plausible, como demuestran las pruebas epicutáneas positivas a diferentes fármacos implicados en la SHF69,70. También se ha valorado el papel de los inmunocomplejos en la patogenia de la SHF. Se ha detectado la presencia de anticuerpos frente a diferentes antígenos. Cribb et al71 hallan en ratas la existencia de anticuerpos frente a proteínas del retículo endoplásmico en SHF inducido por sulfonamidas. Además se han descrito anticuerpos IgG antisulfametoxazol en un paciente con SHF72. Por otro lado, se han encontrado anticuerpos IgG frente al CYP450 3A167.
Diferentes teorías sugieren la idea de que el SHF es una forma de enfermedad injerto contra huésped11,22,73. La similitud entre las manifestaciones de ambas enfermedades, la exposición inicial, el período de inducción y la respuesta ha llevado a plantear esta hipótesis.
Virus
El papel de los virus en la patogenia del SHF parece tener cada día más fuerza, y en la actualidad son numerosos los artículos publicados que así lo demuestran24,28,74-81. La interacción entre medicamentos e infección viral activa es evidente en algunos casos, principalmente con los virus de la familia de los herpes y el virus de la inmunodeficiencia humana (VIH).
La incidencia de toxicodermias en el sida se encuentra aumentada 100 veces respecto a la población general82,83. Los fármacos implicados son principalmente los antibióticos, los antiepilépticos y los antirretrovirales. La causa de una mayor incidencia de reacciones medicamentosas en este grupo de pacientes no está bien establecida, y podría ser una mayor sensibilidad a los metabolitos oxidativos de los medicamentos o una pronunciada disminución de los linfocitos CD4. En cualquier caso, el SHF puede aparecer en estos pacientes84-86 asociado con los mismos fármacos descritos en la literatura y además con antirretrovirales como el abacavir.
Dentro de la familia de los herpes, el virus herpes humano 6 (VHH6), el virus herpes humano 7 (VHH7), el citomegalovirus (CMV) y el virus de Epstein-Barr (VEB) se han relacionado con el SHF81. La reactivación de infecciones provocadas por estos virus y los medicamentos aumenta el riesgo de padecer un SHF. En los numerosos artículos aparecidos en los últimos años el VHH6 es el más relacionado con reacciones cutáneas graves, seguido del CMV, el VHH7 y el VEB. Los títulos de anticuerpos IgG contra VHH6, VHH7, CMV y VEB se encuentran elevados en el período de actividad del SHF78-81. Además, mediante la reacción en cadena de la polimerasa (PCR) se puede detectar la presencia de estos virus en el suero, el líquido cefalorraquídeo78-81 y, en ocasiones, con inmunohistoquímica en tejidos79. Los fármacos implicados en la infección vírica y en el SHF son múltiples y similares a los descritos en otros grupos de población80,81,85,87-90. En cuanto al perfil clínico, no muestra diferencias con respecto al de los pacientes que no asocian infección, aunque algunos presenten ciertas peculiaridades86,89,90.
Posiblemente el SHF sea un proceso dinámico multifactorial en el que intervienen diferentes factores que desencadenan una respuesta inflamatoria mediada por citocinas, como ocurre en otros procesos cutáneos.
CLÍNICA
La clínica que pueden presentar estos pacientes es muy abigarrada y variable, de aquí la gran cantidad de sinónimos que ha recibido. La tríada de afectación cutánea, multiorgánica y fiebre es la más comúnmente aceptada, aunque en ocasiones puede describirse como un seudolinfoma.
Originalmente se asoció con los tratamientos antiepilépticos, lo que llevó a denominarlo síndrome de hipersensibilidad a anticonvulsionantes, pero posteriormente son numerosos los medicamentos que se han implicado en el desencadenamiento del SHF. Clásicamente se refiere que el cuadro se desarrolla entre las 2 y 6 semanas de iniciar la ingesta del fármaco responsable. Sin embargo, la aparición de los primeros síntomas suele ser más precoz, y no es raro observar que entre los 7 y 15 días ya se ha desarrollado el SHF10,12,29,91. La fenitoína presenta un tiempo medio de aparición de 17 a 21 días, mientras que la carbamazepina aparece generalmente entre los 21 a 28 días13. La lamotrigina, el abacavir y la nevirapina tienen un intervalo más corto de aparición que otros fármacos16. En pacientes previamente sensibilizados este período es mucho más corto. El cuadro puede aparecer a cualquier edad, e incluso se ha descrito en prematuros92.
La fiebre a menudo es el primer síntoma, es elevada (38-40 °C) y persistente, y se acompaña de malestar general y en ocasiones de faringitis. La mayoría de las publicaciones refieren que la fiebre afecta prácticamente al 100% de los pacientes10, pero Peyriére et al16 la sitúan entre el 23 y el 100% para el grupo de pacientes estudiado y entre el 78 y el 100% para los descritos en la literatura.
Clínica cutánea
La clínica cutánea es la principal característica que lleva al diagnóstico de esta enfermedad, pero su presentación es muy variable. Dentro de este síndrome existen diversas formas de afectación cutánea: exantema generalizado, dermatitis eccematosa, dermatitis exfoliativa, eritrodermia, pustulosis exantemática aguda generalizada, lesiones similares a lupus eritematoso, SS, NET y seudolinfoma. Esta complejidad en la presentación del SHF contribuye a incrementar la dificultad de su diagnóstico91,93.
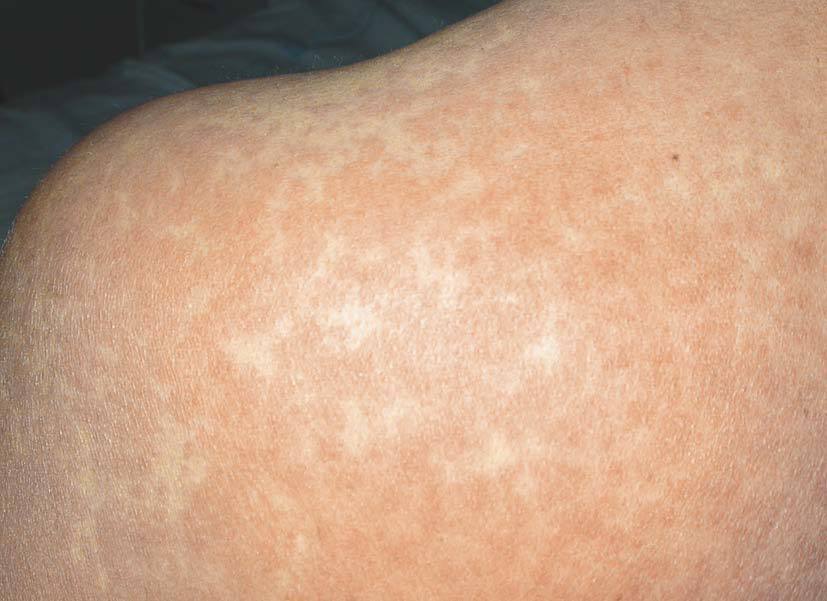
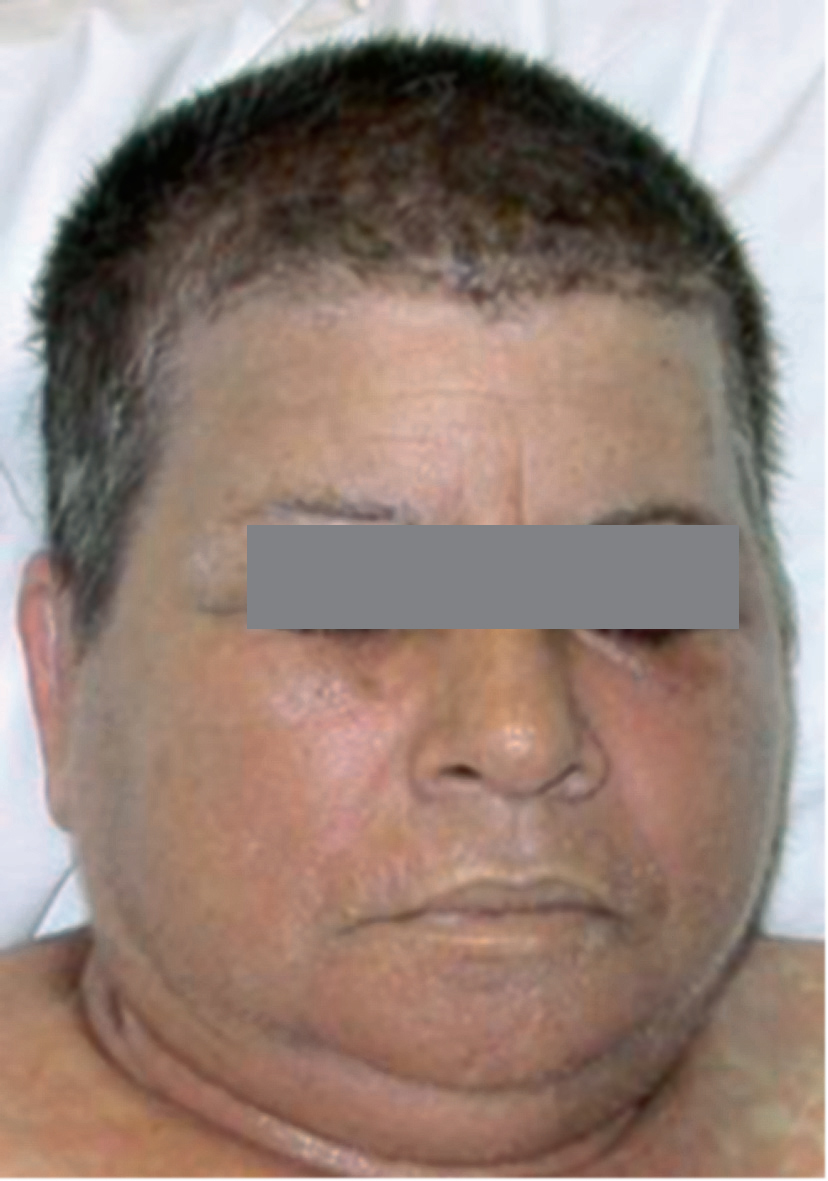
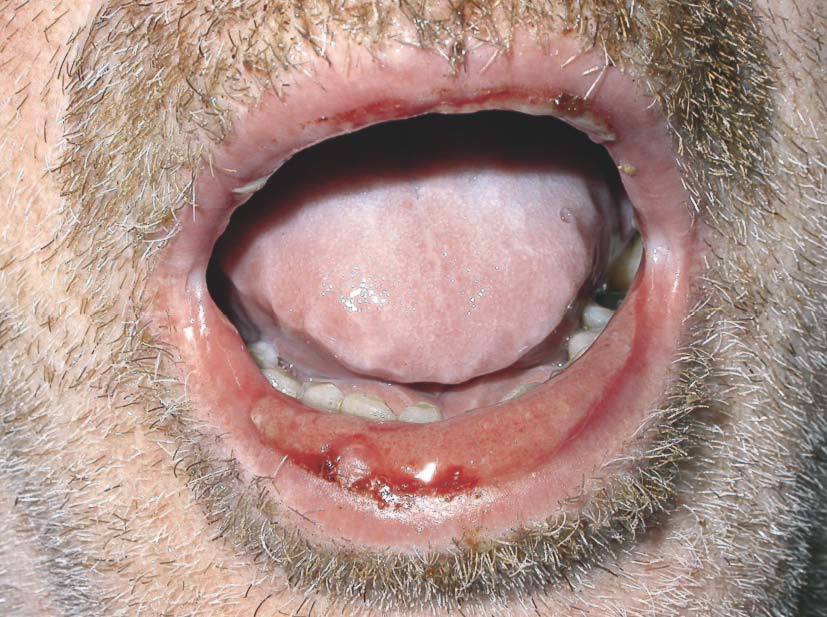
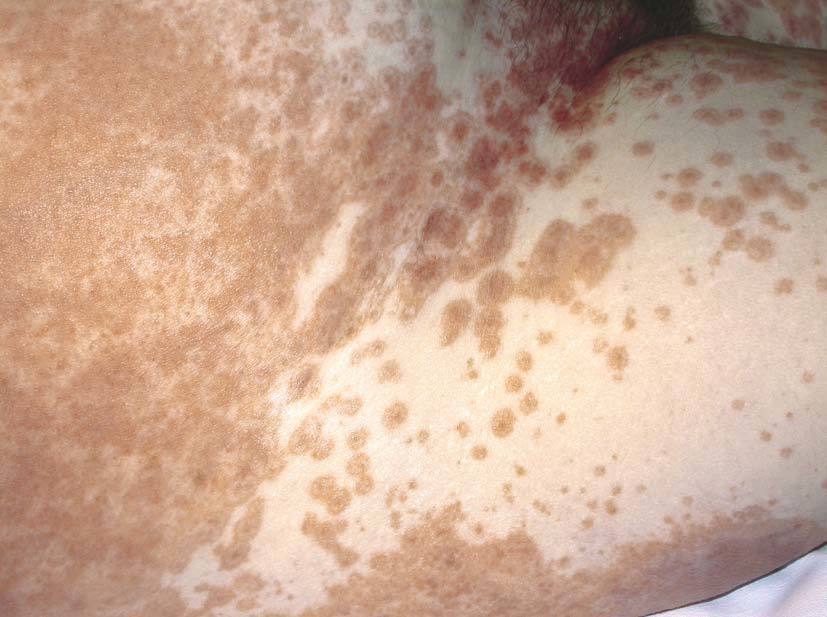
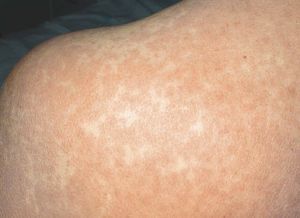
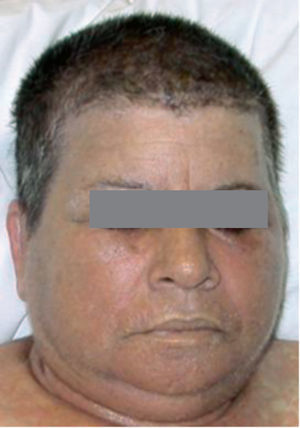
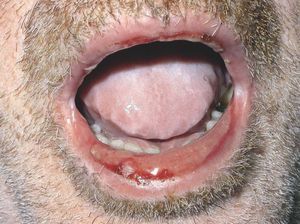
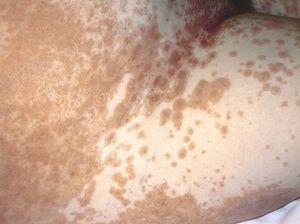
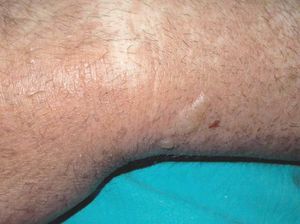
Las lesiones cutáneas generalmente consisten en un exantema morbiliforme o maculopapuloso confluente que aparece uno o 2 días después de iniciarse la fiebre (fig. 1). El exantema afecta predominantemente a la cara, el tronco y las extremidades, y en estas últimas regiones es más intenso en áreas proximales. En la cara es frecuente el edema y la presencia ocasional de pequeñas pústulas, principalmente periorales y en escaso número, y además puede existir una conjuntivitis (fig. 2). En algunos casos el exantema evoluciona a una eritrodermia o incluso a una dermatitis descamativa generalizada, o puede iniciarse como tal. La presentación de inicio con una clínica de urticaria o similar a eritema exudativo multiforme es más rara (fig. 3). Las lesiones son eritematosas y simétricas, y el prurito de moderado a intenso es constante en los pacientes. Inicialmente la cara y el tronco son las primeras zonas afectas, para extenderse con posterioridad a las extremidades inferiores. A veces aparecen pústulas foliculares y no foliculares estériles en otras localizaciones diferentes a la cara, dando un aspecto de pustulosis exantemática aguda generalizada. También se han descrito lesiones ampollosas aisladas5 o en el seno de formas más graves, como el SS o la NET (fig. 4). La afectación de mucosas es rara, si se exceptúa el SS y la NET (fig. 5). Las dosis parecen independientes de la intensidad de la reacción cutánea, aunque valores elevados en sangre pueden provocar síntomas generales por toxicidad94,95. Al regresar el cuadro, las lesiones cutáneas adoptan un aspecto descamativo que puede durar varias semanas.
Figura 1> Exantema maculopapuloso confluente en el tronco.
Figura 2> Eritema y edema facial intensos, acompañados de algunas pústulas periorales.
Figura 3> Lesiones erosivas en la mucosa oral.
Figura 4> Eritema con lesiones en diana tipo eritema exudativo multiforme.
Figura 5> Lesiones ampollosas sobre el exantema generalizado.
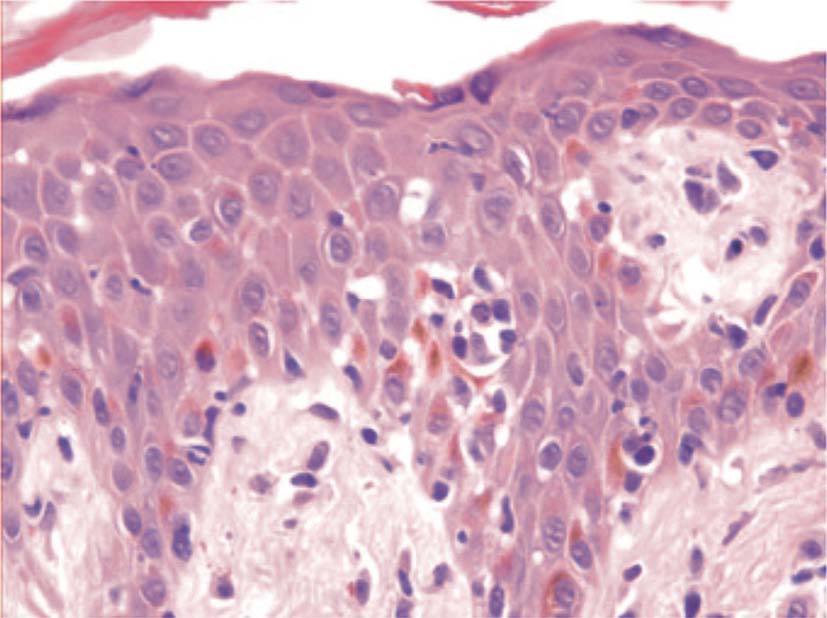
La histopatología de las lesiones cutáneas mencionadas con anterioridad no es específica y depende fundamentalmente del tipo de lesión biopsiada y de la fase evolutiva en la que se encuentre. Como características más comunes aparecen queratinocitos necróticos y un infiltrado inflamatorio de lin-focitos con disposición perivascular en la dermis papilar. En ocasiones este infiltrado adopta una distribución liquenoide, con exocitosis y edema en la dermis papilar. Las lesiones de cuadros más específicos, como la pustulosis exantemática aguda generalizada, el SS o la NET, dan unos hallazgos que son los descritos clásicamente en estas enfermedades.
Clínica extracutánea
La afectación multiorgánica es tan abigarrada como la cutánea, y son numerosos los órganos potencialmente alterados. Las lesiones cutáneas preceden a las sistémicas, que pueden incluso ser asintomáticas. Las linfadenopatías son habituales en el SHF, y cerca del 70% de los pacientes las presentan2,10; son predominantemente cervicales, pero pueden generalizarse y afectar a axilas e ingles. Histológicamente las adenopatías presentan una hiperplasia linfoide benigna reactiva (linfadenopatía dermatopática), aunque excepcionalmente se ha descrito linfadenitis necrosante96.
El hígado y las alteraciones hematológicas son casi tan frecuentes como las adenopatías. La afectación hepática alcanza al 50-60% de los pacientes97, y casi siempre se trata de una elevación transitoria de las transaminasas que alcanza cifras de hasta 10 a 20 veces las normales98. Rara vez se han descrito casos de fallo hepático agudo que han requerido un trasplante, y casos con desenlace fatal99-101. Las vías biliares pueden afectarse secundariamente con la presencia de colestasis intra y extrahepática98. Una colestasis anictérica con elevación de la fosfatasa alcalina y la gammaglutamiltransferasa es posible, pero es infrecuente la ictericia98. La biopsia hepática demuestra un infiltrado de eosinófilos o granulomas, y esta alteración se acompaña de necrosis de los hepatocitos y colestasis. En los casos más graves puede existir una necrosis hepática focal múltiple diseminada o masiva102. En el caso del abacavir las alteraciones gastrointestinales (náu-seas, vómitos, diarrea) son frecuentes, pero no la afectación hepática63.
La afectación hematológica global es un poco inferior a la hepática, con porcentajes aproximados del 50%2,10. Sin embargo, la eosinofilia, que es la alteración más frecuente, puede presentarse hasta en el 70-80% de los pacientes con cifras de entre 2.000-5.000/mm3, asociada o no a linfocitosis103. No obstante, los porcentajes de eosinofilia varían en relación al fármaco responsable del SHF. La carbamazepina, el fenobarbital, la hidantoína, el alopurinol, la minociclina y la nevirapina alcanzan porcentajes de eosinofilia hasta del 100% de los pacientes. Por contraste, el abacavir y la lamotrigina sólo alcanzan el 9 y el 21% de eosinofilia, respectivamente16. Dentro de las alteraciones hematológicas también se han descrito linfocitosis atípica, esplenomegalia, trombocitopenia, anemia, neutropenia y anemia aplásica22,52. Los linfocitos grandes atípicos circulantes en sangre periférica similares a las células de Sézary aparecen en el 50-70% de los pacientes10,103. Los casos de complicaciones hematológicas graves, como anemia aplásica, agra-nulocitosis o síndrome hemofagocítico, son excepcionales pero están recogidos en la literatura médica28,51,104,105. La hipogammaglobulinemia es otro de los efectos secundarios que pueden aparecen en el SHF106,107. Recientemente, Kano et al76 han valorado la disminución los linfocitos B circulantes como posible causa de la hipogammaglobulinemia. Otros autores han encontrado infección activa por VHH6 y elevación de la IgE asociada con la hipogammaglobulinemia108. Las alteraciones de la coagulación se han descrito principalmente en pacientes con fallo hepático agudo28,98.
Otros órganos, como el riñón, el pulmón, el corazón o el SNC pueden estar afectados en el SHF, pero su incidencia es mucho menor. Las manifestaciones renales del SHF aparecen hasta en el 30% de los pacientes103. Las más frecuentes son hematuria microscópica, proteinuria ligera, leucocituria aséptica y elevación de la creatinina. Las formas más graves de alteraciones renales, como la nefritis intersticial y el fallo renal agudo, son mucho más raras109,110. La mayoría de los pacientes con problemas renales graves están en relación con la ingesta de alopurinol, y habitualmente suelen ser pacientes con cifras de creatinina previamente elevadas38,111. El tratamiento precoz con glucocorticoides, e incluso con inmunosupresores y hemodiálisis, es fun-damental para evitar un daño renal permanente39,110,111. En el aparato respiratorio pueden aparecer efectos secundarios hasta en el 15% de los pacientes con SHF, y muchos de éstos están relacionados con la minociclina y el abacavir. La neumonía intersticial, el síndrome de distrés respiratorio o incluso la vasculitis están referidas en algunas publicaciones32,44,55,112. La minociclina provoca un cuadro de neumopatía intersticial eosinofílica con disnea y tos seca, mientras que el abacavir da un cuadro de taquipnea y de faringitis principalmente16,63. La afectación cardíaca es muy poco frecuente y en general pobremente documentada16. La pericarditis, la miocarditis, las necrosis miocárdicas, la trombosis de la arteria coronaria y la taquicardia se han descrito en diversos casos de SHF2,44,113,114. En la literatura se han documentado alteraciones del SNC (encefalitis, meningitis aséptica), rabdomiólisis, diabetes mellitus tipo 1, vasculitis, enfermedad autoinmune e hipotiroidismo transitorio relacionados con el SHF12,24,27,30,49,89,115. Muchas de estas últimas asociaciones son meramente fortuitas o su significado estadístico no es destacable.
Seudolinfoma
Los anticonvulsionantes pueden dar una clínica semejante a la descrita en algunos linfomas cutáneos. De hecho, muchas de las descripciones originales con antiepilépticos lo fueron como seudolinfomas116,117. En realidad se trata de una dualidad de los anticomiciales, que pueden presentar una clínica abigarrada, como la referida con anterioridad en forma de SHF, o pueden simular un linfoma cutáneo T o B. Entre el SHF y los seudolinfomas existen claras diferencias clinicopatológicas que permiten separarlos la mayoría de las veces. En ocasiones aparecen casos de superposición con un cuadro agudo idéntico al SHF e histología de linfoma, lo que dificulta el diagnóstico44,118. Algunos autores asocian el SHF con los cuadros de seudolinfoma29, cuando en realidad son entidades diferentes que comparten el fármaco que las induce y que pueden compartir algunas características comunes44,102.
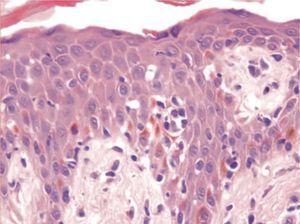
Los seudolinfomas inducidos por fármacos pueden ser T o B, pero son mucho más frecuentes los primeros102. La mayoría de los casos simulan un lin-foma cutáneo de células T tipo micosis fungoide (MF). La clínica puede ser orientativa pero no específica, y en realidad es la histopatología la que permite el diagnóstico. En los seudolinfomas T el período de iniciación de las lesiones es habitualmente mucho más tardío e insidioso que el referido en el SHF. La iniciación de los síntomas puede ser de hasta 2 años, y es frecuente un período de latencia de meses antes de aparecer las lesiones cutáneas117. Por otra parte, la afectación multiorgánica, las adenopatías y la fiebre están ausentes en los seudolinfomas. Las lesiones cutáneas aparecen de manera solitaria o en escaso número, principalmente en forma de placas o nódulos, y aunque éstos son más típicos de seudolinfomas B, también existen casos de eritrodermia que recuerdan a una MF. Los hallazgos histológicos son superponibles a los de una MF con epidermotropismo, microabscesos de Pautrier e infiltrado linfocitario en banda en dermis papilar (fig. 6). Además, los linfocitos presentan atipia citológica con hábito cerebriforme semejante a las células de Sézary. Sin embargo, como hecho diferenciador, en los seudolinfomas aparece espongiosis, queratinocitos necróticos, infiltrado de eosinófilos, edema de la dermis papilar y extravasación de linfocitos119. Los estudios con reordenamiento clonal son generalmente negativos y rara vez positivos, pero tampoco ayudan a establecer el diagnóstico diferencial118,119. Los fármacos que pueden inducir la aparición de los seudolinfomas son fundamentalmente los anticonvulsionantes (hidantoína y carbamazepina), pero también se han descrito casos con otros medicamentos44. La evolución es semejante al SHF; en la mayoría de los casos el cuadro se resuelve con la retirada del fármaco responsable, pero a diferencia de éstos, los seudolinfomas no necesitan habitualmente tratamiento12.
Figura 6> Aspecto histopatológico de seudolinfoma con microabscesos de Pautrier y linfocitos atípicos.
DIAGNÓSTICO DIFERENCIAL
El diagnóstico del SHF es fundamentalmente clínico, si bien existen una serie de pruebas que permiten confirmar el fármaco responsable, sobre todo en los casos en que hay evidencia de ingesta de más de un medicamento o la relación temporal no es clara. Los ensayos de linfotoxicidad (LTA) y las pruebas de contacto ayudan a poner de manifiesto el papel del fármaco al que se imputa la reacción.
Los ensayos in vitro de LTA demuestran el porcentaje de linfocitos muertos al enfrentarlos a concentraciones crecientes del medicamento, y se comparan con controles22,120,121. Las pruebas epicutáneas de contacto pueden realizarse 2-3 meses después de la reacción en concentraciones variables del 1-10% en petrolatum o vaselina. La negatividad de las mismas no excluye la implicación del fármaco responsable, mientras que la positividad apoya el diagnóstico69,70.
Algunas enfermedades pueden simular un SHF, principalmente otras reacciones medicamentosas, infecciones víricas (VEB, virus de la hepatitis, influenza, CMV y VIH), linfomas, seudolinfomas, linfadenopatía angioinmunoblástica, enfermedad del suero, conectivopatías y vasculitis. Sin embargo, el cuadro clínico y las pruebas complementarias de laboratorio, las pruebas de imagen, el electrocardiograma, el ecocardiograma, los LTA y las pruebas de contacto pueden ser de gran ayuda para establecer el diagnóstico.
TRATAMIENTO
El pronóstico de estos pacientes puede ser fatal hasta en el 10% de los casos, y la principal causa de muerte es el fallo hepático1,122. La primera medida es la retirada del o de los medicamentos sospechosos del SHF, evitando los fármacos que puedan tener reactividad cruzada en lo sucesivo. Considerando que la reactividad cruzada de los anticonvulsionantes aromáticos es de hasta el 75%, es imprescindible considerar otras alternativas para el control de las crisis epilépticas. La administración de otros anticomiciales, como las benzodiazepinas, la gabapentina o el ácido valproico, puede ser valorada, teniendo en cuenta que este último es hepatotóxico, especialmente en niños menores de 2 años. Otros medicamentos, como la tiagabina, el topiramato o la zonisamida, que presentan una estructura química diferente a la de los anticonvulsionantes aromáticos, puede ser viable10.
Los corticoides sistémicos constituyen el tratamiento de elección, con dosis de prednisona de 1-2 mg/kg/día, que deben mantenerse durante 10-14 días para disminuir con posterioridad de manera progresiva. Los antihistamínicos y corticoides tópicos representan un complemento en los casos con prurito intenso o afectación epidérmica y descamación, respectivamente. Los pacientes con SS/NET deben ser tratados como quemados con reposición de fluidos y medidas locales, que incluyen el uso de apósitos con suero fisiológico y antibióticos tópicos y/o sistémicos. El empleo de corticoides sistémi-cos en los pacientes que evolucionen a una NET es controvertido. En la actualidad se aboga por tratamientos con inmunoglobulinas intravenosas (IGIV), ciclosporina o ciclofosfamida110. Las IGIV en monoterapia o asociadas a esteroides sistémicos se han empleado con buenos resultados100,123,124. Aunque algunos autores refieren el uso en monoterapia de las IGIV, está lejos de convertirse en un tratamiento estándar125,126. En los casos con afectación multiorgánica grave es necesario complementar el tratamiento esteroideo con los específicos del órgano afectado: hemodiálisis, trasplante hepático, etc.
Otras alternativas a estos tratamientos se han utilizado ocasionalmente con buenos resultados. La N-acetilcisteína es un precursor del glutatión y está implicado en la detoxificación de algunos medicamentos, entre ellos los anticomiciales, e inhibe la inmunorrespuesta del SHF. Además, la N-acetilcisteína es considerada un medicamento seguro, aunque puede provocar algunos efectos secundarios como angioedema, vómitos, dolor de cabeza y crisis epilépticas127-129. La plasmaféresis se ha usado en un caso de SHF con afectación multiorgánica grave resistente al tratamiento con corticoides130.
CONCLUSIONES
El SHF es un cuadro complejo desde el punto de vista clínico que ha recibido numerosas denominaciones en la literatura médica. En la actualidad los criterios que definen el SHF englobarían a todas estas entidades, incluido el DRESS.
Los primeros casos se describieron con los antiepilépticos aromáticos, y de hecho en numerosas revisiones y artículos se denomina síndrome de hipersensibilidad a anticonvulsionantes. Hoy en día la lista de medicamentos capaces de provocar el SHF es numerosísima. La tríada de afectación cutánea, multiorgánica y fiebre es la más comúnmente aceptada, aunque en ocasiones puede describirse como un seudolinfoma. El SHF es un proceso dinámico de patogenia multifactorial en el que intervienen diferentes factores: genéticos, metabolitos tóxicos y virus principalmente, que desencadenan una respuesta inflamatoria mediada por citocinas semejante a la de otras patologías cutáneas inflamatorias.
El diagnóstico del SHF es fundamentalmente clínico, y la importancia del mismo radica en el potencial riesgo de padecer alguna complicación grave. Existen una serie de pruebas de laboratorio que pueden ayudar a confirmar el diagnóstico. Los corticoides sistémicos constituyen el tratamiento de elección, y el empleo en pacientes que evolucionen a una NET es controvertido. Las IGIV en monoterapia o asociadas a esteroides sistémicos puede ser una alternativa.