INTRODUCCIÓN
La artritis reumatoide (AR) es una enfermedad sistémica, inflamatoria, autoinmune y crónica cuya afectación principal recae sobre el tejido sinovial, fundamentalmente en las articulaciones diartrodiales. Afecta a casi el 1% de la población adulta mundial, es más frecuente en mujeres y puede ocurrir casi a cualquier edad, aunque es más habitual entre los 40 y los 70 años, y su incidencia se incrementa con la edad. Cuando la enfermedad no se diagnostica, o se hace tarde, conduce a un grado muy intenso de pérdida funcional por destrucción y deformidad articular y favorece la muerte prematura al acortar las expectativas de vida, con un incremento en la mortalidad por enfermedad cardiovascular, infección o neoplasias. Tiene un efecto social muy importante en términos de costes, discapacidad y pérdida de productividad.
La etiología de la AR permanece incierta, aunque una serie de factores genéticos, infecciosos, ambientales y hormonales estarían implicados en una compleja red de interacciones. En los últimos años la adquisición de un mayor conocimiento en los mecanismos celulares y moleculares, junto a la aplicación de la moderna biotecnología, han aportado nueva información acerca de los factores de riesgo hereditarios, de la inmunopatogénesis subyacente y de la heterogeneidad de la enfermedad relacionada con las manifestaciones tanto localizadas como sistémicas. Gracias a todo este nuevo conocimiento se han desarrollado nuevas terapias y nuevas estrategias, dirigidas hacia dianas moleculares específicas, que permiten un control eficaz de formas de la enfermedad muy activas y rápidamente progresivas. Sin embargo, el coste de esta eficacia se paga en ocasiones con el precio de los efectos adversos, muy variados, pero especialmente con la tendencia a favorecer una serie de procesos infecciosos de diferente impacto y consecuencias, lo que hace aún más amplio el concepto de tropismo que enlaza la AR con las enfermedades infecciosas y sus microorganismos patógenos.
ETIOPATOGENIA DE LA ARTRITIS REUMATOIDE Y AGENTES INFECCIOSOS
En la etiopatogenia de la AR participan tanto factores genéticos como no genéticos. La contribución genética en la AR se basa en su conocida tendencia de agregación familiar, con una mayor concordancia en gemelos monocigotos que en los dicigotos y por un mayor riesgo (de 1,2 a 10) de padecer la enfermedad en los familiares de primer grado de los pacientes respecto a la población general. Pese a ser uno de los paradigmas de enfermedad inflamatoria crónica autoinmune, el o los antígenos responsables directos de la respuesta inflamatoria no son completamente conocidos. Algunas de las teorías etiopatogénicas de esta enfermedad se basan en modelos animales, y éstos no siempre pueden extrapolarse a la situación que se da en humanos. La observación de agrupamientos geográficos de este trastorno en antiguos esqueletos implica contar con factores ambientales (todavía desconocidos) como causa de la AR en determinados grupos de población. No obstante, en la AR no siempre se establece un antecedente de origen infeccioso claro, el cual podría anticiparse durante años al comienzo de las manifestaciones clínicas.
Aunque muchas de las series de AR subrayan la importancia de una causa infecciosa subyacente, no se ha aislado ningún microorganismo, pese a los esfuerzos realizados. Entre los otros factores no genéticos ambientales, aparte de la infección, se incluyen habitualmente el hábito tabáquico, la masa corporal y el antecedente de transfusiones. Todos estos factores podrían estar conectados con una serie de procesos moleculares relacionados con el azar que desembocarían en mutaciones somáticas de genes, reordenamiento de genes de inmunoglobulinas y del receptor del linfocito T, o selección de subpoblaciones de linfocitos T, entre otros. Se ha sugerido que la interacción de múltiples factores en un huésped inmunogenéticamente predispuesto sería la causa del inicio de la sinovitis poliarticular y, una vez comenzado, el proceso podría llegar a autoperpetuarse por sí mismo. En esa línea se ha especulado que los factores infecciosos exógenos podrían actuar como desencadenantes directos de la inflamación articular, mientras que los factores genéticos modularían la expresión de la enfermedad en relación con su gravedad o cronicidad. El hecho de que la incidencia de AR se haya visto disminuir en áreas concretas constituiría un fenómeno sugestivo también de la implicación de una influencia ambiental1,2.
Posible papel de la infección
Aunque ciertos factores de riesgo, por ejemplo ser mujer o tener los epítopos de susceptibilidad, son importantes, no son suficientes para el desarrollo de la AR. Para desencadenar su inicio son necesarios varios elementos adicionales aún no bien establecidos. Entre los factores ambientales, la infección siempre ha mantenido un peso específico considerable. La implicación de distintos microorganismos en la génesis de algunas artritis humanas y en modelos animales ha provocado la hipótesis del origen infeccioso de la AR. Sin embargo, en muchos de los casos no se registra un claro antecedente infeccioso y, además, la búsqueda de estos microorganismos en largas series de pacientes con AR ha presentado un balance infructuoso o resultados inconsistentes, y las evidencias de esta asociación son meramente circunstanciales3-5.
Infección bacteriana
Los resultados de los estudios que han intentado implicar bacterias vivas en el desarrollo de la AR son insuficientes para demostrar la causalidad. Sin embargo, Deighton et al6 han podido relacionar la presencia de anticuerpos específicos frente a Proteus mirabilis con valores elevados de proteína C reactiva en esta población, sugiriendo un posible rol en la patogenia de la inflamación.
Infección por especies de micoplasmas
La infección por especies del género Mycoplasma ha sido propuesta como un posible desencadenante de AR, aunque los intentos para cultivar o detectar ADN de estos microorganismos en muestras de líquido sinovial utilizando técnicas de reacción en cadena de la polimerasa (PCR) han obtenido resultados contradictorios7-9.
Virus
Los estudios que han evaluado los virus como posibles factores etiológicos entre los pacientes con AR han ofrecido resultados más rentables que los efectuados con bacterias. Por ejemplo, en muestras de tejido sinovial se han detectado antígenos del virus de la rubéola y secuencias de nucleótidos de adenovirus. También los linfocitos de varios pacientes han sido activados fácilmente por antígenos de citomegalovirus10. Aunque, sin duda, las investigaciones que han permitido construir las mejores hipótesis entre los factores etiológicos y la patogénesis de la enfermedad han sido las que valoran la reacción cruzada de diferentes antígenos con proteínas endógenas, como se aprecia en los siguientes comentarios de algunos virus.
Virus de Epstein-Barr (VEB). Esta relación ya fue planteada con el hallazgo en 1975 de un anticuerpo en el suero de pacientes con AR que reaccionaba con un antígeno nuclear del VEB11-12. Otros datos adicionales que apoyarían esta relación podrían ser los siguientes: a) El receptor del VEB sobre los linfocitos B es el receptor del complemento tipo 2; b) el VEB es un activador policlonal de los linfocitos B, incluyendo los que expresan el factor reumatoide; c) existe una supresión defectuosa de las células B infectadas por las células T específicas del VEB; d) los pacientes con AR poseen una respuesta inmune celular y humoral incrementada frente a antígenos del VEB, Brucella ovis y Lactobacillus lactis que contienen la secuencia QKRAA, la cual es la misma que se encuentra en el alelo HLA-DR asociado con la AR13; e) la membrana sinovial de los pacientes con AR almacena ARN del VEB en mayor número de ocasiones cuando se compara con la de los pacientes con artritis no reumatoide14, aunque este punto presenta alguna controversia puesto que otros autores no han encontrado evidencia de ARN del VEB en células de la sinovial de enfermos con AR, excepto en linfocitos B "atípicos"15, y f) los pacientes con AR pueden tener una carga viral del VEB alta, como se determinó en un estudio de 84 pacientes con AR, comparados con 69 controles sanos y con 22 con otras enfermedades reumáticas16. La carga viral de ADN del VEB se incrementó en casi 10 veces en pacientes con AR, permaneció estable en el tiempo y no estuvo influida por el tratamiento con fármacos antirreumáticos modificadores de la enfermedad. Una pequeña proporción de linfocitos T de sangre periférica de pacientes con AR fueron estimulados por la glucoproteína 110 del VEB, y esta reactividad fue inversamente proporcional a la velocidad de sedimentación globular (VSG)17.
Parvovirus. Los datos sobre el papel de los parvovirus humanos en la AR son más controvertidos. En un estudio se detectó ADN de parvovirus B19 humano en el tejido sinovial de 30 de 39 pacientes japoneses con AR, y sólo en unos pocos con osteoartrosis o artritis traumática18. Además, el antígeno VP-1 del parvovirus B19 se halló en todas las sinoviales estudiadas (27 de 27), frente a ninguna de la sinovial de los casos con artrosis o traumatismo. Por el contrario, las muestras de membrana y de líquido sinovial de 30 pacientes italianos con AR y muestras similares de 24 pacientes con artrosis no mostraron un incremento significativo de la prevalencia de ADN viral19. La sinovial de los pacientes con AR y de los controles con artrosis fueron positivas para secuencias de ADN viral en el 37 y el 50%, respectivamente; el ADN viral estuvo presente en el líquido sinovial del 33 y del 21%.
Retrovirus. Existe un interés cada vez mayor por el papel de los retrovirus tanto como causa como factor amplificador de la AR, puesto que estos agentes aportan todos los mecanismos requeridos para generar una sinovitis inflamatoria y proliferativa crónica. Un retrovirus podría impulsar una AR mediante la activación eventual de los linfocitos T y de las células sinoviales simultáneamente, y quizás con la contribución de los superantígenos derivados de sus propias proteínas. El virus linfotropo T humano tipo I (HTLV-I), agente etiológico causante del linfoma/leucemia de células T del adulto, se ha asociado ocasionalmente con una artropatía inflamatoria en Japón20. Por ejemplo, las mujeres con AR de la ciudad de Nagasaki tienen una seroprevalencia del HTLV-I 5 veces más alta que los controles21. Pero ninguno de los datos sugiere que este virus sea su causa, y es más probable que el HTLV-I sea otro de los factores predisponentes, aumentando la producción de factor de necrosis tumoral alfa (TNF-α) por las células sinoviales y el sistema monocito-macrófago22. El ADN proviral del retrovirus humano 5 se ha detectado también en el tejido sinovial de pacientes con AR, lupus eritematoso sistémico y otras enfermedades autoinmunes23. El papel exacto de estos retrovirus en la AR, así como en otros procesos, es aún incierto.
Por todo lo expuesto, en la actualidad se acepta que si bien en algunos casos puede ocurrir que una infección favorezca una alteración inmunológica capaz de iniciar la AR, no se dispone de datos objetivos definitivos que establezcan una etiología infecciosa como factor principal en el origen de la AR, y parte de su influencia podría estar mediada en forma de superantígenos, como se comenta a continuación.
Superantígenos y proteínas del shock caliente
Habitualmente, un antígeno específico presentado en el contexto de los antígenos celulares de superficie del sistema HLA-II suele activar una de cada 10.000 células T. Sin embargo, existen unas moléculas, llamadas superantígenos, que pueden activar múltiples clones de células T (una de cada 10 células) a través de procesos en gran parte independientes del complejo mayor de histocompatibilidad (CMH). Como ejemplos de superantígenos están las toxinas estafilocócicas y estreptocócicas y las denominadas proteínas del shock caliente (HSP). Estas últimas son proteínas intracelulares inducidas por estímulos ambientales como el calor, las partículas infecciosas y el estrés oxidativo, y se encuentran muy conservadas entre diferentes especies. Las HSP parecen tener una función intracelular de estabilización de la estructura molecular y de la función de otras proteínas, y actúan a modo de chaperonas.
El mayor conocimiento de las HSP ha permitido relacionar en algunos aspectos la AR y la infección. Inicialmente se descubrió que un componente de Mycobacterium tuberculosis usado para producir una "artritis adyuvante" en ratas era una HSP de 65 kD24. Posteriormente, 2 hechos indirectos han apoyado esta asociación: a) la proteína de 65 kD activa los linfocitos de pacientes con AR25, y b) los anticuerpos frente a la HSP humana son producidos por linfocitos B del tejido sinovial reumatoide transformados por el VEB26. La hipótesis más plausible, que implica a las HSP como factores causales, es la de que estas proteínas comparten determinantes antigénicos con otras proteínas del huésped, por lo que pueden dar lugar al desarrollo de anticuerpos con reacción cruzada capaces de inducir una respuesta autoinmune (por mimetismo molecular). Como ejemplo, 2 proteínas que comparten el "epítopo de susceptibilidad" (QKRAA) sobre HLA-DRB1*0404 son la glucoproteína 110 del VEB y la dnaJ de Escherichia coli. Esta última molécula es una HSP fuertemente antigénica. Los anticuerpos específicos frente a dnaJ reaccionan cruzadamente con células DRB1*0401 (Dw4), pero no con las que expresan otros alelos27.
Por reacción cruzada, algunos individuos con HLA-DR4, en los cuales las células T se desvían hacia el epítopo QKRAA a causa de una selección positiva, pueden desarrollar una respuesta autoinmune sistémica mediante producción de anticuerpos con alta afinidad contra QKRAA. Estos anticuerpos podrían conducir hacia la autoperpetuación de la sinovitis. Otras células que expresan HLA-DR4 podrían no tener una población celular T periférica desviada hacia QKRAA y, por tanto, no desencadenarían una respuesta inmune suficiente para generar sinovitis28. No se conoce por qué la respuesta inmune primaria en la AR se centra dentro de la sinovial.
INFECCIONES EN LA ARTRITIS REUMATOIDE PER SE
La relación entre los pacientes con AR y el desarrollo de infecciones durante la evolución de la enfermedad presenta cada vez más interesantes puntos de controversia. Dos estudios clásicos ponen en duda que los pacientes con AR tengan mayor incidencia de infección que otras poblaciones. En 1987, Vandenbroucke et al29 no hallaron diferencias entre la incidencia de infección genitourinaria y pulmonar en mujeres posmenopáusicas con AR y en pacientes con artrosis y enfermedades del tejido conectivo. En la misma línea, un año después, Van Albada-Kuipers et al30 tampoco pudieron demostrar diferencias significativas en la incidencia de infecciones entre 448 pacientes con AR y 185 con artrosis y enfermedades del tejido conectivo. Sin embargo, otros trabajos clásicos, realizados antes del uso de corticosteroides, presentaban resultados contrarios31. Más tarde, Wolfe et al32 describieron una incidencia de infección considerablemente más alta en los pacientes con AR que en pacientes control de la misma edad y sexo (6,2 veces superior). También Doran et al33 obtuvieron resultados en la misma línea. Ellos estudiaron una cohorte de pacientes de Minnesota que comparaba 602 enfermos con AR y 609 controles de la misma edad, sexo y número de ingresos hospitalarios. Se describió un aumento del riesgo de padecer infección asociado a la AR de 1,70 (intervalo de confianza [IC] del 95%, 1,42-2,03) y 1,59 (IC del 95%, 1,28-1,97) en las infecciones que precisaron hospitalización. La artritis séptica, la osteomielitis y la infección de piel y de partes blandas fueron las infecciones más frecuentes en los pacientes con AR.
Las diferencias halladas en estos estudios son resultado de los diferentes métodos aplicados en cada uno de ellos, en concreto en la selección de los pacientes del grupo control. En los 2 primeros estudios los pacientes control tenían artrosis o enfermedades del tejido conectivo y, por tanto, son una muestra sesgada de la población general. Estos pacientes podrían por sí mismos tener factores favorecedores de infección. Además, el seguimiento de los pacientes era muy corto. En conjunto, el análisis de los resultados sugiere que la población con AR tiene una tasa de infección superior a la de la población sin AR de su misma edad y sexo.
¿Qué incidencia de infecciones, pues, debe esperarse en los pacientes con AR? En unos datos descritos por Hernández-Cruz et al34, la incidencia de infección se situó en 17 nuevas infecciones por cada 100 pacientes/año de seguimiento. Un estudio posterior mostró que 3,1 de cada 100 pacientes con AR-año precisarían ingreso hospitalario como consecuencia de estas infecciones35. Más recientemente, en la cohorte de Minnesota que analizó pacientes desde el año 1955 hasta 1994, la incidencia de infecciones confirmadas se cifró en 19,64/100 pacientes-año, mientras que la necesidad de ingreso fue de 9,57/100 pacientes-año33.
Factores de riesgo de infección
Las alteraciones de base en el sistema inmunitario, la presencia de comorbilidad, la gravedad de la AR, las alteraciones debidas a procedimientos instrumentales, a hospitalizaciones, a cirugía y a artroplastias y, sobre todo, el uso de medicaciones inmunosupresores son factores relacionados con el aumento de incidencia de infecciones en estos pacientes.
Como se ha comentado anteriormente, la patogénesis de la AR no está bien establecida, pero se conoce que desde las fases iniciales de la enfermedad existe una alteración en la homeostasis de las células T. Esta disfunción no sólo se manifiesta como una hiperproducción de células T a nivel articular, sino también como una depleción de los linfocitos T circulantes36 y una alteración en su dinámica37. Aunque no existen estudios definitivos al respecto, estas alteraciones en la inmunidad celular, que se manifiestan sobre todo ante nuevos estímulos, podrían justificar una respuesta alterada ante la infección. A su vez, también se han descrito alteraciones en la inmunidad humoral que incluyen una pérdida de tolerancia de los linfocitos B, con la consecuente e inapropiada producción de autoanticuerpos38. Las relaciones entre la inmunopatogénesis de la AR y el aumento de riesgo de infección deberán ser exploradas en los próximos años.
Los pacientes con AR presentan con frecuencia comorbilidades39,40. La diabetes mellitus, el alcoho-lismo, la leucopenia y la enfermedad pulmonar crónica no son infrecuentes, y su relación con la infección está ampliamente documentada en la literatura. Un estudio de Doran et al39 que analiza los factores de riesgo de infección en los pacientes con AR describe que el riesgo relativo de tener infección en esta población aumenta a 1,60, 1,67, 1,91 y 1,84, respectivamente, ante la presencia de cada una de las citadas comorbilidades.
La gravedad de la AR medida por la presencia de factor reumatoide positivo, nódulos reumatoides, manifestaciones extraarticulares, incremento de la velocidad de sedimentación globular y deterioro del estado funcional, también se correlacionó de forma importante con la infección39. Previamente, la inmovilidad o las deformidades propias de la enfermedad ya se habían relacionado con un aumento de la prevalencia de infección, básicamente a expensas de la artritis séptica41. El deterioro funcional de estos pacientes contribuye a una mayor necesidad de hospitalizaciones, procedimientos instrumentales, cirugía y prótesis articulares, lo que incrementa aún más el riesgo de infección. Las infecciones relacionadas con estos procesos se analizan más adelante de forma exhaustiva.
Por último, el factor de riesgo de desarrollo de infección más importante en estos pacientes sigue siendo el uso de tratamientos inmunosupresores. En ausencia de un tratamiento curativo de la AR, el tratamiento farmacológico de elección en estos pacientes se basa en una escala terapéutica que incluye antiinflamatorios no esteroideos, corticoides a dosis bajas y fármacos antirreumáticos modificadores de la enfermedad (FAME). La práctica totalidad de los pacientes con AR precisan FAME42. El metotrexato, la ciclofosfamida, la azatioprina y la ciclosporina son los FAME que se han relacionado directamente con el aumento de riesgo de infección, mientras que esta relación pierde importancia con el resto de fármacos (sulfasalazina, sales de oro, hidroxicloroquina y leflunomida)43,44.
El metotrexato es el fármaco recomendado en todos los pacientes que no han recibido previamente ningún FAME. Se ha demostrado que dosis elevadas, como las que se utilizan en tratamientos quimioterápicos, producen una clara inmunosupresión. Aunque las dosis utilizadas habitualmente en AR son significativamente menores, también se han asociado a alteraciones del sistema inmune tales como disminución de la producción de inmunoglobulinas, de la secreción de citocinas, y alteraciones de la inmunidad celular y de la función de los neutrófilos45,46. Clásicamente, el porcentaje de infecciones atribuibles al uso de metotrexato se estableció entre el 0 y el 20%47,48. Entre ellas, se han descrito tanto casos de infecciones convencionales como de infecciones oportunistas, y las más frecuentes entre estas últimas son la neumonía por Pneumocystis jirovecii y el herpes zoster. Menos frecuentemente se han descrito casos de listeriosis, nocardiosis, tuberculosis, criptococosis, histoplasmosis, aspergilosis, herpes zoster y citomegalovirosis34,47,49-53. Sin embargo, en los últimos años diferentes estudios debaten el papel del metotrexato como agente promotor de infecciones. Por un lado, Singh et al43 analizaron las diferentes toxicidades de 7 FAME en 2.479 pacientes con AR. Entre sus conclusiones destacan que los pacientes en tratamiento con metotrexato o ciclosporina tuvieron un mayor riesgo de infección que los tratados con otros FAME43. El metotrexato también se asoció a infección y a recurrencia de la infección en el estudio de Hernández-Cruz et al34. Se detectaron 211 infecciones entre 1.274 pacientes-año (con incidencia de 0,17 nuevas infecciones por paciente-año), y en el análisis por regresión logística se mostró que las variables asociadas con infección fueron la dosis acumulativa de metotrexato, el tiempo de toma de corticoides y la dosis media de D-penicilamina34.
En contraposición, en un estudio prospectivo de Van der Veen et al54 se describió un aumento de la incidencia de infecciones del 1,52 (IC del 95%, 1,04-2,22) en los 228 pacientes tratados con metotrexato, pero estos resultados carecieron de significación estadística al ajustarse por gravedad de la enfermedad. De forma similar, Boerbooms et al47 sugirieron que las infecciones asociadas al uso de metotrexato ocurrían mayoritariamente en pacientes con AR avanzada y en el primer año y medio. Sin embargo, no pudieron demostrar diferencias en la frecuencia de infecciones en pacientes tratados con metotrexato o con azatioprina, salvo ajustando por gravedad la AR. El uso de metotrexato tampoco se correlacionó con una mayor incidencia de infecciones en un estudio de 609 pacientes con AR realizado por Doran et al39. En resumen, parece que el riesgo de infección con dosis bajas de metotrexato es poco significativo y probablemente se ve potenciado por otros factores, como el uso concomitante de corticoides, la comorbilidad o la gravedad y el estadio de la AR.
Existen menos dudas sobre el papel inmunosupresor de otros FAME, como la ciclofosfamida. Ésta causa un descenso en la producción de neutrófilos y un incremento de su destrucción55. Por ello, la causa más frecuente de retirada del tratamiento es la leucopenia42. La neumonía grave por microorganismos como Staphylococcus aureus, Haemophilus influenzae y Pseudomonas aeruginosa, o las infecciones fúngicas se han relacionado con el uso de este fármaco56,57. Las complicaciones infecciosas se observan fundamentalmente en el transcurso de la neutropenia secundaria al uso del fármaco, con la asociación de esteroides y según la gravedad de la enfermedad de base58-59. La ciclosporina interfiere en la activación de los linfocitos T y produce un déficit de inmunidad celular60. En pacientes con AR este fármaco suele darse siempre en combinación, por lo que es difícil establecer su peso específico en el desarrollo de infecciones. La azatioprina interacciona con el sistema inmune en diferentes niveles y produce disminución de la síntesis de inmunoglobulinas, alteración de la función linfocitaria y supresión de la actividad de la médula ósea58. Aun así, el efecto inmunosupresor que produce es menor que el de otros FAME (ciclofosfamida o metotrexato), y resulta excepcional la descripción de infecciones oportunistas en pacientes en tratamiento único con azatioprina58.
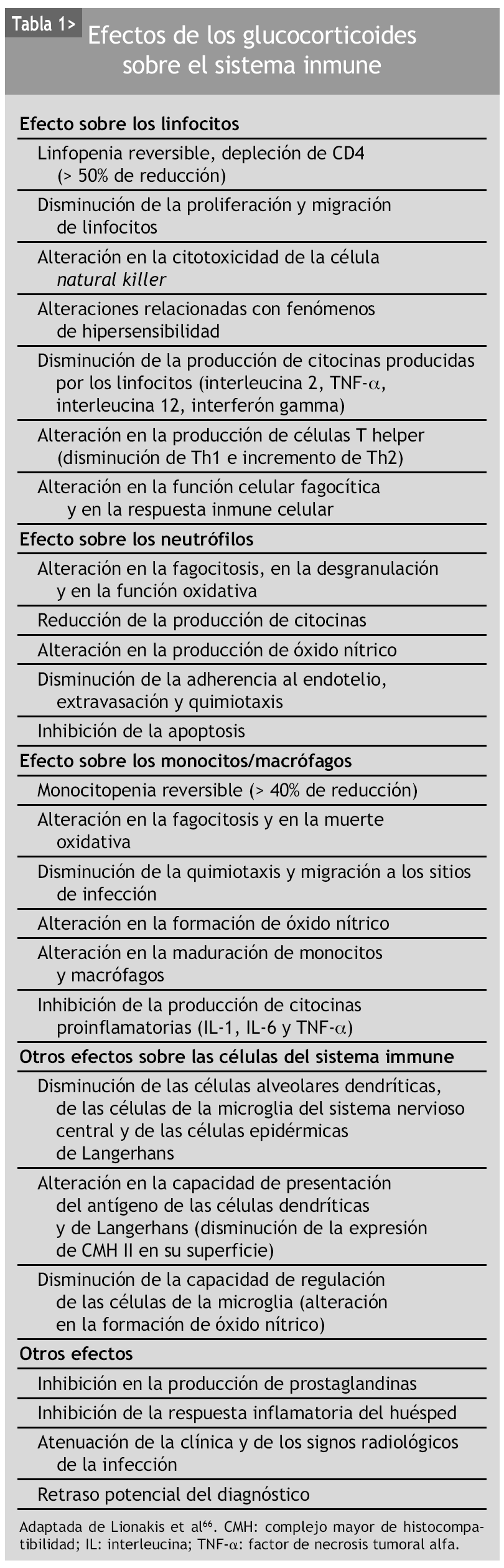
El tratamiento crónico con glucocorticoides sigue relacionándose con un amplio espectro de infecciones, mayoritariamente oportunistas, como por ejemplo tuberculosis, nocardiosis, candidiasis, aspergilosis, criptococosis y neumonía por P. jirovecii61-66. Los efectos de los glucocorticoides sobre el sistema inmune son múltiples, complejos y no siempre bien conocidos. Los glucocorticoides actúan sobre la inmunidad celular y humoral. La tabla 1 muestra algunos de los efectos más importantes de los glucocorticoides en la disfunción del sistema inmune.
Concretamente, en pacientes con AR, Saag et al67 describieron un aumento de la infección asociado a la corticoterapia 8 veces mayor. Stuck et al68 realizaron un metaanálisis de 71 estudios que aleatorizaban a los pacientes con AR a tomar o no glucocorticoides, y el riesgo relativo de desarrollar una infección fue de 1,6 (IC del 95%, 1,3-1,9) en el grupo de pacientes con corticoterapia. Dos estudios posteriores mostraron que no sólo se producía un aumento de la incidencia de infecciones, sino que además éstas eran de mayor gravedad y con mayor frecuencia de recidivas33,34. Con todo ello, parece evidente que los glucocorticoides desempeñan un papel importante en la infección de los pacientes con AR y que, por tanto, sus dosis deberían ajustarse a las mínimas necesarias e interrumpirlos tan pronto como fuera posible.
¿Se puede disminuir el riesgo de infección asociado al uso de glucocorticoides? El estudio de Stuck et al68 sugiere que el riesgo de infección disminuye en los pacientes con dosis menores de 10 mg/día o dosis totales acumuladas de menos de 700 mg. En la misma línea, un estudio últimamente publicado que valora la efectividad de dosis bajas de glucocortocoides (menos de 10 mg/día) en los pacientes con un diagnóstico reciente de AR69, muestra que no se observan diferencias en la incidencia de infecciones entre los pacientes tratados con estas dosis y los pacientes no tratados con esteroides. Sin embargo, Wolfe et al70, basándose en un estudio de 16.788 pacientes seguidos 2 veces al año durante 3,5 años en el que describen los factores de riesgo de infección pulmonar en los pacientes con AR, sugieren que sólo dosis menores de 5 mg/día disminuyen el riesgo de infección. Otro aspecto que merecería ser estudiado en los próximos años es determinar si estrategias como el uso de glucocortocoides, a días alternos o "en pulsos", puede disminuir este riesgo58,71,72.
Por otro lado, las guías americanas de prevención de la tuberculosis sugieren que a todo paciente que deba recibir más de 15 mg/día de prednisona durante más de un mes se debería descartar previamente una infección tuberculosa latente (ITL). Aunque por el momento no existen estudios que precisen el impacto de esta estrategia de prevención, a muchos clínicos nos parece una medida imprescindible. Jick et al73 cuantificaron el riesgo de padecer tuberculosis en más de 5 veces superior al resto de la población en pacientes sometidos a tratamiento corticoideo crónico con dosis de 15 mg/ día. Este riesgo se mantenía 3 veces superior con dosis de 7,5 mg/día. Además, una vez iniciado el tratamiento corticoideo, la fiabilidad y la rentabilidad de la prueba de la tuberculina (o de Mantoux) disminuye, dado que aumentan los falsos negativos por un mecanismo de anergia provocada74. Por todos estos motivos, antes de iniciar el tratamiento parece imprescindible realizar la prueba de la tuberculina en todos los pacientes que deban recibir corticoides, de la misma forma que se lleva a cabo en otros pacientes que van a ser inmunosuprimidos farmacológicamente. La prueba de Mantoux debe evaluarla una persona entrenada y experta; en estos pacientes, según la mayoría de guías y recomendaciones, se considera positiva si la induración alcanza un diámetro entre 5-9 mm75-79. En ese caso, se aconseja iniciar profilaxis con isoniazida a dosis de 5 mg/kg/día con una duración de entre 6 y 9 meses, independientemente de la edad del paciente.
Características de las infecciones
Como hemos apreciado, los pacientes con AR presentan varias características especiales: alteraciones en la inmunidad de base, uso de inmunosu-presores y un contacto estrecho con el entorno hospitalario. Todos estos factores influyen no sólo en la frecuencia de las infecciones, sino también en las características y aspectos cualitativos de las mismas. Las infecciones pueden ser convencionales u oportunistas, y se debe tener en cuenta que los microorganismos causantes pueden estar in-fluidos por la relación con el ámbito sanitario, impregnándose del carácter nosocomial. Las infecciones pulmonares, las infecciones del tracto urinario y las cutáneas son, al igual que en la población general, las infecciones más frecuentes en estos pacientes33,57, aunque sin duda las infecciones articulares son las que conllevan una mayor preocupación y, por ello, se tratan más adelante en profundidad.
La neumonía es una de las causas más importantes de mortalidad en los pacientes con AR32. Los factores antes comentados, como la inmunosupresión farmacológica, la diabetes o las enfermedades crónicas pulmonares de estos pacientes, favorecen estas infecciones. No existen, sin embargo, estudios que comparen las etiologías o el pronóstico de los pacientes con AR y neumonía con las de otros pacientes sin AR. Las infecciones pulmonares oportunistas, como consecuencia del uso de terapias biológicas, se analizan más adelante. Es importante recordar que los pacientes con AR seguramente se beneficiarán de la vacunación antigripal con carácter anual, y probablemente de la vacunación antineumocócica.
No está demostrado que los pacientes con AR tengan una mayor prevalencia de infecciones urinarias que la población general33. Al igual que ocurre con las infecciones respiratorias, no existen datos para conocer con exactitud la etiología y el patrón de resistencias de los microorganismos implicados en estas infecciones en la AR, pero se sabe que en la mayoría de los casos se trata de infecciones no complicadas y que no precisan ingreso hospitalario.
Las infecciones de la piel y de sus anejos también son frecuentes, sobre todo las infecciones fúngicas causadas por dermatofitos y por levaduras y que dan lugar a micosis cutáneas (intertrigos) y onicomicosis. Aunque estas infecciones no suelen conllevar problemas sistémicos, sí pueden ser molestas y difíciles de erradicar. Los pacientes con síndrome de Felty (leucopenia, esplenomegalia y artritis crónica deformante) tienen una alta incidencia de infecciones cutá-neas. Entre los agentes causales destacan especies de estreptococos, estafilococos, bacilos gramnegativos (como Pseudomonas aeruginosa) y hongos80.
Infecciones articulares y artritis séptica en la artritis reumatoide
La AR incrementa los riesgos y la frecuencia de padecer artritis séptica respecto a la población general81,82. La incidencia descrita de infección articular varía de 2 a 5/100.000/año en la población general a 28 a 38/100.000/año en pacientes con AR, y llega a ser de 40 a 68/100.000/año en pacientes con prótesis articulares. Ocurre con más frecuencia en estadios avanzados de la AR33. La artritis séptica es una complicación grave, puesto que el porcentaje de muertes alcanza del 10 al 25%, y un 25 a 50% de los enfermos padecerán algún grado de secuelas con pérdida de la función articular83,84. La sinovitis crónica, la estructura anómala de la articulación, las infiltraciones intraarticulares de corticoides y, en ocasiones, la presencia de artroplastias incrementan el riesgo de infección articular. Nolla et al85 relacionan este riesgo de padecer artritis séptica con la gravedad de la AR y el uso de corticoides. Entre los factores promotores destacan el déficit de aporte vascular a las articulaciones, la alteración de la fagocitosis por los polimorfonucleares en la articulación desestructurada, la falta de expresión de receptores C3 del complemento en la superficie celular y el aumento en el paso de bacterias a la articulación por discontinuidad de la barrera hematoarticular86. Además, las infecciones de la piel y de los tejidos blandos son un factor favorecedor de artritis séptica y suele establecerse la correlación por los cultivos congruentes de ambas áreas. La integridad de los tegumentos está comprometida por la deformidad articular, los nódulos reumatoides y la atrofia secundaria a los tratamientos. Para reducir el riesgo de artritis séptica en los pacientes con AR deben extremarse las medidas de profilaxis y de tratamiento apropiado de las infecciones cutáneas.
La artritis séptica espontánea es la infección más frecuente en pacientes con AR, y ocurre más habitualmente en los que reciben tratamiento con corticoides o metotrexato. El foco de origen de los microorganismos implicados no siempre llega a conocerse, aunque los más frecuentes suelen ser la piel, la cavidad orofaríngea y los tractos respiratorio, gastrointestinal y urinario. La semiología local o general puede quedar enmascarada por el propio tratamiento antiinflamatorio o por la confusión de los síntomas y signos con los propiamente debidos a la AR, por lo cual puede haber formas de presentación atípicas. Otro factor de confusión es que, a veces, la infección puede ser poliarticular (30-45%)87. Uno de los mayores problemas de esta infección lo constituye, pues, el retraso diagnóstico. Las articulaciones afectadas con más frecuencia son la rodilla (25-40%), el codo (10-20%) y la muñeca (10-25%). En cerca del 80-95% de los episodios se suele aislar el microorganismo causal en el cultivo del líquido sinovial, y S. aureus es el más frecuentemente implicado, con cerca del 70% de los casos. El grupo restante está constituido por especies de estreptococos (10-15%), en concreto Streptococcus pyogenes, S. agalactiae, estreptococos betahemolíticos de los grupos C y G, S. pneumoniae y bacilos gramnegativos (8%)87-89. Otros microorganismos, como pueden ser Listeria monocytogenes, Salmonella spp., Pasteurella multocida, anaerobios y especies de Candida, conforman un grupo variado de descripciones anecdóticas en la AR.
Sin olvidar la práctica de los hemocultivos, la artrocentesis sigue siendo la técnica de elección para el diagnóstico clínico y microbiológico, y puede obtenerse información útil con la misma tinción de Gram en el 50 al 75% de los casos. El tratamiento incluiría el drenaje de la articulación y la antibioterapia empírica, que debería ofrecer una buena cobertura frente a los microorganismos antes citados. No obstante, una revisión extensa sobre los procedimientos diagnósticos de la artritis séptica y su manejo terapéutico escapan a la intención y al espacio disponible en esta ocasión, y remitimos al lector a otros artículos recientes80,90.
INFECCIONES ARTICULARES EN RELACIÓN CON MANIOBRAS MEDICOQUIRÚRGICAS
La necesidad ocasional de realizar en los pacientes con AR diferentes técnicas invasoras de las articulaciones afectadas con carácter diagnóstico o terapéutico conlleva también de forma inherente un riesgo no precisamente minúsculo. Puede distinguirse, pues, entre las artritis sépticas que aparecen a consecuencia de procedimientos instrumentales invasores o quirúrgicos, y las debidas a la implantación de una prótesis articular.
Artritis séptica tras procedimientos instrumentales invasores
Principalmente relacionadas con procedimientos como las artrocentesis, en ocasiones repetidas, o las artroscopias, las artritis sépticas que derivan de estas maniobras deberían ser poco frecuentes bajo las condiciones apropiadas de manipulación aséptica, estimándose en una frecuencia de 1 por cada 10.000-20.000 procedimientos. No obstante, cuando ocurren son complicaciones graves y configuran, aproximadamente, el 2% de los casos de artritis séptica en pacientes con AR91,92. Las tasas globales de complicaciones postartroscopia en todo tipo de pacientes son generalmente bajas (0,1-0,6% de los procedimientos), y son muy raras las complicaciones infecciosas articulares o de la herida (0,01-0,48% de las artroscopias)93. Sin embargo, cuando ocurren generan una importante morbilidad, ya que requieren reingreso en el hospital, una operación adicional como mínimo y un tiempo de tratamiento antibiótico prolongado, ya sea intravenoso y/o por vía oral. La recuperación puede ser también larga y con resultados funcionales de la articulación subóptimos. Esto conlleva un coste significativo para el paciente y para el sistema sanitario. Los factores de riesgo incluyen el uso de corticoides por vía intraarticular, un tiempo de torniquete prolongado, la edad mayor de 50 años, la preparación inadecuada del área quirúrgica antes de la conversión a artrotomía, la complejidad del procedimiento y una historia de maniobras previas repetidas en la misma articulación. Se han descrito algunos brotes de infección postartroscopia relacionados con quebrantamiento de las medidas de control de la infección o con instrumental contaminado.
Muchos de los microorganismos causales que producen este tipo de artritis postinstrumentación son flora cutánea colonizadora primaria. Entre el 25 y el 50% de estos episodios son causados por S. aureus, y el resto por estafilococos negativos para la coagulasa (ECN), estreptococos del grupo viridans, especies de Corynebacterium y Propionibacterium acnes, por todo lo cual es necesario extremar cuidadosamente la preparación cutánea y llevar a cabo una técnica estéril cuando se realizan estos procedimientos. Estas bacterias colonizadoras de la piel pueden ser reconocidas como verdaderos patógenos en este tipo de infecciones, y sus aislamientos no deberían ser despreciados cuando se encuentran en cultivos de muestras de una articulación afectada de esta forma. Con estas bacterias "menos virulentas" se han descrito cursos clínicos de la artritis más indolentes, por lo cual el índice de sospecha debe ser más alto en pacientes con lenta recuperación y una molestia persistente. También pueden producirse este tipo de artritis por microorganismos contaminantes de las soluciones (anestésicos, corticoides, antiinflamatorios) que se infiltran en la bursa sinovial o en la propia articulación, especialmente bacilos gramnegativos (tanto enterobacterias como bacilos no fermentadores), pero también micobacterias ambientales (algunas de crecimiento rápido, como el complejo Mycobacterium fortuitum-cheloneae-abscessus) y algunos hongos.
La mayoría de los pacientes con infecciones articulares postinstrumentación son tratados con una estrategia de combinación médica y quirúrgica93. Sólo los pacientes con una mínima infección de la puerta de entrada se beneficiarían de un tratamiento antibiótico oral, sin desbridamiento. Todos los pacientes con infecciones más importantes deberían recibir ciclos prolongados de antibióticos por vía intravenosa (de 2 a 6 semanas, según autores) seguidos de antibioterapia oral, y pueden requerir irrigación y lavado de la articulación, artroscópicamente o con artrotomía abierta, aunque algunos se pueden manejar sólo con múltiples aspiraciones.
Artritis séptica sobre prótesis articular
Para conservar o recuperar parte del funcionalismo de grandes articulaciones, como la cadera o la rodilla, muchos de los pacientes con AR avanzada se someten a la implantación de una prótesis articular. La frecuencia de infección de este tipo de prótesis oscila entre el 1 y el 3% de las artroplastias, y es algo mayor para la rodilla que para la cadera. Un total del 5 al 7% de los pacientes sometidos a una artroplastia total de cadera o de rodilla tienen una AR de forma subyacente94. La AR constituye uno de los clásicos factores de riesgo implicados en la infección primaria de prótesis articular según algunos estudios95-98, aunque otros no lo han demostrado. Aunque a juicio de algunos autores el riesgo de infección de una prótesis articular no es significativamente mayor en el paciente con AR ni adquiere peculiaridades especiales que la diferencien de la que ocurre con otros grupos de pacientes, el resultado de la artroplastia en estos enfermos no está claramente dilucidado, en parte porque las cohortes de pacientes con infección de la prótesis habían incluido pocos enfermos con AR99-101.
En un estudio retrospectivo recientemente publicado, si bien referido a un período de tiempo más antiguo pero amplio (desde 1969 a 1995), se incluyeron 160 pacientes con AR con un total de 200 episodios primarios de infección de prótesis articular102. A diferencia de otras series generales en las que preponderaban los ECN como principales agentes etiológicos, en este estudio fue S. aureus el microorganismo más frecuentemente aislado, que causó el 37% de las infecciones protésicas. Le siguieron, en orden de frecuencia, los ECN (12%), los bacilos gramnegativos aerobios (11%), los anaerobios (8%) y especies de Enterococcus (4%). La infección se consideró polimicrobiana en el 15%. De estos episodios, el 23% fueron tratados con desbridamiento y retención de los componentes protésicos, el 19% con un recambio en dos tiempos, y el 37% con artroplastia de resección. Las tasas de supervivencia a 5 años libre de fracaso terapéutico para pacientes con episodios de infección protésica articular tratados con desbridamiento y retención de los componentes, recambio en dos tiempos y artroplastia de resección fueron del 32, del 79 y del 61%, respectivamente. El tipo de procedimiento quirúrgico fue así la única variable clínica analizada que se asoció con fracaso del tratamiento. La duración media entre la implantación de la prótesis y el diagnóstico de infección fue de 25 meses (rango, 9 meses a 5 años), por lo que en esta serie la mayoría de infecciones protésicas podrían clasificarse en los grupos patogénicos tipo II (infección crónica tardía) y tipo III (hematógena). Este hecho es importante, puesto que puede influir en el tipo y distribución de los microorganismos patógenos causantes de la infección. Entre los agentes más infrecuentes de artritis protésica pueden encontrarse infecciones por micobacterias, tanto tuberculosas como atípicas, y por hongos del género Candida103,104, en los cuales suele ser necesaria, por no decir obligatoria, la retirada de la prótesis para conseguir su curación definitiva105.
Más allá del tropismo infeccioso en la AR, una serie de revisiones muy completas permitirán al lector profundizar en los aspectos diagnósticos, terapéuticos y de prevención de las infecciones de prótesis articulares106-109.
INFECCIONES ASOCIADAS AL USO DE TERAPIAS BIOLÓGICAS
El TNF-α es una citocina inflamatoria que ejerce múltiples funciones. En los últimos años su papel en la fisiopatogenia de la AR ha sido clarificado y diferentes estudios demuestran que los pacientes con AR tienen concentraciones elevadas de TNF-α en el líquido articular y el suero, causando la inflamación sinovial y las alteraciones articulares secundarias110,111. Pero las acciones del TNF-α van más allá de la actividad inflamatoria. El TNF-α tiene también actividad antitumoral, antiviral y mediadora de los procesos de caquexia y de shock. Una de las funciones más importantes que ostenta es la actividad reguladora del sistema inmune112. En esta línea el TNF-α ejerce una función principal sobre el reclutamiento de las células inflamatorias hacia el lugar de la infección, promoviendo la maduración de las células inflamatorias y regulando la formación, la estructura y el mantenimiento funcional de los granulomas113-115. La acción del TNF-α varía en función de la unión con sus 2 receptores: TNFR1 (55kDa; p55) y TNFR2 (75 kDa; p75). Ambos tienen funciones similares, pero el TNFR1 es el responsable de las acciones de proliferación de los linfocitos y de formación y maduración de los granulomas116,117.
En los últimos años la aparición de tratamientos que interaccionan con determinadas citocinas inflamatorias o sus receptores, y en especial la de las moléculas que bloquean la acción del TNF-α, todas ellas conocidas como nuevas terapias biológicas, ha representado una revolución en el tratamiento de la AR. En la actualidad se dispone de 3 fármacos comercializados en España: infliximab y adalimumab, ambos anticuerpos monoclonales (quimérico y humano, respectivamente), y etanercept, que es una proteína de fusión dimérica. Sin embargo, la gran eficacia demostrada por estos tratamientos en la AR y en otros procesos inflamatorios autoinmunes se ha visto empañada por su relación con un gran número de infecciones por microorganismos convencionales, como estreptococos, estafilococos, Legionella spp., Moraxella spp., etc.118,119, aunque sin duda las de mayor trascendencia en cuanto a morbimortalidad han sido las denominadas infecciones oportunistas: listeriosis, neumonía por Pneumocystis jirovecii, aspergilosis invasiva, in-fecciones por Histoplasma spp., esporotricosis diseminadas, meningitis por Cryptococcus neoformans, citomegalovirosis diseminada, reactivaciones del virus de la hepatitis B (VHB), infecciones cutáneas por Molluscum contagiosum119-124, y la más importante, la tuberculosis125. Desde los primeros estudios que determinaron la eficacia de estos tratamientos se observó como complicación una alta frecuencia de infecciones, especialmente del tracto respiratorio126,127. En el estudio ATTRACT, el 44% de los pacientes tratados con infliximab precisaron tratamiento antibiótico, mientras que en el grupo control el consumo de los mismos se observó sólo en el 35%128. Sin embargo, en estos estudios no se hallaron diferencias significativas en la frecuencia de infecciones que precisaron hospitalización.
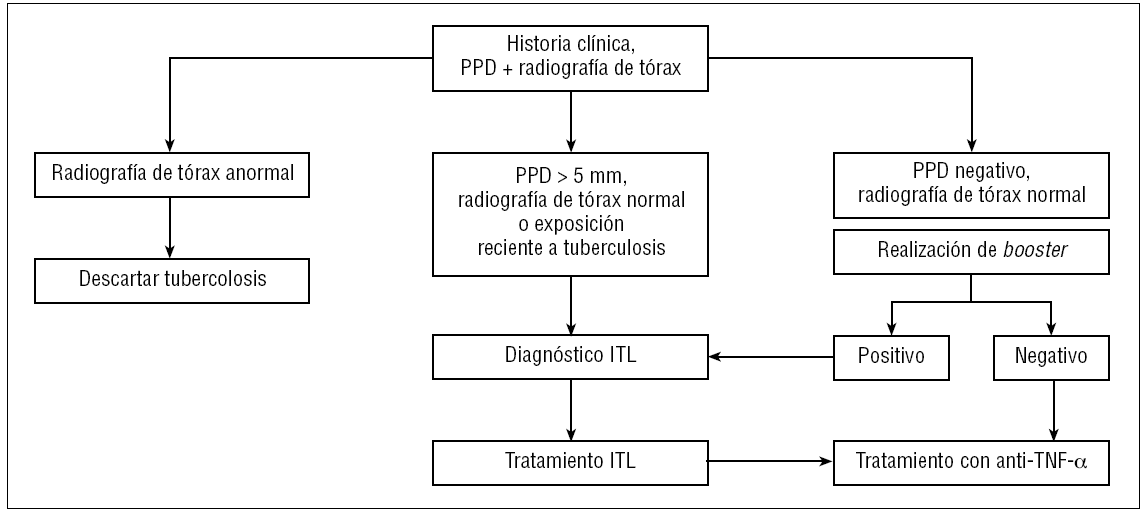
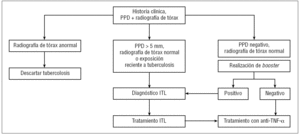
La señal de alarma se disparó en el año 2001, cuando Keane et al125 describieron 70 casos de tuberculosis entre 147.000 pacientes tratados con fármacos anti-TNF-α, sobre todo con infliximab, lo que representaba una incidencia de 24,4 casos por 100.000 pacientes. Hasta el momento la incidencia de tuberculosis descrita en los pacientes con AR en Estados Unidos era de 6,2 casos por 100.000 habitantes. Desde ese momento ya se percibió que la tuberculosis de estos pacientes presentaba características especiales: se diagnosticaban mayoritariamente en los primeros meses de tratamiento (acumulándose en las primeras 9-12 semanas tras el inicio del mismo) y un alto porcentaje presentaban manifestaciones atípicas de la enfermedad tuberculosa (formas extrapulmonares y diseminadas). El diagnóstico se demoraba en ocasiones por estas formas atípicas, además de la dificultad para su confirmación (con hallazgos histopatológicos de granulomas incompletos, cultivos de incubación prolongada) y el bajo índice de sospecha inicial. La mortalidad, después de iniciar el tratamiento, fue baja. Posteriormente se describió un alto porcentaje de reacciones paradójicas asociadas al tratamiento tuberculostático, no debidas a incumplimiento terapéutico ni a aspectos de resistencias sino a fenómenos de reconstitución inmune, que en todos los casos fueron graves y precisaron de antiinflamatorios o de cirugía para su resolución129. En este contexto, se empezó a exigir en la evaluación del enfermo el cribado previo de la infección tuberculosa latente (ITL) en todos los pacientes que debían ser tratados con fármacos anti-TNF-α u otras terapias biológicas, aparte de los inmunosupresores que podían estar recibiendo (corticoides, metotrexato)130-132. La estrategia recomendada por la mayoría de autores para este cribado se muestra en la figura 1. La anamnesis de estos pacientes debe recoger los antecedentes de enfermedad tuberculosa o de contactos previos con otros pacientes con tuberculosis, administración de vacuna antituberculosa BCG, infecciones anteriores por micobacterias atípicas, así como la historia antigua de otras infecciones del paciente, con especial interés en todas las que pueden presentar un curso latente (grupo herpes, virus de la hepatitis, leishmaniasis, toxoplasmosis, etc.).
Figura 1> Algoritmo de cribado de la infección tuberculosa latente (ITL) en pacientes que deben recibir tratamiento con agentes biológicos. PPD: prueba de la tuberculina o de Mantoux con derivado proteico purificado; TNF-α: factor de necrosis tumoral alfa.
En los pacientes diagnosticados de ITL, una vez descartada la enfermedad tuberculosa activa mediante la anamnesis, la exploración física, la radiografía de tórax y la baciloscopia de esputo si se precisa, debería iniciarse tratamiento con alguna de las pautas de quimioprofilaxis aceptadas, especialmente con isoniazida a dosis de 5 mg/kg/día durante 9 meses como primera elección. No obstante, algunos grupos creen que la duración de la profilaxis con isoniazida podría ser algo menor, de 6 meses, dependiendo del grado de inmunosupresión global del paciente133. También existen otras pautas de tratamiento de la ITL más cortas, de 2 a 3 meses, con combinaciones de 2 fármacos134,135 (pirazinamida más rifampicina, isoniazida más rifampicina) que alcanzan un mayor grado de cumplimiento terapéutico, pero que a veces se relacionan con una mayor intolerancia o con aumento de los efectos secundarios, especialmente hepatoto-xicidad136. Esperemos que con el advenimiento de las nuevas vacunas terapéuticas frente a M. tuberculosis actualmente en investigación, como RUTI137, pueda acortarse en un futuro este período de tratamiento de la ITL con duraciones cercanas a un solo mes.
En esta situación de ITL el tiempo que debe o puede demorarse el comienzo del fármaco anti-TNF-α no está bien establecido, pero nuestra experiencia y la de otros grupos sugiere que puede iniciarse de manera precoz, en un plazo medio de unas 4 semanas138, aunque ello depende de varios factores: grado de afectación e incapacidad por la AR, tipo de fármaco que se pretende iniciar, estado neto de inmunosupresión, existencia o no de lesiones radiográficas, etc. En la actualidad, y siguiendo algunas recomendaciones139-141, no parece obligado esperar a finalizar el tratamiento de la ITL para comenzar las terapias biológicas, aunque todo este proceso debe ser estrechamente controlado.
¿Por qué estos tratamientos favorecen más las enfermedades granulomatosas?
El TNF-α es una citocina inflamatoria que estimula la producción de IL-2, IL-3, IL-4, IL-5 e IL-8, promoviendo la llegada de la respuesta inmune al sitio de la infección. A su vez, a través de diferentes intermediarios, aumenta la capacidad fagocítica y destructora de los macrófagos ante los microorganismos intracelulares y ejerce un papel principal en la formación y el mantenimiento de la homeostasis del granuloma142-143. Con el uso de las terapias biológicas todos estos procesos se ven alterados y se favorece la proliferación de enfermedades infecciosas granulomatosas acantonadas. Como ya se ha comentado anteriormente, la mayoría de estas enfermedades infecciosas se desarrollan en los primeros 2-3 meses del uso del tratamiento biológico. Esto sugiere que muchas de ellas son consecuencia de la reactivación de una infección latente y que, por ello, la búsqueda y el tratamiento de estas infecciones es un aspecto clave144. Otro hecho que confirma este argumento es que desde la instauración de estrategias profilácticas de tratamiento de las infecciones latentes, como la tuberculosis secundaria al uso de estos agentes, aquéllas han disminuido drásticamente su frecuencia125,145.
¿Tienen el mismo riesgo de infección todos los agentes bloqueadores del factor de necrosis tumoral alfa?
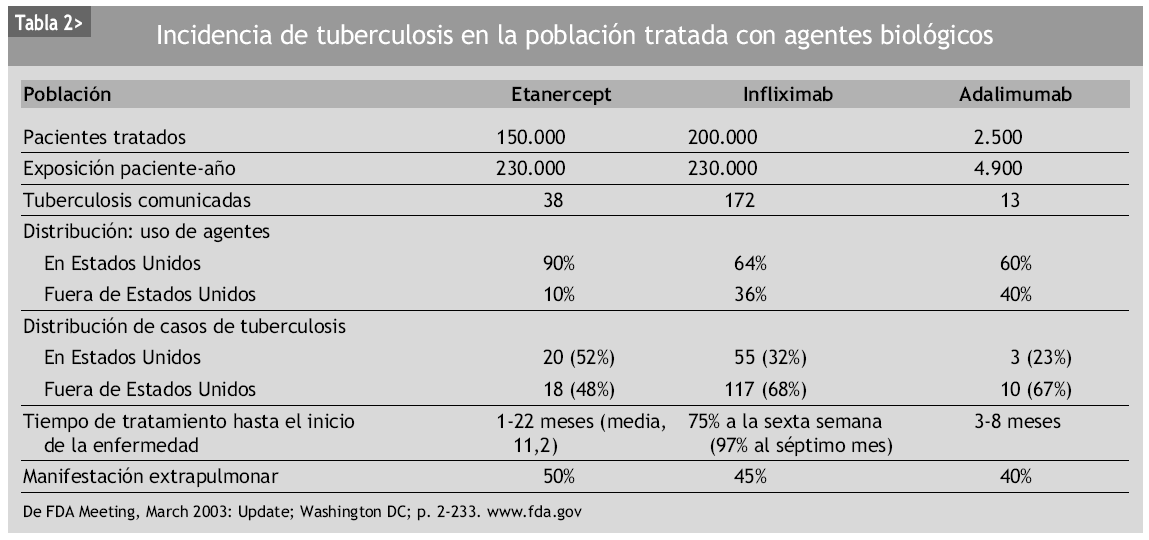
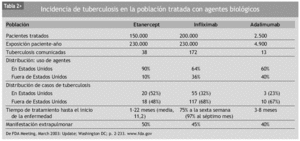
En la literatura, todas las terapias biológicas se han visto relacionadas con infecciones oportunistas119,125. No hay estudios concluyentes que demuestren que un fármaco anti-TNF-α se encuentre más asociado a determinadas infecciones que otros. Sin embargo, algunos datos sugieren que el uso de infliximab se relaciona con un mayor índice de complicaciones infecciosas comparado con el uso de etanercept120. Como ya se ha comentado, la incidencia de tuberculosis asociada al empleo de infliximab se estima en 24,4 casos por 100.000 pacientes125, mientras que tras la introducción en el mercado de etanercept la incidencia de tuberculosis fue de 10 casos por 100.000 pacientes146. Los casos de tuberculosis relacionadas con el uso de etanercept presentaban las mismas características clínicas que las de los pacientes que recibían infliximab, pero el tiempo de aparición era considerablemente más tardío (11 meses), lo cual puede hacer suponer que muchos de estos casos no se deberían propiamente a la reactivación de una ITL, sino a una primoinfección o reinfección (tabla 2). Estos resultados concuerdan con los de Wallis et al120, que describen un aumento de 3,25 veces de riesgo de infección granulomatosa en los pacientes tratados con infliximab comparado con los tratados con etanercept. Estos hallazgos se pueden explicar por las diferentes maneras con la que estos fármacos interaccionan con el sistema inmune. Infliximab tiene cierto efecto de apoptosis sobre los monocitos y las células T a través de la activación de la vía de las caspasas, fenómeno que no es producido por etanercept. Además, ambos fármacos presentan una bioactividad muy dispar: mientras infliximab neutraliza irreversiblemente la actividad del TNF-α, etanercept ejerce una función de inhibición más inestable, y algunos trabajos sugieren que, más que inhibir, redistribuye la acción del TNF-α de una forma más "fisiológica", permitiendo que siempre se mantenga un cierto efecto umbral de estabilización y control de la estructura y funcionalismo de los granulomas112,143. La esencia molecular acerca del diferente riesgo de reactivación de la infección latente, especialmente para M. tuberculosis, que es casi 9 veces mayor con infliximab respecto a etanercept, podría asentar en el distinto efecto de cada fármaco sobre la expresión génica de genes inducidos por la tuberculosis. Infliximab (y también adalimumab) inhibe la producción celular de interferón gamma (IFN-γ) inducida por M. tuberculosis, una citocina necesaria para la defensa del huésped frente a las micobacterias y otros microorganismos causantes de infecciones oportunistas granulomatosas, mientras que etanercept no provoca tal efecto incluso a concentraciones supraterapéuticas147. Los 3 fármacos bloquean la producción de IL-10 como citocina reguladora en la tuberculosis, la cual produce una inhibición de la activación de las células T y de la producción de IFN-γ. Por tanto, serían los efectos combinados sobre el TNF-α y sobre el IFN-γ los que marcarían el diferente riesgo hacia la tuberculosis de cada uno de estos fármacos.
Existen pocos datos sobre las complicaciones infecciosas de los pacientes tratados con adalimumab. La farmacodinámica de este anti-TNF-α es muy parecida a la del infliximab, por lo que el perfil de complicaciones infecciosas podría ser parecido. Sin embargo, en el estudio ARMADA que valoraba la eficacia y la seguridad de los pacientes tratados con este fármaco durante 12 meses, sólo se describe un índice de infecciones graves asociadas de 0,02/pacientes-año y no se menciona ningún caso de tuberculosis148. Tampoco se especifica si se llevó a cabo el cribado de la ITL antes de iniciar el fármaco. Después de la comercialización del fármaco se han empezado a describir casos de tuberculosis relacionada con adalimumab, aunque la experiencia es aún muy anecdótica149-151. Probablemente, la escasa incidencia de tuberculosis asociada a este fármaco por ahora es más bien el nuevo reflejo de la efectividad de las medidas de cribado y de tratamiento de la ITL antes de iniciar las terapias biológicas.
En una reciente revisión sistemática de los efectos perjudiciales recopilados a partir de los ensayos controlados y aleatorizados con los 2 anticuerpos monoclonales anti-TNF-α de uso establecido (infliximab y adalimumab) se ha mostrado la existencia de un riesgo evidente e incrementado de infecciones graves y un riesgo de neoplasias aumentado de forma dependiente de la dosis en pacientes con AR tratados con estos fármacos152. Se incluyeron 9 ensayos clínicos que cumplían los criterios preestablecidos, con 3.493 pacientes tratados con estos anticuerpos monoclonales y 1.512 que recibieron placebo. La odds ratio para infecciones graves (que requirieron tratamiento antimicrobiano u hospitalización) fue de 2,0 (IC del 95%, 1,3-3,1), y para neoplasias, de 3,3 (IC del 95%, 1,2-9,1). En los pacientes tratados con estos fármacos anti-TNF-α incluidos en los ensayos clínicos, el número de pacientes que hay que tratar para conseguir una infección grave fue de 59 (IC del 95%, 39-125) durante un período de 3 a 12 meses de tratamiento. Hubiera sido muy interesante extender este estudio, o un subanálisis del mismo, con la inclusión de la otra molécula anti-TNF-α, etanercept, para haber podido conocer las reales diferencias entre los anticuerpos monoclonales entre sí y respecto a las proteínas de fusión.
El perfil de seguridad y los datos sobre efectos adversos de abatacept, una proteína de fusión recombinante humana, soluble, que comprende el dominio extracelular de CTLA-4 y la porción Fc de la IgG1, distan mucho aún de ser bien conocidos153,154. Esta nueva molécula modula selectivamente la señal coestimuladora requerida para la activación de las células T. No obstante, el porcentaje de infecciones graves causado por abatacept no sobrepasa el 2,5% de los casos (11 de 433), frente al 0,9% (2 de 219) en los debidos a placebo más metotrexato, sin que haya diferencias estadísticamente significativas y con sólo 2 infecciones oportunistas154.
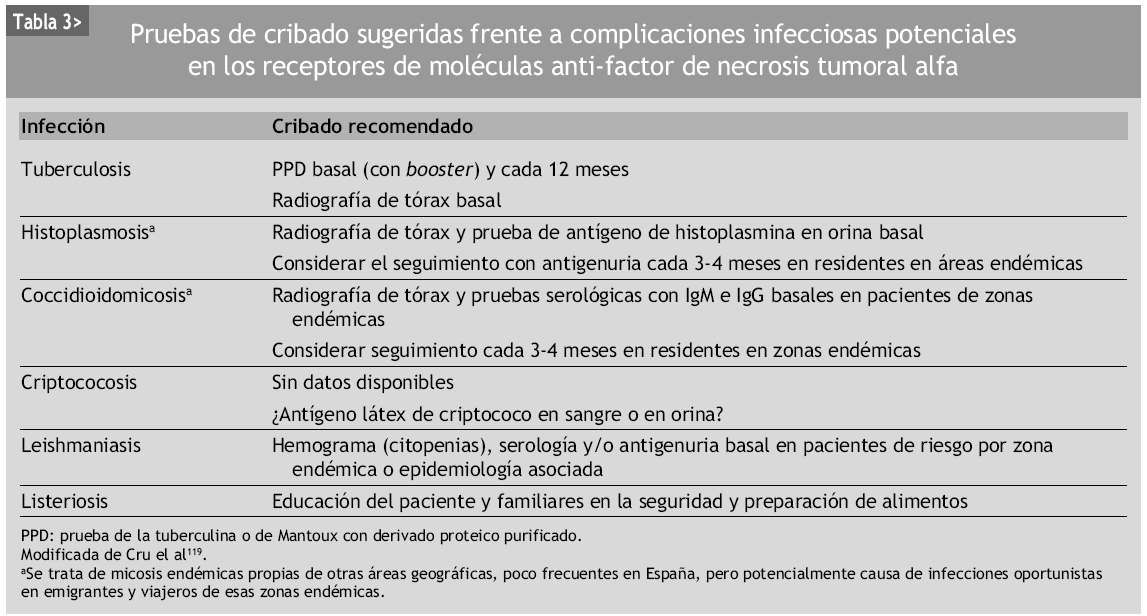
Como conclusión, se debe recordar que los pacientes tratados con terapias biológicas deben someterse a un protocolo de cribado de infecciones latentes, antes del inicio de los fármacos anti-TNF-α144 (tabla 3). Esta evaluación debería incluir una anamnesis y exploración física dirigida y bien orientada a descartar estas infecciones latentes bacterianas (tuberculosis primordialmente), fúngicas, virales o parasitarias, de acuerdo a lo consensuado en cada centro, área sanitaria o especialidad asistida por una sociedad científica (fig. 2). Sólo aplicando estas medidas, las infecciones relacionadas con estos agentes disminuirán de manera espectacular, como ya ocurre en algunos países145. Debe recordarse la importancia de la inmunosupresión global asociada a estos tratamientos y la carga sumatoria de distintas terapias simultáneas o sucesivas. Por todo ello, una vez indicados, siempre que el paciente comience a manifestar síntomas o signos de empeoramiento clínico debería descartarse una posible complicación infecciosa, como ejemplo paradigmático de este tropismo entre AR e infección.
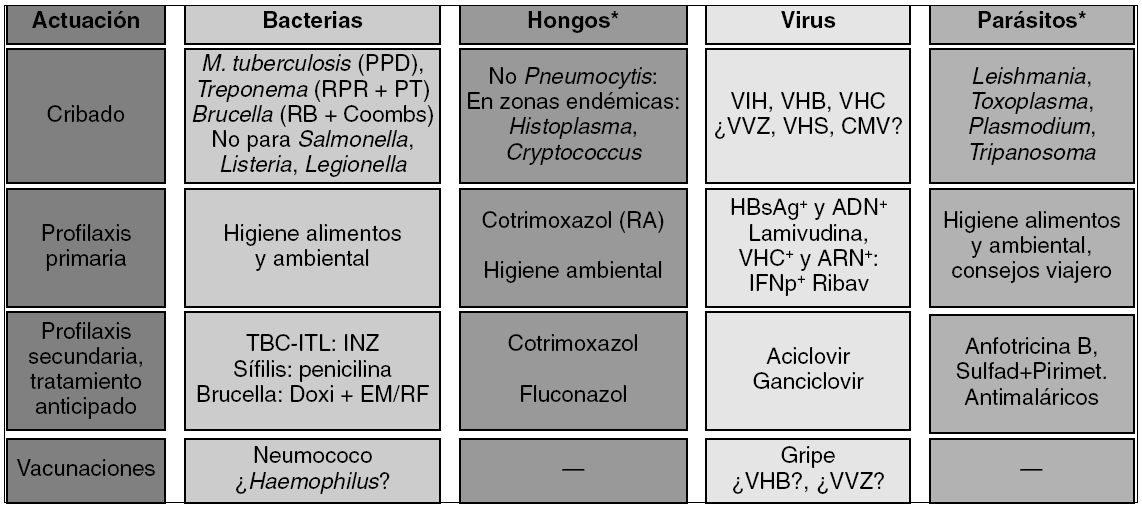
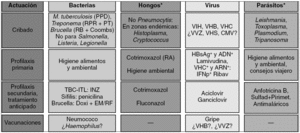
Figura 2> Evaluación clínica de riesgos infecciosos, métodos de cribado y medidas de prevención de infecciones. *Estudio sólo si lo justifica la anamnesis o antecedentes. CMV: citomegalovirus; Coombs: prueba de Coombs anti-Brucella; Doxi+EM/RF: tratamiento con doxiciclina con estreptomicina o rifampicina; INZ: isoniazida; ITL: infección tuberculosa latente; PPD: prueba de la tuberculina o de Mantoux con derivado proteico purificado; PT: pruebas treponémicas, como fluorescencia o hemaglutinación, de estudio de la sífilis; RA: riesgo alto, cuando se reciben además dosis elevadas y prolongadas de corticoides; RB: rosa de Bengala; RPR: prueba no treponémica para estudio de la sífilis; Sulfad+Pirimet: tratamiento o profilaxis secundaria de la toxoplasmosis con sulfadiazina más pirimetamina (suplementando con ácido folínico); TBC: tuberculosis; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHS: virus herpes simples; VIH: virus de la inmunodeficiencia humana; VVZ: virus varicela-zoster.
CONCLUSIONES: ¿EXISTE UN TROPISMO VERDADERO?
Probablemente, tras analizar los apartados que hemos incluido en nuestra síntesis, la respuesta sería: "Sí, existe un tropismo entre AR e infección". Pero no se trataría de un efecto unidireccional, sino de un cúmulo de sucesos y fenómenos que en una dinámica circular enlazarían los estímulos de origen infeccioso (microorganismos y superantígenos) con el impulso generador del principio de la autoinmunidad, dirigida hacia un tropismo articular o sinovial, y en ocasiones sistémico para formas avanzadas o especiales de AR. A su vez, la propia enfermedad por naturaleza y las diferentes intervenciones médicas, instrumentales y quirúrgicas conformarían una constelación de factores suficientemente capacitados, con la inmunosupresión como elemento central, para promover el desarrollo de procesos infecciosos muy variados tanto en sus formas de presentación sindrómica como en el origen etiológico de los mismos. Aunque las bases fisiopatológicas y moleculares de este tropismo infeccioso no son por ahora del todo conocidas, las situaciones pueden llegar a ser tan complejas y difíciles en el mundo real de la asistencia al paciente con AR que el manejo de las mismas se beneficie de un planteamiento basado en la colaboración y el apoyo entre diferentes especialistas con actuaciones precisas y bien definidas.
AGRADECIMIENTOS
Damos las gracias al Dr. Don Francisco Gudiol, Jefe del Servicio de Enfermedades Infecciosas del Hospital Universitario de Bellvitge, por su profunda lectura y precisa revisión del manuscrito y por habernos aportado sugerencias de gran valor.