La principal causa de mortalidad en los pacientes con lupus eritematoso sistémico (LES) es la enfermedad cardiovascular (CV). La aterosclerosis acelerada que ocurre en el LES se considera uno de los mecanismos fundamentales de este aumento de la mortalidad CV. Entre los factores que contribuyen al proceso de la aterosclerosis acelerada se incluyen factores de riesgo CV clásicos, factores inflamatorios y específicos del LES. Es por ello que en los pacientes lúpicos se hace necesaria la estimación del riesgo CV (RCV) y, de este modo, desarrollar estrategias para modificarlo. Sin embargo, hoy en día no disponemos de índices para cuantificar el RCV en esta población de pacientes, a diferencia de lo que ocurre en otras enfermedades reumáticas como la artritis reumatoide en la que la EULAR recomienda el uso del Systematic COronary Risk Evaluation (SCORE) ponderado. Dada la ausencia de índices específicos de estimación del RCV en el LES, debemos valorar y actuar sobre los factores de RCV tradicionales (tabaquismo, presión arterial, diabetes, índice de masa corporal, perfil lipídico) y hacer uso de métodos no invasivos que permiten una estimación de la aterosclerosis subclínica. En los últimos años se ha comenzado a utilizar un gran número de métodos de imagen no invasivos para valorar la aterosclerosis subclínica en los pacientes con LES, entre los que destaca la ecografía carotídea para la detección de placas de ateroma y la medición del grosor íntima-media. Estos métodos permiten en cierta medida estratificar el RCV de manera individualizada y así utilizar una estrategia terapéutica adecuada para tratar de disminuir la mortalidad CV que sufren estos pacientes.
Cardiovascular disease has become the leading cause of mortality in patients with systemic lupus erythematosus (SLE). Accelerated atherosclerosis is considered one of the most important mechanisms implicated in the high cardiovascular (CV) mortality associated with SLE. Atherosclerosis in SLE patients arises from an interaction among classical CV risk factors, inflammatory mediators and factors specific to SLE itself. Consequently, calculating CV risk in these patients is central to decision-making on treatment to prevent CV disease. However, although Systematic COronary Risk Evaluation (SCORE) is recommended by The European League against Rheumatism (EULAR) experts and is widely used by rheumatologists for CV assessment in patients with rheumatoid arthritis and other forms of inflammatory arthritis, CV risk in SLE patients cannot be adequately evaluated with widely used charts for stratifying CV risk. Due to the lack of specific charts, assessment of traditional CV risk factors (smoking, blood pressure, diabetes, body mass index and lipid profile) and the use of validated imaging techniques to detect subclinical atherosclerosis have been proposed for the assessment of vascular disease in SLE patients. Among these techniques, calculating the intima-media thickness of the common carotid arteries measured in the far wall and the presence of plaques in the carotid system have become commonly used indicators of subclinical atherosclerosis. To a certain extent, the use of these methods allows individualized CV assessment and consequently a more useful management strategy, which can decrease CV mortality in SLE patients.
El lupus eritematoso sistémico (LES) es el prototipo de enfermedad reumatológica autoinmune1. En los últimos años la enfermedad cardiovascular (ECV) ha desplazado a las infecciones como primera causa de mortalidad en estos pacientes, principalmente por la utilización más racional de los corticoides y los inmunosupresores2. Parece evidente que este incremento de la morbimortalidad cardiovascular (CV) está relacionado con el desarrollo prematuro de una aterosclerosis acelerada. Hoy en día la aterosclerosis se considera una enfermedad con un importante componente inflamatorio, por lo que se postula que factores específicos del LES proinflamatorios sean responsables de la aterosclerosis acelerada, aunque —como veremos— no se conocen con exactitud3,4. Estudios recientes demuestran que las tasas de mortalidad asociada a la ECV en los pacientes con LES no ha mejorado en los últimos años, y todo ello enfatiza la importancia de realizar una correcta valoración del riesgo cardiovascular (RCV) en nuestros pacientes con LES para tratar de disminuir la morbimortalidad CV5,6.
A continuación revisaremos la relación existente entre el LES y la ECV, explicaremos los factores de riesgo conocidos que colaboran en el desarrollo de la aterosclerosis acelerada y nos centraremos en los métodos disponibles para realizar una valoración adecuada del RCV en los pacientes lúpicos.
Lupus eritematoso sistémico y enfermedad cardiovascularLos primeros en proponer una asociación directa entre el LES y la ECV fueron Urowitz et al., que en 1976 hacían referencia a la existencia de un patrón bimodal en la mortalidad de los pacientes con LES. Sugerían la existencia de un primer pico debido a la propia actividad de la enfermedad e infecciones asociadas, y un segundo pico en pacientes con más de 2años de evolución de la enfermedad causado por enfermedad coronaria arterial7.
Posteriormente, Manzi et al. publicaron que la prevalencia de enfermedad coronaria en mujeres con LES es de 5 a 6veces mayor que en la población general. Al estratificar por edad, vieron que las pacientes lúpicas entre 35 y 44años presentan un riesgo de enfermedad coronaria 52veces superior a la población general, lo que sugiere un establecimiento más temprano de la ECV si tenemos en cuenta que en mujeres menores de 55años sin la enfermedad, los episodios coronarios ocurren raramente5.
Además, en la mujeres con LES la edad media del primer episodio CV es de 49años, lo que contrasta con la edad media de 60años del primer episodio CV en la población femenina general8. Por último, para tratar de asimilar la importancia de las ECV en el LES debemos saber que la tasa absoluta de episodios CV en pacientes lúpicos se ha estimado en el 13% a 10años, y la incidencia anual de enfermedad coronaria, en torno al 1,2-1,5%9,10.
A día de hoy estos aspectos no son objeto de debate, y es evidente que en el LES existe una aterosclerosis acelerada y un aumento de la ECV11. A continuación describiremos la mayoría de los factores de riesgo que han demostrado tener alguna relación con el desarrollo de la aterosclerosis acelerada en esta enfermedad. Aunque se han dividido en varios grupos y se explicará cada uno de ellos de manera independiente, debemos tener presente que existe una compleja red de interacciones entre los distintos factores, en su mayor parte no aclarados o por descubrir (tabla 1).
Factores de riesgo cardiovascular en el lupus eritematoso sistémico (LES)
| Factores clásicos | Hipertensión arterialDiabetes mellitusObesidadTabaquismoDislipidemiaSíndrome metabólicoMenopausia |
| Factores relacionados con la inflamación | PCRMarcadores endoteliales (VCAM, ICAM, E-selectina)HomocisteínaCitocinas proinflamatorias (TNF-alfa, IL6, IL1, MCP-1)Complemento |
| Factores relacionados con el propio LES | Actividad: daño renalDisfunción: daño endotelialCélulas endoteliales apoptóticas/progenitorasInmunocomplejos/ComplementoCD40-CD40LInterferón alfaLeptinasAutoinumunidad |
La explicación más fácil del incremento de morbimortalidad CV sería asumir que nuestros pacientes lúpicos agrupan un mayor número de factores de riesgo cardiovascular (FRCV) clásicos o tradicionales. Diversos estudios epidemiológicos han comprobado que los pacientes con LES presentan una mayor frecuencia de hipertensión arterial (HTA), dislipidemia, tabaquismo y diabetes mellitus (DM), una mayor tendencia a la vida sedentaria y una menopausia prematura, y además, que los que han sufrido episodios CV tienen un mayor número de FRCV tradicionales en comparación con los que no los han padecido, aunque estos no explican en su totalidad el aumento global de la morbimortalidad CV en el LES4,10,12,13.
En relación con la mayor frecuencia de dislipidemia que padecen nuestros pacientes se ha descrito un perfil lipídico aterogénico, que algunos autores han denominado «patrón lúpico de dislipoproteinemia», caracterizado por concentraciones elevadas de colesterol total (CT), triglicéridos (TG), LDL, VLDL y lipoproteína A, así como niveles disminuidos de HDL14. Estudios como el realizado por Bruce et al. concluyeron que los pacientes con LES y elevación crónica de CT, en concreto valores superiores a 200mg/dl durante 3años, presentan más episodios CV que aquellos con un CT normal (27,8 vs. 3%)9. Además, como ya se ha mencionado anteriormente, la dislipidemia se asocia con la presencia de placas carotídeas, y en algunos estudios el CT fue el único factor de riesgo convencional que predijo de forma independiente la presencia de dichas placas4. En este contexto es interesante destacar la correlación directa existente entre la actividad del LES medida mediante el índice systemic lupus erythematosus disease activity index (SLEDAI) y el desarrollo de dislipidemia (aumento de VLDL y TG con un descenso de HDL)15. Una de las explicaciones fisiopatológicas de esta asociación y de la relación entre la dislipidemia y el desarrollo de placas de ateroma radicaría en el carácter antiinflamatorio del HDL, que evitaría la formación de LDL oxidado (ox-LDL), componente esencial de las células espumosas, las cuales conducen a la formación de las placas de ateroma16. En concordancia con esta teoría se ha descrito en el LES la presencia de una HDL proinflamatoria (piHDL) con menor capacidad para evitar la oxidación de LDL. Algunos autores han demostrado mayores niveles de esta piHDL y de ox-LDL tanto en pacientes con LES comparado con controles, así como en pacientes que han tenido algún episodio CV comparando con los que no lo han padecido. Por ello se ha propuesto a los niveles de piHDL como predictores independientes de la presencia de placas carotídeas en pacientes con LES17. Entre los posibles mecanismos responsables de la capacidad proinflamatoria de esta piHDL, se ha postulado una alteración en la función de un componente antioxidante del HDL, denominado paraoxonasa 1 (PON1), que interviene en la inhibición de la oxidación de lipoproteínas y en el catabolismo de las ox-LDL; esta modificación de la PON1 haría que la HDL se viera mermada en su capacidad para prevenir la formación de las ox-LDL, lo cual ha sido apoyado por los datos del estudio de Tripi et al., que concluyen que en los pacientes con LES esta alteración de la PON1 se asocia con un mayor número de episodios cardiovasculares y cerebrovasculares18.
Otro de los FRCV clásicos presente con mayor frecuencia en el LES es la DM. Esto puede ser explicado por la existencia en los pacientes lúpicos de una disminución muy significativa de la sensibilidad a la insulina y una alta prevalencia de síndrome metabólico (18%). Aunque no está claro si existe relación con la terapia corticoidea, varios autores han demostrado una correlación entre el desarrollo de DM y una mayor edad, niveles más altos de ox-LDL, de C3 y de parámetros de inflamación19-21. Esto es interesante, pues de nuevo interrelaciona actividad del LES y otro FRCV, como es la DM, además de la dislipidemia ya comentada15.
Diversos autores, en un intento por aclarar este incremento de morbimortalidad CV no explicado en su totalidad por la mayor presencia de FRCV clásicos, han estudiado la relación existente entre los FRCV y determinadas variables predictoras de RCV (placas carotídeas, presencia de calcio en las arterias coronarias). Estos estudios han demostrado que la HTA, la dislipidemia, la DM y una mayor edad se asocian con un mayor número de placas carotídeas en pacientes con LES22,23. En esta misma línea, Kiani et al. publicaron datos de un estudio transversal y posteriormente prospectivo a 2años, en el que observaron que la edad y la HTA eran los únicos factores asociados a la progresión de la aterosclerosis subclínica y a la presencia de placas carotídeas. De modo semejante la edad, el tabaquismo y el CT se asociaron con la presencia de calcio en las arterias coronarias detectado mediante tomografía computarizada de haz de electrones24,25.
A pesar de todo lo comentado anteriormente, la alta incidencia de episodios CV en pacientes con LES no puede explicarse únicamente por una mayor presencia de los FRCV clásicos10.
Factores de riesgo relacionados con la inflamaciónHoy en día la aterosclerosis es considerada una enfermedad de carácter sistémico con un importante componente inflamatorio. En su desarrollo interviene una compleja interacción de mediadores inmunológicos y citocinas que conducen a la aparición de células espumosas en la pared vascular con la posterior formación de estrías grasas y de placas16,26. Esta respuesta sistémica inflamatoria responsable de la aterosclerosis se ha propuesto como uno de los posibles nexos entre la aterosclerosis y el LES, pues parece evidente que la respuesta inflamatoria sistémica en los pacientes lúpicos contribuye al desarrollo de la aterosclerosis27. Esta relación fisiopatológica entre aterosclerosis y LES ha sido sugerida por diversos autores. Algunos trabajos han demostrado que niveles séricos más elevados de proteína C reactiva (PCR) son predictores de episodios CV, de un mayor grosor de la íntima-media carotídeo (GIMc) y de la presencia de calcificación en arterias coronarias28,29. El trabajo publicado por Rho et al. es especialmente interesante al demostrar que marcadores o mediadores de inflamación asociados con aterosclerosis o RCV en la población general, como son los niveles de moléculas de adhesión endoteliales (VCAM, ICAM y E-selectin) y de TNF-α, están asociadas con la aterosclerosis en el LES, y que además son independientes de los factores de RCV clásicos30. El TNF-α y otras citocinas proinflamatorias como la IL-6 y la proteína de monocitos 1 (MCP-1) intervendría en el desarrollo de la aterosclerosis aumentando la síntesis hepática de PCR y colaborando en la aparición del «patrón lúpico de dislipoproteinemia»31). En el LES la activación del complemento también podría jugar un papel en la aterosclerosis, y así ha sido sugerido por el grupo español de Rua-Figueroa et al. al encontrar en los pacientes con LES una asociación entre las concentraciones séricas altas de C5 y aterosclerosis temprana, así como entre niveles séricos elevados de C3 y la progresión del GIMc en un estudio prospectivo de 2años de duración32.
Factores de riesgo relacionados con el lupus eritematoso sistémicoEn el incremento del riesgo CV de los pacientes con lupus, además de los FRCV clásicos y de los inflamatorios, interviene la propia enfermedad, que se comporta como un FRCV independiente. Este hecho fue comunicado por Goldberg et al. después de encontrar una mayor frecuencia de episodios CV en 237 pacientes con LES apareados con controles con un seguimiento de 8años33. A continuación describimos los mecanismos postulados mediante los cuales el propio LES colabora en el aumento de la ECV.
Actividad de la enfermedadLa propia actividad inflamatoria de la enfermedad se asocia con un mayor RCV5. Esta asociación ha sido cuantificada, y se estima que un incremento de 6 puntos en el índice SLEDAI durante un año se correlaciona con un aumento del 5% en el RCV a 2años34. Una de las manifestaciones clínicas más frecuentes de la actividad inflamatoria es la nefritis lúpica, que se asocia con una aterosclerosis acelerada, y explica que la principal causa de mortalidad en pacientes con nefritis lúpica, en hasta el 50% de los casos, sea la ECV o la enfermedad cerebrovascular23,35.Otros factores involucrados en la nefritis lúpica para el desarrollo de la aterosclerosis acelerada son una mayor tendencia a la dislipidemia y a la HTA.
Disfunción y daño endotelialLa disfunción endotelial juega un papel muy importante en el desarrollo de la aterosclerosis acelerada en pacientes con LES. La evidencia sugiere que el LES acelera el daño vascular y que además los mecanismos para su reparación son inefectivos36. Se han observado niveles elevados de células endoteliales apoptóticas circulantes, expresión de daño vascular y niveles bajos de células endoteliales progenitoras encargadas de reparar el daño arterial en sangre de pacientes con LES. Entre los procesos que intervienen en el daño endotelial destaca la formación de inmunocomplejos y la activación del complemento, características ambas del LES, así como el interferón alfa, que juega un papel importante tanto en el daño endotelial como en su reparación27,37. Algunas sustancias responsables del daño endotelial, como la homocisteína, se han asociado con episodios cardiovasculares en el LES, e incluso algunos trabajos prospectivos han demostrado una asociación entre los niveles séricos de homocisteína y la progresión del grosor de la íntima-media32,38. Otra sustancia que recientemente se ha identificado con factor involucrado en el desarrollo de la aterosclerosis en pacientes lúpicos es la leptina, hormona derivada del tejido adiposo. Se ha comprobado que niveles altos de leptina aumentan el riesgo de aterosclerosis subclínica en el LES, se asocian con un aumento de otros biomarcadores inflamatorios, e incluso se ha propuesto como marcador para identificar a pacientes lúpicos con riesgo de aterosclerosis39. Uno de los pasos finales del daño endotelial es la rotura de la placa y la trombosis, que conduce al episodio CV. El complejo CD40-CD40 ligando promueve la inestabilidad de la placa, y se ha comprobado que está aumentado en el LES e incrementa el RCV en los pacientes con alto riesgo40.
AutoanticuerposSabemos que el LES es la enfermedad reumatológica autoinmune por excelencia, resultado de una disfunción del sistema inmunológico, y nos preguntamos si esta disfunción puede afectar a la progresión de la ECV. Roman et al. publicaron un estudio en el que valoraron la prevalencia de la aterosclerosis subclínica y su relación con los factores relacionados con el LES. Estos autores encontraron una menor frecuencia de anticuerpos anti-Sm, anti-RNP y anticardiolipina (ACA) en pacientes sin placas carotídeas4. Con respecto a estos últimos anticuerpos, diversos estudios los han implicado en la aterogénesis acelerada, posiblemente por su influencia en la activación de células endoteliales41,42. Otros mecanismos de interés han sido postulados para tratar de explicar la relación entre los ACA y la aterosclerosis acelerada. La apoA-I es un componente muy importante del complejo HDL que ayuda a «limpiar el colesterol» de las arterias. Delgado et al. relacionaron la presencia de ACA con una alteración en el perfil lipídico, mediada principalmente por una reacción cruzada de los ACA frente a apoA-I43. Por otro lado, se ha descrito el papel protector de la beta-2-glucoproteínaI (beta2GPI) en la formación de la placa de ateroma al evitar la captación de las LDL-ox por los macrófagos que pasarán a células espumosas para constituir el núcleo de la placa ateromatosa; por ello se piensa que la presencia de anticuerpos frente a beta2GP1 facilitaría la formación de células espumosas —y con ello de la placa de ateroma— al interferir en el mencionado papel protector de la beta2GPI44.
Tratamiento del lupus eritematoso sistémicoAunque los corticoides siguen siendo una de las terapias más efectivas para el manejo de la actividad en el LES, tienen un gran número de efectos metabólicos secundarios, tales como el aumento de la presión arterial, la glucosa, los lípidos y el peso45. Se ha comprobado que una mayor duración de la corticoterapia se asocia con ECV subclínica e independientemente predice episodios CV en pacientes con lupus2. En cambio, la hidroxicloroquina ha demostrado efectos CV beneficiosos en pacientes con LES, siendo hoy en día un tratamiento de primera línea. Se ha comprobado que reduce los niveles de CT, LDL así como TG, y que incluso podría evitar la dislipidemia asociada a corticoides46. Datos más recientes abogan por su efecto tromboprotector, comprobándose una reducción de hasta el 68% en los episodios tromboembólicos en pacientes lúpicos47. Este efecto lo ejercería, al menos parcialmente, por la inhibición de la activación plaquetaria mediada por anticuerpos antifosfolípido48.
Métodos para la valoración del riesgo cardiovascular en el lupus eritematoso sistémicoPara la valoración del RCV en pacientes con LES podemos recurrir a la utilización de tablas de estimación del RCV, de modo similar a como hacemos en la población general y en pacientes con artritis reumatoide y con otras artropatías inflamatorias, o bien a técnicas de imagen con potencial para detectar signos de aterosclerosis.
Tablas de estratificación del riesgo cardiovascularTodos los datos anteriores justifican la relevancia de una correcta valoración del riesgo CV en pacientes con LES, cuya importancia se ha visto enfatizada por varios estudios que muestran que la mortalidad asociada a ECV en pacientes con esta enfermedad no ha disminuido en los últimos años6,49. La tabla Framingham-Wilson, calibrada para pacientes estadounidenses, y la tabla Systematic COronary Risk Evaluation (SCORE), calibrada para pacientes europeos (bajo y alto riesgo), consisten en índices compuestos que incluyen diferentes FRCV como variables y que ofrecen una estimación directa del RCV fatal a 10años de forma individualizada. En la práctica clínica diaria son de gran utilidad para estratificar el RCV en pacientes asintomáticos y como métodos para decidir una intervención terapéutica. En el caso de la tabla Framingham, un RCV≥10% se considera como punto de corte para iniciar una terapia, y en el caso de la tabla SCORE, un RCV≥5%50,51.
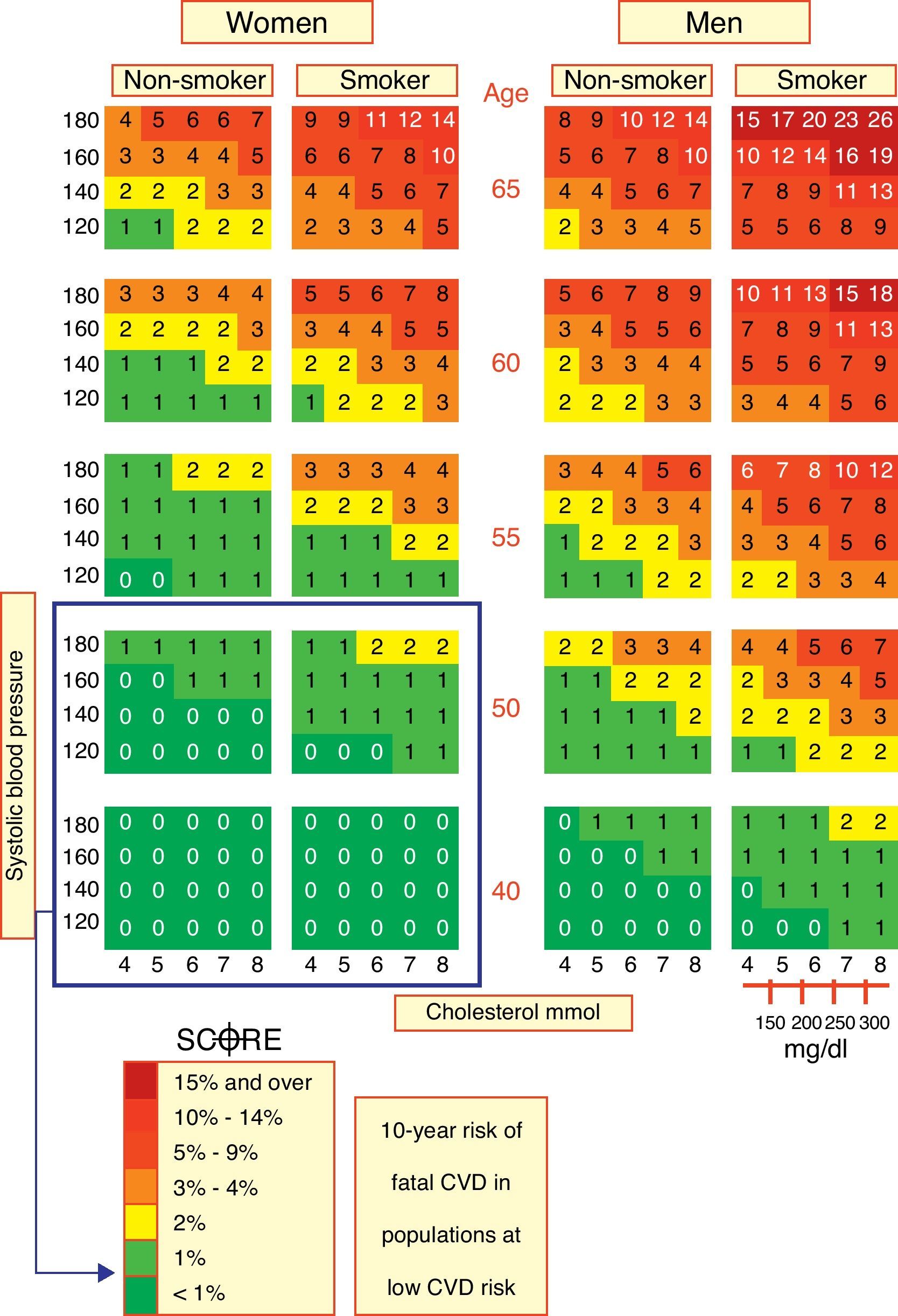
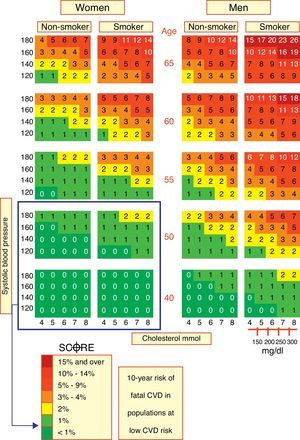
En los últimos años, y en función de las recomendaciones de la European League Against Rheumatism (EULAR), la estimación del RCV ha adquirido una gran importancia en otras enfermedades reumáticas como la artritis reumatoide (AR). En 2010 la EULAR presentó una serie de pautas para el manejo del RCV en pacientes con AR y otras artritis inflamatorias, en las que se recomienda el uso de la tabla SCORE, y en el caso particular de la AR, multiplicar por un factor de 1,5 si concurren ciertas manifestaciones clínicas o analíticas52. En el caso del LES se ha comprobado que estas tablas estiman de manera muy pobre el RCV, por las características epidemiológicas de los pacientes lúpicos —la mayoría mujeres jóvenes—, dado que ambas tablas están fuertemente influidas por la edad (fig. 1)33.
Con respecto al uso de la tabla Framingham para la valoración del RCV en pacientes con LES, se ha descrito que estratifica al 99% de mujeres con LES como de bajo RCV, con una media a 10años de predicción de RCV del 1%, sin diferencias en el RCV con respecto a pacientes controles53. Una idea sobre la falta de idoneidad de la tabla Framingham para estimar el RCV en pacientes con LES se obtiene del trabajo publicado por O’Neill et al., quienes, al calcular el RCV en 308 pacientes lúpicos mediante la tabla Framingham, concluyeron que 35pacientes (11,36%) se clasificaron como de alto RCV; sin embargo, tras eliminar a los diabéticos y a los que habían tenido alguna ECV previa, únicamente el 3,57% de los pacientes se englobaron dentro del grupo de alto riesgo a los que se debía realizar intervención terapéutica54.
En nuestro país se ha realizado una calibración para población española de ambas tablas LES55,56 conocida como REGICOR. Sin embargo, estas tablas calibradas tampoco permiten realizar una estimación apropiada del RCV en pacientes con LES.
Conscientes de la necesidad de disponer de instrumentos que permitan una mejor estimación del RCV en la población general, se han desarrollado algunas tablas que incorporan biomarcadores de inflamación como la PCR ultrasensible. Este es el caso de la tabla de estratificación Reynolds utilizada en mujeres y que ha sido validada57. Con la introducción de la PCR ultrasensible se ha propuesto que podría ser más idónea para la estimación del RCV en pacientes con LES, aunque se ha demostrado igualmente poco útil58.
Por lo tanto, podemos concluir que no existen tablas de estratificación adecuadas que permitan estimar el RCV en pacientes con LES. Hasta que dispongamos de ellas, una posible alternativa es la aplicación de técnicas de imagen que valoren la aterosclerosis y de este modo una estimación del RCV de los pacientes lúpicos.
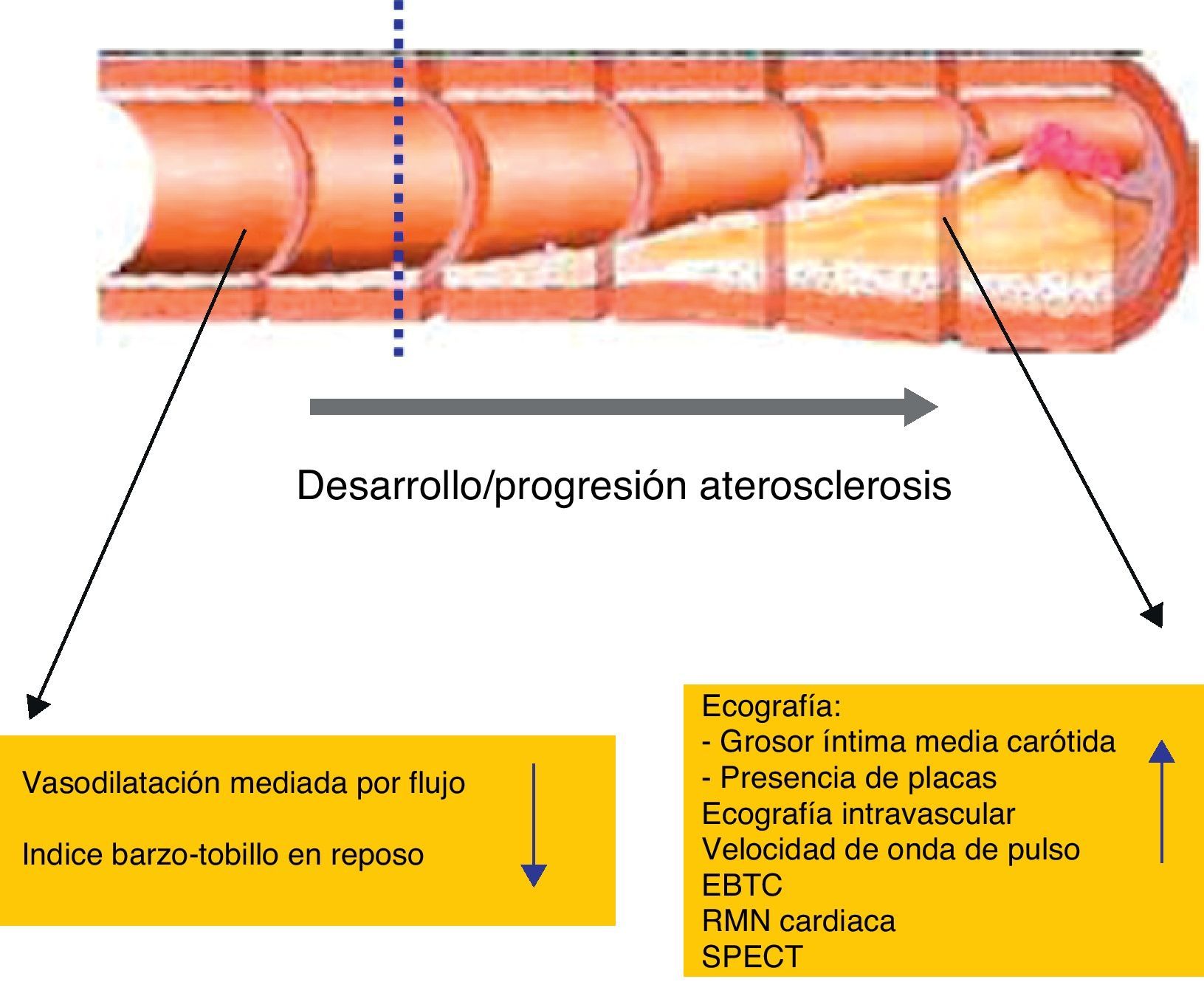
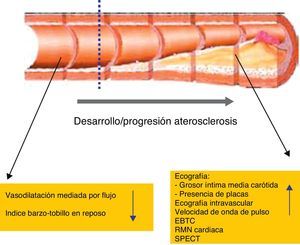
Métodos de imagen para la valoración de la enfermedad cardiovascularComo hemos visto, en los pacientes con LES es esencial identificar la ECV de modo precoz para mejorar su manejo y así aumentar su supervivencia. En la última década se han desarrollado numerosas técnicas de imagen, cada vez más precisas, con las que podemos reconocer de una forma temprana los signos de ECV en pacientes asintomáticos (fig. 2)59.
Mediante estas técnicas podemos valorar alteraciones de la función endotelial y modificaciones estructurales de la pared arterial como expresión de una aterosclerosis precoz. Los resultados de estas técnicas, junto con la valoración de los factores de RCV comentados, nos permitirán una mejor estimación y estratificación individualizada del RCV y de este modo establecer una estrategia terapéutica adecuada para reducirlo60.
A continuación describimos las técnicas que se han empleado para la estimación de la ECV en pacientes con LES y nos centramos en los métodos de imagen no invasivos por su mayor aplicabilidad para el cribado de la aterosclerosis subclínica. Comentamos así mismo los estudios más relevantes al respecto en pacientes lúpicos.
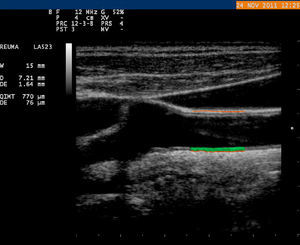
Técnicas de valoración de la disfunción endotelialLa disfunción del endotelio, una capa de células que recubre la íntima arterial, es uno de los primeros signos de aterosclerosis (fig. 3). El término «disfunción endotelial» describe un estado caracterizado por la pérdida de capacidad de adaptación del endotelio. Se ha demostrado que es un episodio temprano en la aterogénesis y que contribuye en las diferentes fases del desarrollo de placa ateroesclerótica61.
Esta disfunción endotelial se puede estimar de manera no invasiva mediante la medición de la velocidad arterial mediada por flujo por ecografía Doppler, técnica que ha sido recientemente validada para la valoración no invasiva de la función endotelial en pacientes con enfermedades reumáticas60. Otro método para la estimación de la disfunción endotelial en arterias periféricas, como la arteria humeral, es la medición de la dilatación arterial mediada por flujo que se realiza de forma sencilla y reproducible mediante ecografía de alta resolución y que se ha relacionado con la función endotelial coronaria y la gravedad de las lesiones62.
Varios estudios realizados con esta técnica en pacientes con LES han demostrado una disminución de la vasodilatación en los pacientes en comparación con controles sanos, lo que sugiere el desarrollo de un proceso aterosclerótico precoz. En esta misma línea, el grupo español de Valdivielso et al. concluyó que dicha disfunción endotelial se correlacionaba con la actividad de la enfermedad, y Ferreira et al. demostraron en un estudio prospectivo de 8semanas que la administración de atorvastatina (20mg/día) mejoraba la vasodilatación endotelial en pacientes con LES63-65.
Métodos de estimación del flujo periféricoEl índice tobillo-brazo (ITB) en reposo es un método muy sencillo y barato que puede ser usado para identificar individuos con alto riesgo de desarrollar ECV, e incluso cuando se aplica en poblaciones de bajo riesgo66. Para su cálculo se determina el cociente entre la presión arterial sistólica a nivel del tobillo y del brazo con la ayuda de un minidoppler. Dicho cociente se considera patológico si es <0,9, >1,4 o la arteria no es compresible, lo que expresa una alteración en las paredes arteriales consecuencia de una aterosclerosis67. Se ha demostrado una alta prevalencia de valores patológicos del ITB en paciente jóvenes con LES en comparación con controles, lo que apoya que el ITB es una herramienta simple no invasiva para detectar aterosclerosis subclínica en estos pacientes68.
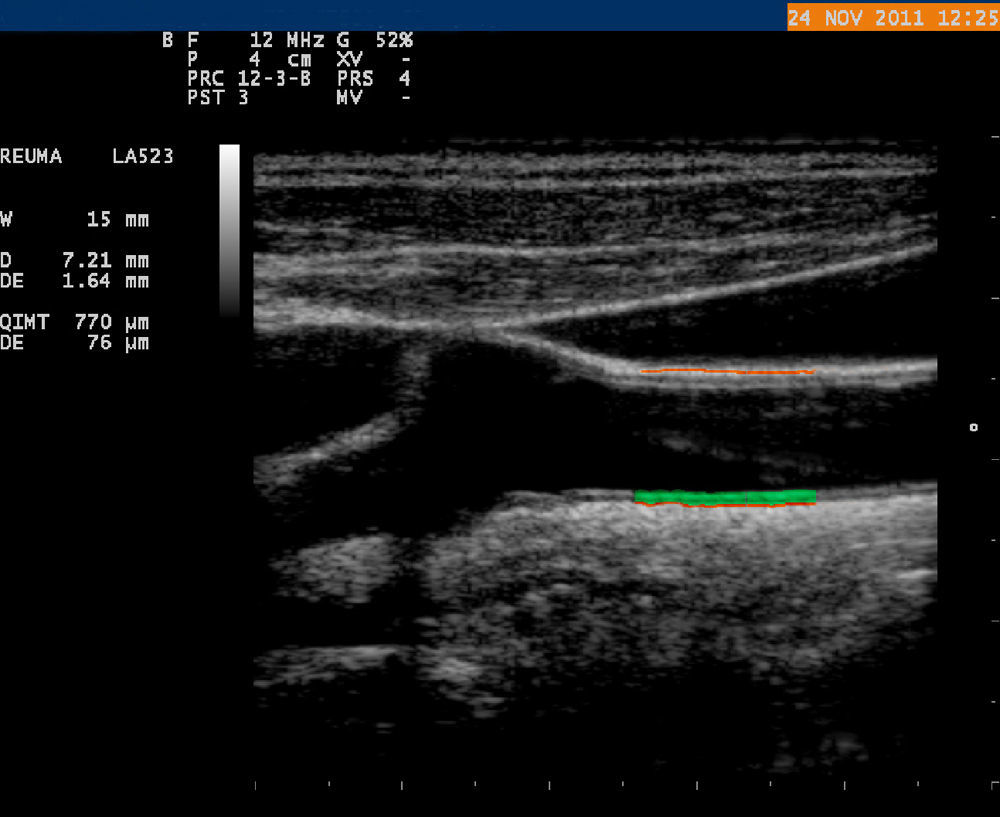
Valoración ecográfica del grosor íntima-media carotídeo y de la presencia de placasLa ecografía carotídea es un método preciso, no invasivo y validado que permite la valoración del GIMc de la pared arterial y la presencia de placas, ambos datos indicativos de aterosclerosis. Además ha demostrado ser una técnica reproducible para cuantificar «la carga de enfermedad aterosclerótica» y ayudar al manejo de la ECV69. Diversos autores han demostrado que en la población general el aumento del GIMc o la presencia de placas ateroscleróticas se asocian con un riesgo incrementado de infarto de miocardio, enfermedad arterial periférica o accidente cerebrovascular70. Estas observaciones determinaron que la Sociedad Americana de Ecocardiografía publicara en 2008 un consenso en el que explicaba de manera estandarizada y sencilla el uso de este método para evaluar el riesgo de ECV (fig. 3)71. En relación con los pacientes con LES existe un gran número de estudios que han valorado el RCV mediante esta técnica y han demostrado que presentan una progresión acelerada en la evolución de las placas ateroscleróticas. Además, la presencia de placas se ha relacionado con la propia enfermedad tras controlar por factores tradicionales de RCV y por todo ello algunos autores consideran que la ecografía carotídea debe ser utilizada en nuestra clínica diaria para valorar y manejar el RCV en pacientes con LES, proponiendo esta técnica como criterio de valoración indirecto del RCV en ensayos clínicos con estos pacientes72. La importancia de la utilización de esta sencilla técnica en los pacientes con lupus queda patente si tenemos en mente que en torno al 40% de nuestros pacientes presentan indicios de placa, y que hasta el 20% va a presentar una placa gran tamaño (>50% de diámetro)22. Además, al analizar la influencia de diversos factores sobre la presencia de placas carotídeas se ha encontrado que una mayor evolución de la enfermedad, una mayor dosis acumulada de corticoides y un mayor daño valorado por el índice de daño Systemic Lupus International Collaborating Clinics/American College of Rheumatology (SLICC/ACR) se asoció a un mayor número placas. El mismo grupo de investigadores llevó a cabo un estudio en 224pacientes lúpicos sin ECV previa con un seguimiento de 10años y comprobó que el incremento del GIMc y la presencia de placa al inicio del estudio se relacionaban con mayor riesgo de ECV en el futuro73.
Rigidez arterial estimada mediante tonometría de pulsoLa pérdida de elasticidad y el desarrollo de rigidez arterial son consecuencias de la progresión de la aterosclerosis74. Mediante la tonometría de pulso podemos examinar diferentes cambios en el perfil de la onda arterial determinados por la elasticidad y otras propiedades de la arteria, los cuales se correlacionan con la distensibilidad y la rigidez arteriales75. Utilizando esta técnica, diferentes estudios han demostrado que los pacientes lúpicos tienen una mayor rigidez aórtica con una correlación positiva con la PCR y los niveles séricos de C376. Así mismo se ha demostrado que el LES es un factor de riesgo independiente de aterosclerosis subclínica y de rigidez arterial, pudiendo asociarse a la enfermedad activa y al daño orgánico77.
Determinación de contenido cálcico coronario por tomografía de haz de electronesLa aterosclerosis de las arterias coronarias puede detectarse mediante la tomografía computarizada (TC) de haz de electrones (EBCT). Esta técnica es una variante de la TC que realiza una captura del corazón en aproximadamente una décima de segundo, con lo que evita imágenes borrosas ocasionadas por los latidos del corazón, y puede detectar la acumulación de calcio en las arterias coronarias, con un papel predictor para el desarrollo de futuros episodios cardíacos22,78. En los pacientes con LES esta técnica se ha aplicado para tratar de cuantificar la aterosclerosis. Asanuma et al. demostraron una prevalencia aumentada de aterosclerosis coronaria, también incrementada en pacientes lúpicos de menor edad3. Chung et al. realizaron un estudio en 2006 en el que compararon las tablas de estratificación del RCV con la presencia de la aterosclerosis subclínica cuantificada por EBCT y, como era de esperar, concluyeron la no utilidad de dichas tablas para la valoración del RCV en los pacientes con LES. En ambos estudios se concluye que la EBCT permite identificar la aterosclerosis subclínica asintomática y que estos pacientes podrían beneficiarse de una terapia dirigida a disminuir el RCV53.
La resonancia magnética cardíaca también se ha utilizado en algunos estudios en pacientes lúpicos y ha demostrado su utilidad para valorar la enfermedad coronaria79.
Otros métodos de imagenLa utilización de la tomografía computarizada por emisión de fotones individuales (SPECT) ha demostrado que hasta el 40% de todas las mujeres lúpicas, y hasta el 35% de mujeres con esta enfermedad y sin historia previa de enfermedad arterial coronaria, tienen anomalías en la perfusión miocárdica, lo que sugiere una alta prevalencia de enfermedad arterial coronaria precoz80.
ConclusionesLa aterosclerosis y la enfermedad cardiovascular son causas fundamentales de morbimortalidad en muchas enfermedades reumáticas, entre las que destaca el LES. Todavía no se conocen completamente las causas de la aterosclerosis acelerada de los pacientes lúpicos, aunque la evidencia sugiere que existe una compleja interacción entre las alteraciones del sistema inmune de estos pacientes, la inflamación, los factores de riesgo tradicionales, la disfunción de células endoteliales y la reparación vascular, así como con algunos de los tratamientos usados para el control del LES. Todo ello ha conducido a que numerosos expertos consideren el lupus como un factor de RCV independiente. Como hemos visto, aunque los pacientes con lupus padecen una aterosclerosis acelerada y un alto riesgo de ECV, el manejo del RCV es subóptimo en gran parte debido a la falta de guías diseñadas para este grupo de pacientes81. Habitualmente los reumatólogos nos centramos en el tratamiento de las manifestaciones clínicas de la enfermedad y nos olvidamos del RCV, confiando para su manejo en los médicos de atención primaria, que en muchas ocasiones no son conscientes del alto RCV que conlleva el LES2. La complejidad de la aterosclerosis acelerada en los pacientes con LES probablemente requiera de un sistema integrado de FRCV y biomarcadores para identificar y tratar a los pacientes con alto RCV, dado que, como ya hemos comentado, las tablas de estratificación CV disponibles en la actualidad no son útiles en estos pacientes. En el futuro es posible que se pueda identificar la aterosclerosis acelerada de estos pacientes mediante un panel de biomarcadores relacionados con la propia enfermedad junto con los factores de riesgo tradicionales asociados. Hasta que dispongamos de este panel de biomarcadores y de tablas de estratificación del RCV diseñadas específicamente para el LES, los paneles de expertos de Europa y Estados Unidos recomiendan la valoración anual de todos los FRCV tradicionales modificables, que incluyen el tabaquismo, la PA, el IMC, la diabetes y el perfil lipídico (tabla 2)82,83. Es llamativo, dado el alto RCV que presentan estos pacientes, que en las recomendaciones de la EULAR para el manejo del LES solo una de las 10recomendaciones hagan referencia al RCV84. A día de hoy seguimos esperando una guía específica para el manejo del RCV en pacientes con LES.
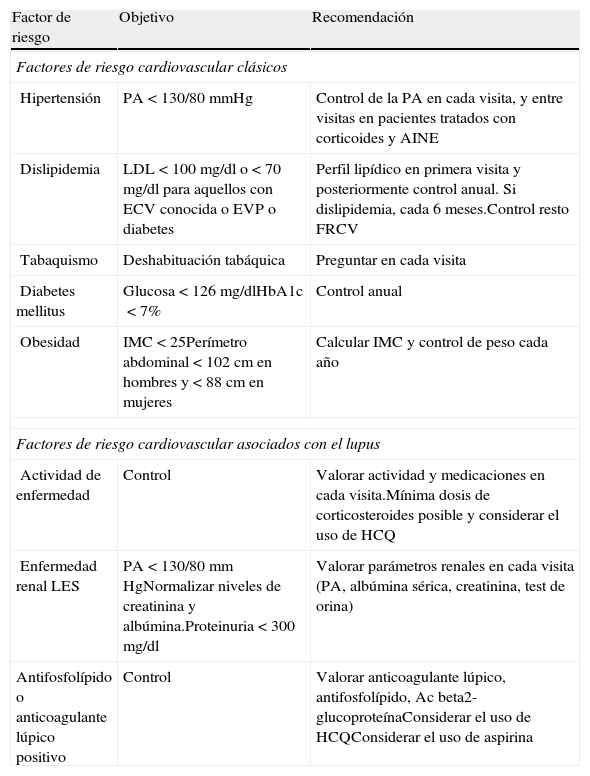
Resumen del manejo de los factores de riesgo cardiovascular clásicos y específicos del lupus eritematoso sistémico
| Factor de riesgo | Objetivo | Recomendación |
| Factores de riesgo cardiovascular clásicos | ||
| Hipertensión | PA<130/80mmHg | Control de la PA en cada visita, y entre visitas en pacientes tratados con corticoides y AINE |
| Dislipidemia | LDL<100 mg/dl o <70mg/dl para aquellos con ECV conocida o EVP o diabetes | Perfil lipídico en primera visita y posteriormente control anual. Si dislipidemia, cada 6 meses.Control resto FRCV |
| Tabaquismo | Deshabituación tabáquica | Preguntar en cada visita |
| Diabetes mellitus | Glucosa<126 mg/dlHbA1c<7% | Control anual |
| Obesidad | IMC<25Perímetro abdominal<102cm en hombres y<88cm en mujeres | Calcular IMC y control de peso cada año |
| Factores de riesgo cardiovascular asociados con el lupus | ||
| Actividad de enfermedad | Control | Valorar actividad y medicaciones en cada visita.Mínima dosis de corticosteroides posible y considerar el uso de HCQ |
| Enfermedad renal LES | PA<130/80mm HgNormalizar niveles de creatinina y albúmina.Proteinuria<300mg/dl | Valorar parámetros renales en cada visita (PA, albúmina sérica, creatinina, test de orina) |
| Antifosfolípido o anticoagulante lúpico positivo | Control | Valorar anticoagulante lúpico, antifosfolípido, Acbeta2-glucoproteínaConsiderar el uso de HCQConsiderar el uso de aspirina |
AINE: antiinflamatorios no esteroideos; Hba1c: hemoglobina glucosilada; HCQ: hidroxicloroquina; PA: presión arterial.
Mientras tanto, creemos que además de un control estricto de los factores de RCV tradicionales, las técnicas de imagen comentadas anteriormente, y en concreto la ecografía carotídea por su fácil manejo y precisión, pueden jugar un papel crucial para la detección del RCV y el manejo precoz en pacientes lúpicos con alto RCV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.