Los síndromes de dolor neuropático son un verdadero reto para los profesionales del dolor. A pesar de que en los últimos años se han producido grandes avances tanto en su diagnóstico como en su tratamiento analgésico, en menos del 50% de los casos se consigue alivio satisfactorio con el tratamiento indicado.
La prevalencia en la población es alrededor del 6-8%, y el sufrimiento que produce es tan intenso que conduce a una pérdida de la calidad de vida y a una importante limitación funcional.
Su enorme complejidad fisiopatológica, los diversos mecanismos implicados en los síntomas, tanto espontáneos como evocados, y la coincidencia de varios de ellos en un mismo paciente complican enormemente la posibilidad de un tratamiento etiopatológico.
Según la clínica que presentan los pacientes y con cuestionarios como el DN4, que constituye una ayuda para etiquetar con bastante exactitud el dolor neuropático, el diagnóstico es bastante más fácil.
Otro problema en el dolor neuropático es cuándo, cómo y con qué debe tratarse. Son numerosas las publicaciones al respecto. El tratamiento del dolor neuropático es de por sí multidisciplinar, dada la comorbilidad asociada, la edad avanzada frecuente en los pacientes, la ansiedad y la depresión provocada por el dolor. Existe gran heterogeneidad en técnicas y tipos de tratamiento, combinación y dosificación de fármacos. Repasamos los tratamientos consensuados e incidimos en los tratamientos emergentes, que representan opciones terapéuticas de futuro: los parches de capsaicina y de lidocaína, los cannabinoides y la toxina botulínica.
Neuropathic pain syndromes are a challenge for professionals working in the field of pain. Although major advances have been made in both diagnostic and analgesic treatment in recent years, satisfactory pain relief is achieved in less than 50% of patients, despite well-indicated treatment. The prevalence in the population is about 6-8% and the distress produced by pain is so intense that it leads to a loss of quality of life and significant functional limitation. The possibility of etiopathological treatment is greatly complicated by the enormous physiopathological complexity of pain, the various mechanisms underlying the various symptoms, both spontaneous and evoked, and the co-occurrence of several mechanisms in the same patient. Diagnosis of neuropathic pain is aided by the patients’ symptoms and questionnaires such as the Neuropathic Pain Diagnostic Questionnaire (DN4), a fairly accurate tool to measure neuropathic pain. Another problem in neuropathic pain is when, how and with what this type of pain should be treated. There are numerous publications on the topic. The treatment of neuropathic pain is itself multidisciplinary, given the comorbidity, the frequency of advanced age in these patients, and the anxiety and depression caused by pain. There is a wide diversity of techniques, types of treatment, combinations, and drug dosages. We review consensus treatments, and emphasize the emerging treatments that represent future therapeutic options: capsaicin and lidocaine patches, cannabinoids and botulinum toxin.
El dolor neuropático, a pesar de todos los avances en los últimos años en cuanto a su diagnóstico y tratamiento, sigue siendo un verdadero reto y desafío para todos los profesionales implicados en el ámbito sanitario. Aún hoy por hoy, en la práctica clínica, se precisa una aproximación terapéutica más racional.
El dolor neuropático se define como aquel dolor que se produce a consecuencia de una lesión o enfermedad que afecta al sistema somatosensorial1, definición a la que se llegó tras acuerdo de consenso de expertos en dolor neuropático —NeuPSIG (Special Interest Group on Neuropathic Pain)— de la International Association for the Study of Pain (IASP) en el año 2008. Este tipo de dolor con mucha frecuencia no se diagnostica y, por tanto, no se trata. De este hecho se deriva sufrimiento, incapacidad, deterioro de la calidad de vida y aumento del gasto sanitario.
El dolor neuropático crónico no tiene ningún efecto beneficioso, es decir, no sirve para nada. Solo nos causa sufrimiento y problemas, y nuestro objetivo es reconocerlo, valorarlo y tratarlo, eliminándolo o al menos disminuyéndolo. Asimismo, la Sociedad Española del Dolor (SED) ha decidido promover una normalización metodológica a la hora de establecer el diagnóstico y cuantificar la respuesta clínica a los tratamientos establecidos en los pacientes con dolor neuropático. Con este fin, ha elaborado un documento con una propuesta metodológica que incluye una serie de cuestionarios y escalas para la valoración y el seguimiento de estos pacientes.
El dolor neuropático se produce como consecuencia de la aparición de alteraciones neurológicas tras disrupción o lesión neurológica somatosensorial a nivel periférico o central, que puede provocar dolor incapacitante, hinchazón, alteración vasomotora, sudoración anormal y alteración de la función motora. Aunque aún no disponemos de un test específico, el diagnóstico cada vez es más preciso gracias a la aplicación de escalas, cuestionarios y pruebas de laboratorio más dirigidas.
PrevalenciaNo se conoce exactamente cuál es su prevalencia, ya que en muchos casos no se diagnostica. Sabemos por 2 estudios realizados en Europa que la prevalencia de dolor de un origen predominantemente neuropático es del 8%2, y la del dolor que presenta características neuropáticas es del 7%3. Ambos estudios destacan que la intensidad y la incapacidad que provoca el dolor neuropático son más difíciles de soportar que cualquier otro tipo de dolor. Se ha visto que la depresión, la ansiedad y las alteraciones en el descanso nocturno son significativamente más prevalentes que en los otros tipos de dolor4. Las evidenciamos en casi todos los pacientes afectados por este dolor.
Solo estos datos ya nos hacen reflexionar que necesitamos un mejor entrenamiento para diagnosticar, evaluar y tratar el dolor neuropático. El dolor neuropático está presente en muchos ámbitos de la clínica diaria: una intervención de hernia inguinal puede derivar en un dolor neuropático posquirúrgico en el 10% de pacientes operados5. La presencia de neuralgia postherpética (NPH) se evidencia en el 8% de los pacientes después de un herpes zoster6. En nuestra área —Barcelona Esquerra, que da atención sanitaria a unas 550.000 personas— se revisaron en 3 centros de atención primaria todos los casos de NPH del año 2008. De 336 pacientes diagnosticados de herpes zoster, el 13,4% (45 pacientes) desarrollaron NPH, y hay que destacar que en el grupo de edad >80 años este porcentaje fue del 40%. La resolución del dolor, con tratamiento correcto, fue del 73,3%7; la del dolor tras accidente vascular cerebral (AVC), del 8%8; tras esclerosis múltiple, del 28%9; tras lesiones medulares, del 67%10, y tras polineuropatía diabética, del 16%11.
Si observamos detenidamente estos datos, podemos inferir que la necesidad de un buen entrenamiento en el diagnóstico y el tratamiento del dolor neuropático no es tributaria de una sola especialidad médica, abarca a prácticamente todas las especialidades y el seguimiento de los pacientes con dolor neuropático ha de ser multidisciplinar y acordado.
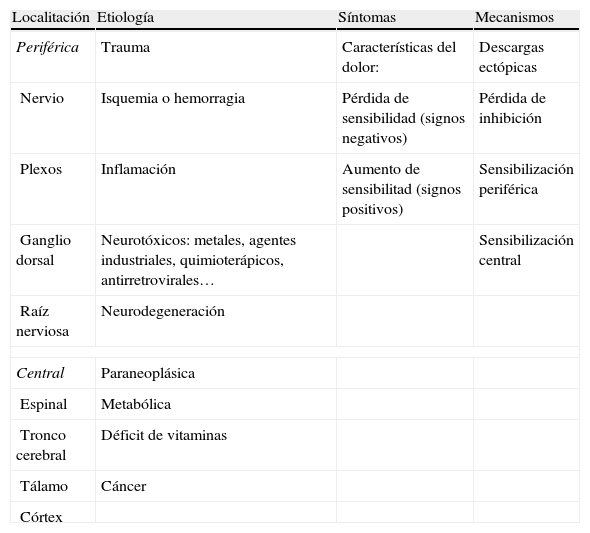
Clasificación del dolor neuropáticoTeniendo en cuenta que la lesión que provoca el dolor neuropático se puede producir a lo largo de toda la vía nerviosa, desde la periferia en los nociceptores hasta las neuronas corticales en el cerebro, la forma más fácil de clasificarlo es en periférico (con origen localizado en el nervio periférico, en los plexos, en los ganglios de las raíces dorsales o en las raíces nerviosas) y central (lesiones en el cerebro o en la médula)12 (tabla 1).
Clasificación del dolor neuropático
| Localitación | Etiología | Síntomas | Mecanismos |
| Periférica | Trauma | Características del dolor: | Descargas ectópicas |
| Nervio | Isquemia o hemorragia | Pérdida de sensibilidad (signos negativos) | Pérdida de inhibición |
| Plexos | Inflamación | Aumento de sensibilitad (signos positivos) | Sensibilización periférica |
| Ganglio dorsal | Neurotóxicos: metales, agentes industriales, quimioterápicos, antirretrovirales… | Sensibilización central | |
| Raíz nerviosa | Neurodegeneración | ||
| Central | Paraneoplásica | ||
| Espinal | Metabólica | ||
| Tronco cerebral | Déficit de vitaminas | ||
| Tálamo | Cáncer | ||
| Córtex | |||
Modificado de Haanpää y Treede12.
También se puede clasificar según la etiología, los síntomas o los mecanismos.
Identificación del dolor neuropáticoHistoria y examen clínico: se basa en la historia clínica bien detallada y en la exploración física. Debemos ser capaces de reconocerlo e identificar los síntomas que presenta el paciente:
- •
Cronología de la sintomatología.
- •
Localizar la lesión: periférica o central.
- •
Patología de base que genera el dolor.
- •
Valorar las limitaciones funcionales derivadas del dolor.
- •
Comorbilidad.
- •
Entorno social.
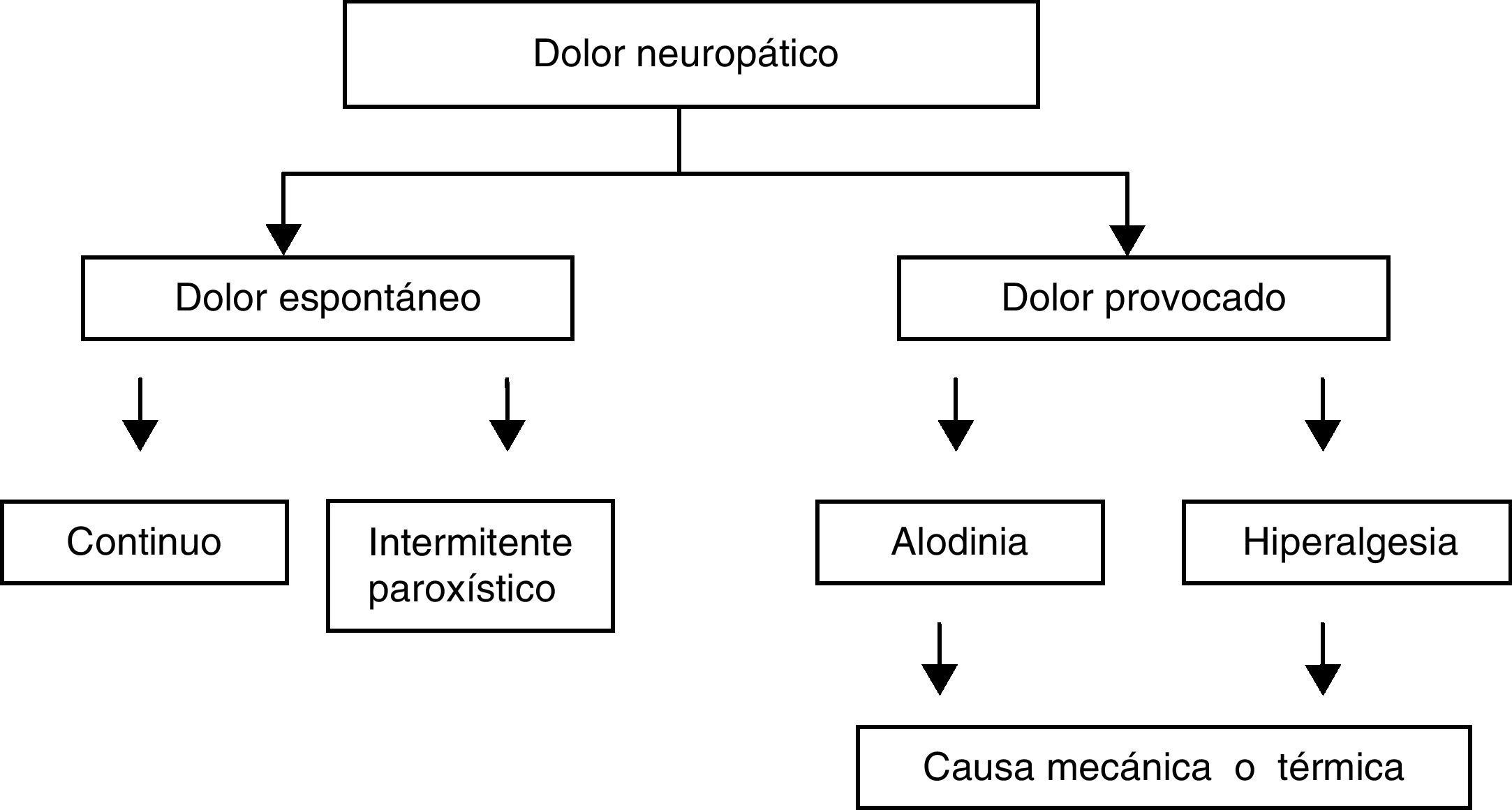
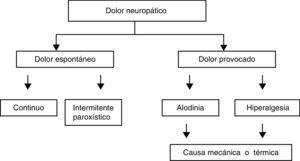
El dolor neuropático presenta características dolorosas espontáneas y provocadas (fig. 1). Se caracteriza por la asociación de síntomas sensoriales positivos y negativos (tabla 2)13.
Componentes del dolor neuropático. Modificada de Haanpää y Treede12.
Definiciones sugestivas de dolor neuropático
| Parestesia | Sensación anormal espontánea o inducida no dolorosa |
| Disestesia | Sensación desagradable anormal espontánea o evocada dolorosa |
| Hipoestesia | Disminución de la sensibilidad a un estímulo no doloroso |
| Hiperestesia | Aumento de la sensibilidad a un estímulo táctil o térmico no doloroso |
| Hipoalgesia | Disminución de la respuesta a un estímulo que normalmente es doloroso |
| Hiperalgesia | Respuesta exagerada a un estímulo que normalmente es doloroso |
| Alodinia | Respuesta dolorosa a un estímulo no doloroso provocado |
Modificada de Merskey y Bogduk13.
Estos fenómenos que describen los pacientes y que varían de uno a otro, conforman un conjunto de síntomas variables descritos de diferente forma (como desagradables, molestos, dolorosos, etc.), lo que nos da una idea de la complejidad del dolor neuropático. No es posible determinar la etiología del dolor neuropático solo por las características clínicas del dolor. Con la intención de facilitar el diagnóstico disponemos de diversas escalas y cuestionarios dirigidos a la identificación del dolor neuropático y que permiten distinguir el dolor nociceptivo del neuropático y detectar los diferentes síntomas y signos presentes en este tipo de dolor. Destacamos la Neuropathic Pain Scale (NPS), la escala de Leeds para síntomas y signos de dolor neuropático (Leeds Assessement of Neuropathic Symptoms and Signs, Lanseria), el cuestionario de dolor neuropático (Neuropathic Pain Questionnaire [NPQ]) y el cuestionario Doleur Neuopathique en 4 cuestiones (DN4). Nos quedamos con este último (anexo 1)14. Está validado al castellano y es uno de los más recomendados en la medicina primaria por ser muy sencillo y rápido de hacer, y además es el cuestionario diagnóstico recomendado en el documento de consenso de la SED. Permite distinguir el dolor neuropático, el nociceptivo y el mixto. Comprende 10 parámetros, con una puntuación total de 10. Una puntuación a partir de 4 es indicativa de dolor neuropático o mixto. En función del número de ítems que presente el paciente, como es razonable, la sensibilidad y la especificidad del cuestionario para establecer el diagnóstico del dolor neuropático se ven modificadas. Los autores del documento han elegido que sean 3 el número de ítems que deba cumplir el paciente para que se establezca el diagnóstico de dolor neuropático, priorizando la sensibilidad diagnóstica frente a la especificidad. Cumpliendo 3 ítems, la sensibilidad del cuestionario es del 90,3% y la especificidad, del 76,8%.
En el documento de consenso de la SED se ha incluido el cuestionario de discapacidad de Oswestry, que mide el grado de discapacidad en pacientes con dolor lumbar. Los autores del consenso español han seleccionado este cuestionario, dada la alta prevalencia de pacientes con dolor lumbar asociado a dolor neuropático que son tratados en las unidades de dolor crónico. La discapacidad en el dolor neuropático provoca en el paciente un sentimiento de no utilidad que se incrementa con la progresión del dolor, tal como se ha podido demostrar en estudios de metaanálisis muy recientes.
Por otra parte, el documento de la SED incluye el cuestionario Short Form SF-12 Health Survey (SF-12), instrumento que proporciona un perfil de estado de salud. Es una de las escalas genéricas más utilizadas en la evaluación de los resultados clínicos y es aplicable en la población general de pacientes con una edad mínima de 14 años, en estudios descriptivos y de evaluación.
Con el fin de medir la comorbilidad asociada al dolor neuropático, los autores también han incluido un cuestionario sobre ansiedad y depresión (Escala Hospitalaria de ansiedad y Depresión [HAD]) y una escala de sueño (Medical Outcomes Study [MOS]).
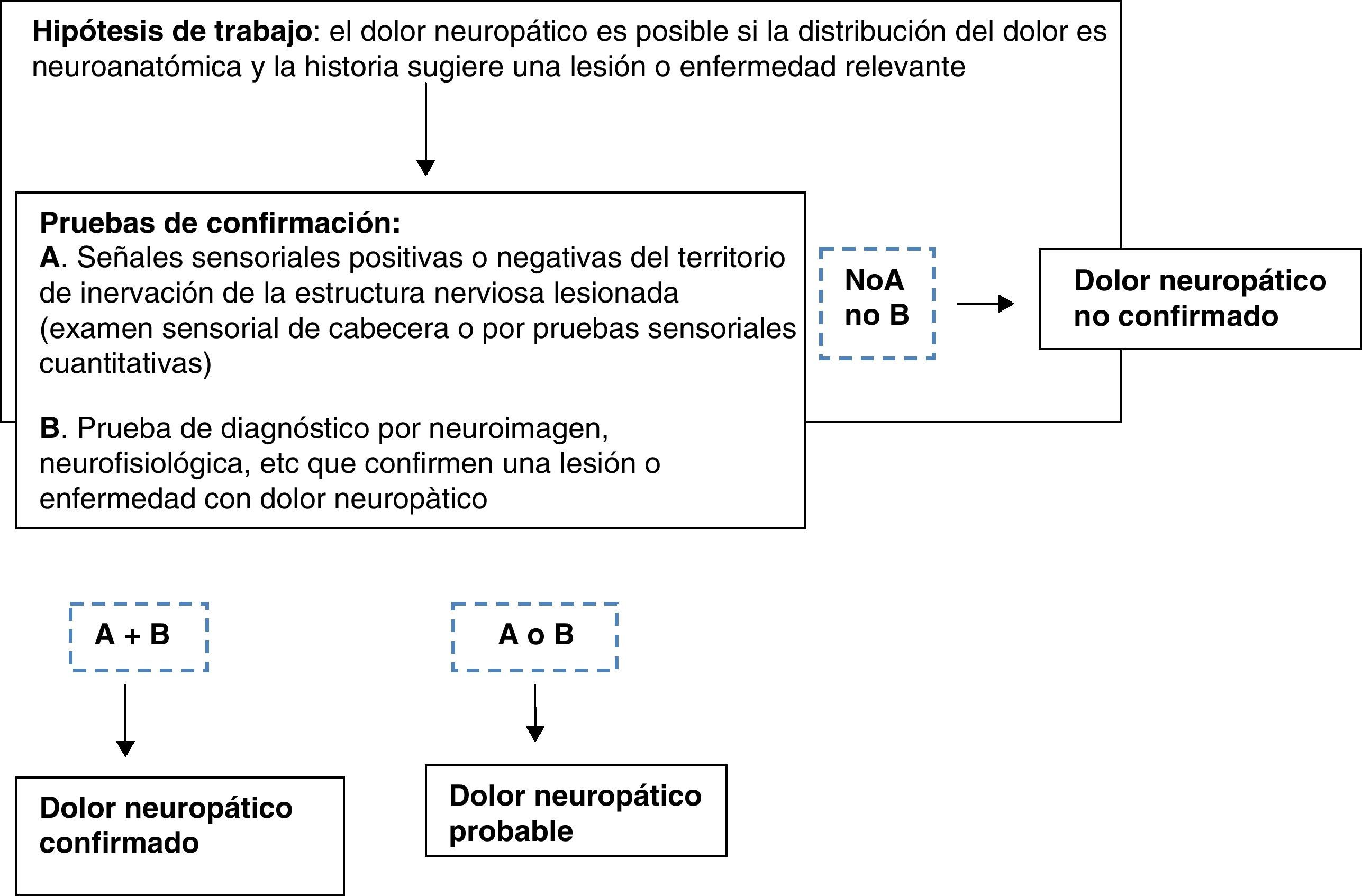
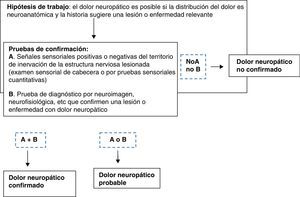
Localización. Examen neurológicoEl diagnóstico del dolor neuropático se basa en una cuidadosa exploración (fig. 2).
Diagnóstico de dolor neuropático. Modificada de Treede et al.1.
La historia clínica debe incluir la localización, la intensidad, el carácter y el perfil temporal, así como los factores agravantes del dolor. La localización del dolor es neuroanatómica en la zona tributaria del nervio afectado. La intensidad del dolor se puede medir mediante la escala verbal o numérica (1-10) o la escala visual analógica (EVA). Del dolor neuropático debemos valorar:
- •
Si es continuo o esporádico.
- •
Tipos de dolor: lancinante, que quema, con pinchazos, descarga eléctrica, entumecimiento, dolor evocado al tocar la luz, dolor al frío, presencia de dolor al mínimo contacto (alodinia), etc.
En ocasiones el diagnóstico puede ser sencillo, como en la NPH después de un cuadro de herpes zoster. En otros casos de neuropatía de distribución periférica será necesario un estudio neurológico más completo, con utilización de test de laboratorio que incluya hemograma, pruebas hepáticas, proteínas séricas, vitamina B12, marcadores tiroideos, etc. Cuando la electromiografía es normal, hay que pensar en una neuropatía de fibras pequeñas que se puede diagnosticar con el estudio de tests somatosensoriales cualitativos y cuantitativos, tras estímulos nociceptivos térmicos y mecánicos y no nociceptivos (afectación de fibras sensoriales de pequeño calibre C y A-delta15,16). En estos estudios se ha podido objetivar que la hiperalgesia mecánica es más frecuente que la térmica, y que la alodinia es mucho más frecuente cuando el origen del dolor neuropático es una NPH. La utilización de potenciales evocados es útil para estudiar la función de las fibras A-delta y la biopsia cutánea puede ser útil para medir la densidad de fibras afectadas en pacientes con signos de disfunción neuronal de pequeñas fibras. Aunque la utilización del diagnóstico por la imagen, la estimulación magnética transcraneal, no está tan extendida en el dolor neuropático en la práctica habitual, nos da una relación de la inhibición motora a nivel central en el dolor neuropático con independencia de la lesión nerviosa periférica15,16.
EtiopatogeniaAunque aún no se conocen todos los detalles de los mecanismos que provocan el dolor neuropático, cada vez se tiene más conocimiento de las enfermedades asociadas a este síndrome y de las claves de las áreas de intervención, tanto sobre la hiperexcitabilidad neuronal periférica como sobre la central. Los canales iónicos de transmisión nerviosa (Nav1.7, Nav 1.8, Nav1.3, Cav2.2 y alfa2-delta subunidades) se alteran en el dolor neuropático, siendo así su bloqueo beneficioso para el tratamiento. También puede ser beneficioso el bloqueo de los receptores TRP V1, TRPM8 y receptores nicotínicos (NNRs) importantes para la sensibilización neuronal. Otras actuaciones, como la modulación de la excitabilidad periférica vía receptores CB1, la reducción de la excitabilidad espinal por bloqueo de receptores de glutamato, el bloqueo de la activación espinal neuroglial (CCR” y P2X7) o el incremento de la inhibición espinal por la mejora de la actividad monoaminérgica, están en proceso de validación a nivel clínico. También empieza a plantearse el abordaje biomolecular en el tratamiento del dolor neuropático. Anticuerpos y tratamiento a nivel genético van parejos al tratamiento de la enfermedad neuronal de base1,5,12.
Tratamiento farmacológico. Recomendaciones basadas en la evidencia en el dolor neuropático periférico y centralOtro problema en el dolor neuropático es cuándo, cómo y con qué debe tratarse. Son numerosas las publicaciones al respecto. Existe gran heterogeneidad en técnicas y tipos de tratamiento, combinación y dosificación de fármacos. Estudios clásicos hablan del papel del bloqueo simpático en el tratamiento del dolor neuropático. Aunque dicho mecanismo de tratamiento es evidente, hoy todavía no están claros su utilidad y el resultado a largo plazo. El tratamiento con bifosfonatos y calcitonina ha resultado eficaz en algunos pacientes. Las terapias cognitivo-conductual y ocupacional y la psicoterapia han contribuido al efecto beneficioso del tratamiento. Los tratamientos invasivos, como la estimulación de cordones posteriores, la acupuntura, tratamientos con esteroides y vitamina C, etc., son beneficiosos en la disminución del nivel de dolor; la neuroestimulación con sistemas implantables a nivel central y periférico es cada vez más indicada en el dolor neuropático para la disminución del dolor y la mejoría de la capacidad funcional y de la calidad de vida.
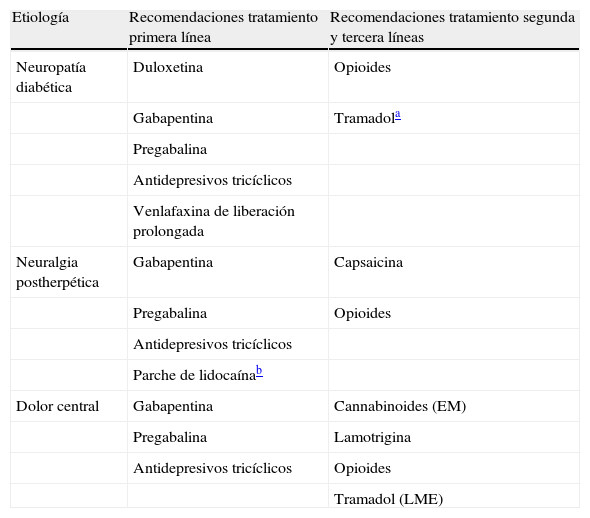
El tratamiento del dolor neuropático es de por sí multidisciplinar, dada la comorbilidad asociada, la edad avanzada frecuente en los pacientes, la ansiedad y la depresión provocada por el dolor (tabla 3). Los antidepresivos tricíclicos (ADT), los anticonvulsivantes (gabapentina y pregabalina), junto con los antidepresivos de última generación (duloxetina y venlafaxina) son los recomendados como tratamientos de primera línea por la IASP, por el Neuropathic Pain Special Group y por la Federación Europea de la Sociedad de Neurología (EFNS)17,18. La lidocaína tópica se recomienda de primera línea en la NPH y está especialmente indicada en las personas mayores. Los opiáceos mayores en general, y el tramadol, son de segunda elección en este tipo de dolor y pasan a ser de primera línea cuando se presenta una exacerbación de este tipo de dolor17. Muchos estudios recientes confirman la utilidad de la pregabalina en las lesiones de médula espinal19,20. Un grupo más reducido de estudios refieren mejora cuando se trata la lesión medular con ADT, gabapentina y tramadol17. Parece que la alodinia provocada por el frío y cepillado en el dolor central responde bien a la duloxetina21.
Recomendaciones para el tratamiento del dolor neuropático
| Etiología | Recomendaciones tratamiento primera línea | Recomendaciones tratamiento segunda y tercera líneas |
| Neuropatía diabética | Duloxetina | Opioides |
| Gabapentina | Tramadola | |
| Pregabalina | ||
| Antidepresivos tricíclicos | ||
| Venlafaxina de liberación prolongada | ||
| Neuralgia postherpética | Gabapentina | Capsaicina |
| Pregabalina | Opioides | |
| Antidepresivos tricíclicos | ||
| Parche de lidocaínab | ||
| Dolor central | Gabapentina | Cannabinoides (EM) |
| Pregabalina | Lamotrigina | |
| Antidepresivos tricíclicos | Opioides | |
| Tramadol (LME) |
EM: esclerosis múltiple; LME: lesión de la médula espinal.
El dolor neuropático de tipo central responde a los mismos tratamientos que el dolor neuropático de tipo periférico, pero con resultados más modestos. Es más rebelde a todo tipo de tratamiento. La neuropatía asociada al VIH y la radiculopatía crónica responden mal a fármacos útiles en el dolor neuropático. La lamotrigina, el cannabis y la capsaicina en parches resultan moderadamente útiles18.
Nuevas combinacionesSe han hecho muchos estudios en dolor neuropático, la mayoría realizados en un solo centro y en pequeñas muestras. Estos estudios muestran similar eficacia en todos los ADT17. El alivio del dolor es mayor cuando se asocia la morfina a la nortriptilina, mientras que la eficacia analgésica de la metadona es comparable a la de los ADT22.
Otros estudios demuestran similar eficacia entre gabapentina versus amitriptilina y entre lamotrigina versus amitriptilina en el dolor neuropático de origen diabético23. Muchos estudios controlados con placebo confirman el beneficio de la gabapentina asociada a nortriptilina o monoterapia de morfina en la neuropatía diabética, así como que la combinación de oxicodona y gabapentina es superior a la gabapentina sola23,24.
Tratamientos emergentesRepresentan opciones terapéuticas de futuro. Destacamos cuatro:
Parches de capsaicinaLa capsaicina es un agonista de los receptores vaniloides. Su efecto va desde un aumento de la sensibilidad hasta la desensibilización persistente en aplicaciones sucesivas, y existe todavía incertidumbre sobre su eficacia y su tolerabilidad en el tratamiento de neuropatías crónicas. Los estudios de revisión solo demuestran mejoría del dolor en aplicación en una única dosis o en repetidas ocasiones en algunos pacientes con dolor neuropático, y la irritación cutánea frecuente es motivo de abandono del tratamiento. El parche de capsaicina al 8%, recientemente introducido, aunque todavía no existen estudios de revisión suficientes, parece que pueda ser una muy buena opción de tratamiento de los pacientes afectados de NPH, de dolor neuropático periférico y de polineuropatía diabética25,26. Está especialmente indicado en la alodinia o dolor quemante. Sus principales efectos adversos son las reacciones locales: dolor, eritema, edema o picor en el momento de su aplicación. Los parches de capsaicina se aplican durante 30-60min en la zona afectada por el dolor neuropático y su duración es de 3meses. La indicación y el tratamiento (colocación de parches) son hospitalarias.
Toxina botulínica AMuchas líneas de investigación sugieren que la toxina botulínica A (BTX-A) puede producir efecto analgésico independiente del efecto sobre el músculo, posiblemente por acción sobre la inflamación neurógena. Dos estudios recientes muestran una eficacia sobre la alodinia a largo plazo para inyección de 100 a 200unidades en zona subcutánea en mononeuropatías27. Este fármaco tiene un excelente perfil de seguridad y no se asocia a efectos sistémicos.
CannabinoidesEl potencial terapéutico de los cannabinoides se ha estudiado de forma intensiva. El uso de estos fármacos es útil en el dolor asociado a la esclerosis múltiple con dolor refractario y a la alodinia18. Como efectos adversos destacamos mareo, boca seca, sedación, fatiga, efectos gastrointestinales e incomodidad. Aunque no se han encontrado efectos psicoactivos ni alteración del nivel de conciencia en el dolor neuropático, el uso de los cannabinoides no se recomienda en pacientes que presentan alteraciones mentales. Existe controversia en cuanto a la tolerancia y la dependencia a largo plazo28.
Parches de lidocaína 5%Recientemente introducidos en la práctica clínica en nuestro país, son parches de 10×14cm de aplicación y acción tópicas. Es un analgésico tópico. Está indicado en el dolor de origen neuropático secundario a un episodio de herpes zoster (NPH). Tiene una acción local con prácticamente nula absorción sistémica. Son muy bien tolerados; se colocan en la zona dolorosa durante 12h cada día y se descansan las otras 12h, para evitar lesiones cutáneas. Actúan a nivel de los canales de sodio estabilizando las membranas neuronales en las fibras A-delta y C29. Hemos tenido la posibilidad de utilizarlo fuera de indicación mediante la petición de uso compasivo en otros tipos de dolor (nociceptivo) y en otros tipos de dolor neuropático con resultados muy esperanzadores. Se trata de situarlo en el lugar adecuado y en las indicaciones en que obtengamos más beneficios. Son necesarios muchos más estudios y seguimiento del tratamiento con estos parches.
¿Es posible mejorar los resultados terapéuticos?A pesar de disponer de nuevos fármacos y de haber diseñado una combinación terapéutica racional que puede mejorar los resultados, la respuesta a la mayoría de los tratamientos en el dolor neuropático es discreta30. Nos faltan muchos estudios con más pacientes, a largo plazo y mucha más información básica para diseñar una mejor estrategia terapéutica. En una reciente publicación31 se pueden consultar las últimas guías clínicas en la valoración del dolor neuropático.
Existen técnicas no farmacológicas y no invasivas, como la estimulación magnética transcraneal32, que se están implementando para el tratamiento del dolor neuropático rebelde a los distintos tratamientos.
ConclusionesEl dolor neuropático es un dolor complejo. Se diagnostica poco y se trata peor. El desconocimiento de muchos de los mecanismos más íntimos de su fisiopatología, que se traducen en una clínica también difícil de valorar, hace que se trate de un dolor difícil, especialmente en su tratamiento, con una gran repercusión en todos los ámbitos de la vida del quien lo padece. Se trata de un verdadero reto para los clínicos. De ello deducimos que necesitamos:
- •
Diagnosticarlo mejor e identificarlo.
- •
Muchos más estudios para conocer sus mecanismos y las causas que lo desencadenan.
- •
Más estudios sobre fármacos y sus combinaciones.
- •
Buscar herramientas de diagnóstico más precisas.
- •
Valorar las repercusiones.
- •
Hacer seguimientos y estudios de su evolución.
- •
Seguridad a largo plazo de los tratamientos empleados.
Es indispensable la colaboración de todos para poder mejorar el diagnóstico, la valoración, el tratamiento y los resultados. La medicina primaria juega un papel muy importante. Es un reto que tenemos pendiente y debemos trabajar juntos.
Recomendaciones- •
Es muy conveniente orientar al paciente candidato, derivarlo a una unidad de dolor y pasarle un documento en el que se especifiquen la mayor parte de conceptos relacionados con el dolor: intensidad, duración, características, tipos, repercusión en las actividades diarias, insomnio, localización, incapacidad, invalidez, etc., para valorar e intentar programarlos según su prioridad.
- •
Hay que iniciar la «cultura» de los cuestionarios. Los hay muy sencillos y que dan mucha información sobre el dolor, sus características y las repercusiones. Esto nos facilita su tratamiento, que ya se puede iniciar desde la primaria. Es por ello que es muy recomendable la utilización del cuestionario DN4 de dolor neuropático.
- •
Control muy estricto reflejado en un documento a todos aquellos pacientes a los que administramos opioides potentes («Acuerdo de opioides»). En nuestra unidad ya lo utilizamos sistemáticamente, y es un compromiso su difusión entre las unidades de dolor, los médicos de primaria y el paciente. Evidentemente, cualquier médico que vea al paciente, si lo cree conveniente, puede modificar la pauta.
- •
La derivación a la unidad de dolor se debe hacer con una historia completa, las pruebas que se han pedido al paciente y, muy especialmente, los tratamientos que ya se han hecho —o los que toma el paciente, actualizados— y con una orientación diagnóstica. Es inadmisible que se deriven pacientes sin tratamiento analgésico ni historia clínica, ni pruebas, ni orientación. Debemos solucionarlo entre todos. Es nuestro reto.
Los autores declaran no tener ningún conflicto de intereses.