La espondiloartritis de inicio en la infancia, también conocida como espondiloartritis juvenil, representa un grupo especial dentro de las entidades comprendidas en el concepto de espondiloartritis, que se caracteriza por un predominio del compromiso periférico (artritis y entesitis) sobre el axial, y por presentarse más frecuentemente como formas indiferencias. Sin embargo, al igual que su equivalente de inicio adulto, tiene el potencial de desarrollar daño estructural y evolucionar a espondilitis anquilosante juvenil, con el consecuente deterioro funcional que se extenderá durante la vida del paciente. Se han producido importantes avances en el conocimiento de la genética y la fisiopatología de la espondiloartritis juvenil, así como en su diagnóstico y tratamiento, que se resumen en el presente artículo.
Juvenile-onset spondyloarthritis is a special group within the entities included in the concept of spondyloarthritis, and is characterized by a predominantly peripheral involvement (arthritis and enthesitis), and more frequent presentation as undifferentiated forms. However, like its adult-onset equivalent, it has the potential to develop structural damage and progress to juvenile ankylosing spondylitis, with consequent irreversible functional impairment. Many important advances have been made in the understanding of the genetics and pathophysiology of juvenile-onset spondyloarthritis, as well as in the diagnosis and treatment of this entity. These advances are summarized in this article.
Las espondiloartritis (EspA) son un grupo de enfermedades fenotípicamente distintas, pero genética y fisiopatológicamente relacionadas, que incluyen la espondilitis anquilosante (EA) (la enfermedad prototipo del grupo y la mejor estudiada), la artritis psoriásica (APso), la artritis asociada a la enfermedad inflamatoria intestinal (EII), la artritis reactiva (ARe), la espondiloartritis indiferenciada (EspInd), y un subgrupo pacientes comprendidos dentro de la artritis idiopática juvenil (AIJ)1,2. Comparten varias características clínicas, tales como el compromiso axial, la artritis periférica, la entesitis, manifestaciones extraarticulares (uveítis, psoriasis y EII), y ausencia de factor reumatoide (FR), anticuerpos antinucleares (ANA) u otros autoanticuerpos3. El sustento genético para agruparlas proviene de su presentación simultánea o secuencial en un mismo individuo o en los miembros de su familia, y de su fuerte asociación con HLA-B272. Generalmente comienzan en la tercera o cuarta décadas de vida, pero del 10 al 20% de los casos presentan síntomas desde la infancia. Se estima que la EspA de inicio en la edad pediátrica, también conocida como EspA juvenil (EspA-J), representa del 15 al 20% del total de artritis en niños4.
La EspA-J no es una simple analogía de su equivalente de inicio adulto, sino que posee características especiales que la diferencian, como el predominio de la artritis periférica y la entesitis sobre el compromiso axial, y su presentación más frecuente como formas indiferenciadas4,5. Sin embargo, al igual que en el adulto, tiene el potencial de evolucionar a EA6,7, con el consecuente deterioro funcional y de la calidad vida, afectando al paciente en etapas posteriores8,9. Por esto resulta de especial interés identificar a los niños con factores de riesgo para desarrollo de daño estructural, a fin de poder instaurar las medidas terapéuticas adecuadas de forma temprana. El presente artículo revisa los aspectos clínicos y terapéuticos más relevantes para este grupo especial de enfermedades de la infancia.
ClasificaciónA pesar de las similitudes entre la EspA-J y la del adulto, existen importantes diferencias que justifican la búsqueda de criterios específicos para pacientes pediátricos. La EspA-J comprende un grupo heterogéneo de entidades diferenciadas e indiferenciadas4,10 (tabla 1), lo que ha conducido al desarrollo y a la aplicación de varios sistemas de diagnóstico y clasificación11-14.
Entidades comprendidas dentro del espectro de las espondiloartritis en la infancia
| Formas clínicas diferenciadas |
| Espondilitis anquilosante juvenil |
| Artritis psoriásica juvenil |
| Artritis reactiva juvenil |
| Artritis asociada a la enfermedad inflamatoria intestinal de inicio pediátrico |
| Formas clínicas indiferenciadas |
| Artritis relacionada con entesitis |
| Síndrome de entesopatía y artropatía seronegativas (síndrome SEA) |
| Tarsitis anquilosante |
| Formas clínicas aisladas |
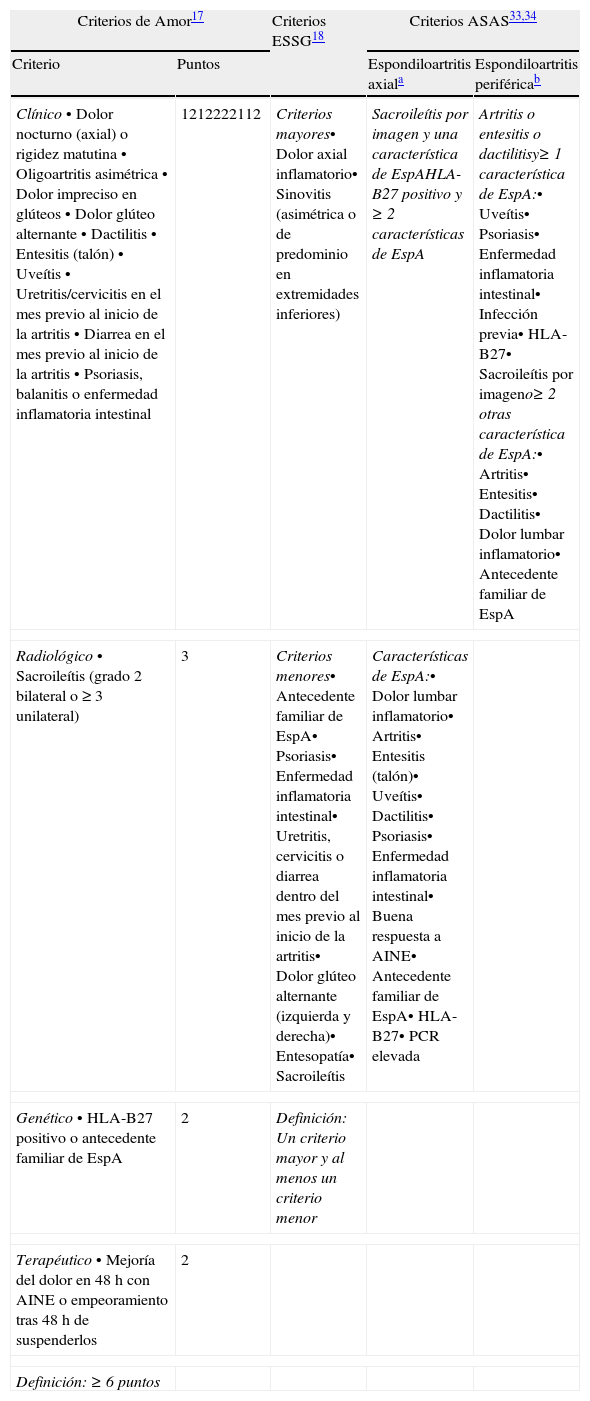
Los criterios de New York modificados (NYm), utilizados para el diagnóstico de la EA en adultos (tabla 2)15, son poco aplicables a la EspA-J, debido a que el compromiso axial es infrecuente en este grupo y los cambios radiográficos aparecen tardíamente5,16. Los sistemas de clasificación desarrollados para las EspA de inicio adulto por Amor et al.17 y el European Spondyloarthropathy Study Group (ESSG)18 han sido probados en la EspA-J (tabla 3). Prieur et al.19 estudiaron estos criterios en 310pacientes consecutivos atendidos en un solo centro, incluyendo 33 con EspA-J definitiva y 19 probable, y encontraron que los de Amor funcionan mejor en niños. La sensibilidad fue del 84 y del 69,7%, y la especificidad, del 96,1 y del 92,2% para los criterios de Amor y ESSG, respectivamente. Este mismo grupo realizó un estudio multicéntrico en 2.982niños europeos con varias enfermedades reumatológicas que incluían 324 con EspA-J definitiva y 334 probable, demostrando una sensibilidad del 73,5% y una especificidad del 97,6% para los criterios de Amor, y una sensibilidad del 78,7% y una especificidad de 92,2% para los criterios ESSG20. Estos resultados demuestran que ambos sistemas funcionan en la EspA-J de forma similar a como lo hacen en adultos4; sin embargo, el parámetro de «dolor axial inflamatorio», incluido en los criterios ESSG, presenta una sensibilidad muy baja (9,1%) en niños21.
Criterios de New York modificados para la espondilitis anquilosante (1984)15
| Criterios clínicos |
| Dolor lumbar y rigidez que mejoran con el ejercicio pero que no se alivian con el reposo, de más de 3 meses de evolución |
| Limitación de la movilidad de la columna lumbar en los planos sagital y frontal |
| Limitación de la expansión torácica respecto a los valores normales según el sexo y la edad |
| Criterio radiológico |
| Sacroileítis grado ≥ 2 bilateral o grado ≥ 3 unilateral |
| Definición |
| El diagnóstico definitivo de espondilitis anquilosante se establece si el criterio radiológico se asocia al menos a un criterio clínico |
| El diagnóstico es probable si: |
| Los 3 criterios clínicos están presentes |
| Solo está presente el criterio radiológico sin ningún signo o síntoma que satisfaga los criterios clínicos (deberían considerarse otras causas de sacroileítis) |
Criterios de clasificación de las espondiloartritis en adultos
| Criterios de Amor17 | Criterios ESSG18 | Criterios ASAS33,34 | ||
| Criterio | Puntos | Espondiloartritis axiala | Espondiloartritis periféricab | |
| Clínico• Dolor nocturno (axial) o rigidez matutina• Oligoartritis asimétrica• Dolor impreciso en glúteos• Dolor glúteo alternante• Dactilitis• Entesitis (talón)• Uveítis• Uretritis/cervicitis en el mes previo al inicio de la artritis• Diarrea en el mes previo al inicio de la artritis• Psoriasis, balanitis o enfermedad inflamatoria intestinal | 1212222112 | Criterios mayores• Dolor axial inflamatorio• Sinovitis (asimétrica o de predominio en extremidades inferiores) | Sacroileítis por imagen y una característica de EspAHLA-B27 positivo y ≥ 2 características de EspA | Artritis o entesitis o dactilitisy≥ 1 característica de EspA:• Uveítis• Psoriasis• Enfermedad inflamatoria intestinal• Infección previa• HLA-B27• Sacroileítis por imageno≥ 2 otras característica de EspA:• Artritis• Entesitis• Dactilitis• Dolor lumbar inflamatorio• Antecedente familiar de EspA |
| Radiológico• Sacroileítis (grado 2 bilateral o ≥ 3 unilateral) | 3 | Criterios menores• Antecedente familiar de EspA• Psoriasis• Enfermedad inflamatoria intestinal• Uretritis, cervicitis o diarrea dentro del mes previo al inicio de la artritis• Dolor glúteo alternante (izquierda y derecha)• Entesopatía• Sacroileítis | Características de EspA:• Dolor lumbar inflamatorio• Artritis• Entesitis (talón)• Uveítis• Dactilitis• Psoriasis• Enfermedad inflamatoria intestinal• Buena respuesta a AINE• Antecedente familiar de EspA• HLA-B27• PCR elevada | |
| Genético• HLA-B27 positivo o antecedente familiar de EspA | 2 | Definición: Un criterio mayor y al menos un criterio menor | ||
| Terapéutico• Mejoría del dolor en 48h con AINE o empeoramiento tras 48h de suspenderlos | 2 | |||
| Definición: ≥ 6 puntos | ||||
El primer intento de diferenciar a los pacientes con EspA-J fue la clasificación europea de la artritis crónica juvenil (ACJ)22, que incluía 2subtipos pauciarticulares: el tipo1, que afecta a niñas pequeñas y se asocia a ANA positivos y uveítis anterior crónica, y el tipo2, más frecuente en niños mayores, con oligoartritis asimétrica, uveítis anterior aguda y alta prevalencia de HLA-B2722. Sin embargo, esta clasificación es muy genérica y no hace distinción entre los diferentes subtipos de la EspA-J. En 1982, Rosenberg y Petty12 agruparon a los niños con artropatía, entesopatía y ausencia de FR y ANA en el denominado síndrome SEA (Seronegative Enthesitis and Arthritis syndrome) (tabla 4). Esto permitió reconocer que este cuadro era diferente a otras formas de artritis de la infancia, ya que estos pacientes no cumplían criterios para EA pero presentaban inflamación en entesis, además de la artritis periférica23.
Criterios de clasificación específicos para las espondiloartritis en la infancia
| Artritis relacionada con entesitis (ILAR)11 | Síndrome SEA12 | Criterios de Garmisch-Partenkirchen13 | Espondiloartritis atípica en niños14 |
| Definición: Artritis y/o entesitis y ≥ 2 de las siguientes características:• Presencia o antecedente de dolor en sacroilíacas y/o lumbosacralgia inflamatoria• Presencia de HLA-B27 positivo• Inicio de artritis en varón mayor de 6 años• Uveítis anterior aguda (sintomática)• Antecedente de enfermedades asociadas a HLA-B27 en familiar de primer grado | Inicio de síntomas musculoesqueléticos antes de los 17 añosAusencia de FR y ANASignos de entesopatíaArtralgia o artritis | Criterios mayores:• Oligoartritis asimétrica con compromiso de cadera, rodilla o tobillo• Entesopatía• Dolor en columna lumbar o en región sacroilíaca• Uveítis aguda | Criterios mayores:• Antecedente familiar de espondiloartritis• Entesopatía• Artritis de articulaciones digitales• HLA-B27 positivo• Recurrencias frecuentes de artritis y artralgias |
| Criterios menores:• Artritis periférica de ≥ 5 articulaciones• Sexo masculino• Inicio de enfermedad después de los 6 años• HLA-B27 positivo• Antecedente o sospecha de EspA en la familia | Criterios menores:• Inicio de enfermedad después de los 10 años• Sexo masculino• Localización en extremidades inferiores• Uveítis aguda o conjuntivitis• Artritis de cadera• Aparición de manifestaciones tras enteritis | ||
| Exclusiones:• Psoriasis en el paciente o en familiar de primer grado• FR IgM• Artritis sistémica• Artritis que cumple criterios de 2 categorías de AIJ | Definición: 2 criterios mayores o cualquiera de los 2 primeros mayores y 2 criterios menores | Definición: 4 criterios ó 3 mayores más 3 menores | |
Otros sistemas de clasificación específicos para la EspA-J de aparición posterior son los criterios de Garmisch-Partenkirchen (GP) desarrollados por Hafner13 en 1987, y los criterios de EspA atípica en niños propuestos por Hussein et al.14 en 1989 (tabla 4). Sin embargo, no fue hasta 1995 que se logró promover una iniciativa internacional para lograr una mejor clasificación de las artritis en la infancia, que se concretó en los criterios de la International League of Associations for Rheumatology (ILAR) para la AIJ, que fueron revisados en 1997 (Durban)24 y en 2001 (Edmonton)11. Esta clasificación reagrupa a los pacientes con EspA-J en 2categorías: la artritis relacionada con entesitis (ERA) y la APso juvenil (APso-J), sin considerar otras formas diferenciadas como la artritis reactiva juvenil (ARe-J) o la artritis asociada a la EII de inicio pediátrico, aunque incluye una categoría de artritis indiferenciada en la que pueden clasificarse pacientes que poseen características de 2 o más categorías o que no encajan en ninguna de ellas11. El subtipo que mejor se correlaciona con la EA juvenil (EA-J) en esta clasificación es la ERA (tabla 4). Esta categoría intenta unificar los diferentes tipos de EspA-J en función de la presencia de entesitis, funcionando como un espectro de enfermedad que abarca desde formas indiferenciadas como el síndrome SEA, hasta formas bien definidas como la EA-J23. En una serie de 80pacientes con EspA-J a los que se aplicaron los criterios ILAR, el 41% fueron clasificados como ERA25. Sin embargo, estos criterios presentan la desventaja de no poder clasificar a pacientes con manifestaciones axiales aisladas4, pero esta forma de presentación es extremadamente rara en la infancia7.
Se ha evaluada la concordancia entre los criterios ILAR y ESSG, con resultados contradictorios. En 2estudios se encontró que aproximadamente el 90% de los pacientes con EspA-J según criterios ESSG eran clasificados en la categoría ERA26,27. Sin embargo, en otros 2estudios la correlación fue mucho menor (47 y 37,3%, respectivamente)28,29. La razón para esta discrepancia probablemente sea que en estos estudios se utilizó la clasificación ILAR de 1997 y no la de 2001, habiéndose demostrado que esta última disminuye los pacientes incluidos en la categoría de artritis indiferenciada e identifica mejor los casos de poliartritis FR negativo30. Hasta la fecha solo se han llevado a cabo 2estudios comparativos de los diferentes criterios clasificatorios para la EspA-J. El primero de ellos, realizado por Kasapcopur et al.31, evaluó los criterios de Amor, ESSG, GP, EspA atípica en niños y síndrome SEA en 62pacientes turcos con EspA-J y 64 con AIJ (excluyendo ERA y APso-J), encontrando valores de sensibilidad del 82,3, el 83,9, el 95,2, el 61,3, y el 62,9%, y de especificidad del 95,3, del 87,5, del 78,1, del 98,4, y del 92,2%, respectivamente. A pesar de que los criterios de GP y EspA atípica en niños tuvieron los mejores resultados de sensibilidad y especificidad, respectivamente, ninguno demostró ser superior a los criterios de Amor y ESSG. Joos et al.32 estudiaron dichos criterios y la categoría ERA de 1997 en 43niños belgas con ACJ pauciarticular de inicio tardío y 62 con otros subtipos, demostrando que los criterios GP tenían la sensibilidad más alta (97,7%), mientras que la más baja correspondía al síndrome SEA (44,2%). Todos los criterios de EspA-J tuvieron alta especificidad (90-98%), pero los criterios GP se correlacionaron mejor con los de Amor y ESSG. Se debe tener en cuenta que ambos trabajos tienen importantes limitaciones debido al número limitado de pacientes y a las diferentes poblaciones estudiadas4.
Recientemente, la Assessment of SpondyloArthritis international Society (ASAS) ha introducido nuevos sistemas de clasificación para la EspA de inicio adulto, tanto axial33 como periférica34, con potencial impacto en la EspA-J (tabla 3). Estos criterios se desarrollaron a partir de la visión de la EspA como un continuo que va de un estadio pre-radiológico denominado «EspA axial», en el cual puede detectarse inflamación en sacroilíacas por resonancia magnética (RM), hasta llegar a la EA establecida, en la cual existe daño estructural que se traduce en sacroileítis radiológica y formación de sindesmofitos35. La clasificación de EspA axial requiere como criterio de entrada el antecedente de lumbalgia inflamatoria de al menos 3meses de evolución, así como la realización de RM y/o radiografía sacroilíacas33. Esto la hace inadecuada para la EspA-J, debido a que los síntomas axiales son infrecuentes en este grupo, y no parece ser claramente racional practicar RM en niños que no presentan estos síntomas36. La clasificación de EspA periférica parece ser más aplicable a la EspA-J, ya que utiliza como criterios de entrada la artritis periférica, la entesitis y la dactilitis. Estos criterios han demostrado tener un buen balance de sensibilidad (77,8%) y especificidad (82,9%), y funcionan mejor que los Amor y ESSG en adultos34, pero no se han validado en niños. La aplicación de los criterios ASAS resulta interesante debido a que tener un sistema común con los adultos podría facilitar la comunicación científica y la transición de pacientes pediátricos, así como la identificación simultánea de los estadios iniciales de la enfermedad en ambos grupos, por lo que queda pendiente establecer su rol en la EspA-J36.
EpidemiologíaLa prevalencia mundial de la AIJ es de 7-401 casos por 100.000 niños37, de los que del 3 al 11% corresponden a ERA y del 2 al 11%, a APso-J38. La prevalencia estimada de EA-J en población pediátrica es del 0,01 al 0,09%, basándose en la prevalencia de EA en adultos y en la frecuencia de inicio de síntomas en la infancia en estos pacientes38,39. La prevalencia de EspA-J en nuestro medio es desconocida, pero este grupo representó el 1,5% de 2.367 pacientes incluidos en el Registro Nacional de Pacientes con Espondiloartritis (REGISPONSER)40. Un estudio epidemiológico sobre la AIJ realizado en Cataluña encontró valores de incidencia y prevalencia para la ERA de 0,8 y 3,4 casos por 100.000niños, respectivamente41, mientras que en una serie de 60pacientes asturianos con AIJ, esta categoría representó el 11,7%42.
La mayoría de estudios describen una preponderancia del sexo masculino en la EspA-J, con una relación niño:niña de 7,4:1 en EA-J23 y de 3,4:1 en ERA43, pero se ha sugerido que la frecuencia es similar en ambos sexos. En una serie británica de 379pacientes con EA-J (278niños y 101niñas) se encontró una relación de 2,7:1. Para las edades de inicio de 5-13años la relación fue de 2,1:1, mientras que para los mayores de 14años fue de 3,2:139. Sin embargo, la sacroileítis clínica es frecuente en niños44.
PatogeniaFactores genéticosLos estudios genéticos en la EspA-J son escasos y con un número limitado de pacientes. Sin embargo, la asociación de EA-J con HLA-B27 es tan fuerte como lo es en adultos, estando presente hasta en el 91% de los casos23. Esto también ocurre en la ERA, habiéndose demostrado que el subtipo HLA-B*2705 confiere un odds ratio de 2,01 para desarrollarla45. Otros haplotipos del complejo mayor de histocompatibilidad tipo ii asociados al desarrollo de EA-J, pero no de EA de adulto, son HLA-DRB1*08, HLA-DPB1*0301 y la subunidad LMP2 del proteosoma, codificada dentro de misma región genética46,47. Recientemente se ha identificado a los genes que codifican la ERAP-1 (una aminopeptidasa del retículo endoplasmático que interviene en el procesamiento de antígenos presentados por HLA-B27) y el receptor de la interleucina 23 (IL-23R) (una citoquina que estimula la actividad de los linfocitos Th17) como nuevos marcadores de susceptibilidad para el desarrollo de EA48. Ambos genes fueron estudiados en 1.054 pacientes con AIJ (incluyendo 65 con ERA, 76 con APso-J y 24 con artritis indiferenciada) y 5.200 controles sanos, encontrándose que ERAP-1 se asocia fuertemente a ERA, mientras que IL-23R a APso-J. Sin embargo, ninguno de estos genes se asoció con otros subtipos de la AIJ49.
Los pacientes con fiebre mediterránea familiar (FMF) pueden desarrollar sacroileítis50 y entesopatía51 como manifestaciones de la enfermedad, y se ha descrito su presentación simultánea con EA52 y una mayor frecuencia de EspA en los familiares de primer grado53, lo que sugiere que el gen MEFV podría estar implicado en las EspA. En zonas en donde la FMF es prevalente, el porcentaje de adultos con EA que presentan mutaciones del gen MEFV puede alcanzar el 30,5%, con inicio de los síntomas en la infancia en muchos de ellos54. En un estudio realizado en 96niños turcos con AIJ (incluyendo 16 con ERA y uno con APso-J), las mutaciones del MEFV se detectaron en el 68,7% de los casos de ERA55.
Factores infecciososLas infecciones intestinales están implicadas en la patogenia de la ARe-J, pero también en otras formas de EspA-J. La búsqueda de ADN bacteriano en el líquido sinovial de pacientes con EA-J y EspInd juvenil (EspInd-J) demostró la presencia de Salmonella, Shigella, Chlamydia, Campylobacter y Mycobacterium tuberculosis56. Se han detectado además anticuerpos contra el peptidoglucano bacteriano en la EA-J57, y respuestas celulares T incrementadas contra enterobacterias en la ACJ pauciarticular HLA-B27 positivo58, iguales a las observadas en la ARe59. El estudio del líquido sinovial de 26niños con ERA detectó respuestas proliferativas antígeno-específicas contra Salmonella typhimurium, Yersinia enterocolitica, Shigella flexneri y Campylobacter jejuni en 14 de ellos, con predominio de linfocitos T CD103+60. Estas células son entrenadas en la mucosa intestinal frente a antígenos bacterianos, y posteriormente pueden llegar a la articulación (o eventualmente a otros órganos blanco, como la piel y el ojo) a través de la circulación, explicando en parte la relación entre la inflamación intestinal y articular en las EspA61. Se ha sugerido que la ERA representa en realidad una forma frustrada de ARe-J crónica62. La interacción inicial entre estas bacterias y el sistema inmune innato se realiza a través de los receptores toll-like (TLR), que reconocen estructuras moleculares conservadas en microorganismos patógenos y señales de daño tisular63. Se ha demostrado que los monocitos circulantes y del líquido sinovial de pacientes con ERA sobreexpresan TLR tipos2 y 4, y esto se correlaciona con aumento de la producción de mediadores proinflamatorios como la IL-6 y la metaloproteasa de la matriz extracelular3, por lo que las infecciones podrían influir en las exacerbaciones de la enfermedad64.
Inflamación intestinal subclínicaHasta dos tercios de los pacientes con EspA-J presentan inflamación intestinal subclínica65,66, que puede detectarse mediante la determinación de calprotectina fecal67, o por pruebas de imagen como la gammagrafía con leucocitos marcados68,69 o la enterografía por RM70. Se han descrito 2tipos histopatológicos: uno agudo, similar a la enterocolitis bacteriana, más frecuente en la ARe, y otro crónico indistinguible de la enfermedad de Crohn (EC), que se relaciona más a EspInd y a EA71. La inflamación intestinal subclínica se asocia a enfermedad erosiva y mayor riesgo de progresión a EA-J65,66,72.
Citoquinas proinflamatoriasEl factor de necrosis tumoral alfa (TNF-α) tiene un rol clave en la patogenia de las EspA. Se ha demostrado aumento del ARN mensajero del TNF-α cerca de zonas de neoformación ósea en biopsias sacroilíacas de adultos con EA73, y concentraciones elevadas de esta citoquina y de sus receptores a nivel sinovial en la EspA-J74. Aunque se ha considerado por mucho tiempo que la respuesta predominante en la EspA-J es de tipo Th123, estudios recientes han encontrado aumento de linfocitos Th17 e IL-17 en la ERA75,76, por lo que esta respuesta también podría ser importante en este grupo de enfermedades.
Histopatología sinovialLa sinovitis en la EspA-J se caracteriza por hipervascularización e infiltrado inflamatorio constituido por linfocitos y macrófagos, al igual que la EspA de inicio adulto. Sin embargo, difiere de esta última por presentar marcada hiperplasia de la capa de revestimiento y bajo número de macrófagos CD163+, superponiéndose parcialmente en estos aspectos con las categorías oligo y poliarticular de la AIJ77.
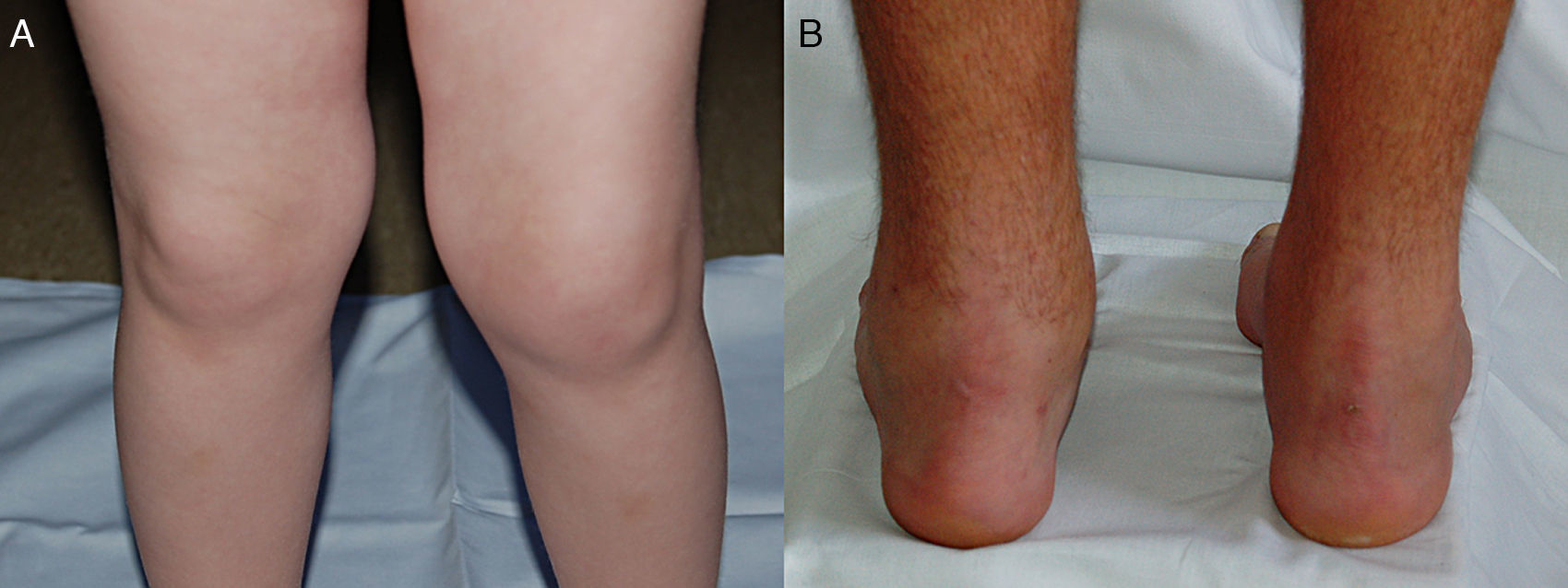
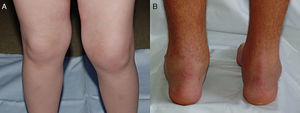
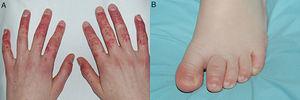
Manifestaciones clínicasManifestaciones articularesArtritisConstituye la manifestación más frecuente de la EspA-J, pero por sí sola tiene valor diagnóstico limitado5. La forma de inicio más común es la mono u oligoartritis asimétrica, aunque hasta el 25% de pacientes comienzan con poliartritis. Las articulaciones de extremidades inferiores están afectadas hasta en el 82% de los casos, mientras que las superiores solo en el 16%23. Las localizaciones más habituales son la rodilla, el tarso y el tobillo, siendo menos frecuente en articulaciones pequeñas del pie y caderas (fig. 1A)5. Su curso es muy variable. Algunos pacientes presentan uno o escasos episodios durante 3 a 6meses; esto suele ocurrir en ARe-J o EspInd-J con HLA-B27 negativo, y en la artritis periférica asociada a EII. Otros casos tienen un curso recurrente, con episodios de mayor duración seguidos por remisión completa o parcial, aunque con poco o ningún daño estructural. Raramente se desarrolla una poliartritis persistente, bilateral y simétrica, con daño estructural en múltiples articulaciones de las extremidades inferiores y superiores5.
EntesitisEste término hace referencia al compromiso inflamatorio de las entesis, es decir, las zonas de inserción de tendones, ligamentos y cápsula articular sobre la superficie ósea78. Es una característica distintiva de las EspA en general y la que mejor valor diagnóstico tiene en la EspA-J5, permitiendo diferenciar la ERA de otras categorías de la AIJ11. Representa la primera manifestación de la EA-J en el 60 al 80% de los casos, siendo más frecuente que la EA de inicio adulto, y se localiza preferentemente en las extremidades inferiores4,5,23. Inicialmente suele afectar una sola entesis, pero durante el curso de la enfermedad el compromiso puede ser múltiple. Las entesis del pie, incluyendo las calcáneas y las del tarso, son los sitios más comúnmente afectados, y pueden cursar con dolor intenso que origina limitación para la bipedestación, la deambulación, el subir escaleras y el correr (fig. 1B)5,79. Su evolución es tan variable como la de la artritis. Algunos pacientes presentan un único episodio, que dura más que el articular (aproximadamente 6-12meses) e involucra una o más entesis. En otros casos los episodios pueden ser recurrentes, seguidos por periodos de remisión completa o parcial. También puede aparecer entesitis severa y persistente en varias localizaciones, con desarrollo posterior de daño estructural que se traduce en entesofitosis, puentes óseos y anquilosis, y menos frecuentemente en la formación de quistes óseos y erosiones5.
Manifestaciones extraarticularesUveítis anterior agudaEs una de las manifestaciones extraarticulares más frecuentes de la Espa-J, y se da en el 7,8% de los casos de ERA80 y en 14 al 27% de EA-J13,81,82. Raramente precede al inicio de los síntomas articulares83. Es más común en niños, habitualmente es unilateral y recurrente, y se presenta con hiperemia conjuntival, dolor y fotofobia. La exploración con lámpara de hendidura demuestra la presencia de células en la cámara anterior. Generalmente es sintomática, por lo que se diagnostica y trata tempranamente, siendo infrecuente el desarrollo de secuelas, y su pronóstico visual es bueno84.
Manifestaciones cardiacasA pesar de que tradicionalmente se ha considerado que la enfermedad cardiovascular es rara en la EspA-J, al menos un estudio demuestra que las alteraciones valvulares, en especial la insuficiencia aórtica, son tan frecuentes como en la EspA del adulto85. Ocasionalmente, las valvulopatías pueden ser graves en niños86-88 y preceder al inicio de la enfermedad89,90.
Manifestaciones respiratoriasLos datos referentes a enfermedad pulmonar en la EspA-J son escasos. La expansión torácica puede estar disminuida 1-2cm en la EA-J debido a artritis y/o entesitis a dicho nivel23; sin embargo, este parámetro no ha demostrado ser útil para la valoración de la EspA-J91. En una serie de 18pacientes con EspA-J según criterios de Amor se encontraron alteraciones espirométricas en el 33%, todos ellos con radiografías de tórax normales. Las alteraciones más frecuentes fueron de tipo restrictivo, con escasa reducción de la capacidad de difusión y sin de enfermedad de la vía aérea92.
Manifestaciones renalesSon raras en las formas tempranas indiferenciadas de la EspA-J, aunque un estudio describió una frecuencia significativamente mayor de glomerulonefritis IgA en la EA-J (14%) con respecto a la de inicio adulto (3,7%)82. En una serie de pacientes con EA-J diagnosticada antes de 1980 se encontró que el 3,8% desarrollaban amiloidosis renal, correspondiendo este porcentaje a los que tenían artropatía periférica severa y elevación persistente de reactantes de fase aguda81.
Manifestaciones neurológicasLa subluxación atloaxoidea ha sido descrita en 2casos de EA-J (una niña de 7años HLA-B27 negativo93 y un niño de 11años HLA-B27 positivo94), en otros 2niños diagnosticados como síndrome SEA95, y en una paciente de 17años con EspA-J indiferenciada HLA-B27 positivo96. En todos estos casos constituyó la forma de presentación de la enfermedad.
Formas clínicas de espondiloartritis en la infanciaEspondilitis anquilosante juvenilLa EA-J es una forma clínica diferenciada de EspA-J que afecta a pacientes menores de 16años; presenta inflamación a nivel del esqueleto axial que conduce al desarrollo de rigidez y limitación funcional5. Se diagnostica a partir de los criterios NYm, al igual que en la EA de inicio adulto15; sin embargo, difiere en varios aspectos, particularmente en la forma de inicio. La mayoría de pacientes comienzan con formas clínicas indiferenciadas, principalmente oligoartritis periférica en las extremidades inferiores5,16. La entesitis también es predominante a dicho nivel, presentando exacerbaciones y remisiones paralelas a las de la artritis, pero en general es más severa y persistente97. Solo el 24% de los casos presentan síntomas axiales al inicio de la enfermedad23, y su prevalencia se incrementa pasados 2,5 años, alcanzando un máximo tras 5-10años de evolución36. Sin embargo, se han descrito casos raros en los que la sacroileítis se desarrolló tempranamente, dentro de los 2-3primeros años97,98. Los síntomas suelen comenzar en la columna dorsal y lumbar, siendo menos frecuentes en la columna cervical y las sacroilíacas. A diferencia de los adultos, el dolor axial en niños puede no mejorar con el movimiento15,97. Se ha sugerido que el término EA-J debería reservarse para pacientes que cumplen criterios de NYm antes de los 16años, mientras que «EA de inicio juvenil» describiría mejor a los que presentan síntomas antes de los 16años pero que no completan criterios hasta que son mayores99.
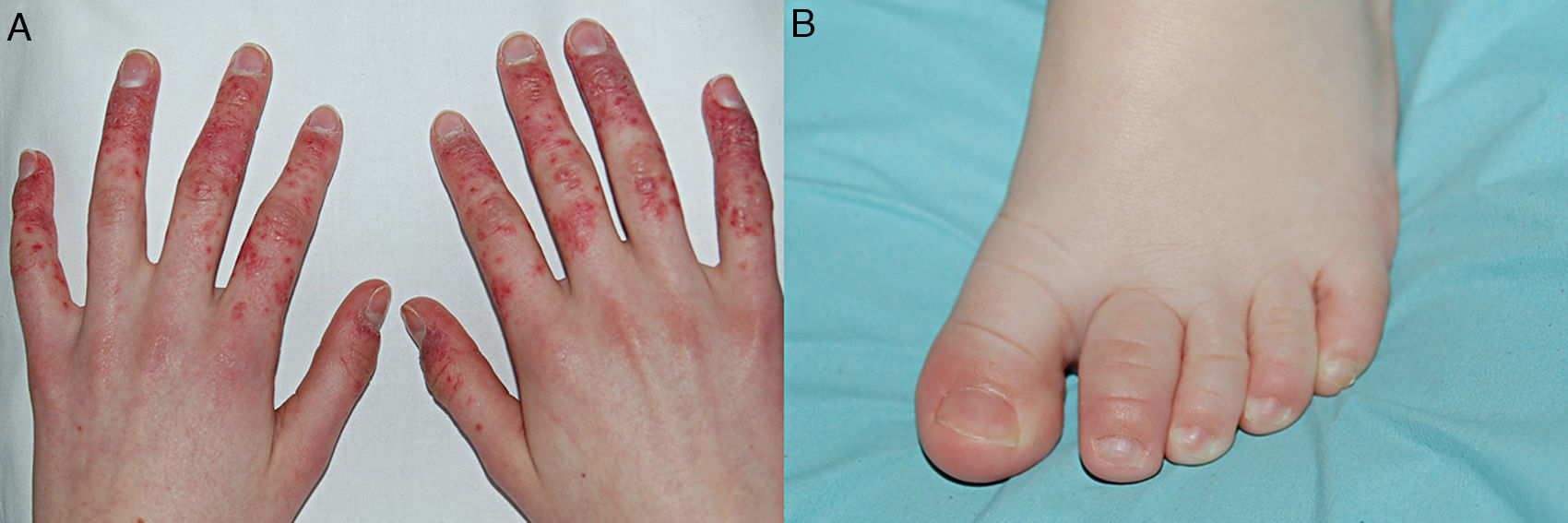
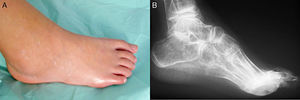
Artritis psoriásica juvenilLa APso-J es definida por los criterios ILAR como la artritis que se inicia antes de los 16años, de al menos 6semanas de duración, asociada a psoriasis o a 2 de las siguientes características: dactilitis, pitting ungueal, onicólisis o psoriasis en un familiar de primer grado. Sin embargo, queda excluida si hay FR positivo, antecedente de enfermedad asociada a HLA-B27 en familiar de primer grado, o si la artritis se inicia en un niño de 6 o más años con HLA-B27 positivo11. A pesar de que la ILAR considera la APso-J como una sola categoría, se sabe actualmente que comprende 2grupos distintos que, en función de la edad de aparición de la artritis, pueden separarse en APso-J de inicio precoz (<5años) y de inicio tardío (≥5años)100. La forma de inicio precoz presenta un pico entre los 2-3años, y clínicamente tiene un perfil similar a las categorías oligo y poliarticular, siendo la mayoría de pacientes niñas con uveítis crónica, ANA y HLA-DR5 positivos98,100,101. Recientemente se ha sugerido que los pacientes con AIJ y ANA positivo deberían considerarse como un solo grupo, independientemente del número de articulaciones afectadas o la presencia de psoriasis102. En contraste, la forma de inicio tardío comparte características con otras EspA-J, tales como presentarse preferentemente en niños de mayor edad (pico 10-12años), con entesitis, compromiso axial y HLA-B27 positivo100,103. La única manifestación articular común a ambos grupos es la dactilitis, que es más frecuente en la forma de inicio precoz (fig. 2)100. Estas diferencias clínicas parecen relacionarse con distintos mecanismos patogénicos, ya que la forma de inicio tardío involucra una activación autoinflamatoria del complejo enteso-sinovial, mientras que la de inicio precoz parece corresponder a procesos autoinmunes más tradicionales103.
Artritis reactiva juvenilLa ARe-J es una forma de artritis no séptica que se desarrolla tras una infección extraarticular104. Se ha descrito su aparición tras una variedad de infecciones virales, bacterianas y parasitarias, pero el término ARe-J se reserva para la artritis asociada a HLA-B27, desencadenada por las denominadas bacterias «artritogénicas», específicamente Salmonella, Yersinia, Campylobacter, Shigella y Chlamydia5. Ocurre habitualmente entre los 8 y los 12años, pero su distribución por sexo y edad se modifican en función del microrganismo desencadenante. La mayoría de casos de ARe-J asociada a Salmonella y Yersinia ocurren en pacientes entre los 3 y los 7años, con un ligero predominio del sexo femenino, mientras que la ARe-J tras infección urogenital por Chlamydia aparece durante la adolescencia y con mayor frecuencia en varones104,105. El cuadro aparece típicamente de una a 4semanas tras la infección desencadenante, pero esta puede ocasionalmente pasar inadvertida106. Los síntomas iniciales pueden ser de tipo constitucional, incluyendo fiebre, pérdida de peso, fatiga y debilidad, desarrollando luego la artritis, que generalmente es asimétrica, mono u oligoarticular, y afecta predominantemente las extremidades inferiores104,106. El dolor intenso y los signos inflamatorios locales son característicos de la ARe-J, pero en algunos casos puede ser más leve. También se ha descrito el desarrollo de entesitis, tenosinovitis, bursitis y dactilitis104. Algunos pacientes con ARe-J por Salmonella y Yersinia presentan poliartritis en articulaciones pequeñas de manos5. La mayoría de casos tienen un solo episodio que dura alrededor de 4semanas, especialmente en la ARe-J por Yersinia y Campylobacter. Sin embargo, otros pacientes presentan episodios recurrentes y formas extendidas con múltiples articulaciones y entesis afectadas. Algunos de ellos pueden aún remitir, pero otros evolucionarán a ERA o EA-J23. La positividad para HLA-B27 se asocia a mayor severidad, así como la infección por Chlamydia, el número de articulaciones afectadas al inicio, la presencia de fiebre o anemia, y el número y la duración de las recurrencias104-106. Dentro de las manifestaciones extraarticulares de la ARe-J se ha descrito estomatitis aftosa, conjuntivitis, eritema nudoso (asociado a Yersinia), balanitis circinada, queratoderma blenorrágica, uveítis anterior, uretritis y cervicitis (en adolescentes con ARe-J adquirida sexualmente), insuficiencia aórtica, miocarditis y pericarditis5. La uveítis y la triada de uretritis-conjuntivitis-artritis (síndrome de Reiter) ocurren más frecuentemente en niños HLA-B27 positivo104.
Artritis asociada a la enfermedad inflamatoria intestinal de inicio pediátricoLa artritis asociada a la EII se define como la artritis no infecciosa que aparece durante la evolución de la EC y la colitis ulcerosa (CU), y la manifestación extraintestinal es más frecuente de estos trastornos107. Se estima que del 7 al 21% de niños con EII presentan artritis107, siendo ligeramente más frecuente en la EC (15,5%) que en la CU (9%)108. Su aparición puede coincidir con el inicio de los síntomas digestivos o desarrollarse posteriormente, y adopta un patrón periférico o axial5. Las articulaciones generalmente afectadas son las de extremidades inferiores, especialmente tobillos y rodillas108. Hasta el 50% de los casos presentan episodios aislados o recurrentes de mono u oligoartritis, de duración inferior a 4semanas5. En algunos pacientes, sobre todo con EII activa, la artritis puede persistir durante varios meses108. Habitualmente este tipo de artritis no se asocia a daño estructural o limitación funcional permanente5,107, pero se ha descrito enfermedad erosiva en adultos jóvenes con EII de inicio pediátrico109,110, y casos raros con anquilosis111. La sacroileítis y la espondilitis son menos frecuentes, se asocian a HLA-B27 y presentan un curso similar a la EA-J. Por lo general guardan poca relación con la actividad de la EII, y se dan en pacientes de mayor edad que la artritis periférica5,107.
Artritis relacionada con entesitisLa ERA es una categoría introducida por la clasificación ILAR de la AIJ y que se define según los criterios de inclusión y exclusión expuestos en la tabla 4. Se trata de una entidad que afecta predominantemente las extremidades inferiores y, eventualmente, el esqueleto axial, caracterizada por la ausencia de FR y ANA y por una fuerte asociación con HLA-B2723. Si un paciente tiene artritis y entesitis, entonces puede clasificarse como ERA. Sin embargo, la presencia de psoriasis o su antecedente familiar excluyen esta categoría11. La media de edad de diagnóstico es de 11,7años (rango, 2,8-17,6años)43. La forma de presentación más común dentro de los 6primeros meses es la oligoartritis asimétrica (≤4articulaciones), y aparece con mayor frecuencia en la rodilla (28%), el tobillo (16%) y la cadera (9%)112. La media de entesis afectadas en el momento del diagnóstico es de 2 a 5 y el compromiso tiende a ser simétrico. Clínicamente, las zonas más comunes de entesitis son la inserción proximal del tendón rotuliano (34,4-50%), la fascia plantar (18,4-38%), el tendón de Aquiles (14,9-22%) y las cabezas de los metatarsianos (16,8-22%)112,113. Sin embargo, un estudio con RM corporal total detectó más entesitis en el trocánter mayor114. El dolor entesítico es uno de los principales motivos de consulta en estos pacientes; está presente en al menos el 47% de las visitas, con ≥3 entesis afectadas en el 18% de ellas113. Entre el 28 y el 60% de los niños con ERA tienen evidencia de sacroileítis clínica o por RM, siendo generalmente simétrica112,114-116 (fig. 3).
Síndrome de entesopatía y artropatía seronegativasLos pacientes con síndrome SEA poseen algunas características de EA-J pero carecen, al menos inicialmente, de compromiso axial. No tienen autoanticuerpos (ANA y FR) y presentan entesitis (habitualmente en talón y rodilla) y oligoartritis (especialmente en las articulaciones grandes y pequeñas de las extremidades inferiores). Este síndrome probablemente representa una forma temprana de EA-J o ERA, más que una entidad separada23. También se ha considerado como una forma indiferenciada de EspA-J que tiende a evolucionar a otra forma definida5,10. En un estudio de seguimiento durante 11años de 23pacientes canadienses con síndrome SEA, el 52% de ellos evolucionaron a una EspA-J diferenciada117. En otro estudio en 21pacientes mexicanos la evolución fue peor, completando criterios NYm en el 75% a los 5años de seguimiento, y en el 90% a los 10años117. Las diferencias en la progresión a EA-J entre estos estudios probablemente sean debidas a la definición de caso utilizada y a factores étnicos5.
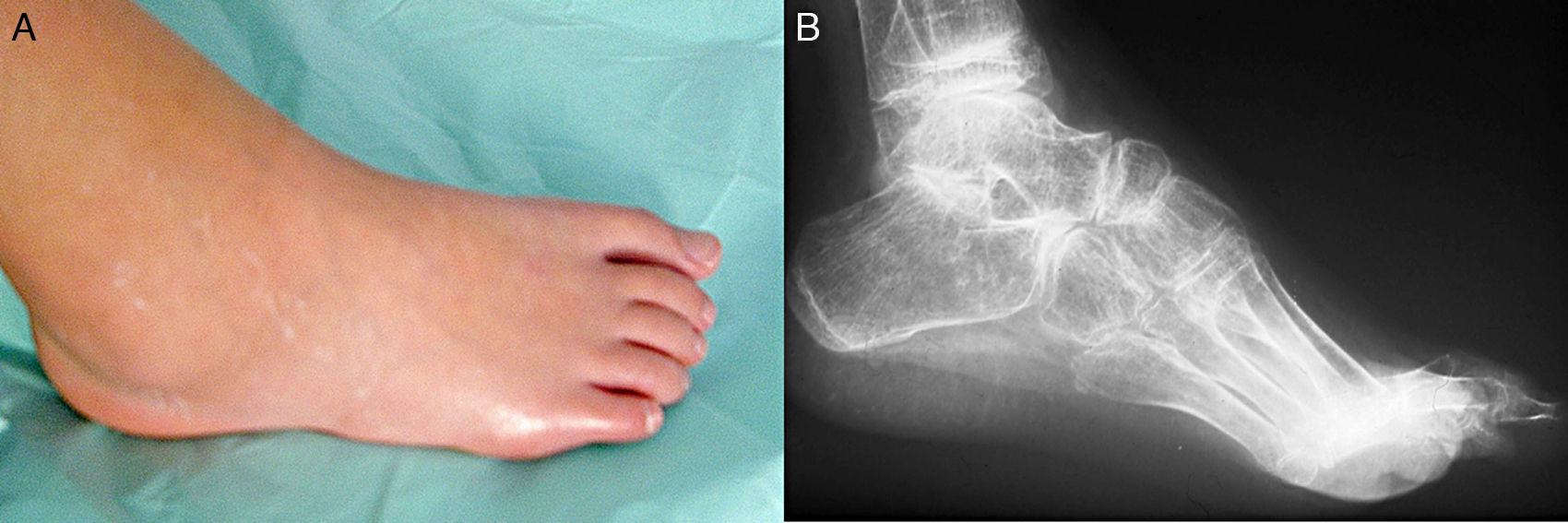
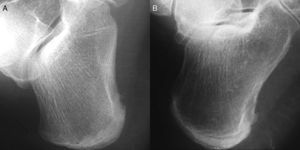
Tarsitis anquilosanteEl compromiso del tarso en la EspA-J fue descrito por Burgos-Vargas et al.118,119. La tarsitis se define como la inflamación que afecta al pie, desde el tobillo hasta las articulaciones metatarsofalángicas120. La fase aguda se caracteriza por una inflamación difusa de los tejidos blandos del tarso (sinovitis, entesitis, tenosinovitis, bursitis), que puede demostrarse por técnicas de imagen. Si la inflamación persiste, se produce daño estructural con cambios proliferativos (periostitis, entosofitosis, anquílosis ósea) que conducen a la fusión de los huesos del tarso, conociéndose a esta forma de evolución como «tarsitis anquilosante» (fig. 4)118-120. Estos cambios clínicos y radiológicos parecen ser equivalentes a los observados a nivel axial5. La tarsitis ocurre en estadios iniciales de la enfermedad hasta en un tercio de los casos120, pudiendo presentarse de forma aislada, como parte de una EspInd-J, o como fase previa al desarrollo de sacroileítis radiológica en la EA-J5,16. Puede dejar como secuela pie plano, o más raramente pie cavo5. La tarsitis también puede aparecer en otras categorías de la AIJ, especialmente en la poliarticular, pero habitualmente de forma tardía, como una «extensión» del compromiso del tobillo121.
Formas clínicas aisladasAlgunos niños presentan manifestaciones aisladas de la enfermedad, especialmente la artritis, siendo bastante difícil diferenciarla de otras categorías de la AIJ. La forma más común es la artritis periférica, especialmente mono u oligoartritis de extremidades inferiores. La localización más frecuente es la rodilla, y la mayoría de casos presentan episodios de dolor y/o tumefacción, que generalmente son atribuidos a traumatismos o esfuerzo físico. En estos casos es importante considerar la edad de inicio, el sexo, los antecedentes familiares de EspA, el patrón de afección articular y el HLA-B27 para su identificación5.
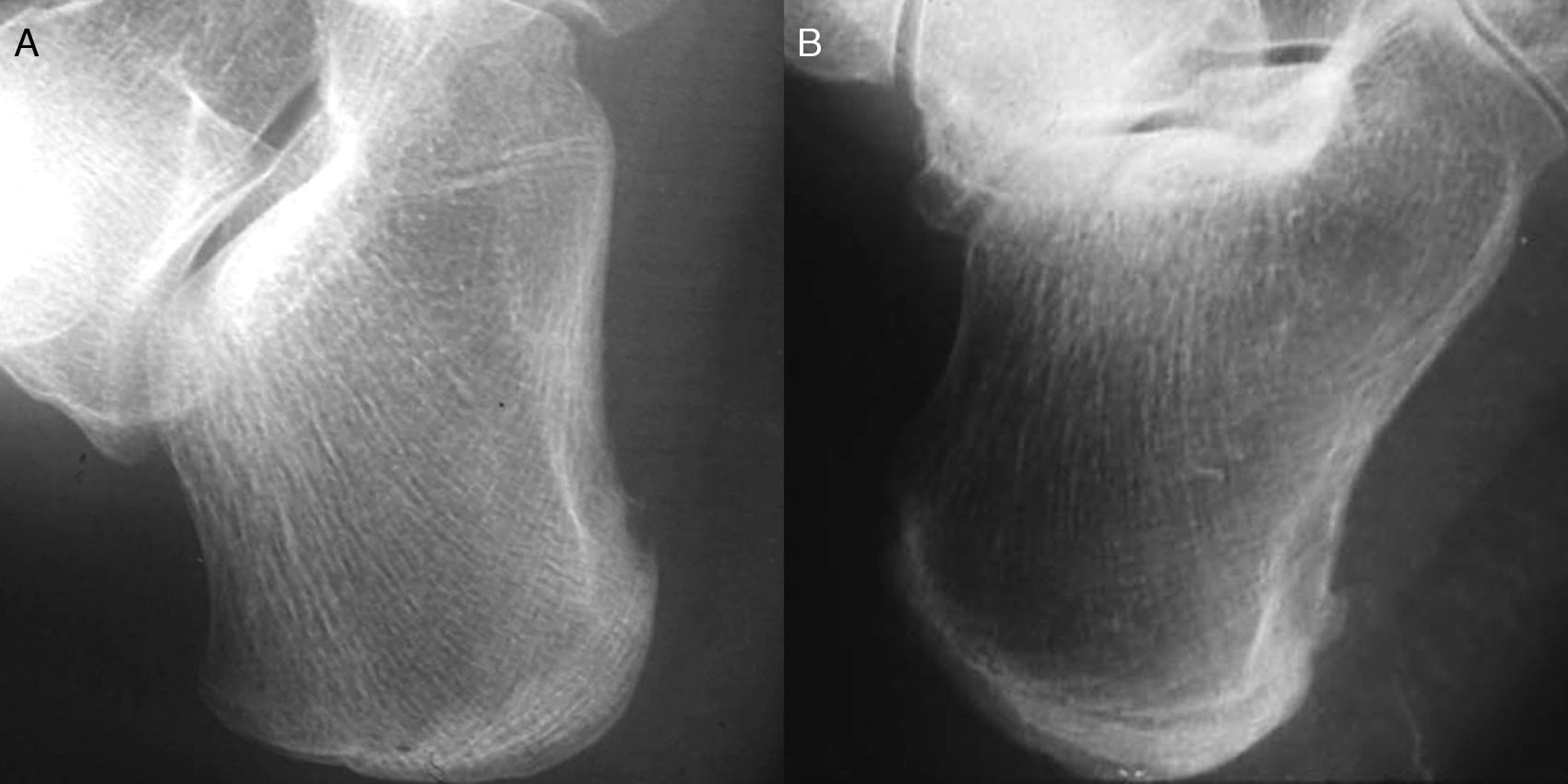
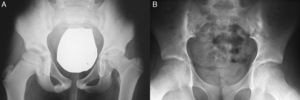
Pruebas de imagenRadiologíaLas alteraciones radiológicas a nivel de articulaciones periféricas en la EspA-J no tienen un patrón específico y son similares a las encontradas en otras formas de artritis de la infancia. La hiperemia local induce aceleración de la osificación de los núcleos epifisarios, con aumento del tamaño de la epífisis y cierre precoz122. Con menor frecuencia se observa pinzamiento articular, periostitis, erosiones, cambios destructivos o anquilosis5. Las entesis pueden presentar desde cambios sutiles, como aumento de partes blandas y pérdida de definición de la zona de inserción, hasta cambios severos, como erosiones y formación de entesofitos23. La sacroileítis radiológica es difícil de valorar en niños debido a que la interlínea articular es amplia e irregular por la presencia de cartílago hialino no calcificado, lo que puede originar una falsa imagen de ensanchamiento o erosiones. El signo más orientador en estos casos es la presencia de esclerosis subcondral, especialmente cuando es unilateral (fig. 5). El desarrollo de sindesmofitos en la columna dorsolumbar es excepcional en la infancia; sin embargo, es frecuente la fusión de articulaciones interapofisarias en la columna cervical, así como la discitis122. La tomografía computarizada brinda mejores imágenes sacroilíacas pero requiere alta dosis de radiación, lo que limita su uso en niños23.
A)Ensanchamiento fisiológico de sacroilíacas de la infancia y coxitis izquierda evolucionada en paciente con espondiloartritis asociada a enfermedad inflamatoria intestinal. B)Sacroileítis bilateral (esclerosis y erosiones) en un paciente varón de 14años con espondilitis anquilosante juvenil.
Es actualmente la técnica de elección para el estudio del compromiso axial en las EspA. Detecta cambios inflamatorios tempranos tanto en sacroilíacas como en columna, siendo el edema óseo/osteítis el mejor caracterizado de ellos, pero también pueden observarse sinovitis, entesitis o capsulitis123. Bollow et al.124 evaluaron 100 niños menores de 16años con EspA-J (criterios ESSG) y 30controles usando RM dinámica, encontrando signos de sacroileítis aguda en 20% de los casos con EspA-J (todos ellos con radiografías normales), pero en ninguno de los controles. En otro estudio en 11pacientes con EA-J probable (solo criterios clínicos de NYm), la RM confirmó la presencia de sacroileítis en todos ellos y adicionalmente detectó entesitis en sínfisis púbica (91%), trocánter mayor/menor (55%), cresta ilíaca (27%), y regiones coxofemoral (45%) e isquiopubiana (27%)125. Recientemente se ha propuesto la realización de RM corporal total para valorar simultáneamente el compromiso axial y periférico126. Rachlis et al.114 estudiaron 23niños con ERA mediante esta técnica y demostraron que, además de detectar la artritis y la entesitis, fue superior a la exploración física en caderas, sacroilíacas y columna.
UltrasonografíaConstituye una herramienta valiosa para el estudio de la patología articular en la AIJ, habiendo demostrado ser más precisa que el examen clínico. Permite la diferenciación entre sinovitis y tenosinovitis, así como la detección temprana de lesiones cartilaginosas y erosiones127. También es útil para valorar la entesitis. En un estudio realizado por Jousse-Joulin et al.128 en 26niños con AIJ (35% con ERA) y 41 controles, la ultrasonografía Doppler encontró entesitis en el 9,4% de los pacientes con AIJ, siendo más frecuente en aquellos con ERA (70%), pero no en niños sanos. La exploración física había sido normal en la mitad de las localizaciones en las que la ultrasonografía detectó entesitis128.
Diagnóstico diferencialEl diagnóstico diferencial de la EspA-J incluye otras causas de artritis en la infancia, dentro de las cuales debemos considerar las otras categorías de la AIJ, así como la enfermedad de Behçet (EB) de inicio pediátrico y los trastornos autoinflamatorios129,130.
Artritis idiopática juvenil de inicio sistémicoHasta el 11% de los pacientes con EA-J y el 6% con EspInd-J pueden cumplir criterios de AIJ de inicio sistémico, ya que pueden presentar fiebre, linfadenopatías, leucocitosis y trombocitosis dentro de los primeros 6meses de la enfermedad o posteriormente durante sus períodos de actividad. La presencia de entesitis y HLA-B27(+) puede ayudar a distinguirlas129.
Poliartritis factor reumatoide negativoCasi el 30% de los pacientes con EA-J y el 17% de EspInd-J cumplen criterios de AIJ poliarticular seronegativa, debido a que la mayoría de ellos presentan poliartritis durante la evolución de la enfermedad. La diferenciación con esta categoría se basa en los criterios de exclusión129.
Poliartritis factor reumatoide positivoA pesar de que la presencia de FR permite diferenciar este subtipo de las EspA-J, algunos de pacientes pueden desarrollar seropositividad durante el curso de la enfermedad129.
Artritis idiopática juvenil oligoarticularEste subtipo plantea más dificultades debido a que la mayoría de pacientes con EspA-J presentan oligoartritis dentro de los primeros 6meses de evolución. No obstante, la edad de inicio, el sexo, la presencia de ANA o HLA-B27, la entesitis y el tipo de uveítis permiten diferenciarlas23,129.
Enfermedad de Behçet de inicio pediátricoLa sacroileítis, la uveítis anterior y la asociación con HLA-B27 pueden encontrarse en la EB131,132, por lo que algún caso podría diagnosticarse como EspA-J. Sin embargo, el origen étnico, su espectro de manifestaciones y la presencia HLA-B51 ayudan a identificarla130.
Trastornos autoinflamatoriosLa sacroileítis puede aparecer hasta en un 7% de los pacientes con FMF50. Las sacroilíacas también pueden estar afectadas en la osteomielitis crónica multifocal recurrente, habiéndose descrito la presencia de esclerosis y erosiones, y también discitis133. La anquilosis de la columna cervical puede ocurrir como parte del síndrome PAPA (artritis piogénica, pioderma gangrenoso, acné)134 y del recientemente descrito síndrome de deficiencia del receptor de la interleucina-1, presentando este último un rash característico que semeja a la psoriasis pustulosa135.
Otras causas de dolor axial en niños incluyen la espondilólisis, la espondilolistesis, la escoliosis, la osteomielitis, la espondilodiscitis, el osteoma osteoide, el neuroblastoma, la enfermedad de Scheuermann y, más raramente, la herniación discal. El dolor sacroilíaco también puede producirse por traumatismos, artritis séptica y sarcoma de Ewing del ilion. La entesitis puede confundirse con entesopatía traumática, con problemas mecánicos o con osteocondrosis, como las que afectan a la tuberosidad tibial (Osgood-Schlatter), el borde rotuliano inferior (Sinding-Larsen-Johansson) y la apófisis del calcáneo (Sever)23,121.
TratamientoNo existen hasta la fecha guías de tratamiento específicas para la EspA-J. Sin embargo, debido a las importantes diferencias que existen respecto a los adultos, se requieren recomendaciones especiales adaptadas para niños136. Al igual que en otras enfermedades crónicas de la infancia, el abordaje debe ser multidisciplinar y el tratamiento ha de individualizarse en función de los problemas del paciente23,137.
Medidas generalesLa educación del paciente y de los familiares respecto al diagnóstico, la cronicidad, las complicaciones, la necesidad de tratamiento a largo plazo, la terapia física y el seguimiento facilita el cumplimiento de las recomendaciones138. Este aspecto es especialmente importante cuando el paciente llega a la adolescencia, y las unidades de transición cumplen un rol fundamental en esta etapa139. Siempre que sea posible, el paciente debería participar de actividades sociales y recreacionales propias de su edad, aunque es importante buscar alternativas para minimizar la sobrecarga en las articulaciones de las extremidades inferiores y en la columna lumbar durante el desarrollo de la actividad física23.
Tratamiento farmacológicoAntiinflamatorios no esteroideosConstituyen el tratamiento inicial en estos pacientes23, a pesar de que se carece de estudios específicos en la EspA-J. En niños se recomienda utilizar naproxeno (15-20mg/kg/día) en vez de indometacina (1-2mg/kg/día), debido a su menor toxicidad23. En pacientes adultos con EA se ha demostrado que el tratamiento continuo con antiinflamatorios no esteroideos (AINE), además de mejorar los síntomas, disminuye los niveles de proteína C reactiva, reduce el número de lesiones inflamatorias por RM y retrasa la progresión radiológica21,138,140,141. Queda por demostrar si esto ocurre también en la EA-J.
GlucocorticoidesEl uso de glucocorticoides (GC) sistémicos en la EspA-J está limitado a tratamientos de corta duración en cuadros severos, habiéndose descrito anecdóticamente una mejoría espectacular, pero transitoria, con la administración de pulsos intravenosos de metilprednisolona (700mg/m2)142,143. Las infiltraciones de GC intraarticulares, y en zonas de entesitis o tenosinovitis, pueden utilizarse como adyuvantes del tratamiento sistémico130,144. Se recomienda para estos fines el hexacetónido de triamcinolona, a dosis de 1mg/kg hasta un máximo de 40mg en articulaciones grandes (cadera, rodilla, tobillo), o 20mg en el carpo y el codo23. La realización de estas infiltraciones con guía ecográfica o fluoroscópica mejora su eficacia127,144. También pueden ser útil la infiltración de las articulaciones sacroilíacas con guía tomográfica o por RM, habiéndose demostrado una reducción significativa de la actividad inflamatoria a este nivel en pacientes con EspA-J refractaria145,146. Los GC tópicos están indicados en el tratamiento de la uveítis aguda, con buena respuesta en la mayoría de casos. Cuando las recaídas son frecuentes o hay riesgo de deterioro visual por desarrollo de secuelas, pueden utilizarse GC orales en combinación con otros fármacos inmunosupresores o anti-TNF-α147.
Fármacos modificadores de enfermedadLa sulfasalazina ha demostrado ser relativamente eficaz para el control de la artritis periférica en la EspA de adulto, pero no en los síntomas axiales o entesíticos148-151. El primer estudio sobre el efecto de la sulfasalazina en EspA-J fue llevado a cabo por Suschke152 en 11pacientes con EA-J y ARe-J refractarios a AINE, obteniendo buena respuesta en 8, ninguna mejoría en 2, y en uno se suspendió por episodios adversos. El único ensayo clínico controlado y aleatorizado (ECR) con este fármaco en EspA-J fue realizado por Burgos-Vargas et al.153, quienes incluyeron a 33pacientes con EA-J y síndrome SEA (17 en el grupo de tratamiento y 16 con placebo) y encontraron mejoría en la valoración global del médico (VGM) y en la del paciente (VGP), pero no en otras medidas de desenlace. En otro ECR en pacientes con AIJ, el 15% de los cuales correspondían a EspA-J (ERA o APso-J), se observó mejoría en el recuento articular, VGM, VGP y reactantes de fase aguda154. En un estudio abierto multicéntrico en AIJ, la sulfasalazina fue eficaz en los pacientes con oligoartritis de inicio tardío y HLA-B27 positivo155, siendo este tipo el que ha tenido mejor respuesta en la artritis periférica en otros estudios pequeños abiertos156-158. La dosis recomendada de sulfasalazina es de 40-50mg/kg/día, hasta un máximo de 2.000mg. Sus efectos terapéuticos no son evidentes hasta varias semanas después de iniciarla, y se deben monitorizar estrechamente el hemograma y las enzimas hepáticas23.
El metotrexato se utiliza ocasionalmente en base a la evidencia de su eficacia en otros subtipos de la AIJ159,160; sin embargo, no existen hasta la fecha estudios específicos en la EspA-J.
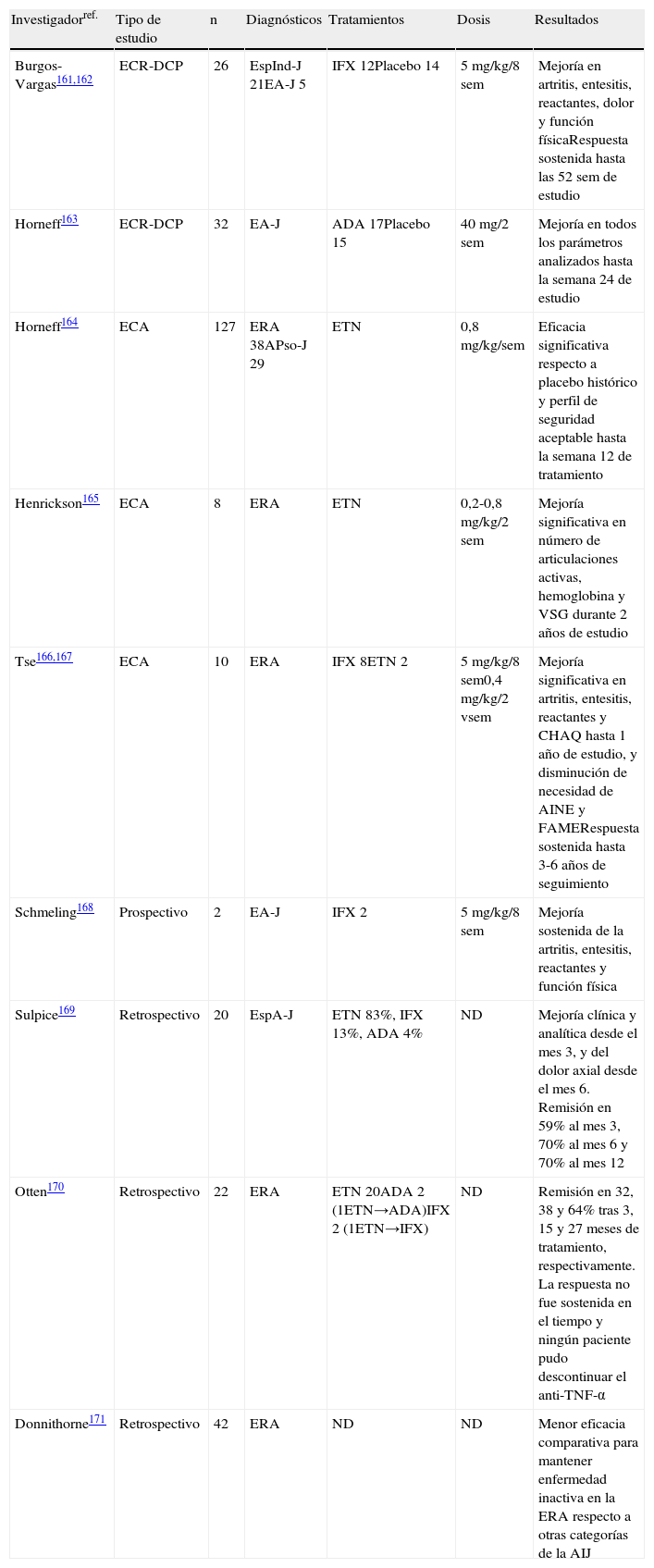
Fármacos anti-factor de necrosis tumoral alfaEl primer ECR con anti-TNF-α en la EspA-J fue llevado a cabo por Burgos-Vargas et al.161, quienes encontraron mejoría significativa en la artritis, la entesitis, los marcadores inflamatorios, el dolor y la función física en 12pacientes tratados con infliximab comparados con 14 que recibieron placebo. Todos estos pacientes continuaron una fase de extensión abierta de 52semanas en las que esta mejoría fue sostenida y no desarrollaron eventos adversos importantes162. En el segundo ERC llevado a cabo en 32pacientes con EA-J, 17 recibieron adalimumab y 15 placebo, encontrándose mejoría rápida significativa en todos los parámetros evaluados, incluyendo ASAS40, Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), Bath Ankylosing Spondylitis Disease Functional Index (BASFI), Childhood Health Assessment Questionnaire-Disability Index, número de articulaciones activas y velocidad de sedimentación globular (VSG). El efecto se mantuvo hasta la semana 24 de tratamiento. Hubo 2episodios adversos serios relacionados con adalimumab en este estudio163. En 3ensayos clínicos abiertos con etanercept en la ERA han encontrado resultados similares164-167. Infliximab también ha demostrado ser eficaz en un número pequeño de pacientes con ERA166,167 y EA-J168. Un estudio retrospectivo en 20pacientes con ERA (83% de ellos con etanercept) demostró tasas de remisión del 59, del 70 y del 70% en los meses 3, 6 y 12 de tratamiento. La mejoría clínica y analítica fue evidente desde el mes3, pero el dolor axial requirió al menos 6meses para un control óptimo169. Sin embargo, 2estudios retrospectivos adicionales describen que la respuesta a los anti-TNF-α en la ERA no es sostenida en el tiempo170, y que tienen una eficacia comparativa menor en relación con otras categorías de la AIJ171. Todos estos estudios se resumen en la tabla 5. Actualmente se encuentran en marcha 2ensayos clínicos en pacientes con ERA, uno multicéntrico fase iii para evaluar la seguridad y eficacia de adalimumab172, y otro enfocado en la inducción de la remisión con etanercept173.
Estudios con fármacos anti-TNF-α en pacientes pediátricos con espondiloartritis
| Investigadorref. | Tipo de estudio | n | Diagnósticos | Tratamientos | Dosis | Resultados |
| Burgos-Vargas161,162 | ECR-DCP | 26 | EspInd-J 21EA-J 5 | IFX 12Placebo 14 | 5 mg/kg/8 sem | Mejoría en artritis, entesitis, reactantes, dolor y función físicaRespuesta sostenida hasta las 52 sem de estudio |
| Horneff163 | ECR-DCP | 32 | EA-J | ADA 17Placebo 15 | 40 mg/2 sem | Mejoría en todos los parámetros analizados hasta la semana 24 de estudio |
| Horneff164 | ECA | 127 | ERA 38APso-J 29 | ETN | 0,8 mg/kg/sem | Eficacia significativa respecto a placebo histórico y perfil de seguridad aceptable hasta la semana 12 de tratamiento |
| Henrickson165 | ECA | 8 | ERA | ETN | 0,2-0,8 mg/kg/2 sem | Mejoría significativa en número de articulaciones activas, hemoglobina y VSG durante 2 años de estudio |
| Tse166,167 | ECA | 10 | ERA | IFX 8ETN 2 | 5 mg/kg/8 sem0,4 mg/kg/2 vsem | Mejoría significativa en artritis, entesitis, reactantes y CHAQ hasta 1 año de estudio, y disminución de necesidad de AINE y FAMERespuesta sostenida hasta 3-6 años de seguimiento |
| Schmeling168 | Prospectivo | 2 | EA-J | IFX 2 | 5 mg/kg/8 sem | Mejoría sostenida de la artritis, entesitis, reactantes y función física |
| Sulpice169 | Retrospectivo | 20 | EspA-J | ETN 83%, IFX 13%, ADA 4% | ND | Mejoría clínica y analítica desde el mes 3, y del dolor axial desde el mes 6. Remisión en 59% al mes 3, 70% al mes 6 y 70% al mes 12 |
| Otten170 | Retrospectivo | 22 | ERA | ETN 20ADA 2 (1ETN→ADA)IFX 2 (1ETN→IFX) | ND | Remisión en 32, 38 y 64% tras 3, 15 y 27 meses de tratamiento, respectivamente. La respuesta no fue sostenida en el tiempo y ningún paciente pudo descontinuar el anti-TNF-α |
| Donnithorne171 | Retrospectivo | 42 | ERA | ND | ND | Menor eficacia comparativa para mantener enfermedad inactiva en la ERA respecto a otras categorías de la AIJ |
ADA: adalimumab; CHAQ: Childhood Health Assessment Questionnaire; ECA: ensayo clínico abierto; ECR-DCP: ensayo clínico aleatorizado, doble ciego, controlado con placebo; ETN: etanercept; IFX: infliximab; ND: datos no disponibles; ref.: referencia; sem: semana; vsem: veces por semana; VSG: velocidad de sedimentación globular.
A pesar de que los anti-TNF-α no lograron reducir la progresión radiológica en los ensayos clínicos en la EA174, un estudio reciente en EspA axial demostró que estos fármacos son capaces de inhibir la neoformación ósea en lesiones inflamatorias tempranas175, por lo que actualmente se considera que existe una «ventana de oportunidad terapéutica» en la EA, lo cual es también prometedor para la EA-J.
Medidas de desenlaceNo existen medidas de desenlace universalmente aceptadas en la EspA-J. La aplicación de índices de la EA de adultos tales como BASDAI, BASFI, ASAS, remisión parcial o Ankylosing Spondylitis Disease Activity Store (ASDAS)123,176 se ve limitada en la EspA-J debido al peso que otorgan a los síntomas axiales4. El índice de daño desarrollado para la AIJ (Juvenile Arthritis Damage Index [JADI])177 no fue validado en la ERA, y su aplicación en estos pacientes ha demostrado que subestima el daño articular y no valora la entesitis ni la limitación axial178. Una versión modificada de este índice, que incorpora la limitación de la movilidad lumbar y del tarso, parece mejorar su rendimiento en la ERA179.
PronósticoEl curso de la EspA-J es muy variable, con tasas de remisión del 17-39% en la EA-J y del 18-44% en la ERA115,180-182. A pesar de que estudios iniciales sugerían un pronóstico favorable en las formas indiferenciadas de la EspA-J181,182, trabajos recientes muestran peor funcionalidad física, mayor intensidad de dolor y persistencia de enfermedad activa en la ERA en comparación con otros subtipos de la AIJ115,183,184. Entre los predictores de fallo para mantener remisión en la ERA se ha descrito el antecedente de EA en familiar de primer grado, HLA-DRB1*08, y la artritis de tobillo dentro de los 6primeros meses, mientras que HLA-DPB1*02 es un factor protector115. Hasta el 40% de las formas indiferencias evolucionan a EA-J dentro de los 10primeros años de enfermedad115,117,180. Los factores de riesgo para desarrollo de sacroileítis en la ERA incluyen HLA-B2744, elevación persistente de VSG, artritis de cadera dentro de los 6primeros meses115 y el número de articulaciones y entesis activas al inicio de la enfermedad185. Además de la limitación axial, los pacientes con EA-J desarrollan daño estructural en entesis y articulaciones periféricas que originan diversos grados de dolor, rigidez, pérdida de movilidad, deterioro funcional y alteración de la calidad de vida5.
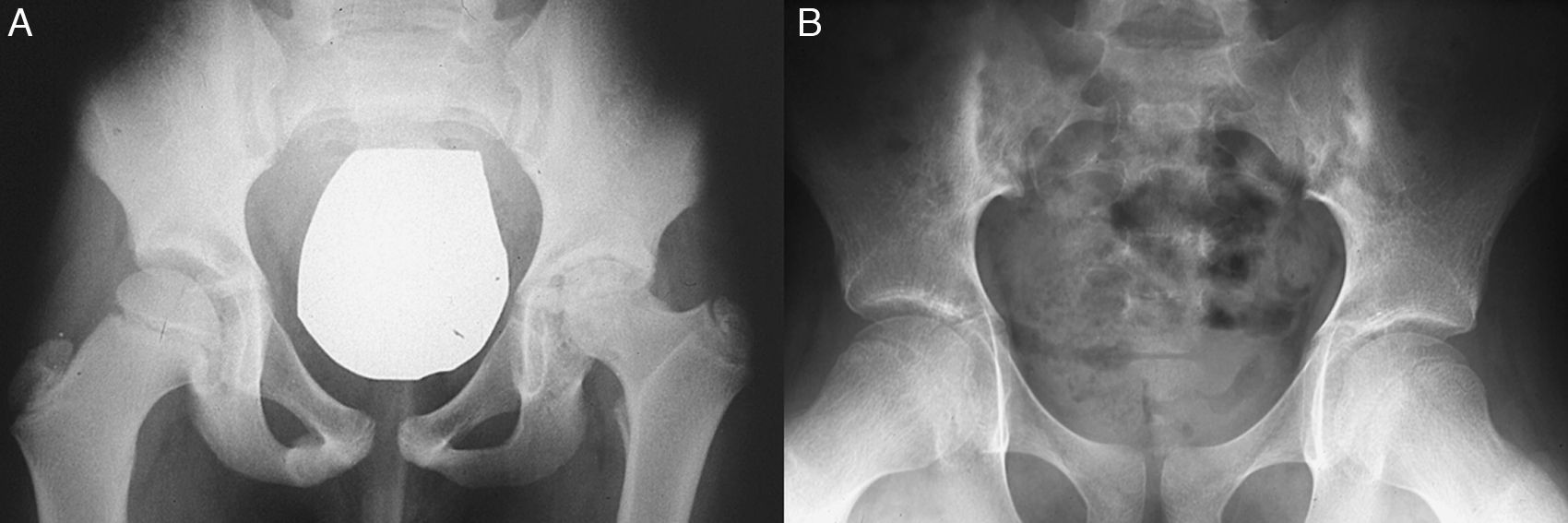
En comparación con la EA de adulto, los pacientes con EA-J presentan mayor probabilidad de compromiso periférico que axial82,186-192, y cuando este último ocurre tiende a ser menos severo193-195. Sin embargo, desarrollan artritis de cadera con mayor frecuencia y severidad, y requieren más prótesis que los adultos186,190,193,196,197. El retraso en el diagnóstico también parece ser mayor en niños194,198. Algunos estudios describen peor pronóstico funcional en la EspA-J que en la de adulto186,195,198, otros no encuentran diferencias significativas82,193,196, y alguno favorece a la primera191. Dentro de las razones que podrían explicar esta disparidad de resultados se incluyen las diferencias de diseño y metodología, así como la probabilidad de cohortes de pacientes realmente distintas, o un efecto del cambio de los patrones de tratamiento199.
ConclusionesEn conclusión, la EspA-J representa un grupo especial dentro de las EspA, que muestra un predominio del compromiso periférico sobre el axial y que aparece más frecuentemente como formas indiferenciadas. Los estudios genéticos y fisiopatológicos demuestran que, a pesar de compartir algunas características con otras entidades comprendidas en el concepto de EspA, posee ciertas peculiaridades que podrían explicar las diferencias clínicas y pronósticas observadas. Queda aún pendiente la unificación de los criterios de clasificación y diagnóstico de la EspA-J y el establecimiento de guías de tratamiento adaptadas a estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.