La cirugía oncoplástica forma parte del grupo de cirugías de conservación mamaria, la cual permite la resección oncológica y la remodelación mamaria en el mismo acto quirúrgico. Actualmente es ampliamente usada en Latinoamérica, sin embargo, no cuentan con grandes reportes de resultados oncológicos. El propósito del estudio es evaluar la seguridad de la cirugía oncoplástica en el tratamiento del cáncer de mama invasivo.
MétodoSe comparan de forma retrospectiva 124 pacientes que recibieron cirugía oncoplástica por cáncer de mama invasivo no metastásico (grupo de estudio) con 302 pacientes que recibieron cirugía de conservación mamaria convencional (no oncoplástica; grupo control) durante el periodo 2007-2015.
ResultadosEl tiempo medio de seguimiento fue de 61 meses, la sobrevida global fue mayor en el grupo de cirugía oncoplástica frente al grupo control a 10 años (97,7 vs. 89.8%, p=0,04), así como la sobrevida libre de enfermedad (93 vs. 86,7% a 10 años, p=0,05).
DiscusiónSe han comparado pacientes que tuvieron cirugía primaria oncoplástica por cáncer de mama invasivo no metastásico (124) con un grupo control (302), realizándose un seguimiento por un periodo prolongado de tiempo, proporcionando el presente estudio evidencia para plantear que la cirugía oncoplástica es una opción de tratamiento seguro y confiable en pacientes con cáncer de mama en Latinoamérica.
Oncoplastic surgery is a type of breast conservation surgery, which allows oncologic resection and breast remodelling in the same surgical procedure. It is now widely used in Latin America, but large studies of its results are lacking. The aim of this study was to evaluate the safety of oncoplastic surgery in the treatment of invasive breast cancer.
MethodA total of 124 patients who underwent oncoplastic surgery between 2007 and 2015 for non-metastatic invasive breast cancer (study group) were retrospectively compared with 302 patients who underwent conventional (non-oncoplastic surgery) breast conservation surgery (control group) in the same period.
ResultsThe mean length of follow-up was 61 months. Overall survival and disease-free survival was higher in the oncoplastic surgery group than in the control group at 10 years (97.7 vs. 89.8%, P=.04; 93 vs. 86.7% at 10 years, P=.05).
DiscussionWe compared patients who had oncoplastic primary surgery for non-metastatic invasive breast cancer (n=124) with a control (n=302) group who were followed-up for a long period, providing evidence to suggest that oncoplastic surgery is a safe and reliable treatment option in patients with breast cancer in Latin America.
La cirugía de conservación mamaria asociada a la adyuvancia con radioterapia se ha convertido en el estándar de tratamiento para el cáncer de mama invasivo temprano, con buenos resultados en sobrevida global (OS) y tiempo libre de enfermedad (DFS), equiparables a los de tratamientos más radicales1–3; sin embargo, la aplicación de técnicas convencionales de conservación mamaria se ve dificultada por: tamaños tumorales grandes, localización, relación volumétrica mama-tumor, así como por la pobre cosmesis obtenida tras resecciones de gran volumen. La cirugía oncoplástica (COP) forma parte de las técnicas quirúrgicas de conservación, permite resecciones quirúrgicas oncológicas y la reconstrucción inmediata mediante el uso de técnicas de cirugía plástica, así como la plastia de la mama contralateral, en casos en que la simetría se vea afectada4. La COP presenta múltiples técnicas y clasificaciones, basadas en 2 niveles: nivel 1, técnicas simples de avance y rotación de tejido glandular, lo cual permite la corrección de pequeños volúmenes, y nivel 2, basado en mamoplastia de mayor diámetro (más del 15% del volumen mamario) y piel, la cual se realiza según el escenario clínico, logrando así la resección de grandes volúmenes manteniendo la estética5.
Se cuenta con múltiples publicaciones sobre el uso de la COP6–16, pero no del seguimiento oncológico de estas pacientes. Con el objetivo de evaluar la seguridad oncológica de este procedimiento, se comparó una serie consecutiva de 124 pacientes que recibieron COP con 320 pacientes que recibieron cirugía de conservación no COP (grupo de control) durante el mismo periodo de tiempo en un instituto oncológico de Latinoamérica.
Pacientes y métodosDurante el periodo 2007-2015, en el Instituto Nacional de Enfermedad Neoplásicas del Perú se identificaron 124 pacientes a las que se realizó COP como cirugía primaria para cáncer de mama invasivo no metastásico (grupo cohorte); los patrones oncoplásticos fueron realizados por médicos del Departamento de Senología. El grupo de control estuvo integrado por 302 pacientes que tuvieron cirugía de conservación no COP, durante el periodo indicado. Se excluyeron las pacientes con: tumores bilaterales, enfermedad metastásica al ingreso, tratadas en otra institución con cirugía resectiva, neoadyuvancia o adyuvancia, y quienes se encontraban fuera del rango de cita de seguimiento (>6 meses).
Técnica quirúrgicaLas técnicas de COP utilizadas en la mama fueron seleccionadas según la evaluación clínica de los cirujanos oncólogos, escogiéndose técnicas de segundo nivel (propuesto por Clough) según cada cuadrante mamario. En el intraoperatorio se realizó el marcaje de la pieza quirúrgica y del lecho tumoral con clips metálicos radiopacos. La estadificación ganglionar se realizó mediante las técnicas azul patente y/o linfografía isotópica, realizándose la disección ganglionar en los casos de uno o más ganglios centinela positivos para macrometástasis, independiente de la técnica oncoplástica17.
Tratamiento neoadyuvanteLa decisión del uso de terapia neoadyuvante (quimioterapia, hormonoterapia o radioterapia) se basó en el estadio clínico y el perfil de inmunohistoquímica, siguiendo los protocolos establecidos por las guías nacionales e internacionales18,19.
Evaluación histopatológicaTodas las piezas operatorias fueron orientas en la sala de operaciones, permitiendo una mejor evaluación de los bordes quirúrgicos. Las piezas fueron teñidas antes del corte de las mismas, fijadas con formalina y parafina, siendo evaluadas con hematoxilina-eosina. En relación con los bordes quirúrgicos se contemplan 3 posibilidades: margen libre «no tinta» en los bordes quirúrgicos18, bordes cercanos (presencia de células tumorales a menos de 1mm) y comprometidos (células tumorales en contacto con los bordes teñidos con tinta). El estudio de inmunohistoquímica se realizó en las biopsias prequirúrgicas y/o en las piezas operatorias para definir el inmunofenotipo de las pacientes, registrándose la expresión de receptores hormonales, estatus HER2 y nivel de Ki67 (este último no evaluado en todas las pacientes).
Tratamiento adyuvanteLos casos fueron evaluados de forma multidisciplinaria, por cirujanos oncólogos, médicos oncólogos y radiooncólogos; la decisión del tratamiento adyuvante estuvo basada en las características biológicas del tumor, la estadificación, los tratamientos previos y las comorbilidades, siguiendo las guías de referencias nacionales e internacionales de tratamiento para ambos grupos18,19.
SeguimientoEl seguimiento clínico posterior a la cirugía de ambos grupos fue similar: evaluaciones clínicas periódicas cada 3 meses (los 2 primeros años), cada 6 meses (hasta cumplir 5 años), y posteriormente una evaluación anual. Los estudios auxiliares durante la evaluación fueron: marcador tumoral (CA 15-3), imágenes radiográficas de tórax, ecografía abdominal y pélvica, ecografía de mamas, mamografía bilateral y gammagrafía ósea.
Los objetivos principales del estudio fueron evaluar la OS, el DFS, la incidencia acumulada de recurrencia local, la recurrencia regional y la recurrencia a distancia, todo medido a partir de la fecha de la cirugía.
La OS se define como el tiempo transcurrido desde la cirugía hasta la muerte de la paciente (por cualquier causa).
El DFS se define como el tiempo transcurrido desde la cirugía hasta la recurrencia (incluyendo recurrencia local, regional o a distancia).
Las recurrencias locales, regionales y a distancia están definidas como el tiempo transcurrido desde la cirugía hasta la recurrencia local, regional y a distancia, respectivamente.
Método estadísticoSe realizó un análisis descriptivo de la información, mediante el programa SPSS v. 22 a través de frecuencias, porcentajes y medidas resumen (media, mediana y rango), las asociaciones de características cualitativas entre los grupos de estudio de COP y no COP se evaluaron con la prueba Chi-cuadrado o la prueba exacta de Fisher, según correspondía.
Las diferencias en la OS y el DFS según el tipo de cirugía se estimaron con el método de Kaplan-Meier y se evaluaron con el test de Log-Rank, utilizándose el modelo de Cox para determinar su valor pronóstico.
Las incidencias acumuladas de los eventos recurrencia local, regional y a distancia se estimaron con el método de Kalbfleisch y Prentice20, considerando eventos competitivos; las diferencias fueron evaluadas con el test de Gray21 y se usó el modelo de Fine y Gray22 para determinar el valor pronóstico del tipo de cirugía. Un valor p<0,05 se consideró para una asociación o diferencia significativa.
En el análisis de los datos se usó el software R (R Core Team, 2017, Viena, Austria).
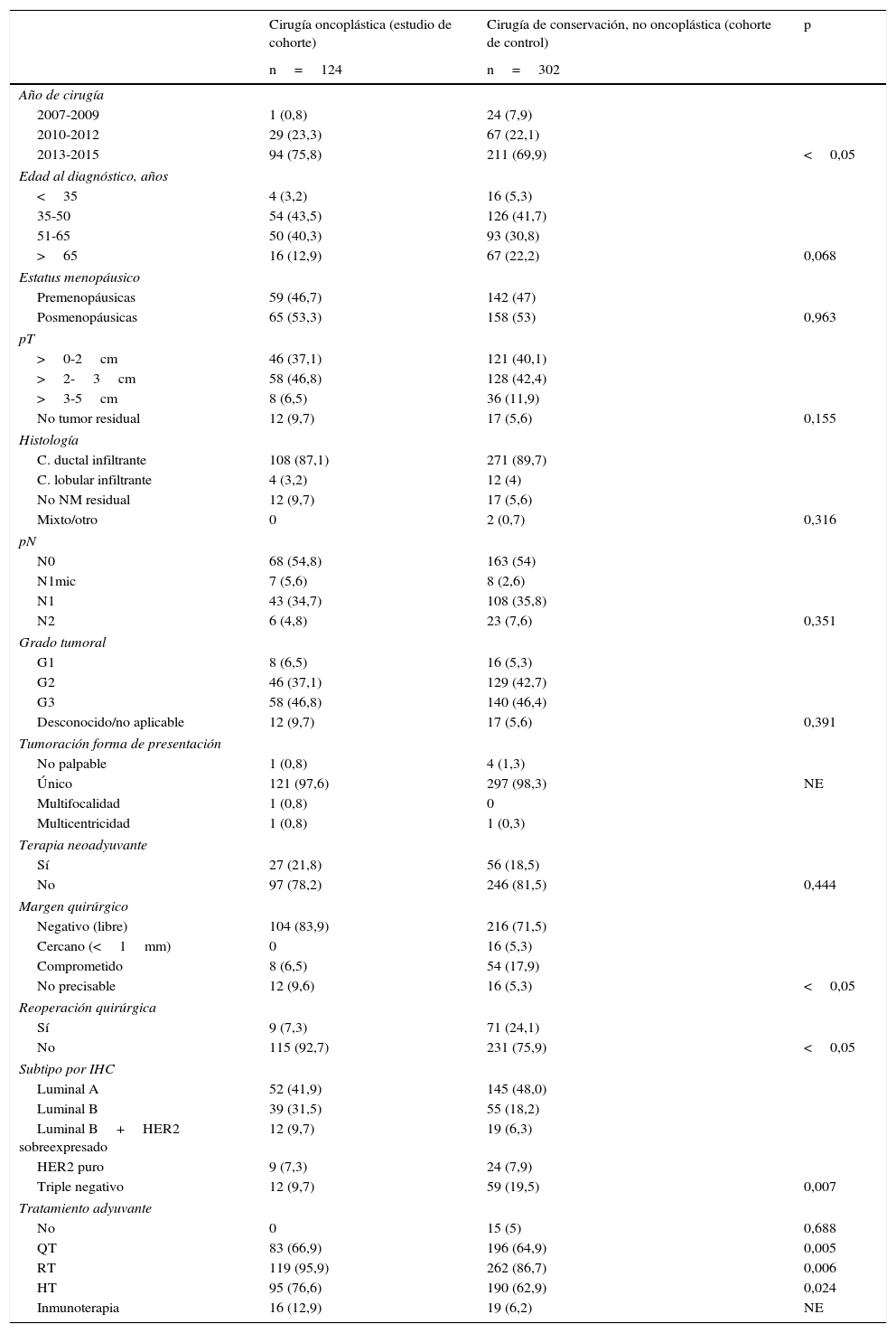
ResultadosLa tabla 1 muestra las características estratificadas entre el grupo COP y el no COP. En relación con las características clínicas no se evidenció ninguna diferencia significativa en la distribución de rangos por edades ni en el estatus menopáusico, siendo grupos equiparables. El diámetro tumoral patológico evidenciado en ambos grupos de estudio fue predominantemente el de>2 a 3cm (46,8 y 42,4%, respectivamente).
Características de los pacientes. Cohorte de estudio y cohorte de control
| Cirugía oncoplástica (estudio de cohorte) | Cirugía de conservación, no oncoplástica (cohorte de control) | p | |
|---|---|---|---|
| n=124 | n=302 | ||
| Año de cirugía | |||
| 2007-2009 | 1 (0,8) | 24 (7,9) | |
| 2010-2012 | 29 (23,3) | 67 (22,1) | |
| 2013-2015 | 94 (75,8) | 211 (69,9) | <0,05 |
| Edad al diagnóstico, años | |||
| <35 | 4 (3,2) | 16 (5,3) | |
| 35-50 | 54 (43,5) | 126 (41,7) | |
| 51-65 | 50 (40,3) | 93 (30,8) | |
| >65 | 16 (12,9) | 67 (22,2) | 0,068 |
| Estatus menopáusico | |||
| Premenopáusicas | 59 (46,7) | 142 (47) | |
| Posmenopáusicas | 65 (53,3) | 158 (53) | 0,963 |
| pT | |||
| >0-2cm | 46 (37,1) | 121 (40,1) | |
| >2-3cm | 58 (46,8) | 128 (42,4) | |
| >3-5cm | 8 (6,5) | 36 (11,9) | |
| No tumor residual | 12 (9,7) | 17 (5,6) | 0,155 |
| Histología | |||
| C. ductal infiltrante | 108 (87,1) | 271 (89,7) | |
| C. lobular infiltrante | 4 (3,2) | 12 (4) | |
| No NM residual | 12 (9,7) | 17 (5,6) | |
| Mixto/otro | 0 | 2 (0,7) | 0,316 |
| pN | |||
| N0 | 68 (54,8) | 163 (54) | |
| N1mic | 7 (5,6) | 8 (2,6) | |
| N1 | 43 (34,7) | 108 (35,8) | |
| N2 | 6 (4,8) | 23 (7,6) | 0,351 |
| Grado tumoral | |||
| G1 | 8 (6,5) | 16 (5,3) | |
| G2 | 46 (37,1) | 129 (42,7) | |
| G3 | 58 (46,8) | 140 (46,4) | |
| Desconocido/no aplicable | 12 (9,7) | 17 (5,6) | 0,391 |
| Tumoración forma de presentación | |||
| No palpable | 1 (0,8) | 4 (1,3) | |
| Único | 121 (97,6) | 297 (98,3) | NE |
| Multifocalidad | 1 (0,8) | 0 | |
| Multicentricidad | 1 (0,8) | 1 (0,3) | |
| Terapia neoadyuvante | |||
| Sí | 27 (21,8) | 56 (18,5) | |
| No | 97 (78,2) | 246 (81,5) | 0,444 |
| Margen quirúrgico | |||
| Negativo (libre) | 104 (83,9) | 216 (71,5) | |
| Cercano (<1mm) | 0 | 16 (5,3) | |
| Comprometido | 8 (6,5) | 54 (17,9) | |
| No precisable | 12 (9,6) | 16 (5,3) | <0,05 |
| Reoperación quirúrgica | |||
| Sí | 9 (7,3) | 71 (24,1) | |
| No | 115 (92,7) | 231 (75,9) | <0,05 |
| Subtipo por IHC | |||
| Luminal A | 52 (41,9) | 145 (48,0) | |
| Luminal B | 39 (31,5) | 55 (18,2) | |
| Luminal B+HER2 sobreexpresado | 12 (9,7) | 19 (6,3) | |
| HER2 puro | 9 (7,3) | 24 (7,9) | |
| Triple negativo | 12 (9,7) | 59 (19,5) | 0,007 |
| Tratamiento adyuvante | |||
| No | 0 | 15 (5) | 0,688 |
| QT | 83 (66,9) | 196 (64,9) | 0,005 |
| RT | 119 (95,9) | 262 (86,7) | 0,006 |
| HT | 95 (76,6) | 190 (62,9) | 0,024 |
| Inmunoterapia | 16 (12,9) | 19 (6,2) | NE |
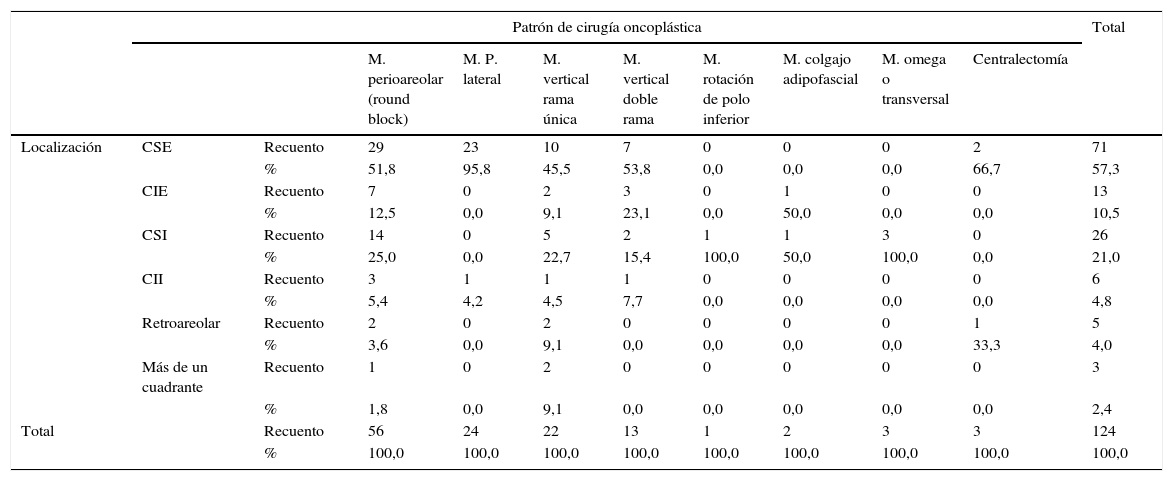
En el grupo de cohorte, los tumores se localizaron en los cuadrantes superiores en 97 pacientes (78,2%), en los cuadrantes inferiores en 29 pacientes (23,3%), retroareolares en 5 pacientes (4%) y en más de un cuadrante en 3 pacientes (2,4%). En el momento de la resección quirúrgica se optó por el patrón oncoplástico más conveniente según las localizaciones descritas, realizándose movilización y avance de tejido glandular buscando preservar la simetría y asegurar una resección oncológica adecuada, siendo las mamoplastias utilizadas: periareolar (round block) en 56 pacientes (45,6%), lateral en 24 pacientes (19,4%), vertical de rama única en 22 pacientes (17,7%), vertical de doble rama en 13 pacientes (10,5%), transversal u omega en 3 pacientes (2,4%), centralectomía en 3 pacientes (2,4%), colgajos adipofasciales en 2 pacientes (1,6%) y colgajo de rotación de polo inferior en una paciente (0,8%) (tabla 2).
Patrón de cirugía oncoplástica según la localización
| Patrón de cirugía oncoplástica | Total | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| M. perioareolar (round block) | M. P. lateral | M. vertical rama única | M. vertical doble rama | M. rotación de polo inferior | M. colgajo adipofascial | M. omega o transversal | Centralectomía | ||||
| Localización | CSE | Recuento | 29 | 23 | 10 | 7 | 0 | 0 | 0 | 2 | 71 |
| % | 51,8 | 95,8 | 45,5 | 53,8 | 0,0 | 0,0 | 0,0 | 66,7 | 57,3 | ||
| CIE | Recuento | 7 | 0 | 2 | 3 | 0 | 1 | 0 | 0 | 13 | |
| % | 12,5 | 0,0 | 9,1 | 23,1 | 0,0 | 50,0 | 0,0 | 0,0 | 10,5 | ||
| CSI | Recuento | 14 | 0 | 5 | 2 | 1 | 1 | 3 | 0 | 26 | |
| % | 25,0 | 0,0 | 22,7 | 15,4 | 100,0 | 50,0 | 100,0 | 0,0 | 21,0 | ||
| CII | Recuento | 3 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 6 | |
| % | 5,4 | 4,2 | 4,5 | 7,7 | 0,0 | 0,0 | 0,0 | 0,0 | 4,8 | ||
| Retroareolar | Recuento | 2 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 5 | |
| % | 3,6 | 0,0 | 9,1 | 0,0 | 0,0 | 0,0 | 0,0 | 33,3 | 4,0 | ||
| Más de un cuadrante | Recuento | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 3 | |
| % | 1,8 | 0,0 | 9,1 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 2,4 | ||
| Total | Recuento | 56 | 24 | 22 | 13 | 1 | 2 | 3 | 3 | 124 | |
| % | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | ||
La cirugía de simetrización en la mama contralateral se llevó a cabo en 16 pacientes (12,9%), utilizándose como técnica de mamoplastia: vertical de rama única (8 pacientes, 50%), vertical de rama doble (3 pacientes, 18,7%), periareolar (2 pacientes, 12,5%), lateral (2 pacientes, 12,5%), transversal u omega (una paciente, 6,2%).
La evaluación de las características patológicas muestra al carcinoma ductal infiltrante subtipo NOS como el más frecuente en ambos grupos (COP y no COP, con un 87 y un 89%, respectivamente), así como unos porcentajes de frecuencias muy similares entre el compromiso ganglionar y el grado tumoral. La presencia de tumoración múltiple en ambos grupos fue escasa, no siendo una variable significativa en el análisis.
La terapia neoadyuvante se indicó en el 21 y el 18% de las pacientes en el grupo de COP y no COP, respectivamente, las cuales presentaron respuesta completa al tratamiento en 12 (9,7%) y 17 casos (5,6%), respectivamente; la mayoría de las pacientes de ambos grupos tenía cirugía de inicio, mostrando en la evaluación de márgenes quirúrgicos una menor proporción de casos con márgenes cercanos y comprometidos en el grupo COP, en relación con el grupo control (0 y 6,5% vs. 5,3 y 17,9%, respectivamente), así como un menor porcentaje de reoperaciones en el grupo de COP (7,3 vs. 24,1%, respectivamente; p<0,05). Sobre la tipificación con base en perfiles de inmunohistoquímica, se apreció un porcentaje mayor de tumores luminales A y B (41,9 y 39%, respectivamente) en el grupo de COP en comparación con el grupo no COP (48 y 18%), así como un mayor porcentaje de tumores triple negativos en el grupo no COP (19,5 vs. 9,7%; p=0,007).
El tratamiento adyuvante en ambos grupos estuvo en función del estadio clínico, el perfil de inmunohistoquímica y el estatus funcional de cada paciente oncológica; el tratamiento con RT externa se administró en mayor proporción en el grupo de COP en relación con el control (95,9 vs. 86,7%; p=0,05); 5 pacientes (4%) del grupo COP recibieron irradiación parcial de la mama intraoperatoria en el lecho tumoral a dosis de 20Gy. El esquema de radioterapia externa más usado fue el de 5.000cGy en 25 sesiones, con boost a dosis de 1.600cGy en el lecho tumoral.
La quimioterapia adyuvante se indicó en el 66,9% (83 pacientes) y el 64,9% (196 pacientes) de las personas de los grupos de estudio y de control, respectivamente, siendo el régimen antraciclinas-ciclofosfamida asociado a taxanos el más utilizado (47,6 y 34,8%, respectivamente, en el grupo de COP y no COP).
La adyuvancia con hormonoterapia se indicó con mayor frecuencia en el grupo de COP (76,6%) vs. el grupo control (62,9%) (p=0,006). El tratamiento anti-HER2 utilizado en la institución fue con trastuzumab, administrado en mayor proporción al grupo de COP (12,9 vs. 6,2%) (p=0,024).
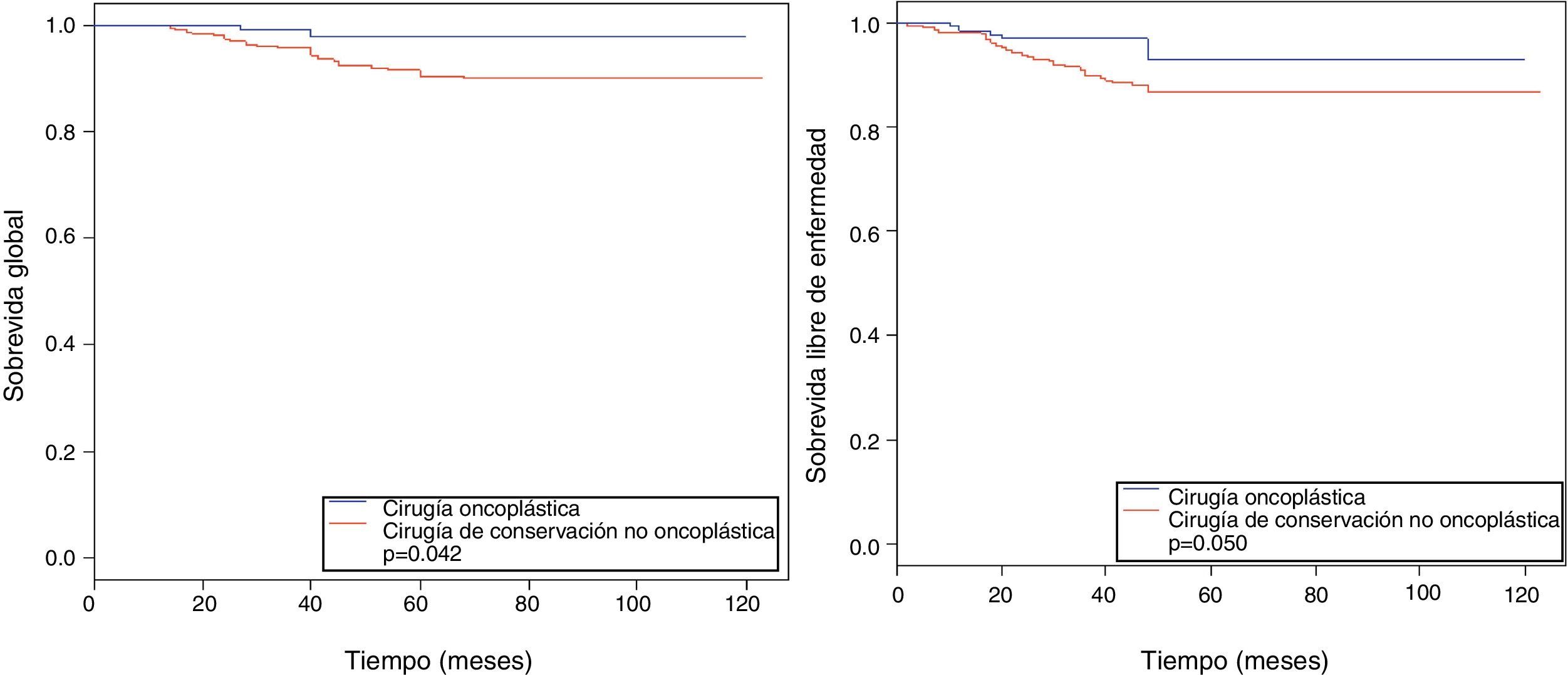
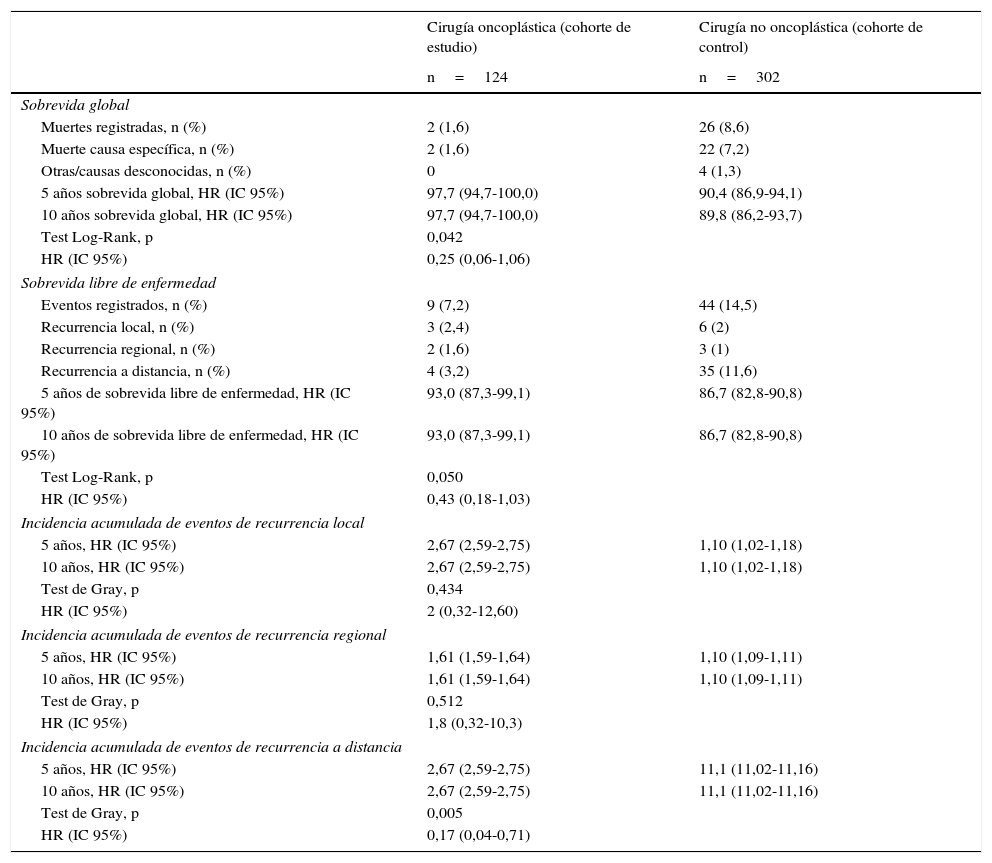
La tabla 3 describe los eventos en ambos grupos, con una media de seguimiento de 61 meses. La OS en el grupo COP a 5 y a 10 años fue significativamente mayor en relación con la del grupo control (97,7 y 97,7% vs. 90,4 y 89,8%, respectivamente; p=0,042), sin diferencia en el riesgo de muerte de las pacientes que tuvieron COP vs. no COP (HR 0,25, IC 95% 0,06-1,06) (fig. 1).
Resultado de supervivencia (tiempo medio de seguimiento: 61 meses). Cohorte de estudio y cohorte de control
| Cirugía oncoplástica (cohorte de estudio) | Cirugía no oncoplástica (cohorte de control) | |
|---|---|---|
| n=124 | n=302 | |
| Sobrevida global | ||
| Muertes registradas, n (%) | 2 (1,6) | 26 (8,6) |
| Muerte causa específica, n (%) | 2 (1,6) | 22 (7,2) |
| Otras/causas desconocidas, n (%) | 0 | 4 (1,3) |
| 5 años sobrevida global, HR (IC 95%) | 97,7 (94,7-100,0) | 90,4 (86,9-94,1) |
| 10 años sobrevida global, HR (IC 95%) | 97,7 (94,7-100,0) | 89,8 (86,2-93,7) |
| Test Log-Rank, p | 0,042 | |
| HR (IC 95%) | 0,25 (0,06-1,06) | |
| Sobrevida libre de enfermedad | ||
| Eventos registrados, n (%) | 9 (7,2) | 44 (14,5) |
| Recurrencia local, n (%) | 3 (2,4) | 6 (2) |
| Recurrencia regional, n (%) | 2 (1,6) | 3 (1) |
| Recurrencia a distancia, n (%) | 4 (3,2) | 35 (11,6) |
| 5 años de sobrevida libre de enfermedad, HR (IC 95%) | 93,0 (87,3-99,1) | 86,7 (82,8-90,8) |
| 10 años de sobrevida libre de enfermedad, HR (IC 95%) | 93,0 (87,3-99,1) | 86,7 (82,8-90,8) |
| Test Log-Rank, p | 0,050 | |
| HR (IC 95%) | 0,43 (0,18-1,03) | |
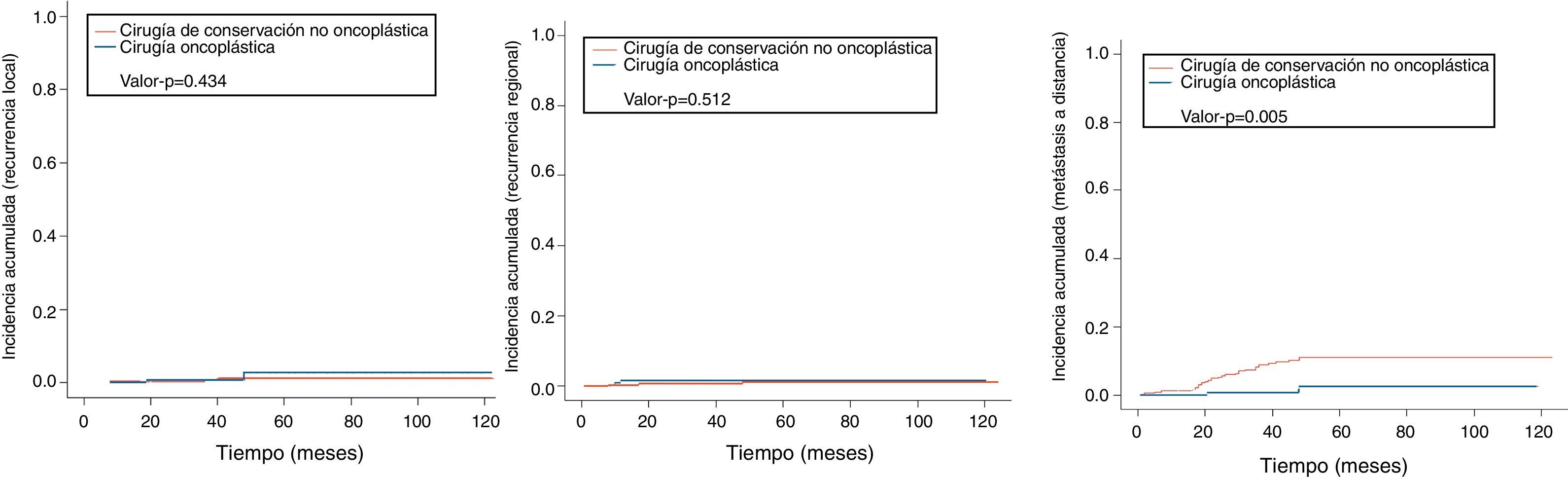
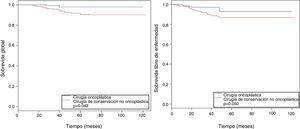
| Incidencia acumulada de eventos de recurrencia local | ||
| 5 años, HR (IC 95%) | 2,67 (2,59-2,75) | 1,10 (1,02-1,18) |
| 10 años, HR (IC 95%) | 2,67 (2,59-2,75) | 1,10 (1,02-1,18) |
| Test de Gray, p | 0,434 | |
| HR (IC 95%) | 2 (0,32-12,60) | |
| Incidencia acumulada de eventos de recurrencia regional | ||
| 5 años, HR (IC 95%) | 1,61 (1,59-1,64) | 1,10 (1,09-1,11) |
| 10 años, HR (IC 95%) | 1,61 (1,59-1,64) | 1,10 (1,09-1,11) |
| Test de Gray, p | 0,512 | |
| HR (IC 95%) | 1,8 (0,32-10,3) | |
| Incidencia acumulada de eventos de recurrencia a distancia | ||
| 5 años, HR (IC 95%) | 2,67 (2,59-2,75) | 11,1 (11,02-11,16) |
| 10 años, HR (IC 95%) | 2,67 (2,59-2,75) | 11,1 (11,02-11,16) |
| Test de Gray, p | 0,005 | |
| HR (IC 95%) | 0,17 (0,04-0,71) | |
El DFS a 5 y 10 años muestra al grupo COP con una mayor estimación (93 y 93%, respectivamente) en comparación con el grupo control (86,7 y 86%, respectivamente; p=0,005) (fig. 1).
La incidencia acumulada de eventos de recurrencia local fue ligeramente superior en el grupo de COP (2,67 vs. 1,1 a 10 años; p=0,43; HR 2, IC 95% 0,32-12,6), igual que en los de recurrencia regional (1,61 vs. 1,10% a 10 años; p=0,51; HR 1,8, IC 95% 0,32-10,3). La incidencia acumulada de los eventos de recurrencia a distancia fue mayor en el grupo de control (cirugía no COP) en comparación con el grupo de estudio (11,1 vs. 2,67% a los 10 años; fig. 2; p=0,005), siendo el riesgo de metástasis a distancia menor en el grupo COP (HR 0,17, IC 95% 0,04-0,71; (fig. 2).
DiscusiónLos resultados de 124 pacientes intervenidas de COP demostraron que es una técnica segura para el tratamiento integral del cáncer de mama en pacientes de la institución, registrándose un aumento en la proporción de utilización de las técnicas oncoplásticas en el último periodo del estudio (2010-2015), esto debido al mayor número de cirujanos entrenados y a la difusión de estas técnicas a nivel mundial. La indicación del uso de COP se ve reflejada en el tamaño tumoral predominante registrado (pT2, 53,3%), tomando en cuenta que en estudios como el MILAN I se excluyeron los tumores mayores de 2cm23, y en el NSABP 07 se excluyeron los tumores mayores de 4cm, que en nuestra serie reflejan un importante porcentaje de casos, similar a los datos publicados por Rietjens et al.24.
La COP permite hacer escisiones con márgenes quirúrgicos más amplios que las lumpectomías tradicionales. En un metaanálisis presentado por Losken et al.25 el rango de márgenes comprometido fue del 12,3% en pacientes con COP en comparación con el 20,6% obtenido en el grupo de cirugía de conservación clásica. Los bordes quirúrgicos comprometidos y cercanos en COP varían según el diámetro medio tumoral; en tamaños entre 2 y 3cm se describen en un rango de 3,3 a 23%26–30, reportando nuestros datos un menor porcentaje de bordes comprometidos y cercanos (6,5 y 0%) en el grupo de COP en comparación con el control (17,9 y 5,3%) (p<0,05), similar a lo descrito a nivel mundial, lo cual conlleva tener una menor proporción de reoperaciones en el grupo de COP (7,3 vs. 24,1%), de las cuales el 55,5% fueron ampliaciones de márgenes selectivos (p≤0,05); hay que tener en cuenta que a nivel mundial se describe que el promedio de reoperaciones en cirugía de conservación mamaria convencionales (no COP), en donde se incluyeron predominantemente tumores menores de 3cm, varía en un rango de 20-24%4,31–33. Clough et al.30 publicaron datos de reoperación en COP de un 12,5%, pudiendo realizar reoperaciones conservadoras de la mama (ampliación de márgenes) hasta en un 36%. Un factor que podría ser atribuido a la disminución de bordes comprometidos y de reoperaciones en nuestros pacientes podría corresponder a la mayor proporción de congelación de bordes quirúrgicos intraoperatorio, así como a ampliaciones de bordes quirúrgicos en el mismo acto.
En el análisis de los objetivos principales se evidenció que la OS, a la mediana de tiempo de seguimiento de 61 meses, en el grupo de COP a 5 y a 10 años fue superior a la del grupo control (97,7 y 97,7% vs. 90,4 y 89,8%; p=0,042), correlacionándose directamente con el resultado expresado en el DFS, en el cual, de forma similar, el grupo de COP obtuvo menores eventos registrados a 5 y a 10 años en relación con el control (93 y 93% vs. 86,7 y 86,7%; p=0,050). Se cuenta con múltiples publicaciones de diversos autores, en las cuales se analizaron tanto la OS como el DFS en pacientes intervenidas de COP4,31,32, teniendo un rango muy variable, entre 86-96% y 73-93%, respectivamente, siendo Grubnik et al. y Mazouni et al.33,34 quienes describen los rangos más elevados: una OS media de 96,2% y un DFS de 92,7%. En nuestra población, una variable que podría asociarse con estos registros de mayor OS y DFS sería el subtipo tumoral según inmunohistoquímica, tomando en cuenta que en el grupo de COP predominaron los tipos luminales A y B (41,9 y 31,5%), en contraste con una mayor frecuencia en los tipos triple negativo y HER2 puro (19,5 y 7,9%) en el grupo control (p=0,007). Se ha descrito que los tumores triple negativo presentan un alto grado nuclear y una relación atenuada entre el tamaño tumoral y la probabilidad de sobrevida35,36, así como una mayor proporción de metástasis visceral –pulmones (40%), cerebro (30%), hígado (20%)–, lo cual tendría un mayor impacto sobre la OS y el DFS de estas pacientes26,37,38.
En contraste, se observó un ligero aumento en el grupo de COP en la incidencia acumulada de eventos locales (recurrencias locales) en comparación con el grupo control (2,67 vs. 1,10% a 10 años), así como en la incidencia acumulada de eventos regionales (recurrencias regionales) (1,61 vs. 1,10% a 10 años), siendo ambos resultados no estadísticamente significativos, no teniendo ningún impacto en la OS de las pacientes (fig. 2). Las publicaciones sobre la recurrencia local en COP nos muestran rangos entre 9,4-2,2%4,31–34, siendo De Lorenzi et al. los que registraron los porcentajes más ínfimos. Una posible explicación en nuestra población de estudio podría ser que se debe a las dificultades para determinar el volumen del blanco a tratar en el refuerzo (boost) durante la administración de terapia adyuvante con radioterapia externa, en relación con el mayor volumen resecado, así como la rotación y la trasposición de tejido fibroglandular en las COP.
La incidencia acumulada a distancia (recurrencias a distancia) fue menor de manera estadísticamente significativa en el grupo de COP en comparación con el control (11,09vs. 2,67% a 10 años, p=0,005) (fig. 2). Estos eventos han sido registrados en pacientes que recibieron COP en un rango de 1,3-14%4,31–34, siendo Chakravorty et al. los que registran los menores rangos26; los datos obtenidos en nuestro estudio estarían en relación con lo ya comentado en los factores asociados a OS y DFS.
ConclusionesEn nuestra institución, hemos comparado una serie de pacientes con carcinomas invasivos primarios de la mama no metastásicos, quienes fueron intervenidas de COP (124), frente a un grupo control (302) cuyas participantes tuvieron un seguimiento medio de 61 meses, proporcionando la mejor evidencia disponible para mostrar que la COP es una opción de tratamiento segura y confiable para el cáncer invasivo de la mama.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor principal y los colaboradores no presentan ningún conflicto de intereses en el presente estudio.