analizar el tipo de tratamiento primario que reciben pacientes mayores de 80 años en un intervalo de 6 años.
Material y métodose ha realizado un estudio observacional retrospectivo en pacientes mayores de 80 años diagnosticadas de cáncer de mama, de 2017 a 2022. Se recogieron datos sobre el tipo de tratamiento, cirugía, características histológicas, estadio y calidad de vida.
Resultadosse obtuvieron datos de un total de 188 pacientes. Edad media de 85 años. El 38,3% eran dependientes para actividades básicas de la vida diaria. Un 73,4% presentaban positividad para receptores estrogénicos y HER2 negativo. Un 75,5% recibió cirugía como tratamiento primario, un 11,1% recibió hormonoterapia, un 3,1% tratamiento con quimioterapia y un 10,1% no recibieron ningún tipo de tratamiento. El 22,3% se encontraban en estadio I. El 13,2% fueron diagnosticadas en estadio avanzado. A un 33,5% se le realizó una biopsia selectiva de ganglio centinela (BSGC).
Conclusionessegún nuestros datos analizados, existe un considerable número de pacientes que han recibido un tratamiento primario más agresivo (mastectomía y BSGC) sin beneficios en la supervivencia general a pesar de que, actualmente, existen datos que apoyan que la omisión de la evaluación axilar quirúrgica o, incluso, la radioterapia después de cirugía conservadora, no afecta la supervivencia general en mujeres de 70 años o más con enfermedad en estadio clínico temprano, receptor hormonal positivo y HER2 negativo.
Analyzing the type of primary treatment that patients aged over 80 years receive within a 6-year interval.
Materials and methodAn observational retrospective study was conducted in patients aged over 80 years who were diagnosed with breast cancer between 2017 to 2022. Data were collected on the type of primary treatment, surgery, histological characteristics of tumors, stage and quality of life.
ResultsInformation was taken from 188 patients. The average age was 85 years old. A 38,3% were dependent for Basic Activities of Daily Living, 73,4% tested positive for estrogen receptors and negative HER2, 75,5% underwent surgery as primary treatment, 11,1% received hormone therapy, 3,1% received chemotherapy treatment, and 10,1% did not undergo any type of treatment; 22,3% of patients were in stage I. A 13,2% were diagnosed at an advanced stage, and 33,5% underwent selective sentinel lymph node biopsy (SSNB).
ConclusiónAccording to our analyzed data, there is a considerable number of patients who have undergone a more aggressive primary treatment (mastectomy and SSNB) without benefits in overall survival, despite evidence supporting that omitting surgical axillary evaluation or even radiotherapy after conservative surgery does not affect overall survival in women aged 70 or older with early clinical stage disease, positive hormonal receptor, and negative HER2.
La edad media de diagnóstico de cáncer en general es de 65 años1. Según la Agencia Internacional de Investigación sobre el Cáncer, en 2020, el cáncer de mama se convirtió en el tipo de cáncer más diagnosticado en el mundo con más de 2,26 millones de nuevos casos y casi 685.000 muertes2,3.
Sabemos que el riesgo de desarrollar cáncer de mama aumenta con la edad. El 45% de las pacientes superan los 65 años y este alcanza un máximo de incidencia a los 804. En el cáncer de mama invasivo, el 30% de los casos se produce en mujeres mayores de 70 años5.
No disponemos de una definición exacta del término anciano, pero estos datos, unidos al envejecimiento poblacional en los países desarrollados y el aumento de la esperanza de vida, nos alertan de que el tratamiento del cáncer de mama requiere un nuevo enfoque.
Las directrices de tratamientos recibido por mujeres mayores deben basarse en el estado funcional y las comorbilidades, de manera que resulten menos agresivos e individualizados a los recibidos en mujeres más jóvenes5. Debemos realizar un abordaje geriátrico integral para la toma de decisiones, sin embargo, en la realidad actual no existe representación geriátrica en los comités multidisciplinares6.
El manejo del cáncer de mama en pacientes añosas es un tema de debate en múltiples publicaciones y un problema diario, ya que no existen pautas de tratamiento estándar claras y pocos estudios examinan el efecto que tiene el tratamiento en la supervivencia general5. Es por ello que hemos querido describir nuestra experiencia, con el objeto de analizar el tipo de tratamiento primario indicado en estas pacientes y poder compararlos con la bibliografía publicada, con especial interés en evaluar el tipo de cirugía y la terapia axilar recibida.
Material y métodosSe expone un estudio observacional, retrospectivo de pacientes mayores de 80 años, diagnosticadas en nuestro centro de cáncer de mama entre enero de 2017 y diciembre de 2022. Se trata de un hospital público universitario de tercer nivel que atiende un área sanitaria de 263.478 habitantes.
Todos los casos fueron valorados en un comité multidisciplinar de tumores y recibieron tratamiento primario en nuestro centro. Se excluyeron pacientes menores de 80 años, que fueran varones o que recibieran tratamiento fuera de nuestro hospital.
Se revisó retrospectivamente la historia clínica de todas las pacientes incluidas en el estudio utilizando ordenadores del centro, garantizando la confidencialidad de los mismos.
Las variables analizadas fueron: la edad de las pacientes y calidad de vida evaluada mediante escala ECOG. Características anatomopatológicas del tumor como: tipo histológico, estadio tumoral y estudio molecular (positividad para receptores hormonales y HER2). Datos sobre del tratamiento primario recibido: cirugía sobre la mama y terapia axilar (biopsia selectiva de ganglio centinela [BSCG] o linfadenectomía), así como tratamiento con quimioterapia y hormonoterapia.
Las variables fueron codificadas en tablas Excel y el análisis estadístico se realizó́ a través de Microsoft Excel, versión 16. Las variables cualitativas fueron descritas con frecuencia absoluta y relativa. Las variables continuas se describieron mediante media, incluyendo el número total de valores válidos.
Para la revisión bibliográfica se realizaron búsquedas en Pub-Med, UpToDate y publicaciones en la revista Senología y Patología Mamaria relacionadas con el tratamiento del cáncer de mama en pacientes mayores.
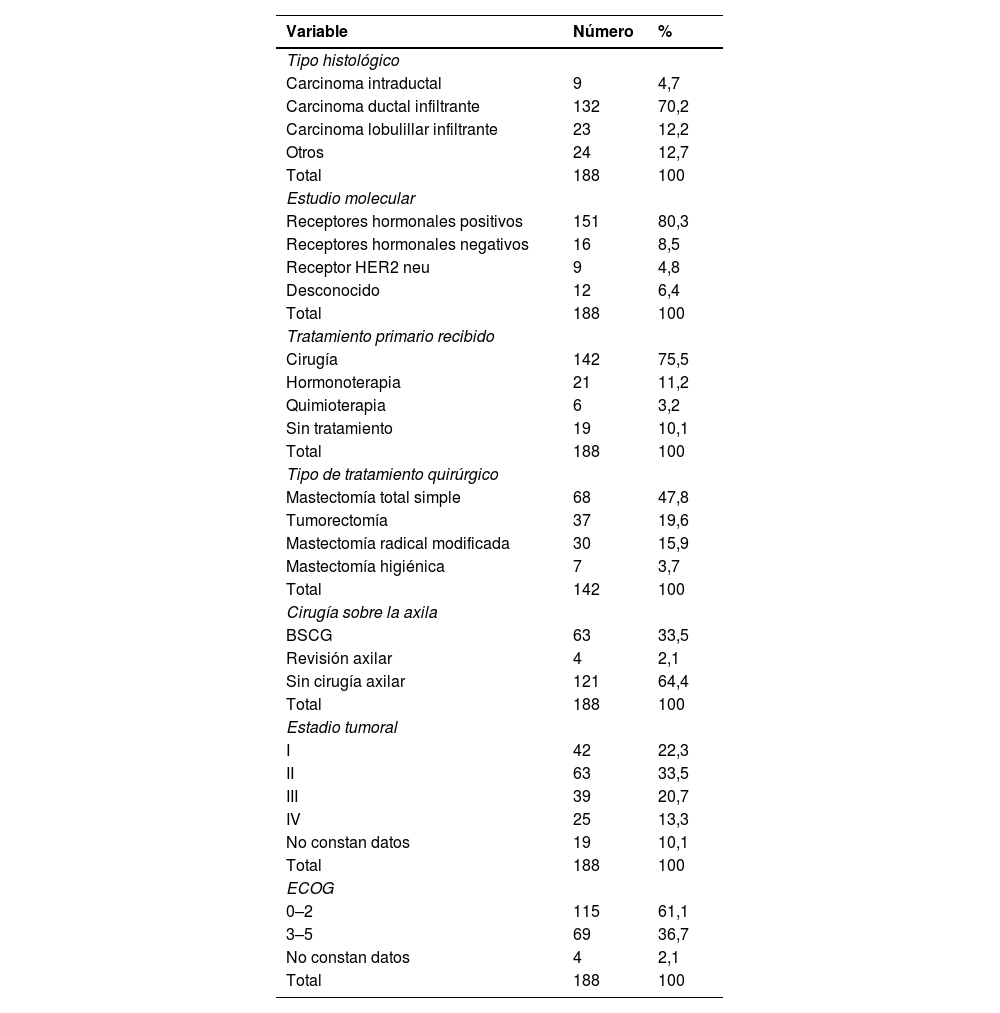
ResultadosSe obtuvieron un total de 194 pacientes mayores de 80 años con cáncer de mama durante el periodo de estudio, de los cuales 6 del eran varones, por lo que no se tuvieron en cuenta para el análisis de resultados, de este modo, se estudiaron un total de 188 mujeres. En la tabla 1 se presentan datos generales analizados en el estudio. El rango de edad estaba comprendido entre los 80 y los 98 años. Se evaluó el grado de dependencia de las pacientes mediante escala ECOG y se observó que el 38,3% (n = 69) presentaba una puntuación mayor o igual a 3.
Datos generales
| Variable | Número | % |
|---|---|---|
| Tipo histológico | ||
| Carcinoma intraductal | 9 | 4,7 |
| Carcinoma ductal infiltrante | 132 | 70,2 |
| Carcinoma lobulillar infiltrante | 23 | 12,2 |
| Otros | 24 | 12,7 |
| Total | 188 | 100 |
| Estudio molecular | ||
| Receptores hormonales positivos | 151 | 80,3 |
| Receptores hormonales negativos | 16 | 8,5 |
| Receptor HER2 neu | 9 | 4,8 |
| Desconocido | 12 | 6,4 |
| Total | 188 | 100 |
| Tratamiento primario recibido | ||
| Cirugía | 142 | 75,5 |
| Hormonoterapia | 21 | 11,2 |
| Quimioterapia | 6 | 3,2 |
| Sin tratamiento | 19 | 10,1 |
| Total | 188 | 100 |
| Tipo de tratamiento quirúrgico | ||
| Mastectomía total simple | 68 | 47,8 |
| Tumorectomía | 37 | 19,6 |
| Mastectomía radical modificada | 30 | 15,9 |
| Mastectomía higiénica | 7 | 3,7 |
| Total | 142 | 100 |
| Cirugía sobre la axila | ||
| BSCG | 63 | 33,5 |
| Revisión axilar | 4 | 2,1 |
| Sin cirugía axilar | 121 | 64,4 |
| Total | 188 | 100 |
| Estadio tumoral | ||
| I | 42 | 22,3 |
| II | 63 | 33,5 |
| III | 39 | 20,7 |
| IV | 25 | 13,3 |
| No constan datos | 19 | 10,1 |
| Total | 188 | 100 |
| ECOG | ||
| 0–2 | 115 | 61,1 |
| 3–5 | 69 | 36,7 |
| No constan datos | 4 | 2,1 |
| Total | 188 | 100 |
BSCG: biopsia selectiva de ganglio centinela; ECOG: escala de la Eastern Cooperative Oncology Group.
En lo referente a las características histológicas, el 70,2% (n = 132) se trataba de carcinoma ductal infiltrante, un 12,2% (n = 23) tipo lobulillar infiltrante y un 4,7% (n = 9) eran carcinomas intraductales. El 80,3% (n = 151) presentaba positividad para receptores hormonales, un 8,5% (n = 16) eran triples negativos y un 4,8% (n = 9) positividad para HER2, no disponiendo de la clasificación molecular en 12 pacientes.
Fueron diagnosticadas en estadio I-II el 55,8% (n = 105) de las pacientes, un 34% (n = 64) en estadio III-IV. Nueve pacientes presentaban un carcinoma in situ y en 10 pacientes no se codificó el estadio tumoral.
En cuanto al tratamiento, un 75,5% (n = 142) recibieron cirugía como tratamiento primario, un 11,2% (n = 21) solo recibieron hormonoterapia, un 3,2% (n = 6) solo recibieron tratamiento con quimioterapia y un 10,1% (n = 19) no recibieron ningún tipo de tratamiento. Este número de pacientes que no fueron tratadas, en parte de ellas se desestimó el tratamiento por comorbilidad y en otras por no deseo de la paciente o familiares de continuar con el diagnóstico.
De las pacientes que recibieron cirugía, en el 47,8% (n = 68) se realizó una mastectomía total simple, en un 19,6% (n = 37) una tumorectomía, en 15,9% (n = 30) una mastectomía radical modificada y en 3,7% (n = 7) una mastectomía higiénica.
Dentro del grupo de pacientes en tratamiento quirúrgico, 92 recibieron tratamiento con terapia hormonal como tratamiento adyuvante. Por lo tanto, si también tenemos en cuenta las pacientes que solo fueron tratadas con hormonoterapia, un 60,1% del total de mujeres incluidas en el estudio (n = 113) recibieron tratamiento hormonal.
Analizando el tipo de tratamiento recibido según el estadio al diagnóstico, 25 pacientes (13,2%) se encontraban en estadio avanzado (IV), de las cuales solo 4 recibieron tratamiento quirúrgico (2 pacientes mastectomía radical modificada y 2 pacientes mastectomía higiénica). Cinco mujeres eran candidatas a cirugía, pero no se realizó por deseo de la paciente o la familia.
En la historia clínica de nuestras pacientes utilizamos la escala ECOG para evaluar el grado de autonomía. Se han realizado 2 gráficos comparativos (fig. 1) uno donde se muestra el tratamiento primario en pacientes con puntuación ECOG 0–2 y otro en pacientes ECOG 3–5. Se puede observar cómo pacientes con mejor calidad de vida (puntuación ECOG más baja) recibieron con mayor frecuencia tratamientos quirúrgicos o quimioterapia.
En referencia a la cirugía realizada sobre la axila, a un 33,5% (n = 63) se le realizó una BSGC, de las cuales en 9 pacientes se finalizó posteriormente una linfadenectomía y en otras 9 se obtuvo un resultado positivo para micrometástasis. En 4 pacientes se realizó una revisión axilar. De estas, 63 pacientes candidatas a realizar BSCG el 70% se encontraban en un estadio IA-IIA.
DiscusiónEl envejecimiento es el principal factor de riesgo del cáncer de mama. Los diagnósticos tardíos, unido al deterioro cognitivo y a la pluripatología lo convierten en un desafío.
El tratamiento del cáncer de mama en todos los grupos de edad está evolucionando a un manejo más conservador, con un enfoque personalizado y con el objetivo de realizar una desescalada terapéutica que mejore la calidad de vida de las pacientes. Cuando se nos presentan casos especiales como es el de las mujeres con edad avanzada, esta premisa debería ganar más peso teniendo en cuenta las particularidades de esta población.
La evidencia científica está sesgada y dificulta la toma de decisiones, ya que estas pacientes tienden a ser excluidas de los estudios, por lo que las recomendaciones se extrapolan de las mujeres más jóvenes. Del mismo modo, existen pocos ensayos clínicos acerca de la supervivencia general con el tratamiento, lo que ocasiona una falta de información al respecto que puede conducir a un tratamiento excesivo o insuficiente5,6.
Las sociedades científicas geriátricas hacen hincapié en que la edad cronológica no debe ser un motivo para decidir el tipo de tratamiento óptimo, sino que la esperanza de vida y la fragilidad subyacente deben contribuir a la toma de decisiones para identificar qué pacientes son susceptibles de complicaciones6,7.
Debemos realizar una evaluación geriátrica integral a todas aquellas pacientes mayores que van a recibir tratamiento contra el cáncer, disminuyendo de esta manera el sobrediagnóstico de fragilidad que muchas veces se achaca a la propia edad. Así es como diferenciaremos a aquellas pacientes que, por sus características, puedan beneficiarse de un tratamiento estándar de las que no son candidatas a realizarse un tratamiento curativo2.
La Red Nacional Integral del Cáncer (NCCN) y de la Sociedad Estadounidense de Oncología Clínica (ASCO) aconsejan el uso de herramientas que nos permitan obtener datos objetivos para valorar el estado de autonomía de nuestras pacientes, como la escala ECOG o la calculadora ePrognosis, que evalúa la esperanza de vida y si es probable que esta se vea disminuida4,6,7.
En nuestra experiencia, resulta fundamental tener en cuenta el estado funcional de nuestras pacientes para poder tomar decisiones respecto al tipo de tratamiento que vamos a administrar, ya que es clave mantener una buena calidad de vida.
Según nuestros datos, la mayoría de las pacientes incluidas en el estudio presentaban puntuación ECOG 0–2. Al presentar un mejor estado funcional, son más aptas para la anestesia y tienen mejor capacidad de recuperación de dichos tratamientos, por lo que en ese grupo observamos que se realizaron mayor número de tratamientos quirúrgicos primarios. Al tener en cuenta su estado funcional, podemos tener más garantías de que la calidad de vida y la recuperación posquirúrgica serán satisfactorias, aunque no disponemos de estos datos en esta revisión.
Sabemos que en esta franja de edad no se realiza cribado mamográfico, por lo que el diagnóstico queda relegado a un screening oportunista, encontrando tumores en estadios avanzados y con peor pronóstico8. Muchas sociedades científicas ya recomiendan ampliar la mamografía hasta los 74–75 años, asumiendo el riesgo de sobrediagnóstico. Algunos grupos, como la Sociedad Estadounidense del Cáncer, recomiendan la mamografía en mujeres mayores, sobre todo en el contexto de una esperanza de vida de 10 años o más4,7.
Según el artículo de Bertolo et al., pacientes de mayor edad fueron diagnosticadas en estadios II-III debido a la falta de un programa de cribado, datos que se asemejan a los de nuestra población, donde el 60% de las pacientes se diagnosticaron en dichos estadios4.
En cuanto a las características tumorales, las pacientes con más de 60 años presentan frecuentemente neoplasias menos agresivas, con un perfil de marcadores más favorables y con mayor positividad para receptores hormonales que mujeres premenopáusicas. Al mismo tiempo, existe una similitud entre los subtipos de cáncer de mama en mujeres mayores de 80 años y mujeres posmenopáusicas más jóvenes, pero a pesar de su semejanza, el tratamiento debe adaptarse4,5.
La cirugía de la mama es generalmente segura y se considera de bajo riesgo, además tiene menos efectos adversos que la terapia endocrina7,9. A pesar de ello, según Ferrigni et al., las mujeres de edad avanzada tienen menos probabilidades de recibir una cirugía conservadora y más de realizarse una mastectomía5.
Apoyándose en esta evidencia, en nuestra cohorte, a 105 pacientes (55,8%) se les realizó una mastectomía, en comparación con un 19,6% a las que se les realizó una cirugía conservadora. Comparando estos datos con los de la población general, en un estudio realizado por la Sociedad Europea de Cáncer de Mama, en una cohorte de pacientes con una media de edad de 61 años con cáncer de mama, a un 66,6% se les realizó una cirugía conservadora y a un 33,4% una mastectomía. Según estos datos, podemos observar que las pacientes ancianas tienen mayor probabilidad de realizarse una mastectomía10.
Una de las preocupaciones que queda en este ámbito es comprobar si estamos infratratando a estas mujeres, ya que si omitimos la cirugía primaria en mujeres ancianas con cáncer de mama que eran candidatas a tratamiento, encontraríamos una mayor progresión de la enfermedad y mayor intervención terapéutica, con el consecuente aumento de mortalidad9,11.
En un artículo donde se compara el tratamiento del cáncer en 2 grupos de edad (mayores de 70 años y menores de 70), se encuentra una menor tasa de cirugía de la mama y axilar y mayor tratamiento con hormonoterapia y alerta sobre un posible tratamiento insuficiente en estas pacientes8.
En cuanto a la estadificación ganglionar, este grupo de pacientes tienen menos probabilidades de ser candidatas a cirugía axilar5. Según Biganzoli et al., no existe un aumento en la supervivencia al realizar tratamiento quirúrgico axilar y las recidivas regionales sin cirugía axilar son raras7,12. Además, en caso de obtener uno o 2 ganglios centinelas afectos, se podría evitar la linfadenectomía o realizar únicamente tratamiento con radioterapia. Sobre todo, debemos valorar la omisión de la BSCG en pacientes frágiles con tumores de bajo grado7. Nuestros datos reflejan que a un 33,5% se les realizó BSCG. En comparación con el estudio realizado por EUSOMA mencionado anteriormente, en el 80,8% de las pacientes se realizó una BSCG10.
La Sociedad Española de Senología y Patología Mamaria (SESPM), en su último consenso sobre BSCG y manejo axilar publicada en 2022, no utiliza un rango de edad para prescindir de la realización de ganglio centinela; solo indica que se puede omitir en mujeres de bajo riesgo con comorbilidad relevante13.
En julio de 2016, la Sociedad de Oncología Quirúrgica, en sus pautas Choosing Wisely, afirma que podemos no realizar BSCG de manera segura en mujeres mayores de 70 años con ganglios clínicamente negativos, enfermedad de bajo riesgo, receptores hormonales positivos y HER2 negativo14,15.
Minami et al., en un artículo publicado en 2022, asegura que diversos ensayos clínicos aleatorizados han demostrado que la omisión de la evaluación axilar quirúrgica no afecta a la supervivencia general en mujeres de 70 años o más con enfermedad en estadio temprano, receptor hormonal positivo y HER2 negativo16,17.
Por otro lado, Ferrigni et al. apoyan esta evidencia, pero alertan de que a pesar de los beneficios de la omisión de la cirugía axilar, esta sigue siendo ampliamente utilizada en estas pacientes con tasas que rondan los 45–95% antes de las directrices publicadas por la Sociedad de Oncología Quirúrgica5.
Según la bibliografía publicada, las pacientes con cáncer de mama mayores de 80 años reciben más terapias hormonales en comparación con pacientes más jóvenes, pero reciben radioterapia y quimioterapia con menos frecuencia que estas. En nuestro estudio solo un 3,2% de las pacientes recibieron quimioterapia y un 11,2% hormonoterapia como tratamiento primario5,18. En comparación con la población general, haciendo referencia a los datos publicados por el estudio de EUSOMA, un 16,7% recibieron quimioterapia neodyuvante como tratamiento primario y un 63,6% terapia hormonal en alguna etapa del tratamiento. Estos datos no son fácilmente comparables, ya que en nuestro estudio se analizó únicamente el tratamiento primario recibido10.
Se debe plantear el tratamiento con quimioterapia en pacientes con receptores hormonales negativos, HER2 positivo, ganglios linfáticos positivos y una alta tasa de proliferación9,19,20.
Para estimar el riesgo de toxicidad al tratamiento disponemos de diferentes herramientas, algunas de ellas como la escala CRASH, que evalúa el riesgo de la quimioterapia en pacientes de edad avanzada6,7,21 y otras como las puntuaciones del Grupo de Investigación sobre el Cáncer y el Envejecimiento (CARG) son fundamentales para la toma de decisiones22,23. En nuestro estudio ninguna de estas herramientas ha sido utilizada, pero suponen una opción interesante para la toma de decisiones futuras en estas pacientes.
ConclusionesA la vista de los datos expuestos, existe un porcentaje elevado de pacientes que han recibido un tratamiento primario más agresivo (mastectomía y BSGC) sin claros beneficios en la supervivencia general, a pesar de que actualmente la bibliografía apoya que la omisión de estadificación axilar o, incluso, la radioterapia después de una cirugía conservadora, no afecta a la supervivencia general en mujeres diagnosticadas de cáncer de mama con 70 años o más, receptor hormonal positivo y HER2 negativo.
A pesar de ello, nos encontramos ante una población donde la mayoría de nuestras pacientes son independientes para actividades básicas de la vida diaria (más del 70%), motivo por el cual se han podido realizar tratamientos quirúrgicos más agresivos.
La discusión más estricta de casos en los comités multidisciplinares, con la adaptación del tratamiento en función de una valoración geriátrica integral y la mayor participación de estas pacientes en ensayos clínicos podría contribuir a evitar el sobretratamiento.
Responsabilidades éticasLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes. La información de las pacientes incluidas en nuestro trabajo ha sido tratada de manera anónima y confidencial. La base de datos generada por nuestra unidad solo es accesible por miembros del equipo investigador. Este estudio fue revisado por el comité ético de investigación del Hospital Universitario de Burgos emitiendo un informe favorable para su publicación.
Consentimiento informadoDada la naturaleza retrospectiva del estudio, se solicitó al Comité Ético de Investigación con Medicamentos la exención del consentimiento informado. Debido a que se utilizaron registros médicos existentes de pacientes que han recibido atención médica anteriormente, la obtención del consentimiento informado directo de cada paciente sería dificultosa ya que algunos de ellos podrían haber fallecido o no estar disponibles para dar su consentimiento debido a la naturaleza retrospectiva de la investigación. Para garantizar la confidencialidad se manejó una base de datos seudonimizada, cumpliendo en todo momento con el reglamento general de protección de datos. La autorización para realizar el estudio sin la obtención del consentimiento informado fue aprobada con fecha 30 de julio de 2024 en su versión n° 3.
FinanciaciónLos autores declaran que no se ha recibido ningún fondo de financiación para la realización de esta revisión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.